RESUMO
Introdução:
Uma série de estudos avaliou a associação entre os polimorfismos -592A>C e -819T>C nas regiões promotoras do risco de interleucina-10 (IL-10) e câncer gástrico (GC). No entanto, os resultados permanecem inconclusivos.
Objetivo:
Para entender melhor a associação dos polimorfismos com o risco de GC, realizamos uma meta-análise abrangente.
Método:
Foi realizada busca eletrônica de vários bancos de dados para identificar estudos relevantes até abril de 2018.
Resultados:
Um total de 44 estudos caso-controle, incluindo 26 estudos sobre IL-10 -592A>C (5.332 casos e 8.272 controles) e 18 estudos sobre IL-10 -819T>C (3.431 casos e 6.109 controles) foram selecionados. No geral, o polimorfismo -592A> C foi associado ao risco de GC sob o modelo heterozigoto (OR=1,153, 95% IC=1,020-1,305, p=0,023), mas não polimorfismo -819T>C. Quando estratificada por etnia, associação significativa foi observada apenas nos asiáticos sob o modelo alelo (OR=1,153, IC 95%=1,007-1,320, p=0,040) e o modelo heterozigoto (OR=1,218, IC 95%=1,076-1,379, p=0,002) para -592A>C.
Conclusão:
Os atuais resultados são inconsistentes com metanálises anteriores; mostrou que o polimorfismo IL-10 -592A> C, mas não o polimorfismo -819T>C, pode ter contribuído para a suscetibilidade de GC em populações globais e asiáticas.
DESCRITORES:
Neoplasias Gástricas; Interleucina-10; Polimorfismo genético; Metanálise
ABSTRACT
Introduction:
A series of studies have evaluated the association between -592A>C and -819T>C polymorphisms in the promoter regions of Interleukin-10 (IL-10) and gastric cancer (GC) risk. However, the results remain inconclusive.
Objective:
To better understand the association of the polymorphisms with GC risk, we performed a comprehensive meta-analysis.
Method:
An electronic search was performed of several databases to identify relevant studies up to April 2018.
Results:
A total of 44 case-control studies, including 26 studies on IL-10 -592A>C (5,332 cases and 8,272 controls) and 18 studies on IL-10 -819T>C (3,431 cases and 6,109 controls) were selected. Overall, -592A>C polymorphism was associated with the risk of GC under the heterozygote model (OR=1.153, 95% CI=1.020-1.305, p=0.023), but not -819T>C polymorphism. When stratified by ethnicity, significant association was only observed in the Asians under the allele model (OR=1.153, 95% CI=1.007-1.320, p=0.040) and the heterozygote model (OR=1.218, 95% CI=1.076-1.379, p=0.002) for -592A>C.
Conclusion:
The current meta-analysis results inconsistent with previous meta-analyses; showed that the IL-10 -592A>C polymorphism, but not -819T>C polymorphism, may be contributed to the susceptibility of GC in overall and Asian populations.
HEADINGS:
Stomach neoplasms; Interleukin-10; Polymorphism, genetic; Meta-analysis
INTRODUÇÃO
O câncer gástrico (CG) é o quinto câncer mais comum e a segunda principal causa de morte relacionada ao câncer em todo o mundo2121 Khoram-Abadi KM, Forat-Yazdi M, Kheirandish S, Saeidi N, Zarezade Z, Mehrabi N, et al. DNMT3B -149 C>T and -579 G>T polymorphisms and risk of gastric and colorectal cancer: A meta-analysis. Asian Pacific J Cancer Prev. 2016;17(6).,3232 Namazi A, Forat-Yazdi M, Jafari M, Farahnak S, Nasiri R, Foroughi E, et al. Association of Interleukin-10 -1082 a/G (Rs1800896) Polymorphism With Susceptibility To Gastric Cancer: Meta-Analysis of 6,101 Cases and 8,557 Controls. Arq Gastroenterol. 2018;55(1):33-40. doi:10.1590/s0004-2803.201800000-18.
https://doi.org/10.1590/s0004-2803.20180...
,3636 Sahami-Fard MH, Yazd EF, Khazaei Z, Neamatzadeh H. Lack of association between the CDH1 -160C C>A polymorphism and risk of gastrointestinal cancer - A meta-analysis. Asian Pacific J Cancer Prev. 2016;17(5). doi:10.7314/APJCP.2016.17.5.2415.
https://doi.org/10.7314/APJCP.2016.17.5....
. Em 2016, estimaram-se 26.370 novos casos de GC nos Estados Unidos3939 Sicinschi LA, Lopez-Carrillo L, Camargo MC, Correa P, Sierra RA, Henry RR, et al. Gastric cancer risk in a Mexican population: role of Helicobacter pylori CagA positive infection and polymorphisms in interleukin-1 and -10 genes. Int J cancer. 2006;118(3):649-657. doi:10.1002/ijc.21364.
https://doi.org/10.1002/ijc.21364...
. Os últimos anos trouxeram muito progresso em relação à genética do GC e o número de SNPs confirmados associados ao GC e os genes aumentaram dramaticamente44 Cui X, Huang Q, Li X, Liu F, Wang D, Yan D, et al. Relationship between Interleukin-10 Gene C-819T Polymorphism and Gastric Cancer Risk: Insights from a Meta-Analysis. Med Sci Monit. 2016;22:2839-2845.,4848 Xue H, Lin B, An J, Zhu Y, Huang G. Interleukin-10-819 promoter polymorphism in association with gastric cancer risk. BMC Cancer. 2012;12(1):102. doi:10.1186/1471-2407-12-102.
https://doi.org/10.1186/1471-2407-12-102...
. Além disso, vários estudos têm apoiado o conceito de que os fatores ambientais são componentes críticos da patogênese do GC5252 Zabaleta J. Multifactorial Etiology of Gastric Cancer. Methods Mol Biol. 2012;863:411-35. doi: 10.1007/978-1-61779-612-8_26.
https://doi.org/10.1007/978-1-61779-612-...
. No entanto, fatores genéticos podem modificar a propensão ao desenvolvimento do CG por meio de uma alteração do estado inflamatório e também interagir com outros fatores de risco4444 Tan P, Yeoh K-G. Genetics and Molecular Pathogenesis of Gastric Adenocarcinoma. Gastroenterology. 2015;149(5):1153-1162.e3. doi:10.1053/j.gastro.2015.05.059.
https://doi.org/10.1053/j.gastro.2015.05...
.
Atualmente os mecanismos da etiologia e progressão da GC estão longe de ser claros44 Cui X, Huang Q, Li X, Liu F, Wang D, Yan D, et al. Relationship between Interleukin-10 Gene C-819T Polymorphism and Gastric Cancer Risk: Insights from a Meta-Analysis. Med Sci Monit. 2016;22:2839-2845.,3838 Shi J, Qu Y-P, Hou P. Pathogenetic mechanisms in gastric cancer. World J Gastroenterol. 2014;20(38):13804. doi:10.3748/wjg.v20.i38.13804.
https://doi.org/10.3748/wjg.v20.i38.1380...
. Vários genes foram identificados como associados ao risco de GC, incluindo Interleucina-10 (IL-10). Ela é uma citocina multifuncional com propriedades anti-inflamatórias, que tem sido relatada envolvendo no progresso e desenvolvimento de algumas neoplasias2222 Kim J, Cho YA, Choi IJ, Lee YS, Kim SY, Shin A, et al. Effects of interleukin-10 polymorphisms, Helicobacter pylori infection, and smoking on the risk of noncardia gastric cancer. Katoh M, ed. PLoS One. 2012;7(1):e29643. doi:10.1371/journal.pone.0029643.
https://doi.org/10.1371/journal.pone.002...
,4848 Xue H, Lin B, An J, Zhu Y, Huang G. Interleukin-10-819 promoter polymorphism in association with gastric cancer risk. BMC Cancer. 2012;12(1):102. doi:10.1186/1471-2407-12-102.
https://doi.org/10.1186/1471-2407-12-102...
. O gene humano que codifica IL-10 (Gene ID: 3586) mapeia para o braço longo do cromossomo 1 (1q31-32), que contém três mais comuns 21082A> G (rs1800896), 2592C> A (rs1800872) e 2829C> T (rs1800871) polimorfismos localizados dentro da região promotora. Esses polimorfismos estão associados à baixa/alta quantidade de secreção de IL-103131 Mocellin S, Marincola FM, Young HA. Interleukin-10 and the immune response against cancer: a counterpoint. J Leukoc Biol. 2005;78(5):1043-1051. doi:10.1189/jlb.0705358.
https://doi.org/10.1189/jlb.0705358...
,4545 Wang P, An J, Zhu Y, Wan X, Zhang H, Xi S, et al. Association of three promoter polymorphisms in interleukin-10 gene with cancer susceptibility in the Chinese population: a meta-analysis. Oncotarget. 2017;8(37):62382-62399. doi:10.18632/oncotarget.18220.
https://doi.org/10.18632/oncotarget.1822...
.
Uma série de estudos epidemiológicos relatou a associação dos polimorfismos -592A> C (rs1800872) e -819T> C (rs3021097) do gene IL-10 com o risco de GC2222 Kim J, Cho YA, Choi IJ, Lee YS, Kim SY, Shin A, et al. Effects of interleukin-10 polymorphisms, Helicobacter pylori infection, and smoking on the risk of noncardia gastric cancer. Katoh M, ed. PLoS One. 2012;7(1):e29643. doi:10.1371/journal.pone.0029643.
https://doi.org/10.1371/journal.pone.002...
,3131 Mocellin S, Marincola FM, Young HA. Interleukin-10 and the immune response against cancer: a counterpoint. J Leukoc Biol. 2005;78(5):1043-1051. doi:10.1189/jlb.0705358.
https://doi.org/10.1189/jlb.0705358...
,4545 Wang P, An J, Zhu Y, Wan X, Zhang H, Xi S, et al. Association of three promoter polymorphisms in interleukin-10 gene with cancer susceptibility in the Chinese population: a meta-analysis. Oncotarget. 2017;8(37):62382-62399. doi:10.18632/oncotarget.18220.
https://doi.org/10.18632/oncotarget.1822...
, mas os resultados permanecem conflitantes e não conclusivos. Algumas metanálises foram publicadas anteriormente sobre a associação dos polimorfismos -592A> C (rs1800872) e -819T> C (rs3021097) com o risco de GC44 Cui X, Huang Q, Li X, Liu F, Wang D, Yan D, et al. Relationship between Interleukin-10 Gene C-819T Polymorphism and Gastric Cancer Risk: Insights from a Meta-Analysis. Med Sci Monit. 2016;22:2839-2845.,4848 Xue H, Lin B, An J, Zhu Y, Huang G. Interleukin-10-819 promoter polymorphism in association with gastric cancer risk. BMC Cancer. 2012;12(1):102. doi:10.1186/1471-2407-12-102.
https://doi.org/10.1186/1471-2407-12-102...
,5555 Zhuang W, Wu XT, Zhou Y, Liu L, Liu GJ, Wu TX, et al. Interleukin10 -592 promoter polymorphism associated with gastric cancer among Asians: a meta-analysis of epidemiologic studies. Dig Dis Sci. 2010;55(6):1525-1532. doi:10.1007/s10620-009-0922-1.
https://doi.org/10.1007/s10620-009-0922-...
. Alguns estudos não foram incluídos nessas metanálises e, também, estudos originais com amostras maiores em diferentes etnias foram publicados desde então. Além disso, algumas das metanálises anteriores relataram conclusões conflitantes.
Assim, realizamos essa metanálise para avaliar se os polimorfismos IL-10 -592A> C e -819T> C contribuíram para a suscetibilidade do GC. Com base em nosso conhecimento, esta é a metanálise mais abrangente e precisa da associação dos polimorfismos IL-10 -592A> C e -819T> C com o risco de GC.
MÉTODO
Estratégia da pesquisa
As bases de dados eletrônicas do PubMed, EMBASE, Web of Knowledge, Scholar, Wanfang, CNBCI e Chinese Biomedical Literature Database (CBM) foram sistematicamente pesquisadas para recuperar publicações potenciais que avaliaram a associação entre -592A> C e -819T> C polimorfismos do gene IL-10 e GC risco, até 10 de abril de 2018. Os principais descritores utilizados foram os seguintes: (câncer gástrico ou neoplasia gástrica ou neoplasias do estômago) E (interleucina-10 OR IL-10) E (-592A> C OU rs1800872) E (-819T> C OU rs1800871) E (Polimorfismo OR SNP OU polimorfismo de nucleotídeo único OR variação ou mutação). Esta metanálise incluiu apenas publicações relativas a seres humanos, cobrindo todas as publicações relevantes em inglês e chinês com artigos de texto completo disponíveis. Listas de referências de artigos recuperados, artigos de revisão e metanálises anteriores também foram manualmente pesquisadas para evitar a falta de estudos relevantes.
Critérios de inclusão e exclusão
Os estudos foram incluídos na metanálise se satisfizessem os seguintes critérios: 1) texto completo disponível; 2) estudos caso-controle ou coorte; 3) os estudos que enfocassem a associação dos polimorfismos -592A> C (rs1800872) e -819T> C (rs3021097) do gene da IL-10 com o risco de GC; 4) dados publicados suficientes para frequências genotípicas e alélicas para calcular o Odds Ratio (OR) e intervalo de confiança de 95% (IC).
As principais razões para a exclusão dos estudos foram as seguintes: 1) resumo, artigos de revisão, relatos de casos, dados não publicados e comentários; 2) estudos com dados sobrepostos ou duplicados; 3) nenhum grupo controle saudável estabelecido no estudo; 4) estudos com dados pouco claros ou ambíguos ou frequências genotípicas. Quando os estudos estavam duplicados e publicados pelo mesmo autor com base na mesma amostra de pacientes, apenas aquele com o maior tamanho de amostra foi incluído nesta metanálise.
Extração de dados
Os dados foram cuidadosamente extraídos de todos os estudos elegíveis, independentemente por dois investigadores, de acordo com os critérios de inclusão e exclusão. Os seguintes dados foram coletados de cada estudo: primeiro autor, ano de publicação, origem do país, etnia, número total de casos e controles, frequências de genótipos, alelos menores (MAFs), valor de p para o equilíbrio de Hardy-Weinberg (HWE). Em caso de discordância (na extração de dados), foi resolvido por consenso, ou um terceiro autor avaliaria esses artigos. Na metanálise atual, a qualidade dos estudos selecionados foi testada pela confirmação de HWE em grupos controle, e estudos sem a confirmação de HWE em controles foram definidos como estudos de baixa qualidade, enquanto estudos com a confirmação de HWE em controles foram definidos como estudos de alta qualidade (Tabela 1).
Análise estatística
Todas as metanálises foram conduzidas usando o software Comprehensive Meta-Analysis (CMA) (EUA, versão 2.2.064) e p inferior a 0,05 foi considerado estatisticamente significativo. A força da associação dos polimorfismos -592A> C e -819T> C do gene da IL-10 com o risco de GC foi estimada por odds ratio brutas (OR) com correspondentes intervalos de confiança de 95% (ICs). A significância da OR agrupada foi determinada pelo teste Z. Um modelo de contraste de alelo (C vs. T), modelo homozigoto (CC vs. TT), modelo heterozigoto (CT vs. TT), modelo dominante (CC + CT vs. TT) e recessivo (CC vs. CT + TT) foram utilizados para o polimorfismo IL-10 -819T> C. Um modelo de contraste de alelo (C vs. A), modelo homozigoto (CC vs. AA), modelo heterozigoto (CA vs. AA), modelo dominante (CC + CA vs. AA) e recessivo (CC vs. CA + AA) foram utilizados para o polimorfismo -592A> C. O teste estatístico Q baseado no qui-quadrado de Cochran foi utilizado para avaliar a heterogeneidade estatística entre os estudos (com p <0,05 para significância estatística). Além disso, medida quantitativa da heterogeneidade entre os estudos também foi investigada usando a estatística I2, e a heterogeneidade entre os estudos foi considerada baixa, moderada e alta com base nos valores I2 de 25%, 50% e 75%, respectivamente1818 Kamali M, Hantoushzadeh S, Borna S, Neamatzadeh H, Mazaheri M, Noori-Shadkam M, et al. Association between Thrombophilic Genes Polymorphisms and Recurrent Pregnancy Loss Susceptibility in the Iranian Population: a Systematic Review and Meta-Analysis. Iran Biomed J. 2018;22(2):78-89.. Se a heterogeneidade entre os estudos foi estatisticamente significativa, o modelo de efeitos aleatórios77 DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7(3):177-188. foi aplicado; caso contrário, o modelo de efeitos fixos2929 Mantel N, Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. J Natl Cancer Inst. 1959;22(4):719-748. foi usado. A análise de sensibilidade foi realizada para avaliar a contribuição de estudos individuais para a estimativa do efeito agrupado, removendo sequencialmente cada estudo, um de cada vez, e computando estimativas diferenciais para o repouso. Além disso, a análise de sensibilidade foi realizada excluindo os estudos de baixa qualidade para testar a estabilidade dos resultados. O viés de publicação foi examinado usando o gráfico de funil de Begg e o teste de Egger22 Begg CB, Mazumdar M. Operating characteristics of a rank correlation test for publication bias. Biometrics. 1994;50(4):1088-1101.,99 Egger M, Davey Smith G, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ. 1997;315(7109):629-634.. Se o viés de publicação existisse, o método não-paramétrico “trim and fill” de Duval e Tweedie era usado para ajustá-lo. Análises de subgrupos por etnia e qualidade dos estudos (por status de HWE) foram realizadas posteriormente. A distribuição dos genótipos nos grupos de controle foi avaliada para uma partida do HWE usando o teste do qui-quadrado.
RESULTADOS
Características dos estudos
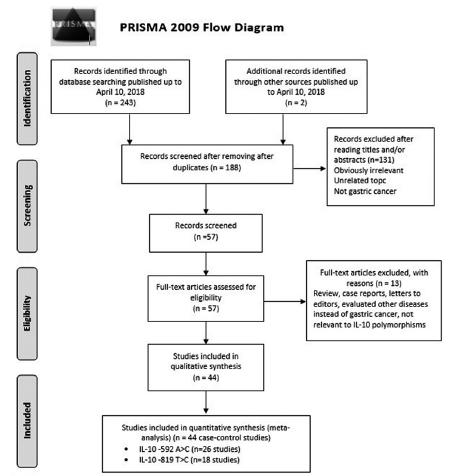
As Tabelas 1 e 2 mostram as características de todos os estudos elegíveis selecionados na metanálise. Os processos de seleção estão apresentados na Figura 1 (PRISMA 2009 Flow Diagram). Avaliamos todos os estudos recuperados, examinando títulos, resumos e conclusões. De acordo com a elegibilidade dos critérios, foram identificados 44 estudos em 29 publicações referentes à associação entre os polimorfismos IL-10 -592A> C e -819T> C com susceptibilidade ao GC. Todos estes 44 estudos eram caso-controle e forneceram dados suficientes para calcular a associação entre a IL-10 -592A> C 1,3,5,6,8,10,11,14,19,20,22,24,25, 27,28,31,33,34,43,46,47,37,39,50,53,54 e -819T> C 1,5,14,19,22-24,26,27,33,37, 43,42,46,47,51,53,54 polimorfismos com risco de GC. As características dos estudos selecionados estão resumidas nas Tabelas 1 e 3. Dentre esses estudos, 26 caso-controle avaliaram a associação do polimorfismo -592A> C com GC com 5.332 casos e 8.272 controles, incluindo cinco grupos de caucasianos55 Crusius JB1, Canzian F, Capellá G, Peña AS, Pera G, Sala N, et al. Cytokine gene polymorphisms and the risk of adenocarcinoma of the stomach in the European prospective investigation into cancer and nutrition (EPIC-EURGAST). Ann Oncol. 2008;19(11):1894-1902. doi:10.1093/annonc/mdn400.
https://doi.org/10.1093/annonc/mdn400...
,1010 El-Omar EM, Rabkin CS, Gammon MD, Vaughan TL, Risch HA, Schoenberg JB, et al. Increased risk of noncardia gastric cancer associated with proinflammatory cytokine gene polymorphisms. Gastroenterology. 2003;124(5):1193-1201.,1111 García-González MA, Lanas A, Quintero E, Nicolás D, Parra-Blanco A, Strunk M, Benito R, et al. Gastric Cancer Susceptibility Is Not Linked to Pro-and Anti-Inflammatory Cytokine Gene Polymorphisms in Whites: A Nationwide Multicenter Study in Spain. Am J Gastroenterol. 2007;102(9):1878-1892. doi:10.1111/j.1572-0241.2007.01423.x
https://doi.org/10.1111/j.1572-0241.2007...
,1919 Kamangar F, Abnet CC, Hutchinson AA, Newschaffer CJ, Helzlsouer K, Shugart YY, et al. Polymorphisms in inflammation-related genes and risk of gastric cancer (Finland). Cancer Causes Control. 2006;17(1):117-125. doi:10.1007/s10552-005-0439-7.
https://doi.org/10.1007/s10552-005-0439-...
,5353 Zambon CF, Basso D, Navaglia F, Belluco C, Falda A, Fogar P, et al. Pro- and anti-inflammatory cytokines gene polymorphisms and Helicobacter pylori infection: interactions influence outcome. Cytokine. 2005;29(4):141-152. doi:10.1016/j.cyto.2004.10.013.
https://doi.org/10.1016/j.cyto.2004.10.0...
, 16 grupos de asiáticos 88 Deng W, He L, Peng X. [The relationship among IL-10 gene polymorphisms H elicobacter pylori and noncardia gastric cancer development in Fujian province]. [Article in Chinese]. Wei Chang Bing Xue He Gan Bing Xue Za Zhi. 2008;17:212-214.,1414 He B, Pan Y, Xu Y, Nie Z, Chen L, Gu L, et al. Increased Risk for Gastric Cancer in Carriers of the Lymphotoxin-a+252G Variant Infected by Helicobacter pylori. Genet Test Mol Biomarkers. 2012;16(1):9-14. doi:10.1089/gtmb.2011.0078.
https://doi.org/10.1089/gtmb.2011.0078...
,2020 Kang JM, Kim N, Lee DH, Park JH, Lee MK, Kim JS, et al. The effects of genetic polymorphisms of IL-6, IL-8, and IL-10 on Helicobacter pylori-induced gastroduodenal diseases in Korea. J Clin Gastroenterol. 2009;43(5):420-428. doi:10.1097/MCG.0b013e318178d1d3.
https://doi.org/10.1097/MCG.0b013e318178...
,2222 Kim J, Cho YA, Choi IJ, Lee YS, Kim SY, Shin A, et al. Effects of interleukin-10 polymorphisms, Helicobacter pylori infection, and smoking on the risk of noncardia gastric cancer. Katoh M, ed. PLoS One. 2012;7(1):e29643. doi:10.1371/journal.pone.0029643.
https://doi.org/10.1371/journal.pone.002...
,2424 Kuo WH, Huang CY, Fu CK, Hsieh YH, Liao CH, Hsu CM,et al. Effects of interleukin-10 polymorphisms and smoking on the risk of gastric cancer in Taiwan. In Vivo. 2014;28(5):967-971.,2525 Lee JY, Kim HY, Kim KH, Kim SM, Jang MK, Park JY, et al. Association of polymorphism of IL-10 and TNF-A genes with gastric cancer in Korea. Cancer Lett. 2005;225(2):207-214. doi:10.1016/j.canlet.2004.11.028.
https://doi.org/10.1016/j.canlet.2004.11...
,2727 Liu J, Song B, Wang J-L, Li Z-J, Li W-H, Wang Z-H. Polymorphisms of interleukin-10 promoter are not associated with prognosis of advanced gastric cancer. World J Gastroenterol. 2011;17(10):1362. doi:10.3748/wjg.v17.i10.1362.
https://doi.org/10.3748/wjg.v17.i10.1362...
,2828 Ma B, Zhang T, Wan Y, Zhan F. [A case-control study of interleukin-10 gene -592A/C polymorphism and the risk of gastric cancer]. [Article in Chinese].,3333 Oh SS, Chang SC, Cai L, Cordon-Cardo C, Ding BG, Greenland S, et al. Single nucleotide polymorphisms of 8 inflammation-related genes and their associations with smoking-related cancers. Int J cancer. 2010;127(9):2169-2182. doi:10.1002/ijc.25214.
https://doi.org/10.1002/ijc.25214...
,3434 Pan XF, Yang SJ, Loh M, Xie Y, Wen YY, Tian Z, et al. Interleukin-10 gene promoter polymorphisms and risk of gastric cancer in a Chinese population: single nucleotide and haplotype analyses. Asian Pac J Cancer Prev. 2013;14(4):2577-2582.,3737 Savage SA, Abnet CC, Haque K, Mark SD, Qiao YL, Dong ZW, et al. Polymorphisms in interleukin -2, -6, and -10 are not associated with gastric cardia or esophageal cancer in a high-risk Chinese population. Cancer Epidemiol Biomarkers Prev. 2004;13(9):1547-1549.,4343 Sugimoto M, Furuta T, Shirai N, Nakamura A, Kajimura M, Sugimura H, et al. Effects of interleukin-10 gene polymorphism on the development of gastric cancer and peptic ulcer in Japanese subjects. J Gastroenterol Hepatol. 2007;22(9):1443-1449. doi:10.1111/j.1440-1746.2006.04613.x
https://doi.org/10.1111/j.1440-1746.2006...
,4747 Xiao H, Jiang Y, Li R, Xia B. [Association of IL-10 gene polymorphisms with gastroduodenal diseases in Hubei Han population]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 2009;26(4):423-426.,4646 Wu MS, Wu CY, Chen CJ, Lin MT, Shun CT, Lin JT. Interleukin-10 genotypes associate with the risk of gastric carcinoma in Taiwanese Chinese. Int J cancer. 2003;104(5):617-623. doi:10.1002/ijc.10987.
https://doi.org/10.1002/ijc.10987...
,5050 Yin J, Wang X, Wei J, Wang L, Shi Y, Zheng L,et al. Interleukin 12B rs3212227 T>G polymorphism was associated with an increased risk of gastric cardiac adenocarcinoma in a Chinese population. Dis esophagus Off J Int Soc Dis Esophagus. 2015;28(3):291-298. doi:10.1111/dote.12189.
https://doi.org/10.1111/dote.12189...
,5454 Zeng X, Li Y, Liu T, Zhang J. Diverse H. pylori strains, IL-10 promoter polymorphisms with high morbidity of gastric cancer in Hexi area of Gansu Province, China. Mol Cell Biochem. 2012;362(1-2):241-248. doi:10.1007/s11010-011-1149-y.
https://doi.org/10.1007/s11010-011-1149-...
e cinco latinos11 Alpízar-Alpízar W, Pérez-Pérez GI, Une C, Cuenca P, Sierra R. Association of interleukin-1B and interleukin-1RN polymorphisms with gastric cancer in a high-risk population of Costa Rica. Clin Exp Med. 2005;5(4):169-176. doi:10.1007/s10238-005-0082-3.
https://doi.org/10.1007/s10238-005-0082-...
,33 Con SA, Takeuchi H, Con-Chin GR, Con-Chin VG, Yasuda N, Con-Wong R. Role of bacterial and genetic factors in gastric cancer in Costa Rica. World J Gastroenterol. 2009;15(2):211-218. doi:10.3748/WJG.15.211.
https://doi.org/10.3748/WJG.15.211...
,66 de Oliveira JG, Rossi AF, Nizato DM, Cadamuro AC, Jorge YC, Valsechi MC, et al. Influence of functional polymorphisms in TNF-a, IL-8, and IL-10 cytokine genes on mRNA expression levels and risk of gastric cancer. Tumor Biol. 2015;36(12):9159-9170. doi:10.1007/s13277-015-3593-x.
https://doi.org/10.1007/s13277-015-3593-...
,3131 Mocellin S, Marincola FM, Young HA. Interleukin-10 and the immune response against cancer: a counterpoint. J Leukoc Biol. 2005;78(5):1043-1051. doi:10.1189/jlb.0705358.
https://doi.org/10.1189/jlb.0705358...
,3939 Sicinschi LA, Lopez-Carrillo L, Camargo MC, Correa P, Sierra RA, Henry RR, et al. Gastric cancer risk in a Mexican population: role of Helicobacter pylori CagA positive infection and polymorphisms in interleukin-1 and -10 genes. Int J cancer. 2006;118(3):649-657. doi:10.1002/ijc.21364.
https://doi.org/10.1002/ijc.21364...
(Tabela 1). Dezoito estudos de caso-controle avaliaram a associação entre os polimorfismos -819T> C e o risco de GC, com 3.431 casos e 6.109 controles, incluindo três grupos de caucasianos55 Crusius JB1, Canzian F, Capellá G, Peña AS, Pera G, Sala N, et al. Cytokine gene polymorphisms and the risk of adenocarcinoma of the stomach in the European prospective investigation into cancer and nutrition (EPIC-EURGAST). Ann Oncol. 2008;19(11):1894-1902. doi:10.1093/annonc/mdn400.
https://doi.org/10.1093/annonc/mdn400...
,1919 Kamangar F, Abnet CC, Hutchinson AA, Newschaffer CJ, Helzlsouer K, Shugart YY, et al. Polymorphisms in inflammation-related genes and risk of gastric cancer (Finland). Cancer Causes Control. 2006;17(1):117-125. doi:10.1007/s10552-005-0439-7.
https://doi.org/10.1007/s10552-005-0439-...
,5353 Zambon CF, Basso D, Navaglia F, Belluco C, Falda A, Fogar P, et al. Pro- and anti-inflammatory cytokines gene polymorphisms and Helicobacter pylori infection: interactions influence outcome. Cytokine. 2005;29(4):141-152. doi:10.1016/j.cyto.2004.10.013.
https://doi.org/10.1016/j.cyto.2004.10.0...
, 14 de asiáticos14,22-24,26. , 27,33,37,42,43,46,47,51,54 e uma população latina11 Alpízar-Alpízar W, Pérez-Pérez GI, Une C, Cuenca P, Sierra R. Association of interleukin-1B and interleukin-1RN polymorphisms with gastric cancer in a high-risk population of Costa Rica. Clin Exp Med. 2005;5(4):169-176. doi:10.1007/s10238-005-0082-3.
https://doi.org/10.1007/s10238-005-0082-...
(Tabela 2). Os países desses estudos incluíram China, Coréia, Japão, Índia, EUA, Itália, Finlândia, Espanha, Holanda, Costa Rica, Brasil, México e Chile. Todas as distribuições dos genótipos dos controles estavam de acordo com o HWE para os polimorfismos IL-10 -592A> C e -819T> C, exceto em nove estudos em cinco publicações1111 García-González MA, Lanas A, Quintero E, Nicolás D, Parra-Blanco A, Strunk M, Benito R, et al. Gastric Cancer Susceptibility Is Not Linked to Pro-and Anti-Inflammatory Cytokine Gene Polymorphisms in Whites: A Nationwide Multicenter Study in Spain. Am J Gastroenterol. 2007;102(9):1878-1892. doi:10.1111/j.1572-0241.2007.01423.x
https://doi.org/10.1111/j.1572-0241.2007...
,2121 Khoram-Abadi KM, Forat-Yazdi M, Kheirandish S, Saeidi N, Zarezade Z, Mehrabi N, et al. DNMT3B -149 C>T and -579 G>T polymorphisms and risk of gastric and colorectal cancer: A meta-analysis. Asian Pacific J Cancer Prev. 2016;17(6).,3030 Mehdinejad M, Sobhan MR, Mazaheri M, Shehneh MZ, Neamatzadeh H, Kalantar SM. Genetic association between ERCC2, NBN, RAD51 gene variants and osteosarcoma risk: A systematic review and meta-analysis. Asian Pacific J Cancer Prev. 2017;18(5). doi:10.22034/APJCP.2017.18.5.1315.
https://doi.org/10.22034/APJCP.2017.18.5...
,3131 Mocellin S, Marincola FM, Young HA. Interleukin-10 and the immune response against cancer: a counterpoint. J Leukoc Biol. 2005;78(5):1043-1051. doi:10.1189/jlb.0705358.
https://doi.org/10.1189/jlb.0705358...
,4040 Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66(1):7-30. doi:10.3322/caac.21332.
https://doi.org/10.3322/caac.21332...
. Portanto, 35 dos 44 estudos de caso-controle foram definidos como estudos de alta qualidade (Tabelas 1 e 2).
Fluxograma da seleção de estudos nesta metanálise (IL-10 -592A> C e -819T> C Polimorfismos)
Metanálise
Polimorfismo IL-10 -592A> C
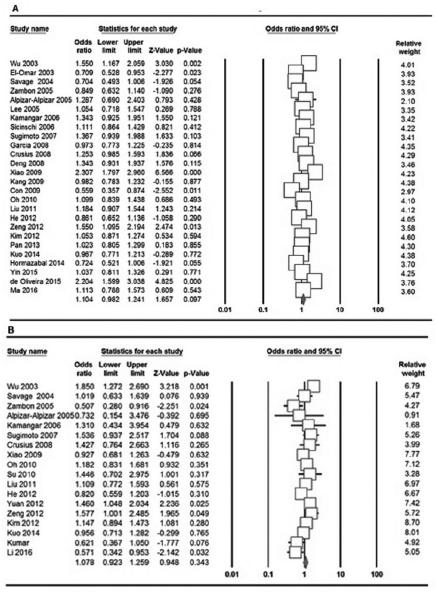
A Tabela 3 lista os principais resultados da metanálise do polimorfismo IL-10 -592A> C e do risco de GC. Quando todos os estudos elegíveis do polimorfismo IL-10 -592A> C foram nela agrupados, uma associação significativa foi encontrada apenas sob o modelo heterozigoto (CA VS. AA: OR=1,153, IC 95%=1,020-1,305, p=0,023, Figura 2A). Além disso, heterogeneidade significativa entre os estudos foi detectada em todos os modelos genéticos. Quando estratificada por etnia, associação significativa entre o polimorfismo IL-10 -592A> C e o aumento do risco de GC entre asiáticos foi detectada no modelo alelo (C vs. A: OR=1,153, IC 95%=1,007-1,320, p=0,040) e o modelo heterozigoto (CA Vs. AA: OR=1,218, IC 95%=1,076-1,379, p=0,002), mas não entre as populações caucasiana e latina. A análise de subgrupos de estudos com alta qualidade mostrou que houve associação significativa entre o polimorfismo IL-10 -1082 A> G e aumento do risco de GC apenas sob o modelo alélico (OR=1,154, IC 95%=1,004-1,326, p=0,044, Tabela2).
Gráfico de floresta da associação de IL-10 -592A> C e -819T> C Polimorfismos com GC: A) -592A> C (modelo homozigótico: C vs. A); B) -819T> C (modelo dominante: CC + CT vs. TT).
Polimorfismo IL-10 -819T> C
A Tabela 4 e a Figura 2B mostram os principais resultados da metanálise do polimorfismo IL-10 -819T> C e do risco de GC. Quando todos os estudos elegíveis foram agrupados na metanálise do polimorfismo IL-10 -819T> C, não foi observada associação significativa em nenhum modelo genético. Nas análises estratificadas baseadas na etnia e na qualidade dos estudos, ainda não houve associação significativa entre o polimorfismo IL-10 -819T> C e o risco de GC.
Análise de heterogeneidade e sensibilidade
Como mostrado nas Tabelas 3 e 4, houve heterogeneidade significativa entre os estudos para o polimorfismo IL-10 -592A> C em todos os modelos genéticos (C vs. A: Ph=0,001; CC vs. AA: Ph=0,001; CA Vs. AA: Ph=0,009; CC + CA vs. AA: Ph=0,001; CC vs. CA + AA: Ph=0,001), e para o polimorfismo IL-10 -819T> C (rs3021097) sob quatro modelos genéticos (C Vs. A: Ph=0,001; CC vs. TT: Ph=0,0160,001; CT vs. TT: Ph=021 e CC + CT vs. TT: Ph=0,002), exceto o modelo genético recessivo (CC vs. CT + TT: Ph=0,150). Realizamos a análise de sensibilidade omitindo um estudo de cada vez e calculando novamente os OR agrupados. No entanto, os resultados não mostraram diferenças estatísticas significativas quando os estudos foram omitidos. Portanto, a estabilidade do estudo não foi influenciada por nenhum estudo individual.
Viés de publicação
Tanto o gráfico de funil de Begg quanto o teste de Egger foram realizados para avaliar os vieses de publicação dos estudos. As Tabelas 3 e 4 apresentam os resultados sob os cinco modelos genéticos. Como mostrado na Figura 3A as formas dos gráficos de funil de Begg sob o modelo de alelo do polimorfismo IL-10 -592A> C mostraram evidências aproximadamente simétricas e significativas de viés de publicação não foram observadas pelo teste de Egger. Quanto ao polimorfismo IL-10 -819T> C, as formas dos gráficos do funil de Begg sob o modelo de comparação heterozigoto pareciam simétricas (Figura 3B). Além disso, os testes de Egger (todos os valores de p para o teste de Egger >0,05) também mostraram que não havia evidência de viés de publicação para ambos os polimorfismos.
Gráfico de funil para viés de publicação na metanálise dos polimorfismos IL-10 -592A> C e -819T> C com GC: A) -592A> C (modelo heterozigótico: CA vs. AA); B) -819T> C (modelo alelo: C vs. T)
DISCUSSÃO
Uma metanálise pode combinar resultados de estudos individuais para superar a limitação de amostras pequenas e poder estatístico inadequado, produzir uma única estimativa do efeito principal, responder questões não resolvidas pelos estudos individuais, resolver debates controversos decorrentes de estudos conflitantes e citar limitações do conhecimento atual1212 Garg AX, Hackam D, Tonelli M. Systematic Review and Meta-analysis: When One Study Is Just not Enough. Clin J Am Soc Nephrol. 2008;3(1):253-260. doi:10.2215/CJN.01430307.
https://doi.org/10.2215/CJN.01430307...
,1515 Haidich AB, Haidich AB. Meta-analysis in medical research. Hippokratia. 2010;14(Suppl 1):29-37.. Até o momento, várias metanálises foram realizadas para avaliar a associação do gene IL-10 -592A> C e -819T> C polimorfismos com GC. No entanto, devido à falta de capacidade de obter conclusões confiáveis em geral, devido ao tamanho limitado das amostras, um consenso não foi alcançado. Portanto, para melhor elucidar a associação dos polimorfismos IL-10 -592A> C e -819T> C com o GC, foi realizada metanálise atualizada e mais abrangente através da coleta de 44 estudos de caso-controle relevantes em 29 publicações.
Em 2014, Qi et al. em metanálise de 12 estudos com 2.116 casos de GC e 4.077 controles, relataram que não houve associação significativa entre o polimorfismo IL-10 -592C> A e o risco de GC na população total3535 Qi M, Liu DM, Pan LL, Lin YX. Interleukin-10 gene -592C>A polymorphism and susceptibility to gastric cancer. Genet Mol Res. 2014;13(4):8954-8961. doi:10.4238/2014.October.31.10.
https://doi.org/10.4238/2014.October.31....
. Desde então, uma série de estudos de caso-controle mais bem desenhados sobre essa associação foram realizados. Portanto, seus resultados como uma metanálise permanecem essencialmente como um campo aberto. Nesta metanálise 26 estudos de caso-controle elegíveis com 5.332 casos e 8.272 controles foram identificados e analisados. Nossos resultados mostraram que houve associação significativa entre o polimorfismo IL-10 -592C> A e a suscetibilidade ao GC na população total. Além disso, em comparação com a metanálise de Qi et al, o modelo genético de alelos e a análise de subgrupos entre os latinos também foram realizados. Nesta metanálise descobrimos que o polimorfismo IL-10 -592C> A estava associado ao risco de GC em asiáticos sob o modelo de alelo (C vs. A: OR=1,153, IC 95%=1,007-1,320, p=0,040) e o modelo heterozigoto (CA vs. AA: OR=1,218, IC 95%=1,076-1,379, p=0,002). Além disso, vale ressaltar que a associação entre o polimorfismo IL-10 -592C> A e o risco de GC foi significativa pela qualidade dos estudos sob o modelo alelo (OR=1,154, IC95%=1,004-1,326, p=0,044).
Em 2016, Cui et al. realizaram uma metanálise para avaliar a suscetibilidade do polimorfismo IL-10 -819T> C ao GC, incluindo 11 artigos com 1.960 casos e 3.705 controles44 Cui X, Huang Q, Li X, Liu F, Wang D, Yan D, et al. Relationship between Interleukin-10 Gene C-819T Polymorphism and Gastric Cancer Risk: Insights from a Meta-Analysis. Med Sci Monit. 2016;22:2839-2845.. Seus resultados sugeriram que L-10 -819T> O polimorfismo C tem papel protetor na suscetibilidade ao GC, embora seus resultados tenham sugerido que o polimorfismo IL-10 -819T> C pode não contribuir para o risco de GC; no entanto, esses estudos foram com pequeno número de casos e controles. Na metanálise atual, incluímos um total de 18 estudos de caso-controle com 3.431 casos e 6.109 controles. Os resultados agrupados indicaram que não houve associação óbvia entre o polimorfismo IL-10 -819T> C para GC. Portanto, nossa metanálise não apenas confirmou os resultados de Cui et al, mas também forneceu resultados estatísticos mais confiáveis, incluindo mais sete estudos de caso-controle44 Cui X, Huang Q, Li X, Liu F, Wang D, Yan D, et al. Relationship between Interleukin-10 Gene C-819T Polymorphism and Gastric Cancer Risk: Insights from a Meta-Analysis. Med Sci Monit. 2016;22:2839-2845..
A heterogeneidade entre os estudos é comum na metanálise de estudos de associação genética4141 Sobhan MR, Mehdinejad M, Jamaladini MH, Mazaheri M, Zare-Shehneh M, Neamatzadeh H. Association between aspartic acid repeat polymorphism of the asporin gene and risk of knee osteoarthritis: A systematic review and meta-analysis. Acta Orthop Traumatol Turc. 2017;51(5). doi:10.1016/j.aott.2017.08.001.
https://doi.org/10.1016/j.aott.2017.08.0...
,4949 Yazdi MM, Jamalaldini MH, Sobhan MR, Jafari M, Mazaheri M, Zare-Shehneh M, et al. Association of ESRa Gene Pvu II T>C, XbaI A>G and BtgI G>A Polymorphisms with Knee Osteoarthritis Susceptibility: A Systematic Review and Meta-Analysis Based on 22 Case-Control Studies. Arch Bone Jt Surg. 2017;5(6). doi:10.22038/abjs.2017.22391.1578.
https://doi.org/10.22038/abjs.2017.22391...
. Em cada caso, ela pode ser resultado de diferentes covariáveis, como etnia, fontes de controles, tamanho da amostra, HWE e métodos utilizados, entre outros1616 Jafari Nedooshan J, Kargar S, Neamatzadeh H, Haghighi F, Dehghani Mohammad-Abadi R, Seddighi N. Lack of Association of the Fat Mass and Obesity Associated (FTO) Gene rs9939609 Polymorphism with Breast Cancer Risk: a Systematic Review and Meta-Analysis Based on Case - Control Studies. Asian Pac J Cancer Prev. 2017;18(4):1031-1037. doi:10.22034/APJCP.2017.18.4.1031.
https://doi.org/10.22034/APJCP.2017.18.4...
,1717 Jafari Nedooshan J, Forat-Yazdi M, Neamatzadeh H, Zare Shehneh M, Kargar S, Seddighi N. Genetic Association of XRCC1 Gene rs1799782, rs25487 and rs25489 Polymorphisms with Risk of Thyroid Cancer: Meta-Analysis. Asian Pac J Cancer Prev. 2017;18(1):263-270.,3030 Mehdinejad M, Sobhan MR, Mazaheri M, Shehneh MZ, Neamatzadeh H, Kalantar SM. Genetic association between ERCC2, NBN, RAD51 gene variants and osteosarcoma risk: A systematic review and meta-analysis. Asian Pacific J Cancer Prev. 2017;18(5). doi:10.22034/APJCP.2017.18.5.1315.
https://doi.org/10.22034/APJCP.2017.18.5...
. Na metanálise atual, heterogeneidade significativa foi detectada entre todos os estudos sob todos os modelos genéticos e, portanto, selecionamos o modelo de efeitos aleatórios para resumir as ORs. Portanto, realizamos a análise de metarregressão para encontrar a fonte de heterogeneidade entre os estudos. Os resultados mostraram que a qualidade da etnia e dos estudos não contribuiu para a heterogeneidade substancial entre os trabalhos da metanálise atual. Além disso, realizamos análises de sensibilidade de acordo com o tamanho da amostra e a análise do leave-one-out para determinar se a modificação dos critérios de inclusão através da remoção de um estudo de cada vez afetou os resultados. No entanto, para os polimorfismos IL-10 -592A> C e -819T> C, as análises de sensibilidade não afetaram materialmente os resultados originais.
A presente metanálise tem algumas vantagens em comparação com as anteriores. No entanto, ela tem algumas limitações que devem ser levadas em conta. Primeiro, incluímos apenas estudos publicados em inglês e chinês; portanto, viés de publicação pode ter ocorrido. Em segundo, nesta metanálise, a grande proporção do poder estatístico foi contribuída pela etnia asiática. Não houve estudos suficientes em caucasianos e latinos, o que limitou o poder estatístico. Além disso, o africano foi uma das três maiores etnias, mas não encontramos nenhum estudo sobre os africanos. Terceiro, a metanálise atual foi realizada para analisar esses polimorfismos separadamente; entretanto, uma análise de haplótipos poderia ter sido mais poderosa para encontrar associações significativas com GC. As OR extraídas de cada estudo elegível foram baseadas em estimativas não ajustadas, enquanto análise mais precisa deveria ser realizada em todos os dados individuais disponíveis, o que permitiria o ajuste por outras co-variantes, incluindo idade, exposições ambientais, tabagismo e outros fatores de estilo de vida. Finalmente, as interações gene-gene e gene-ambiente que podem modular a suscetibilidade do GC não foram abordadas nesta metanálise pela falta de dados suficientes.
CONCLUSÃO
A atual metanálise resulta inconsistente com as metanálises anteriores; mostrou que o polimorfismo IL-10 -592A> C contribuiu para a suscetibilidade de GC na população geral, particularmente em populações asiáticas. No entanto, o polimorfismo IL-10 -819T> C não foi associado a um risco aumentado de GC. Outros grandes estudos bem desenhados ainda são necessários para determinar os efeitos dos polimorfismos IL-10 -592A> C e -819T> C no GC.
REFERENCES
-
1Alpízar-Alpízar W, Pérez-Pérez GI, Une C, Cuenca P, Sierra R. Association of interleukin-1B and interleukin-1RN polymorphisms with gastric cancer in a high-risk population of Costa Rica. Clin Exp Med. 2005;5(4):169-176. doi:10.1007/s10238-005-0082-3.
» https://doi.org/10.1007/s10238-005-0082-3 -
2Begg CB, Mazumdar M. Operating characteristics of a rank correlation test for publication bias. Biometrics. 1994;50(4):1088-1101.
-
3Con SA, Takeuchi H, Con-Chin GR, Con-Chin VG, Yasuda N, Con-Wong R. Role of bacterial and genetic factors in gastric cancer in Costa Rica. World J Gastroenterol. 2009;15(2):211-218. doi:10.3748/WJG.15.211.
» https://doi.org/10.3748/WJG.15.211 -
4Cui X, Huang Q, Li X, Liu F, Wang D, Yan D, et al. Relationship between Interleukin-10 Gene C-819T Polymorphism and Gastric Cancer Risk: Insights from a Meta-Analysis. Med Sci Monit. 2016;22:2839-2845.
-
5Crusius JB1, Canzian F, Capellá G, Peña AS, Pera G, Sala N, et al. Cytokine gene polymorphisms and the risk of adenocarcinoma of the stomach in the European prospective investigation into cancer and nutrition (EPIC-EURGAST). Ann Oncol. 2008;19(11):1894-1902. doi:10.1093/annonc/mdn400.
» https://doi.org/10.1093/annonc/mdn400 -
6de Oliveira JG, Rossi AF, Nizato DM, Cadamuro AC, Jorge YC, Valsechi MC, et al. Influence of functional polymorphisms in TNF-a, IL-8, and IL-10 cytokine genes on mRNA expression levels and risk of gastric cancer. Tumor Biol. 2015;36(12):9159-9170. doi:10.1007/s13277-015-3593-x.
» https://doi.org/10.1007/s13277-015-3593-x -
7DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7(3):177-188.
-
8Deng W, He L, Peng X. [The relationship among IL-10 gene polymorphisms H elicobacter pylori and noncardia gastric cancer development in Fujian province]. [Article in Chinese]. Wei Chang Bing Xue He Gan Bing Xue Za Zhi. 2008;17:212-214.
-
9Egger M, Davey Smith G, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ. 1997;315(7109):629-634.
-
10El-Omar EM, Rabkin CS, Gammon MD, Vaughan TL, Risch HA, Schoenberg JB, et al. Increased risk of noncardia gastric cancer associated with proinflammatory cytokine gene polymorphisms. Gastroenterology. 2003;124(5):1193-1201.
-
11García-González MA, Lanas A, Quintero E, Nicolás D, Parra-Blanco A, Strunk M, Benito R, et al. Gastric Cancer Susceptibility Is Not Linked to Pro-and Anti-Inflammatory Cytokine Gene Polymorphisms in Whites: A Nationwide Multicenter Study in Spain. Am J Gastroenterol. 2007;102(9):1878-1892. doi:10.1111/j.1572-0241.2007.01423.x
» https://doi.org/10.1111/j.1572-0241.2007.01423.x -
12Garg AX, Hackam D, Tonelli M. Systematic Review and Meta-analysis: When One Study Is Just not Enough. Clin J Am Soc Nephrol. 2008;3(1):253-260. doi:10.2215/CJN.01430307.
» https://doi.org/10.2215/CJN.01430307 -
13Gonzalez-Hormazabal P, Musleh M, Bustamante M, Stambuk J, Escandar S, Valladares H, et al. Role of cytokine gene polymorphisms in gastric cancer risk in Chile. Anticancer Res. 2014;34(7):3523-3530.
-
14He B, Pan Y, Xu Y, Nie Z, Chen L, Gu L, et al. Increased Risk for Gastric Cancer in Carriers of the Lymphotoxin-a+252G Variant Infected by Helicobacter pylori. Genet Test Mol Biomarkers. 2012;16(1):9-14. doi:10.1089/gtmb.2011.0078.
» https://doi.org/10.1089/gtmb.2011.0078 -
15Haidich AB, Haidich AB. Meta-analysis in medical research. Hippokratia. 2010;14(Suppl 1):29-37.
-
16Jafari Nedooshan J, Kargar S, Neamatzadeh H, Haghighi F, Dehghani Mohammad-Abadi R, Seddighi N. Lack of Association of the Fat Mass and Obesity Associated (FTO) Gene rs9939609 Polymorphism with Breast Cancer Risk: a Systematic Review and Meta-Analysis Based on Case - Control Studies. Asian Pac J Cancer Prev. 2017;18(4):1031-1037. doi:10.22034/APJCP.2017.18.4.1031.
» https://doi.org/10.22034/APJCP.2017.18.4.1031 -
17Jafari Nedooshan J, Forat-Yazdi M, Neamatzadeh H, Zare Shehneh M, Kargar S, Seddighi N. Genetic Association of XRCC1 Gene rs1799782, rs25487 and rs25489 Polymorphisms with Risk of Thyroid Cancer: Meta-Analysis. Asian Pac J Cancer Prev. 2017;18(1):263-270.
-
18Kamali M, Hantoushzadeh S, Borna S, Neamatzadeh H, Mazaheri M, Noori-Shadkam M, et al. Association between Thrombophilic Genes Polymorphisms and Recurrent Pregnancy Loss Susceptibility in the Iranian Population: a Systematic Review and Meta-Analysis. Iran Biomed J. 2018;22(2):78-89.
-
19Kamangar F, Abnet CC, Hutchinson AA, Newschaffer CJ, Helzlsouer K, Shugart YY, et al. Polymorphisms in inflammation-related genes and risk of gastric cancer (Finland). Cancer Causes Control. 2006;17(1):117-125. doi:10.1007/s10552-005-0439-7.
» https://doi.org/10.1007/s10552-005-0439-7 -
20Kang JM, Kim N, Lee DH, Park JH, Lee MK, Kim JS, et al. The effects of genetic polymorphisms of IL-6, IL-8, and IL-10 on Helicobacter pylori-induced gastroduodenal diseases in Korea. J Clin Gastroenterol. 2009;43(5):420-428. doi:10.1097/MCG.0b013e318178d1d3.
» https://doi.org/10.1097/MCG.0b013e318178d1d3 -
21Khoram-Abadi KM, Forat-Yazdi M, Kheirandish S, Saeidi N, Zarezade Z, Mehrabi N, et al. DNMT3B -149 C>T and -579 G>T polymorphisms and risk of gastric and colorectal cancer: A meta-analysis. Asian Pacific J Cancer Prev. 2016;17(6).
-
22Kim J, Cho YA, Choi IJ, Lee YS, Kim SY, Shin A, et al. Effects of interleukin-10 polymorphisms, Helicobacter pylori infection, and smoking on the risk of noncardia gastric cancer. Katoh M, ed. PLoS One. 2012;7(1):e29643. doi:10.1371/journal.pone.0029643.
» https://doi.org/10.1371/journal.pone.0029643 -
23Kumar S, Kumari N, Mittal RD, Mohindra S, Ghoshal UC. Association between pro-(IL-8) and anti-inflammatory (IL-10) cytokine variants and their serum levels and H. pylori-related gastric carcinogenesis in northern India. Meta Gene. 2015;6:9-16. doi:10.1016/j.mgene.2015.07.008.
» https://doi.org/10.1016/j.mgene.2015.07.008 -
24Kuo WH, Huang CY, Fu CK, Hsieh YH, Liao CH, Hsu CM,et al. Effects of interleukin-10 polymorphisms and smoking on the risk of gastric cancer in Taiwan. In Vivo. 2014;28(5):967-971.
-
25Lee JY, Kim HY, Kim KH, Kim SM, Jang MK, Park JY, et al. Association of polymorphism of IL-10 and TNF-A genes with gastric cancer in Korea. Cancer Lett. 2005;225(2):207-214. doi:10.1016/j.canlet.2004.11.028.
» https://doi.org/10.1016/j.canlet.2004.11.028 -
26Li L, Tang XY, Ye LM, Yang Q, Li Y. Investigation on the association between IL-10 C819T gene polymorphisms and susceptibility to gastric cancer. Genet Mol Res. 2016;15(4). doi:10.4238/gmr15047915.
» https://doi.org/10.4238/gmr15047915 -
27Liu J, Song B, Wang J-L, Li Z-J, Li W-H, Wang Z-H. Polymorphisms of interleukin-10 promoter are not associated with prognosis of advanced gastric cancer. World J Gastroenterol. 2011;17(10):1362. doi:10.3748/wjg.v17.i10.1362.
» https://doi.org/10.3748/wjg.v17.i10.1362 -
28Ma B, Zhang T, Wan Y, Zhan F. [A case-control study of interleukin-10 gene -592A/C polymorphism and the risk of gastric cancer]. [Article in Chinese].
-
29Mantel N, Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. J Natl Cancer Inst. 1959;22(4):719-748.
-
30Mehdinejad M, Sobhan MR, Mazaheri M, Shehneh MZ, Neamatzadeh H, Kalantar SM. Genetic association between ERCC2, NBN, RAD51 gene variants and osteosarcoma risk: A systematic review and meta-analysis. Asian Pacific J Cancer Prev. 2017;18(5). doi:10.22034/APJCP.2017.18.5.1315.
» https://doi.org/10.22034/APJCP.2017.18.5.1315 -
31Mocellin S, Marincola FM, Young HA. Interleukin-10 and the immune response against cancer: a counterpoint. J Leukoc Biol. 2005;78(5):1043-1051. doi:10.1189/jlb.0705358.
» https://doi.org/10.1189/jlb.0705358 -
32Namazi A, Forat-Yazdi M, Jafari M, Farahnak S, Nasiri R, Foroughi E, et al. Association of Interleukin-10 -1082 a/G (Rs1800896) Polymorphism With Susceptibility To Gastric Cancer: Meta-Analysis of 6,101 Cases and 8,557 Controls. Arq Gastroenterol. 2018;55(1):33-40. doi:10.1590/s0004-2803.201800000-18.
» https://doi.org/10.1590/s0004-2803.201800000-18 -
33Oh SS, Chang SC, Cai L, Cordon-Cardo C, Ding BG, Greenland S, et al. Single nucleotide polymorphisms of 8 inflammation-related genes and their associations with smoking-related cancers. Int J cancer. 2010;127(9):2169-2182. doi:10.1002/ijc.25214.
» https://doi.org/10.1002/ijc.25214 -
34Pan XF, Yang SJ, Loh M, Xie Y, Wen YY, Tian Z, et al. Interleukin-10 gene promoter polymorphisms and risk of gastric cancer in a Chinese population: single nucleotide and haplotype analyses. Asian Pac J Cancer Prev. 2013;14(4):2577-2582.
-
35Qi M, Liu DM, Pan LL, Lin YX. Interleukin-10 gene -592C>A polymorphism and susceptibility to gastric cancer. Genet Mol Res. 2014;13(4):8954-8961. doi:10.4238/2014.October.31.10.
» https://doi.org/10.4238/2014.October.31.10 -
36Sahami-Fard MH, Yazd EF, Khazaei Z, Neamatzadeh H. Lack of association between the CDH1 -160C C>A polymorphism and risk of gastrointestinal cancer - A meta-analysis. Asian Pacific J Cancer Prev. 2016;17(5). doi:10.7314/APJCP.2016.17.5.2415.
» https://doi.org/10.7314/APJCP.2016.17.5.2415 -
37Savage SA, Abnet CC, Haque K, Mark SD, Qiao YL, Dong ZW, et al. Polymorphisms in interleukin -2, -6, and -10 are not associated with gastric cardia or esophageal cancer in a high-risk Chinese population. Cancer Epidemiol Biomarkers Prev. 2004;13(9):1547-1549.
-
38Shi J, Qu Y-P, Hou P. Pathogenetic mechanisms in gastric cancer. World J Gastroenterol. 2014;20(38):13804. doi:10.3748/wjg.v20.i38.13804.
» https://doi.org/10.3748/wjg.v20.i38.13804 -
39Sicinschi LA, Lopez-Carrillo L, Camargo MC, Correa P, Sierra RA, Henry RR, et al. Gastric cancer risk in a Mexican population: role of Helicobacter pylori CagA positive infection and polymorphisms in interleukin-1 and -10 genes. Int J cancer. 2006;118(3):649-657. doi:10.1002/ijc.21364.
» https://doi.org/10.1002/ijc.21364 -
40Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66(1):7-30. doi:10.3322/caac.21332.
» https://doi.org/10.3322/caac.21332 -
41Sobhan MR, Mehdinejad M, Jamaladini MH, Mazaheri M, Zare-Shehneh M, Neamatzadeh H. Association between aspartic acid repeat polymorphism of the asporin gene and risk of knee osteoarthritis: A systematic review and meta-analysis. Acta Orthop Traumatol Turc. 2017;51(5). doi:10.1016/j.aott.2017.08.001.
» https://doi.org/10.1016/j.aott.2017.08.001 -
42Su SP, Yang ZB, Tian YL, Xiang Y, Wu M, Ma X. Relationship between Polymorphisms of IL-1ß-31, IL-10-819 and TNF-a-1031 Genes and Susceptibilities to H. Pylori Infection-Associated Gastric Ulcer and Cancer. Chinese Journal of Biologicals. 2010;23(5):517-520.
-
43Sugimoto M, Furuta T, Shirai N, Nakamura A, Kajimura M, Sugimura H, et al. Effects of interleukin-10 gene polymorphism on the development of gastric cancer and peptic ulcer in Japanese subjects. J Gastroenterol Hepatol. 2007;22(9):1443-1449. doi:10.1111/j.1440-1746.2006.04613.x
» https://doi.org/10.1111/j.1440-1746.2006.04613.x -
44Tan P, Yeoh K-G. Genetics and Molecular Pathogenesis of Gastric Adenocarcinoma. Gastroenterology. 2015;149(5):1153-1162.e3. doi:10.1053/j.gastro.2015.05.059.
» https://doi.org/10.1053/j.gastro.2015.05.059 -
45Wang P, An J, Zhu Y, Wan X, Zhang H, Xi S, et al. Association of three promoter polymorphisms in interleukin-10 gene with cancer susceptibility in the Chinese population: a meta-analysis. Oncotarget. 2017;8(37):62382-62399. doi:10.18632/oncotarget.18220.
» https://doi.org/10.18632/oncotarget.18220 -
46Wu MS, Wu CY, Chen CJ, Lin MT, Shun CT, Lin JT. Interleukin-10 genotypes associate with the risk of gastric carcinoma in Taiwanese Chinese. Int J cancer. 2003;104(5):617-623. doi:10.1002/ijc.10987.
» https://doi.org/10.1002/ijc.10987 -
47Xiao H, Jiang Y, Li R, Xia B. [Association of IL-10 gene polymorphisms with gastroduodenal diseases in Hubei Han population]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 2009;26(4):423-426.
-
48Xue H, Lin B, An J, Zhu Y, Huang G. Interleukin-10-819 promoter polymorphism in association with gastric cancer risk. BMC Cancer. 2012;12(1):102. doi:10.1186/1471-2407-12-102.
» https://doi.org/10.1186/1471-2407-12-102 -
49Yazdi MM, Jamalaldini MH, Sobhan MR, Jafari M, Mazaheri M, Zare-Shehneh M, et al. Association of ESRa Gene Pvu II T>C, XbaI A>G and BtgI G>A Polymorphisms with Knee Osteoarthritis Susceptibility: A Systematic Review and Meta-Analysis Based on 22 Case-Control Studies. Arch Bone Jt Surg. 2017;5(6). doi:10.22038/abjs.2017.22391.1578.
» https://doi.org/10.22038/abjs.2017.22391.1578 -
50Yin J, Wang X, Wei J, Wang L, Shi Y, Zheng L,et al. Interleukin 12B rs3212227 T>G polymorphism was associated with an increased risk of gastric cardiac adenocarcinoma in a Chinese population. Dis esophagus Off J Int Soc Dis Esophagus. 2015;28(3):291-298. doi:10.1111/dote.12189.
» https://doi.org/10.1111/dote.12189 -
51Yuan LJ, Jin TB, Yin JK, Du XL, Wang Q, Dong R, et al. Polymorphisms of tumor-related genes IL-10, PSCA, MTRR and NOC3L are associated with the risk of gastric cancer in the Chinese Han population. Cancer Epidemiol. 2012;36(6):e366-e372. doi:10.1016/j.canep.2012.05.016.
» https://doi.org/10.1016/j.canep.2012.05.016 -
52Zabaleta J. Multifactorial Etiology of Gastric Cancer. Methods Mol Biol. 2012;863:411-35. doi: 10.1007/978-1-61779-612-8_26.
» https://doi.org/10.1007/978-1-61779-612-8_26 -
53Zambon CF, Basso D, Navaglia F, Belluco C, Falda A, Fogar P, et al. Pro- and anti-inflammatory cytokines gene polymorphisms and Helicobacter pylori infection: interactions influence outcome. Cytokine. 2005;29(4):141-152. doi:10.1016/j.cyto.2004.10.013.
» https://doi.org/10.1016/j.cyto.2004.10.013 -
54Zeng X, Li Y, Liu T, Zhang J. Diverse H. pylori strains, IL-10 promoter polymorphisms with high morbidity of gastric cancer in Hexi area of Gansu Province, China. Mol Cell Biochem. 2012;362(1-2):241-248. doi:10.1007/s11010-011-1149-y.
» https://doi.org/10.1007/s11010-011-1149-y -
55Zhuang W, Wu XT, Zhou Y, Liu L, Liu GJ, Wu TX, et al. Interleukin10 -592 promoter polymorphism associated with gastric cancer among Asians: a meta-analysis of epidemiologic studies. Dig Dis Sci. 2010;55(6):1525-1532. doi:10.1007/s10620-009-0922-1.
» https://doi.org/10.1007/s10620-009-0922-1
-
Fonte de financiamento:
não há
Datas de Publicação
-
Publicação nesta coleção
2019
Histórico
-
Recebido
21 Ago 2018 -
Aceito
11 Out 2018