Resumos
A gravidez está associada com a necessidade aumentada de secreção hormonal pela tireóide desde as primeiras semanas após a concepção. Para que esta maior demanda ocorra, a gestação induz uma série de alterações fisiológicas que afetam a função tireoidiana e, portanto, os testes de avaliação da função glandular. Para as mulheres grávidas normais que vivem em áreas suficientes em iodo, este desafio em ajustar a liberação de hormônios tireoidianos para o novo estado de equilíbrio e manter até o término da gestação, geralmente, ocorre sem dificuldades. Entretanto, em mulheres com a capacidade funcional da tireóide prejudicada por alguma doença tireoidiana ou naquelas que residem em áreas de insuficiência iódica, isso não ocorre. O manejo de disfunções tireoidianas durante a gestação requer considerações especiais, pois tanto o hipotireoidismo quanto o hipertireoidismo podem levar a complicações maternas e fetais. Além disso, nódulos tireoidianos são detectados, com certa freqüência, em gestantes, o que pode gerar a necessidade do diagnóstico diferencial entre benignos e malignos ainda durante a gestação.
Gestação; Hipotireoidismo; Hipertireoidismo; Doença nodular tireoidiana
Pregnancy is associated with an increased requirement of hormone secretion by the thyroid, within the first weeks after conception. To this greater demand to occurs, pregnancy induces a series of physiological changes that affect thyroid function and, consequently, the tests of glandular function. For normal pregnant women living in areas with a sufficient supply of iodine, this challenge regarding the adjustment of thyroid hormone releases to this new state of equilibrium and its maintenance until the end of pregnancy it meets no difficulties. However, among women with impaired thyroid function due to some thyroid disease or among women residing in areas with an insufficient iodine supply, this does not occur. The management of thyroid dysfunction during gestation requires special considerations, since both hypothyroidism and hyperthyroidism can lead to maternal and fetal complications. In addition, thyroid nodules are detected at reasonable frequency among pregnant women, a fact that requires a differential diagnosis between benign and malignant growths during the pregnancy itself.
Pregnancy; Hypothyroidism; Hyperthyroidism; Thyroid nodular disease
REVISÃO
Tireóide e gravidez
Thyroid and pregnancy
Léa Maria Zanini Maciel; Patrícia K. R. Magalhães
Divisão de Endocrinologia do Departamento de Clínica Médica da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), Ribeirão Preto,SP, Brasil
Endereço para correspondência Endereço para correspondência: Léa Maria Zanini Maciel Faculdade de Medicina de Ribeirão Preto, USP Av. Bandeirantes, 3900 14049-900 Ribeirão Preto - SP E-mail: lmzmacie@fmrp.usp.br
RESUMO
A gravidez está associada com a necessidade aumentada de secreção hormonal pela tireóide desde as primeiras semanas após a concepção. Para que esta maior demanda ocorra, a gestação induz uma série de alterações fisiológicas que afetam a função tireoidiana e, portanto, os testes de avaliação da função glandular. Para as mulheres grávidas normais que vivem em áreas suficientes em iodo, este desafio em ajustar a liberação de hormônios tireoidianos para o novo estado de equilíbrio e manter até o término da gestação, geralmente, ocorre sem dificuldades. Entretanto, em mulheres com a capacidade funcional da tireóide prejudicada por alguma doença tireoidiana ou naquelas que residem em áreas de insuficiência iódica, isso não ocorre. O manejo de disfunções tireoidianas durante a gestação requer considerações especiais, pois tanto o hipotireoidismo quanto o hipertireoidismo podem levar a complicações maternas e fetais. Além disso, nódulos tireoidianos são detectados, com certa freqüência, em gestantes, o que pode gerar a necessidade do diagnóstico diferencial entre benignos e malignos ainda durante a gestação.
Descritores: Gestação; Hipotireoidismo; Hipertireoidismo; Doença nodular tireoidiana
ABSTRACT
Pregnancy is associated with an increased requirement of hormone secretion by the thyroid, within the first weeks after conception. To this greater demand to occurs, pregnancy induces a series of physiological changes that affect thyroid function and, consequently, the tests of glandular function. For normal pregnant women living in areas with a sufficient supply of iodine, this challenge regarding the adjustment of thyroid hormone releases to this new state of equilibrium and its maintenance until the end of pregnancy it meets no difficulties. However, among women with impaired thyroid function due to some thyroid disease or among women residing in areas with an insufficient iodine supply, this does not occur. The management of thyroid dysfunction during gestation requires special considerations, since both hypothyroidism and hyperthyroidism can lead to maternal and fetal complications. In addition, thyroid nodules are detected at reasonable frequency among pregnant women, a fact that requires a differential diagnosis between benign and malignant growths during the pregnancy itself.
Keywords: Pregnancy; Hypothyroidism; Hyperthyroidism; Thyroid nodular disease
INTRODUÇÃO
Os distúrbios tireoidianos são comuns em mulheres adultas em fase reprodutiva e se devem, principalmente, à deficiência de iodo, que ainda ocorre em extensas áreas do planeta, ou a alterações imunológicas, em áreas suficientes neste elemento. As repercussões da disfunção tireoidiana na gestação são ainda maiores, tendo em vista as profundas alterações hormonais e imunológicas que ocorrem neste período, bem como a dependência dos hormônios tireoidianos e do iodo maternos evidenciada no feto.
FISIOLOGIA TIREOIDIANA MATERNA
Um conjunto de significativas alterações funcionais, que ocorre na gestação, determina modificações marcantes da função tireoidiana (1).
Precocemente, já no início da gestação, os níveis elevados de estrógeno determinam aumento das concentrações séricas da proteína transportadora de T4 (TBG), tanto por estímulo de sua síntese quanto pela produção da isoforma sializada desta proteína, que se degrada menos rapidamente no fígado (2). Em conseqüência, há aumento das concentrações séricas de T4 e T3 totais que atingem um plateau por volta de 12 a 14 semanas da gestação. Este aumento rápido e marcante da TBG (2 a 3 vezes o normal) é acompanhado por tendência à diminuição do T4 e do T3 livres e resulta estímulo do eixo hipotálamo-hipófise-tireóide (3,4). Estas alterações nas concentrações de T4 livre seguidas de aumento de TSH (hormônio estimulador da tireóide) para novo equilíbrio não são usualmente detectadas nos testes de rotina, porém, nas mulheres gestantes que vivem em áreas carentes em iodo, ficam bem evidentes (5).
No primeiro trimestre da gestação, ocorre estimulação direta da tireóide materna pelas concentrações elevadas de gonadotrofina coriônica (hCG). Este aumento, que atinge valores de pico entre a 8ª e a 14ª semana de gestação, é acompanhado por inibição do eixo hipotálamo-hipófise e, em face da reatividade cruzada com o receptor de TSH, promove aumento temporário do T4 livre (6,7). Na maioria das gestações normais, esse efeito estimulatório da hCG sobre a tireóide é de curta duração e geralmente não detectável (8). Para ser clinicamente aparente e levar à tireotoxicose gestacional, os níveis circulantes da hCG devem estar acima de 50.000 a 75.000 IU/L e se manterem elevados durante períodos mais prolongados (8).
Além disso, durante toda a gestação, ocorre modificação do metabolismo dos hormônios maternos por meio de sua desiodação pela placenta. Três enzimas catalisam a desiodação dos hormônios tireoidianos (HT) nos tecidos humanos (9,10). A atividade da desiodase tipo 1 parece não ser modificada na gestação, enquanto a do tipo 2 é expressa na placenta, porquanto sua atividade representa mecanismo homeostático para manter a produção maior de T3 local, quando as concentrações de T4 maternas são reduzidas. A placenta contém grandes quantidades de desiodases tipo 3 que convertem T4 em T3 reverso (rT3) e T3 em T2. Esta alta atividade durante a vida fetal pode explicar as concentrações baixas de T3 e altas de rT3, que são características do metabolismo dos HT fetal.
A glândula tireóide normal não demonstra qualquer dificuldade em responder a essas alterações funcionais. Entretanto, isso não ocorrerá quando a capacidade funcional da glândula estiver comprometida por doença tireoidiana ou quando a gravidez ocorrer em mulheres saudáveis, mas que residam em áreas deficientes em iodo.
DEFICIÊNCIA DE IODO E BÓCIO
A Organização Mundial da Saúde (OMS) recomenda a ingestão diária de 250 µg/dia de iodo para mulheres grávidas (150 µg/dia para não-grávidas) (11,12). Esta maior necessidade se deve ao aumento do clearance renal de iodo e à transferência do iodo para a unidade feto-placentária, o que é necessário para a produção fetal dos hormônios tireoidianos. De acordo com a OMS (13), distúrbios decorrentes da deficiência de iodo afetam 740 milhões de pessoas e 30% do restante da população mundial corre o risco de apresentar esta deficiência. A ingestão limítrofe deste elemento, cronicamente, leva à estimulação da tireóide e ao bócio que pode persistir após o parto, principalmente em mulheres que amamentam. Os neonatos destas mulheres com deficiência iódica também apresentam volumes tireoidianos maiores (2). A excreção urinária de iodo acima de 100 µg/dia é reflexo de suficiência em iodo.
FISIOLOGIA FETO-PLACENTÁRIA
A captação iódica pela glândula tireoidiana fetal se inicia por volta da 10ª a 12ª semanas de gestação e permanece baixa até a metade da gestação, quando a captação de iodo e as concentrações de T4 começam a aumentar (14).
Ao contrário do que se pensava no passado, os hormônios tireoidianos maternos atravessam a barreira placentária, antes e após o início da função tireoidiana fetal. O T4 é encontrado no fluido celômico entre a quarta e a sexta semana de gestação (15). A demonstração de que neonatos com agenesia da glândula ou defeitos completos de organificação apresentavam concentrações de T4 correspondentes a 30% dos níveis normais circulantes sugere que a transferência transplacentária continua até o nascimento (16). A identificação da presença de receptores de T3 no cérebro fetal por volta da décima semana (17) e a observação da primeira fase de rápido desenvolvimento cerebral no segundo trimestre, período no qual o suprimento de hormônios tireoidianos se faz principalmente às custas da passagem materna, sugerem que baixas concentrações maternas de T4 podem resultar em déficit neurológico irreversível na criança (18-20).
Várias drogas atravessam a barreira placentária, incluindo o iodo, as tionamidas, os bloqueadores β-adrenérgicos, o TRH (hormônio liberador de tireotrofina), a somastatina e os anticorpos, entre eles os estimuladores e os bloqueadores da tireóide. O TSH não ultrapassa a barreira placentária (21).
DISTÚRBIOS DA GLÂNDULA TIREOIDIANA NA GESTAÇÃO
Hipotireoidismo
O hipotireodismo é incomum na gestação, mas, quando presente, está associado a efeitos adversos, tanto para a gestante quanto para o feto. Esses efeitos podem ser prevenidos com a terapia adequada com levotiroxina (L-T4). Até o momento, não existe consenso para o screening universal para disfunção tireoidiana na mulher grávida ou em mulheres na fase reprodutiva (22,23). Entretanto, é recomendado reconhecer grupos de mulheres que apresentem maior risco para desenvolver o hipotireoidismo (Tabela 1), nas quais a dosagem de TSH deve ser realizada na primeira consulta de pré-natal ou no momento do diagnóstico da gravidez e, quando indicado, o apropriado início da terapia com L-T4 instituído.
Prevalência
Estudo com 2 mil mulheres americanas avaliadas entre a 15ª e a 18ª semana de gestação identificou 49 gestantes (2,5%) com TSH acima de 6 mU/L. Em seis delas, o T4 sérico estava reduzido, resultando incidência de hipotireoidismo declarado de 0,3% (24). Outros estudos têm encontrado incidências ainda menores (25).
Etiologia
Em áreas suficientes em iodo, a causa mais comum de hipotireoidismo na gestação é a doença auto-imune tireoidiana (tireoidite de Hashimoto) (24). Na maior parte dos casos remanescentes, a etiologia é secundária ao tratamento prévio de hipertireoidismo com iodo radioativo ou cirurgia para a doença de Graves ou pós-tireoidectomia por carcinoma ou bócio nodular benigno (24). Causas mais raras de hipotireoidismo, como sarcoidose, amiloidose, hemocromatose, cistinose, tireoidite de Riedel, não foram relatadas durante a gestação. Uma série de medicações que inclui o iodo, as drogas antitireoidianas, o lítio e a amiodarona, pode levar ao hipotireoidismo por interferência com a síntese, a liberação e/ou a ação periférica dos HT (26). Entre estas, a amiodarona, que, em face de sua eficácia como agente antiarrítmico, algumas vezes pode estar sendo utilizada em gestantes, poderá acarretar conseqüências, tanto para a mãe quanto para o feto (27). O hipotireodismo secundário a doenças hipofisárias e hipotalâmicas pode ocorrer; nestas situações as concentrações séricas de TSH estarão normais, baixas ou discretamente elevadas, mas as concentrações de T4 estarão baixas.
Diagnóstico
O diagnóstico clínico do hipotireoidismo na gestação é difícil de ser estabelecido, a não ser quando os sintomas e os sinais sejam muito óbvios. Os principais sintomas são cansaço e ganho de peso, apesar de apetite diminuído, o que, muitas vezes, pode ser atribuído à gestação per si. Outros sintomas incluem: queda de cabelos, constipação intestinal, intolerância ao frio (sintoma pouco usual na gestante normal). Cerca de 20% a 30% das mulheres não apresentam qualquer sintoma, apesar de testes de função tireoidiana claramente anormais (28). O bócio pode ou não estar presente. A freqüência cardíaca pode estar diminuída quando cotejada àquela esperada para a gestante normal. Na história, poderão ser identificadas irregularidades menstruais prévias à gestação, particularmente menorragia, o que se observa, com freqüência, em pacientes com hipotireoidismo leve (29).
A elevação de TSH sérico confirma o diagnóstico do hipotireoidismo primário. A distinção entre o hipotireoidismo subclínico e o declarado dependerá das concentrações de T4 livre, que estarão normais ou diminuídas para a idade gestacional, respectivamente. A determinação dos anticorpos antiperoxidase (anti-TPO) e antitireoglobulina (anti-Tg) confirma a origem auto-imune do distúrbio. Como as concentrações de T4 livre diminuem durante a gestação, recomenda-se cuidado na interpretação de seus valores e que cada laboratório estabeleça sua faixa de normalidade para cada trimestre da gestação (3,12).
Tratamento
O tratamento de escolha para o hipotireoidismo é a L-T4. A boa evolução da gravidez nas mulheres hipotireoidianas dependerá dos esforços para identificá-las e tratá-las adequadamente. Elas deverão alcançar o eutireoidismo o mais rápido possível e, idealmente, deverão estar em eutireoidismo antes da concepção, quando possível. Assim, o primeiro passo na abordagem das mulheres hipotireoidianas que querem engravidar é otimizar o seu tratamento. Estas mulheres deverão ser encorajadas a fazer o uso regular da medicação e manter as concentrações de TSH em valores de até 2,5 µUI/ml já antes da concepção (12).
Existe uma série de fatores que possivelmente contribui para o aumento das necessidades dos hormônios tireoidianos na mulher grávida. O primeiro deles é a elevação das concentrações da TBG, requerendo maior quantidade de hormônio para saturar a proteína. Coincidindo com este aumento, há também maior estímulo da tireóide pela hCG. As mulheres sem tireóide não responderão a este estímulo e muito provavelmente necessitarão de maior dosagem da T4.
No segundo e no terceiro trimestres, outros fatores estarão contribuindo para o incremento das necessidades, pois com o aumento do tamanho da placenta e a maior atividade da desiodase tipo 3, há maior inativação dos HT. Além disso, ocorrem alterações na volemia e na distribuição sangüínea.
Algumas evidências sugerem que as magnitudes destas necessidades são inversamente proporcionais à reserva tireoidiana, ou seja, dependendo da etiologia da doença tireoidiana, haverá maior ou menor necessidade dos HT. O TSH deverá ser mensurado no primeiro trimestre e os ajustes necessários devem ser realizados. Estudo de Kaplan (30), em 1992, demonstrou que as mulheres grávidas com ablação tireoidiana por 131I ou cirurgia requereram aumento da dose em cerca de 76%, enquanto as que apresentavam tireoidite de Hashimoto necessitaram de cerca de 47% de incremento.
Outros advogam aumento de 25% a 50% na mulher atireótica, quando a gravidez for detectada (12,31).
Apesar de a maioria dos autores sugerir aumento da dose de reposição com L-T4 na vigência de gestação em mulheres hipotireoidianas, Chopra e Baber (32), em 2003, mostraram que as concentrações médias de TSH durante a gestação não diferiram das observadas antes ou após a gestação, enquanto as de T4 livre, não obstante apresentarem valores menores durante a gestação, eram semelhantes àquelas das gestantes não-hipotireoidianas. Ainda, quando compararam as necessidades da droga diante da etiologia do hipotireoidismo, observaram que as mulheres tireoidectomizadas necessitaram de doses modestamente maiores (incremento de 2 a 24 µg/dia) e concluíram que, possivelmente, o aumento das doses da L-T4 observado na gestação se devia à diminuição da absorção da L-T4 pelo uso concomitante de cálcio e/ou ferro, usualmente prescritos nestas condições. Os citados autores concluíram, também, que, apesar de não se observar aumento das necessidades da tiroxina na gestação, estas mulheres deviam ser cuidadosamente monitoradas a cada dois meses, para se assegurar a manutenção do estado eutireóideo. Entretanto, Alexander e cols. (33) documentaram, recentemente, a necessidade de aumento das doses de L-T4 precocemente (já na quinta semana de gestação) e sugeriram que se faça o reajuste da dose em aproximadamente 30%, tão logo a gravidez seja confirmada.
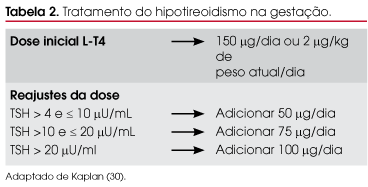
As mulheres cujo diagnóstico tiver sido estabelecido durante a gestação deverão iniciar L-T4 na dose de 150 µg/dia ou 2 µg/kg de peso atual/dia (30). As concentrações de TSH e T4 deverão ser mensuradas após quatro semanas do início do tratamento. Os testes de função tireoidiana devem ser normalizados o mais rapidamente possível, e a meta é manter as concentrações de TSH em valores menores do que 2,5 µUI/ml no primeiro trimestre da gestação ou 3 µUI/ml no segundo e no terceiro trimestre (12). Após as concentrações de TSH e T4 livre terem atingido a faixa de normalidade para a idade gestacional, as avaliações quanto à função tireoidiana deverão ser realizadas a cada 6 a 8 semanas (12). Os reajustes necessários deverão ser implementados com base nas concentrações de TSH (30) (Tabela 2). Em sua maioria, as mulheres grávidas são jovens e livres de doença cardiovascular, de modo que, quase sempre, é seguro iniciar o tratamento com a dose plena. Recomenda-se administrar a dose de L-T4 no início da manhã, em jejum. Porém, algumas mulheres, particularmente no primeiro trimestre, poderão não tolerar a medicação nesta hora; sendo assim, elas deverão ingerir a medicação posteriormente, em horário mais conveniente, quando não apresentarem náuseas ou vômitos. Muitas mulheres utilizam o sulfato ferroso e/ou cálcio durante a gestação. Essas substâncias podem formar complexos insolúveis com a tiroxina e reduzir a absorção do medicamento. Dessa forma, é importante frisar que a ingestão destas outras medicações deverá ser feita com intervalo de, no mínimo, duas horas.
Após o parto, a dosagem de L-T4 deverá ser reduzida para os níveis pré-gestacionais e o TSH ser reavaliado aproximadamente após quatro semanas (12). Deve ser ressaltado que as mulheres com evidências de auto-imunidade tireoidiana têm maior risco de desenvolver tireoidite pós-parto, síndrome que pode justificar diferenças nas necessidades de L-T4 em relação às utilizadas no período pré-gestacional. Sendo assim, é importante monitorar a função tireoidiana nestas mulheres até seis meses após o parto (12).
As pacientes com história de carcinoma tireoidiano usualmente são tratadas com doses maiores de L-T4, para manter os níveis de TSH abaixo da faixa da normalidade. Quando grávidas estas mulheres deverão manter os níveis de TSH supressos (0,1 µU/ml) sem induzir os sintomas de hipertireoidismo clínico. As concentrações de T4 livre deverão estar no limite superior, ou discretamente mais elevadas.
Implicações do hipotireoidismo na gestação
Estudos mais antigos indicavam ocorrência elevada de abortos espontâneos em mulheres grávidas hipotireoidianas (34). Investigações mais recentes, porém, sugerem melhor prognóstico destas gestações, que podem ser completadas com sucesso, mesmo em mulheres com a doença avançada (35,36). Certamente, a melhor qualidade de cuidados perinatais também beneficiou estas pacientes, incluindo monitorização fetal, diagnóstico precoce de sofrimento fetal e cuidados fetais mais efetivos.
Vários estudos mostram incidência aumentada de hipertensão gestacional em mulheres grávidas que apresentam hipotireoidismo declarado ou subclínico. Entretanto, a gravidade da hipertensão, assim como a incidência de complicações periparto, são maiores nas gestantes com hipotireoidismo declarado. O tratamento do hipotireoidismo, com normalização dos testes de função tireoidiana, diminui significativamente a incidência da hipertensão gestacional. A alta incidência de crianças com baixo peso está também relacionada à presença de hipertensão, que culmina com parto prematuro (28). No estudo de Davis e cols. (28), em pacientes com hipotireoidismo declarado, a incidência de pré-eclâmpsia foi de 44%, visto que duas mortes intra-uterinas ocorreram na 27ª e na 30ª semana de gestação por descolamento de placenta. A incidência de crianças pesando menos que 2.000 g foi de 31%.
Em estudo recente, Abalovich e cols. (37) avaliando, retrospectivamente, 150 gestações relacionadas a 114 mulheres hipotireoidianas, observaram que 34% conceberam enquanto hipotireoidianas. O tratamento adequado foi fundamental para a evolução destas gestações, pois, quando o tratamento foi inadequado, ocorreram 60% de abortos nas pacientes com hipotireoidismo declarado e 71,4% nas que apresentavam hipotireoidismo subclínico; houve maior ocorrência de parto prematuro nas mulheres com hipotireoidismo declarado (20%) em relação as que apresentavam hipotireoidismo subclínico (7,2%). Nas gestantes com tratamento adequado, a freqüência de parto a termo foi de 100% nas que apresentavam hipotireoidismo declarado, e de 90,5% nas com hipotireoidismo subclínico, sem que ocorressem abortos em ambos os grupos. Os autores concluem que a evolução das gestações não depende do tipo do hipotireoidismo, declarado ou subclínico, mas do tratamento adequado realizado.
A incidência de malformações congênitas não está aumentada nas crianças de mães hipotireoidianas (31).
Hipertireoidismo
A prevalência de hipertireoidismo na mulher grávida varia de 0,05% a 0,2% (38). O diagnóstico pode ser difícil, pois sintomas de intolerância ao calor, sudorese, cansaço, ansiedade e taquicardia são freqüentes na gravidez. Por outro lado, perda de peso ou incapacidade de ganhar peso, não obstante manter bom apetite, taquicardia (freqüência cardíaca acima de 100 bp/min), presença de bócio e sintomas gastrintestinais, como náuseas e vômitos de grande intensidade, podem sugerir o hipertireoidismo. A confirmação bioquímica é obtida com valores de TSH supressos, concentrações elevadas de T4 livre e/ou T3 livre. É importante mencionar que cerca de 15% das gestantes normais apresentam TSH suprimido ou abaixo da faixa da normalidade no primeiro trimestre da gestação (2); assim um valor subnormal de TSH neste período gestacional deve ser interpretado com cautela.
Doença de Graves
Representa 90% a 95% das etiologias de hipertireoidismo na gestação e se caracteriza pela presença de anticorpos estimuladores do receptor de TSH, cujos títulos diminuem com a evolução da gravidez. A doença se manifesta com bócio difuso, com ou sem sopro, enquanto a oftalmopatia pode estar presente ou ausente. O curso natural da doença na gestação se faz com exacerbação dos sintomas no primeiro trimestre, atribuída a estimulação da glândula pela hCG placentária (39), seguida de melhora, na segunda metade da gestação, em decorrência da imunossupressão que se manifesta, voltando a se agravar no período pós-parto (40).
Na grande maioria dos casos, quando o diagnóstico é estabelecido pela primeira vez na gestação, os sintomas de hipertireoidismo antecediam a gravidez. Casos leves, diagnosticados no primeiro trimestre, com ganho adequado de peso e em boas condições obstétricas, podem ser seguidos cuidadosamente; porém, casos de maior gravidade necessitam de tratamento com tionamidas. A meta é controlar o hipertireoidismo materno, normalizando as concentrações de T4 livre tão rapidamente quanto possível, sem causar o hipotireoidismo fetal (41).
O tratamento poderá ser realizado com tapazol ou propiltiouracil (PTU). O recente guideline de prática clínica publicado (12) recomenda o tratamento preferencial com PTU, em face da sua menor passagem pela barreira placentária, bem como em decorrência dos relatos de aplasia cútis (42) e atresia cloacal, fístula traqueoesofágica e anomalias faciais (43) com o uso de tapazol. A dose de ataque de PTU é de 100 mg (em casos mais graves 150 mg) a cada oito horas e a de tapazol, 10 a 40 mg por dia, em uma ou duas tomadas. Algumas pacientes poderão requerer doses maiores. Após o início do tratamento, seis a oito semanas, se a paciente estiver eutireoidiana, a dose é diminuída progressivamente, podendo até ser suspensa em algumas pacientes, pela melhora da doença que poderá ocorrer. Não é recomendado que se suspenda a droga antes de 32 a 34 semanas de gestação, pois poderá ocorrer recidiva do hipertireoidismo em significativo número de pacientes. Os ajustes da dose deverão ser efetuados de acordo com as concentrações do T4 livre. O cuidado a ser tomado é de utilizar a mínima dose possível da droga antitireoidiana, deixando as concentrações do T4 livre nos limites superiores da normalidade para mulheres não-grávidas (12,44).
As drogas antitireoidianas podem provocar efeitos colaterais, alguns deles sérios, como agranulocitose (0,1% dos casos), hepatite e vasculite, bem como outros, de menor gravidade, incluindo rash cutâneo, prurido, síndrome like-lupus e febre. A presença de bócio e bradicardia fetais são condizentes com o hipertratamento materno.
Os betabloqueadores ajudam a controlar os sintomas adrenérgicos. O propranolol (20 a 40 mg, 2 a 3 vezes ao dia) ou o atenolol (25 a 50 mg, diariamente) pode ser utilizado quando necessário. Entretanto, seu uso prolongado poderá acarretar diminuição do crescimento uterino, bradicardia fetal e hipoglicemia.
A terapia com iodo deve ser evitada, uma vez que ele cruza a barreira placentária e poderá causar bócio, hipotireoidismo e até asfixia fetal (45). Entretanto, na crise tireotóxica poderá ser utilizado por curto período (menos que 2 semanas, 5 a 7 gotas de iodeto de potássio, duas vezes ao dia).
A tireoidectomia subtotal é uma maneira efetiva para controlar o hipertireoidismo, porém, atualmente, é pouco utilizada sendo reservada para situações especiais, como reação adversa séria a ambas as drogas antitireoidianas e casos excepcionais de resistência às drogas antitireoidianas (12,46). Recomenda-se que a tireoidectomia seja realizada no segundo trimestre da gestação, idealmente antes da 22ª a 24ª semana de gestação.
A terapia com 131I é contra-indicada na gestação por ser substância radioativa e, se oferecida após a 10ª semana de gestação, poder ainda provocar o hipotireoidismo fetal (47,48).
Hipertireoidismo relacionado à gonadotrofina coriônica (hCG)
No primeiro trimestre, o hipertireoidismo poderá estar relacionado à hCG ou a variantes moleculares deste hormônio. O quadro de hipertireoidismo poderá manifestar-se de modo variável:
Tireotoxicose transitória gestacional
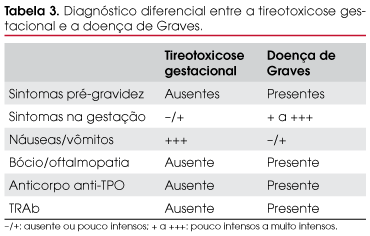
Ocorre no primeiro trimestre, entre a 8ª e a 14ª semana de gestação, com prevalência de 2,4%, documentada em um estudo prospectivo (7). A glândula tireóide não está aumentada e a paciente raramente requer tratamento, pois é de natureza transitória. As características mais importantes que permitem o diagnóstico diferencial com a doença de Graves estão na Tabela 3.
Hiperemese gravídica
Representa uma séria complicação, pois está associada à perda de peso e à desidratação grave (49). O hipertireoidismo bioquímico é encontrado na maioria das mulheres. O tratamento é realizado com medidas de suporte; entretanto, terapia com PTU pode ser instituída, se tolerada.
Doença trofoblástica gestacional
A mola hidatiforme e o coriocarcinoma podem ser associados com concentrações extremamente elevadas de hCG e o hipertireoidismo bioquímico é documentado em 50% das mulheres. O tratamento desta condição subjacente restaurará a função normal da glândula tireóide. Tionamidas e b-bloqueadores poderão ser necessários antes do tratamento cirúrgico da mola (50).
Hipertireoidismo gestacional recorrente
Casos de hipertireoidismo recorrente na gestação têm sido descritos (51). Em um destes casos foi associado a uma mutação no domínio extracelular do gene que expressa o receptor de TSH, tornando-o hipersensível a níveis normais de hCG (52).
Outras causas de hipertireoidismo
Outras causas de hipertireoidismo poderão ocorrer na gestação, incluindo o adenoma tóxico e o bócio multinodular tóxico. Nestas condições, há a presença de bócio uni ou multinodular, respectivamente, e o tratamento com drogas antitireoidianas deverá ser realizado, deixando o tratamento definitivo (iodo radioativo ou cirurgia) para o período pós-parto.
Struma ovarii é um subtipo raro de cisto dermóide e representa a massa ovariana mais comumente detectada na gestação. Ele consiste inteira ou parcialmente de tecido tireoidiano que pode produzir hormônios, levando ao hipertireoidismo (53,54).
Uma outra causa rara de hipertireoidismo é o tumor secretor de TSH, cujo diagnóstico poderá ser feito na gestação (55).
Complicações maternas e perinatais
A morbimortalidade associada ao hipertireoidismo eram elevadas no passado, quando não se dispunha das medidas terapêuticas atuais, havendo relatos de toxemia de até 70%, mortalidade perinatal de 7% e incidência de aborto espontâneo elevada (56). Entretanto, nos últimos 30 anos houve considerável redução destas taxas, o que está diretamente ligado ao controle do hipertireoidismo materno (57,58). Entre as complicações mais freqüentes está a doença hipertensiva da gravidez (Tabela 4). Momotani e Ito (59) relataram a incidência de aborto espontâneo em 25,7% e parto prematuro em 14,9% das mulheres quando hipertireoidianas já no momento da concepção.
Cuidados pós-parto
Após o parto, a terapia com drogas antitireoidianas deverá continuar e as mulheres devem ser orientadas sobre o aleitamento materno.
As mulheres que descontinuaram a terapia antitireoidiana na gravidez deverão entrar em contato com o seu médico, caso voltem a apresentar os sintomas do hipertireoidismo, que deve ser confirmado com as dosagens laboratoriais. Nas pacientes que permanecerem assintomáticas, a determinação rotineira de TSH e T4 livre deverá ser realizada seis semanas após o parto (56), e o seguimento deve ser programado em intervalos regulares, uma vez que recorrências são comuns após alguns meses do parto.
Hipertireoidismo neonatal
O hipertireoidismo neonatal não é comum, documentando-se incidência menor que 1% nas crianças nascidas de mães hipertireoidianas. É causado pela transferência pela mãe de anticorpos estimuladores da tireóide (60). Quando a mãe é tratada com drogas antitireoidianas, o feto se beneficia do tratamento materno e permanece eutireoidiano durante a gestação. Entretanto, o efeito protetor da droga é perdido após o parto, podendo, então, o hipertireoidismo clínico se desenvolver poucos dias após, podendo requerer tratamento com drogas antitireoidianas. Altos títulos de anticorpos estimuladores identificados no terceiro trimestre da gestação são preditores de hipertireoidismo neonatal (61). Preconiza-se, inclusive, a dosagem de TRAb (anticorpo anti-receptor de TSH) entre a 26ª e a 28ª semana de gestação, incluindo aquelas mulheres com história prévia de doença de Graves tratadas com iodo radioativo ou cirurgia. Naquelas com valores elevados de TRAb, deve ser realizado ultra-som fetal para avaliar a presença de bócio ou outro sinal de hipertireoidismo, como retardo de crescimento intra-uterino ou falência cardíaca (12,44).
Hipotireoidismo central neonatal
Existem diversos relatos de hipotireoidismo central em filhos de mães com doença de Graves, cujo hipertireoidismo não foi controlado na gestação (62). A explicação para essa ocorrência é a passagem de altas concentrações de T4 maternas para o feto, levando à supressão da hipófise fetal. O diagnóstico é estabelecido após o nascimento, sendo observados valores de T4 livre baixos e TSH normal, baixo ou inapropriado para os níveis de T4 livre. A função tireoidiana fetal retornará ao normal após semanas ou meses. Entretanto, é recomendado o tratamento com L-T4 e seguimento a longo prazo.
Aleitamento
O aleitamento deverá ser permitido às mulheres que necessitem de medicações antitireoidianas. Entretanto, deverão utilizar a mínima dose possível da droga; recomenda-se, no máximo, 200 mg/dia de PTU e 10 mg/dia de tapazol (56). É prudente que estas doses sejam ingeridas pela mãe logo após a amamentação. As crianças deverão ser acompanhadas com os testes de função tireoidiana.
Doença nodular tireoidiana
Nódulos tireoidianos são detectados, com certa freqüência, em mulheres durante a gravidez e isto decorre, principalmente, da maior atenção médica oferecida às mulheres grávidas, que, muitas vezes, são avaliadas por médicos pela primeira vez.
Na maioria das vezes, os nódulos são benignos e não-funcionantes (63-65). Tem sido estimado que os carcinomas papilíferos ou foliculares afetam uma em mil gestantes (66).
Como investigar os nódulos detectados na gestação?
A abordagem da doença nodular tireoidiana (DNT) não difere daquela empregada nas mulheres não-grávidas. As pacientes requerem, pelo menos, a dosagem de TSH e a realização da punção aspirativa com agulha fina (PAAF) do nódulo maior do que 1 cm (12). A realização do ultra-som é desejável por várias razões: para a caracterização do tipo de nódulo (sólido ou não, hipoecogênico ou não), para a identificação de microcalcificações (que são suspeitas para malignidade), para a detecção de outros nódulos e/ou a presença de linfonodos suspeitos, assim como para monitorar o crescimento do nódulo.
A PAAF é de fundamental importância no diagnóstico da DNT. Trata-se de procedimento seguro, simples e é recomendado que seja realizada por ocasião da detecção do nódulo (12).
Qual conduta tomar?
Citologia sugestiva de benignidade
O nódulo benigno à citologia poderá ser observado com avaliações clínicas periódicas com o objetivo de avaliar seu eventual crescimento. Caso ele apresente crescimento na gestação ou no período pós-parto, nova PAAF é recomendada. Estimativa sugere que isso poderá ocorrer em 15% dos casos (65).
Citologia sugestiva de carcinoma papilífero
Nódulos com este diagnóstico deverão ser ressecados. A decisão relativa a quando submeter estas pacientes à cirurgia é motivo de grande ansiedade, tanto para o médico quanto para a paciente (66,67). Esta ansiedade se torna ainda maior quando se consideram relatos sugerindo que a gravidez possa acelerar o curso da doença (68). O mais recomendado é a tireoidectomia ser realizada no segundo trimestre, por ser mais segura, pois quando realizada no terceiro trimestre poderá precipitar o trabalho de parto prematuro (69,70). Assim, quando o diagnóstico do nódulo é estabelecido no terceiro trimestre, a abordagem cirúrgica deverá ser postergada para o período pós-parto. Neste caso, a avaliação citológica também poderá ser adiada para depois do parto, uma vez que nenhuma conduta será tomada.
Controvérsias existem quanto a qual seria o impacto da época da realização da cirurgia na evolução dos carcinomas papilíferos. Moosa e Mazzaferri (66) compararam a evolução de 61 pacientes grávidas com carcinoma diferenciado de tireóide (87% com carcinoma papilífero) com 598 pacientes não-grávidas com idades semelhantes. Não observaram diferenças quanto à taxa de recorrência, metástases à distância ou mortalidade entre os dois grupos. A evolução foi semelhante independentemente de a cirurgia ser realizada durante a gravidez ou após, e concluíram que não havia razão para a realização da tireoidectomia durante a gestação, mesmo que o tumor fosse volumoso e estivesse associado à metástase ganglionar.
Citologia suspeita para malignidade
Os nódulos cujo diagnóstico citológico forem de neoplasia folicular ou de Hürthle representam um dilema. Aproximadamente 14% a 25% são carcinomas foliculares; os demais, adenomas foliculares ou bócios hiperplásicos. A abordagem para estes nódulos, em mulheres não-grávidas, inclui a realização da cintilografia de tireóide seguida da ressecção cirúrgica, caso o nódulo seja "frio". Entretanto, na gestante, a cintilografia com radioisótopo é absolutamente contra-indicada. Assim, a opção terapêutica envolve a ressecção cirúrgica no segundo trimestre ou a realização da investigação com radioisótopo e definição da conduta no período pós-parto. A abordagem mais apropriada é delinear individualmente a conduta para cada caso, estabelecendo-se acordo entre paciente, endocrinologista e cirurgião.
Citologia sugestiva de carcinoma medular
Pouca informação existe na literatura quanto ao carcinoma medular detectado na gestação. Entretanto, considerando-se a maior agressividade do tumor, estes nódulos deverão ser ressecados durante a gestação, preferencialmente, no 2º trimestre, antes da 22ª semana de gestação. Diante do diagnóstico de um carcinoma medular, há a necessidade de se excluir a presença de um feocromocitoma, pois este carcinoma poderá fazer parte de neoplasia endócrina múltipla tipo 2A. A pesquisa e, se presente, o tratamento cirúrgico de feocromocitoma antes da cirurgia do tumor de tireóide, são essenciais, de modo que mortes inesperadas decorrentes de complicações inerentes ao tumor adrenal sejam evitadas.
A Figura 1 representa o fluxograma diagnóstico e de seguimento dos nódulos tireoidianos detectados na gestação.
Os autores declaram não haver conflitos de interesse científico neste artigo.
Recebido em 25/3/2008
Aceito em 17/6/2008
- 1. Glinoer D. What happens to the normal thyroid during pregnancy? Thyroid. 1999;9:631-5.
- 2. Glinoer D. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocr Rev. 1997;8:404-33.
- 3. Vieira JGH, Kanashiro I, Tachibana TT, Ghiringhello MT, Hauache OM, Maciel RMB. Definição de valores normais de tiroxina livre durante a gravidez. Arq Bras Endocrinol Metab. 2004;48:305-9.
- 4. Stricker Echenard M, Eberhart R, Chevailler MC, Perez V, Quinn FA, Stricker R. Evaluation of maternal thyroid function during pregnancy: the importance of using gestational age-specific reference intervals. Eur J Endocrinol. 2007;157:509-14.
- 5. Smallridge RC, Ladenson PW. Hypothyroidism in pregnancy: consequences to neonatal health. J Clin Endocrinol Metab. 2001;6:2349-53.
- 6. Glinoer D, de Nayer P, Bourdoux P, Lemone M, Robyn C, van Steirteghem A, et al. Regulation of maternal thyroid during pregnancy. J Clin Endocrinol Metab. 1990;1:276-87.
- 7. Glinoer D, De Nayer P, Robyn C, Lejeune B, Kinthaert J, Meuris S. Serum levels of intact human chorionic gonadotropin (HCG) and its free alpha and beta subunits, in relation to maternal thyroid stimulation during normal pregnancy. J Endocrinol Invest. 1993;16:881-8.
- 8. Grun JP, Meuris S, De Nayer P, Glinoer D. The thyrotrophic role of human chorionic gonadotrophin (hCG) in the early stages of twin (versus single) pregnancies. Clin Endocrinol (Oxf). 1997;46:719-25.
- 9. Larsen PR, Silva JE, Kaplan MM. Relationships between circulating and intracellular thyroid hormones: physiological and clinical implications. Endocr Rev. 1981;2:87-102.
- 10. Bianco AC, Salvatore D, Gereben B, Berry MJ, Larsen PR. Biochemistry, cellular and molecular biology, and physiological roles of the iodothyronine selenodesiodases. Endocr Rev. 2002;23:38-89.
- 11. World Heath Organization. Technical consultation of experts in Geneva in January 2005. The prevention and control of iodine deficiency in pregnant and lactating women and in children under two years: recommendations of a WHO Technical Consultation. Public Health Nutr, in press.
- 12. Abalovich M, Amino N, Barbour LA, Cobin RH, De Groot LJ, Glinoer D, et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2007;92(8 Suppl):S1-47.
-
13World Heath Organization. Assessment of Iodine Deficiency Disorders and monitoring their elimination. 2. ed. Geneva, Switzerland: Department of Nutrition. World Health Organization; 2001.
- 14. Glinoer D, Delange F. The potential repercussions of maternal, fetal, and neonatal hypothyroxinemia on the the progeny. Thyroid. 2000;10:871-87.
- 15. Contempre B, Jauniaux E, Calvo R, Jurkovic D, Campbell S, de Escobar GM. Detection of thyroid hormones in human embryonic cavities during the first trimester of pregnancy. J Clin Endocrinol Metab. 1993;77:1719-22.
- 16. Vulsma T, Gons MH, de Vijlder JJ. Maternal-fetal transfer of thyroxine in congenital hypothyroidism due to a total organification defect or thyroid agenesis. N Engl J Med. 1989;321:13-6.
- 17. Morreale de Escobar G, Obregón MJ, Escobar del Rey F. Role of thyroid hormone during early brain development. Eur J Endocrinol. 2004;151:U25-37.
- 18. Pop VJ, Kuijpens JL, van Baar AL, Verkerk G, van Son MM, de Vijlder JJ, et al. Low maternal free thyroxine concentrations during early pregnancy are associated with impaired psychomotor development in infancy. Clin Endocrinol (Oxf). 1999;50:149-55.
- 19. Haddow JE, Palomaki GE, Allan WC, Williams JR, Knight GJ, Gagnon J, et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med. 1999;341:549-55.
- 20. Smit BJ, Kok JH, Vulsma T, Briet JM, Boer K, Wiersinga WM. Neurologic development of the newborn and young child in relation to maternal thyroid function. Acta Paediatr. 2000;89:291-5.
- 21. Roti E, Gnudi A, Braverman LE. The placental transport, synthesis and metabolism of hormones and drugs which affect thyroid function. Endocr Rev. 1983;4:131-49.
- 22. ACGO practice bulletin. Thyroid disease in pregnancy. Int J Gynaecol Obstet. 2002;79:171-80.
- 23. Surks MI, Ortiz E, Daniels GH, Sawin CT, Col NF, Cobin RH, et al. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. JAMA. 2004;292:228-38.
- 24. Klein RZ, Haddow JE, Faix JD, Brown RS, Hermos RJ, Pulkkinen A, Mitchell ML. Prevalence of thyroid deficiency in pregnant women. Clin Endocrinol (Oxf). 1991;35:41-6.
- 25. Kamijo K, Saito T, Sato M, Yachi A, Mukai A, Fukusi M, Takasugi N. Transient subclinical hypothyroidism in early pregnancy. Endocrinol Jpn. 1990;37:397-403.
- 26. Wartofsky L, Van Noostrand D, Burmam KD. Overt and 'subclinical' hypothyroidism in women. Obstet Gynecol Surv. 2006;61:535-42.
- 27. Magee LA, Downar E, Sermer M, Boulton BC, Allen LC, Koren G. Pregnancy outcome after gestational exposure to amiodarone in Canada. Am J Obstet Gynecol. 1995;172:1307-11.
- 28. Davis LE, Leveno KJ, Cunningham FG. Hypothyroidism complicating pregnancy. Obstet Gynecol. 1988;72:108-12.
- 29. Wilansky DL, Greisman B. Early hypothyroidism in patients with menorrhagia. Am J Obstet Gynecol. 1989;160:673-7.
- 30. Kaplan MM. Monitoring thyroxine treatment during pregnancy. Thyroid. 1992;2:147-52.
- 31. Brent GA. Maternal hypothyroidism: recognition and management. Thyroid. 1999;9:661-5.
- 32. Chopra IJ, Baber K. Treatment of primary hypothyrodism during pregnancy: Is there an increase in thyroxine dose requirement in pregnancy? Metabolism. 2003;52:122-8.
- 33. Alexander EK, Marqusee E, Lawrance J, Jarolim P, Fischer GA, Larsen PR. Timing and magnitude of Increases in levothyroixine requirements during pregnancy with hypothyroidism. N Engl J Med. 2004;351:241-9.
- 34. Jones WS, Man EB. Thyroid function in human pregnancy. VI. Premature deliveries and reproductive failures of pregnant women with low serum butanol-extractable iodines. Maternal serum TBG and TBPA capacities. Am J Obstet Gynecol. 1969;104:909-14.
- 35. Montoro M, Collea JV, Frasier SD, Mestman JH. Successful outcome of pregnancy in women with hypothyroidism. Ann Intern Med. 1981;94:31-4.
- 36. Balen AH, Kurtz AB. Successful outcome of pregnancy with severe hypothyroidism. Case report and literature review. Br J Obstet Gynaecol. 1990;97:536-9.
- 37. Abalovich M, Gutierrez S, Alcaraz G, Maccallini G, Garcia A, Levalle O. Overt and subclinical hypothyroidism complicating pregnancy. Thyroid. 2002;12:63-8.
- 38. Fernandez-Soto ML, Jovanovic LG, Gonzalez-Jimenez A, Lobon-Hernandez JA, Escobar-Jimenez F, Lopez-Cozar LN, et al. Thyroid function during pregnancy and the postpartum period: iodine metabolism and disease states. Endocr Pract. 1998;4:97-105.
- 39. Tamaki H, Itoh E, Kaneda T, Asahi K, Mitsuda N, Tanizawa O, Amino N. Crucial role of serum human chorionic gonadotropin for the aggravation of thyrotoxicosis in early pregnancy in Graves' disease. Thyroid 1993;3:189-93.
- 40. Watanabe M, Iwatani Y, Kaneda T, Hidaka Y, Mitsuda N, Morimoto Y, Amino N. Changes in T, B, and NK lymphocyte subsets during and after normal pregnancy. Am J Reprod Immunol. 1997;37:368-77.
- 41. Mandel SJ, Cooper DS. The use of antithyroid drugs in pregnancy and lactation. J Clin Endocrinol Metab 2001;86:2354-9.
- 42. Milham Jr S. Scalp defects in infants of mothers treated for hyperthyroidism with methimazole or carbimazole during pregnancy. Teratology. 1985;32:321.
- 43. Di Gianantonio E, Schaefer C, Mastroiacovo PP, Cournot MP, Benedicenti F, Reuvers M, et al. Adverse effects of prenatal methimazole exposure. Teratology 2001;64:262-6.
- 44. Chan GW, Mandel SJ. Therapy insight: management of Graves' disease during pregnancy. Nat Clin Pract Endocrinol Metab. 2007;3:470-8.
- 45. Galina MP, Avnet ML, Einhorn A. Iodides during pregnancy. An apparent cause of neonatal death. N Engl J Med. 1962;267:1124-7.
- 46. Bruner JP, Landon MB, Gabbe SG. Diabetes mellitus and Graves' disease in pregnancy complicated by maternal allergies to antithyroid medication. Obstet Gynecol. 1988;72(3 Pt 2):443-5.
- 47. Stoffer SS, Hamburger JI. Inadvertent 131I therapy for hyperthyroidism in the first trimester of pregnancy. J Nucl Med. 1976;17:146-9.
- 48. Evans PM, Webster J, Evans WD, Bevan JS, Scanlon MF. Radioiodine treatment in unsuspected pregnancy. Clin Endocrinol (Oxf). 1998;48:281-3.
- 49. Bashiri A, Neumann L, Maymon E, Katz M. Hyperemesis gravidarum: epidemiologic features, complications and outcome. Eur J Obstet Gynecol Reprod Biol. 1995;63:135-8.
- 50. Morgan LS. Hormonally active gynecologic tumors. Semin Surg Oncol. 1990;6:83-90.
- 51. Nader S, Mastrobattista J. Recurrent hyperthyroidism in consecutive pregnancies characterized by hyperemesis. Thyroid. 1996;6:465-6.
- 52. Rodien P, Bremont C, Sanson ML, Parma J, Van Sande J, Costagliola S, et al. Familial gestational hyperthyroidism caused by a mutant thyrotropin receptor hypersensitive to human chorionic gonadotropin. N Engl J Med. 1998;339:1823-6.
- 53. Coughlin L, Haddad NG. Struma ovarii presenting as hyperemesis gravidarum in pregnancy. J Obstet Gynaecol. 2000;20:310.
- 54. Sifakis S, Panayiotides IG, Angelakis E, Martavatzis N, Koumantakis E. Benign struma ovarii complicating pregnancy: a case report and review of the literature. Arch Gynecol Obstet. 2003;269:72-3.
- 55. Chaiamnuay S, Moster M, Katz MR, Kim YN. Successful management of a pregnant woman with a TSH secreting pituitary adenoma with surgical and medical therapy. Pituitary. 2003;6:109-13.
- 56. Mestman JH. Hyperthyroidism in pregnancy. Best Prac Res Clin Endocrinol Metab. 2004;18:267-88.
- 57. Mestman JH, Manning PR, Hodgman J. Hyperthyroidism and pregnancy. Arch Intern Med. 1974;34:434-9.
- 58. Phoojaroenchanachai M, Sriussadaporn S, Peerapatdit T, Vannasaeng S, Nitiyanant W, Boonnamsiri V, Vichayanrat A. Effect of maternal hyperthyroidism during late pregnancy on the risk of neonatal low birth weight. Clin Endocrinol (Oxf). 2001;54:365-70.
- 59. Momotani N, Ito K. Treatment of pregnant patients with Basedow's disease. Exp Clin Endocrinol. 1991;97:268-74.
- 60. McKenzie JM, Zakarija M. Fetal and neonatal hyperthyroidism and hypothyroidism due to maternal TSH receptor antibodies. Thyroid. 1992;2:155-9.
- 61. Peleg D, Cada S, Peleg A, Ben-Ami M. The relationship between maternal serum thyroid-stimulating immunoglobulin and fetal and neonatal thyrotoxicosis. Obstet Gynecol. 2002;99:1040-3.
- 62. Kempers MJ, van Tijn DA, van Trotsenburg AS, de Vijlder JJ, Wiedijk BM, Vulsma T. Central congenital hypothyroidism due to gestational hyperthyroidism: detection where prevention failed. J Clin Endocrinol Metab. 2003;88:5851-7.
- 63. Tan GH, Gharib H, Goellner JR, van Heerden JA, Bahn RS. Management of thyroid nodules in pregnancy. Arch Intern Med. 1996;156:2317-20.
- 64. Marley EF, Oertel YC. Fine-needle aspiration of thyroid lesions in 57 pregnant and postpartum women. Diagn Cytopathol. 1997;16:122-5.
- 65. Rosen IB, Korman M, Walfish PG. Thyroid nodular disease in pregnancy: current diagnosis and management. Clin Obstet Gynecol. 1997;40:81-9.
- 66. Moosa M, Mazzaferri EL. Outcome of differentiated thyroid cancer diagnosed in pregnant women. J Clin Endocrinol Metab. 1997;82:2862-6.
- 67. Hod M, Sharony R, Friedman S, Ovadia J. Pregnancy and thyroid carcinoma: a review of incidence, course, and prognosis. Obstet Gynecol Surv. 1989;44:774-9.
- 68. Kobayashi K, Tanaka Y, Ishiguro S, Mori T. Rapidly growing thyroid carcinoma during pregnancy. J Surg Oncol. 1994;55:61-4.
- 69. Doherty CM, Shindo ML, Rice DH, Montero M, Mestman JH. Management of thyroid nodules during pregnancy. Laryngoscope. 1995;105(3 Pt 1):251-5.
- 70. Tan GH, Gharib H, Goellner JR, van Heerden JA, Bahn RS. Management of thyroid nodules in pregnancy. Arch Intern Med. 1996;156:2317-20.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
03 Dez 2008 -
Data do Fascículo
Out 2008
Histórico
-
Recebido
25 Mar 2008 -
Aceito
17 Jun 2008