Resumo
The aim of this study was to evaluate the therapeutic action of flunixin meglumine and aqueous extract of Curcuma longa (10%) on local lesions caused by bothropic venom, comparing with the specific antivenom. Twelve adult dogs were inoculated in the middle third of the lateral face of the thigh with 0.3mg/kg of venom. The dogs were divided into three groups of four animals and the treatment was done two hours after venom inoculation as follows: Group I- specific antivenom diluted in saline (one dosage sufficient to neutralize the venom), Group II- flunixin meglumine (1.1mg/kg, IM, once a day for five days), Group III- topical application of aqueous extract of C. longa (10%) (three times a day for five days). Necrosis was observed in all dogs of groups I and II, and in two dogs of group III. Edema and hemorrhagic halo were observed in all dogs. Better recovery of lesions was observed in dogs of group I and III. The results denote a satisfactory effect of C. longa on treatment of local lesions caused by bothropic venom in dogs.
snake; antivenom; Bothrops alternatus; Curcuma longa; dog; flunixin meglumine
snake; antivenom; Bothrops alternatus; Curcuma longa; dog; flunixin meglumine
serpente; veneno; Bothrops alternatus; Curcuma longa; cão; flunixina meglumina
COMUNICAÇÃO
Avaliação das lesões locais de cães envenenados experimentalmente com Bothrops alternatus após diferentes tratamentos
Evaluation of local lesions in dogs experimentally envenomed by Bothrops alternatus after different treatments
M.M.B. SantosI; M.M. MeloI; D.O. JacomeI; K.M. FerreiraI; G.G. HabermehlII
IDepartamento de Clínica e Cirurgia Veterinárias Escola de Veterináriada da UFMG Caixa Postal 567 30123-970 - Belo Horizonte, MG
IIChemisches Institut, Tierärztliche Hochschule, Hannover, Germany
Palavras-chave: serpente, veneno, Bothrops alternatus, Curcuma longa, cão, flunixina meglumina
ABSTRACT
The aim of this study was to evaluate the therapeutic action of flunixin meglumine and aqueous extract of Curcuma longa (10%) on local lesions caused by bothropic venom, comparing with the specific antivenom. Twelve adult dogs were inoculated in the middle third of the lateral face of the thigh with 0.3mg/kg of venom. The dogs were divided into three groups of four animals and the treatment was done two hours after venom inoculation as follows: Group I- specific antivenom diluted in saline (one dosage sufficient to neutralize the venom), Group II- flunixin meglumine (1.1mg/kg, IM, once a day for five days), Group III- topical application of aqueous extract of C. longa (10%) (three times a day for five days). Necrosis was observed in all dogs of groups I and II, and in two dogs of group III. Edema and hemorrhagic halo were observed in all dogs. Better recovery of lesions was observed in dogs of group I and III. The results denote a satisfactory effect of C. longa on treatment of local lesions caused by bothropic venom in dogs.
Keywords: snake, antivenom, Bothrops alternatus, Curcuma longa, dog, flunixin meglumine
As serpentes do gênero Bothrops são responsáveis por 90% dos acidentes por serpentes na América do Sul. O veneno botrópico possui ações proteolítica, coagulante e hemorrágica, sendo os distúrbios hemostáticos e os sinais locais como edema, hemorragia e necrose as principais manifestações clínicas observadas (Maruyama et al., 1990; Sanchez et al., 1992). O processo inflamatório causado pelas frações proteolíticas do veneno caracteriza-se clinicamente por edema e dor na região da picada. A necrose, manifestação local mais importante, limita-se ao subcutâneo, mas pode comprometer estruturas mais profundas, como tendões, músculos e ossos, podendo causar distrofias e deixar seqüelas (Lomonte et al., 1990; Selistre et al, 1990). O único tratamento disponível para o acidente por Bothrops consiste na administração do soro específico. No entanto, tem-se demonstrado que os efeitos locais provocados por esses venenos são apenas parcialmente neutralizados pelo soro específico (Wen, 2000), sendo necessária a busca de alternativas terapêuticas que minimizem os efeitos locais da ação do veneno.
A flunixina meglumina é um antiinflamatório não esteroide, derivada do ácido nicotínico, utilizada na veterinária pelas suas propriedades analgésica, antiinflamatória e antipirética (Howe, 1998), sendo também indicada como medicação opcional para o tratamento do envenenamento botrópico em bovinos (Novaes et al., 1997). O mecanismo de ação da flunixina meglumina consiste na prevenção da síntese de prostaglandinas por inibição da ciclooxigenase durante o período de irritação ou lesão celular, tendo como conseqüência a inibição dos eicosanoides envolvidos na inflamação (Lees et al., 1991; Moraillon, 1992; Isaacs, 1996).
Muitas espécies de plantas têm demonstrado possuir substâncias que protegem o homem e os animais contra venenos de serpentes (Mors et al., 2000). A Curcuma longa é uma planta medicinal da Ásia, popularmente conhecida como açafrão, e seus extratos tem demonstrado propriedades antiinflamatória e anti-veneno em modelos animais (Ammon et al., 1992; Ferreira et al., 1992).
Devido à escassez de estudos clínicos para avaliar a eficácia de distintos fármacos na redução dos danos ocasionados pelo envenenamento botrópico este trabalho tem por objetivo comparar a eficácia da flunixina meglumina, do extrato aquoso de C. longa (10%) e do soro antibotrópico em reverter as alterações locais em cães, provocadas pelo veneno de Bothrops alternatus (urutu-cruzeiro).
Foram utilizados 12 cães adultos, sadios, sem raça definida, com peso médio 17,62±4,94kg. O veneno liofilizado da serpente Bothrops alternatus foi diluído na proporção de 3mg em 1,0ml de solução fisiológica de cloreto de sódio 0,9% e administrado na dose de 0,3mg/kg PV (Santos et al., 2000), via intramuscular na face caudal da coxa esquerda, com agulha hipodérmica 25×7.
Rizomas de Curcuma longa (32,7g) foram triturados e extraídos com 327ml de água destilada por 24 horas. Após esse período, a solução foi filtrada em papel de filtro e armazenada em frasco de vidro para posterior utilização no tratamento tópico.
Foram constituídos três grupos (G) experimentais, com quatro animais cada, de acordo com o tratamento instituído: GI- animais tratados com soro-antibotrópico (Soro antibotrópico - Fundação Ezequiel Dias (FUNED), Belo Horizonte (MG), Brasil) diluído em solução fisiológica 0,9%, na dose de 1ml para cada 5mg de veneno inoculado (dose correspondente a capacidade mínima de neutralização do soro antibotrópico utilizado), via intravenosa; GII- animais tratados com flunixina meglumina (Banamine - Shering Plough, Indústria Brasileira) na dose de 1,1 mg/kg de 24/24 horas por cinco dias, via intramuscular (Moraillon, 1992; Kelly e Benitiz, 1994); GIII- animais tratados com extrato aquoso de C. longa a 10%, tópico no local da injeção do veneno, três vezes ao dia por cinco dias (Melo et al., 2000b).
Os tratamentos foram iniciados duas horas após a inoculação do veneno. A pele foi dimensionada antes da inoculação do veneno botrópico (T0) e a avaliação das lesões locais (halo hemorrágico, edema e necrose) foi realizada após a inoculação nos seguintes tempos: duas horas após a inoculação (antes do início do tratamento) (T1), seis horas (T2), 24 horas (T3), 48 horas (T4), três dias (T5), quatro dias (T6), cinco dias (T7), seis dias (T8), sete dias (T9), oito dias (T10), nove dias (T11), dez dias (T12), onze dias (T13), doze dias (T14), treze dias (T15) e quatorze dias (T16).
O grau de edema foi avaliado realizando medições com paquímetro. O halo hemorrágico e a necrose medindo-se o diâmetro em centímetros com régua com gabaritos circulares, sendo que o halo hemorrágico foi dimensionado também na sua forma. Os resultados do halo hemorrágico e necrose foram tratados pelo método Kruskal-Wallis, e os obtidos do edema foram delineados em parcelas subdivididas. As médias foram comparadas utilizando-se o teste t de Student com índice de significância de 5% (Sampaio, 1998).
Em todos os animais observou-se formação do halo hemorrágico seis horas após a inoculação (T2) do veneno botrópico. Vinte e quatro horas após a inoculação o halo apresentou-se difuso e permaneceu assim até o sétimo dia, quando se iniciou a regressão dos sinais. A equimose no local da inoculação do veneno ocorreu devido ao sangramento subcutâneo, sendo observado em grande extensão da face interna da coxa. Hemorragias sistêmicas e locais são complicações comumente encontradas por venenos de Bothrops, os quais possuem toxinas procoagulantes. A ação das hemorraginas (metaloproteinases) sobre a parede dos vasos contribuem potencialmente para essas hemorragias (Kamiguti et al., 1996). No oitavo dia, somente o GIII (Curcuma longa) apresentou regressão total do halo hemorrágico e no 11º dia (T13), todos os outros animais (GI e GII) mostravam ausência de halo hemorrágico no local de inoculação do veneno. Somente houve diferença significativa (P<0,05) entre tempos dentro de cada grupo, mas não houve diferença (P>0,05) entre os grupos quanto ao desenvolvimento do halo hemorrágico (Tab.1). Apesar de não ter ocorrido diferença significativa entre os grupos, o tratado com extrato aquoso de Curcuma longa apresentou regressão total do halo hemorrágico dois dias antes dos outros grupos, concordando com Ferreira et al. (1992).
Tabela 1 - Clique para ampliar
Imediatamente após a inoculação do veneno, observou-se edema do membro inoculado em todos os animais. Conforme demonstrado na Tab.2, houve diferença significativa (P<0,05) entre os tempos em todos os grupos, ocorrendo a regressão do edema a partir de T8 (seis dias após a inoculação), porém não houve diferença entre grupos (P>0,05) quanto à recuperação do edema.
Tabela 2 - Clique para ampliar
A atividade edematogênica dos venenos botrópicos é amplamente evidente nos modelos experimentais e a maioria desses componentes desencadeia um processo inflamatório de maneira indireta, induzindo a liberação de autacóides no organismo. Vários mediadores parecem estar envolvidos, incluindo fator de necrose tumoral, histamina, bradicinina, prostaglandinas, leucotrienos e eicosanóides derivados do ácido araquidônico. A origem multifatorial do edema no envenenamento e a complexidade dos mecanismos que participam desse efeito representam um obstáculo importante para uma abordagem terapêutica adequada como descrito por Gutiérrez e Lomonte (1989). As prostaglandinas são mediadores do processo inflamatório e a inibição de sua síntese ou ação diminui a dor e o edema associados com a injúria, porém, somente esta ação exercida pela flunixina meglumina e pelo extrato aquoso de C. longa (10%) não foi suficiente para o controle do edema provocado pelo veneno de B. alternatus em cães. Assim como a administração do soro antibotrópico duas horas após o envenenamento, também não foi eficaz para o controle do edema conforme descrito por Wen (2000).
As ações anticoagulante e hemorrágica também influenciam na evolução da atividade inflamatória. A ação anticoagulante, ao formar trombos na microvasculatura, provoca conseqüente hipóxia com agravamento do edema e necrose tecidual. A ação hemorrágica amplia o quadro inflamatório por lesão no endotélio vascular que propicia o extravasamento de líquidos para o espaço intersticial.
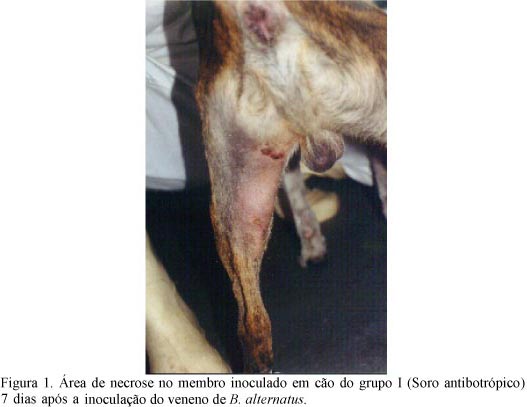
Todos os animais dos grupos I e II (Fig.1 e 2 ) e dois do grupo III (Fig.3) apresentaram necrose cutânea no local de inoculação do veneno. Houve diferença (P<0,05) entre os grupos I e III em relação ao grupo II quanto ao desenvolvimento da necrose (Tab.3). Melhor recuperação das lesões foi observada nos grupos I e III. O grupo III mostrou-se (P<0,05) diferente do grupo II a partir de 24 horas após a inoculação (T3) até o 14º dia (T16). Os grupos I e III mostraram-se (P<0,05) diferentes do grupo II do sexto dia após a inoculação (T8) até o 14ºdia (T16) (Tab.3).
Tabela 3 - Clique para ampliar
A necrose tecidual decorre da atividade proteolítica do veneno e da isquemia conseqüente às alterações circulatórias descritas anteriormente. Para que algum tratamento interfira neste quadro, é necessário que ele interaja com as propriedades bioquímicas do veneno.
O efeito satisfatório do extrato aquoso de C. longa (10%) sobre a necrose ocasionada pelo veneno de B. alternatus pôde ser comprovado neste trabalho, demonstrando que essa planta possui substâncias antiiflamatórias e neutralizadoras das toxinas presentes no veneno. Resultados semelhantes com o uso da C. longa para o tratamento das lesões locais ocasionadas pelos venenos botrópicos foram também constatados por Ferreira et al. (1992), Melo et al. (2000, ab) e Mors et al. (2000).
O mecanismo de ação antiinflamatória da C. longa ainda não foi completamente esclarecido, embora sugira-se que ele possa ocorrer por inibição da formação dos leucotrienos em neutrófilos polimorfonucleares (Ammon et al., 1992), sensibilização tecidual para os hormônios do córtex adrenal (Srimal, Dhawan, 1972), inibição da produção de ácido araquidônico, modulação da atividade da ciclooxigenase e lipooxigenase, inibição de quinases, varredura de radicais livres (Grinberg et al., 1996; South et al., 1997; Mors et al., 2000) e por modulação do sistema imune (South et al.,1997).
Os resultados permitem concluir que o extrato aquoso de C. longa (10%) pode ser utilizado como tratamento complementar local no envenenamento botrópico por ter apresentado efeito satisfatório sobre a necrose. O antiiflamatório flunixina meglumina não deve ser indicado para o tratamento de cães envenenados pela serpente B. alternatus pois não só impediu a formação de necrose local como retardou sua recuperação.
Recebido para publicação em 3 de abril de 2002
Recebido para publicação, após modificações, em 6 de agosto de 2003
E-mail: manubarbosa@hotmail.com.br
- AMMON, H.P.T.; ANAZODO, M.I.; SAFAYHI, H. et al. Curcumin: a potent inhibitor of leukotriene B4 formation in rat peritoneal polymorphonuclear neutrophils (PMNL). Planta Med, v.58, p.226, 1992.
- CHACUR, M.; PICOLO, G.; GUTIERREZ, J.M. et al. Capacidade do antiveneno botrópico em neutralizar a hiperalgesia induzida pelos venenos de Bothrops asper In: SIMPÓSIO DA SOCIEDADE BRASILEIRA DE TOXINOLOGIA, 6, 2000, São Pedro. Anais..São Pedro: Cruzeiro, 2000. p.270.
- FERREIRA, L.A.F.; HENRIQUES, O.B.; ANDREONI, A.A.S. et al. Antivenom and biological efects of ar-turmerone isolated from Curcuma longa (Zingiberaceae). Toxicon, v.30, p.1211-1218, 1992.
- GRINBERG, L.N.; SHALEV, O.; TONNESEN, H.H. et al. Studies on curcumin and curcuminoids: XXVI. Antioxidant effects of curcumin on the red blood cell membrane. Int. J. Pharmacol, v.132, p.251-257, 1996.
- GUTIÉRREZ, J.M.; LOMONTE, B. Local tissue damage induced by Bothrops snake venoms. A review. Mem. Inst. Butantan, v.51, p.211-223, 1989.
- HOWE, L.M. Treatment of endotoxic shock: glucocorticoids, lazaroids, nonsteroidals, others. Vet. Clin. North Am.: Small Anim. Pract, v.28, p.249-265, 1998.
- ISAACS, J.P. Adverse effects of non-steroidal anti-inflammatory drugs in the dog and cat. Aust. Vet. Practit., v.26, p.180-187, 1996.
- KAMIGUTI, A.S. HAY, C.R.M., THEAKSTON, R.D.G. et al. Review article. Insights into the mechanism of haemorrhage caused by snake venom metalloproteinases. Toxicon, v.34, p.327-642, 1996.
- LEES, P.; MAY, S.A.; McKELLAR, Q.A. Pharmacology and therapeutics of non-steroidal anti-inflammatory drugs in the dog and cat: 1 General pharmacology. J. Small Anim. Pract., v.32, p.183-193, 1991.
- LOMONTE, B.; GUTIÉRREZ, J.M.; FURTADO, M.F. et al. Isolation of basic myotoxins from Bothrops moojeni and Bothrops atrox snake venoms. Toxicon, v.28, p.1137-1146, 1990.
- MARUYAMA, M.; KAMIGUTI, A.S.; CARDOSO, J.L.C. et al. Studies on blood coagulation and fibrinolysis in patients bitten by Bothrops jararaca (Jararaca). Thromb. Haemost., v.63, p.449-453, 1990.
- MELO, M.M.; HABERMEHL, G.G.; OLIVEIRA, N.J.F. Drugs against snake bite. In: SIMPÓSIO DA SOCIEDADE BRASILEIRA DE TOXINOLOGIA, 6, 2000, São Paulo. Resumos..São Paulo: Cruzeiro, 2000. p.130a.
- MELO, M.M.; HABERMEHL, G.G.; OLIVEIRA, N.J.F. et al. Extracts plants against Bothrops alternatus bite. In: WORLD CONGRESS ON ANIMAL PLANT AND MICROBIAL TOXINS, 13, 2000. Anais..Paris: 2000. p.239b.
- MORAILLON, R. Emprego de antiinflamatórios não-esteróides em pequenos animais. Hora Vet., n.69, p.42-47, 1992.
- MORS, W.B.; NASCIMENTO, M.C.; PEREIRA, B.M.R. et al. Plant natural products active against snake bite - the molecular approach. Phytochemistry, n.55, p.627-642, 2000.
- NOVAES, A.P.; LUCAS, S.; ABE, A.S. et al. Envenenamento botrópico em bovinos: tratamento opcional. Vet News, n.30, p.9-12, 1997.
- SAMPAIO, I.B.M. Estatística aplicada à experimentação animal Belo Horizonte: Fundação de Ensino e Pesquisa em Medicina Veterinária e Zootecnia, 1998. 221p.
- SANCHEZ, E.F.; FREITAS, T.V.; FERREIRA-ALVES, D.L. et al. Biological activities of venoms from south american snakes. Toxicon, v.30, p.95-103, 1992.
- SANTOS, E.P.; RESENDE, E.S.; SILVEIRA, P.V.P. et al. Efeitos do soro antibotrópico nas alterações hemodinâmicas induzidas em cães pelo veneno de Bothrops moojeni Acta Cir. Bras, v.15, p.1-13, 2000.
- SELISTRE, H.S.; QUEIROZ, L.S.; CUNHA, A.B. et al. Isolation and characterization of hemorrhagic, myonecrotic and edema-inducing toxins from Bothrops insularis (Jararaca Ilhoa) snake venom. Toxicon, v.28, p.261-273, 1990.
- SOUTH, E.H.; EXON, J.H.; HENDRIX, K. Dietary curcumin enhances antibody response in rats. Immunopharmacol. Immunotoxicol, v.19, p.105-119, 1997.
- SRIMAL, R.C; DHAWAN, B.N. Pharmacology of diferuloyl methane (curcumin), a non-steroidal anti-inflammatory agent. J. Pharm. Pharmac, v.25, p.447-452, 1972.
- WEN, F.R. Ineficácia do antiveneno na reversão do edema e necrose em pacientes picados por serpentes do gênero Bothrops In: SIMPÓSIO DA SOCIEDADE BRASILEIRA DE TOXINOLOGIA, 6, 2000, São Pedro. Anais..São Pedro: Cruzeiro, 2000. p.78-81.
Datas de Publicação
-
Publicação nesta coleção
13 Jan 2004 -
Data do Fascículo
Out 2003
Histórico
-
Revisado
06 Ago 2003 -
Recebido
03 Abr 2002