Resumos
Nos últimos anos temos atendido vítimas de trauma com ferimento transfixante dos rins direito e esquerdo. Em trabalho anterior utilizamos colágeno tipo I em ferimentos transfixantes do fígado, com bons resultados. Assim, extendemos a utilização do método para o rim aplicando o colágeno tipo I produzido na UNICAMP, o qual pode ser injetado e moldado ocupando toda a área lesada e o trajeto anfractuoso ou irregular. Desta forma pode-se conseguir um tamponamento completo, coibindo a hemorragia e sustando a perda de urina. O colágeno será posteriormente reabsorvido não funcionando como corpo estranho. Trinta e seis cães foram submetidos a lesão transfixante na região inferior do rim esquerdo, procurando simular uma lesão produzida por um projétil de arma de fogo. Seis destes animais não receberam tratamento e foram a óbito por choque hemorrágico. Em todos os outros 30 animais, aplicou-se o colágeno tipo I em toda a extensão do túnel formado pela lesão, através da injeção do material. Foram realizadas avaliações clínicas no pós-operatório, sendo os cães sacrificados, em grupos de seis, aos 4, 7,15, 30 e 60 dias de pós-operatório O estudo macroscópico e microscópico, revelou uma formação cicatricial homogênea, com regeneração renal intensa, precoce e organizada, a partir do 7º dia de pós-operatório. Conclui-se que a aplicação do colágeno tipo I, nestes tipos de ferimentos são de aplicação simples e segura.
Trauma; Colágeno; Regeneração
Over the past years we have used of the type I collagen to tamponade transfixing hepatic lesions in dogs, manufactured at University of Campinas. We have considered the use of this collagen to tamponed transfixing renal lesions, wich can be molded to the entire wounded area thus tamponading all surface irregularities. In this way, a complete tamponade way be achieved, and urinary loss is prevented. Thirty six mongrel dogs received a perforating transfixing lesion in the distal region of the kidney, similar to that caused by a firearm bullet. Into the wounded tunnel type I collagen was introduced. Evaluations were made in the 4th , 7th, 15th, 30th and 60th day after the intervention, when animals were sacrificed. Microscope evaluation induced a homogeneous scar formation with early, organized renal regeneration evident from the 7th day onward. It is therefore believed that the use of type I collagen is an effective and safe method to be used in this type of renal wound.
Trauma; Collagen; Regeneration
Tamponamento das lesões renais transfixantes com colágeno tipo I1 1 . Trabalho realizado no Laboratório de Investigação de Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia do Trauma do Depto de Cirurgia e no Laboratório da DCT/NMCE, FCM/UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma da UNICAMP 3 . Professor Titular do Departamento de Biologia Celular do Instituto de Biologia da UNICAMP. 4 . Ex- Médico Assistente da Disciplina de Cirurgia do Trauma da UNICAMP.
Mario Mantovani2 1 . Trabalho realizado no Laboratório de Investigação de Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia do Trauma do Depto de Cirurgia e no Laboratório da DCT/NMCE, FCM/UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma da UNICAMP 3 . Professor Titular do Departamento de Biologia Celular do Instituto de Biologia da UNICAMP. 4 . Ex- Médico Assistente da Disciplina de Cirurgia do Trauma da UNICAMP.
Benedicto Campos Vidal3 1 . Trabalho realizado no Laboratório de Investigação de Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia do Trauma do Depto de Cirurgia e no Laboratório da DCT/NMCE, FCM/UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma da UNICAMP 3 . Professor Titular do Departamento de Biologia Celular do Instituto de Biologia da UNICAMP. 4 . Ex- Médico Assistente da Disciplina de Cirurgia do Trauma da UNICAMP.
Admar Concon Filho4 1 . Trabalho realizado no Laboratório de Investigação de Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia do Trauma do Depto de Cirurgia e no Laboratório da DCT/NMCE, FCM/UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma da UNICAMP 3 . Professor Titular do Departamento de Biologia Celular do Instituto de Biologia da UNICAMP. 4 . Ex- Médico Assistente da Disciplina de Cirurgia do Trauma da UNICAMP.
Mantovani M, Vidal BC, Concon Filho A. Tamponamento das lesões renais transfixantes com colágeno tipo I. Acta Cir Bras [serial online] 1999 Oct-Dec;14(4). Available from: URL: http://www.scielo.br/acb.
RESUMO: Nos últimos anos temos atendido vítimas de trauma com ferimento transfixante dos rins direito e esquerdo. Em trabalho anterior utilizamos colágeno tipo I em ferimentos transfixantes do fígado, com bons resultados. Assim, extendemos a utilização do método para o rim aplicando o colágeno tipo I produzido na UNICAMP, o qual pode ser injetado e moldado ocupando toda a área lesada e o trajeto anfractuoso ou irregular. Desta forma pode-se conseguir um tamponamento completo, coibindo a hemorragia e sustando a perda de urina. O colágeno será posteriormente reabsorvido não funcionando como corpo estranho. Trinta e seis cães foram submetidos a lesão transfixante na região inferior do rim esquerdo, procurando simular uma lesão produzida por um projétil de arma de fogo. Seis destes animais não receberam tratamento e foram a óbito por choque hemorrágico. Em todos os outros 30 animais, aplicou-se o colágeno tipo I em toda a extensão do túnel formado pela lesão, através da injeção do material. Foram realizadas avaliações clínicas no pós-operatório, sendo os cães sacrificados, em grupos de seis, aos 4, 7,15, 30 e 60 dias de pós-operatório O estudo macroscópico e microscópico, revelou uma formação cicatricial homogênea, com regeneração renal intensa, precoce e organizada, a partir do 7º dia de pós-operatório. Conclui-se que a aplicação do colágeno tipo I, nestes tipos de ferimentos são de aplicação simples e segura.
DESCRITORES: Trauma. Colágeno. Regeneração.
INTRODUÇÃO
O tratamento das lesões traumáticas transfixantes do rim acompanhadas de grandes hemorragias costuma ser tecnicamente difícil podendo ocorrer perda do órgão ou óbito dos pacientes por exsanguinação pós-operatória. A adoção de técnicas convencionais de tamponamento ou ressecção costuma levar a índices elevados de complicações pós-operatórias.
Recentemente, surgiram técnicas de aplicação da cola biológica como solução ideal na obtenção de hemostasia no ferimento hepático (2) demonstrando que ela é útil por promover hemostasia adequada e não alterando o processo da cicatrização. Outras pesquisas foram realizadas com a utilização do colágeno I liofilizado em várias situações biológicas (6) em particular no estudo de regeneração do tecido muscular após trauma da parede abdominal (3) e na regeneração hepática após tamponamento de lesões transfixantes com o colágeno(4).
No entanto, nenhum trabalho experimental com a utilização de colágeno, foi realizado em ferimentos profundos transfixantes do rim, cujas vantagens em termos de relação extensão da lesão / quantidade de material, como também propriedades biomecânicas, podem fazê-lo um procedimento mais adequado.
Isto posto, pesquisamos um modelo experimental para ser moldado no sentido de obter um tamponamento de qualquer ferimento transfixante renal, capaz de promover hemostasia imediata e impedimento do extravazamento urinário. Deste modo, o colágeno injetado sob pressão, seria moldado em toda a área lesada, tamponando os pontos irregulares da lesão transfixante.
Assim seria possível estudar a fase aguda do procedimento, suas possíveis complicações, a reabsorção e regeneração do tecido renal nestes pontos de aplicação do colágeno, que não vai se portar como corpo estranho. Ainda, na fase tardia, seria possível analisar a adesão, a diferenciação, a morfogênese, a remodelação e o reparo, como resposta celular à aplicação renal do colágeno tipo I.
Interessados em melhor conhecer as aplicações do método quanto à sua facilidade de aplicação, efetividade e segurança nestes tipos de ferimentos renais, elaboramos este trabalho em cães.
MÉTODO
Foram utilizados 36 cães mestiços, sem raça definida, aparentemente sadios, com peso variando de 8 a 12 kg operados no Núcleo de Medicina e Cirurgia Experimental da Faculdade de Ciências Médicas da UNICAMP, segundo as normas do COBEA, 1991(1).
O pré-operatório constitui-se de jejum durante um período de 12 horas. Os animais, uma hora antes do ato cirúrgico, foram medicados com xylamina (Rompum), na dose de 1 ml sub-cutâneo. Após 30 a 40 minutos, foi dissecada uma veia periférica do membro inferior direito para infusão de líquidos.
Os animais foram submetidos à anestesia geral com o barbitúrico tiopental sódico (Thionembutal), na dose de 30 mg/kg de peso, intravenoso e mantidos com respiração espontânea. Todos os animais receberam durante o ato cirúrgico, manutenção anestésica com doses suplementares de Thionembutal. Ainda, durante o ato cirúrgico, era infundido cerca 250 ml de soro fisiológico intravenoso.
a) PLANEJAMENTO
Os cães foram submetidos à laparotomia através de incisão mediana, segundo sorteio em relação ao grupo de estudo. Os animais foram divididos em 6 grupos:
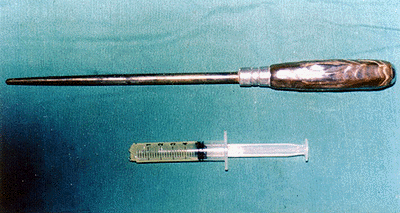
Grupo 1 : 6 cães, produzindo-se lesão traumática transfixante no polo inferior do rim esquerdo, através de um empalador, evoluindo com hemorragia, sem tratamento oclusivo; deste modo produziu-se uma lesão pérfuro-contundente, estabelecendo-se um orifício de entrada e um outro de saída, à semelhança do obtido por ferimento de arma de fogo, como um túnel (FIGURAS 1 e 2).
: Detalhe do empalador utilizado (acima) e seringa contendo o colágeno pronto para aplicação na lesão transfixante (abaixo).
Empalador produzindo lesão traumática transfixante no polo inferior do rim esquerdo de cão.
Grupo 2: 6 cães, após a perfuração, aplicação de colágeno, sendo sacrificados 4 dias após para estudo. O colágeno altamente polimerizado, cristalino, em fragmentos de tamanhos variáveis foi injetado por seringa sob pressão), moldando internamente todo o trajeto lesado e sustando a hemorragia (FIGURA 3)
: Injeção do colágeno por seringa, sob pressão, moldando todo o trajeto interno do ferimento transfixante. Note-se o grau de hemorragia local, nesta situação inicial da injeção.
Grupo 3 : 6 cães, como no grupo 2, com sacrifício no 7º dia de pós-operatório;
Grupo 4: 6 cães, como o grupo 2, com sacrifício no 15º dia de pós-operatório;
Grupo 5: 6 cães, como no grupo 2, com sacrifício no 30º dia de pós-operatório;
Grupo 6: 6 cães, como no grupo2, com sacrifício no 60º dia de pós-operatório.
b) PÓS-OPERATÓRIO
Todos os animais foram mantidos em observação constante, sendo retirada a venossecção quando já apresentavam reflexos e estavam totalmente acordados. No período de observação, receberam mais 250 ml de soro fisiológico. A alimentação era inciada 6 horas após, usando a dieta padrão do canil. Os animais foram inspecionados no primeiro dia de 4 em 4 horas; no segundo dia de 6 em 6 horas e, posteriormente, duas vezes ao dia, por um período de uma semana. Daí para frente, eram observados 1 vez ao dia.
Observou-se no pós-operatório imediato: hemorragia, estado geral e óbito. No pós-operatório tardio: supuração da ferida operatória e outras complicações (peritonite, pneumonias, etc.)
c) SACRIFÍCIO DOS ANIMAIS
O sacrifício dos animais ocorreu após a anestesia com Thionembutal, semelhante ao início do experimento. Realizou-se nova laparotomia com exploração da cavidade abdominal, observando-se aderências intestinais e possíveis coleções nos espaços sub-frênicos e entre as alças intestinais. Retirado o rim para estudo no local da aplicação do colágeno. Após este procedimento, os animais eram sacrificados com injeção de éter etilico, por via intra-venosa.
d) ESTUDO DO MATERIAL Á MICROSCOPIA ÓPTICA
A peças foram fixadas em solução de formaldeído a 10%, incluídas em parafina e os cortes, em cinco micras de espessura, foram corados pela hematoxilina-eosina. O exame histológico teve a finalidade de avaliar, comparativamente, a evolução do processo de reparação nos grupos de animais no 4º, 7º, 15º, 30º e 60º dias de pós-operatório.
Foram classificadas as características de coaptação das bordas do tecido colágeno ao tecido renal, bem como a evolução cicatricial ocorrida no próprio tecido colágeno, variando desde tecido inflamatório até uma substituição por tecido conjuntivo denso e posterior regeneração renal.
RESULTADOS
a) TEMPO DE SANGRAMENTO APÓS TRAUMA
O tempo de sangramento dos animais do grupo 1 foi maior do que 20 minutos, quando então foi fechada a laparotomia e os animais passaram a ser observados no pós-operatório.
Nos demais grupos, o sangramento cessou de imediato, após a aplicação do colágeno em toda a extensão do ferimento transfixante renal.
b) ÓBITO NO PÓS-OPERATÓRIO
Em todos os cães do grupo 1 ocorreu óbito, por hemoperitônio, variando o tempo de 8 a 26 horas.
Nos outros grupos, não ocorreram óbitos e todos foram sacrificados conforme a programação prévia.
c) RESULTADOS À MACROSCOPIA
Todos os cães do grupo 1 morreram entre 8 e 26 horas após o ato cirúrgico. Encontrou-se grande quantidade de sangue livre na cavidade abdominal.
Nos demais cães, observou-se pequeno bloqueio de alças do intestino delgado e epíploon no local da aplicação do colágeno, que se desfaziam facilmente à dissecção.
No 4º e 7º dias, notava-se facilmente o local da aplicação do colágeno (FIGURA 4).
: Peça anatômica (rim esquerdo), onde se nota o local da injeção do colágeno, aos 7 dias de evolução pós-operatória.
O fragmento de tecido no local da aplicação mostrava o colágeno presente. (FIGURA 5).
: Fragmento de tecido renal, no 7º dia de pós-operatório, no local da aplicação do colágeno, que é percebido preenchendo toda a circunferência do pertuito lesado.
Não se notava macroscopicamente, presença ou vestígios de colágeno, do 15º ao 60º dia de pós-operatório, no local de sua aplicação (FIGURA 6).
O estudo do fragmento no local da implantação mostrava absorção evidente do colágeno (FIGURA 7).
Fragmento de tecido renal, no local da aplicação, aos 15º dias de pós-operatório, revelando absorção evidente do colágeno.
Aos 30 e 60 dias não havia vestígios de colágeno, tanto no rim quanto nos fragmentos retirados.
d) RESULTADOS À MICROSCOPIA ÓPTICA
No 4º dia após o implante, vê-se área de fibrina e tecido renal necrótico (necrose hialina) sem liquefação. Notam-se hemácias presas nas malhas de fibrina, compactadas em diversos graus e ausência de supuração. Inicia-se o processo proliferativo com vasos neoformados (FIGURA 8).
: Fotomicrografia do rim após 4 dias de implantação do colágeno.
Presença de anéis de fibrina (F) e hemácea (H) envolvendo fragmentos de colágeno (I) injetado. Presença de cordões de células epiteliais(CE). (HE, 290x).
Aos sete dias de implantação do colágeno, os eritócritos e neutrófilos remanescentes desapareceram. A malha de fibrina permanece hialina. Em torno dos fragmentos de colágeno, implantados, encontra-se proliferação fibroblástica e intensa neovascularização. (FIGURA 9).
Fotomicrografia de implantes de rim, após 7 dias de procedimento experimental.
Predomínio de vasos neoformados, sem aspecto de inflamação crônica. Fase de proliferação fibroblástica ativa, com predomínio de áreas de granulação e fibrilas de colágeno neoformados. ( H.E., 288x)
Após 15 dias de evolução, ocorre intensa aderência de fibroblastos nos fragmentos do colágeno implantado, semelhante a 7 dias, acentuando-se o processo proliferativo de granulação.
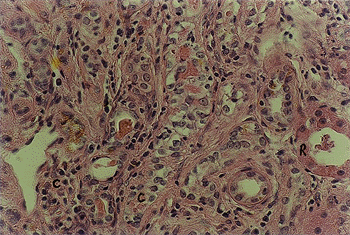
No 30º dia de evolução, observa-se glomérulos com estrutura típica, porém com citoplasma intensamente granulado e dentro do qual vê-se restos celulares, e pressença de cordões celulares epiteliais neoformados, sugerindo regeneração tubular (FIGURA 10).
: Fotomicrografia de tecido renal após 30 dias de implante de colágeno. Restos celulares (R). Cordões celulares (C) epiteliais. (H.E., 451 x)
Em volta da região da arteríola aferente reunem-se figuras que lembram túbulos renais proximais neoformados, recanalizados (FIGURA 11).
Fotomicrografia de tecido renal após 30 dias de implante de colágeno.
Túbulos renais proximais neoformados (seta). Túbulos renais remanescentes com sinais de degeneração turva das células epiteliais (D). (H.E., 288 x).
Os fragmentos de implante de colágeno exibem vários estágios de absorção ou remodelação. Em torno do glomérulo e, de permeio com a zona de implante, percebe-se rica proliferação fibroblástica e vasos neoformados (V). Observa-se glomérulos com aspecto normal, possivelmente espelhando um processo de reparo (G). (FIGURA 12).
No 60º dia de pós-operatório, ocorreu absorção completa do implante e o leito da ferida apresenta-se com fibrose. Ocorreu cicatrização completa com reparação dos tubulos e glomérulos.
DISCUSSÃO
Os implantes de colágeno, como toda aplicação clínico-cirúrgica, encontram seus fundamentos nas suas características e propriedades moleculares e biológicas. É fundamental a existência de receptores celulares para colágeno, o que permite adesão de células às fibras de colágeno, seguida de diferenciação celular, migração e reparação (7).
Outro fator importante é a ordem molecular (5) , pois os implantes encontram reconhecimento do colágeno por várias células, a de maior interesse para o reparo, adesão destas células, proliferação e migração com o preenchimento das malhas do implante, remodelação e absorção do implante com reparo da lesão e, no caso presente, regeneração do tecido renal, a partir do 7º dia de evolução, como foram observados em trabalhos anteriores com regeneração de tecido muscular (3) e hepático (4).
Analisando-se os resultados obtidos, à macroscopia, podemos observar que foi muito simples e prático o uso do colágeno tipo I para estancar a hemorragia e fazer o reparo da lesão transfixante, em toda a sua extensão. É um procedimento simples podendo ser executado durante a hemorragia profusa, ocluindo todo o trajeto, controlando facilmente a hemorragia e mantendo o ferimento durante a cicatrização, pelas características do colágeno anteriormente citadas.
Os seis animais do grupo 1 que evoluíram sem tratamento foram a óbito por choque hemorrágico conseqüente à lesão renal produzida. Todos os outros 30 cães evoluíram bem após a aplicação do colágeno, mostrando ser um método seguro no tratamento destas lesões renais transfixantes, pois não houve extravasamento de urina ou presença de hemorragia durante toda a evolução clínica e por ocasião do sacrifício. Não ocorreram outras complicações infecciosas como abscessos ou supuração da ferida operatória.
O colágeno implantado, bem como o tecido renal adjacente foram retirados e analisados sob microscopia óptica observando-se na evolução do processo cicatricial, uma fase inicial composta predominantemente por reação inflamatória aguda exsudativa, constituída por leucócitos neutrófilos, mas que rapidamente dá lugar à reação inflamatória proliferativa, como se vê aos quatro dias de evolução (FIGURA 8).
Na evolução, nota-se ainda no 7º dia de pós-operatório, presença de colágeno implantado, que gradativamente foi substituído por tecido de granulação, neovascularizado, onde se nota início de regeneração de células renais, tanto nas bordas deste tecido, como também em "ninhos" disseminados pelo mesmo. Acompanhando esta regeneração de tecido renal vê-se também intensa neoformação vascular. (FIGURA 9).
O aspecto de regeneração tubular inicia-se no 15º e, aos 30 dias de evolução pós-operatória, encontram-se cordões celulares epiteliais neoformados (FIGURAS 10 e 11).
Os sinais de reabsorção do implante só são bem evidentes no 60º dia após o implante. Ocorreu cicatrização completa com reparação dos túbulos e glomérulos .
As propriedades hemostáticas dos implantes devem-se ao fato de que as plaquetas aderem-se prontamente ao colágeno desencadeando a cascata enzimática responsável pela coagulação. É bem conhecido o fato de que plaquetas possuem receptores para colágeno (6).
Desta forma, observa-se grande vantagem na aplicação do colágeno, na área renal lesada, pois na fase aguda sustou a hemorragia e a perda urinária; durante a evolução clínica imediata não conduziu a complicações e depois, a partir do quarto dia de evolução, propiciou-se um processo cicatricial mais homogêneo, sendo substituído por tecido renal, com aspecto regenerativo intenso, precoce e organizado.
AGRADECIMENTOS
Agradeço ao prof. Benedicto Campos Vidal, Professor Titular do Departamento de Biologia Celular do Instituto de Biologia da UNICAMP, pela realização dos estudos histológicos da presente pesquisa.
Também agradeço a Sra. Rosana Celestina Morandim , bióloga do LICIT - Laboratório de Investigação em Cirurgia do Trauma, da UNICAMP, pelos cuidados dispensados aos cães e pela preparação das peças cirúrgicas.
Mantovani M, Vidal BC, Concon Filho A. type I collagen used to tamponade transfixing lesion of the kidney. Acta Cir Bras [serial online] 1999 Oct-Dec;14(4). Available from: URL: http://www.scielo.br/acb.
SUMMARY: Over the past years we have used of the type I collagen to tamponade transfixing hepatic lesions in dogs, manufactured at University of Campinas. We have considered the use of this collagen to tamponed transfixing renal lesions, wich can be molded to the entire wounded area thus tamponading all surface irregularities. In this way, a complete tamponade way be achieved, and urinary loss is prevented. Thirty six mongrel dogs received a perforating transfixing lesion in the distal region of the kidney, similar to that caused by a firearm bullet. Into the wounded tunnel type I collagen was introduced. Evaluations were made in the 4th , 7th, 15th, 30th and 60th day after the intervention, when animals were sacrificed. Microscope evaluation induced a homogeneous scar formation with early, organized renal regeneration evident from the 7th day onward. It is therefore believed that the use of type I collagen is an effective and safe method to be used in this type of renal wound.
SUBJECT HEADINGS: Trauma. Collagen. Regeneration.
Endereço para correspondência:
Mario Mantovani
Rua José de Campos Salles 650
13.095-300 Campinas - SP
Tel/Fax: (019)251-7049
Data do recebimento: 15/04/99
Data da revisão: 20/05/99
Data da aprovação: 26/06/99
-
1C.O.B.E.A (Colégio Brasileiro de Experimentação Animal). Princípios éticos na experimentação animal. In: Congresso do Colégio Brasileiro de Experimentação Animal. São Paulo, 1991.
- 2. Kran HB, Reuben BI, Fleming AW, Shoemaker WC. Use of fibrin glue in hepatic trauma. J Trauma 1988;28:1195-1201.
- 3. Mantovani M, Vidal BC, Diorio AC, Faria LL. Efeito do implante de feltro de colágeno I no trauma da musculatura retoabdominal de ratos. Acta Cir Bras 1992;7:21-4.
- 4. Mantovani M, Vidal BC, Filho AC. Tamponamento das lesőes hepáticas transfixantes com colágeno tipo I. Acta Cir Bras 1998;13(2):80-5.
- 5. Vidal BC. Alteraçőes células-matriz extracelulares: uma unidade estrutural e sistemática. Rev Fac Cięn Med Unicamp 1989;1:33-40.
- 6. Vidal BC. Cell and extracellular matrix interaction: a feedback theory based on molecular order recognition-adhesion events. Rev Fac Cięn Med Unicamp 1994;4:11-4.
- 7. Vidal BC, Vilarta R. Articular cartilage: collagen II proteoglycans interactions: availability of reactive groups variation in birrefringence and differences as compared to collagen I. Acta Histochem 1989;83:189-205.
Datas de Publicação
-
Publicação nesta coleção
14 Jan 2000 -
Data do Fascículo
Out 1999
Histórico
-
Recebido
15 Abr 1999 -
Revisado
20 Maio 1999 -
Aceito
26 Jun 1999