Resumos
Comparação da eficácia da somatostatina e da escleroterapia no sangramento digestivo proveniente da ruptura de varizes do esôfago. Foram avaliados prospectivamente 40 pacientes com hemorragia digestiva. Vinte e um pacientes foram randomizados a receber somatostatina (dose inicial de 250 mig seguida de infusão contínua de 250 µg/h por 48 h com reforços de 250 µg de 6/6 h nas primeiras 24 h) e 19 realizaram escleroterapia com oleato de etanolamina a 5%, sendo avaliados em 48 horas e no sétimo dia após o tratamento. Os grupos eram semelhantes quanto a sexo, idade, gravidade do sangramento e grau de falência hepatocelular. Falha terapêutica ocorreu em 48 h e 7 dias, respectivamente, em 26,3% e 35,7% no grupo da escleroterapia e em 23,8% e 21,4% no da somatostatina. A necessidade de transfusão (3,38 U no grupo da escleroterapia e 2,42 U no da somatostatina) e a mortalidade (31,6% no grupo da escleroterapia e 28,6% no grupo da somatostatina) também foram semelhantes (P >0,05). Conclui-se que a somatostatina é tão efetiva quanto a escleroterapia, devendo ser considerada no tratamento do sangramento agudo decorrente de ruptura de varizes do esôfago.
Escleroterapia; Somatostatina; Hemorragia gastrointestinal; Varizes esofágicas e gástricas; Cirrose hepática; Hipertensão portal
The aim of this study was to compare the efficacy of somatostatin versus endoscopic sclerotherapy in the management of digestive bleeding caused by rupture of esophageal varices. Forty patients were evaluated; 21 were randomly assigned to receive somatostatin (initial 250 mug followed by a 48-hour continuous infusion of 250 mug/h and 250 mug 6/6h bolus in the first 24 hours) and 19 to receive endoscopic sclerotherapy with ethanolamine oleate 5%. The patients were evaluated after 48 hours and after 7 days of treatment. Both groups of patients were similar in sex, age, gravity of the hemorrhage and liver dysfunction. Therapeutic failure occurred in 26,3% and 35,7% in the group of endoscopic sclerotherapy (48 h and 7 days respectively), and in 23,8% and 21,4% in the group of somatostatin. The need of blood transfusion (3,38 U in the group of endoscopic sclerotherapy and 2,42 U in the group of somatostatin) and the mortality rate (31,6% in the group of endoscopic sclerotherapy and 28,6% in the group of somatostatin) were also similar (P >0,05). The authors conclude that somatostatin is as effective as endoscopic sclerotherapy and that it should be considered in the treatment of acute esophageal variceal bleeding.
Sclerotherapy; Somatostatin; Gastrointestinal hemorrhage; Esophageal and gastric varices; Liver cirrhosis; Hypertension; portal
ARTIGO ORIGINAL / ORIGINAL ARTICLE
ESCLEROTERAPIA VERSUS SOMATOSTATINA NA HEMORRAGIA DIGESTIVA ALTA POR RUPTURA DE VARIZES ESOFÁGICAS+ + Curso de Pós-Graduação em Hepatologia da Fundação Faculdade Federal de Ciências Médicas de Porto Alegre (FFFCMPA) e da Irmandade Santa Casa de Misericórdia de Porto Alegre (ISCMPA), Porto Alegre, RS.
Renata Pereira RAMIRES* + Curso de Pós-Graduação em Hepatologia da Fundação Faculdade Federal de Ciências Médicas de Porto Alegre (FFFCMPA) e da Irmandade Santa Casa de Misericórdia de Porto Alegre (ISCMPA), Porto Alegre, RS. , Cristiane Kopacek ZILS** + Curso de Pós-Graduação em Hepatologia da Fundação Faculdade Federal de Ciências Médicas de Porto Alegre (FFFCMPA) e da Irmandade Santa Casa de Misericórdia de Porto Alegre (ISCMPA), Porto Alegre, RS. e Angelo Alves MATTOS*** + Curso de Pós-Graduação em Hepatologia da Fundação Faculdade Federal de Ciências Médicas de Porto Alegre (FFFCMPA) e da Irmandade Santa Casa de Misericórdia de Porto Alegre (ISCMPA), Porto Alegre, RS.
RESUMO -Comparação da eficácia da somatostatina e da escleroterapia no sangramento digestivo proveniente da ruptura de varizes do esôfago. Foram avaliados prospectivamente 40 pacientes com hemorragia digestiva. Vinte e um pacientes foram randomizados a receber somatostatina (dose inicial de 250 mg seguida de infusão contínua de 250 µg/h por 48 h com reforços de 250 µg de 6/6 h nas primeiras 24 h) e 19 realizaram escleroterapia com oleato de etanolamina a 5%, sendo avaliados em 48 horas e no sétimo dia após o tratamento. Os grupos eram semelhantes quanto a sexo, idade, gravidade do sangramento e grau de falência hepatocelular. Falha terapêutica ocorreu em 48 h e 7 dias, respectivamente, em 26,3% e 35,7% no grupo da escleroterapia e em 23,8% e 21,4% no da somatostatina. A necessidade de transfusão (3,38 U no grupo da escleroterapia e 2,42 U no da somatostatina) e a mortalidade (31,6% no grupo da escleroterapia e 28,6% no grupo da somatostatina) também foram semelhantes (P >0,05). Conclui-se que a somatostatina é tão efetiva quanto a escleroterapia, devendo ser considerada no tratamento do sangramento agudo decorrente de ruptura de varizes do esôfago.
DESCRITORES -Escleroterapia. Somatostatina. Hemorragia gastrointestinal. Varizes esofágicas e gástricas. Cirrose hepática. Hipertensão portal.
INTRODUÇÃO
A prevalência de varizes gastroesofágicas (VGE) em pacientes cirróticos é de aproximadamente 60%. Uma vez presentes, observa-se risco médio de sangramento de 32% em 2 anos. Por outro lado, o risco de ressangramento é muito alto, atingindo um pico na primeira semana, mas permanecendo elevado até o terceiro mês, com índices de até 70% em um ano(21, 22). Paralelamente, observa-se que a mortalidade do paciente com sangramento é de 30% a 50% dos casos, ou seja, maior do que três vezes aquela por sangramento digestivo de outra causa(6, 15, 29, 30).
Em decorrência da freqüência da hemorragia digestiva alta (HDA) por ruptura de VGE e do mau prognóstico que a mesma acarreta ao paciente com cirrose, torna-se fundamental que se proporcione uma terapia eficaz a essa população de doentes.
Diferentes modalidades terapêuticas têm sido empregadas para controlar a hemorragia por VGE. Destacam-se o papel das drogas vasoativas, do tamponamento por balão, da escleroterapia, da ligadura elástica, do TIPS ("transjugular intrahepatic porto-systemic shunt"), da embolização transhepática percutânea e da cirurgia de emergência. Nenhuma destas modalidades terapêuticas tem resultado plenamente eficaz, o que justifica estudos comparativos entre as mesmas. Ressalve-se ser o transplante hepático o único tratamento definitivo para esta situação, devendo ser sempre lembrado quando há falha terapêutica, desde que preenchidos os critérios de sua indicação(24).
Estudos randomizados mostraram que a somatostatina e seu análogo sintético o octreotide são mais eficazes que a vasopressina(8, 15, 29) e têm eficácia semelhante à terlipressina(18, 31, 39, 42), ao balão de Sengstaken-Blakemore(1, 25) e à escleroterapia(17, 26, 27, 32, 34, 36, 40) no controle do sangramento agudo por varizes esofágicas, tendo como principal mérito o fato de seus efeitos colaterais, quando presentes, serem discretos(12).
A utilização isolada de somatostatina/octreotide foi comparada ao seu uso combinado à ligadura elástica de varizes(37) e à escleroterapia(5) e esta associação mostrou eficácia superior, reduzindo a taxa de ressangramento, embora sem traduzir melhora na sobrevida. No entanto, recentemente(41), foi demonstrado que o uso combinado só apresenta vantagens à utilização isolada de somatostatina em pacientes com alto risco de insucesso com o uso da terapia farmacológica, ou seja, em pacientes em choque ou naqueles com sangramento ativo durante a endoscopia.
O uso combinado de somatostatina/octreotide e escleroterapia mostrou-se superior à utilização do procedimento endoscópico, quando o mesmo foi usado de forma isolada(7, 10, 35), fato que nem sempre é aceito(13). Ressalve-se existir estudo que preconiza a utilização da droga de forma precoce, antes da avaliação da endoscopia, revestindo-se esta conduta em benefício do paciente(3). Assim, a terapia farmacológica deveria ser iniciada imediatamente após a suspeita de sangramento decorrente da hipertensão portal(28).
Tendo em vista a freqüência e a gravidade do sangramento digestivo por ruptura de varizes esofágicas e pela dificuldade em eleger uma conduta terapêutica ideal, este trabalho tem como objetivo comparar a eficácia da somatostatina e da escleroterapia na vigência do sangramento digestivo por ruptura de varizes de esôfago.
MATERIAL E MÉTODOS
De junho 1996 a junho de 1998, 43 pacientes consecutivos com HDA por ruptura de varizes de esôfago, foram avaliados prospectivamente na Irmandade Santa Casa de Misericórdia de Porto Alegre (ISCMPA), Porto Alegre, RS.
O diagnóstico de cirrose hepática foi clínico/laboratorial/ecográfico e/ou através de biopsia hepática.
A presença de trombose porta, quando sugerida no "ecodoppler", foi confirmada por estudo angiográfico.
Os pacientes avaliados eram provenientes da emergência ou de uma unidade de internação e apresentaram HDA nas últimas 6 horas que precederam a endoscopia.
Foram considerados critérios de exclusão: pacientes com menos de 18 anos, com diagnóstico de carcinoma hepatocelular, com diabetes mellitus descompensado, com creatinina sérica acima de 2 mg/100 mL, mulheres grávidas ou lactantes e pacientes com sangramento de varizes gástricas.
O diagnóstico de sangramento decorrente da ruptura de varizes de esôfago foi realizado quando havia presença de sangramento ativo em jato ou em "babação", estigmas de sangramento recente (erosão ou coágulo sobre as varizes) ou presença de sangue no esôfago ou no estômago, e varizes esofágicas, como única causa potencial de sangramento(27, 32, 34, 36).
Assim que identificados, os pacientes com sangramento digestivo por prováveis varizes de esôfago e após avaliação inicial, foram randomizados em dois grupos através de sorteio com envelope fechado. No grupo I foi utilizada somatostatina, no grupo II foi realizada escleroterapia endoscópica.
Os pacientes do grupo I receberam somatostatina em dose inicial de 250 mg EV seguido de infusão contínua, 250 mg/hora durante 48 horas, além de reforços de 250 mg de 6/6 horas nas primeiras 24 horas. No grupo II a escleroterapia foi realizada utilizando um esofagogastroduodenoscópio Olympus modelo XQ20, com injeção de oleato de etanolamina a 5% nas varizes esofágicas, em uma dose máxima de 10 mL por variz. Nos casos de sangramento ativo, apenas o vaso sangrante foi esclerosado até cessar a hemorragia, nunca ultrapassando a dose máxima já referida. Quando existiam apenas estigmas de sangramento em algum vaso, somente este recebia substância esclerosante, até ser visto o balonamento do mesmo. Por fim, quando as varizes eram o único sítio possível de sangramento, a esclerose foi realizada em todos os cordões varicosos existentes, nunca ultrapassando a dose máxima por vaso, já descrita. A escleroterapia sempre foi realizada ou supervisionada por um dos autores.
Ambas as terapias foram iniciadas logo após a randomização e internação do paciente em unidade de tratamento intensivo. Todos os pacientes foram estabilizados hemodinamicamente, utilizaram lactulose (via oral ou através de enemas) para profilaxia de encefalopatia portossistêmica e norfloxacina 400 mg 12/12 horas para prevenção de infecções de origem entérica.
Referente à gravidade, todos os pacientes foram classificados segundo o critério de Child-Pugh(33).
A monitorização dos pacientes foi feita desde o momento da inclusão no protocolo, até o término do período de observação (48 horas), e baseou-se em critérios clínicos e laboratoriais.
No momento da internação, foram realizados hemograma, plaquetas, tempo de protrombina, glicemia, uréia, creatinina, sódio, potássio, albumina, bilirrubinas, aminotransferases e fosfatase alcalina. A cada 2 horas foram determinadas a pressão arterial, a freqüência cardíaca, a pressão venosa central, a diurese parcial, além da avaliação da hemorragia através de parâmetros clínicos. A cada 6 horas realizou-se um hemoglicoteste e a cada 12 horas novo hemograma, plaquetas, tempo de protrombina, glicemia, creatinina, sódio e potássio.
Foram realizadas, no mínimo, duas endoscopias: uma no momento da inclusão e a outra em 48 horas.
Foi considerada falha do tratamento a persistência do sangramento, apesar da terapia estabelecida ou quando ocorreu ressangramento nas primeiras 48 horas de randomização. Clinicamente, o ressangramento foi definido por qualquer episódio de hematêmese ou melena que tenha reduzido a pressão sistólica para menos de 100 mm Hg ou elevado a freqüência cardíaca para mais de 100 bpm(21). Nestes casos, sempre era realizada uma endoscopia digestiva para comprovação da hemorragia. Quando ocorreu falha do tratamento, os pacientes, nos dois grupos, foram tratados ou novamente tratados com escleroterapia.
Ressangramento tardio foi considerado como qualquer episódio de hemorragia digestiva alta ocorrido após 48 horas, porém dentro da primeira semana de hospitalização.
A sobrevida foi avaliada em 48 horas e uma semana após a randomização.
Os pacientes foram incluídos após obtenção de seu consentimento informado ou de um de seus familiares.
O presente estudo foi avaliado e aprovado pelo Comitê de Ética da Irmandade Santa Casa de Misericórdia de Porto Alegre.
A eficácia da somatostatina ou da injeção do esclerosante foi avaliada através do teste de proporções do Qui-quadrado (c²), com correção de Yates, quando necessário. A correlação existente entre o grau de falência hepatocelular e a classificação de Child-Pugh foi calculada pelo teste do c² para múltiplas variáveis qualitativas. A análise estatística utilizou um nível de significância de 5%.
RESULTADOS
Quando a casuística inicial foi avaliada, três pacientes foram excluídos: um por não apresentar dados completos no protocolo e dois por terem utilizado somatostatina por somente 12 horas.
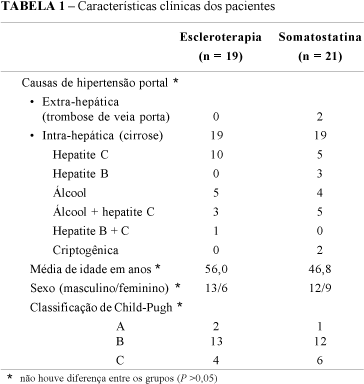
Dos 40 pacientes avaliados, 25 (62,5%) eram do sexo masculino e 15 (37,5%) do feminino. A idade média era de 51,1 ± 12,3 anos (variação de 22 a 85 anos). Trinta e oito (95%) pacientes apresentavam cirrose hepática (15 por vírus da hepatite C, 9 por álcool, 3 por vírus da hepatite B, 8 por álcool e vírus da hepatite C, 1 por vírus da hepatite B e C e em 2 a doença foi considerada criptogênica) e 2 (5%) trombose de veia porta.
A gravidade clínica no momento do sangramento foi avaliada nos 38 pacientes cirróticos: 3 eram Child A, 25 Child B e 10 Child C. Na análise estatística, não houve diferença com relação a classificação de Child nos dois grupos estudados (P <0,05).
Os dois grupos foram avaliados e comparados com relação à gravidade do sangramento. No grupo da somatostatina as médias e desvios padrão da pressão arterial sistólica, freqüência cardíaca e taxa de hemoglobina foram, respectivamente, 97 ± 36,1 mm Hg, 101,83 ± 14,26 bpm e 7,02 ± 2,31 mg/dL. No grupo da escleroterapia esses valores foram: 105,55 ± 26,83 mm Hg, 103,72 ± 22,42 bpm e 8,30 ± 2,17 mg/dL. Quando realizada a análise estatística, não se verificou diferença significativa entre os grupos, sendo o valor do P para pressão arterial sistólica, freqüência cardíaca e taxa de hemoglobina 0,42, 0,76 e 0,08, respectivamente.
A necessidade de transfusão sangüínea foi similar nos dois grupos: média de 3,38 unidades de concentrado de hemácias no grupo I e 2,42 unidades no grupo II (P >0,05).
Vinte e um pacientes foram randomizados para o grupo I (somatostatina) e 19 para o grupo II (escleroterapia), não havendo diferença entre os grupos no que diz respeito ao sexo, idade, etiologia da cirrose e classificação de Child-Pugh, segundo os critérios utilizados (P >0,05) (Tabela 1).
No momento da endoscopia, mais pacientes do grupo II (52,6% ´ 23,8%) apresentavam sangramento ativo, porém não houve diferença estatística (P = 0,06).
Falha do tratamento ocorreu em cinco (23,80%) pacientes do grupo I e em cinco (26,31%) do grupo II (P >0,05). Os cinco que não responderam à somatostatina foram submetidos a escleroterapia com sucesso. Dos cinco pacientes do grupo II que falharam no tratamento, quatro foram a óbito (sendo dois por sangramento incontrolável) (Tabela 2).
Com relação à taxa de ressangramento tardio, em até 7 dias, observou-se que quatro (21,04%) pacientes do grupo I e cinco (35,71%) do grupo II ressangraram (P >0,05), sendo que um de cada grupo foi a óbito por esse motivo (Tabela 3).
Quando avaliada a mortalidade total e a taxa de ressangramento geral, estas foram 30% e 42,5%, respectivamente. Dos 12 pacientes que foram a óbito 4 (33,33%) eram Child C, sendo que, excluído o sangramento propriamente dito, a principal causa de morte em ambos os grupos foi o choque séptico.
Em relação à terapêutica utilizada, não foram observadas complicações maiores em ambos os grupos, havendo um único relato de dor retroesternal após o procedimento, no grupo que se submeteu a escleroterapia.
DISCUSSÃO
A somatostatina foi introduzida no tratamento da hemorragia de VGE devido a sua capacidade de diminuir a pressão portal, sem os efeitos adversos de outros fármacos na circulação sistêmica. Causa uma vasoconstrição esplâncnica seletiva, provavelmente devido à inibição de peptídios vasodilatadores esplâncnicos, como o glucagon, peptídio intestinal vasoativo e substância P(8, 14) . Além disso, por inibir a secreção gástrica, poderia evitar a dissolução do coágulo no local da hemostasia das varizes, que depende de um pH ácido(34, 38).
Dois trabalhos clássicos da literatura comparando a eficácia da somatostatina com placebo no sangramento agudo de VGE, obtiveram resultados conflitantes; o primeiro, um estudo multicêntrico americano(38), não mostrou efeito benéfico da somatostatina, ressalvado o fato de ter apresentado índice muito elevado de controle do sangramento no grupo placebo (83%). Já o trabalho inglês, do Royal Free Hospital(11), demonstrou que a somatostatina é significativamente mais eficaz que o placebo no controle da HDA por VGE. Em ambos os estudos, a taxa de controle da hemorragia com a somatostatina foi semelhante (65% e 64%, respectivamente), apesar da mesma ter sido utilizada por somente 30 horas no primeiro trabalho e durante 5 dias no segundo. Um terceiro estudo comparando-a com o placebo(20), não mostrou diferença no que se refere ao ressangramento e mortalidade. Neste estudo, o grupo placebo também apresentou eficácia maior que a esperada no controle do sangramento.
A somatostatina, quando comparada com a vasopressina, mostrou aumento no controle do sangramento com a vantagem de apresentar baixa taxa de complicações (6,5% somatostatina vs 49% vasopressina)(8). IMPERIALE et al.(23), em uma metanálise, compararam a eficácia clínica da somatostatina e vasopressina no controle do sangramento por varizes e mostraram uma superioridade da somatostatina, além da ausência de efeitos adversos significativos desta droga. A ausência de efeitos colaterais significantes com a somatostatina representa sua maior vantagem sobre outras drogas transformando-a, certamente, em terapia mais segura(15).
Quando comparada a somatostatina com a terlipressina análogo sintético da vasopressina observou-se terem ambas as drogas eficácia semelhante no tratamento da hemorragia por VGE(18, 39, 42, 43).
Estudos realizados(26, 27, 32, 34, 36, 40) têm demonstrado que a somatostatina ou seu análogo sintético, o octreotide, é tão eficaz quanto a escleroterapia, tratamento considerado padrão na maioria dos centros médicos, no controle da HDA por ruptura de varizes esofágicas ou na prevenção do ressangramento precoce(17). Deve-se, no entanto, ressalvar o fato de que o octreotide parece não ter a mesma eficácia que a somatostatina(2, 4, 9). Estudos em ratos demonstram que esta droga teria seu maior efeito diminuindo o fluxo sangüíneo colateral porta, com ação menos significativa na redução da pressão portal(19). Uma explicação para a discrepância de ação entre as duas drogas poderia estar baseada no fato de que o efeito da somatostatina na redução da pressão portal ou da pressão das varizes seria mediada por receptores, aos quais o octeotride teria menor afinidade(4).
SHIELDS et al.(34), ao avaliarem 80 pacientes, observaram que o controle do sangramento (83% no grupo da escleroterapia e 77% no da somatostatina) e a taxa de mortalidade (19,5% no grupo da escleroterapia e 30,7% no grupo da somatostatina) não foram significativamente diferentes entre os dois grupos em análise, sendo que as complicações no grupo da somatostatina foram de menor importância e menos freqüentes do que após o procedimento endoscópico (29% no grupo da escleroterapia e 13% no grupo da somatostatina). Outros estudos obtiveram resultados semelhantes(32, 36, 40). Assim, PLANAS et al.(32), quando estudaram 70 pacientes, observaram falha terapêutica em 20% no grupo da somatostastina e 17% no grupo da escleroterapia e mortalidade, em 1 semana, semelhante em ambos os grupos (11,5%). O índice de complicações foi maior no grupo da escleroterapia, porém sem significância estatística (28,5% x 14,2%). Chamam a atenção para o fato de que as complicações de maior gravidade ocorreram nos pacientes que realizaram escleroterapia, contribuindo inclusive, no índice de óbito destes. Da mesma forma, SUNG et al.(36) obtiveram resultados semelhantes com relação ao ressangramento em 48 h (14% octreotide x 16% escleroterapia) e a mortalidade em 30 dias (29% x 41%), mostrando, assim, semelhante eficácia do octreotide e da escleroterapia. O número de complicações foi maior nos pacientes que realizaram escleroterapia. O Grupo de Estudos das Varizes Sangrantes (Variceal Bleeding Study Group)(40), ao avaliar de forma randomizada e controlada 170 pacientes cirróticos, observou ressangramento (em 5 dias) em 17% dos pacientes tratados com escleroterapia e 19% nos que receberam somatostatina (P >0,05). As complicações foram significativamente mais freqüentes (19% x 9%) e mais graves no grupo da escleroterapia. A despeito de JENKINS et al.(26), em avaliação inicial, encontraram dados que se superpõem aos anteriores, quando avaliaram maior casuística(27) e obtiveram controle do sangramento em 48 h (85% no grupo do octreotide e 82% no da escleroterapia) e mortalidade em 5 dias semelhantes, porém observaram maior mortalidade (31% x 17%) em 60 dias e número maior de complicações no grupo do octreotide, embora sem significância estatística.
No estudo de Di FEBO et al.(16), ao compararem a somatostatina com a escleroterapia num grupo de 47 pacientes, observaram falha de controle do sangramento semelhante nas primeiras 48 horas (22% x 8%), embora em 7 dias tenha sido menor no grupo da escleroterapia (28% x 4,5%). No entanto, o índice de complicações foi menor no grupo da somatostatina e a taxa de mortalidade, quando avaliada em 30 dias, foi a mesma em ambos os grupos (somatostatina 26% x escleroterapia 21%).
ESCORSELL et al.(17), avaliando pacientes após o controle do episódio agudo de sangramento, utilizaram somatostatina durante 5 dias ou escleroterapia. A taxa de ressangramento em 5 dias e em 6 semanas oscilou em torno de 15%, sendo semelhante nos dois grupos. A necessidade de transfusão em 5 dias no grupo da somatostatina foi 0,5 ± 1 unidades e no da escleroterapia 2,5 ± 1 unidades (P >0,05). Da mesma forma, não houve diferença na mortalidade observada em 6 semanas (5%). Em relação às complicações, observaram serem as mesmas significativamente mais freqüentes no grupo da escleroterapia (24% x 4,4%).
D'AMICO et al.(15), em metanálise, mostraram não haver diferença entre as duas proposições terapêuticas no que diz respeito ao controle do sangramento e na mortalidade. AVGERINOS(4), ao referendar estes achados, chama a atenção para o maior índice de complicações naqueles pacientes que realizaram escleroterapia.
No presente estudo, do ponto de vista clínico, os dois grupos de pacientes avaliados eram semelhantes (Tabela 1). Embora houvesse, no grupo II, maior número de pacientes com sangramento ativo, no momento da endoscopia, a diferença não foi estatisticamente significativa, o que pode ser decorrente do número de casos avaliados. Observou-se que, quanto à gravidade do sangramento, também não houve diferença entre os dois grupos. Quando analisado nas primeiras 48 h, como pode ser visto na Tabela 2, observou-se falha do tratamento em 23,80% no grupo da somatostatina e 26,31% no da escleroterapia (P >0,05). Estes dados são concordes com a literatura(16, 27, 32, 34, 36). Com relação ao ressangramento tardio (Tabela 3), os índices de 21,04% no grupo da somatostatina e de 35,71% no da escleroterapia (P >0,05), discordam dos achados de Di FEBO et al.(16), uma vez que estes autores observaram maior prevenção de ressangramento em 7 dias no grupo da escleroterapia. Conforme referido por outros autores(27, 32,34, 36), o número de unidades de sangue transfundido foi semelhante nos dois grupos. Quando avaliada a mortalidade global (30%), metade dos pacientes foi a óbito por causas diretamente relacionadas ao sangramento, embora, à semelhança de outros autores(16, 17, 27, 32, 34, 40), não se observou diferença da mesma nos grupos em estudo (Tabelas 2 e 3).
As taxas de complicações, não diferiram nos grupos, contrastando com o menor índice referido na literatura(16, 17, 32, 34, 36, 40) dos pacientes submetidos a terapia farmacológica. Ressalve-se que só foram avaliadas as possíveis complicações ocorridas na primeira semana após tratamento.
Do presente estudo conclui-se que a somatostatina é uma alternativa válida a ser oferecida aos pacientes com sangramento agudo por ruptura de varizes de esôfago. Existem estudos que recomendam sua utilização precocemente, antes mesmo da endoscopia. No entanto, a associação com a escleroterapia deveria ser limitada àqueles casos em que existe instabilidade hemodinâmica (choque) ou sangramento ativo no momento do exame(41). Espera-se que outros estudos referendem o posicionamento aqui assumido, para que se possa, então, propor uma conduta mais definitiva.
Ramires RP, Zilz CK, Mattos AA de. Sclerotherapy versus somatostatin in the treatment of upper digestive hemorrhage caused by rupture of esophageal varices. Arq Gastroenterol 2000;37(3):148-154.
ABSTRACT -The aim of this study was to compare the efficacy of somatostatin versus endoscopic sclerotherapy in the management of digestive bleeding caused by rupture of esophageal varices. Forty patients were evaluated; 21 were randomly assigned to receive somatostatin (initial 250 mg followed by a 48-hour continuous infusion of 250 mg/h and 250 mg 6/6h bolus in the first 24 hours) and 19 to receive endoscopic sclerotherapy with ethanolamine oleate 5%. The patients were evaluated after 48 hours and after 7 days of treatment. Both groups of patients were similar in sex, age, gravity of the hemorrhage and liver dysfunction. Therapeutic failure occurred in 26,3% and 35,7% in the group of endoscopic sclerotherapy (48 h and 7 days respectively), and in 23,8% and 21,4% in the group of somatostatin. The need of blood transfusion (3,38 U in the group of endoscopic sclerotherapy and 2,42 U in the group of somatostatin) and the mortality rate (31,6% in the group of endoscopic sclerotherapy and 28,6% in the group of somatostatin) were also similar (P >0,05). The authors conclude that somatostatin is as effective as endoscopic sclerotherapy and that it should be considered in the treatment of acute esophageal variceal bleeding.
HEADING -Sclerotherapy. Somatostatin. Gastrointestinal hemorrhage. Esophageal and gastric varices. Liver cirrhosis. Hypertension, portal.
Recebido para publicação em 12/1/2000.
Aprovado para publicação em 11/5/2000.
* Médica Gastroenterologista da ISCMPA e Mestranda do Curso de Pós-Graduação em Hepatologia da FFFCMPA e da ISCMPA.
** Acadêmica de Medicina da FFFCMPA.
**** Professor Titular da Disciplina de Gastroenterologia da FFFCMPA e Coordenador do Curso de Pós-Graduação em Hepatologia da FFFCMPA e da ISCMPA.
Endereço para correspondência: Dr. Angelo Alves de Mattos - Rua Cel. Aurélio Bitencourt, 35/201 - 90430-080 - Porto Alegre, RS.
- 1. Avgerinos A, Klonis C, Rekoumis G, Gouma P, Papadimitrus N, Raptis S. A prospective randomized trial comparing somatostatin, balloon tamponade and the combination of both methods in the management of acute variceal haemorrhage. J Hepatol 1991;13:78-83.
- 2. Avgerinos A, Armonis A, Rekoumis G, Manalakopoulos S, Argirakis G, Raptis S. The effect of somatostatin and octreotide on intravascular oesophageal variceal pressure in patients with cirrhosis. J Hepatol 1995;22:379-80.
- 3. Avgerinos A, Nevens F, Raptis S, Fevery J and a Study Group. Early administration of somatostatin and efficacy of sclerotherapy in acute oesophageal variceal bleeds: the European acute bleeding oesophageal variceal episodes randomized trial. Lancet 1997;350:1495-9.
- 4. Avgerinos A. Approach to the management of bleeding esophageal varices: role of somatostatin. Digestion 1998;59:1-22.
- 5. Balanzó J, Villanueva C, Novella MT, Ortiz J, Pamplona J, Sáinz S. Octreotide vs. sclerotherapy and octreotide for acute variceal bleeding. A pilot study [abstract]. Annual Meeting of the American Society for Gastrointestinal Endosocopy; 1996 May 19-22; San Francisco, Calif., USA. Gastrointest Endosc 1996;43:331.
- 6. Bass NM, Somberg KA. Portal hypertension and gastrointestinal bleeding. In: Sleilenger MH, Fordtran JS, editors. Gastrointestinal Disease, Pathophysiology/Diagnosis/Management. 6. ed. Philadelphia: WB Saunders; 1998. p.1284-309.
- 7. Besson I, Ingrand P, Person B, Boutroux D, Heresbach D, Bernard P, Hochain P, Larricq J, Gourlaouen A, Ribard D. Sclerotherapy with or without octreotide for acute variceal bleeding. N Engl J Med 1995;333:555-60.
- 8. Bosch J, D'Amico G, Luca A. Drug therapy for variceal haemorrhage. In: Bosch J, Groszmann RJ, editors. Portal hypertension pathophysiology and treatment. Oxford: Blackwell Scientific; 1994. p.108-23.
- 9. Bosch J. Medical treatment of portal hypertension. Digestion 1998;59:547-55.
- 10. Brunati S, Ceriani R, Curioni R, Brunelle L, Repaci G, Morini L. Sclerotherapy alone vs. sclerotherapy plus terlipressin vs. sclerotherapy plus octreotide in the treatment of acute variceal haemorrhage. Hepatology 1996;24:207A.
- 11. Burroughs AK, McCormick PA, Hughes MD. Randomized, double-blind, placebo-controlled trial of somatostatin for variceal bleeding. Emergency control and prevention of early variceal rebleeding. Gastroenterology 1990;99:1388-95.
- 12. Burroughs AK. Octreotide in variceal bleeding. Gut 1994;3:23-7.
- 13. Burroughs AK for the International Otreotid Varices Group. Double blind RCT of 5 day octreotide versus placebo, associated with sclerotherapy for trials failures. Hepatology 1996;24:352A.
- 14. Burroughs AK. Pharmacological treatment of acute variceal bleeding. Digestion 1998;59:28-36.
- 15. D'Amico G, Pagliaro L, Bosch L. The treatment of portal hypertension. A meta-analytic review. Hepatology 1995;22:332-54.
- 16. Di Febo G, Siringo S, Vacirca M, Santoro P, Merighi S, Mustaja A. Somatostatin and urgent sclerotherapy in active esophageal variceal bleeding [abstract]. Gastroenterology 1990;98:583.
- 17. Escorsell A, Bordas JM, del Arbol LR, Jaramillo JL, Planas R, Banares R, Albillos A, Bosch J. Randomized controlled trial of sclerotherapy versus somatostatin infusion in the prevention of early rebleeding following acute variceal hemorrhage in patients with cirrhosis. J Hepatol 1998;29:779-88.
- 18. Feu F, Arbol LR, Bañares R, Planas R, Bosch J, Members of the Variceal Bleeding Study Group. Double-blind randomized controlled comparing terlipressin and somatostatin for acute variceal hemorrhage. Gastroenterology 1996;111:1291-9.
- 19. Fort J, Oberti F, Pilette C, Veal N, Gallois T, Douay O, Rousselet MC, Rosenbaum J, Cales P. Antifibrotic and hemodynamic effects of early and chronic administration of octreotide in two models of liver fibrosis in rats. Hepatology 1998;28:1525-31.
- 20. Gotzsche PC, Gjorup I, Bonnén H, Brahe NEB, Becker U, Burcharth F. Somatostatin vs placebo in bleeding oesophageal varices: randomized trial and meta-analysis. BMJ 1995;310:1495-8.
- 21. Grace ND, Groszmann RJ, Garcia-Tsao G, Burroughs AK, Pagliaro L, Makuch RW, Bosch J, Stiegmann GV, Henderson JM, de Franchis R, Wagner JL, Conn HO, Rodes J. Portal hypertension and variceal bleeding: an AASLD single topic symposium. Hepatology 1998;28:868-80.
- 22. Groszmann RJ, Franchis R. Portal hypertension. In: Schiff L, Schiff ER, editors. Disease of the liver. 8. Ed. Philadelphia: JB Lippincott; 1999. p.387-442.
- 23. Imperiale TF, Teran JC, McCullough AJ. A meta-analysis of somatostatin versus vasopressin in the management of acute esophageal variceal hemorrhage. Gastroenterology 1995;109:1289-94.
- 24. Iwatsuki S, Starzl TE, Todo S. Liver transplantation in the treatment of bleeding esophageal varices. Surgery 1988;104:697-705.
- 25. Jaramillo JL, de la Mata M, Miño G, Costán G, Gómez-Camacho F. Somatostatin versus Sengstaken balloon tamponade for primary haemostasia of bleeding esophageal varices. A randomized pilot study. J Hepatol 1991;12:100-5.
- 26. Jenkins SA, Copeland G, Kingsnorth A, Shields R. A prospective randomised controlled clinical trial comparing sandostatin and injection sclerotherapy in the control of acute variceal haemorrhage: an interim report. Gut 1992;33:221.
- 27. Jenkins SA, Shields R, Davies M, Elias E, Turnbull AJ, Bassendin EMF, James OF, Iredale JP, Vyas SK, Arthur MJH, Kingsnorth NA, Sutton R. A multicentre randomised trial comparing octreotide and injection sclerotherapy in the management and outcome of acute variceal haemorrhage. Gut 1997;41:526-33.
- 28. Mc Cormack G, Mc Cormick A. A practical guide the management of oesophageal varices. Drugs 1999;5:327-35.
- 29. Nader A, Grace N. Pharmacologic intervention during the acute bleeding episode. Gastrointest Endosc Clin North Am 1999;9:287-99.
- 30. Pagliaro L, D'Amico G, Luca A, Pasta L, Politi F, Aragona E, Malizia G. Portal hypertension: diagnosis and treatment. J Hepatol 1995;23 Suppl 1:36-44.
- 31. Pedretti G, Elia G, Calzetti C, Magnani G, Fiaccadori F. Octreotide versus terlipressin in the acute variceal hemorrhage in liver cirrhosis. Clin Invest 1994;72:653-9.
- 32. Planas R, Quer JC, Boix J, Canet J, Armengol M, Cabre E, Pintanel T, Humbert P, Oller B, Broggi MA. A prospective randomized trial comparing somatostatin and scleroterapy in the treatment of acute variceal bleeding. Hepatology 1994;20:370-5.
- 33. Pugh RWH, Murray-Lyon IM, Dawson JL. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg 1983;60:646-9.
- 34. Shields R, Jenkins SA, Baxter JN, Kingsnorth AN, Ellenbogen S, Makin CA, Gilmore I, Morris AI, Ashby D, West CR. A prospective randomized controlled trial comparing the efficacy of somatostatin with injection sclerotherapy in the control of bleeding oesophageal varices. J Hepatol 1992;16:128-37.
- 35. Signorelli S, Negrini F, Paris B, Bonelli M, Girola M. Sclerotherapy with or without somatostatin or octreotide in the treatment of acute variceal haemorrhage: our experience. Gastroenterology 1996;110:1326A.
- 36. Sung JJ, Chung SC, Lai CW, Chan FK, Leung JW, Yung MY, Kassianides C, Li AK. Octreotide infusion or emergency sclerotherapy for variceal haemorrhage. Lancet 1993;342:637-41.
- 37. Sung JJ, Chung SC, Yung MY, Lai CW, Lou JY, Lee YT, Leung VK, Li MK, Li AK. Prospective randomized study of effect of octreotide on rebleeding from oesophageal varices after endoscopic ligation. Lancet 1995; 346:1666-9.
- 38. Valenzuela JE, Schubert T, Fogel MR. A multicenter, randomized, double-blind trial of somatostatin in the management of acute hemorrhage from esophageal varices. Hepatology 1989;99:1388-95.
- 39. Variceal Bleeding Study Group. Double-blind comparison of somatostatin infusion vs glipressin injection in the treatment of acute variceal haemorrhage in patients with cirrhosis. J Hepatol 1993;18:1-75.
- 40. Variceal Bleeding Study Group. Randomized controled trial of sclerotherapy vs somatostatin infusion in the prevention of early rebleeding following variceal hemorrhage in patients with cirrhosis. Hepatology 1994;19:1361A.
- 41. Villanueva C, Ortiz J, Sàbat M, Gallego A, Torras X, Soriano G, Sainz S, Boadas J, Cusso X, Guarner C, Balanzo J. Somatostatin alone or combined with emergency sclerotherapy in treatment of acute esophageal variceal bleeding: a prospective randomized trial. Hepatology 1999;30:384-9.
- 42. Walker S, Kreichgauer HP, Bode JC. Terlipressin vs somatostatin in bleeding esophageal varices: a controlled double-blind study. Hepatology 1992;15:1023-30.
- 43. Walker S, Kreichgauer HP, Bode JC. Terlipressin (glipressin) versus somatostatin in the treatment of bleeding esophageal varices ž final report of a placebo-controlled, double-blind study. Z Gastroenterol 1996;34:692-8.
Datas de Publicação
-
Publicação nesta coleção
29 Nov 2002 -
Data do Fascículo
Jul 2000
Histórico
-
Aceito
11 Maio 2000 -
Recebido
12 Jan 2000