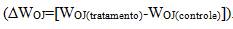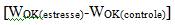Resumos
O objetivo do trabalho foi estudar os efeitos de baixas temperaturas sobre o aparato fotossintético de híbridos de canola. Plantas de canola foram cultivadas em casa de vegetação e, 50 dias após a semeadura, acondicionadas em câmara de crescimento com ausência de luz, onde foram submetidas a temperaturas de 0 ou 4oC pelo período de 1 ou 4 horas. Avaliou-se a cinética de emissão da fluorescência da clorofila a. Os híbridos apresentaram o mesmo comportamento em relação à fluorescência da clorofila em resposta ao estresse. Os parâmetros da fluorescência foram amplamente afetados em todos os tratamentos e a análise da cinética revelou efeitos da temperatura, principalmente no passo J, que representa o acúmulo de plastoquinona reduzida e na fase I-P, que reflete a redução dos aceptores de elétrons finais do lado aceptor do fotossistema I. Conclui-se que os parâmetros mais responsivos às condições impostas pelo frio são os que descrevem o grau de reoxidação do aceptor final de elétrons do fotossistema II e a atividade do fotossistema I
Brassica napus; Teste JIP; cinética da fluorescência; estresse
The objective of this research was to study the effects of low temperatures on the photosynthetic apparatus of canola hybrids. Oilseed rape plants were grown in a greenhouse and, 50 days after sowing, placed in a growth chamber with absence of light which were subjected to different periods of low temperatures: 0 or 4oC during 1 or 4 hours. The kinetics of emission of chlorophyll fluorescence was evaluated. The hybrids showed the same behavior in relation to chlorophyll fluorescence in response to stress. The parameters of fluorescence related to the activity of the photosystem were largely affected in all treatments. The analysis of the kinetics showed temperature effects, mainly at the J step which reflects the accumulation of reduced plastoquinone and the I-P phase reflecting the reduction of end electron acceptors at the photosystem I acceptor side. It was concluded that the parameters more responsive to conditions imposed by cold are describing the degree of reoxidation of the final electron acceptor of photosystem II and activity of photosystem I
Brassica napus; JIP-test; fluorescence kinetics; stress
INTRODUÇÃO:
As baixas temperaturas limitam o crescimento e a produtividade das culturas anuais de inverno, além da distribuição geográfica das plantas. O estresse por frio impede a expressão do potencial genético das plantas, devido à inibição de reações metabólicas e, indiretamente, através da restrição da absorção de água e desidratação celular, induzida pelo congelamento (CHINNUSAMY et al., 2007). As plantas têm sido classificadas de acordo com a faixa de temperatura, em: i. sensíveis ao frio; ii. tolerantes ao frio; e iii. tolerantes ao congelamento, as quais podem adquirir tolerância à geada após um período de exposição a temperaturas baixas não-congelantes em um processo adaptativo (GARSTKA et al., 2007).
Muitas espécies de plantas de clima temperado podem aclimatar-se ao frio e adquirir tolerância à formação de gelo extracelular em seus tecidos. Esta aclimatação pode ocorrer mediante exposição prévia a temperaturas baixas não-congelantes, onde as plantas podem aumentar sua tolerância ao congelamento, ou sobreviver a temperaturas reduzidas (CHINNUSAMY et al., 2007). Este processo está associado a diversas alterações fisiológicas e bioquímicas: i. aumento dos níveis de açúcares, proteínas, aminoácidos e ácidos orgânicos; acúmulo de osmólitos e proteínas protetoras; ii. alterações no transporte fotossintético de elétrons; iii. expressão alterada de enzimas do ciclo de Calvin; iv. modificações na composição da membrana lipídica; e v. alterações na expressão gênica (HUGHES & DUNN, 1996; PALVA et al., 2001; STITT & HURRY, 2002; HUNER et al., 2003).
A fluorescência da clorofila a têm sido utilizada para a avaliação do efeito de fatores ambientais sobre o metabolismo fotossintético, bem como para medir o grau de tolerância das plantas frente aos estresses abióticos (STIRBET & GOVINDJEE, 2011). Estudos utilizando a fluorescência da clorofila a indicam que o fotossistema II (FSII) é um dos principais alvos do estresse por baixas (BERTAMINI et al., 2007) e altas temperaturas (BRESTICA et al., 2012).
Obtidos os dados de intensidade da fluorescência, estes podem ser analisados através do Teste JIP, desenvolvido por STRASSER & STRASSER (1995). O Teste JIP é uma análise multiparamétrica do rápido aumento da fluorescência transiente OJIP, o qual permite quantificar o fluxo de energia absorvido e aproveitado no sistema fotossintético das plantas (STIRBET & GOVINDJEE, 2011).
O cultivo mundial de canola (Brassica napus L.) concentra-se em regiões temperadas, principalmente em latitudes superiores a 35o. No Brasil, devido às condições não atenderem ao número de horas de frio requerido pela cultura, emprega-se apenas cultivares de primavera da espécie B. napus L. var. oleifera, em latitude máxima de 30oS (TOMM et al., 2009). A área de cultivo, de aproximadamente 40mil ha, é responsável pela produção anual de 53 mil ton. O Rio Grande do Sul é o maior produtor com 26mil ha cultivados anualmente (CONAB, 2012). A temperatura do ar é a variável ambiental mais importante na regulação do crescimento e desenvolvimento da canola, sendo que temperaturas muito baixas são prejudiciais em vários estádios da cultura (MCCLINCHEY & KOTT, 2008). Com isso, é necessário que plantas de canola passem por um período de aclimatação ao frio para que sejam capazes de resistir aos danos causados pela geada (DALMAGO et al., 2010).
O conhecimento das respostas desta oleaginosa em relação às baixas temperaturas é de grande importância, podendo contribuir para elucidação do processo de aclimatação ao frio desta espécie. O trabalho teve como objetivo estudar os efeitos de baixas temperaturas sobre o funcionamento do aparato fotossintético de quatro híbridos de canola.
MATERIAL E MÉTODOS:
Os híbridos de canola Hyola 43, Hyola 401, Hyola 420 e Hyola 432, recomendados para o cultivo no Rio Grande do Sul (TOMM el al., 2009), foram cultivados em casa de vegetação com temperatura controlada (20 oC ± 2 oC). A semeadura foi realizada em vasos plásticos (0,5L), contendo areia lavada como substrato. A irrigação foi realizada diariamente, sendo aplicada solução nutritiva de HOAGLAND e ARNON (1950) a cada dois dias. Aos 50 dias após a semeadura, quando as plantas estavam no estádio de roseta, com três/quatro folhas completamente expandidas, elas foram acondicionadas em câmara de crescimento com ausência de luz e submetidas a temperaturas de 0 ou 4oC, pelo período de 1 ou 4 horas. As temperaturas e os tempos de estresse foram definidos em ensaios preliminares, os quais demonstraram respostas significativas nestas condições. Antes da indução do estresse, foram realizadas determinações da fluorescência, sendo os valores registrados considerados como controle. As determinações foram repetidas após aplicação dos tratamentos e depois de uma hora de permanência das plantas à temperatura de 20-25ºC (período de recuperação).
A fluorescência transiente da clorofila a foi medida com fluorômetro portátil (Handy PEA, Hansatech Instruments). A partir das intensidades de fluorescência registradas, foram calculados os parâmetros estabelecidos pelo Teste JIP (STRASSER & STRASSER, 1995), bem como as diferenças na cinética de emissão de fluorescência [maiores detalhes são descritos em YUSUF et al. (2010)].
O transiente OJIP foi normalizado entre os passos O e P e expressa como fluorescência variável relativa
para revelar as alterações no formato da curva entre os passos O e P. Para possibilitar a possível identificação da banda-L (aproximadamente 150μs), a fluorescência relativa variável foi normalizada entre os passos 0 (50μs) e e a diferença cinética foi mostrada através da equação (aproximadamente300μs) foi visualizada quando realizada a diferença cinética entre a fluorescência variável nos passos 0 (50μs) e e a diferença cinética . Foi realizada a normalização da fluorescência na fase O-I, utilizando-se da equação e, para análise da fase I-P, os dados foram normalizados comoUtilizaram-se 10 repetições por tratamento, sendo cada unidade experimental constituída por um vaso contendo uma planta. O experimento foi conduzido em delineamento inteiramente casualizado, sendo que as médias dos parâmetros de fluorescência comparadas pelo Teste de Scott Knott, em nível de 5% de probabilidade de erro. As análises estatísticas foram realizadas com o software Origin 8(r).
RESULTADOS E DISCUSSÃO:
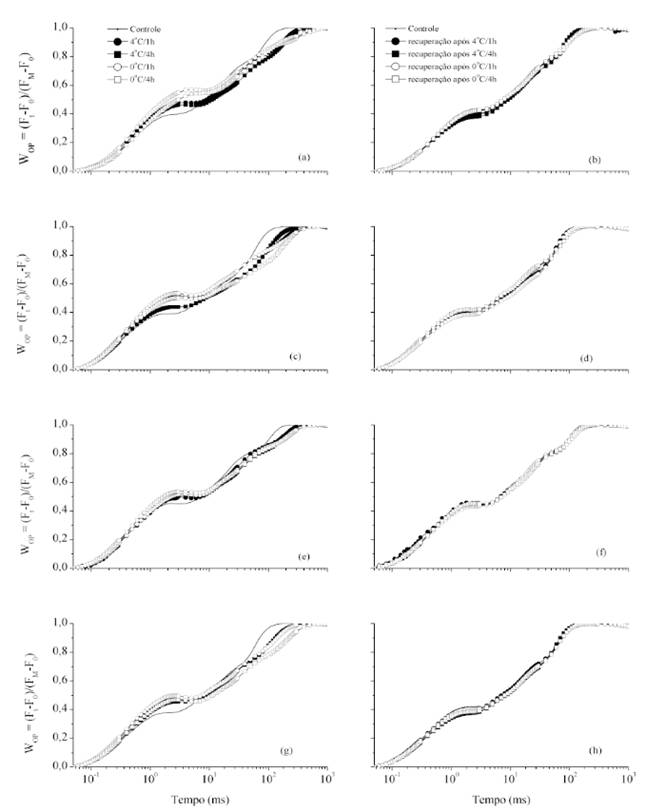
A cinética de emissão da fluorescência da clorofila a de plantas de canola submetidas a baixas temperaturas é apresentada na figura 1. Em geral, as diferenças nas cinéticas da fluorescência em função dos tratamentos utilizados foram similares em todos os híbridos. Todas as curvas da fluorescência variável relativa (WOP) apresentaram uma forma OJIP típica, com uma fluorescência variável máxima, indicando que as amostras apresentavam-se fotossinteticamente ativas (STRASSER et al., 2004; YUSUF et al., 2010). Pode-se verificar aumento da fluorescência variável transiente no passo J, o qual reflete o acúmulo de plastoquinona A reduzida (QA -) e valores de fluorescência mais baixos na fase I-P, relacionada à redução dos aceptores de elétrons finais do lado aceptor do fotossistema I (FSI).
Fluorescência variável relativa (WOP=(Ft-F0)/(FM-F0) (u.r.) de plantas de híbridos de canola Hyola 43 (a-b), Hyola 401 (c-d), Hyola 420 (e-f) e Hyola 432 (g-h), submetidas à temperatura de 4 ou 0ºC, pelo período de 1 ou 4 horas (a, c, e, g) e após recuperação por 1 hora em temperatura ambiente (b, d, f, h).
Considerando que todos os híbridos apresentaram o mesmo comportamento em relação à cinética da fluorescência em resposta às baixas temperaturas, as diferenças de emissão foram representadas através dos resultados obtidos nas plantas do híbrido Hyola 43.
Na tabela 1, pode-se verificar que baixas temperaturas provocaram aumento no tempo (em ms) para atingir a fluorescência máxima (tFM), na razão que representa a energia necessária para fechar todos os centros de reação (RC) do FSII (Sm) e no número de giros de oxidação e reoxidação de QA (N). A permanência das amostras em temperatura ambiente foi capaz de reduzir estes parâmetros técnicos aos níveis do controle, exceto no tratamento correspondente à aplicação de 0oC por 4h.
: Tempo para atingir a fluorescência máxima (tFM), razão que representa a energia necessária para fechar todos os centros de reação do fotossistema II, número de giros de oxidação e reoxidação de QA (N) e parâmetros fluxo de energia por centro de reação, obtidos por meio do Teste JIP, a partir da fluorescência transiente de plantas do híbrido de canola Hyola 43, submetidas à temperatura de 4 ou 0ºC pelo período de 1 ou 4 horas e após recuperação por 1 hora, em temperatura ambiente (1).
Os fluxos de absorção, de energia capturada e de transporte de elétrons por RC (ABS/RC, TR0/RC e ET0/RC, respectivamente) sofreram redução em todos os tratamentos (Tabela 1). Contudo, somente a temperatura de 4°C promoveu redução do fluxo de energia dissipada por RC (DI0/RC) e intensificou a redução do aceptor final de elétrons do FSI por RC (RE0/RC).
Para os parâmetros que descrevem rendimento (Tabela 2), observa-se que φPo (rendimento quântico máximo fotoquímico) foi reduzido em plantas que foram mantidas a 0 °C, sendo que os parâmetros ΨEo (probabilidade que um éxciton capturado no RC mova um elétron na cadeia de transporte de elétrons além de QA -) e φE0 (rendimento quântico de transporte de elétrons de QA - para o intersistema de aceptores de elétrons) decresceram em todos os tratamentos testados. Os parâmetros δRo (eficiência com que um elétron pode mover-se do intersistema de aceptores de elétrons para o aceptor final de elétrons do FSI) e φRo (rendimento quântico de transporte de elétrons de QA - para os aceptores finais de elétrons do FSI) aumentaram nos diferentes tempos de exposição ao frio, apresentando valores ao nível de controle após o período de recuperação.
: Rendimentos, eficiências de fluxo de energia e índice de performance total (PItotal), obtidos por meio do Teste JIP, a partir da fluorescência transiente de plantas de híbridos de canola Hyola 43, submetidas à temperatura de 4 ou 0ºC, pelo período de 1 ou 4 horas e após recuperação por 1 hora, em temperatura ambiente (1).
A permanência em temperatura ambiente não foi capaz de restabelecer os parâmetros referentes aos fluxos específicos por RC e os parâmetros que descrevem rendimento em alguns tratamentos, principalmente nos correspondentes ao período de exposição de 4 horas.
O índice de performance total (PItotal), que mede a performance até os aceptores finais de elétrons do FSI aumentou em função do estresse, contudo, o período de recuperação tornou os valores de PItotal similares aos valores do controle (Tabela 2).
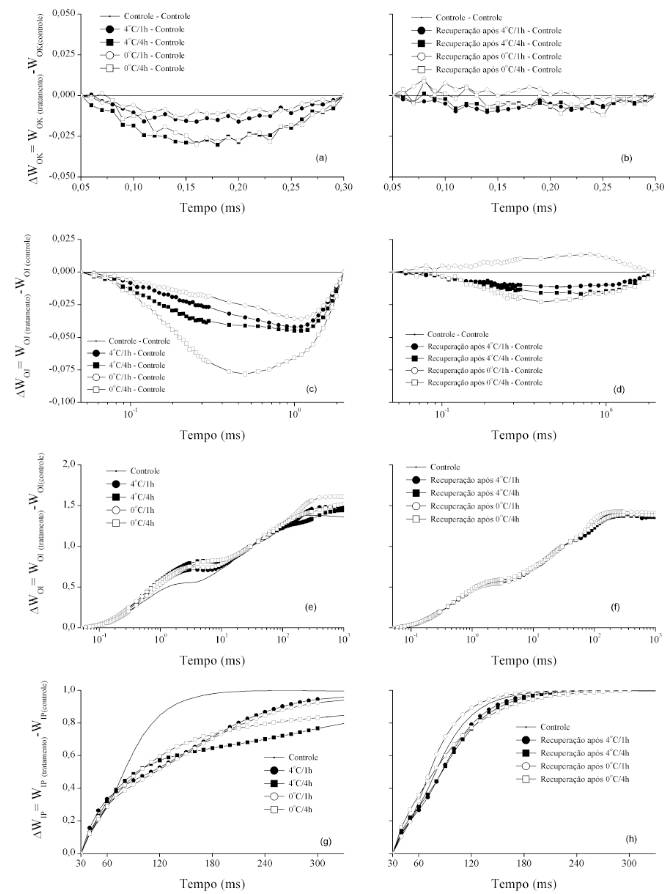
Na figura 2, os dados de fluorescência foram normalizados entre O (50μs) e K (300 μs) evidenciando diferenças cinéticas em função do estresse
e do período de recuperação (Figura 2a e 2b). Foi possível observar a presença de banda L negativa (~150µs) em todos os tratamentos. A presença da banda L, segundo STRASSER & STIRBET (1998), é um indicador do grau de agrupamento das unidades do FSII, sendo que, quando a banda L é mais positiva, a conectividade entre as unidades do FSII é menor, refletindo o fato de que quanto menor a conectividade, menor a estabilidade do sistema e a utilização da energia de excitação (STRASSER et al., 2004). Assim, pode-se inferir que as baixas temperaturas promoveram maximização da conectividade dos componentes do FSII, ou mesmo tornando centro de reação não-redutores de QA em centros de reação ativos, principalmente no maior período de exposição.
: Diferença cinética da fluorescência da clorofila a de plantas de híbridos de canola Hyola 43, submetidas à temperatura de 4 ou 0ºC pelo período de 1 ou 4 horas (a, c, e, g) e após recuperação por 1 hora em temperatura ambiente (b, d, f, h).
Nas figuras 2c e 2d, verifica-se a diferença cinética entre os passos O (50µs) e
e , respectivamente, e identifica-se a presença da banda K negativa (~300μs) em todos os tratamentos. Segundo YUSUF et al. (2010), quando a banda K é positiva, há inativação do complexo de evolução de oxigênio e/ou aumento do tamanho da antena funcional do FSII, sendo que, no presente trabalho, não foi identificada banda K positiva quando as plantas foram submetidas às baixas temperaturas. O período de recuperação tornou mínimas as diferenças cinéticas entre os tratamentos e os controles, exceto quando as plantas permaneceram por 1h a 0oC e retornaram à temperatura ambiente, quando foi identificada a presença da banda K positiva.Na fase O-I, os valores de fluorescência normalizados como WOI (Figura 2e e 2f) permitem, quando WOI<1, avaliar a sequência de eventos que ocorre a partir da captura do éxciton pelo FSII até a redução da plastoquinona. Para a fase I-P, os dados foram normalizados como WIP (Figuras 2g e 2h), sendo definida a meia-vida quando WIP = 0,5. Admitindo-se que, o inverso da meia vida é a constante global de redução do pool de aceptores finais de elétrons do FSI (YUSUF et al., 2010), todos os tratamentos de baixa temperatura apresentaram menores constantes de taxa quando comparados ao controle.
A partir dos dados obtidos, duas observações importantes podem ser feitas: i. a forma da transiente OJIP, registrada nas folhas de plantas de canola submetidas ao frio, difere da registrada em folhas de plantas não tratadas e ii. a alteração dos transientes em função do estresse foi semelhante em todos os híbridos estudados. O frio, em plantas de canola, resultou em aumento na intensidade de fluorescência em 2ms (passo J), o qual é geralmente interpretado como acúmulo da fração do pool de QA -, possivelmente devido a uma diminuição no transporte de elétrons além de QA - (YUSUF et al., 2010).
Os tilacoides são relatados como o principal local de dano induzido pelo frio no cloroplasto, uma vez que suas membranas perdem a capacidade de transporte de elétrons e fotofosforilação em condições de queda de temperatura, possivelmente, devido a alteração ou reorganização de componentes como polipeptídeos de membrana (BERTAMINI et al., 2007). STRAND & ÖQUIST (1988) relataram que, em Pinus sylvestris, danos nas estruturas dos tilacoides levam à inibição do fluxo de elétrons a partir de QA. Da mesma forma, RAPACZ (2007) verificou que alterações na fluorescência da clorofila de plantas de trigo, observadas diretamente após baixas temperaturas, foram provocadas pelo fluxo de energia a partir de QA.
Embora a eficiência do transporte de elétrons para os aceptores finais do FSI tenha sido favorecida, pode-se verificar, baseado na fluorescência variável na fase I-P e na taxa global de redução dos aceptores finais de elétrons, decréscimo na redução dos aceptores de elétrons finais do lado aceptor do FSI. Tal resultado, além da possível relação com a limitação do fluxo de elétrons a partir de QA, pode ser explicado pelo fluxo de elétrons cíclico do FSI, onde a ferredoxina reduzida, o aceptor final do FSI, transfere seus elétrons de volta para o pool de plastoquinona, através de NADPH ou diretamente para o complexo Cytb6f, sendo um processo acoplado à translocação de prótons e formação de ATP (JOLIOT & JOLIOT, 2002).
CONCLUSÃO:
Os híbridos de Brassica napus L. testados demonstram comportamentos semelhantes em resposta às baixas temperaturas. Os parâmetros relacionados ao grau de reoxidação do aceptor final de elétrons do FSII, e aqueles que descrevem atividade do FSI, são os mais responsivos às condições impostas pelo frio.
AGRADECIMENTOS
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), à Fundação de Amparo à Pesquisa do Rio Grande do Sul (FAPERGS) e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
Referências bibliográficas
-
BERTAMINI, M. et al. Low night temperature effects on photosynthetic
performance on two gravepine genotypes. Biologia Plantarum, v.51, p.381-385, 2007.
Disponível em: <http://link.springer.com/article/10.1007%2Fs10535-007-0080-2>.
Acesso em: 14 out. 2013. doi: 10.1007/s10535-007-0080-2.
» https://doi.org/10.1007/s10535-007-0080-2» http://link.springer.com/article/10.1007%2Fs10535-007-0080-2 -
BRESTICA, M. et al. Photosystem II thermostability in situ:
environmentally induced acclimation and genotype-specific reactions in Triticum
aestivum. Plant Physiology and Biochemistry, v.57, p.93-105, 2012. Disponível em:
<http://dx.doi.org/10.1016/j.plaphy.2012.05.012>. Acesso em: 20 fev. 2014. doi:
10.1016/j.plaphy.2012.05.012.
» https://doi.org/10.1016/j.plaphy.2012.05.012» http://dx.doi.org/10.1016/j.plaphy.2012.05.012 -
CHINNUSAMY, V. et al. Cold stress regulation of gene expression in
plants. Trends in Plant Science, v.12, p.444-451, 2007. Disponível em:
<http://dx.doi.org/10.1016/j.tplants. 2007.07.002>. Acesso em: 07 out. 2013.
doi: 10.1016/j.tplants.2007.07.002.
» https://doi.org/10.1016/j.tplants.2007.07.002» http://dx.doi.org/10.1016/j.tplants. 2007.07.002 -
CONAB. Acompanhamento da safra brasileira: grãos, safra 2011/2012.
Companhia Nacional de Abastecimento, 2012. Disponível
em:<http://www.conab.gov.br>. Acesso em: 05 nov. 2013.
» http://www.conab.gov.br -
DALMAGO, G.A. et al. Aclimatação ao frio e dano por geada em canola.
Pesquisa Agropecuária Brasileira, v.45, p.933-943, 2010. Disponível em:
<http://www.scielo.br/pdf/ pab/v45n9/a01v45n9.pdf>. Acesso em: 07 out. 2013.
doi: 10.1590/S0100-204X2010000900001.
» https://doi.org/10.1590/S0100-204X2010000900001» http://www.scielo.br/pdf/ pab/v45n9/a01v45n9.pdf -
GARSTKA, M. et al. Contrasting effect of dark-chilling on chloroplast
structure and arrangement of chlorophyll-protein complexes in pea and tomato: plants
with a different susceptibility to non-freezing temperature. Planta, v.226,
p.1165-1181, 2007. Disponível em:
<http://link.springer.com/article/10.1007%2Fs00425-007-0562-7>. Acesso em: 02
maio 2014. doi: 10.1007/s00425-007-0562-7.
» https://doi.org/10.1007/s00425-007-0562-7» http://link.springer.com/article/10.1007%2Fs00425-007-0562-7 - HOAGLAND, D.; ARNON, D.I. The water culture method for growing plants without soil. Berkeley: California Agriculture Experiment Station Circular, 347p. 1950.
-
HUGHES, M.A.; DUNN, M.A. The molecular biology of plant acclimation to
low temperature. Journal of Experimental Botany, v.47, p.291-305, 1996. Disponível
em: <http://jxb.oxfordjournals.org/content/47/3/291.short>. Acesso em: 02 maio
2014. doi: 10.1093/jxb/47.3.291.
» https://doi.org/10.1093/jxb/47.3.291» http://jxb.oxfordjournals.org/content/47/3/291.short -
HUNER, N.P.A. et al. Photostasis in plants, green algae and
cyanobacteria: the role of light harvesting antenna complexes. In: GREEN, B.R.;
PARSON, W.W. (Eds.). Advances in photosynthesis and respiration light harvesting
antennas in photosynthesis. Dordrecht: Kluwer Academic Publishers, 2003. p.401-421.
Disponível em: <http://link.springer.com/
chapter/10.1007%2F978-94-017-2087-8_14>. Acesso em: 02 maio 2014.
» http://link.springer.com/ chapter/10.1007%2F978-94-017-2087-8_14 -
JOLIOT, P.; JOLIOT, A. Cyclic electron transfer in plant leaf.
Proceedings of the National Academy of Sciences of the United States of America,
v.99, p.10209-10214, 2002. Disponível em:
<http://www.ncbi.nlm.nih.gov/pmc/articles/PMC126649/pdf/pq1502010209>. pdf.
Acesso em: 09 set. 2013. doi: 10.1073/pnas.102306999.
» https://doi.org/10.1073/pnas.102306999» http://www.ncbi.nlm.nih.gov/pmc/articles/PMC126649/pdf/pq1502010209 -
MCCLINCHEY, S.L.; KOTT, L.S. Production of mutants with high cold
tolerance in spring canola (Brassica napus). Euphytica, v.162, p.51-67, 2008.
Disponível em: <http://link.springer.com/article/10.1007%2Fs10681-007-9554-8>.
Acesso em: 44 out. 2013. doi: 10.1007/s10681-007-9554-8.
» https://doi.org/10.1007/s10681-007-9554-8.» http://link.springer.com/article/10.1007%2Fs10681-007-9554-8 -
PALVA, E.T. el al. Cold acclimation and development of freezing and
drought tolerance in plants. Acta Horticulturae, v.560, p.277-284, 2001. Disponível
em: <http://www.actahort.org/books/560/560_53.htm>. Acesso em: 02 maio 2014.
» http://www.actahort.org/books/560/560_53.htm -
RAPACZ, M. Chlorophyll a fluorescence transient during freezing and
recovery in winter wheat. Photosynthetica, v.45, p.409-418, 2007. Disponível em:
<http://link.springer.com/ article/10.1007%2Fs11099-007-0069-2>. Acesso em: 29
ago. 2013. doi: 10.1007/s11099-007-0069-2.
» https://doi.org/10.1007/s11099-007-0069-2» http://link.springer.com/ article/10.1007%2Fs11099-007-0069-2 -
STIRBET, A.; GOVINDJEE. On the relation between the Kautsky effect
(chlorophyll a fluorescence induction) and Photosystem II: Basics and applications of
the OJIP fluorescence transient. Journal of Photochemistry and Photobiology B:
Biology, v.104, p. 236-257, 2011. Disponível em:
<http://dx.doi.org/10.1016/j.jphotobiol.2010.12.010>. Acesso em: 20 fev. 2014.
doi: 10.1016/j.jphotobiol.2010.12.010.
» https://doi.org/10.1016/j.jphotobiol.2010.12.010» http://dx.doi.org/10.1016/j.jphotobiol.2010.12.010 -
STITT, M.; HURRY, V. A plant for all seasons: alterations in
photosynthetic carbon metabolism during cold acclimation in Arabidopsis. Current
Opinion in Plant Biology, v.5, p.199-206, 2002. Disponível em:
<http://www.sciencedirect.com/science/article/pii/ S1369526602002583>. Acesso
em: 02 maio, 2014. doi: 10.1016/S1369-5266(02)00258-3.
» https://doi.org/10.1016/S1369-5266(02)00258-3» http://www.sciencedirect.com/science/article/pii/ S1369526602002583 -
STRAND, M.; ÖQUIST, G. Effects of frost hardening, dehardening and
freezing stress on in vivo chlorophyll fluorescence of seedlings of Scots pine (Pinus
sylvestris L.). Plant Cell Environment, v.11, p.231-238, 1988. Disponível em:
<http://onlinelibrary.wiley.com/doi/10. 1111/j.1365-3040.1988.tb01141.x/pdf>.
Acesso em: 02 out. 2013. doi: 10.1111/j.1365-3040.1988.tb01141.x.
» https://doi.org/10.1111/j.1365-3040.1988.tb01141.x» http://onlinelibrary.wiley.com/doi/10. 1111/j.1365-3040.1988.tb01141.x/pdf - STRASSER, B.J.; STRASSER, R.J. Measuring fast fluorescence transient to address environmental questions: the JIP-test. In: MATHIS, P. (Ed.). Photosynthesis: from light to biosphere. Dordrecht: Kluwer Academic Publisher, 1995. p.977-980.
- STRASSER, R.J. et al. Analysis of the fluorescence transient. In: PAPAGEORGIOU, G.C.; GOVINDJEE (Eds.). Chlorophyll fluorescence: a signature of photosynthesis. Advances in Photosynthesis and Respiration Series. Netherlands: Springer, 2004. p.321-362.
-
STRASSER, R.J.; STIRBET, A.D. Heterogeneity of photosystem II probed by
the numerically simulated chlorophyll a fluorescence rise (O-J-I-P). Mathematics and
Computers in Simulation, v.48, p.3-9, 1998. Disponível em:
<http://dx.doi.org/10.1016/ S0378-4754(98)00150-5>. Acesso em: 27 set. 2013.
doi: 10.1016/S0378-4754(98)00150-5.
» https://doi.org/10.1016/S0378-4754(98)00150-5» http://dx.doi.org/10.1016/ S0378-4754(98)00150-5 -
TOMM, G.O. et al. Panorama atual e indicações para aumento de eficiência
da produção de canola no Brasil. Documento 118. 2009. Disponível em
<http://www.cnpt.embrapa.br/biblio/ do/p_do118.pdf >. Acesso em: 24 fev.
2014.
» http://www.cnpt.embrapa.br/biblio/ do/p_do118.pdf -
YUSUF, M.A. et al. Overexpression of γ-tocopherol methyl transferase
gene in transgenic Brassica juncea plants alleviates abiotic stress: physiological
and chlorophyll a fluorescence measurements. Biochimica et Biophysica Acta, v.1797,
p.1428-1438, 2010. Disponível em:
<http://dx.doi.org/10.1016/j.bbabio.2010.02.002>. Acesso em: 13 out. 2013. doi:
10.1016/j.bbabio.2010.02.002.
» https://doi.org/10.1016/j.bbabio.2010.02.002» http://dx.doi.org/10.1016/j.bbabio.2010.02.002
Datas de Publicação
-
Publicação nesta coleção
28 Out 2014 -
Data do Fascículo
Fev 2015
Histórico
-
Recebido
27 Out 2013 -
Aceito
27 Jun 2014

 Baixas temperaturas sobre a fluorescência da clorofila a em plantas de
diferentes híbridos de canola
Baixas temperaturas sobre a fluorescência da clorofila a em plantas de
diferentes híbridos de canola