Resumos
As amilases estão entre as mais importantes enzimas industriais e são de grande interesse na biotecnologia atual. Embora elas possam ser derivadas de diversas fontes, as de origem microbiana são geralmente as mais procuradas pelas indústrias. As espécies do gênero Bacillus são consideradas as principais fontes de amilases. Apesar disso, a busca por novas fontes microbianas vem crescendo em todo o mundo. O presente estudo objetivou avaliar a produção de amilase por rizóbios nativos, usando farinha de pupunha como substrato. Neste estudo, foi adotado o delineamento experimental inteiramente casualizado, com três repetições. Foram determinados ainda os coeficientes de correlação de Pearson entre as variáveis pH do meio, proteína extracelular, biomassa celular, diâmetro médio da colônia (DMC), diâmetro médio do halo (DMH), índice enzimático (IE) e atividade amilolítica das bactérias selecionadas. Dos 19 isolados com atividade amilolítica em meio YMA modificado, sete (36,8%) exibiram "IE" > 2,1, o que permite considerá-los bons produtores de amilase. Os "IE" apresentados pelos isolados INPA R-987, 950 e 915B foram significativamente inferiores (p < 0,01) aos mostrados pelas bactérias INPA R-926, 975 e 957. A atividade amilolítica variou significativamente (p < 0,01) entre as bactérias investigadas. Os isolados INPA R-975 e R-926 apresentaram, respectivamente, a maior (1,00 U.min-1.mL-1) e a menor (0,31 U.min-1.mL-1) média de atividade. Em termos gerais, a proteína extracelular correlacionou-se positivamente com "IE" (r = 0,52*; p < 0,05) e "DMH" (r = 0,55*; p < 0,05). A biomassa celular apresentou correlações positivas com atividade amilolítica (r = 0,55*; p < 0,05) e "DMH" (r = 0,54*; p < 0,05) e negativa com o pH final do meio de cultivo (r = 0,93**; p < 0,01).
atividade amilolítica; rizóbios; farinha de pupunha; Amazônia Central
Amylases are among the most important industrial enzymes and are of great significance in present-day biotechnology. Although they can be derived from various sources, enzymes from microbial sources are generally the most required by industry. Species of the genus Bacillus are considered to be the main sources of amylases, although screening for new microbial sources is increasing all over the world. The objective of the present study was to evaluate the production of amylase by indigenous rhizobia, using peach palm flour as substrate. In this study, a completely randomized experimental design was adopted with three replicates. Pearson's correlation coefficients were calculated for medium pH, extracellular protein, cellular biomass, mean colony diameter (MCD), mean halo diameter (MHD), enzymatic index (EI) and amylolytic activity variables from the bacteria selected. Out of the 19 rhizobia strains with amylolytic activity on modified YMA, seven (36.8%) strains showed "EI" > 2,1, and they were considered as good producers of amylase. The "IE" presented by bacteria INPA R-987, R-950 and R-915B were significantly lower (p < 0.01) than those shown by the INPA R-926, R-975 and R-957. The amylolytic activity varied significantly (p < 0.01) among the rhizobia strains. INPA R-975 and R-926 strains presented, respectively, the highest (1.00 U.min-1.mL-1) and the lowest (0.31 U.min¹.mL-1) activity average. In general terms, the extracellular protein was correlated positively with "EI" (r = 0.52*; p < 0.05) and "MHD" (r = 0.55*; p < 0.05). The cellular biomass showed positive correlations with amylolytic activity (r = 0.55*; p < 0.05) and "MHD" (r = 0.54*; p < 0.05), and a negative with final pH medium (r = 0.93**; p < 0.01).
amylolytic activity; rhizobia; peach palm flour; Central Amazonian
Produção de amilase por rizóbios, usando farinha de pupunha como substrato
Production of amylase by rhizobia using peach palm flour as substrate
Arlem Nascimento de OliveiraI, * * A quem a correspondência deve ser enviada ; Luiz Antonio de OliveiraII; Jerusa Souza AndradeIII; Aloisio Freitas Chagas-JúniorI
ICoordenação de Pesquisas em Ciências Agronômicas CPCA, Instituto Nacional de Pesquisas da Amazônia INPA, Universidade Federal do Amazonas UFAM, Av. André Araújo, 2936, Aleixo, CEP 69060-001, Manaus - AM, Brasil, E-mail: arllem@yahoo.com.br
IIInstituto Nacional de Pesquisas da Amazônia, Coordenação de Pesquisas em Ciências Agronômicas CPCA, Instituto Nacional de Pesquisas da Amazônia INPA, E-mail: luizoli@inpa.gov.br
IIIInstituto Nacional de Pesquisas da Amazônia INPA, Coordenação de Pesquisas em Tecnologia de Alimentos CPTA, E-mail: andrade@inpa.gov.br
RESUMO
As amilases estão entre as mais importantes enzimas industriais e são de grande interesse na biotecnologia atual. Embora elas possam ser derivadas de diversas fontes, as de origem microbiana são geralmente as mais procuradas pelas indústrias. As espécies do gênero Bacillus são consideradas as principais fontes de amilases. Apesar disso, a busca por novas fontes microbianas vem crescendo em todo o mundo. O presente estudo objetivou avaliar a produção de amilase por rizóbios nativos, usando farinha de pupunha como substrato. Neste estudo, foi adotado o delineamento experimental inteiramente casualizado, com três repetições. Foram determinados ainda os coeficientes de correlação de Pearson entre as variáveis pH do meio, proteína extracelular, biomassa celular, diâmetro médio da colônia (DMC), diâmetro médio do halo (DMH), índice enzimático (IE) e atividade amilolítica das bactérias selecionadas. Dos 19 isolados com atividade amilolítica em meio YMA modificado, sete (36,8%) exibiram "IE" > 2,1, o que permite considerá-los bons produtores de amilase. Os "IE" apresentados pelos isolados INPA R-987, 950 e 915B foram significativamente inferiores (p < 0,01) aos mostrados pelas bactérias INPA R-926, 975 e 957. A atividade amilolítica variou significativamente (p < 0,01) entre as bactérias investigadas. Os isolados INPA R-975 e R-926 apresentaram, respectivamente, a maior (1,00 U.min-1.mL-1) e a menor (0,31 U.min-1.mL-1) média de atividade. Em termos gerais, a proteína extracelular correlacionou-se positivamente com "IE" (r = 0,52*; p < 0,05) e "DMH" (r = 0,55*; p < 0,05). A biomassa celular apresentou correlações positivas com atividade amilolítica (r = 0,55*; p < 0,05) e "DMH" (r = 0,54*; p < 0,05) e negativa com o pH final do meio de cultivo (r = 0,93**; p < 0,01).
Palavras-chave: atividade amilolítica; rizóbios; farinha de pupunha; Amazônia Central.
ABSTRACT
Amylases are among the most important industrial enzymes and are of great significance in present-day biotechnology. Although they can be derived from various sources, enzymes from microbial sources are generally the most required by industry. Species of the genus Bacillus are considered to be the main sources of amylases, although screening for new microbial sources is increasing all over the world. The objective of the present study was to evaluate the production of amylase by indigenous rhizobia, using peach palm flour as substrate. In this study, a completely randomized experimental design was adopted with three replicates. Pearson's correlation coefficients were calculated for medium pH, extracellular protein, cellular biomass, mean colony diameter (MCD), mean halo diameter (MHD), enzymatic index (EI) and amylolytic activity variables from the bacteria selected. Out of the 19 rhizobia strains with amylolytic activity on modified YMA, seven (36.8%) strains showed "EI" > 2,1, and they were considered as good producers of amylase. The "IE" presented by bacteria INPA R-987, R-950 and R-915B were significantly lower (p < 0.01) than those shown by the INPA R-926, R-975 and R-957. The amylolytic activity varied significantly (p < 0.01) among the rhizobia strains. INPA R-975 and R-926 strains presented, respectively, the highest (1.00 U.min-1.mL-1) and the lowest (0.31 U.min1.mL-1) activity average. In general terms, the extracellular protein was correlated positively with "EI" (r = 0.52*; p < 0.05) and "MHD" (r = 0.55*; p < 0.05). The cellular biomass showed positive correlations with amylolytic activity (r = 0.55*; p < 0.05) and "MHD" (r = 0.54*; p < 0.05), and a negative with final pH medium (r = 0.93**; p < 0.01).
Keywords: amylolytic activity; rhizobia; peach palm flour; Central Amazonian.
1 Introdução
O amido, principal polissacarídeo de reserva dos vegetais, é degradado por enzimas amilolíticas de vários microrganismos20. As amilases estão entre as mais importantes enzimas industriais e são de grande importância na biotecnologia atual26. Além de serem usadas como aditivos em detergentes, elas podem ser empregadas na sacarificação do amido e nas indústrias de alimentos, fermentação, papel e têxtil. Com o advento de novas fronteiras biotecnológicas, o espectro de aplicação das amilases tem se expandido para muitas outras áreas, incluindo a clínica, farmacêutica, médica e químico-analítica26.
As amilases ocorrem amplamente em animais, plantas e microrganismos. Entretanto, devido às vantagens que oferecem, como menor tempo de produção, as amilases microbianas têm a preferência do mercado de enzimas28. O gênero Bacillus é um dos mais importantes e investigados grupos de bactérias produtoras de amilase comercial26. Porém, programas para selecionar novas fontes microbianas estão crescendo ao redor do mundo6,33,34.
Entre os vários parâmetros que estimulam a produção de amilases, as condições de crescimento microbiano e os substratos de carbono usados no meio de cultivo têm recebido atenção especial. Fontes de carbono como dextrina, frutose, glicose, lactose, maltose, amido solúvel, além de outras, encarecem sua produção12. No meio de cultivo, esses substratos podem ser substituídos por subprodutos agrícolas de baixo custo, o que torna o processo de produção dessas enzimas mais econômico. Com esse objetivo, farinhas e farelos de diferentes grãos e tubérculos como arroz, cevada, milho, trigo, mandioca e batata têm sido usadas no meio de cultura para aumentar a produtividade de amilases de fungos e bactérias12,13,27.
Palmeira nativa dos trópicos americanos, a pupunheira (Bactris gasipaes Kunth) produz frutos comestíveis de alto valor nutritivo39, os quais estão completamente integrados à dieta alimentar dos amazônidas8,22. Os frutos são consumidos cozidos e prestam-se à extração de óleo ou à produção de farinhas para as mais variadas finalidades10. Segundo CLEMENT7, a composição média de carboidratos nos frutos pode variar de 59,7 a 81,0% em base seca, o que evidencia a potencialidade de seus subprodutos como fonte de amido para a produção de amilases por microrganismos amilolíticos. Nesse sentido, o presente estudo visou avaliar o uso da farinha de pupunha na produção de amilase por isolados de rizóbio nativos da Amazônia Central.
2 Material e métodos
2.1 Obtenção da farinha de pupunha
Os frutos de 15 tipos de pupunha foram obtidos no mercado municipal Adopho Lisboa e processados em farinha com casca e sem caroço nas dependências da Coordenação de Pesquisas em Tecnologia de Alimentos do Instituto Nacional de Pesquisas da Amazônia (CPTA/INPA). Detalhes referentes à obtenção da farinha podem ser encontrados no estudo de ANDRADE3. A composição média da farinha de pupunha pode ser observada na Tabela 1.
2.2 Coleta de solo e isolamento dos rizóbios
Foram coletadas amostras de solos de várzea e de terra preta de índio como fontes potenciais de inóculo de rizóbia em algumas propriedades rurais dos Municípios de Careiro da Várzea e Manacapuru, ambos no Estado do Amazonas. Os solos foram obtidos das rizosferas de cultivos de feijão, mandioca, couve, jerimum, pepino, quiabo, além de algumas gramíneas, a uma profundidade máxima de 10 cm.
Como substrato, misturou-se 30 g de solo-inóculo com 900 g de areia previamente esterilizada (lavada e autoclavada a 121 °C por 60 minutos). Nesse substrato, plantas de feijão caupi e soja (plantas-iscas) foram irrigadas diariamente com água estéril e nutridas, a cada dois dias, com 50 mL de solução nutritiva25. Ao final de 45 dias de crescimento, os nódulos das plantas foram coletados e as bactérias isoladas de acordo com VINCENT38.
2.3 Atividade amilolítica dos rizóbios em meio sólido
Para testar a habilidade dos rizóbios em produzir amilase em meio sólido, colônias puras de diferentes isolados foram repicadas para o centro de placas de Petri contendo meio YMA (yeast manitol agar)38 modificado, no qual o manitol foi substituído na mesma concentração por amido de milho (maizena®). Após quatro dias de incubação das bactérias nesse meio, adicionou-se, em cada placa, 5 mL de tintura de iodo. Uma zona amarelada ao redor da colônia, em contraste com o meio azulado (Figura 1), indicou atividade amilolítica6.
A atividade amilolítica dos isolados foi estimada mediante um indice enzimático (IE) que expressa a relação do diâmetro médio do halo de hidrólise e o diâmetro médio da colônia14. A partir desses índices, avaliou-se em meio líquido, apenas a produção amilolítica das bactérias que apresentaram "IE" > 2,4 (INPA R-926, R-957, R-975 e R-991). Nesse experimento, usou-se o meio YM38 modificado, com a farinha de pupunha (1%, peso/volume) sendo a única fonte de carbono.
2.4 Preparação do sobrenadante enzimático dos isolados selecionados
Em frascos de Erlenmeyer contendo 30 mL do meio supracitado (esterilizado a 121 °C por 20 minutos), inoculou-se 1 mL de suspensão bacteriana (INPA R-926 = 1,4 x 109 UFC; INPA R-975 = 1,3 x 109 UFC; INPA R-957 = 109 UFC; INPA R-991 = 1,8 x 109 UFC). Após a inoculação, os frascos foram incubados em um agitador rotatório (100 rpm) a 28 °C, por três (INPA R-926, R-975 e R-957) e cinco dias (INPA R-991). Ao final dessa etapa, as células foram colhidas por centrifugação a 10000 rpm por 10 minutos, a 28 °C. O sobrenadante obtido foi usado para avaliar a atividade enzimática, teores de proteína e pH.
2.5 Processos analíticos
A atividade amilolítica foi avaliada quantificando-se os açúcares redutores23 liberados durante a reação, usando-se amido de milho (maizena®) gelatinizado como substrato. A mistura de reação conteve 0,35 mL de solução de amido 1%, 0,35 mL de tampão fosfato 0,05 M, pH 6,5 e 0,3 mL de sobrenadante enzimático. O branco de reação consistiu-se de 0,35 mL de solução de amido 1% e 0,65 mL de tampão fosfato 0,05 M, pH 6,5. Após incubação por 30 minutos, a 37 °C, a reação foi paralisada em água fervente, seguida de resfriamento em banho gelado. Uma unidade de amilase (U) foi definida como a quantidade de sobrenadante enzimático necessário para liberar um mmol de glicose por minuto nas condições experimentais descritas anteriormente. A proteína foi determinada pelo método do biureto11, usando-se albumina de soro bovino (BSA) na elaboração da curva padrão.
2.6 Produção de biomassa e determinação do pH
A massa celular foi avaliada após pré-pesagens de tubos eppendorf vazios com volume para 2 mL de meio. As células obtidas após centrifugação foram secas por uma noite a 110 °C e, em seguida, pesadas. A biomassa (g.L-1) foi o resultado da diferença entre os pesos final e inicial dos tubos (balança com 0,0001 g de precisão). O pH do meio foi determinado com o uso de um eletrodo de vidro (HM 7B, TOA, Japan).
2.7 Análises estatísticas
Para detectar diferenças nos valores médios dos tratamentos arranjados ao acaso, os dados obtidos de três repetições foram submetidos à análise de variância e ao teste de Tukey, usando-se o Sistema de Análise Estatística ESTAT 2,0. Determinaram-se, ainda, as correlações de Pearson entre as variáveis pH final do meio, proteína extracelular, biomassa celular, diâmetros médios do halo (DMH) e da colônia (MDC), índice enzimático (IE) e atividade amilolítica das bactérias selecionadas. As análises de correlação foram processadas no programa Estatistica (StatSoft; Tulsa, USA).
3 Resultados e discussão
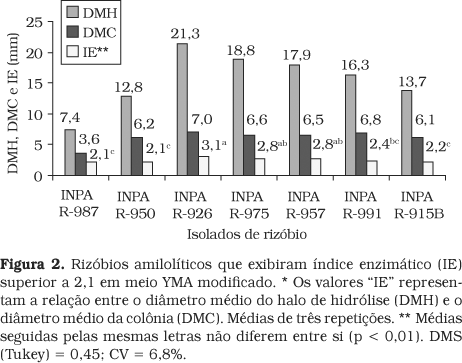
Para considerar um microrganismo como um bom produtor de enzimas extracelulares em meio sólido, LEALEM e GASHE18 indicam um índice enzimático (IE) > 2,0. Nesse experimento, dos 19 isolados com atividade amilolítica em meio YMA modificado (dados não mostrados), sete (36,8%) exibiram IE > 2,1 (Figura 2), o que permite considerá-los como bons produtores de amilase. Comparativamente, os "IE" apresentados pelas bactérias INPA R-987, R-950 e R-915B foram significativamente inferiores aos mostrados por INPA R-926, R-975 e R-957 (Figura 2). Entre as que mostraram maiores "IE", apenas INPA R-991 foi isolada dos nódulos da soja.
A habilidade de rizóbios em degradar amido tem sido discutida em alguns trabalhos. Estudos como os de BERTHELOT e DELMOTTE5, SINGH e SINGH30 e VAN SPRONSEN et al.37 sugerem uma possível participação de algumas glicosidases, como as amilases, no estabelecimento intracelular da simbiose leguminosa versus rizóbia. Esse é o primeiro relato da ocorrência da enzima amilase em rizóbios nativos da Amazônia Central.
A produção de amilase, proteína extracelular e a taxa de crescimento dos isolados INPA R-926, R-950, R-957 e R-991 foram investigadas em meio YM modificado, contendo farinha de pupunha como substrato. Excetuando-se o isolado INPA R-991 que elevou o pH final, os demais acidificaram o meio de cultivo. Os isolados INPA R-957 e R-975 foram os que mais reduziram o pH, com valor médio de 1,6 ponto (Tabela 2). A alteração do pH do meio de crescimento é um importante parâmetro fisiológico numa classificação preliminar dos rizóbios. Por exibirem crescimento rápido em meio YMA com azul de bromotimol (dois a cinco dias) e terem causado reação ácida nos meios líquido e sólido (coloração amarela), os isolados INPA R-926, R-957 e R-975 provavelmente pertençam ao gênero Rhizobium16. Ao contrário, Bradyrhizobium pode ser o gênero do qual faz parte o INPA R-991, pois, além de apresentar crescimento relativamente lento (cinco a sete dias), elevou o pH do meio líquido e alcalinizou o meio sólido (coloração azul), características fisiológicas comuns para esse táxon15,21,36.
Indiretamente, a dosagem protéica evidenciou que as bactérias possuem capacidades distintas em secretar proteína no meio de cultura. Nesse estudo, os isolados INPA R-975 e R-991 foram os que mais se destacaram quanto a essa habilidade (Tabela 2).
Apesar dos isolados INPA R-957 e R-975 terem apresentado as maiores produções de biomassa (Tabela 2), esses valores ficaram abaixo dos resultados de um cultivo em garrafão de Rhizobium leguminosarum bv. phaeoli, que, após 29 horas de cultivo, alcançou uma biomassa celular de 4,0 g.L-136. A biomassa de 0,73 g.L-1 atingida pelo isolado INPA R-991 também foi inferior à anotada para Bradyrhizobium japonicum. Nesse estudo, em 72 horas de cultivo, URENHA et al.36 observaram uma produção de biomassa de quase 1,7 g.L-1. Vale a pena mencionar que, nesse experimento, a fonte de carbono usada foi o glicerol, considerado um das preferências para a produção de biomassa por essa bactéria.
De acordo com os dados das Tabelas 2 e 3, os resultados de biomassa obtidos nesse estudo não estão necessariamente associados aos conteúdos protéicos dos isolados, uma vez que, em termos comparativos, o INPA R-957, terceiro em conteúdo protéico extracelular, foi o que mais produziu biomassa celular. O mesmo comportamento, porém inverso, foi registrado para o INPA R-926, que apresentou a terceira maior biomassa e o menor teor de proteína extracelular. Por outro lado, a bactéria INPA R-991 isolada da soja, apresentou os menores níveis protéicos e de biomassa no meio YM modificado (Tabela 2).
A atividade amilolítica variou de 0,31 a 1,00 U.min-1.mL1, resultando em diferenças significativas entre as bactérias investigadas. Os isolados INPA R-975 e R-926 apresentaram, respectivamente, a maior e a menor média de atividade (Tabela 2). Por falta de estudos envolvendo a produção de amilases por rizóbios, principalmente nas condições experimentais avaliadas, é difícil estabelecer comparações, sobretudo dentro do mesmo grupo microbiano.
Segundo PANDEY et al.26, o gênero Bacillus é considerado a principal fonte de amilases microbianas. Comparativamente, a atividade de 1,00 U mostrada pelo isolado INPA R-957 é inferior à registrada para algumas espécies de Bacillus, como B. subtilis29 e B. licheniformis SPT 27 [1], que produziram, em meios e condições otimizados, 535 e 252 U, respectivamente; porém, superior a de outras bactérias, como B. coagulans e B. circulans2, Aeromonas e Pseudomonas35, que produziram abaixo desse nível.
Os coeficientes de correlação de Pearson revelaram seis correlações significativas, das quais cinco foram positivas e uma negativa (Tabela 3). Ainda que alguns autores tenham documentado a existência de correlação positiva e linearmente significativa entre proteína extracelular e atividade amilolítica de alguns fungos24 e bactérias17, essa não ocorreu quando se avaliam conjuntamente os isolados. Porém, excluindo-se da análise o INPA R-926, estabeleceu-se uma relação altamente significativa (r = 0,85; p < 0,01). Portanto, é provável que, no sobrenadante enzimático dessa bactéria, possam estar presentes, além de amilase, outras substâncias ou mesmo enzimas que podem estar inibindo a atividade amilolítica. Embora não tenha diferido significativamente da atividade das amilases produzida pelos isolados INPA R-975 e R-991, o R-926 apresentou a menor atividade enzimática (Tabela 3).
A proteína extracelular foi correlacionada também com o índice enzimático (IE, r = 0,52; p < 0,05) e diâmetro médio do halo (DMH, r = 0,55; p < 0,05), indicando que parte das proteínas extracelulares secretadas possui atividade amilolítica. Neste trabalho, o registro de uma forte correlação entre "IE" e "DMH" (r = 0,86; p < 0,01) confirma relatos anteriores18,32. Contudo, vale mencionar que, apesar da estreita relação entre as variáveis "DMH" e "IE", elas não estão significativamente relacionadas com o diâmetro médio da colônia (DMC) (Tabela 3). Similarmente, não houve correlação significativa entre atividade enzimática, "DMH", "DMC" e "IE" (Tabela 3). Quando se excluem da análise os isolados INPA R-926 e R-975, observa-se uma correlação positiva e significativa entre atividade enzimática e "DMH" (r = 0,79; p < 0,05). Essa relação também tem sido anotada para a endopoligalacturonase do fungo Peacilomyces clavisporus31.
A biomassa celular estabeleceu correlação significativa com a atividade amilolítica (r = 0,55; p < 0,05) e negativa com o pH final do meio (r = 0,93; p < 0,01). A correlação inversa entre a biomassa celular e o pH do meio (Tabela 3), além de ser esperada, confirma os estudos de BALLATI4, segundo os quais, o pH exerce uma forte influência na produção de biomassa de rizóbios, e que essa influência é dependente das estirpes estudadas. A correlação da biomassa celular com atividade enzimática da amilase registrada neste estudo foi igualmente constatada por STAMFORD et al.33 em Nocardiopsis sp., FOSSI et al.9 em leveduras, e por HAQ et al.13 em Bacillus licheniformis.
4 Conclusões
-
Os isolados de rizóbio INPA R-991, R-957, R-975 e R-926 são considerados bons produtores de amilase extracelular em meio YMA modificado;
-
A farinha de pupunha estimulou a maior produção de biomassa dos isolados INPA R-957 e R-975, com o INPA-R-957 também se destacando como maior produtor de amilase;
-
A atividade amilolítica das bactérias está positivamente associada com a produção de biomassa;
-
As análises de correlação conjunta dos dados não revelaram associações significativas entre diâmetro médio do halo e proteína extracelular com a produção de amilase das bactérias investigadas.
Agradecimentos
Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (Processo: 474007/2003-0), pela concessão de recursos financeiros à realização desse trabalho. O primeiro autor mostra-se grato, também, à Superintendência da Zona Franca de Manaus (Suframa), pela concessão da bolsa de doutorado.
Recebido para publicação em 15/12/2005
Aceito para publicação em 24/1/2007 (001652)
- 1. AIYER, P. V. Effect of C:N ratio on alpha amylase production by Bacillus licheniformis SPT 27. Afr. J. Biotechnol., v. 3, n. 10, p. 519-522, 2004.
- 2. AJAYI, A. O.; FAGADE, O. E. Utilization of corn starch as substrate for b-amylase by Bacillus spp. Afr. J. Biomed. Res., v. 6, n. 1, p. 37-42, 2003.
- 3. ANDRADE, J. S. Agregação de valor e conservação das matérias-primas regionais. In: Prêmio Professor Samuel Benchimol Manaus. Ministério do Desenvolvimento, Indústria e Comércio MDIC e Secretaria de Tecnologia Industrial STI, 2004. Cap. 6, p. 178-188. Brasil.
- 4. BALATTI, A. P. Producción de Inoculantes para Leguminosas, 1Ş. edição. La Pampa: Faculdad de Ciencias Exactas y Naturales de la Universidad Nacional de La Pampa, 1992. Argentina.
- 5. BERTHELOT, K.; Delmotte, F.M. Purification and Characterization of an a - Glucosidase from Rhizobium sp. (Robinia pseudoacacia L.) Strain USDA 4280. Appl. Environ. Microbiol., v. 65, n. 7, p. 2907-2911, 1999.
- 6. BUZZINI, P.; MARTINI, A. Extracellular enzymatic activity profiles in yeast and yeast-like strains isolated from tropical environments. J. Appl. Microbiol., v. 93, n. 6, p. 1020-1025, 2002.
- 7. CLEMENT, C. R. The pejibaye: a domesticated tree. Ciência Hoje Special Edition: Amazonia, 1991. p. 43-47.
- 8. CLEMENT, C. R.; Santos, L. A. Pupunha no mercado de Manaus: Preferências de consumidores e suas implicações. Rev. Bras. Frutic., v. 24, n. 3, p. 778-779, 2002.
- 9. Fossi, B. T.; Tavea, F.; Ndjouenkeu, R. Production and partial characterization of a thermostable amylase from ascomycetes yeast strain isolated from starchy soils. Afr. J. Biotechnol., v. 4, n. 1, p. 14-18, 2005.
- 10. Goia, C. H.; Andrade, J. S.; Aragão, C. G. Composição química da farinha de pupunha. Rev. Quím. Ind., v. 2, n. 2, p. 48-54, 1993.
- 11. GORNALL, A. G.; BARDAWILL, C. J.; DAVID, M. M. Determination of serum proteins by mean of biuret reaction. J. Biol. Chem., v. 177, n. 1, p. 751-756, 1949.
- 12. HAQ, I.; ASHRAF, S.; OMAR, S.; QADEER, M. A. Biosynthesis of Amyloglucosidase by Aspergillus niger using wheat bran as substrate. Pak. J. Biol. Sci., v. 5, n. 9, p. 962-964, 2002.
- 13. HAQ, I.; ASHRAF, H.; QADEER, M. A.; IQBAL, J. Pearl millet, a source of alpha amylase production by Bacillus licheniformis Bioresour. Technol., v. 96, n. 10, p. 1201-1204, 2005.
- 14. HANKIN, L.; ANAGNOSTAKIS, S. L. The use of solid media for detection of enzymes production by fungi. Mycologia, v. 67, n. 3, p. 597-607, 1975.
- 15. HUNGRIA, M. Coleta de nódulos e isolamento de rizóbio. In: HUNGRIA, M.; ARAÚJO, R. S. (Ed.). Manual de métodos empregados em estudos de microbiologia agrícola Brasília: Embrapa, 1994. Cap. 2, p. 45-61.
- 16. JORDAN, D. C. FAMILY III, Rhizobiaceae Conn 1938. In: KRIEG, N. R.; HOLT, J. G. (Ed.). Bergey's Manual of Systematic Bacteriology Baltimore: Willians & Wilkins, 1984. p. 234-244.
- 17. KIRAN, O.; ÇÖMLEKÇLOGLU, U.; Arikan, B. Effects of carbon sources and various chemicals on the production of a novel amylase from a Thermophillic Bacillus sp. K-12. Turk J. Biol., v. 29, n. 2. p. 99-103, 2005.
- 18. LEALEM, F.; GASHE, B. A. Amylase production by a gram-positive bacterium isolated from fermenting tef (Eraglostis tef). J. Appl. Bacteriol., v. 77, n. 1, p. 348-352, 1994.
- 19. LIN, J. E.; CHANG, D. C. N.; SHEN, G. J. Correlations among several screening method used for identifying wood-decay fungi that can degrade toxic chemicals. Biotechniques, v. 5, n. 4, p. 275-280, 1991.
- 20. LIN, L. L.; HSU, W. H.; CHU, W. S. A gene encoding for an a-amylase from thermophilic Bacillus sp. Strain TS-23 and its expression in Escherichia coli J. Appl. Microbiol., v. 82, n. 3, p. 325-334, 1997.
- 21. MOREIRA, F. M. S.; GILLIS, M.; POT, B.; KERSKERS, K.; FRANCO, A. A. Characterization of rhizobia isolated from different divergence groups of tropical leguminosae by comparative polyacrylamide gel eletrophoresis of their total proteins. Syst. Appl. Microbiol., v. 17, n. 1, p. 135-146, 1993.
- 22. MORA-URPI, J. Diversidad genética en pejibaye [Bactris (Guilielma) gasipaes Kunth]: Origem y domesticación. In: IV CONGRESSO SOBRE BIOLOGIA, AGRONOMIA E INDUSTRIALIZACIÓN DEL PIJUAYO, 1993. Resumo expandido... Iquitos, 1993. p. 21-29.
- 23. NELSON, N. A fotometric adaptation of Somogyi method for a determination of glucose. J. Biol. Chem., v. 153, n. 1, p. 375-380, 1944.
- 24. OLAMA, Z. A.; SABRY, S. A. Extracellular amylase synthesis by Aspergillus flavus and Penicillium purpurescence J. Islam. Acad. Sci., v. 2, n. 4, p. 272-276, 1989.
- 25. OLIVEIRA, L. A. Competitive ability of Rhizobiun leguminosarum bv. phaseoli strains 1988. 125p. Thesis (Ph.D in Soil Microbiology), University of Minnesota, United State of American.
- 26. Pandey, A.; Nigam, P.; Soccol, C. R.; Soccol, V. T.; Singh, D.; Mohan, R. Advances in microbial amylases. Biotechnol. Appl. Biochem., v. 31, n. 2, p. 135-152, 2000.
- 27. RAMESH, B.; REDDY, P. R. M, SEENAYYA, G.; REDDY, G. Effect of various flours on the production of thermostable b-amylase and pullulanase by Clostridium thermosulfurogenes SV2. Bioresour. Technol., v. 76, n. 2, p. 169-171, 2001.
- 28. REDDY, N. S.; NIMMAGADDA, A.; RAO, K. R. S. S. An overview of the microbial a-amylase family. Afr. J. Biotechnol., v. 2, n. 12, p. 645-648, 2003.
- 29. RIAZ, N.; HAQ, I.; QADEER, M. A. Characterization of a-amylase by Bacillus subtilis Int. J. Agr. Biol., v. 5, n. 3, p. 249-252, 2003.
- 30. SINGH, A. P.; SINGH, J. B. Differences in a and b-glucosidase and b-galactosidase activity among fast and slow-growing species of Rhizobium and Agrobacterium tumefaciens Microbios, v. 43, n. 2, p. 169-176, 1985.
- 31. SOUZA, J. V. B.; SILVA, E. S.; MAIA, M. L. S.; TEIXEIRA, M. F. S. Screening of fungal strains for pectinolytic activity: endopolygalacturonase production by Peacilomyces clavisporus 2A. UMIDA. 1. Process Biochem., v. 39, n. 4, p. 455-458, 2003.
- 32. STAMFORD, T. L. M.; ARAÚJO, J. M.; STAMFORD, N. P. Atividade enzimática de microrganismos isolados do jacatupé (Pachyrhizus erosus L. Urban). Ciênc. Tecnol. Aliment., v. 18, n. 4, p. 382-385, 1998.
- 33. STAMFORD, T. L. M.; STAMFORD, N. P.; COELHO, L. C. B. B.; ARAÚJO, J. M. Production and characterization of a thermostable a-amylase from Nocardiopsis sp. endophyte of yam bean. Bioresour. Technol., v. 76, n. 2, p. 137-141, 2001.
- 34. STRAUSS, M. L. A.; JOLLY, N. P.; LAMBRECHIS, M. G.; VAN RENSBURG, P. Screening for the production of extracellular hydrolytic enzymes by non-Saccharomyces wine yeasts. J. Appl. Microbiol., v. 91, n. 1, p. 182-190, 2001.
- 35. SUGITA, H.; KAWASAKI, J.; DEGUCHI, Y. Production of amylase by the intestinal microflora in cultured freshwater fish. Lett. Appl. Microbiol., v. 24, n. 2, p. 105-108, 1997.
- 36. URENHA, L. C.; PRADELLA, J. G. C.; OLIVEIRA, M. S. O.; BONOMI, A. Produção de biomassa celular de rizóbio. In: Hungria, M.; Araújo, R. S. (Ed.). Manaul de métodos empregados em estudos de microbiologia agrícola Brasília: Embrapa, 1994. Cap. 4, p. 95-137.
- 37. VAN SPRONSEN, P. C.; BAKHUISEN, R.; VAN BRUSSEL, A. A. N.; KIJNE, J. W. Cell wall degradation during infection thread formation by the root nodule bacterium Rhizobium leguminosarum is a two-step process. Eur. J. Cell Biol., v. 64, n. 1, p. 88-94, 1994.
- 38. VINCENT, J. M. A manual for the practical study of root-nodules bacteria Oxford: Brackwell Scientific Publications, 1970.
- 39. YUYAMA, L. K.; AGUIAR, J. P.; YUYAMA, K.; CLEMENT, C. R.; MACEDO, S. H.; FAVARO, D. I.; AFONSO, C.; VASCONCELLOS, M. B.; PIMENTEL, S. A.; BADOLATO, E. S.; VANNUCCHI, H. Chemical composition of the fruit mesocarp of three peach palm (Bactris gasipaes) populations grown in central Amazonia, Brazil. Int. J. Food Sci. Nutr., v. 54, n. 1, p. 49-56, 2003.
Datas de Publicação
-
Publicação nesta coleção
11 Maio 2007 -
Data do Fascículo
Mar 2007
Histórico
-
Aceito
24 Jan 2007 -
Recebido
15 Dez 2005