RESUMO:
Este estudo avaliou a toxicidade aguda e crônica de um inseticida a base de tiametoxam para peixes da espécie Pacamã (Lophisiolurus alexandri), avaliando a CL50%, além de alterações histopatológicas hepáticas em animais expostos por 96 horas e 15 dias ao inseticida. Para tanto foram utilizados 120 alevinos submetidos a cinco diferentes concentrações do inseticida (30, 60, 120, 240 e 480mg/L) por 15 dias, com dois tempos amostrais, 96 horas e 15 dias. Não houve mortalidade significativa durante todo o período experimental, no entanto os animais apresentaram alterações como vacuolização citoplasmática, congestão e necrose. A CL50% foi determinada como superior a 100mg/L, considerada praticamente não tóxico. A necrose foi a alteração melhor evidenciada nos animais expostos, com o aumento da ocorrência nos animais do teste de toxicidade crônica.
TERMOS DE INDEXAÇÃO:
Toxicidade; tiametoxam; inseticida; pacamã; Lophisiolurus alexandri; peixe
ABSTRACT:
This research evaluated acute and chronic toxicity of a thiamethoxam insecticide for Pacamã (Lophisiolurus alexandri), assessing the LC50 and liver histopathological changes in animals exposed for 96 hours and 15 days. Therefore, were used 120 fingerlings subjected to five different concentrations (30, 60, 120, 240 and 480mg/L) for 15 days with two sampling times, 96 hours and 15 days. There was no significant mortality during the experimental period, however the animals showed changes as vacuolation, congestion and necrosis. The LC50 was determined as greater than 100mg/L, considered practically non-toxic. Necrosis was the more significant change in exposed animals, with increasing occurrence in chronic toxicity test.
INDEX TERMS:
Toxicity; thiamethoxam; insecticide; pacamã; Lophisiolurus alexandri; fish
Introdução
Na última década o mercado de agrotóxicos no Brasil expandiu rapidamente, levando o país a alcançar a posição de maior consumidor mundial de agrotóxicos desde 2008 (Londres 2011Londres F. 2011. Agrotóxicos no Brasil: um guia para ação em defesa da vida. Rio de Janeiro. 190p., Rigotto et al. 2014Rigotto R.M., Vasconcelos D.P. & Rocha M.M. 2014. Uso de agrotóxicos no Brasil e problemas para a saúde pública. Cad. Saúde Pública 30(7):1-3.). Considerando diferentes regiões do Brasil, as quais fazem uso significativo de agrotóxicos, a região do submédio São Francisco, na região Nordeste do Brasil, tem se destacado como uma das principais áreas de exploração e exportação da hortifruticultura irrigada do país, tendo mais de 51% da sua população economicamente ativa empregada na agricultura. A produção de manga e uva irrigadas aparece como principais monoculturas na região e são exploradas por grandes e pequenos agricultores. Devido ao tipo de produção predominante, a principal classe de agrotóxicos utilizada na região é a inseticida (56%) e entre os agrotóxicos mais vendidos na região está um inseticida a base de tiametoxam (Bedor 2007Bedor C.N.G., Ramos L.O., Rêgo M.A.V., Pavão A.C. & Augusto L.G.S. 2007. Avaliação e reflexão da comercialização e utilização de agrotóxicos na região do submédio do Vale do São Francisco. Revta Baiana Saúde Pública 31(1):68-76.).
O tiametoxam é um inseticida neonicotinóide de segunda geração, com potencial tóxico para o meio ambiente (classe ambiental III). O mecanismo de ação do Tiametoxam ocorre por meio de ligação nos receptores nicotínicos da acetilcolina (Maienfisch 2001Maienfisch P., Angst M., Brandl F., Fischer W., Hofer D., Kayser H., Kobel W., Rindlisbacher A., Senn R.A. & Widmer H. 2001. Chemistry and biology of thiamethoxam: a second generation neonicotinoid. Pest Manag. Sci. 57(10):906-913.). Essa nova geração de inseticidas veio substituir os organofosforados e carbamatos, os quais têm diminuído a sua eficiência e vem sendo menos utilizados, em função do aumento das restrições de seu uso (Tavares 2011Tavares D.A. 2011. Análise morfológica e imunocitoquímica do cérebro de abelhas africanizadas Apis mellifera após exposição a doses subletais do inseticida tiametoxam. Dissertação de Mestrado em Biologia Celular e Molecular. Instituto de Biociências de Rio Claro, Universidade Estadual Paulista, Rio Claro. 75p.). Segundo Silva et al. (2014)Silva G.S., Albuquerque Jr E.C., Amorim Jr A.C., Ezequiel J.M. & Silva P.T.S. 2014. Avaliação da potencial contaminação das águas superficiais e subterrâneas por agrotóxicos em áreas de produção de uva para exportação no Vale do São Francisco. Anais 12º Simpósio Ítalo-Brasileiro de Engenharia Sanitária e Ambiental, Natal, p.1-7. (Resumo) o tiametoxam é um composto considerado moderadamente persistente no solo, não sofre lixiviação para água subterrânea, e possui baixo potencial de transporte em água quando associado a sedimento, porém um alto potencial quando dissolvido em água. Pouco se sabe a respeito da toxicidade de neonicotinóide para os organismos de água doce não alvo e seu potencial efeito nesse ecossistema (Uğurlu et al. 2015Uğurlu P., Ünlü E. & Satar E.I. 2015. The toxicological effects of thiamethoxam on Gammarus kischineffensis (Schellenberg, 1937) (Crustacea: Amphipoda). Environ. Toxicol. Pharmacol. 39(2):720-726.).
Tem sido indicado para uso em diversas culturas agrícolas e tem sido prospectado para o uso terapêutico em aquicultura (Carraschi et al. 2014Carraschi S.P., Barbuio R., Ikefuti C.V., Florêncio T., Cruz C. & Ranzani-Paiva M.J.T. 2014. Effectiveness of therapeutic agents in disease treatment in Piaractus mesopotamicus. Aquaculture 431(7):124-128.). Alguns autores consideram o Tiametoxam praticamente não tóxico para peixes (Maienfisch 2001Maienfisch P., Angst M., Brandl F., Fischer W., Hofer D., Kayser H., Kobel W., Rindlisbacher A., Senn R.A. & Widmer H. 2001. Chemistry and biology of thiamethoxam: a second generation neonicotinoid. Pest Manag. Sci. 57(10):906-913.), no entanto, ainda são poucos os estudos realizados sobre os efeitos do tiametoxam com esses animais.
O pacamã (Lophiosilurus alexandri) é um peixe carnívoro, de hábito bentônico, espécie não migradora e de desova parcelada (Tenório et al. 2006Tenório R.A., Santos A.J.G., Lopes J.P. & Nogueira E.M.S. 2006. Crescimento do niquim (Lophiosilurus alexandri Steindachner, 1876), em diferentes condições de luminosidade e tipos de alimentos. Acta Scientiarum, Biological Sciences 28(4):305-309.). É uma das espécies endêmicas da Bacia do Rio São Francisco (Figueiredo et al. 2014Figueiredo R.A.C.R., Souza R.C., Bezerra K.S., Campeche D.F.B., Campos R.M.L., Souza A.M. & Melo J.F.B. 2014. Relação proteína: carboidrato no desempenho e metabolismo de juvenis de pacamã (Lophiosilurus alexandri). Arq. Bras. Med. Vet. Zootec. 66(5):1567-1576.) e com crescente interesse comercial nessa região (Campeche et al. 2011Campeche D.F.B., Balzana L., Figueiredo R.C.R., Barbalho M.R.S., Reis F.J.S. & Melo J.F.B. 2011. Peixe nativo do rio São Francisco adaptado para cultivo. Documento 244, Embrapa Seminário.).
Alterações histológicas em tecidos de peixes constituem ferramentas sensíveis para detectar os efeitos tóxicos diretos de compostos químicos em órgãos-alvo e, portanto, são indicadores potentes da exposição prévia a estressores ambientais (Schwaiger et al. 1997Schwaiger J., Wanke R., Adam S., Pawert M., Honnen W. & Triebskorn R. 1997. The use of histopathological indicators to evaluate contaminant-related stress in fish. J. Aquatic Ecosystem Stress and Recovery 6(1):75-86.). Lins et al. (2012)Lins J.A.P.N., Kirschnik P.G., Queiroz V.S. & Cirio S.M. 2012. Uso de peixes como biomarcadores para monitoramento ambiental aquático. Revta. Acad. Ciênc. Agrár. Ambient. 8(4):469-484. ressalta que órgãos de contato direto com o agente agressor, como as brânquias e os órgãos de metabolismo e excreção de xenobióticos - como o fígado e o rim, podem indicar alterações de ação tóxica aguda ou crônica desses agentes em tecidos animais.
Considerando os aspectos endêmicos do pacamã na região do Vale do São Francisco no Nordeste brasileiro, com evidente característica comercial para consumo humano, além de escassez de informação na literatura a respeito da toxicidade de neonicotinóide para a espécie em questão, objetivou-se avaliar a toxicidade aguda e crônica de inseticida a base de tiametoxam, por meio da concentração letal 50% (CL50) e de eventuais alterações histológicas em tecido hepático de Pacamãs.
Material e Métodos
O experimento conduzido foi aprovado pelo Comitê de Ética no Uso de Animais da Escola de Medicina Veterinária e Zootecnia da Universidade Federal da Bahia, sob o número 36/2014.
Foram utilizados 120 alevinos de pacamã (Lophisiolurus alexandri) provenientes da fazenda da Companhia de Desenvolvimento do Vale do São Francisco (CODEVASF) em Petrolina, PE. Os animais apresentavam peso médio de 5,0±0,35g, e estavam clinicamente hígidos. Os mesmos foram transportados de carro, acondicionados em sacos plásticos com água e injetados de oxigênio,da fazenda da Codevasf em Petrolina até o Laboratório de Sanidade de Organismos Aquáticos (LASOA) da Escola de Medicina Veterinária da UFBA, onde foi realizado o experimento.
Ao chegarem, foram colocados em tanques de fibra de vidro de 500L, com aeração artificial, onde foram mantidos para aclimatação por 10 dias. Os animais foram alimentados com ração formulada para peixes carnívoros com 44,8% de proteína bruta.
O inseticida utilizado foi o Actara 250WG®, produto comercial à base de Tiametoxam, comercializado pela Syngenta Proteção de Cultivos LTDA. Na sua composição estão presentes 250g/kg de 3-(2-Cloro-tiazol-5-ilmetil)-5-metil-[1,3,5] oxadiazinan-4-ilideno-N-nitroamina e 750g/kg de ingredientes inertes.
Os parâmetros de qualidade da água como oxigênio dissolvido, pH e temperatura foram mensurados diariamente em todos os tanques.
Para a realização do experimento, os peixes foram distribuídos aleatoriamente em 24 caixas plásticas com 20L de água declorada, com aeração artificial. O experimento foi realizado em sistema estático, sem renovação da água. Foram utilizados cinco peixes por caixa, perfazendo um total de 20 peixes por tratamento. Foram utilizadas cinco diferentes concentrações do inseticida e um controle (T0), com quatro repetições por tratamento. As concentrações utilizadas foram 30(T1), 60(T2), 120(T3), 240(T4) e 480(T5) mg/L do Actara 250WG®.
A primeira etapa do experimento teve a duração de 96horas, com observação e quantificação de mortalidade a cada 24 horas, no entanto não foi possível determinar a CL50 por não ter ocorrido nenhuma mortalidade neste período. Ao final das 96 horas foram selecionados, aleatoriamente, dois animais por caixa para coleta de material para análise histológica e os outros três peixes foram mantidos na mesma solução até completarem 15 dias de exposição. Ao final dos 15 dias, contabilizou-se apenas uma mortalidade na concentração de 480mg/L, ocorrida no quinto dia de exposição, quando, então, foram selecionados novamente dois peixes de cada caixa para coleta de material para análise microscópica. Na primeira etapa do experimento os animais não foram alimentados, de acordo com as recomendações das normas de ensaio de toxicidade aguda com peixes, da Associação Brasileira de Normas Técnicas (ABNT 2011ABNT 2011. Ecotoxicologia aquática, toxicidade aguda: método de ensaio com peixes. Associação Brasileira de Normas Técnicas, Rio de Janeiro. 22p.).
A eutanásia dos peixes foi feita por aprofundamento anestésico, com imersão em benzocaína, de acordo com o Guia Brasileiro de Boas Práticas para Eutanásia em Animais do Conselho Federal de Medicina Veterinária (CFMV 2012CFMV 2012. Guia Brasileiro de Boas Práticas para Eutanásia em Animais: conceitos e procedimentos recomendados. Conselho Federal de Medicina Veterinária, Brasília. 66p.). Imediatamente após a eutanásia dos peixes foi feita a coleta do fígado para análise histológica. Os fragmentos foram fixados em formol neutro e tamponado a 10% e processados segundo a técnica rotineira de inclusão em parafina (Prophet et al. 1992Prophet E.B., Mills B., Arrington J.B. & Sobin L.H. 1992. Methods in Histotechnology. American Registry of Pathology, Washington. 278p.). A coloração utilizada foi hematoxilina e eosina (HE). Alguns cortes foram submetidos à técnica histoquímica do ácido periódico de Schiff (PAS), para confirmar a presença de glicogênio. Utilizaram-se seis animais de cada concentração para análise histológica.
Secções de 5μ de espessura foram analisadas em microscópio de luz branca e as alterações encontradas foram classificadas individualmente de acordo com o grau da lesão no tecido. Foi utilizado um sistema de graduação semiquantitativa, que foi de um a três, sendo 1-mínimo, 2-moderado, 3-severo, além do zero quando a alteração não era vista no tecido. Os dados foram avaliados por meio de dispersão de frequência absoluta, bem como registro descritivo das lesões observadas na histologia e histoquímica.
Resultados
A qualidade da água manteve-se dentro da normalidade para espécies de clima tropical durante todo o período experimental, em todas as caixas, com um pH médio de 7,6±0,06; oxigênio dissolvido (OD) de 6,9 mg/L±0,20e uma temperatura de 27,1°C±0,10. A determinação exata da CL50 96 horas não foi realizada, uma vez que não houve nenhuma mortalidade no tempo e nas concentrações utilizadas, porém com as informações obtidas nesse experimento pode-se considerar a CL50% superior a 100mg/L.
Nesse experimento as principais alterações encontradas em fígado foram vacuolização citoplasmática, congestão e necrose. As graduações referentes a vacuolização hepatocelular, variaram do grau 0 ao 3 e as alterações apareceram de forma geral como extensas áreas cujas células de aspecto baloniforme, continham vacúolos intracitoplasmáticos claros ou com presença de material floculento (Fig.1). Quanto ao grau de vacuolização entre o grupo controle e os animais expostos, tanto no teste agudo quanto no crônico, foi possível registrar, no teste agudo, que 55,6% apresentavam grau 2 de vacuolização, enquanto que no teste crônico, 80,6% apresentavam grau 3 de vacuolização.
Tecido hepático com diferentes graduações de vacuolização. (A) Vacuolização grau 1 referente a animal do grupo controle 96 horas. HE, obj.40x. (B) Controle 96 horas, vacuolização grau 1 demonstrando reação positiva ao PAS (seta amarela). PAS, obj.40x. (C) Peixe exposto ao T1 por 96 horas, apresentando vacuolização grau 2. HE, obj.40x. (D) Peixe exposto ao T1, vacuolização grau 2 demonstrando reação positiva ao PAS, obj.40x. (E) Peixe exposto ao T5 por 15 dias, apresentando vacuolização grau 3. HE, obj.40x. (F) Peixe exposto ao T5 por 15 dias, vacuolização grau 3, demonstrando a fraca reação ao PAS (granulações). Seta amarela = área de reação positiva ao PAS. Asterisco (*) veia central.
Na reação ao ácido periódico de Schiff (PAS), independente de ser animal exposto ou controle, foi observado uma maior positividade nos animais que apresentaram grau de vacuolização entre 0 e 1, apresentando desde áreas com intensa coloração avermelhada ocupando toda a célula até pequenos grânulos corados no citoplasma. Os animais com vacuolizações grau 2 e 3 apresentaram desde pequenas granulações de coloração avermelhada até a ausência de qualquer reação ao PAS (Fig.1).
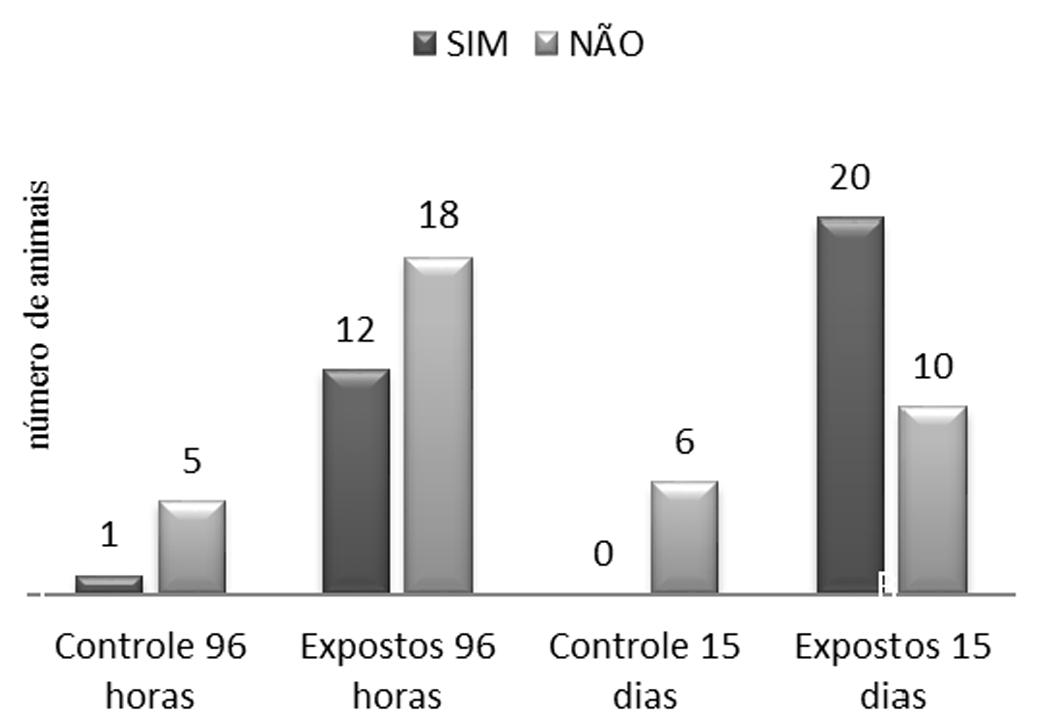
A presença de congestão variou do grau 0 ao 3, caracterizando-se pela presença de grande quantidade de hemácias em vasos e capilares sinusoidais dilatados, porém a distribuição dessa alteração dentre os grupos se apresentou de forma homogênea. Já em relação a presença de necrose, observou-se variação entre o grau 0 e 2, com distribuição focal a multifocal, mostrando dissolução tecidual com hemorragia e presença de células com núcleos em picnose (Fig.2). No teste de toxicidade aguda, 40% dos animais expostos apresentaram necrose, sendo que entre esses 75% foram classificadas em grau 1 e 25% no grau 2 e apenas 1 animal do grupo controle apresentou a mesma alteração. No teste de toxicidade crônica, a necrose apareceu em 66,7% dos animais expostos ao inseticida, sendo 45% classificadas no grau 1 e 55% no grau 2. Nesse período, nenhum animal do grupo controle apresentou necrose.
Tecido hepático de pacamã expostos ao tiametoxam por 15 dias. (A) Extensa área de necrose (seta preta) com presença de hemácias (*), HE, obj.10x. (B) Área de necrose com presença de núcleos picnóticos (seta amarela), HE, obj.40x.
Na figura 3 é possível observar a distribuição da frequência absoluta entre o número de animais com necrose no grupo controle e expostos, assim como o aumento na ocorrência dessa alteração com o maior tempo de exposição.
Distribuição da frequência absoluta de necrose hepática em pacamãs expostos ao tiametoxam por 96 horas e 15 dias.
Discussão
A temperatura, OD e pH da água numa situação de conforto para peixes tropicais deve estar entre 28-32°C, superior a 5mg/Le entre 6,5-8,0, respectivamente (Kubitza & Kubitza 2000Kubitza F. & Kubitza L.M.M. 2000. Qualidade da água, sistemas de cultivo, planejamento da produção, manejo nutricional e alimentar e sanidade. Panorama da Aquicultura 10(59):44-53., Brasil 2005Brasil 2005. CONAMA - Resolução nº 357, de 17 de março de 2005. Diário Oficial da União. Conselho Nacional do Meio Ambiente, Ministério do Meio Ambiente, Brasília. 27p.), condições estas que foram compatíveis com as condições de conforto estabelecidas neste experimento.
Em relação à toxicidade do agrotóxico de acordo com sua CL50, Zucker (1985Zucker E. 1985. Hazard Evaluation Division, Standard Evaluation Procedure, Acute Toxicity Test for Freshwater Fish. USEPA Publication, Washington, 540(9):85-86.) afirma que um agrotóxico é considerado praticamente não tóxico quando a CL50> 100mg/L. Nesse experimento não foi obtida nenhuma mortalidade em nenhuma das concentrações, nem mesmo na concentração de 480mg/L, sendo considerado, portanto, que o tiametoxam é praticamente não tóxico para pacamãs, sem a necessidade de repetir o experimento com concentrações mais elevadas. Fulton et al. (2014)Fulton M.H., Key P.B. & Delorenzo M.E. 2014. Insecticide toxicity in fish, p.310-369. In: Tierney K.B., Farrell A.P., Brauner C.J. (Eds), Organic chemical toxicology of Fishes, USA, ed. Elsevier, p.576. afirmam que a toxicidade aguda de neonicotinóides para peixes é baixa, enquanto que Barbee & Stout (2009)Barbee G.C. & Stout M.J. 2009. Comparative acute toxicity of neonicotinoid and pyretroid insecticides to non-target crayfish (Procambarus clarkii) associated with rice-crayfish crop rotations. Pest Manag. Sci. 65(11):1250-1256. reportaram, tanto para truta arco-iris (Oncorhynchus mykiss) quanto para bluegillsunfish (Lepomis macrochirus), valores de CL50 superiores a 100mg/L e 114 mg/L, respectivamente. Em tilápias do Nilo (Oreochromis niloticus) foi encontrado, por Albinati et al. (2014)Albinati A.C.L., Albinati R.C.B., Soares P.C., Lira A.D. & Maslowa T. 2014. Toxicidade aguda do tiametoxam para alevinos de tilápia do Nilo (Oreochromis niloticus). Anais 13º Encontro Brasileiro de Patologistas de Organismos Aquáticos, Aracaju. ABRAPOA, Aracaju. (CD-Rom, ENBRAPOA), CL50 de 322,08mg/L. No entanto, algumas espécies apresentam uma maior sensibilidade como o Pacu (Piaractus mesopotamicus), que apresentaram CL50 de 16,97mg/L e o Mato Grosso (Hyphessobrycon eques) com 49,78mg/L (Carraschi et al. 2015Carraschi S.P., Florêncio T., Garlich N., Carraschi S.P. & Florencio T. 2015. Ecotoxicology of drugs used in fish disease treatment. Journal of Environmental Chemistry and Ecotoxicology 7(3):31-36.). Cabe ressaltar que apenas um pequeno número de espécies de peixes tem sido avaliado quanto à sensibilidade a neonicotinóides (Anderson et al. 2015Anderson J.C., Dubetz C. & Palace V.P. 2015. Neonicotinoids in the Canadian Aquatic environment: A literature review on current use products with a focus on fate, exposure, and biological effects. Science of the Total Environment 505(1):409-422.).
Embora no teste de toxicidade aguda o tiametoxam tenha se comportado como um inseticida praticamente não tóxico para o pacamã ressalta-se que nem todos os pesticidas provocam morte imediata dos peixes e doses subletais podem causar mudanças comportamentais, perda de peso, queda na resistência e redução da resposta imunológica, dentre outros problemas (Helfrich et al. 1996Helfrich L.A., Weigmann D.L., Hipkins P. & Stinson E.R. 1996. Pesticides and aquatic animals: a guide to reducing impacts on aquatic systems. Virginia State University, June, p.420-013. Disponível em <Disponível em www.ext.pt.edu/pubs/waterquality/420-013.html
> Acessado em 2 mar. 2004.
www.ext.pt.edu/pubs/waterquality/420-013...
).
As alterações histopatológicas encontradas nesse trabalho são concordantes com as relatadas por Viana et al. (2013)Viana A.P., Frédou F.L., Montes C.S. & Rocha R.M. 2013. Fish histopathology and catalase activity as biomarkers of the environmental quality of the industrial district on the Amazon estuary, Brazil. Acta Scientiarum, Biological Sciences 35(3):395-401., quando estudaram peixes coletados de zonas de risco de um estuário amazônico, encontrando como principais alterações degeneração gordurosa, congestão e necrose focal. Em levantamento realizado por Santos-Filho et al. (2014)Santos-Filho F.M., Rezende K.F.O., Emerenciano A.K., Moreira L.M., Vila V.B., Borges R.M. & Pressinotti L.N. 2014. Avaliação de biomarcadores histológicos em peixes coletados a montante e a jusante da mancha urbana. Atas Saúde Ambiental 2(1):9-22., a vacuolização foi a alteração hepática mais frequente encontrada em peixes expostos a poluentes.
As vacuolizações hepáticas representam armazenamento de glicogênio e lipídeos e podem ocorrer quando a tomada de energia excede os requerimentos metabólicos. O fígado de peixes tende a estocar o excesso de energia em forma de glicogênio e ou lipídeo no citoplasma dos hepatócitos. Isso é comum em peixes de cultivos que são alimentados com rações calóricas e não tem muitos gastos energéticos. A predileção para acumular glicogênio ou lipídeo é espécie dependente e pode estar relacionada à dieta (Wolf et al. 2015Wolf J.C., Baumgartner W.A., Blazer V.S., Camus A.C., Engelhardt J.A., Fournie J.W., Frasca J.R.S., Groman D.B., Kent L., Khoo L.H., Law J.M., Lombadirni E.D., Ruehl-Fehlert C., Segner H.E., Smith S.A., Spitsbergen J.M., Weber K. & Wolfer M.J. 2015. Nonlesions, misdiagnoses, missed diagnoses, and other interpretive challenges in fish histopathology studies: a guide for investigators, authors, reviewers, and reader. Toxicol. Pathol. 43(3):297-325.).
Peixes doentes, estressados ou malnutridos frequentemente exibem uma redução nos estoques hepáticos de energia, diminuindo a vacuolização hepatocelular (Wolf et al. 2015Wolf J.C., Baumgartner W.A., Blazer V.S., Camus A.C., Engelhardt J.A., Fournie J.W., Frasca J.R.S., Groman D.B., Kent L., Khoo L.H., Law J.M., Lombadirni E.D., Ruehl-Fehlert C., Segner H.E., Smith S.A., Spitsbergen J.M., Weber K. & Wolfer M.J. 2015. Nonlesions, misdiagnoses, missed diagnoses, and other interpretive challenges in fish histopathology studies: a guide for investigators, authors, reviewers, and reader. Toxicol. Pathol. 43(3):297-325.). Uma resposta morfológica hepática comum em peixes expostos a agentes tóxicos é a perda de glicogênio e ou lipídeo (Ferguson 1989Ferguson H. 1989. Systemic pathology of fish: a text and atlas of comparative tissue responses in diseases of teleosts. Iowa State University Press, Iowa. 263p.). Essa perda pode ocorrer como efeito direto da intoxicação, porém a exposição a agentes tóxicos pode também resultar em acúmulo de gordura ou glicogênio hepático, com a hipótese de ser resultante do decréscimo de quebra de glicogênio devido a toxicidade hepatocelular (Wolf & Wolfe 2005Wolf J.C. & Wolfe M.J. 2005. A brief overview of non-neoplastic hepatic toxi-city in fish. Toxicol. Pathol. 33(1):75-85.). Stoyanova et al. (2012)Stoyanova S., Georgieva E., Velcheva I. & Atanasova P. 2012. Effects of the insecticide “actara 25 wg” on the glyconeogenesis in the liver of common carp (Cyprinus carpio L.). J. Biosci. Biotech. 1(3):249-254. estudando carpas expostas por 96 horas a 6,6;10 e 20mg/L de Actara 25WG demonstraram que a intensidade da coloração de reação ao ácido periódico de Schifft, em fígados, foi diretamente proporcional ao aumento da concentração do inseticida, indicando um aumento na quantidade de glicogênio hepático. Em Pacus sadios expostos a 75mg/L de tiametoxam em banhos terapêuticos por sete dias não foi identificada nenhuma alteração histopatológica em brânquias, fígado, rins e pele, no entanto, houve uma polarização do glicogênio hepático, indicando que esta reserva energética estava sendo utilizada (Carraschi 2014Carraschi S.P. 2014. Ecotoxicidade, segurança clínica e eficácia de fármacos em jovens de pacu (Piaractus mesopotamicus). Tese de Doutorado em Aquicultura, Centro de Aquicultura, Universidade Estadual Paulista, Jaboticabal. 101p.).
Vale ressaltar que nesse experimento, nas primeiras 96 horas, os animais não foram alimentados e após esse período foi feita a oferta diária de alimento. Esse fato pode refletir em uma maior vacuolização nos animais avaliados após 15 dias, independente de estarem ou não expostos ao inseticida, uma vez que não houve diferença entre o grau de vacuolização entre o grupo controle e o exposto.
No presente trabalho a maioria dos fígados apresentaram um grau elevado de vacuolização, independente de pertencerem a grupos expostos ou não ao inseticida, o que demonstra que os animais não se encontravam em condição de estresse suficiente para interferir nas demandas metabólicas com reflexos no estoque hepático. A reação ao PAS foi fracamente positiva nos animais que apresentavam um maior grau de vacuolização, o que pode estar relacionado a uma maior presença de lipídeos em relação ao glicogênio. Outra possibilidade para a quantidade de vacúolos presentes nos animais pode estar relacionada à alimentação oferecida, uma vez que ainda não existe um protocolo com dados técnicos para o cultivo de pacamã, gerando hipótese de que a dieta ofertada pode estar com elevada taxa calórica, o que deve ser posteriormente avaliado.
Em relação as congestões hepáticas encontradas, não foi observada diferença entre os grupos expostos e o controle, sendo essa alteração não considerada como indicativa de toxicidade do tiametoxam. Segundo Wolf et al. (2015)Wolf J.C., Baumgartner W.A., Blazer V.S., Camus A.C., Engelhardt J.A., Fournie J.W., Frasca J.R.S., Groman D.B., Kent L., Khoo L.H., Law J.M., Lombadirni E.D., Ruehl-Fehlert C., Segner H.E., Smith S.A., Spitsbergen J.M., Weber K. & Wolfer M.J. 2015. Nonlesions, misdiagnoses, missed diagnoses, and other interpretive challenges in fish histopathology studies: a guide for investigators, authors, reviewers, and reader. Toxicol. Pathol. 43(3):297-325. a avaliação de congestão e dilatação de sinusóides pode estar relacionada a forma como o peixe foi eutanasiado. Quanto a necrose hepática, esta foi uma alteração encontrada por outros autores em experimentos com exposição de peixes a agrotóxicos, como em tilápias do Nilo alimentadas com 1.45g/L de deltametrina (Kan et al. 2012Kan Y., Cengiz E.I., Ugurlu P. & Yanar M. 2012. The protective role of vitamin E on gill and liver tissue histopathology and micronucleus frequencies in peripheral erythrocytes of Oreochromis niloticus exposed to Deltamethrin. Environ. Toxicol. Pharmacol. 34:170-179.), Heterobranchus bidorsalis expostos a cipermetrina (Olufayo & Alade 2012Olufayo M.O. & Alade O.H. 2012. Acute toxicity and histological changes in gills, liver and kidney of catfish, Heterobranchus bidorsalis exposed to cypermethrin concentration. African J. Agricult. Res. 7(31):4453-4459.) e Poecilia reticulata expostos a 250μg/L de rotenona (Melo et al. 2015Melo K.M., Oliveira R., Grisolia C.K., Domingues I., Pieczarka J.C., Souza Filho J. & Nagamachi C.Y. 2015. Short-term exposure to low doses of rotenone induces developmental, biochemical, behavioral, and histological changes in fish. Environ. Sci. Pollut. Res. 22:13926-13938.). Segundo Wolf & Wolfe (2005)Wolf J.C. & Wolfe M.J. 2005. A brief overview of non-neoplastic hepatic toxi-city in fish. Toxicol. Pathol. 33(1):75-85., a necrose é uma resposta claramente patológica do fígado de peixes relacionada às toxinas. Necrose focal pode estar isolada entre o tecido hepático normal ou infiltrado por células inflamatórias e é uma alteração que pode estar associada a várias condições tóxicas, incluindo pesticidas (Roberts 2012Roberts R.J. 2012. Fish Pathology. Wiley-Blackwell, London. 583p.).O fígado geralmente demonstra os efeitos tóxicos após exposição prolongada (Melo et al. 2015Melo K.M., Oliveira R., Grisolia C.K., Domingues I., Pieczarka J.C., Souza Filho J. & Nagamachi C.Y. 2015. Short-term exposure to low doses of rotenone induces developmental, biochemical, behavioral, and histological changes in fish. Environ. Sci. Pollut. Res. 22:13926-13938.), o que foi observado nesse experimento, com o aumento da ocorrência de necrose nos animais expostos cronicamente ao tiametoxam.
Conclusão
O inseticida a base de tiametoxam avaliado nesse experimento, foi considerado como praticamente não tóxico quanto a CL50, no entanto necrose hepática foi observada nos peixes expostos com o aumento dessa ocorrência nos peixes do teste de toxicidade crônica.
Agradecimentos
À Fundação de Amparo a Ciência e Tecnologia do Estado de Pernambuco (FACEPE) pela bolsa concedida à primeira autora (IBPG - 0903-5.05/11). À CODEVASF - Bebedouro, por ceder os animais utilizados na pesquisa
Referências
- ABNT 2011. Ecotoxicologia aquática, toxicidade aguda: método de ensaio com peixes. Associação Brasileira de Normas Técnicas, Rio de Janeiro. 22p.
- Albinati A.C.L., Albinati R.C.B., Soares P.C., Lira A.D. & Maslowa T. 2014. Toxicidade aguda do tiametoxam para alevinos de tilápia do Nilo (Oreochromis niloticus). Anais 13º Encontro Brasileiro de Patologistas de Organismos Aquáticos, Aracaju. ABRAPOA, Aracaju. (CD-Rom, ENBRAPOA)
- Anderson J.C., Dubetz C. & Palace V.P. 2015. Neonicotinoids in the Canadian Aquatic environment: A literature review on current use products with a focus on fate, exposure, and biological effects. Science of the Total Environment 505(1):409-422.
- Barbee G.C. & Stout M.J. 2009. Comparative acute toxicity of neonicotinoid and pyretroid insecticides to non-target crayfish (Procambarus clarkii) associated with rice-crayfish crop rotations. Pest Manag. Sci. 65(11):1250-1256.
- Bedor C.N.G., Ramos L.O., Rêgo M.A.V., Pavão A.C. & Augusto L.G.S. 2007. Avaliação e reflexão da comercialização e utilização de agrotóxicos na região do submédio do Vale do São Francisco. Revta Baiana Saúde Pública 31(1):68-76.
- Brasil 2005. CONAMA - Resolução nº 357, de 17 de março de 2005. Diário Oficial da União. Conselho Nacional do Meio Ambiente, Ministério do Meio Ambiente, Brasília. 27p.
- Campeche D.F.B., Balzana L., Figueiredo R.C.R., Barbalho M.R.S., Reis F.J.S. & Melo J.F.B. 2011. Peixe nativo do rio São Francisco adaptado para cultivo. Documento 244, Embrapa Seminário.
- Carraschi S.P. 2014. Ecotoxicidade, segurança clínica e eficácia de fármacos em jovens de pacu (Piaractus mesopotamicus). Tese de Doutorado em Aquicultura, Centro de Aquicultura, Universidade Estadual Paulista, Jaboticabal. 101p.
- Carraschi S.P., Barbuio R., Ikefuti C.V., Florêncio T., Cruz C. & Ranzani-Paiva M.J.T. 2014. Effectiveness of therapeutic agents in disease treatment in Piaractus mesopotamicus Aquaculture 431(7):124-128.
- Carraschi S.P., Florêncio T., Garlich N., Carraschi S.P. & Florencio T. 2015. Ecotoxicology of drugs used in fish disease treatment. Journal of Environmental Chemistry and Ecotoxicology 7(3):31-36.
- CFMV 2012. Guia Brasileiro de Boas Práticas para Eutanásia em Animais: conceitos e procedimentos recomendados. Conselho Federal de Medicina Veterinária, Brasília. 66p.
- Ferguson H. 1989. Systemic pathology of fish: a text and atlas of comparative tissue responses in diseases of teleosts. Iowa State University Press, Iowa. 263p.
- Figueiredo R.A.C.R., Souza R.C., Bezerra K.S., Campeche D.F.B., Campos R.M.L., Souza A.M. & Melo J.F.B. 2014. Relação proteína: carboidrato no desempenho e metabolismo de juvenis de pacamã (Lophiosilurus alexandri). Arq. Bras. Med. Vet. Zootec. 66(5):1567-1576.
- Fulton M.H., Key P.B. & Delorenzo M.E. 2014. Insecticide toxicity in fish, p.310-369. In: Tierney K.B., Farrell A.P., Brauner C.J. (Eds), Organic chemical toxicology of Fishes, USA, ed. Elsevier, p.576.
- Helfrich L.A., Weigmann D.L., Hipkins P. & Stinson E.R. 1996. Pesticides and aquatic animals: a guide to reducing impacts on aquatic systems. Virginia State University, June, p.420-013. Disponível em <Disponível em www.ext.pt.edu/pubs/waterquality/420-013.html > Acessado em 2 mar. 2004.
» www.ext.pt.edu/pubs/waterquality/420-013.html - Kan Y., Cengiz E.I., Ugurlu P. & Yanar M. 2012. The protective role of vitamin E on gill and liver tissue histopathology and micronucleus frequencies in peripheral erythrocytes of Oreochromis niloticus exposed to Deltamethrin. Environ. Toxicol. Pharmacol. 34:170-179.
- Kubitza F. & Kubitza L.M.M. 2000. Qualidade da água, sistemas de cultivo, planejamento da produção, manejo nutricional e alimentar e sanidade. Panorama da Aquicultura 10(59):44-53.
- Lins J.A.P.N., Kirschnik P.G., Queiroz V.S. & Cirio S.M. 2012. Uso de peixes como biomarcadores para monitoramento ambiental aquático. Revta. Acad. Ciênc. Agrár. Ambient. 8(4):469-484.
- Londres F. 2011. Agrotóxicos no Brasil: um guia para ação em defesa da vida. Rio de Janeiro. 190p.
- Maienfisch P., Angst M., Brandl F., Fischer W., Hofer D., Kayser H., Kobel W., Rindlisbacher A., Senn R.A. & Widmer H. 2001. Chemistry and biology of thiamethoxam: a second generation neonicotinoid. Pest Manag. Sci. 57(10):906-913.
- Melo K.M., Oliveira R., Grisolia C.K., Domingues I., Pieczarka J.C., Souza Filho J. & Nagamachi C.Y. 2015. Short-term exposure to low doses of rotenone induces developmental, biochemical, behavioral, and histological changes in fish. Environ. Sci. Pollut. Res. 22:13926-13938.
- Olufayo M.O. & Alade O.H. 2012. Acute toxicity and histological changes in gills, liver and kidney of catfish, Heterobranchus bidorsalis exposed to cypermethrin concentration. African J. Agricult. Res. 7(31):4453-4459.
- Prophet E.B., Mills B., Arrington J.B. & Sobin L.H. 1992. Methods in Histotechnology. American Registry of Pathology, Washington. 278p.
- Rigotto R.M., Vasconcelos D.P. & Rocha M.M. 2014. Uso de agrotóxicos no Brasil e problemas para a saúde pública. Cad. Saúde Pública 30(7):1-3.
- Roberts R.J. 2012. Fish Pathology. Wiley-Blackwell, London. 583p.
- Santos-Filho F.M., Rezende K.F.O., Emerenciano A.K., Moreira L.M., Vila V.B., Borges R.M. & Pressinotti L.N. 2014. Avaliação de biomarcadores histológicos em peixes coletados a montante e a jusante da mancha urbana. Atas Saúde Ambiental 2(1):9-22.
- Schwaiger J., Wanke R., Adam S., Pawert M., Honnen W. & Triebskorn R. 1997. The use of histopathological indicators to evaluate contaminant-related stress in fish. J. Aquatic Ecosystem Stress and Recovery 6(1):75-86.
- Silva G.S., Albuquerque Jr E.C., Amorim Jr A.C., Ezequiel J.M. & Silva P.T.S. 2014. Avaliação da potencial contaminação das águas superficiais e subterrâneas por agrotóxicos em áreas de produção de uva para exportação no Vale do São Francisco. Anais 12º Simpósio Ítalo-Brasileiro de Engenharia Sanitária e Ambiental, Natal, p.1-7. (Resumo)
- Stoyanova S., Georgieva E., Velcheva I. & Atanasova P. 2012. Effects of the insecticide “actara 25 wg” on the glyconeogenesis in the liver of common carp (Cyprinus carpio L.). J. Biosci. Biotech. 1(3):249-254.
- Tavares D.A. 2011. Análise morfológica e imunocitoquímica do cérebro de abelhas africanizadas Apis mellifera após exposição a doses subletais do inseticida tiametoxam. Dissertação de Mestrado em Biologia Celular e Molecular. Instituto de Biociências de Rio Claro, Universidade Estadual Paulista, Rio Claro. 75p.
- Tenório R.A., Santos A.J.G., Lopes J.P. & Nogueira E.M.S. 2006. Crescimento do niquim (Lophiosilurus alexandri Steindachner, 1876), em diferentes condições de luminosidade e tipos de alimentos. Acta Scientiarum, Biological Sciences 28(4):305-309.
- Uğurlu P., Ünlü E. & Satar E.I. 2015. The toxicological effects of thiamethoxam on Gammarus kischineffensis (Schellenberg, 1937) (Crustacea: Amphipoda). Environ. Toxicol. Pharmacol. 39(2):720-726.
- Viana A.P., Frédou F.L., Montes C.S. & Rocha R.M. 2013. Fish histopathology and catalase activity as biomarkers of the environmental quality of the industrial district on the Amazon estuary, Brazil. Acta Scientiarum, Biological Sciences 35(3):395-401.
- Wolf J.C. & Wolfe M.J. 2005. A brief overview of non-neoplastic hepatic toxi-city in fish. Toxicol. Pathol. 33(1):75-85.
- Wolf J.C., Baumgartner W.A., Blazer V.S., Camus A.C., Engelhardt J.A., Fournie J.W., Frasca J.R.S., Groman D.B., Kent L., Khoo L.H., Law J.M., Lombadirni E.D., Ruehl-Fehlert C., Segner H.E., Smith S.A., Spitsbergen J.M., Weber K. & Wolfer M.J. 2015. Nonlesions, misdiagnoses, missed diagnoses, and other interpretive challenges in fish histopathology studies: a guide for investigators, authors, reviewers, and reader. Toxicol. Pathol. 43(3):297-325.
- Zucker E. 1985. Hazard Evaluation Division, Standard Evaluation Procedure, Acute Toxicity Test for Freshwater Fish. USEPA Publication, Washington, 540(9):85-86.
Datas de Publicação
-
Publicação nesta coleção
Abr 2017
Histórico
-
Recebido
18 Maio 2016 -
Aceito
23 Set 2016