Resumos
Os efeitos da suplementação da vitamina D3 e de seus diferentes metabólitos foram avaliados na resposta imune e na morfometria intestinal de frangos de corte. Foram utilizados 952 frangos de corte de um dia de idade, distribuídos em um delineamento inteiramente casualizado, com quatro tratamentos, sete repetições e 34 aves por unidade experimental. Os tratamentos foram constituídos por quatros diferentes fontes de vitamina D3: colecalciferol (D3), 25-hidroxicolecalciferol (25(OH)D3), 1,25-dihidroxicolecalciferol (1,25(OH)2D3) e 1α-hidroxicolecalciferol (1α(OH)D3). As diferentes fontes foram incluídas na dieta, fornecendo 2000 e 1600 UI de vitamina D, nas fases pré-inicial, inicial e de crescimento, respectivamente. O peso relativo do intestino delgado diferiu entre os tratamentos aos 7, 21 e 42 dias e o peso relativo do fígado somente aos 42 dias de idade. Os demais órgãos e parâmetros imunológicos avaliados (peso dos órgãos linfóides, reação de hipersensibilidade cutânea basofílica, avaliação da atividade de macrófagos, dosagem de nitrito e perfil heterofilo: linfócito foram similares entre os animais alimentados com os diferentes metabólitos. Houve efeito (P<0,05) dos diferentes metabólitos da vitamina D3 sobre o comprimento dos vilos de jejuno e íleo aos sete dias, diferindo entre os animais alimentados com 1,25(OH)2D3 e 1α(OH)D3 para jejuno e 1,25(OH)2D3 e vitamina D3 para íleo (P<0,05). Para as demais fases não foi observado influência (P>0,05) dos tratamentos. Os parâmetros imunológicos não foram afetados pelos diferentes metabólitos de vitamina D. Os diferentes metabólitos de vitamina D afetaram positivamente a morfometria intestinal na altura de vilo na fase inicial, sendo os melhores resultados obtido pelos animais alimentados com 1,25(OH)2D3, contudo os parâmetros imunológicos foram similares entre os metabólitos estudados.
Vitamina D3; colecalciferol; macrófagos; intestino; frangos
The aim of this experiment was to evaluate the effect of different vitamin D metabolites on immune response and intestine morphometry of broiler chickens. We used 952 1-day-old chicks, male Cobb, distributed into a completely randomized design with four treatments, seven replications and 34 birds each. There were evaluated four different metabolites of vitamin D: D3, 25(OH)D3, 1,25(OH)2D3 and 1α(OH)D3, providing 2000 and 1600 IU/kg feed of vitamin D in initial and growth period, respectively. The different metabolites of vitamin D did not affect the relative weight of the organs except for the weight of the intestine and liver at 21 and 42 days. There was a significant effect (P<0.05) of the different metabolites of D3 vitamin on the villi length of jejunum and ileum at 7 days, between animals fed with 1,25(OH)2D3 and 1α(OH)D3 to the jejunum and 1,25(OH)2D3 and vitamin D3 to the ileum (P<0.05). There were no differences (P>0.05) for weight of lymphoid organs, cutaneous basophil hypersensitivity reaction, macrophage activity assessment, measurement of nitric oxide and heterophil profile: lymphocyte. The different sources of vitamin D affect the intestine morphometrics on the villi length in the initial phase, but the effect was not observed in other phases. The immunological parameters were not affected by metabolites of vitamin D.
Vitamin D3; cholecalciferol; macrophages; intestine; broilers
MORFOFISIOLOGIA
Utilização da vitamina D3 e seus metabólitos na alimentação de frangos de corte sobre parâmetros imunológicos e morfometria intestinal
Use of vitamin D3 and its metabolites in broiler feed on immunological parameters and intestinal morphometry
Ana Flávia Q. Garcia Guerra; Alice E. Murakami* * Autor para correspondência: A.E. Murakami ( aemurakami@uem.br). ; Tatiana C. Santos; Cinthia Eyng; Karla P. Picoli; Iván C. Ospina-Rojas
Departamento de Zootecnia, Universidade Estadual de Maringá (UEM), Av. Colombo 5790, Maringá, PR 87020-900, Brasil. E-mails: A.F.Q.M Garcia (flaviaquiles@gmail.com), T.C. Santos (tcsantos@uem.br), C. Eyng (cinthiaeyng@hotmail.com), Karla Paola Picoli (kppicoli@hotmail.com), Iván Camilo Ospina-Rojas (ivancamilo1987@hotmail.com)
RESUMO
Os efeitos da suplementação da vitamina D3 e de seus diferentes metabólitos foram avaliados na resposta imune e na morfometria intestinal de frangos de corte. Foram utilizados 952 frangos de corte de um dia de idade, distribuídos em um delineamento inteiramente casualizado, com quatro tratamentos, sete repetições e 34 aves por unidade experimental. Os tratamentos foram constituídos por quatros diferentes fontes de vitamina D3: colecalciferol (D3), 25-hidroxicolecalciferol (25(OH)D3), 1,25-dihidroxicolecalciferol (1,25(OH)2D3) e 1α-hidroxicolecalciferol (1α(OH)D3). As diferentes fontes foram incluídas na dieta, fornecendo 2000 e 1600 UI de vitamina D, nas fases pré-inicial, inicial e de crescimento, respectivamente. O peso relativo do intestino delgado diferiu entre os tratamentos aos 7, 21 e 42 dias e o peso relativo do fígado somente aos 42 dias de idade. Os demais órgãos e parâmetros imunológicos avaliados (peso dos órgãos linfóides, reação de hipersensibilidade cutânea basofílica, avaliação da atividade de macrófagos, dosagem de nitrito e perfil heterofilo: linfócito foram similares entre os animais alimentados com os diferentes metabólitos. Houve efeito (P<0,05) dos diferentes metabólitos da vitamina D3 sobre o comprimento dos vilos de jejuno e íleo aos sete dias, diferindo entre os animais alimentados com 1,25(OH)2D3 e 1α(OH)D3 para jejuno e 1,25(OH)2D3 e vitamina D3 para íleo (P<0,05). Para as demais fases não foi observado influência (P>0,05) dos tratamentos. Os parâmetros imunológicos não foram afetados pelos diferentes metabólitos de vitamina D. Os diferentes metabólitos de vitamina D afetaram positivamente a morfometria intestinal na altura de vilo na fase inicial, sendo os melhores resultados obtido pelos animais alimentados com 1,25(OH)2D3, contudo os parâmetros imunológicos foram similares entre os metabólitos estudados.
Termos de indexação: Vitamina D3, colecalciferol, macrófagos, intestino, frangos.
ABSTRACT
The aim of this experiment was to evaluate the effect of different vitamin D metabolites on immune response and intestine morphometry of broiler chickens. We used 952 1-day-old chicks, male Cobb, distributed into a completely randomized design with four treatments, seven replications and 34 birds each. There were evaluated four different metabolites of vitamin D: D3, 25(OH)D3, 1,25(OH)2D3 and 1α(OH)D3, providing 2000 and 1600 IU/kg feed of vitamin D in initial and growth period, respectively. The different metabolites of vitamin D did not affect the relative weight of the organs except for the weight of the intestine and liver at 21 and 42 days. There was a significant effect (P<0.05) of the different metabolites of D3 vitamin on the villi length of jejunum and ileum at 7 days, between animals fed with 1,25(OH)2D3 and 1α(OH)D3 to the jejunum and 1,25(OH)2D3 and vitamin D3 to the ileum (P<0.05). There were no differences (P>0.05) for weight of lymphoid organs, cutaneous basophil hypersensitivity reaction, macrophage activity assessment, measurement of nitric oxide and heterophil profile: lymphocyte. The different sources of vitamin D affect the intestine morphometrics on the villi length in the initial phase, but the effect was not observed in other phases. The immunological parameters were not affected by metabolites of vitamin D.
Index terms: Vitamin D3, cholecalciferol, macrophages, intestine, broilers.
INTRODUÇÃO
A avicultura de corte avançou muito nas últimas décadas, melhorando significativamente os principais índices produtivos, como conversão alimentar, idade ao abate e mortalidade. Porém, o melhoramento genético, para melhoria do desempenho, pode ter prejudicado o sistema imunológico do animal (Cheema et al. 2003). Assim, a suplementação de nutrientes adequados na ração, principalmente aqueles com ação imunomoduladora, como a vitamina D, é uma forma de prevenir problemas imunológicos e promover a integridade intestinal.
A vitamina D é uma vitamina lipossolúvel que pode ser encontrada na forma de ergocalciferol (vitamina D2) ou de colecalciferol (vitamina D3). A estrutura química entre estas duas formas da vitamina D diferem apenas quanto ao tamanho das cadeias e são formadas no organismo animal mediante ação da radiação ultravioleta sobre os esteróides, ergosteróis e 7-dehidrocolesterol (Barros 2010), ou são fornecidas na dieta. As vitaminas D2 e D3 não são biologicamente ativas, mas são convertidas in vivo na forma ativa da vitamina D, a 1,25- dihidroxicolecalciferol (1,25(OH)2D3), por duas reações sequenciais de hidroxilação (Lesson & Summers 2001).
O papel da vitamina D no metabolismo do cálcio é muito bem estudada e sua ação na resposta imune tem sido descrita pela ação em mecanismos antiproliferativos, pró-diferenciação e imunomodulatórios (Muszkai et al. 2010). A vitamina D é um potente regulador do sistema imunológico em geral e especificamente das células T. No metabolismo, o 1,25(OH)2D3 liga-se ao receptor de vitamina D (VDR) e juntos regulam a transcrição de diversos genes, o que explica a presença de receptores em diversos componentes do sistema imunológico, como o timo e as células T, nas quais o 1,25(OH)2D3 age aumentando a produção de IL-4 por Th2. A presença de VDR em células mononucleares sanguíneas e em células CD4+ Th sugere a influência da vitamina D no sistema imunológico. Além disso, o 1,25(OH)2D3 tem a capacidade de inibir a produção de IL-2, IFN-gama, TNF-alfa e a proliferação de células T helper tipo 1 (Th1)1 (Lemire 1995, Deluca & Catorna 2001) e o 1,25(OH)2D3 possui função de regular os VDR, os quais por sua vez, promovem um equilíbrio entre as células T (Catorna 2006).
A concentração de 1,25(OH)2D3 regula a síntese de poliaminas através da ação de enzimas como a ornitina descarboxilase e a espermidina N-acetiltrasferase. As poliaminas desempenham um papel importante no crescimento e na diferenciação celular, acelerando a taxa de migração de enterócitos da região das criptas para as vilosidades intestinais, podendo alterar a morfologia intestinal, o comprimento de vilos e das microvilosidades e a composição das proteínas na superfície celular (Moruzzi et al. 1982, Kumar 1986, Suda et al. 1990, Drozdowsk & Thomson 2006).
Desta maneira, objetivou-se avaliar os efeitos da utilização de diferentes metabólitos de vitamina D3 em dietas de frangos de corte sobre a resposta imune e a morfometria da mucosa intestinal.
MATERIAL E MÉTODOS
O experimento foi conduzido no setor de avicultura da Fazenda Experimental de Iguatemi da Universidade Estadual de Maringá, sob aprovação do Comitê de Ética de animais em experimentação - CEEA/UEM (Registro Nº034/2011). Foram utilizados 952 pintos de corte, machos, da linhagem comercial "Cobb", distribuídos em um delineamento experimental inteiramente casualizado, com quatro tratamentos (rações contendo diferentes metabólitos de vitamina D3), sete repetições e 34 aves por unidade experimental.
Os tratamentos foram constituídos por quatro diferentes fontes de vitamina D: colecalciferol (D3), 25-hidroxicolecalciferol (25(OH)D3), 1,25-dihidroxicolecalciferol (1,25(OH)2D3), e 1α-hidroxicolecalciferol (1α(OH)D3). As rações foram formuladas à base de milho e farelo de soja, utilizando os valores de composição química dos alimentos e as exigências nutricionais para frangos de corte machos, em cada fase (Quadro 1). As diferentes fontes foram incluídas na dieta fornecendo 2000 UI de vitamina D3, nas fases pré-inicial e inicial e 1600 UI na fase de crescimento, de acordo com as recomendações de Rostagno et al. (2005). O suplemento vitamínico foi isento de vitamina D3.
Aos 7, 21 e 42 dias de idade, duas aves por unidade experimental foram dessensibilizadas por eletrochoque e sacrificadas por sangria na veia jugular. Para determinação do peso relativo dos órgãos e peso absoluto do intestino delgado foram obtidos o peso vivo individual e o peso de cada órgãos após dissecação: órgãos linfóides (timo, baço e bolsa cloacal), proventrículo, moela, intestino delgado e grosso, fígado e pâncreas. O peso dos órgãos foi obtido em balança de precisão (0,001g) e o peso relativo de cada órgão foi obtido pela fórmula:
Peso relativo = (peso órgão/peso vivo) x 100
Para a determinação de título de anticorpo contra a doença de Newcastle, as aves foram vacinadas contra a doença de Newcastle no sétimo dia de idade e realizada a coleta de soro sanguíneo de uma ave por unidade experimental aos 28 dias de idade. A coleta foi realizada por punção da veia jugular ou da veia braquial. A detecção de título de anticorpos contra a Doença Newcastle foi realizada por kit comercial imunoenzimático Enzime Linked Immunossorbent Assay (ELISA). Os títulos avaliados foram referentes à resposta vacinal (vacina vírus vivo).
Para a determinação do perfil hematológico, aos 28 e 42 dias foram colhidas amostras de sangue com anticoagulante (EDTA), através de punção da veia jugular de uma ave por unidade experimental, sete aves por tratamento. Foram produzidos esfregaços sanguíneos, corados com corante hematológico de Giensa, em que foram contadas 100 células da linhagem branca e determinada a proporção entre elas (Charles Noriega 2000).
Atividade fagocítica de macrófagos. Para avaliação da atividade fagocítica de macrófagos foi utilizada uma ave por repetição, sete aves por tratamento. As aves foram inoculadas no 38º dia de vida, através de injeção intra-abdominal de Sephadex G-50® (Sigma) a 3%, (um mL/100g de peso vivo) (Qureshi et al. 1986, Konjufca 2004) para migração dos macrófagos para a cavidade abdominal. Para esse procedimento foram utilizados cateteres intravasculares G-14. Após 42 horas, as aves foram submetidas a atordoamento por eletronarcose e sacrificadas através de deslocamento cervical. As aves foram lavadas com detergente neutro e sanitizadas com álcool 70%, sendo transportadas ao laboratório. A cavidade abdominal foi lavada com 20 mL de solução de tampão fosfato estéril heparinizado, contendo 0,5 UI/L (Liquemine® 25.000 UI/5mL - Roche) através de uma pequena abertura na parede e recuperados, aproximadamente, 15 mL de líquido após massagem. O líquido recuperado foi imediatamente refrigerado e centrifugado a 1500 rpm/10 minutos, sendo o "pellet", ressuspendido em 2 mL de meio RPMI 1640® (Sigma).
Da suspensão de macrófagos obtida em cada ave, 150 µL foi colocado em poços de placas de cultura contendo lamínula de 13 mm de diâmetro ao fundo, incubados por uma hora em temperatura ambiente para adesão dos macrófagos na lamínula. As placas foram lavadas com PBS estéril gelado para remover as células não aderentes e adicionado 150 µL de suspensão de 3% de eritrócitos de carneiros em meio RPMI 1640® (Sigma). As placas foram incubadas por uma hora em estufa (37ºC e 5% de CO2). As lamínulas em cada placa foram novamente lavadas com PBS estéril gelado, coradas pelo kit comercial Panótico Rápido LB® (Laborclin) e preparadas sobre lâminas histológicas utilizando Permount®. Em cada lamínula foram contados 300 macrófagos e verificado o número de células com hemácias fagocitadas. A atividade fagocítica (FA) foi calculada pela relação entre o número de macrófagos contendo hemácias fagocitadas e o número total de macrófagos contados.
Paralelamente uma segunda amostra de cada ave foi preparada da mesma para a determinação da concentração de óxido nítrico produzida pelos macrófagos aderidos. Nestas amostras, o sobrenadante foi coletado e congelado a -80ºC. A dosagem de nitrito foi realizada por meio da reação de Griess e posterior leitura em espectrofotômetro, com a presença de um controle positivo e negativo.
Reação de hipersensibilidade cutânea basofílica. A reação de hipersensibilidade cutânea basofílica ou avaliação da imunidade mediada por células in vivo, foi realizada aos 35 dias de idade, utilizando uma ave de cada unidade experimental (sete aves por tratamento) (Corrier & DeLoach 1990). Cada ave foi inoculada intradermicamente, no espaço interdigital entre o 3º e 4º dedo do pé direito com 0,1 mL de uma solução fitohemaglutinina PHA-M® (1057601 - Invitrogen). Como controle negativo, 0,1 mL de PBS estéril foi inoculado entre o 3º e 4º dedo do pé esquerdo. O espessamento da pele, de ambos os pés, foi aferido em milímetros utilizando um paquímetro digital antes da inoculação e 12, 24, 48 e 72 horas após a inoculação.
A resposta a fitohemaglutinina é medida pela espessura da pele após o tempo de inoculação menos a espessura no tempo zero (antes da inoculação). A resposta do controle é medida pela espessura da pele após o tempo de inoculação (PBS) menos a espessura no tempo zero (antes da inoculação). O cálculo foi realizado segundo Corrier & DeLoach (1990) da seguinte forma: Reação = resposta a fitohemaglutinina - resposta do controle.
Morfometria intestinal. A análise morfométrica da mucosa intestinal foi realizada aos 7, 21 e 42 dias, utilizando duas aves por unidade experimental. Os fragmentos do intestino delgado foram obtidos no duodeno, jenuno e íleo. As amostras foram lavadas em solução salina, fixados em formol 10% por 24h, desidratadas em uma série de concentrações crescentes de alcoóis, diafanizadas em xilol e incluídas em parafina. Foram feitos cortes histológicos transversais e semisseriados dos segmentos do intestino, com sete micrômetros de espessura e corados pelo método de Hematoxilina-Eosina. Imagens digitais obtidas em microscópio de luz foram utilizadas para as mensurações em software IMAGE PROPLUS 4.1, da Mídia Cibertecnics. De cada ave e de cada segmento intestinal foram medidos 20 vilos e 20 criptas intestinais. A relação vilo:cripta foi determinada pela fórmula: Altura de vilo/ profundidade de cripta.
Para realização da análise estatística, os dados obtidos de cada parâmetro foram desdobrados em polinômios ortogonais de forma a permitir a análise de variância e as médias foram comparadas pelo teste de Tukey a 5%, utilizando o programa estatístico SAEG® (2005).
RESULTADOS
Os valores médios dos pesos relativos dos órgãos de frangos de corte alimentados com diferentes fontes de vitamina D3, aos 7, 21 e 42 dias, estão demonstrados no Quadro 2. Aos 7 dias, as aves alimentadas com o metabólito 25(OH)D3 apresentaram maior peso absoluto do intestino delgado (P<0,05) em relação ao grupo 1α(OH)D3 no entanto o comprimento e o peso relativo do intestino delgado no mesmo período não apresentaram diferenças (P>0,05) entre os metabólitos. Aos 21 dias, os metabólitos apresentaram efeito inverso com relação ao peso absoluto, peso relativo e comprimento do intestino delgado de modo que o grupo alimentado com a fonte 1α(OH)D3 apresentaram maiores pesos em relação ao 25(OH)D3, porém sem diferenças em relação aos demais tratamentos.
Para peso do fígado aos 42 dias, o grupo 1α(OH)D3, apresentou o maior peso (P<0,05) que o grupo 1,25(OH)2D3, que não se diferenciaram dos demais. As demais variáveis de peso dos órgãos e vísceras não apresentaram diferenças (p>0,05) entre os diferentes metabólitos utilizados nas dietas.
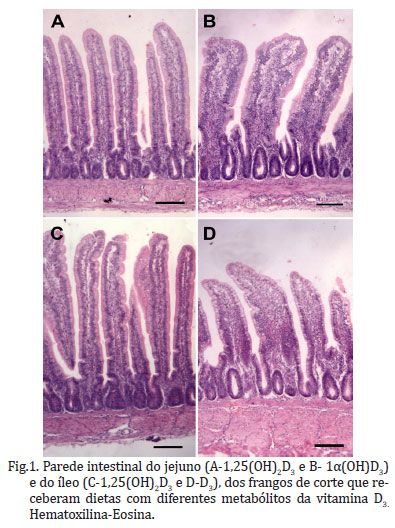
Aos 7 dias o 1,25(OH)2D3 proporcionou maior comprimento dos vilos que a 1α(OH)D3, no jejuno e que a vitamina D3 no íleo (Fig.1). Os demais metabólitos não diferiram (P>0,05) nestes mesmos segmentos. Para as demais idades o comprimento de vilo, profundidade de cripta e relação vilo:cripta não foram influenciados pelos diferentes metabólitos (Quadro 3).
O título de anticorpos contra a doença de Newcastle, reação de hipersensibilidade cutânea basofílica, avaliação da atividade de macrófagos, dosagem de nitrito e perfil eritrócito: leucócitos dos animais não foram influenciadas (P>0,05) pelos diferentes metabólitos da vitamina D3, em nenhum dos períodos avaliados (Quadros 4 e 5).
DISCUSSÃO
Os resultados sugerem que maiores pesos e comprimento do intestino delgado podem representar uma maior superfície de absorção dos nutrientes, porém aos 42 dias os comprimentos e pesos absolutos não apresentaram diferenças (P>0,05) entre si para os diferentes metabólitos. Somente o peso relativo do intestino delgado foi maior (P<0,05) para os animais alimentados com 1α(OH)D3, em relação aos demais metabólitos. Considerando que o peso relativo foi maior, sem alteração no peso absoluto e comprimento, pode-se concluir que o maior peso relativo é devido ao menor peso corporal dos animais alimentados com 1α(OH)D3. O maior peso relativo do fígado pode ser explicado também pelo menor peso médio dos animais alimentados com 1α(OH)D3.
Provavelmente, o aumento das vilosidades intestinais, aos 7dias, do grupo que recebeu o metabólito 1,25(OH)2D3 pode ter ocorrido pelo aumento nos níveis séricos deste metabólito, que influenciou a ativação de enzimas que atuam na regulação do desenvolvimento da mucosa intestinal. Assim, um aumento nas vilosidades intestinais está relacionado a um importante papel da vitamina D no desenvolvimento morfológico e funcional do intestino (Ding et al. 2011). Os animais alimentados com 1α(OH)D3, apresentaram intestinos mais pesados, porém menores comprimentos de vilos em comparação ao 1,25(OH)2D3, sugerindo que o 1,25(OH)2D3 pode ter acarretado em menor demanda energética e maior absorção de nutrientes (Chou et al. 2009).
Outro ponto importante é que ao longo de todo o trato gastrointestinal existem receptores para vitamina D que são de extrema importância para a absorção de cálcio e fosfato, porém estudos sugerem que estes receptores atuam também no desenvolvimento da mucosa intestinal. Isto porque estão localizadas em concentrações mais elevadas próximos a locais em que ocorrem maior diferenciação e proliferação celular no intestino, sugerindo sua atuação no desenvolvimento, integridade, homeostase e saúde intestinal (Klasing 2006, Riner et al. 2008, Zanuzzi et al. 2011). De acordo com McCarthy et al. (1984), este mecanismo se torna mais evidente quando administrado vitamina D após um período de deficiência, fazendo com que sua ação aconteça rapidamente de forma a reparar os danos causados pela deficiência.
As poliaminas, putrescina, espermidina e espermina, desempenham diversas funções no metabolismo dos animais, principalmente na fase inicial, atuando sobre a renovação e funcionalidade do trato gastrointestinal e maturação da mucosa intestinal (Shinki et al. 1985, Deng et al. 2005). A enzima ornitina descarboxilase converte a putrescina em ornitina e a espermidina N-acetiltrasferase, em espermidina. Essas enzimas são reguladas pelo 1,25(OH)2D3, desta maneira se dá a importância da vitamina D sobre a morfologia intestinal (Maeda et al. 2002, Ding et al. 2011). A falta de putrescina induz a redução no comprimento dos vilos e inibição na absorção de cálcio em pintinhos com deficiência em vitamina D, indicando a relação entre a putrescina, vitamina D e desenvolvimento da mucosa intestinal (Shinki et al. 1991).
O peso relativo dos órgãos e os demais parâmetros imunológicos não foram influenciado (p>0,05) pelos diferentes metabólitos da vitamina D3 utilizados. Provavelmente, nestes órgãos essas fontes agem de forma semelhante, e o mesmo pode-se sugerir para imunidade celular, uma vez que o timo é um órgão que possui receptores para vitamina D e atua principalmente em resposta mediadas por células T e produção de IL-4 por células Th2 (Catorna 2006).
O 1,25(OH)2D3 atua como imunomodulador de células do sistema imune como: linfócitos, macrófagos, citocinas e células citotóxicas naturais (natural killer). Grande parte das células do sistema imune possuem receptores para a vitamina D, sugerindo a participação desta na regulação do sistema imune (Bertolini & Tzanno-Martins 2000, Chen et al. 2013), sendo assim, seria esperado que os metabólitos atuariam de maneira distinta no sistema imune dos animais. Porém esse efeito não foi observado.
As aves são capazes de particionar a utilização da vitamina D em função de seu estado de saúde, além disso, a resposta imune primária é uma resposta fraca. A vitamina D favorece o desenvolvimento de células Th2 que induzem o crescimento e diferenciação celular e, que consequentemente, induzem a produção de imunoglobulinas. Dessa maneira, quando houver resposta secundária, esta tende a ser mais rápida com grande produção de anticorpos específicos (Chou et al. 2009). Os resultados corroboram com Fritts et al. (2002), no qual as fontes de vitamina D não diferiram quanto a resposta mediada por células.
A resposta de hipersensibilidade cutânea basofílica não sofreu influência dos diferentes metabólitos da vitamina D3. Aslam et al. (1998) encontraram uma máxima reação basofílica após 20 horas e concluíram que a dieta deficiente em vitamina D deprimiu a resposta, sugerindo que esta pode reduzir a imunocompetência mediada por células T em frangos de corte.
Embora vitamina D3 atue como imunomodulador no organismo, induzindo a fusão e diferenciação de macrófagos em decorrência de um estímulo relacionado a imunidade mediada por células (Bikle et al. 2008, Mayne et al. 2011), os resultados para atividade fagocítica e dosagem de nitrito, indicativo da atividade dos macrófagos, não diferiram (p>0,05) com os diferentes metabólitos. perfil hematológico também não foi influenciado (p>0,05) pelos diferentes metabolitos da vitamina D3.
Os macrófagos atuam como um mecanismo de defesa primário do organismo com a função de realizar fagocitose e secretar citocinas, as quais possuem uma ação muito importante no mecanismo de regulação da resposta imunológica, atuando nos processos inflamatórios, cicatrização, metabolismo ósseo e crescimento animal. Macrófagos ativados aumentam a secreção de citocinas que estimulam a produção de reativos de oxigênio, aumentando a produção de óxido nítrico, essenciais para os mecanismos de defesa dos macrófagos, relacionados a resistência a infecções e efeitos citotóxicos e a imunidade inata dos animais (Galha 2006, Bueno 2006, Xavier et al. 2006, Gertner et al. 2008).
Quanto ao perfil hematológico, a contagem de células sanguíneas não diferiu (P<0,05) entre os metabólitos. Os valores encontrados são semelhantes aos considerados normais de 60 a 65% de linfócitos, 25 a 30% de heterófilos, 2% de eosinófilos, 1,7% de basófilos e 10% de monócitos, com uma relação heterófilo: linfócito próximo a 1:2 (Laganá et al. 2005).
CONCLUSÕES
Os diferentes metabólitos de vitamina D3 afetaram positivamente a morfometria intestinal na fase inicial, com melhores resultados obtidos pelos animais alimentados com 1,25-dihidroxicolecalciferol.
Os parâmetros imunológicos foram similares entre os metabólitos.
Recebido em 5 de dezembro de 2013.
Aceito para publicação em 9 de abril de 2014.
- Aslam S.M., Garlich J.D. & Qureshi M.A. 1998. Vitamin D deficiency alters the immune responses of broiler chicks. Poult. Sci. 77:842-849.
- Barros R. 2010. Efeito da vitamina D ativada no desempenho zootécnico e qualidade óssea de suínos. Dissertação de Mestrado em Zootecnia, Universidade Federal do Paraná, Curitiba, PR. 57p.
- Bertolini D.L. & Tzanno-Martins C. 2000. Efeitos imunomoduladores da vitamina D: uma revisão. J. Bras. Nefrol. 22:157-161.
- Bikle D., Adams J. & Christakos S. 2009. Vitamin D: Production, Metabolism, Mechanism of Action, and Clinical Requirements, in Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism, 7th ed. John Wiley and Sons Inc., Hoboken, NJ, USA. 539p.
- Bueno R. 2006. Estudo do gene nramp1 canino em macrófagos infectados com Leishmania leishmania chagasi. Tese de doutorado,Universidade Federal de Minas Gerais, Belo Horizonte, MG. 88p.
- Catorna M.T., Zhu Y., Froicu M. & Whittke A. 2004. Vitamin D status, 1,25-dihydroxyvitamin D3, and the immune system. Am. J. Clin. Nutr. 80:1717-1720.
- Charles Noriega M.L.V.C. 2000. Apuntes de hematología aviar: material didático para curso de hematologia aviária. Departamento de Produccíon Animal: Aves, Universidad Nacional Autónoma de México, México. 70p.
- Cheema M.A., Qureshi M.A. & Havenstein G.B. 2003. A comparison of the immune response of a 2001 commercial broiler with a 1957 random bred broiler strain when fed representative 1957 and 2001 broiler diets. Poult. Sci. 82:1519-1529.
- Chen Y., Liu W., Sun T., Huang Y., Wang Y., Deb D.K., Yoon D., Kong J., Thadhani R., Li Y.C., Boos A., Hässig M. & Liesegang A. 2013. 1,25-dihydroxyvitamin D promotes negative feedback regulation of Toll-Like Receptor Signaling via Targeting MicroRNA-155-SOCS1 in macrophages. J. Immunol. 190:3687-3695.
- Chou S.H., Chung T.K. & Yu B. 2009. Effects of supplemental 25-hydroxycholecalciferol on growth performance, small intestine morphology, and immune response of broiler chickens. Poult. Sci. 88:2333-2341.
- Corrier D.E. & Deloach J.R. 1990. Evaluation of cell-mediated, cutaneous basophil hypersensitivity in young chickens by an interdigital skin test. Poult. Sci. 69:403-408.
- Deluca H.F. & Cantorna M.T. 2001. Vitamin D: its role and uses in immunology. FASEB Journal 15:2579-2585.
- Deng W., Viar M.J. & Johnson L.R. 2005. Polyamine depletion inhibits irradiation-induced apoptosis in intestinal epithelia. Am. J. Physiol. Gastrointest. Liver Physiol. 289:599-606.
- Ding B.A., Pirone A. & Lenzi C. 2011. Effect of hen diet supplemented with 25-OH-D3 on the development of small intestinal morphology of chick. J. Anim. Feed Sci. 20:420-431.
- Drozdowski L. & Thomson A.B.R. 2006. Intestinal mucosal adaptation. World J. Gastroenterol. 12:4614-4627.
- Fritts C.A., Erf G.F & Bersl T.K. 2004. Effect of source and level of vitamin D on immune function in growing broilers. J. Appl. Poult. Res. 13:263-273.
- Galha V. 2006. Relação entre imunossupressão e coccidiose clínica em frangos de corte criados comercialmente. Dissertação de Mestrado em Imunopatologia, Universidade Estadual Paulista, SP. 87p.
- Gertner L.R.S., Santin E. & Saad M.B. 2008. Influência fumonisina sobre a resposta imunológica de aves. Revta Acad. Ciênc. Agrár. Ambient. 6:401-411.
- Klasing K.C. 2006. Micronutrient supply: influence on gut health and immunity, p.210-223. In: Ibid. (Ed.), Avian Gut Function in Health and Disease. CABI International, Cambridge, MA.
- Konjufca V.K. 2004. Influence of dietary vitamin E on phagocytic functions of macropHages in broilers. Poult. Sci. 83:1530-1534.
- Kumar R. 1986. The metabolism and mechanism of action of 1,25-dihydroxyvitamin D3 Kidney International 30:793-803.
- Laganá C., Ribeiro A.M.L., González F.H.D., Lacerda L.A., Terra R. & Barbosa P.R. 2005. Suplementação de vitaminas e minerais orgânicos nos parâmetros bioquímicos e hematológicos de frangos de corte em estresse por calor. Bolm Indústr. Anim., Nova Odessa, 62:157-165.
- Lemire J.M. 1995. Immunomodulatory actions of 1,25-dihydroxyvitamin D3. J. Steroid Biochem. Mol. Biol. 53:599-602.
- Maeda Y., Rachez C., Hawel L., Byus C.V., Freedman L.P. & Sladek F.M. 2002. Polyamines modulate the interaction between nuclear receptors and vitamin D receptor-interacting protein 205. Mol. Endocrinol. 16(7):1502-1510.
- Mayne C.G., Spanier J.A., Relland L.M., Williams K.B. & Hayes C.E. 2011. 1,25-dihydroxyvitamin D3 acts directly on the T lymphocyte vitamin D receptor to inhibit experimental autoimmune encephalomyelitis. Eur. J. Immunol. 41:822-832.
- McCarthy J.T., Barham S.S. & Kumar R. 1984. 1,25-dihydroxyvitamin D, rapidly alters the morphology of the duodenal mucosa of rachitic chicks: evidence for novel effects of 1,25-dihydroxyvitamin D. J. Steroid Biochem. 21:253-258.
- Moruzzi M.S., Monti M.G., Piccinini G. & Mezzeti G. 1982. Spermine-binding protein and polyamine metabolism in duodenal mucosa of chick embryo. Life Sci. 31:1639-1644.
- Muszkai P., Camargo M.B.R., Griz L.H.M. & Lazaretti-Castro M. 2010. Evidence-based non-skeletal actions of vitamin D. Arq. Bras. Endocrinol. Metabol. 54:110-117.
- Quershi M.A., Dieteri R.R. & Bacon L.D. 1986. Genetic variation in the recruitment and activation of chicken peritoneal macrophages. Proc. Society for Experimental Biology and Medicine 181:560-568.
- Riner K., Boos A., Hässig M. & Liesegang A. 2008. Vitamin D receptor distribution in intestines of domesticated sheep Ovis ammon f. aries J. Morphol.269:144-152.
- Rostagno H.S., Albino L.F.T., Donzele J.L., Gomes P.C., Oliveira R.F., Lopes D.C., Ferreira A.S., Barreto S.L.T. & Euclides R.F. 2005. Tabelas brasileiras para aves e suínos: composição de alimentos e exigências nutricionais. 2Ş ed. Departamento de Zootecnia, UFV, Viçosa, MG. 186p.
- SAEG. 2005. Sistema de Análises Estatísticas e Genéticas, Versão 5.0. Universidade Federal de Viçosa, Viçosa, MG.
- Shinki T., Takahashi N., Kadofuku T., Sato T. & Suda T. 1985. Induction of spermidine NI-acetyltransferase by 1α, 25-dyhydroxyvitamin D3 as an early common event in the target tissues of vitamin D. J. Biol. Chem. 260:2185-2190.
- Shinki T., Tanaka H., Takito J., Yamagushi A., Nakamura Y., Yoshiki S. & Suda T. 1991. Putrescine is involved in the vitamin D action in chick intestine. Gastroenterology 100:113-122.
- Suda T., Shinki T. & Takahashi N. 1990. The role of vitamin d in bone and intestinal cell differentiation. Annu. Rev. Nutrition 10:195-211.
- Xavier E.G., Rutz F. & Roll V.F.B. 2006. Imunonutrientes na produção de suínos. Anais Simpósio UFRGS sobre Produção, Reprodução e Sanidade Suína, Porto Alegre. Universidade Federal do Rio Grande do Sul, Porto Alegre, p.174-190.
- Zanuzzi C.N., Nishida F., Portiansky P.A., Fontana P.A., Gimeno E.J. & Barbeito C.G. 2011. Effects of Solanum glaucophyllum toxicity on cell proliferation and apoptosis in the small and large intestine of rabbits. Res. Vet. Sci. 93:336-342.
Datas de Publicação
-
Publicação nesta coleção
10 Jul 2014 -
Data do Fascículo
Maio 2014
Histórico
-
Aceito
09 Abr 2014 -
Recebido
05 Dez 2013