Resumo
The Zn-TiO2nanocomposite films were prepared by electrodeposition, using an acidic zinc sulphate solution with TiO2 nanoparticles in suspension. The as-deposited samples have been heated in air at 450 ºC for 6 h. The XRD and SEM analyses pointed out to the metal matrix conversion from Zn to ZnO and a rich morphology of needles-shaped grains. These materials were used on the photoelectrochemical degradation of AO7, which was efficiently degraded, with 40% of color removal, after 2 h period at 1.0 V, under white light irradiation. The apparent first order rate constant of the photoelectrodegradation reaction was 4.12 x 10-3 min-1.
ZnO-TiO2 nanocomposite films; AO7 dye; photoelectrodegradation
ZnO-TiO2 nanocomposite films; AO7 dye; photoelectrodegradation
ARTIGO
Fotoeletrodegradação do corante AO7 utilizando filmes de nanocompósitos de ZnO-TiO2
Photoelectrodegradation of AO7 dye by ZnO-TiO2 nanocomposite films
Tânia FradeI; Anabela GomesI,* * e-mail: abmg@fc.ul.pt ; Maria Isabel da Silva PereiraI; Ana LopesII; Lurdes CiríacoII
IDepartamento de Química e Bioquímica, Faculdade de Ciências, Universidade de Lisboa, 1749-016 Lisboa, Portugal
IIDepartamento de Química, Universidade da Beira Interior, 6201-001 Covilhã, Portugal
ABSTRACT
The Zn-TiO2nanocomposite films were prepared by electrodeposition, using an acidic zinc sulphate solution with TiO2 nanoparticles in suspension. The as-deposited samples have been heated in air at 450 ºC for 6 h. The XRD and SEM analyses pointed out to the metal matrix conversion from Zn to ZnO and a rich morphology of needles-shaped grains. These materials were used on the photoelectrochemical degradation of AO7, which was efficiently degraded, with 40% of color removal, after 2 h period at 1.0 V, under white light irradiation. The apparent first order rate constant of the photoelectrodegradation reaction was 4.12 x 10-3 min-1.
Keywords: ZnO-TiO2 nanocomposite films; AO7 dye; photoelectrodegradation.
INTRODUÇÃO
Atualmente, os corantes utilizados na indústria têxtil exigem especial atenção, uma vez que a sua persistência no meio hídrico após o tratamento dos efluentes tem provocado problemas ambientais a nível mundial.1-3 Assim, o desenvolvimento de tecnologias eficazes para o tratamento de efluentes tem sido alvo de muita investigação. Existem vários métodos que permitem a remoção de cor e carga orgânica de efluentes que contenham corantes. No entanto, muitos destes métodos têm a desvantagem de serem de elevado custo, o que impossibilita a sua aplicação em larga escala na indústria têxtil.4
Os processos oxidativos avançados (POAs) mostram-se muito promissores no tratamento de efluentes, uma vez que demonstraram ser eficazes na degradação de poluentes orgânicos em águas e solos, sendo possível uma degradação quase total dos compostos.5 Os POAs utilizam o radical hidroxila (HO), que tem um elevado poder oxidante e pode promover a degradação de vários compostos poluentes num tempo relativamente reduzido. De modo geral, estes processos, envolvem oxidação química,6-8 eletroquímica,9 fotocatalítica10,11 e/ou fotoeletrocatalítica.12,13
Os processos de oxidação fotoeletrocatalítica têm sido a grande aposta por parte dos investigadores, pois têm demonstrado ser eficientes, econômicos e "amigos" do ambiente em várias aplicações industriais,14 incluindo a mineralização de poluentes orgânicos,15-17 purificação de água18 e ar,19 assim como na produção de combustíveis20,21 e eletricidade.22 Este tipo de processo baseia-se, de modo geral, na irradiação de um material semicondutor por fotóns, suficientemente energéticos, que permitam a passagem de elétrons da banda de valência para a banda de condução (e-BC), criando lacunas carregadas positivamente (h+BV) na banda de valência.23-25 Desta forma, os compostos orgânicos poderão ser degradados pelos radicais hidroxila formados através da reação da lacuna fotogerada com a água adsorvida à superfície do semicondutor26 e/ou da reação dos elétrons fotoinjetados com o O2 que formará um ânion radical superóxida, que irá sofrer reações sucessivas até a formação de radicais hidroxila.24,27 A aplicação de uma densidade de corrente ou de um potencial anódico constante ao fotoânodo, através de um circuito externo, irá permitir a fotogeração de elétrons que serão continuamente extraídos do fotoânodo, melhorando a eficiência do processo.23
Os semicondutores TiO2 e ZnO têm sido extensivamente estudados como fotocatalisadores15-19,28 e fotoeletrocatalisadores29-31 na degradação de poluentes orgânicos, devido ao seu baixo custo, alta eficiência, baixa toxicidade e alta estabilidade em meio aquoso. O problema da recombinação do par e-BC/h+BV gerado durante os processos fotocatalíticos é ultrapassado nos processos fotoeletrocatalíticos, pois aqui se induz o aumento do tempo de vida do par e-BC/h+BV, com o consequente aumento da eficiência.32 Com o objetivo de ultrapassar este problema e expandir a região de absorção da luz, melhorando a eficiência dos processos, têm sido estudadas diferentes formas de preparar nanocompósitos de ZnO-TiO2.33
Existem vários métodos de preparação de nanocompósitos de ZnO-TiO2, referenciados na literatura, sendo de salientar a oxidação térmica da matriz metálica por ser um método simples e econômico, permitindo produzir óxidos metálicos nanoestruturados e com dimensões diversas, mediante as condições de aquecimento.34
Neste trabalho prepararam-se, através de oxidação térmica, nanocompósitos de ZnO-TiO2, modificando a matriz metálica de Zn em ZnO, de modo a serem aplicados em fotoeletrocatálise.
O corante Acid Orange 7, AO7, foi escolhido como modelo por ser uma molécula simples e amplamente utilizado para coloração na indústria do papel e têxtil.35
PARTE EXPERIMENTAL
Preparação dos nanocompósitos de Zn-TiO2 e tratamento térmico
A solução eletrolítica era composta por 0,1 mol dm-3 ZnSO4.7H2O (Sigma-Aldrich, 99%), 0,2 mol dm-3 MgSO4.7H2O (Sigma-Aldrich, > 99%), 0,15 mol dm-3 H3BO3 (Panreac, 99.8%) e 10 g dm-3 de partículas de TiO2 (Aeroxide® P25), sendo acidificada a pH 4 pela adição de H2SO4 diluído. Todas as soluções foram preparadas diariamente sem purificação prévia, sendo desaeradas com fluxo de nitrogênio antes e durante a eletrodeposição.
Usou-se uma célula de vidro de dois compartimentos, com uma placa de Zn como eletrodo secundário e um eletrodo de Ag/AgCl como referência. O eletrodo de trabalho era um disco de Ti com 0,8 cm2 de área (Goodfellow Corporation). O disco de Ti foi mergulhado em HF a 40%, polido com sílica em pó de 0,05 µm (Buehler) e limpo em ultrassom durante 10 min em água ultrapura Millipore Milli-Q.
Os nanocompósitos de Zn-TiO2 foram preparados por eletrodeposição galvanostática pulsada, onde ic e ia são as densidades de corrente catódica e anódica (com os valores -19 e 19 mA cm-2, respectivamente) e, tc e ta as durações de impulso catódico e anódico (com os valores 16 e 8 ms, respectivamente).
A deposição foi realizada sob agitação (150 rpm) à temperatura ambiente durante 100 min. Após terminada a deposição, o eletrodo foi retirado da célula, lavado com água ultrapura Millipore Milli-Q e seco sob fluxo de nitrogênio durante 5 a 10 min.
As eletrodeposições foram realizadas usando um potenciostato/galvanostato Autolab PGSTAT12, com aquisição automática de dados por software GPES 4.9.
Os nanocompósitos de Zn-TiO2 foram posteriormente aquecidos ao ar durante 6 h a 450 ºC, usando uma velocidade de aquecimento de 1 ºC/min. Para tal, utilizou-se um forno convencial Naberterm P320 controlado pelo programador Logotherm Controller S19.
Caracterização dos filmes
A caracterização estrutural dos nanocompósitos foi realizada por difração de raios-X (DRX), num difratómetro Philips Analytical PW 3050/60 X'Pert PRO equipado com um detetor X'Celerator e com aquisição automática de dados através do software X'Pert Data Collector (V2.0b), usando uma radiação monocromática de CuKα como feixe incidente, operando a 40 kV e 30 mA.
Os difratogramas foram obtidos por varrimento contínuo num intervalo de 2θ de 20 a 90º, com um tamanho de passo 2θ de 0,02º e um tempo de aquisição de 10 s/passo.
A caracterização morfológica e elementar dos filmes foi realizada por microscopia eletrônica de varredura (FEG-MEV Jeol 7001F) e microanálise semiquantitativa por dispersão de energias (EDS), com um feixe de elétrons de 25 kV de potência.
Ensaios de fotoeletrodegradação
Os ensaios de fotoeletrodegradação do corante AO7 foram efetuados usando uma solução aquosa de 0,035 mol dm-3 Na2SO4 (pH 6,2) como eletrólito suporte, com 5 ppm do sal de sódio 4-dimetilaminoazobenzeno-4'-sulfónico, conhecido como Acid Orange 7 (AO7) (Sigma-Adrich).
Os ensaios foram realizados potenciostaticamente, sendo o valor de potencial aplicado de 0,8 e 1,0 V vs Ag/AgCl, durante 2 h, sob agitação, à temperatura ambiente. Os eletrodos de trabalho foram iluminados, através de uma janela de quartzo, a 365 nm e com luz branca colocada a 16 cm de distância. O volume de solução foi 100 mL.
O processo de fotoeletrodegradação foi acompanhado por espetroscopia de UV-Vis, num intervalo de 200 a 700 nm através de um espetrofotómetro Jasco V-560, com aquisição automática de dados via software Jasco Spectra Manager (V1.52). Utilizaram-se células de quartzo de 1 cm de percurso ótico. A concentração do AO7 foi determinada através dos valores de absorvância a λ = 485 nm e a percentagem de remoção da cor foi calculada através da Equação 1:
onde Abs0 é o valor de absorvância da solução inicial. Fizeram-se recolhas regulares de solução em intervalos de 30 min para determinação da absorvância da solução (Abs).
RESULTADOS E DISCUSSÃO
Caracterização estrutural
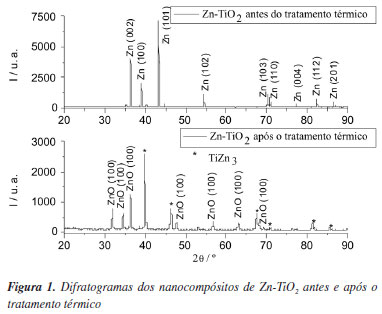
A identificação das fases constituintes dos nanocompósitos de Zn-TiO2 antes e depois de sujeitos ao tratamento térmico foi feita com base nos difratogramas respectivos. Na Figura 1 apresenta-se o resultado dessa identificação.
Pode verificar-se que as reflexões antes do tratamento térmico correspondem à fase cristalina do Zn hexagonal.36 Após o aquecimento, o Zn da matriz metálica transforma-se, com sucesso, na estrutura cristalina de ZnO hexagonal.37 Este fato poderá ser atribuído à presença das partículas de TiO2 incorporadas na matriz metálica. Estudos realizados anteriormente comprovaram que a presença de nanopartículas incorporadas numa matriz metálica promove a diminuição do tamanho de cristalite38 que, por sua vez, irá permitir uma conversão de uma matriz de Zn a ZnO bem sucedida.39,40 Segundo Lin et al.,40 a presença das partículas de TiO2 afeta o crescimento do tamanho de grão da matriz metálica, impedindo o aumento deste durante o processo de recristalização por ação do aquecimento.
Caracterização morfológica
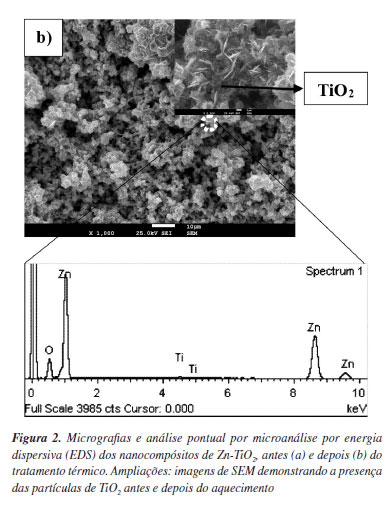
A morfologia da superfície dos nancompósitos de Zn-TiO2 antes e depois do tratamento térmico é mostrada na Figura 2. Nas micrografias dos nanocompósitos de Zn-TiO2 antes de aquecidos (Figura 2a), é visível um tamanho de grão de Zn reduzido e uma superfície morfologicamente irregular, com a formação de aglomerados. Após o aquecimento (Figura 2b), visualiza-se a formação de cristais hexagonais muito pequenos, nos quais crescem nanoagulhas com ~1 µm de altura, compostas por Zn e O, que foram identificados por EDS. Estes resultados estão de acordo com os reportados por Deguchi et al.,39 que descrevem as condições otimizadas para se obter amostras de Zn-TiO2 em aço, bem como as atividades fotocatalíticas após tratamento térmico. Aal et al.41 também provaram ser possível obter o mesmo tipo de morfologia na preparação de filmes de ZnO a 450 ºC.
De modo a interpretar o mecanismo de crescimento das nanoestruturas unidimensionais (1D) de ZnO, podem ser considerados diferentes mecanismos de crescimento de cristais. A morfologia das nanoestruturas pode ser influenciada por vários parâmetros experimentais, tais como temperatura de reação, tamanho de grão e textura cristalográfica do Zn e velocidade de oxidação que favorecem o crescimento na direção axial e a inibição nas direções restantes.34,42-44
Eletrodegradação fotoassistida do AO7
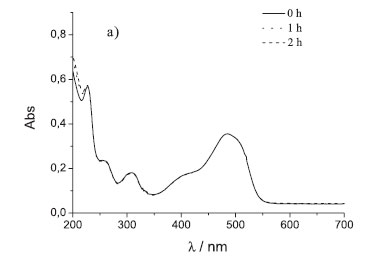
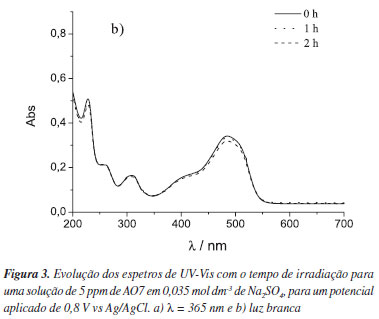
A Figura 3 mostra a evolução dos espectros de UV-Vis durante os processos de fotoeletrodegradação realizados a potencial constante igual a 0,8 V vs Ag/AgCl, utilizando como fotoânodo um nanocompósito de ZnO-TiO2 obtido por oxidação térmica, iluminado com luz monocromática λ = 365 nm (Figura 3a) e luz branca (Figura 3b).
A Figura 3a mostra que não ocorre degradação significativa do corante AO7, pois não se observa a diminuição das bandas de absorção a 485, 310 e 228 nm, características deste corante. No entanto, quando o fotoânodo é irradiado com luz branca, verifica-se uma ligeira diminuição das bandas de absorção a 485 e 228 nm. Este resultado permite afirmar que ocorreu uma pequena degradação do corante. Para se obter a degradação total, seria necessário aumentar o tempo de irradiação mantendo o mesmo valor de potencial aplicado ou aplicar um potencial mais positivo.
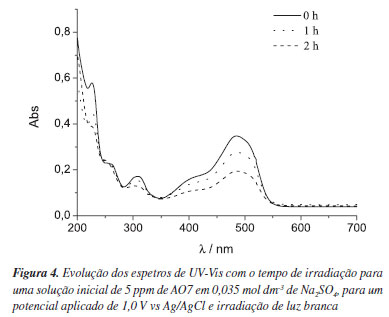
Na Figura 4 está representada a evolução do espectro de UV-Vis da solução eletrolítica contendo AO7, quando se aplica um potencial de 1,0 V vs Ag/AgCl sob irradiação de luz branca. Como se pode verificar, ocorreu uma diminuição considerável das bandas de absorção caraterísticas do corante, ao longo do tempo, comprovando a sua degradação parcial. A diminuição da banda de absorção a 485 nm corresponde à quebra da ligação azo (-N=N-) do corante. Estes resultados estão de acordo com os publicados para a degradação eletroquímica e fotoeletroquímica do AO7, usando eletrodos de diamante dopado com boro (BDD) e filmes mesoporosos de TiO2, respectivamente.35,45
A partir do valor de absorvância da banda a 485 nm foram calculadas as concentrações das amostras de AO7 ao longo do tempo de eletrólise, a partir da lei de Lambert-Beer.46 Através destes resultados foi possível calcular a percentagem de remoção de cor do corante, em solução, ao longo da fotoeletrodegradação, Figura 5. Observa-se que ao fim de 2 h de ensaio, a percentagem de remoção de cor é aproximadamente 40%. Hou et al.47 realizaram um estudo semelhante utilizando nanotubos de TiO2 na fotoeletrodegradação do AO7, obtendo 78% de degradação em 3 h para uma área geométrica de fotoânodo de 8 cm2. Considerando que a área geométrica dos filmes nanocompósitos é 10 vezes menor, pode-se concluir que a eletrodegradação fotoassistida do corante AO7 foi bem sucedida para o tipo de material estudado. A variação de ln(c/c0) com o tempo de fotoeletrodegradação (t) é linear. A constante aparente de velocidade de primeira ordem da reação de degradação pode ser estimada a partir da Equação 2:
em que c é a concentração de AO7 remanescente na solução no instante t e c0 é a concentração de corante inicial a t =0.
O valor obtido para k é de 4,12 x 10-3 min-1 (0,247 h-1), valor muito próximo ao obtido por Hou et al.47 para a degradação deste corante utilizando filmes de TiO2.
CONCLUSÃO
A preparação e utilização pela primeira vez de nanocompósitos de Zn-TiO2 na eletrodegradação fotoassistida do corante AO7 foi realizada com sucesso. A análise de DRX dos nanocompósitos de Zn-TiO2 confirma a conversão da matriz metálica de Zn para ZnO após o tratamento térmico, e os resultados de SEM indicam que os filmes apresentam uma elevada área com uma morfologia rica em nanoagulhas de ZnO.
Os testes de fotoeletrodegradação realizados ao potencial de 1,0 V vs Ag/AgCl, em 0,035 mol dm-3 Na2SO4, com 5 ppm de AO7, sob irradiação de luz branca, durante 2 h, demonstraram que os eletrodos utilizados são eficazes, tendo sido removida 40% da cor, sendo a constante aparente de velocidade de primeira ordem da reação de fotoeletrodegradação de 4,12 x 10-3 min-1.
AGRADECIMENTOS
Ao financiamento da Fundação para a Ciência e Tecnologia (Portugal), sob o projeto de investigação PTDC/CTM/64856/2006.
37. Em ref. 36, File 36-1451.
Recebido em 27/11/10; aceito em 18/5/11; publicado na web em 8/7/11
- 1. Hassemer, M. E. N.; Sens, M. L.; Engenharia Sanitária e Ambiental 2002,7,30.
- 2. Oliveira, L. C. A.; Gonçalves, M.; Oliveira, D. Q. L.; Guerreiro, M. C.; Guilherme, L. R. G.; Dallago, R. M.; J. Hazard. Mater. 2007,141,344.
- 3. Méndez-Paz, D.; Omil, F.; Lema, J. M.; Enzyme Microb. Technol. 2005,36,264.
- 4. Kunz, A.; Zamora-Peralta, P.; Moraes, S. G.; Durán, N.; Quim. Nova 2002,25,78.
- 5. Anotai, J.; Lu, M.-C.; Chewpreecha, P.; Water Res. 2006,40,1841.
- 6. Huber, M. M.; Canonica, S.; Park, G.-Y.; Gunten, U. V.; Environ. Sci. Technol. 2003,37,1016.
- 7. Saritha, P.; Aparna, C.; Himabindu, V.; Anjaneyulu, Y.; J. Hazard. Mater. 2007,149,609.
- 8. Neyens, E.; Baeyens, J.; J. Hazard. Mater. 2003,98,33.
- 9. Rajkumar, D.; Palanivelu, K.; J. Hazard. Mater. 2004,B113,123.
- 10. Méndez-Arriaga, F.; Esplugas, S.; Giménez, J.; Water Res. 2010,44,589.
- 11. Klauson, D.; Babkina, J.; Stepanova, K.; Krichevskaya, M.; Preis, S.; Catal. Today 2010,15,139.
- 12. Waldner, G.; Pourmodjib, M.; Bauer, R.; Neumann-Spallart, M.; Chemosphere 2003,50,989.
- 13. Zhao, X.; Qu, J.; Liu, H.; Qiang, Z.; Liu, R.; Hu, C.; Appl. Catal., B 2009,91,539.
- 14. Antoniadou, M.; Kondarides, D. I.; Labou, D.; Neophytides, S.; Lianos, P.; Sol. Energy Mater. Sol. Cells 2010,94,592.
- 15. Mills, A.; Le Hunte, S.; J. Photochem. Photobiol., A 1997,108,1.
- 16. Fujishima, A.; Zhang, X.; Tryk, D. A.; J. Hydrog. Ener. 2007,31,2664.
- 17. Herrmann, J. M.; Catal. Today 1999,53,115.
- 18. Bahnemann, D.; Sol. Energy 2004,77,445.
- 19. Zhao, J.; Yang, X. D.; Build. Environ. 2003,38,645.
- 20. Khaselev, O.; Turner, J. A.; Science 1998,280,425.
- 21. Kondarides, D. I.; Daskalaki, V. M.; Patsoura, A.; Verykios, X. E.; Catal. Lett. 2008,122,26.
- 22. Graetzel, M.; Nature 2001,414,338.
- 23. Martínez-Huitle, C. A.; Brillas, E.; Appl. Catal., B 2009,87,105.
- 24. Rauf, M. A.; Ashraf, S. S.; Chem. Eng. J. 2009,151,10.
- 25. Pelton, R.; Geng, X.; Brook, M.; Adv. Colloid Interface Sci. 2006,127,43.
- 26. Mahmoodi, N. M.; Arami, M.; Limaee, N. Y.; J. Colloid Interface Sci. 2006,295,159.
- 27. Yue, B.; Zhou, Y.; Xu, J.; Wu, Z.; Zhang, X.; Zou, Y.; Jin, S.; Environ. Sci. Technol. 2002,36,1325.
- 28. Yassitepe, E.; Yatmaz, H. C.; Öztürk, C.; Duran, C.; J. Photochem. Photobiol., A 2008,198,1.
- 29. Li, X. Z.; He, C.; Graham, N.; Ziong, Y.; J. Appl. Electrochem. 2005,35,741.
- 30. Cheng, S. T.; Chenthamarakshan, C. R.; Tacconi, N. R. de; Rajeshwar, K.; Res. Chem. Intermed. 2007,33,225.
- 31. Tacconi, N. R. de; Boyles, C. A.; Rajeshwar, K.; Langmuir 2000,16,5665.
- 32. Hoffmann, M. R.; Martin, S. T.; Choi, W. Y.; Bahnemann, D. W.; Chem. Rev. 1995,95,69.
- 33. Liu, R.; Ye, H.; Xiong, X.; Liu, H.; Mater. Chem. Phys. 2010,121,432.
- 34. Yuvaraj, D.; Rao, K. N.; Mater. Sci. Eng., B 2009,164,195.
- 35. Fernandes, A.; Morão, A.; Magrinho, M.; Lopes, A.; Gonçalves, I.; Dyes Pigm. 2004,61,287.
- 36. JCPDS-ICDD International Center for Diffraction Data; Powder Diffraction File Alphabetical Index, Swathmore: PA, 1988, File 4-0831.
- 38. Frade, T.; Bouzón, V.; Gomes, A.; Silva Pereira, M. I. da; Surf. Coat. Technol. 2010,204,3592.
- 39. Deguchi, T.; Imai, K.; Iwasaki, M.; Tada, H.; Ito, S.; J. Electrochem. Soc. 2000,147,2263.
- 40. Lin, C. S.; Lee, C. Y.; Chang, C. F.; Chang, C. H.; Surf. Coat. Technol. 2006,200,3690.
- 41. Aal, A. A.; Mahmoud, S. A.; Aboul-Gheit, A. K.; Mater. Sci. Eng., C 2009,29,831.
- 42. Yu, W.; Pan, C.; Mater. Chem. Phys. 2009,115,74.
- 43. Yuvaraj, D.; Rao, K. N.; Mater. Sci. Eng., B 2009,164,195.
- 44. Yan, H.; Hou, J.; Fu, Z.; Yang, B.; Yang, P.; Liu, K.; Wen, M.; Chen, Y.; Fu, S.; Li, F.; Mater. Res. Bull. 2009,44,1954.
- 45. Carneiro, P. A.; Osugi, M. E.; Sene, J. J.; Anderson, M. A.; Zanoni, M. V. B.; Electrochim. Acta 2004,49,3807.
- 46. Skoog, D. A.; Holler, F. J.; Crouch, S. R.; Principles of intrumental analysis, Brooks/Cole: New York, 2006.
- 47. Hou, Y.; Li, X.; Liu, P.; Zou, X.; Chen, G.; Yue, P.-L.; Sep. Purif. Technol. 2009,67,135.
Datas de Publicação
-
Publicação nesta coleção
27 Fev 2012 -
Data do Fascículo
2012
Histórico
-
Recebido
27 Nov 2010 -
Aceito
18 Maio 2011