Resumo
The purpose of this paper is to present a classification criterion for general chemistry experiments departing from a survey of 35 years of the experimental general chemistry discipline at the Chemistry Institute - UNICAMP. It is shown that by considering the most remarkable characteristics of an experiment and classifying it under Conceptual, Fundamental, Methodological or Quantitative criterion, teachers could better develop the discipline plan and prevent a subject superposition. Taking into account the system Fe3+/SCN- , the article also exemplify how is possible to modify an experimental approach and to conceive other procedures with different didactic purposes.
General Chemistry; experiments; classification
General Chemistry; experiments; classification
EDUCAÇÃO
Montagem de uma disciplina experimental: contribuição para a química geral
Conceiving an experimental discipline: a contribution to general chemistry
Deborah de Alencar SimoniI; João Carlos de AndradeII; José de Alencar SimoniII,* * e-mail: caja@iqm.unicamp.br
IPontifícia Universidade Católica de Campinas, Rod. D. Pedro I, km 136, 13086-900 Campinas - SP, Brasil
IIInstituto de Química, Universidade Estadual de Campinas, Cidade Universitária Zeferino Vaz, 13083-970 Campinas - SP, Brasil
ABSTRACT
The purpose of this paper is to present a classification criterion for general chemistry experiments departing from a survey of 35 years of the experimental general chemistry discipline at the Chemistry Institute - UNICAMP. It is shown that by considering the most remarkable characteristics of an experiment and classifying it under Conceptual, Fundamental, Methodological or Quantitative criterion, teachers could better develop the discipline plan and prevent a subject superposition. Taking into account the system Fe3+/SCN - , the article also exemplify how is possible to modify an experimental approach and to conceive other procedures with different didactic purposes.
Keywords: General Chemistry; experiments; classification.
INTRODUÇÃO
Pesquisas revelam que o laboratório de ensino pode ser um local apropriado para se desenvolver habilidades manuais e na resolução de problemas, na formação de conceitos e no desenvolvimento intelectual do estudante, no entanto, falha em alcançar todos esses objetivos conjuntamente.1
Em relação à estrutura de um roteiro experimental, uma classificação mais geral e simplificada, aponta para quatro categorias: laboratório formal ou de verificação (cookbook), laboratório aberto-fechado (semiestruturado), baseado num problema (problem-based), investigatório (inquiry-based). De acordo com a taxonomia de Bloom, a habilidade cognitiva é mais baixa para o primeiro tipo de laboratório (verificação) e vai aumentando conforme se caminha na direção do laboratório investigatório. Enquanto o laboratório de verificação exige apenas processos cognitivos de ordem mais baixa, como conhecimento e compreensão, em que o estudante deve apenas seguir passo-a-passo o procedimento experimental e depois preencher uma tabela em branco ou responder a algumas perguntas, previamente formuladas, o laboratório investigatório exige habilidades cognitivas de alta ordem, como análise, síntese e avaliação, uma vez que o estudante deve planejar toda a experimentação, inclusive a escolha do sistema a ser investigado.2
Um laboratório semiestruturado se parece mais com o de verificação, enquanto o baseado em um problema se aproxima do de investigação. De uma forma bem simplificada, um experimento semiestruturado apresenta alguns passos que devem ser seguidos e outros passos (bem simples) que o estudante deve planejar. No caso do experimento baseado num problema, o professor define o que vai ser estudado, dá algumas informações sobre o assunto e o estudante planeja como fazer.
No que diz respeito à evolução dos experimentos no ensino de química, as teorias do conhecimento de Bruner,3 Piaget4 e Vygotysk5 influenciaram de forma significativa na direção do laboratório investigatório, mas seria muito difícil descrever essa evolução no espaço desse texto. Entretanto, havendo interesse maior nesse assunto, o leitor pode procurar na literatura experimentos associados às palavras discovery, hands-on, construtivism, collaborative, cooperative, inquiry, etc.
Outro aspecto mais geral e simplificado que pode emergir dessas influências pode ser resumido numa classificação dos experimentos como cooperativos e colaborativos. Nos dois casos os estudantes trabalham para resolver um problema em comum. Cada estudante ou grupo resolve uma parte do problema. A diferença mais sutil entre esses dois tipos de experimentos diz respeito a sua estruturação de trabalho: no caso do cooperativo cada estudante obtém uma informação diferente e a junção de todas as informações leva à resolução do problema. Já no caso do colaborativo, todos investigam a mesma coisa e os resultados são discutidos e questionados. O laboratório cooperativo é mais eficaz onde o conhecimento básico e os assuntos estão definidos conceitualmente, enquanto que o colaborativo é mais eficaz onde o conhecimento depende das condições de trabalho, dos resultados e da forma como se vê o problema.6
A disciplina de química geral experimental tem múltiplos propósitos no ensino de química no nível superior. Como exemplo, só na UNICAMP são quatro disciplinas distintas, muitas vezes com diferentes objetivos, mas com experimentos em comum. Essas disciplinas têm sofrido muitas modificações ao longo do tempo, como consequência de adaptações de todos os tipos, introduzidas para refletir as condições locais de ensino.7-9
No entanto, em função das adequações introduzidas nos roteiros experimentais ou mesmo pela acomodação docente, muitos destes experimentos se perpetuam nessas disciplinas. Alguns permanecem durante décadas e outros, por outro lado, podem ser oferecidos apenas uma vez, como no caso da determinação da constante de Avogadro,10 como se observou no levantamento feito no IQ/Unicamp. Dentre os experimentos clássicos que se perpetuam está, por exemplo, a série de reatividade eletroquímica que, apesar de requerer o descarte de soluções de metais tóxicos, se configura numa das raras oportunidades que os alunos têm de vivenciar esse assunto de uma forma direta.11 Como substituir um experimento tão fundamental como esse? Considerando-se somente a série de reatividade, seria necessário introduzir multímetros e a construção de pilhas para a medida de potenciais, o que exigira uma habilidade elevada para os alunos do nível de química geral. Outra possibilidade seria restringir os metais para os casos menos insalubres, como ferro, alumínio, magnésio, zinco e cobre, além do íon H+.
Geralmente, experimentos que envolvem assuntos muito marcantes em alguma área específica da Química (ex.: inorgânica, analítica, etc.) correm o risco de serem oferecidos apenas uma única vez, e isso geralmente ocorre quando o professor enfatiza muito essa natureza específica. Um exemplo clássico, no IQ/Unicamp, é a determinação da pressão de vapor da água.12
Conforme defendem Johnstone e colaboradores,13,14 um bom experimento não deve ter um formato piramidal, com uma base larga contendo muitas informações e o objetivo principal no topo. Esse formato faz com que o objetivo (sinal) seja mascarado com detalhes pouco relevantes (ruídos). Esses pesquisadores sugerem que a estrutura experimental seja parecida a uma pirâmide invertida, em que a ideia principal (objetivo) esteja clara já de início, evitando que muitos aspectos secundários (ruídos) possam prejudicar o resultado pedagógico.
Outro ponto relevante a considerar diz respeito aos objetivos centrais de uma disciplina experimental de química geral. Há cursos que são intersecções de várias áreas do conhecimento, como no caso da Engenharia de Alimentos, Agronomia, Nutrição, Engenharia Agrícola, entre outros, em que não se dispõe de muito tempo para disciplinas de química e, frequentemente, só se oferece uma única disciplina de química, no formato de química geral. Nestes casos, quais as expectativas desses cursos em relação à disciplina de química geral? Geralmente, essas expectativas se restringem a cobrir o programa da disciplina que foi previamente estabelecido pela Faculdade ou Instituto que oferece o curso.
Por outro lado, quando a disciplina de química geral é oferecida como uma disciplina de serviço como, por exemplo, para alunos de Engenharia de Computação assistindo aulas de química ministradas por docentes de outro departamento ou Instituto, muitas dificuldades e divergências surgem devido ao interesse particular do curso que recebe o serviço e as reais possibilidades do departamento ou Instituto que oferece a disciplina. Administrar as necessidades de um lado e as possibilidades de outro pode ser uma tarefa árdua e, muitas vezes, com poucos resultados positivos.
De certa forma, há uma opinião generalizada de que uma disciplina de química geral experimental deva oferecer a qualquer estudante uma oportunidade de conviver com todas as nuances e características da Química, como a organização do conhecimento, os códigos e linguagem, as formas de comunicação e o uso correto de equipamentos, destacando o modo de agir e de pensar do químico nas suas atividades específicas.15
Quando se pensa na química geral experimental dessa forma, muitas dificuldades de atribuição de objetivos e organização da disciplina desaparecem. Num levantamento histórico de 35 anos de química geral experimental no IQ/Unicamp, foi grande a dificuldade em se estabelecer uma lógica única, norteadora da concepção dessa disciplina ao longo do tempo. Assim, tendo como cenário esse levantamento, propõe-se uma classificação para os experimentos, com a qual se espera contribuir ou facilitar a concepção de uma disciplina experimental.
Entretanto há que se considerar que o Brasil é um país de grande extensão e com muitas diferenças culturais, econômicas, etc. Nesse sentido, é possível admitir que haja diferenças entre o que foi observado na Unicamp e o que se observa em outros locais. Dessa forma, a "realidade local" poderá dificultar a aplicação direta da proposta aqui elaborada, mas nunca inviabilizá-la.
SITUANDO O PROBLEMA E A CATALOGAÇÃO DOS EXPERIMENTOS
Fundada em 1966, a Unicamp conta formalmente com o Instituto de Química desde 1968. A disciplina de química geral experimental, anteriormente nomeada Q- X , hoje QG- X, tem sido ministrada tanto aos alunos de graduação em Química quanto aos alunos da área de exatas. Porém, ao longo do tempo, diversas modificações ocorreram no perfil dessa disciplina.
Até por volta de 1980 todos os alunos (de Química e de outras áreas) cursavam, no então ciclo básico, Q-102 (química geral experimental I) e Q-202 (química geral experimental II). Com a extinção do ciclo básico e, posteriormente, com a criação das Comissões de Graduação dos Institutos e Faculdades, as unidades de ensino tornaram-se mais independentes para escolher o que consideravam mais útil para seus graduandos. No IQ foi criada uma única disciplina de química geral, denominada QG-102, uma condensação das anteriores Q-102 e Q-202.
Ao longo dos anos, a disciplina QG-102 foi sendo modificada, utilizando-se experimentos mais adequados às necessidades de cada curso. Atualmente os alunos das áreas das Engenharias de Computação, Elétrica, Mecânica e de Controle e Automação têm a disciplina QG-100, enquanto os da Biologia têm a QG-107, e os da Engenharia Química e Engenharia Agrícola têm a QG-102. Todas essas disciplinas são denominadas disciplinas de serviço. Os alunos dos cursos de Química e de Farmácia cursam a disciplina QG-109. Até 1995 essa disciplina tinha a sigla QG-103.
Porém, o fato de ter havido uma separação das disciplinas não implicou, necessariamente, em divergência total entre elas; inclusive, a cada semestre, a substituição de experimentos é uma tendência na busca da melhor qualidade para a disciplina. Dessa forma, a maioria das QG(s), se não todas, adota experimentos comuns ou semelhantes, que enfatizam tópicos importantes para os alunos e, por esse motivo, têm sido frequentemente oferecidos ao longo do tempo.
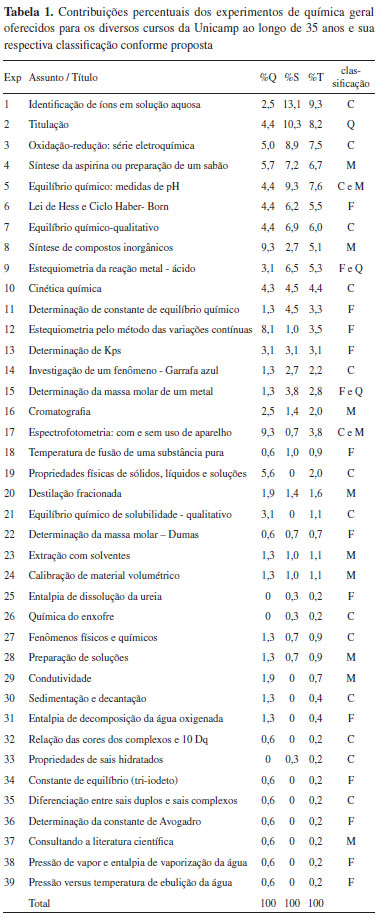
O levantamento dos experimentos oferecidos nas disciplinas de química geral experimental foi feito junto aos professores, técnicos de laboratório e comissão de graduação do IQ/Unicamp. Dentre os materiais utilizados destacam-se relatórios, cadernos de técnicos de laboratório e principalmente apostilas. Além disso, de alguns professores foram obtidas informações particulares sobre períodos onde não havia registros. A Tabela 1 mostra os resultados obtidos:
Nessa Tabela, (%Q) é a contribuição percentual do experimento ao longo do tempo nas disciplinas de química geral para o curso de Química, (%S) para os cursos de serviço do IQ/Unicamp e (%T) é a contribuição percentual do experimento como um todo. O valor (%T) foi calculado dividindo-se a quantidade de vezes que o experimento foi oferecido nas disciplinas de química geral, pela quantidade total de experimentos oferecidos, ao longo dos 35 anos. É importante observar que os valores de T% são intermediários entre Q% e S%.
Apresentação da proposta
Após levantamento e catalogação de todos os experimentos oferecidos ao longo desse tempo nas disciplinas de química geral, algumas perguntas ainda requerem respostas: O que teria motivado a escolha dos professores entre um ou outro experimento? Que critérios cada professor teria utilizado nessa escolha? Teria o professor baseado sua escolha em alguma literatura específica?
Apesar dos esforços, não foi possível encontrar as respostas desejadas por meio desse levantamento. Entretanto, um dos autores desse trabalho tem ministrado essas disciplinas de química geral por inúmeras vezes ao longo tempo e o que pode relatar é que as ementas e programas dessas disciplinas sempre foram seguidos. Porém, os programas e as ementas só contemplavam e contemplam aspectos de conteúdo, não se preocupando, por exemplo, com formatos e outros aspectos pedagógicos importantes na experimentação. De acordo com a proposta deste trabalho, um exemplo clássico de equívoco é oferecer a síntese da aspirina como o último experimento da disciplina, sob o argumento que ele contempla aspectos da "química orgânica", quando na verdade ele deve ser utilizado como um experimento "Metodológico" (ver classificação à frente) e deve, portanto, ser oferecido no início da disciplina, como segundo ou terceiro experimento.
Outros equívocos têm sido observados ao longo do tempo, o que motivou a procura de possibilidades e de novos pontos de vista para essa disciplina. Como resultado, propõe-se uma classificação geral para os diversos tipos de experimentos, válidos para qualquer disciplina experimental de química. Talvez essa proposta já tenha sido, inconscientemente, empregada por alguns professores na escolha dos experimentos mais apropriados aos objetivos institucionais, permitindo inclusive escolhas mais equilibradas para a composição das disciplinas.
Sabe-se que, em linhas gerais, os cuidados míninos necessários ao se propor um experimento são:
1. Alertar sobre a periculosidade e toxicidade de substâncias perigosas ou insalubres utilizadas; sempre que possível, evitar o emprego de substâncias deste tipo.
2. Trocar substâncias de um roteiro original que levem à geração de resíduos de difícil descarte, por outras que contemplem esse aspecto, sem prejudicar o objetivo didático do experimento.
3. Exigir exatidão e precisão de resultados, compatíveis com a instrumentação e preparo dos alunos.
4. Tomar cuidado especial com resultados muito complexos para serem analisados, quando comparados aos objetivos centrais do experimento.
5. Utilizar sempre uma instrumentação mais simples se o aluno não tiver a oportunidade de operar ou entender como um instrumento mais complexo funciona.
6. Propor experimentos adequados ao período de duração da aula. Não exceder o tempo e nem terminar muito cedo.
7. Verificar a disponibilidade de instrumentos e compatibilizar seu uso com o período da aula e o número de alunos.
8. Evitar erros conceituais, de códigos e da linguagem da Química no roteiro fornecido.
9. Observar recomendações da IUPAC e usar o Sistema Internacional de Unidades no roteiro.
10. Evitar roteiros tipo "livro de receitas".
11. Verificar erros de português e a clareza das informações.
12. Explicitar, na introdução do roteiro experimental, a principal motivação do experimento.
Tendo em conta todos esses cuidados básicos, o que aqui se propõe é uma classificação de experimentos laboratoriais de química, de modo que seja facilitada a montagem de uma disciplina de química geral experimental.
Classificação dos experimentos
Experimentos conceituais (C)
São experimentos que envolvem conceitos fundamentais da Química. Normalmente os aspectos quantitativos não devem ser muito exigidos na sua execução e não há um único roteiro central, mas sim vários procedimentos semelhantes envolvendo espécies químicas diferentes. Frequentemente, esses experimentos não requerem medidas precisas de quantidades, como volume e massa, são independentes da temperatura e da pressão e têm como característica principal alterações drásticas de aspectos físicos do sistema, facilmente perceptíveis.16
Nesse tipo de experimento não há muita preocupação em se detalhar técnicas de transferências, manipulação de substâncias, pesagens, controle de temperatura ou uso de instrumentação específica.
Dentre outros, os principais tópicos abordados nesse tipo de experimento são: equilíbrios químicos vistos sob o ponto de vista qualitativo, principalmente relativos ao princípio de Le Chatelier; verificação da ocorrência ou não de reações químicas (observação de formação de precipitados, aquecimento ou resfriamento do meio reacional, mudanças de cor, formação de gases); testes de identificação de substâncias orgânicas e inorgânicas (principalmente as inorgânicas) e a observação de séries de reatividades em reações de oxidação e redução.11
Experimentos metodológicos (M)
Estes experimentos têm como objetivo central o desenvolvimento do aluno em técnicas experimentais, como transferências de materiais sólidos, líquidos ou gasosos, (estes com menor frequência), calibração de material volumétrico, separação de substâncias (líquido-líquido e líquido-sólido), utilização de balanças e instrumentos de pequeno porte (como espectrofotômetros, condutivímetros, medidores de pH e voltímetros),17 medidas de temperatura, processos de destilação, purificação por recristalização, etc. Enquadram-se neste bloco experimentos de sínteses em geral e separações ou purificações de determinadas substâncias presentes em matrizes mais complexas, como no caso da separação de produtos naturais por cromatografia.18,19 Quando os experimentos exigem medidas mais exatas e precisas de quantidades físicas (ex.: massa, volume, etc), o uso de balanças analíticas e de aparelhos volumétricos calibrados é recomendado. Neste aspecto, os experimentos metodológicos confundem-se com os quantitativos, mencionados abaixo.
Experimentos fundamentais (F)
Classificam-se como fundamentais os experimentos que envolvem medidas de quantidades fundamentais para a caracterização de um sistema químico. Em geral, em alguma etapa do experimento, são necessárias medidas quantitativas com razoável exatidão e precisão, exige-se um padrão de comparação e também algum controle das condições experimentais, principalmente da temperatura.
Não é uma condição necessária, mas é bastante comum a utilização de instrumentação de pequeno ou de médio porte, como no caso dos experimentos metodológicos. Aqui, no entanto, a preocupação não é exclusivamente com a técnica em si, mas sim com o resultado. Os dados, geralmente, têm que ser elaborados para se obter o resultado final desejado, ao contrário dos experimentos metodológicos em que os dados obtidos já servem como objetivo final do experimento e a principal preocupação é entender como se faz a medida.
Nos experimentos fundamentais procuram-se grandezas fundamentais como constantes de equilíbrio de solubilidade e de dissociação ácida ou básica, valores de pressão de vapor, valores de temperatura de transição de fases, grandezas energéticas em processos de transição de fases ou em reações químicas etc.20,21
Como característica particular, o conhecimento e o controle da pureza das substâncias são fundamentais nestes experimentos. Quando não se usa instrumentação nesse tipo de experimento, frequentemente são necessárias quantidades maiores de substâncias em relação àquelas em que se utilizam instrumentos.
Normalmente esses experimentos são introduzidos em disciplinas em que se deseja ilustrar, ou reforçar, experimentalmente, algum conceito ou princípio que está sendo visto em uma disciplina teórica paralela. Na maioria das vezes, quando se trata de cursos em que estão previstas outras disciplinas de química, esses experimentos serão repetidos com muito mais rigor, tanto no procedimento quanto no tratamento dos dados experimentais, em disciplinas específicas.
Experimentos quantitativos (Q)
Para esses experimentos, seria mais apropriado nomeá-los como química analítica quantitativa básica. É comum esse tipo de experimento envolver determinações quantitativas de diversos gêneros. No entanto, não é comum fazer determinações de substâncias preparadas pelos próprios alunos. Normalmente as determinações são feitas para amostras naturais, podendo ser alimentos, rochas e também produtos comerciais, cuja determinação de pureza é o objetivo mais frequente.
Em vista da inexperiência dos alunos e do uso de instrumentação simples, o professor geralmente precisa adicionar impurezas ("batizar") ou, alternativamente, utilizar um produto de baixa pureza para se atingir o objetivo. Quando se trata de uma amostra natural como alimentos e frutas, ou um produto comercial como um complemento alimentar ou mesmo uma rocha, o experimento desperta maior interesse dos alunos.
Quando se oferece esse tipo de experimento, é importante levar em conta o curso de formação e adequar a amostra sob análise, de modo a motivar o estudante. Assim, a análise de um comprimido de vitamina C faz mais sucesso entre os estudantes de Biologia, enquanto que o teor de carbonato em uma rocha faz mais sucesso entre os estudantes de Engenharia Civil ou Agronomia.22
Se o experimento estiver dentro dessa classificação, então o uso de padrões químicos será sempre uma rotina no procedimento. As determinações quantitativas podem envolver técnicas gravimétricas, volumétricas, espectrofotométricas e potenciométricas. No entanto, a análise de qualquer texto de experimentos para química geral irá revelar uma preferência pela análise volumétrica.23
Essa proposta de classificação não significa, no entanto, que um experimento classificado de uma forma, não possa também ser classificado de outra forma. A grande vantagem dessa classificação é justamente o fato de que o olhar e a experiência do professor podem permitir que um experimento possa ser classificado, modificado e utilizado conforme a necessidade. No entanto, há propostas em que todas essas possibilidades estão presentes.24
A seguir, como forma de exemplificar essa proposta, apresenta-se um experimento muito utilizado nas disciplinas experimentais: o estudo do equilíbrio envolvendo a formação dos complexos Fe(III)-tiocianato.
Equilíbrios envolvendo os íons tiocianato e Fe(III)
Em linhas gerais, esse experimento envolve o estudo do equilíbrio entre os íons SCN - e Fe3+, para formar complexos de cor vermelha do tipo [Fe(SCN)n(H2O)6-n]3-n, em que n = 1,2,......,6. Em baixos valores de [SCN - ]/[Fe3+], a espécie predominante é a [Fe(SCN)(H2O)5]2+ e em altas relações a espécie predominante é a [Fe(SCN)6]3- , Equação 1:
Esses equilíbrios são muito interessantes e muito utilizados, pois envolvem a formação de compostos de coloração vermelha muito intensa, soluções de fácil manuseio e descartes pouco insalubres. Os valores de constantes de formação das várias espécies são bastante divergentes na literatura, o que levou a IUPAC a fazer uma revisão do assunto.25 Por esse documento da IUPAC, log β1 = 2,94 ; log β2 = 5,30 e log β3 = 6,22. Os trabalhos de Ozutsumi et al.26,27 mostram valores de constantes de formação para as seis espécies químicas possíveis, sendo log β4 = 12,4; log β5 = 13,9 e log β6 = 14,8, porém esses estudos foram feitos em meio não aquoso (DMA) contendo (C2H5)4NClO4 na concentração de 0,4 mol dm-3. Esses mesmos trabalhos mostram que as espécies com 4, 5 e 6 tiocianato não se formam em meio aquoso simples e mostram que o íon ferro se coordena ao tiocianato pelo nitrogênio.
Por outro lado, conforme Greenwood e Earnshaw, é possível obter no estado sólido apenas a espécie Fe(SCN)3 e sais dos íons [Fe(SCN)4] - e [Fe(SCN)6]3.3-28 Como as constantes de formação dos complexos são bastante favoráveis, o uso desse sistema químico em experimentos introdutórios é frequente, apesar das complicações causadas pela presença de várias espécies em equilíbrio na solução.
Considerando então os equilíbrios envolvendo os íons SCN - e Fe3+ e suas interações com outras espécies químicas em solução, apresentam-se abaixo exemplos dos vários enfoques de acordo com a proposta de classificação.
Experimento com o enfoque conceitual
Num roteiro com o propósito conceitual, por exemplo, pode-se estudar a influência de íons não comuns ao equilíbrio na coloração da solução. Também se pode estudar o efeito do pH no equilíbrio, uma vez que o Fe3+ pode precipitar em altos valores de pH e o SCN - pode se associar aos íons H3O+ em valores de pH mais baixos. Íons que se coordenam ao Fe3+, como o PO43- e o [Fe(CN)6]4- , também podem ter sua influência verificada no equilíbrio.29
É importante ressaltar que, nesse caso, o roteiro seria conduzido sem muito rigor nas quantidades. Por exemplo, pode-se observar a variação da coloração de uma solução contendo uma proporção fixa entre as concentrações de Fe3+ e SCN - , ao se adicionar a ela outra solução contendo íons que interferem ("interferentes") no equilíbrio inicial.
Repare que nesse procedimento o interesse é verificar um conceito químico: a questão da influência de alguns fatores no equilíbrio químico. Esse roteiro poderia servir tanto em disciplinas de química geral como em química analítica qualitativa. Não seria necessário muito rigor em quantidades e as observações envolveriam apenas mudanças de cores ou diminuição de intensidades da cor vermelha. No entanto, esse procedimento não poderia contemplar estudos sobre o efeito do íon comum devido à possibilidade de formação de diferentes espécies [Fe(SCN)n(H2O)6-n]3-n, como mencionado anteriormente.
Experimento com o enfoque fundamental
Para atender às especificações desse tipo de roteiro, o procedimento deve contemplar um controle das quantidades iniciais de Fe3+ e SCN - . Há exemplos na literatura de como conduzir o experimento com esse propósito. Por exemplo, pode-se estudar espectrofotometricamente a influência de um eletrólito inerte no equilíbrio químico, caso o interesse seja mostrar que uma constante de equilíbrio calculada em termos da concentração das espécies não se mantém constante com variações da força iônica.
Esse exemplo é adequado à disciplina de química geral como proposto por Stolzberg.30 Com um pouco mais de rigor, esse roteiro pode ser também aplicado a disciplinas experimentais de físico-química.31 É importante notar que se trata de um mesmo sistema químico, envolvendo o mesmo princípio, mas com propósitos e concepções diferentes da proposta anterior e com conteúdos diferenciados.
Alguém pode argumentar que isso é o esperado, já que se trata de diferentes disciplinas. É verdade, mas também pode ser aplicado a uma única disciplina como a química geral experimental, bastando que o professor defina seus propósitos e, então, faça os ajustes necessários. A ideia dessa classificação é mostrar que isso é desejável, não é difícil, bastando que se tenha uma noção clara do que se pretende didaticamente.
Experimento com o enfoque metodológico
Como visto anteriormente, o roteiro com características de experimento fundamental aplicado à química geral pode ser adaptado para se ter como objetivo o uso de espectrofotômetros.30 Como o roteiro da ref. 18 utiliza o espectrofotômetro, o professor pode focar sua atenção, prioritariamente, para o uso adequado deste instrumento, num experimento metodológico.
Assim o roteiro pode propor a obtenção de espectros de absorção das várias soluções com razões de concentração [SCN - ]/[Fe3+] diferentes e também pode solicitar que se faça uma curva de calibração para a determinação de ferro, usando as condições experimentais onde a existência da espécie [Fe(SCN)(H2O)5]2+ é preponderante.
Nesse caso, os objetivos do professor na condução do experimento seriam a utilização do instrumento, a construção de uma curva de calibração e como se utilizam as informações contidas em um espectro de absorção.
Esse tipo de roteiro poderia servir muito bem, tanto para uma disciplina de química geral como para uma disciplina de química analítica instrumental. Evidentemente o rigor na obtenção dos dados e na operação do instrumento seria bem diferente nos dois casos. Também aí a classificação proposta é importante, pois o professor pode definir seus objetivos em função do que se espera na disciplina em questão.
Experimento com o enfoque quantitativo
Esse tipo de roteiro é muito parecido com o metodológico, mas a principal diferença diz respeito ao objetivo final. Em um roteiro do tipo quantitativo pode-se informar, por exemplo, o coeficiente de absorção molar do complexo em um determinado comprimento de onda e solicitar que apenas as medidas de absorvância sejam realizadas. Este seria o caso para aplicação em uma disciplina de química geral, em que a inexperiência do estudante, associada à pouca disponibilidade de tempo de aula, é um fator que não pode ser ignorado.
O mesmo experimento poderia ser oferecido em uma disciplina mais específica, como química analítica quantitativa, onde o rigor experimental exigiria, por exemplo, o preparo adequado das soluções e a construção da curva analítica.32 É importante reparar que esse tipo de roteiro tem como objetivo central a determinação da concentração de uma substância em uma solução, como no caso de uma titulação, mas o rigor na experimentação deve ser muito maior em uma disciplina especifica de química analítica quantitativa.
DISCUSSÃO
Em relação ao levantamento histórico dos experimentos, Tabela 1, observa-se um total de 39 experimentos que, na realidade, é um número bem maior, já que alguns títulos foram agrupados como, por exemplo, os experimentos de titulação (experimento 2), em que o objetivo poderia ser a determinação da hidratação do ácido oxálico, ou a acidez do leite ou de um suco, ou do teor de vitamina C.
Também é importante enfatizar o fato de que alguns experimentos foram oferecidos poucas vezes. Nesses casos, o que geralmente ocorre é que o experimento não contempla a ementa ou o programa da disciplina, ou o tempo de duração do experimento é inadequado, ou há muitas incertezas nos resultados, o que, de alguma forma, motiva a sua remoção da disciplina.
Outro aspecto relevante a considerar é o fato de que em 100% dos casos verificados, o primeiro experimento é classificado como conceitual, exemplificado pelos experimentos 14 (Garrafa azul), 1 (Identificação de íons em solução) e 27 (Fenômenos físicos e químicos). De alguma forma, essa observação indica que, pelo menos subliminarmente, os professores concordam que ao entrar pela primeira vez em um laboratório, o estudante não pode se deparar com um procedimento experimental complexo e que os resultados experimentais não devem ser muito dependentes do procedimento experimental. Há que se considerar que esses experimentos também provocam alguma excitação nos estudantes, o que é conveniente no início do curso.
Mais especificamente sobre os dados da Tabela 1, fazendo-se a soma percentual das quatro classificações possíveis e normalizando-as (considerando-se que um mesmo experimento pode ter recebido duas classificações), observa-se que 38,5% são de experimentos conceituais, 22,2% são fundamentais, 25,8% são metodológicos e 13,6% são quantitativos. Na opinião dos autores, se esse resultado fosse uma realidade dentro de um único semestre, estaria evidenciado um equilíbrio dentro da disciplina, visto que os experimentos quantitativos não são tão definitivos na formação dos estudantes. Onde eles são importantes, com certeza, os estudantes terão oportunidades futuras de experimentá-los. O que não deve ocorrer é a predominância de um único tipo de experimento na disciplina, a menos que esse seja um objetivo explícito do curso de formação (recentemente a Faculdade de Engenharia de Alimentos da Unicamp retirou de seu programa a disciplina de química geral e toda a capacitação dos alunos recaiu sobre a química analítica, como primeira disciplina de química).
De modo geral, como visto acima, vários experimentos podem ter mais que uma classificação, mesmo partindo-se de um mesmo roteiro. Nesses casos, a grande vantagem para o professor está no fato de que, se o experimento é versátil, ele pode ser aproveitado em diferentes momentos e com diferentes objetivos. Basta, para isso, que o professor faça pequenas alterações no roteiro, de modo a adequá-lo à sua necessidade.
Outro aspecto interessante nessa classificação reside no fato de que uma disciplina de química geral experimental, na opinião dos autores, deve oferecer experimentos de tipos variados. Utilizando esses critérios, o professor pode evitar, por exemplo, oferecer dois procedimentos de titulação com propósitos semelhantes.
Por outro lado, um experimento de síntese em química geral deve ter o propósito único de ser um experimento metodológico, possibilitando ao aluno, vivenciar técnicas de pesagens em balanças semianalíticas, transferências de substâncias, processos de solubilização e cristalização e filtrações. Essas são operações unitárias fundamentais, necessárias em qualquer atividade experimental na disciplina de química geral, em outras disciplinas ou mesmo na futura atividade profissional do aluno. Dessa forma, esse tipo de experimento deve ser oferecido nas primeiras aulas, deve ser de fácil realização, envolver substâncias de fácil manuseio e pouco insalubres, além de permitir a obtenção de produtos a partir de reações que dêem um bom rendimento na síntese. Geralmente os alunos gostam bastante desse tipo de experimento. No IQ/Unicamp tem-se utilizado frequentemente nas disciplinas de química geral a síntese da aspirina e também do tris(oxalato) ferrato(III) de potássio, tri-hidratado (K3[Fe(C2O4)3].3H2O).18,24
Com o andamento da disciplina, seria conveniente oferecer um experimento quantitativo, mas não se deve exigir necessariamente o manuseio de substâncias higroscópicas, de massas molares muito pequenas ou muito elevadas. A obtenção dos resultados não deve ser dependente de operações sequenciais, uma vez que um erro inicial pode prejudicar todas as operações subsequentes, sendo difícil avaliar em que momento ele pode ter ocorrido.
Em química geral, os experimentos metodológicos geralmente envolvem instrumentação de pequeno porte como espectrofotômetros, peagâmetros, condutivímetros e multímetros. Dependendo do tempo e da quantidade de instrumentos disponível, o roteiro pode exigir procedimentos de calibração do instrumento. No entanto, quando essa operação tiver que ser realizada várias vezes e por vários usuários, o melhor é realizar previamente esse procedimento ou então fazer com que esse procedimento seja compartilhado por vários usuários. Isso é típico em experimentos onde se pede a construção de uma curva de absorção.24
Como em geral não há muitos instrumentos disponíveis nos laboratórios de ensino de química geral, três ou mais grupos podem compartilhar o instrumento ou então o tempo será um fator limitante. Também quando são muitas as medidas experimentais a serem realizadas, pode-se propor o compartilhamento dos dados obtidos por vários grupos de alunos, cada um deles dando a sua contribuição ao outro. Isso poupa tempo, permite utilizar o experimento com o duplo propósito de se estudar o sistema proposto e possibilitar a capacitação dos alunos na organização do trabalho experimental, uma tarefa que o professor deve deixar os alunos realizarem.
Os experimentos conceituais e fundamentais oferecem uma oportunidade ao aluno de vivenciar aspectos de conteúdo da química. Dessa forma, o professor deve estar atento à grade curricular do aluno. Se o aluno tem disciplinas teóricas que envolvem ou envolverão o assunto em pauta, o experimento deve permitir situações mais características do assunto, com ênfase especial em aspectos que não podem ser vivenciados pela teoria ou que são tão significativos que devem ser vistos tanto na teoria como na prática.
Não há consenso na literatura se a experimentação precede ou deve vir após a teoria, ou se ambas devem ser concomitantes. Se os alunos forem consultados, também se perceberá que eles não têm uma escolha preferencial. Caso o experimento seja a oportunidade única de o aluno estudar e vivenciar determinado assunto, então o professor deve entender que o conteúdo não será relevante, já que muito pouco tempo estará disponível para a efetiva conclusão dessa tarefa. Assim, nestes casos, a preocupação do professor deve ser com o processo e não com o resultado final.
CONCLUSÕES
Do ponto de vista dos objetivos de uma disciplina de química geral experimental, é possível classificar os experimentos em Conceituais, Fundamentais, Metodológicos e Quantitativos.
A menos de uma diretriz explícita, um laboratório de química geral deve oferecer experimentos de todos os tipos e em quantidades equilibradas.
Experimentos conceituais e metodológicos que envolvem manipulações simples devem ser oferecidos no início da disciplina.
Experimentos quantitativos que dependem de várias operações de transferência devem ser oferecidos após certa vivência laboratorial do estudante.
Um mesmo sistema químico pode ser estudado com um procedimento experimental modificado para contemplar uma classificação ou outra. Assim, a reação de um metal com ácido pode ser feita com o propósito de se observar o simples desprendimento de hidrogênio (C), por exemplo, mas também pode ser usada para se estudar a cinética do desprendimento por medidas de pressão (M) ou então para se determinar a pureza do metal (Q) ou a sua massa molar (F) se o mesmo for puro.
Recebido em 29/11/10; aceito em 15/3/11; publicado na web em 5/5/11
- 1. Hofstein, A.; Luneta, V. N.; Rev. Educ. Res. 1982, 52, 201.
- 2. Domin, D. S.; J. Chem. Educ. 1999, 76, 109.
- 3. Piaget, J.; Aprendizagem e Conhecimento, Freitas Bastos: São Paulo, 1977.
- 4. Takaya, K.; Interchange 2008, 39, 1.
- 5. Vygotsky, L. S.; Pensamento e Linguagem, Martins Fontes: São Paulo, 1987.
- 6. Bowen, C. W.; J. Chem. Educ. 2000, 77, 116.
- 7. Byrne, M. S.; Educ. Chem. 1990, 27, 12.
- 8. Johnstone, A. H.; Letton, K. M.; Educ. Chem. 1990, 27, 9.
- 9. Cooper, M. M.; J. Chem. Educ 2006, 83, 1356.
- 10. Ellis, R. H.; Rauch, R. B.; J. Chem. Educ. 1953, 30, 460.
-
11CHEM Study; Química- Uma Ciência Experimental, 1ª ed., EDART, São Paulo, 1969.
- 12. Levinson, G. S.; J. Chem. Educ. 1982, 59, 337.
- 13. Johnstone, A. H.; Wham, A. J. B.; Educ. Chem. 1982, 19, 71.
- 14. Viana, J. F.; Sleet, R. J.; Johnstone, A. H.; Quim. Nova 1999, 22, 280.
- 15. Devenport, J.; Lazonby, J. S. N.; Waddington, D. J.; Educ. Chem. 1979, 16, 188.
- 16. Ferreira, L. H.; Hartwig, D. H.; Rocha-Filho, R. C.; Química Nova na Escola 1997, nş 5, 28.
- 17. Nyasulu, F.; Stevanov, K.; Barlag, R.; J. Chem. Educ. 2010, 59, 337.
- 18. Olmsted III, J. A.; J. Chem. Educ. 1998, 75, 1261.
- 19. Weiner, S. A.; Peters, E. I.; Introduction to Chemical Principles: A laboratory Approach, W. B. Saunders Co.: Philadelphia, 1980.
- 20. Marzzacco, C. J.; J. Chem. Educ. 1999, 76, 1517.
- 21. Jackson, B. A.; David, J. C.; J. Chem. Educ. 1998, 75, 997.
- 22. Maia, A. S.; Osorio, V. K. L.; Quim. Nova 2003, 26, 595.
- 23. Martins, J. V.; Ruas de Souza, A. P.; Salles, M. O.; Serrano, S. H. P.; Quim. Nova 2010, 33, 755.
- 24. Simoni, D. A.; Andrade, J. C.; Faigle, J. F. G.; Simoni, J. A.; Quim. Nova 2002, 25, 1034.
- 25. Bahta, A. S.; Parker, G. A.; Tuck, D. G.; Pure Appl. Chem. 1997, 59, 1489.
- 26. Ozutsumi, K.; Kurihara, M.; Kawashima, T.; Talanta 1993, 40, 599.
- 27. Ozutsumi, K.; Hasegawa, E.; Kurihara, M.; Kawashima, T.; Polyhedron 1993, 12, 2185.
- 28. Greenwood, N. N.; Earnshaw, A.; Chemistry of the Elements, 2nd ed., Butterworth-Heinemann: Oxford, 1997.
- 29. DuBois, R.; J. Chem. Educ. 1937, 14, 324.
- 30. Stolzberg, R. J.; J. Chem. Educ. 1999, 76, 640.
- 31. Cobb, C. L.; Love, G. A.; J. Chem. Educ. 1998, 75, 90.
- 32. Lahti, M.; Vilpo, J.; Hovinen, J.; J. Chem. Educ. 1999, 76, 1281.
Datas de Publicação
-
Publicação nesta coleção
06 Dez 2011 -
Data do Fascículo
2011
Histórico
-
Aceito
15 Mar 2011 -
Recebido
29 Nov 2010