Resumo
Introdução:
A lesão hepática por isquemia-reperfusão é um processo fisiopatológico comum em cirurgias hepáticas. Mais estudos ainda são necessários para avaliar se o propofol pode reduzir a lesão de isquemia-reperfusão miocárdica induzida pela lesão de isquemia-reperfusão hepática em ratos, juntamente com os mecanismos que estão relacionados.
Objetivo:
Investigar se propofol protege as células do miocárdio da apoptose com a lesão hepática por isquemia-reperfusão.
Métodos:
Ratos machos da raça Sprague-Dawley (n = 18) foram alocados aleatoriamente em três grupos: Grupo Sham (Grupo S, n = 6), Grupo Lesão Hepática por Isquemia-reperfusão (Grupo IR, n = 6) e Grupo Propofol (Grupo P, n = 6). O Grupo S foi submetido apenas à laparotomia. O grupo IR foi submetido à isquemia por 30 min e reperfusão por 4 h. O grupo P foi submetido à mesma isquemia do grupo IR, com a administração de 120 mg.kg-1 de propofol iniciada 10min antes da isquemia, seguida de infusão contínua a 20 mg.kg-1.h-1. A apoptose celular foi examinada por meio do ensaio de marcação de terminações dUTP pela deoxinucleotidil transferase. Retículo endoplasmático Ca2+-ATPase2 (SERCA2) e caspase-3 do ácido aspártico contendo cisteína (caspase-3 clivada) foram avaliados com o ensaio western blot e reação em cadeia da polimerase.
Resultados:
A taxa de apoptose foi maior com mRNA e proteína de SERCA2 regulados para baixo e caspase-3 clivada suprarregulada no Grupo IR, em comparação com o Grupo S (p < 0,01). A taxa de apoptose foi menor com mRNA e proteína de SERCA2 suprarregulada e caspase-3 clivada sub-regulada no Grupo P, em comparação com o Grupo IR (p < 0,01).
Conclusões:
O propofol pode reduzir a apoptose de células miocárdicas induzida por lesão hepática por isquemia-reperfusão. Entretanto, pode suprarregular o mRNA e a proteína de SERCA2 em ratos.
PALAVRAS-CHAVE
Propofol; Fígado; Lesão de reperfusão; Miocárdio; Retículo endoplasmático Ca2+-ATPase2
Abstract
Introduction:
Hepatic ischemia-reperfusion injury is a common pathophysiological process in liver surgery. Whether Propofol can reduce myocardial ischemia-reperfusion injury induced by hepatic ischemia-reperfusion injury in rats, together with related mechanisms, still needs further studies.
Objective:
To investigate if propofol would protect the myocardial cells from apoptosis with hepatic ischemia-reperfusion injury.
Methods:
Male Sprague-Dawley rats (n = 18) were randomly allocated into three groups: Sham Group (Group S, n = 6), Hepatic Ischemia-reperfusion Injury Group (Group IR, n = 6) and Propofol Group (Group P, n = 6). Group S was only subjected to laparotomy. Group IR was attained by ischemia for 30 min and reperfusion for 4 h. Group P was subjected identical insult as in Group IR with the administration of propofol started 10 min before ischemia with 120 mg.kg−1, following by continuous infusion at 20 mg.kg−1.h−1. Cell apoptosis was examined by terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay. Endoplasmic reticulum Ca2+-ATPase2 (SERCA2) and cysteine-containing aspartic acid cleaved-caspase3 (cleaved-caspase3) were assayed by western blot and Altimeter polymerase chain reaction.
Results:
Apoptosis rate was increased, with mRNA and protein of SERCA2 down-regulated and cleaved-caspase3 up-regulated in Group IR compared with Group S (p < 0.01). Apoptosis rate was decreased, with mRNA and protein of SERCA2 up-regulated and cleaved-caspase3 down-regulated in Group P compared with Group IR (p < 0.01).
Conclusions:
Propofol can reduce hepatic ischemia-reperfusion injury-induced myocardial cell apoptosis, meanwhile, can up-regulate mRNA and protein of SERCA2 in rats.
KEYWORDS
Propofol; Liver; Reperfusion injury; Myocardium; Endoplasmic reticulum Ca2+-ATPase2
Introdução
A isquemia-reperfusão hepática total é comumente encontrada na macrossecção central do tumor hepático ou na área do fígado, no tumor do lobo caudado e na ressecção hepática e no transplante ortotópico de fígado. Nos últimos anos, estudos relatam que a lesão de isquemia-reperfusão (I/R) hepática tem reação geral, pode afetar a função hepática e causar danos em órgãos distantes.11 Miranda LE, Capellini VK, Reis GS, et al. Effects of partial liver ischemia followed by global liver reperfusion on the remote tissue expression of nitric oxide synthase: lungs and kidneys. Transplant Proc. 2010;42:1557-62.
2 Yang JC, Wang ZW, Li CL, et al. Multiple organ injury at early stage of intestinal and hepatic ischemia-reperfusion in rats. J First Mil Med Univ. 2004;24:198-201.
3 Magan AA, Khalil AA, Ahmed MH. Terlipressin and hepatorenal syndrome: what is important for nephrologists and hepatologists. World J Gastroenterol. 2010;16:5139-47.-44 Cash WJ, McConville P, McDermott E, et al. Current concepts in the assessment and treatment of hepatic encephalopathy. QJM. 2010;103:9-16. Os principais mecanismos podem ser derivados do aumento de radicais de oxigênio e da sobrecarga de cálcio nas células, o aumento de radicais de oxigênio é o fator mais importante.55 Weinbroun AA, Hochhauser E, Rudick V, et al. Multiple oxygen dysfunction after remote circulatory arrest; common pathway of radical oxygen species. J Trauma. 1999;47:691-8.
6 Omar MA, Wang L, Clanachan AS. Cardioprotection by GSK-3 inhibition: role of enhanced glycogen synthesis and attenuation of calcium overload. Cardiovasc Res. 2010;86:478-86.-77 Arii S, Teramoto K, Kawamura T. Current progress in the understanding of and therapeutic strategies for ischetmia and reperfusion injury of the liver. J Hepatobiliary Pancreat Surg. 2003;10:189-94. Como prevenir e curar a lesão hepática após I/R e as lesões secundárias a órgãos distantes são questões importantes a serem resolvidas.
Na reperfusão pós-isquemia hepática da veia hepática para o átrio direito, o coração é o primeiro órgão a receber a perfusão sanguínea e o estágio inicial pode gerar danos. A sobrecarga de cálcio, a geração de radicais de oxigênio e a morte de células cardíacas são os principais motivos que levam à lesão miocárdica causada por I/R.88 Chen H, Lei ZL, Han SJ, et al. Protective effects of propofol on renal injury during liver ischemia/reperfusion. Med J Chin PAPF. 2009;20:15-7.,99 Lotz C, Ping P, Kehl F. Letter by Lotz regarding article, "Reactive oxygen species-induced stimulation of 5′ AMP-activated protein kinase mediates sevoflurane-induced cardioprotection". Circulation. 2010;121:e399-400. O estágio inicial da lesão de I/R hepática pode gerar uma grande quantidade de radicais de oxigênio77 Arii S, Teramoto K, Kawamura T. Current progress in the understanding of and therapeutic strategies for ischetmia and reperfusion injury of the liver. J Hepatobiliary Pancreat Surg. 2003;10:189-94. que podem chegar aos tecidos musculares cardíacos via reperfusão sanguínea. O radical oxigênio pode ativar peróxido em lipídios da membrana e levar ao aumento da permeabilidade da membrana miocárdica e agir diretamente sobre a Ca2+-ATPase2 no retículo sarcoplasmático/endoplasmático (SERCA2). O processo pode reduzir a função da SERCA2 ou inibir sua atividade, reduzir ainda mais a ingestão de Ca2+ e levar à sobrecarga de cálcio.1010 Kendzari DE, Tcheng JE. Double negatives. Am Heart J. 2003;145:9-11.
11 Goldhaber JI, Qayyum MS. Oxygen free radicals and excitation-contraction coupling. Antioxid Redox Signal. 2000;2:55-64.-1212 Yoshiki U, Yoshiyuki A, Kosuke M, et al. Endothelin-1 prolongs intracellular calcium transient decay in neonatal rat cardiac myocytes. Heart Vessels. 2012;27:98-105. Uma grande quantidade de caspase-3 ativada pode levar à apoptose miocárdica.1313 Sun GB, Sun H, Meng XB, et al. Aconitine-induced Ca2+ overload causes arrhythmia and triggers apoptosis through p38 MAPK signaling pathway in rats. Toxicol Appl Pharmacol. 2014;279:8-22.,1414 Chang G, Zhang D, Liu J, et al. Exenatide protects against hypoxia/reoxygenation-induced apoptosis by improving mitochondrial function in H9c2 cells. Exp Biol Med (Maywood). 2014;239:414-22.
Atualmente, o propofol tem sido amplamente aplicado na anestesia clínica e é o medicamento comum para estudar a proteção da lesão de isquemia-reperfusão. O propofol pode proteger órgãos distantes na isquemia-reperfusão hepática em ratos1515 Lu B, Zhao JL, Niu JC, et al. Effect of propofol on myocardial injury induced by hepatic ischemla/reperfusion in rats and the role of PI3K/Akt signaling pathway. Chin J Anesthesiol. 2010;30:1250-3.,1616 Gao WZ, Dan L, Tian ZD, et al. Effects of propofol on lung injury and PI3K/Akt pathway in rats after liver ischemia and reperfusion. Chin J Pathol. 2013;29:488-92. e este estudo teve como objetivo estimar o efeito do propofol sobre a apoptose miocárdica e seu mecanismo.
Material e métodos
Animais
Ratos machos Sprague-Dawley entre 200 e 230 g foram comprados no Experimental Animal Center (número de licença: SCXK-Jun 2012-0004); os experimentos foram iniciados após uma semana de alimentação adaptativa com adequação de água e ração. Este estudo foi feito em estrita conformidade com as recomendações do Guia para o Cuidado e Uso de Animais de Laboratório do Instituto Nacional de Saúde. O protocolo de uso de animais foi revisado e aprovado pelo Comitê Institucional para o Uso e Cuidado de Animais (IACUC) da Universidade de Medicina de Shanxi.
Designação dos grupos
Os ratos (n = 18) foram randomicamente alocados em três grupos: Grupo S (n = 6), Grupo IR (n = 6) e Grupo P (n = 6).
Preparação do modelo de I/R nos ratos
Segundo estudos prévios,1616 Gao WZ, Dan L, Tian ZD, et al. Effects of propofol on lung injury and PI3K/Akt pathway in rats after liver ischemia and reperfusion. Chin J Pathol. 2013;29:488-92.,1717 Jin YC, Kim W, Ha YM, et al. Propofol limits rat myocardial ischemia and reperfusion injury with an associated reduction in apoptotic cell death in vivo. Vascul Pharmacol. 2009;50:71-7. após a indução anestésica via injeção intraperitoneal de uretano a 25% (0,4 mL.100 mg-1), o rato foi preso com firmeza em supinação sobre a mesa cirúrgica, a pele abdominal foi raspada, o animal foi desinfetado e a cavidade abdominal foi aberta camada por camada. Uma micropinça vascular não invasiva foi então usada para fixar o pedículo do fígado para preparar o modelo de isquemia hepática total; 30 minutos (min) depois a perfusão foi recuperada. Para os ratos no Grupo S, o abdome foi aberto apenas para o porta hepatis, mas não foi ligado. O grupo IR foi preparado como o modelo de lesão hepática por IR total. Para o Grupo P, uma dose de carga de propofol (20 mg.kg-1) foi injetada lentamente através da veia caudal 10 min antes da preparação do modelo e depois continuamente infundida a uma velocidade de 20 mg.kg-1.h-1, até a execução. Os demais procedimentos foram iguais aos do Grupo IR.
Coleta de amostras
Os ratos dos grupos IR e P foram mortos quatro horas (h) após a reperfusão e os ratos do Grupo S foram mortos 4 h após a dissecção do porta hepatis. A cavidade torácica foi então aberta e o coração exposto; após o enxágue com solução salina, os ventrículos direito e esquerdo foram cortados ao longo do septo interventricular e os tecidos miocárdicos da parede ventricular esquerda foram rapidamente seccionados e armazenados a -80 °C para posterior detecção de apoptose em cardiomiócitos e exame de proteínas relacionadas. Os tecidos do lobo lateral esquerdo foram então amostrados para coloração com hematoxilina-eosina (HE) e as observações histopatológicas foram feitas com um microscópio de luz (com ampliação de 200×).
Detecção de apoptose em células miocárdicas pelo ensaio de marcação de Nicks por dUTP-biotina mediada por desoxinucleotidil transferase terminal (TUNEL)
Uma quantidade apropriada de tecido miocárdico foi usada para detectar apoptose com o kit de detecção de apoptose TUNEL (Beyotime Biotechnology Co. Ltd., Xangai, China), de acordo com as instruções do fabricante, sob um microscópio de luz (com ampliação de 200×).
Detecção de proteínas SERCA2 e caspase-3 clivada em tecidos miocárdicos por western blot
Proteínas teciduais totais foram extraídas de 100 mg de tecidos miocárdicos; albumina de soro bovino (Beyotime Biotechnology Co. Ltd., Xangai, China) foi usada como padrão proteico. Os teores de proteína foram então determinados com o método azul brilhante de Coomassie. Uma quantidade igual de amostra de proteína (50 µg) foi então separada com o uso de eletroforese em gel de poliacrilamida com dodecilsulfato de sódio a 10% e transferida para uma membrana de nitrocelulose pelo método de transferência semisseco. Após o bloqueio com albumina de soro bovino a 3% por 2 h, o anticorpo SERCA2 diluído (1:1.000; Abcam Inc., EUA) e o anticorpo clivado da caspase-3 (1:1.000; Abcam Inc., EUA) foram adicionados às membranas e incubados durante a noite a 4 °C. Após lavagem com TBST (Tris-HCl, NaCl, Tween 20) (5 min × 3 x), o anticorpo secundário anti-IgG de coelho feito em cabra (H + L) (1:5.000) foi adicionado à membrana e incubado a 37 °C por 2 h. Esse processo foi seguido por lavagem com TBST (5min × 3x) e desenvolvimento com o kit de quimioluminescência BeyoECL Plus. O sistema de imagem em gel ChemiDoc™ XRS (Bio-Rad, EUA) foi usado para escaneamento e o software de análise Quantity One foi usado para detecção e análise da expressão de SERCA2 e caspase-3.
Detecção do mRNA de SERCA2 e caspase-3 clivada em tecidos miocárdicos por reação em cadeia da polimerase (PCR) em tempo real
O RNA total foi extraído de acordo com as instruções do kit trizol (Invitrogen). O RNA foi então transcrito reversamente em cDNA com o uso do kit RT-PCR e o método de uma etapa para posterior amplificação por PCR; os produtos de amplificação por PCR foram então analisados por eletroforese em gel. O sistema de transcrição reversa foi usado com 2 µL do molde de RNA total (1 µg), 2 µL da mistura de dNTP, 2 µL de MgCl2, mais EDPC e água destilada para 25 µL. Os parâmetros da reação foram os seguintes: pré-saturação a 95 °C por 5 min, desnaturação a 95 °C por 30s, anelamento a 58 °C por 30s e extensão a 72 °C por 30s, por 40 ciclos. Os iniciadores (primers) usados são apresentados na tabela 1 (Sangon Biotech (Xangai) Co., Ltd., China).
Análise de dados
O software SPSS 13.0 foi usado para análise estatística. Os dados eram de distribuição normal e foram expressos em média ± desvio-padrão e as comparações intergrupos foram feitas com Anova, com p < 0,05 considerado estatisticamente significante.
Resultados
Coloração com HE (hematoxilina-eosina)
Os tecidos hepáticos do Grupo S não apresentaram infiltração de neutrófilos e as estruturas do fígado estavam claras e completas. Os tecidos hepáticos dos grupos IR e P apresentaram sinusoides hepáticos estreitos, edema evidente e degeneração vacuolar após 4 h de reperfusão. Os filetes de células hepáticas estavam desordenados com necrose local. As lesões das células hepáticas do Grupo P foram significativamente reduzidas em comparação com as do Grupo IR e a morfologia do fígado estava próxima ao normal, com congestão sinusoidal e ocasional infiltração de uma pequena quantidade de células inflamatórias.
Detecção de apoptose miocárdica por TUNEL
No Grupo IR, a taxa de apoptose aumentou significativamente, em comparação com a do Grupo S (p < 0,01 para todos). No Grupo P, a taxa de apoptose diminuiu significativamente, em comparação com a do Grupo IR (p < 0,01 para todos), conforme demonstrado na figura 1 e tabela 2.
Detecção de apoptose miocárdica. Grupo IR: grupo submetido à lesão de isquemia-reperfusão hepática, obtida com isquemia por 30 min e reperfusão por 4 h. Grupo P: grupo propofol, submetido à isquemia idêntica à do Grupo IR, com a administração de propofol iniciada 10 min antes da isquemia com 20 g.kg-1, seguida de infusão contínua a 20 g.kg-1.h-1. Grupo S: grupo sham; Grupo IR: grupo isquemia-reperfusão; Grupo P: grupo propofol.
* p < 0,01: comparado com o Grupo S; # p < 0,01: comparado com o grupo IR.
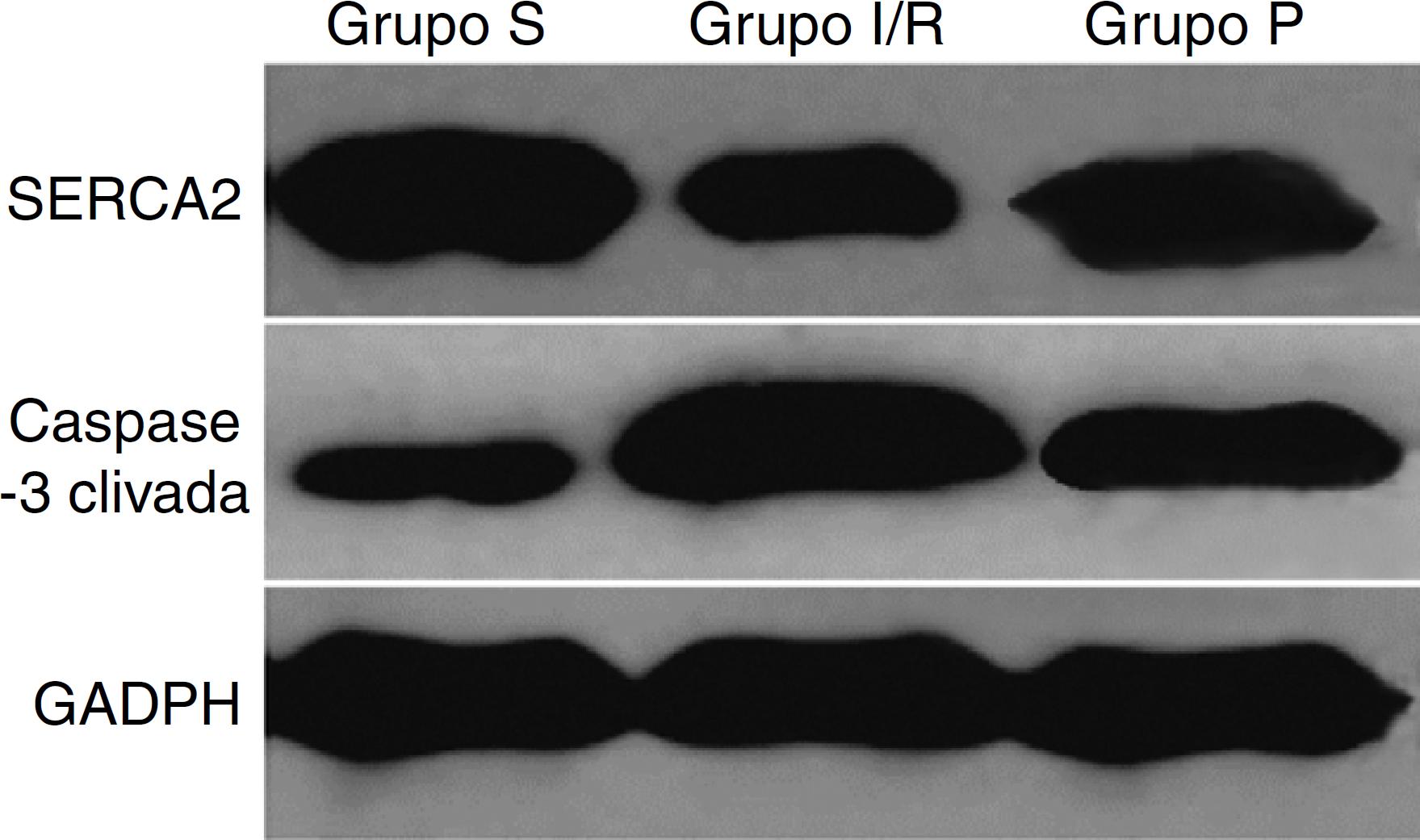
Detecção de proteínas de SERCA2 e caspase-3 clivada
A expressão da proteína de SERCA2 foi significantemente sub-regulada no Grupo IR, em comparação com o Grupo S, mas a proteína da caspase-3 clivada foi significativamente suprarregulada (p < 0,01 para todos). SERCA2 foi significativamente suprarregulada no Grupo P, em comparação com o grupo IR, mas a caspase-3 clivada foi significativamente sub-regulada no Grupo P (p < 0,01 para todos), conforme demonstrado na figura 2 e tabela 3.
Detecção das proteínas SERCA2 e caspase3 clivada em cada grupo. Grupo IR, grupo submetido à lesão de isquemia-reperfusão hepática, obtida com isquemia por 30 min e reperfusão por 4 h. Grupo P, grupo propofol, submetido à isquemia idêntica à do Grupo IR, com a administração de propofol iniciada 10 min antes da isquemia com 20 g.kg-1, seguida de infusão contínua a 20 g.kg-1.h-1. SERCA2: retículo endoplasmático Ca2+-ATPase2; GADPH, gliceraldeído-3-fosfato desidrogenase; Grupo S, grupo sham; Grupo IR, grupo isquemia-reperfusão; Grupo P, grupo propofol. GADPH foi usado como referência interna.
Detecção de mRNA de SERCA2 e caspase-3 clivada
Em comparação com o Grupo S, o mRNA de SERCA2 foi significativamente sub-regulado no Grupo IR, mas na caspase-3 clivada o mRNA foi significativamente suprarregulado (p < 0,01 para todos). Em comparação com o Grupo IR, o mRNA de SERCA2 foi significativamente suprarregulado no subgrupo P, mas a caspase-3 clivada foi significativamente sub-regulada no Grupo P (p < 0,01 para todos), conforme demonstrado na tabela 4.
Discussão
A caspase-3 é um membro importante na execução de apoptose da família caspase, é necessária para a resposta em cascata de protease apoptótica. Uma vez ativada, a apoptose não será evitada e é a enzima efetora e a protease-chave no processo de apoptose como índice sensível e principal fator de efetividade na apoptose celular. Portanto, o nível de expressão da caspase-3 pode ser usado para estimar a situação da apoptose celular.
Com base em modelo de rato para indução de I/R segundo Goldhaber et al.,1111 Goldhaber JI, Qayyum MS. Oxygen free radicals and excitation-contraction coupling. Antioxid Redox Signal. 2000;2:55-64. este estudo teve como objetivo detectar a taxa de apoptose de miócitos cardíacos com o método TUNEL e compreender a expressão da caspase-3 clivada com os métodos western blot e PCR. Descobrimos que a taxa de apoptose de miócitos cardíacos foi maior no Grupo IR do que no Grupo S e que as expressões de mRNA e proteína da caspase-3 clivada foram obviamente suprarreguladas, indicaram que o modelo de lesão de isquemia-reperfusão do miocárdio foi construído com sucesso. No experimento primário, a maior taxa de apoptose foi detectada com 4 h de reperfusão, causou sérios danos patológicos. Portanto, selecionamos os índices relevantes a 4 h de reperfusão. De acordo com o tempo e a dose administrada da droga,1616 Gao WZ, Dan L, Tian ZD, et al. Effects of propofol on lung injury and PI3K/Akt pathway in rats after liver ischemia and reperfusion. Chin J Pathol. 2013;29:488-92. descobrimos que as taxas de apoptose no Grupo P foram menores do que as do Grupo IR e houve menos expressão de proteína e mRNA da caspase-3 clivada com os métodos de coloração com HE, TUNEL, western blot e PCR. Esses resultados implicam que propofol pode reduzir a apoptose miocárdica por I/R do fígado em ratos, resultados semelhantes aos observados por Gao et al.1616 Gao WZ, Dan L, Tian ZD, et al. Effects of propofol on lung injury and PI3K/Akt pathway in rats after liver ischemia and reperfusion. Chin J Pathol. 2013;29:488-92. e Jin et al.1717 Jin YC, Kim W, Ha YM, et al. Propofol limits rat myocardial ischemia and reperfusion injury with an associated reduction in apoptotic cell death in vivo. Vascul Pharmacol. 2009;50:71-7.
A sobrecarga de cálcio intracelular desempenha um papel importante no desencadeamento de lesão de I/R do miocárdio e melhora a taxa de apoptose de miócitos cardíacos;1818 Cheng YS, Chen Y, Li D. The mechanism and research status of calcium overload in myocardial ischemia/reperfusion injury. Chinese Med Innov. 2013;10:150-2.
19 Zhu N, Yao RL, Liu JS, et al. The regulation of the apoptosis and oxidative stress of myocardial apoptosis and oxidative stress in rat limb ischemia/reperfusion. Chin J Gerontol. 2015;35:6666-8.-2020 Talukder MA, Yang F, Nishijima Y, et al. Reduced SERCA2a converts sub-lethal myocardial injury to infarction and affects postischemic functional recovery. J Mol Cell Cardiol. 2009;46:285-7. inibir a sobrecarga de cálcio pode reduzir significativamente o dano miocárdico causado por I/R.2121 Zhang MH, Yin YQ, He HY, et al. Effects of dioscin on calcium channels in rat ventricular cardiomyocytes. Pharmacol Clin Chin Mater Med. 2011;27:23-6. O retículo sarcoplasmático é o principal local de captação, reserva e liberação de Ca2+; SERCA2 pode manter baixo o nível de Ca2+ pela transmissão intracitoplasmática de Ca2+ para o retículo sarcoplasmático. Talukder et al.2222 Talukder MA, Kalyanasundaram A, Zhao X, et al. Expression of SERCA isoform with faster Ca2+ transport properties improves postischemic cardiac function and Ca2+ handling and decreases myocardial infarction. Am J Physiol Heart Circ Physiol. 2007;293:H2418-28. indicaram que uma expressão mais elevada de SERCA2 pode aumentar a captação de Ca2+, reduzir a sobrecarga de cálcio e, consequentemente, reduzir a lesão de I/R do miocárdio. Propofol pode ajustar a homeostase do cálcio intracelular e reduzir a apoptose miocárdica.2323 Kim HS, Chang WC, Hwang KC, et al. Effect of propofol on calcium homeostasis in hypoxia-reoxygenated neonatal rat cardiomyocytes. Eur J Pharmacol. 2008;594:139-45. A expressão da SERCA2 pode refletir indiretamente a concentração de Ca2+ intracelular pela detecção de Ca2+ no tecido muscular cardíaco. Comparado com o Grupo S, a expressão de SERCA2 no Grupo I/R foi menor e a taxa de apoptose maior; na comparação com o Grupo I/R, a SERCA2 no Grupo P estava aumentada e a taxa de apoptose reduzida. Todos esses resultados indicam que propofol pode inibir a sobrecarga de cálcio pelo aumento da expressão de SERCA2 e, consequentemente, reduzir a apoptose do miocárdio causada por I/R.
Em resumo, a isquemia-reperfusão hepática total pode levar à apoptose do miocárdio em ratos, propofol pode reduzir a apoptose miocárdica induzida por isquemia-reperfusão hepática e o principal mecanismo pode ser a suprarregulação da expressão de SERCA2, que inibe a sobrecarga de cálcio. Mais detalhes sobre o mecanismo devem ser investigados em estudos adicionais que avaliem a concentração intracelular de Ca2+.
Agradecimentos
Este estudo foi apoiado pela Science and Technology Projects of Shanxi Health Planning Commission (n° 201-201-055).
Este estudo foi feito em estrita conformidade com as recomendações do Guia para o Cuidado e Uso de Animais de Laboratório do Instituto Nacional de Saúde. O protocolo de uso de animais foi revisado e aprovado pelo Comitê Institucional para o Uso e Cuidado de Animais (IACUC) da Universidade de Medicina de Shanxi.
References
-
1Miranda LE, Capellini VK, Reis GS, et al. Effects of partial liver ischemia followed by global liver reperfusion on the remote tissue expression of nitric oxide synthase: lungs and kidneys. Transplant Proc. 2010;42:1557-62.
-
2Yang JC, Wang ZW, Li CL, et al. Multiple organ injury at early stage of intestinal and hepatic ischemia-reperfusion in rats. J First Mil Med Univ. 2004;24:198-201.
-
3Magan AA, Khalil AA, Ahmed MH. Terlipressin and hepatorenal syndrome: what is important for nephrologists and hepatologists. World J Gastroenterol. 2010;16:5139-47.
-
4Cash WJ, McConville P, McDermott E, et al. Current concepts in the assessment and treatment of hepatic encephalopathy. QJM. 2010;103:9-16.
-
5Weinbroun AA, Hochhauser E, Rudick V, et al. Multiple oxygen dysfunction after remote circulatory arrest; common pathway of radical oxygen species. J Trauma. 1999;47:691-8.
-
6Omar MA, Wang L, Clanachan AS. Cardioprotection by GSK-3 inhibition: role of enhanced glycogen synthesis and attenuation of calcium overload. Cardiovasc Res. 2010;86:478-86.
-
7Arii S, Teramoto K, Kawamura T. Current progress in the understanding of and therapeutic strategies for ischetmia and reperfusion injury of the liver. J Hepatobiliary Pancreat Surg. 2003;10:189-94.
-
8Chen H, Lei ZL, Han SJ, et al. Protective effects of propofol on renal injury during liver ischemia/reperfusion. Med J Chin PAPF. 2009;20:15-7.
-
9Lotz C, Ping P, Kehl F. Letter by Lotz regarding article, "Reactive oxygen species-induced stimulation of 5′ AMP-activated protein kinase mediates sevoflurane-induced cardioprotection". Circulation. 2010;121:e399-400.
-
10Kendzari DE, Tcheng JE. Double negatives. Am Heart J. 2003;145:9-11.
-
11Goldhaber JI, Qayyum MS. Oxygen free radicals and excitation-contraction coupling. Antioxid Redox Signal. 2000;2:55-64.
-
12Yoshiki U, Yoshiyuki A, Kosuke M, et al. Endothelin-1 prolongs intracellular calcium transient decay in neonatal rat cardiac myocytes. Heart Vessels. 2012;27:98-105.
-
13Sun GB, Sun H, Meng XB, et al. Aconitine-induced Ca2+ overload causes arrhythmia and triggers apoptosis through p38 MAPK signaling pathway in rats. Toxicol Appl Pharmacol. 2014;279:8-22.
-
14Chang G, Zhang D, Liu J, et al. Exenatide protects against hypoxia/reoxygenation-induced apoptosis by improving mitochondrial function in H9c2 cells. Exp Biol Med (Maywood). 2014;239:414-22.
-
15Lu B, Zhao JL, Niu JC, et al. Effect of propofol on myocardial injury induced by hepatic ischemla/reperfusion in rats and the role of PI3K/Akt signaling pathway. Chin J Anesthesiol. 2010;30:1250-3.
-
16Gao WZ, Dan L, Tian ZD, et al. Effects of propofol on lung injury and PI3K/Akt pathway in rats after liver ischemia and reperfusion. Chin J Pathol. 2013;29:488-92.
-
17Jin YC, Kim W, Ha YM, et al. Propofol limits rat myocardial ischemia and reperfusion injury with an associated reduction in apoptotic cell death in vivo. Vascul Pharmacol. 2009;50:71-7.
-
18Cheng YS, Chen Y, Li D. The mechanism and research status of calcium overload in myocardial ischemia/reperfusion injury. Chinese Med Innov. 2013;10:150-2.
-
19Zhu N, Yao RL, Liu JS, et al. The regulation of the apoptosis and oxidative stress of myocardial apoptosis and oxidative stress in rat limb ischemia/reperfusion. Chin J Gerontol. 2015;35:6666-8.
-
20Talukder MA, Yang F, Nishijima Y, et al. Reduced SERCA2a converts sub-lethal myocardial injury to infarction and affects postischemic functional recovery. J Mol Cell Cardiol. 2009;46:285-7.
-
21Zhang MH, Yin YQ, He HY, et al. Effects of dioscin on calcium channels in rat ventricular cardiomyocytes. Pharmacol Clin Chin Mater Med. 2011;27:23-6.
-
22Talukder MA, Kalyanasundaram A, Zhao X, et al. Expression of SERCA isoform with faster Ca2+ transport properties improves postischemic cardiac function and Ca2+ handling and decreases myocardial infarction. Am J Physiol Heart Circ Physiol. 2007;293:H2418-28.
-
23Kim HS, Chang WC, Hwang KC, et al. Effect of propofol on calcium homeostasis in hypoxia-reoxygenated neonatal rat cardiomyocytes. Eur J Pharmacol. 2008;594:139-45.
Datas de Publicação
-
Publicação nesta coleção
Nov-Dec 2018
Histórico
-
Recebido
26 Set 2016 -
Aceito
15 Jun 2018 -
Publicado
24 Jul 2018