Resumo
Objetivo:
A amiloidose AA é uma complicação rara de condições inflamatórias crônicas. A maior parte dos pacientes com amiloidose AA apresenta nefropatia, que leva à insuficiência renal e à morte. Estudaram-se as características clínicas e a sobrevida em pacientes com amiloidose AA.
Métodos:
Analisaram-se retrospectivamente 81 pacientes (51 homens, 30 mulheres) com amiloidose AA comprovada por biópsia renal. Os pacientes foram divididos em grupos de desfecho bom e ruim de acordo com os resultados de sobrevida.
Resultados:
A maior parte dos pacientes (55,6%) tinha proteinúria na faixa nefrótica no momento do diagnóstico. Os distúrbios subjacentes mais frequentes foram a febre familiar do Mediterrâneo (FFM, 21,2%) e a artrite reumatoide (10,6%) no grupo de desfecho bom e a malignidade (20%) no grupo de desfecho ruim. Somente a pressão arterial diastólica no grupo de desfecho bom e o nível de fósforo no grupo de desfecho ruim foram mais elevados. Os níveis séricos de creatinina aumentaram após o tratamento em ambos os grupos, enquanto a proteinúria diminuiu no grupo de desfecho bom. O aumento na creatinina sérica e a diminuição na TFGe do grupo de desfecho ruim foram mais significativos no grupo de desfecho bom. No momento do diagnóstico, 18,5% e 27,2% de todos os pacientes tinham doença renal crônica avançada (estágios 4 e 5, respectivamente). A duração média da sobrevida renal foi de 65 ± 3,54 meses. Entre todos os pacientes, 27,1% iniciaram tratamento de diálise durante o período de seguimento e 7,4% de todos os pacientes foram submetidos a transplante renal. Níveis elevados de pressão arterial sistólica [taxas de risco (HR) 1,03, intervalo de confiança (IC) de 95%: 1 a 1,06, p = 0,036], creatinina sérica (HR 1,25, IC 95%: 1,07 a 1,46, p = 0,006) e excreção urinária de proteínas (HR 1,08, IC 95%: 1,01 a 1,16, p = 0,027) foram preditores de doença renal terminal. A mediana da sobrevida de pacientes com comprometimento de órgãos foi de 50,3 ± 16 meses.
Conclusão:
O presente estudo indicou que a FFM constituiu uma grande proporção de casos e crescente quantidade de pacientes com amiloidose AA idiopática. Adicionalmente, observou-se que a sobrevida do paciente não foi afetada pelas diferentes causas etiológicas na amiloidose AA.
Palavras-chave:
Amiloidose AA; Doença renal crônica; Febre familiar do Mediterrâneo; Mortalidade; Sobrevida renal
Abstract
Aim
Amyloid A amyloidosis is a rare complication of chronic inflammatory conditions. Most patients with amyloid A amyloidosis present with nephropathy and it leads to renal failure and death. We studied clinical characteristics and survival in patients with amyloid A amyloidosis.
Methods:
A total of 81 patients (51 males, 30 females) with renal biopsy proven amyloid A amyloidosis were analyzed retrospectively. The patients were divided into good and poor outcomes groups according to survival results.
Results:
Most of the patients (55.6%) had nephrotic range proteinuria at diagnosis. Most frequent underlying disorders were familial Mediterranean fever (21.2%) and rheumatoid arthritis (10.6%) in the good outcome group and malignancy (20%) in the poor outcome group. Only diastolic blood pressure in the good outcome group and phosphorus level in the poor outcome group was higher. Serum creatinine levels increased after treatment in both groups, while proteinuria in the good outcome group decreased. Increase in serum creatinine and decrease in estimated glomerular filtration rate of the poor outcome group were more significant in the good outcome group. At the time of diagnosis 18.5% and 27.2% of all patients had advanced chronic kidney disease (stage 4 and 5, respectively). Median duration of renal survival was 65 ± 3.54 months. Among all patients, 27.1% were started dialysis treatment during the follow-up period and 7.4% of all patients underwent kidney transplantation. Higher levels of systolic blood pressure [hazard ratios 1.03, 95% confidence interval: 1-1.06, p = 0.036], serum creatinine (hazard ratios 1.25, 95% confidence interval: 1.07-1.46, p = 0.006) and urinary protein excretion (hazard ratios 1.08, 95% confidence interval: 1.01-1.16, p = 0.027) were predictors of end-stage renal disease. Median survival of patients with organ involvement was 50.3 ± 16 months.
Conclusion
Our study indicated that familial Mediterranean fever constituted a large proportion of cases and increased number of patients with idiopathic amyloid A amyloidosis. Additionally, it was observed that patient survival was not affected by different etiological causes in amyloid A amyloidosis.
Keywords:
AA amyloidosis; Chronic kidney disease; Familial Mediterranean fever; Mortality; Renal survival
Introdução
O termo "amiloidose" representa um grupo heterogêneo de doenças causadas pela deposição no tecido extracelular de subunidades de baixo peso molecular de uma variedade de proteínas na forma de fibras insolúveis.11 Mohamed N, Nasr SH. Renal amyloidosis. Surg Pathol Clin. 2014;7:409-25. Os principais tipos de amiloidose sistêmica são a amiloidose primária de cadeia leve (AL), a amiloidose amiloide A (AA), a amiloidose familiar, a amiloidose hereditária (associada a uma mutação genética autossômica dominante) ou transtirretina senil (sem mutação) (ATTR) e a amiloidose relacionada com a β-microglobulina em pacientes com doença renal terminal. A incidência global de amiloidose é estimada em cinco a nove casos por milhão de pacientes-ano.22 Real de Asúa D, Costa R, Galván JM, Filigheddu MT, Trujillo D, Cadiñanos J. Systemic AA amyloidosis: epidemiology, diagnosis, and management. Clin Epidemiol. 2014;6:369-77. A amiloidose AA é também chamada de amiloidose secundária ou reativa. Os depósitos amiloides ocorrem em razão do estado sérico supersaturado - de modo prolongado e persistente - de proteína amiloide A (AEA). Essa é uma apolipoproteína de lipoproteínas de alta densidade que atua como um reagente de fase aguda sintetizado no fígado, como consequência da doença inflamatória de longo prazo.33 Westermark GT, Fändrich M, Westermark P. AA amyloidosis: pathogenesis and targeted therapy. Annu Rev Pathol. 2015;10:321-44. Os estímulos inflamatórios na amiloidose AA estão associados à artrite inflamatória crônica (artrite reumatoide, poliartrite crônica juvenil, espondilite anquilosante), doença inflamatória intestinal, infecções crônicas, síndromes de febre periódica hereditárias familiares como a febre familiar do Mediterrâneo (FFM), neoplasias, doença de Castleman e causas idiopáticas.22 Real de Asúa D, Costa R, Galván JM, Filigheddu MT, Trujillo D, Cadiñanos J. Systemic AA amyloidosis: epidemiology, diagnosis, and management. Clin Epidemiol. 2014;6:369-77.,44 Murakami T, Inoshima Y, Ishiguro N. Systemic AA amyloidosis as a prion-like disorder. Virus Res. 2015;207:76-81.,55 Khalighi MA, Dean Wallace W, Palma-Diaz MF. Amyloid nephropathy. Clin Kidney J. 2014;7:97-106. A amiloidose AA é frequente em países em desenvolvimento e em algumas regiões da Europa. A amiloidose AL é prevalente em países desenvolvidos.22 Real de Asúa D, Costa R, Galván JM, Filigheddu MT, Trujillo D, Cadiñanos J. Systemic AA amyloidosis: epidemiology, diagnosis, and management. Clin Epidemiol. 2014;6:369-77.,66 Nienhuis HL, Bijzet J, Hazenberg BP. The prevalence and management of systemic amyloidosis in Western countries. Kidney Dis (Basel). 2016;2:10-9.
O envolvimento renal é uma manifestação comum na maior parte dos tipos de amiloidose sistêmica. O envolvimento cardíaco e neuropático pode ser visto em casos raros. No entanto, o rim apresenta envolvimento variável em pacientes com amiloidose AA. À biópsia renal, a incidência total de amiloidose varia de 1,3% a 4%.11 Mohamed N, Nasr SH. Renal amyloidosis. Surg Pathol Clin. 2014;7:409-25.,77 Rivera F, López-Gómez JM, Pérez-García R. Spanish registry of glomerulonephritis frequency of renal pathology in Spain 1994-1999. Nephrol Dial Transplant. 2002;17:1594-602.
8 Said SM, Sethi S, Valeri AM, Leung N, Cornell LD, Fidler ME, et al. Renal amyloidosis: origin and clinicopathologic correlations of 474 recent cases. Clin J Am Soc Nephrol. 2013;8:1515-23.-99 von Hutten H, Mihatsch M, Lobeck H, Rudolph B, Eriksson M, Röcken C. Prevalence and origin of amyloid in kidney biopsies. Am J Surg Pathol. 2009;33:1198-205. Os pacientes em geral apresentam proteinúria assintomática, síndrome nefrótica, declínio renal progressivo ou doença renal terminal.1010 Pinney JH, Lachmann HJ. Systemic AA amyloidosis. Subcell Biochem. 2012;65:541-64. Contudo, nos pacientes que têm deposição amiloide limitada nos vasos sanguíneos ou túbulos renais, pode-se observar insuficiência renal com quantidades mais baixas de extravasamento de proteínas ou sem proteinúria.1111 Kurita N, Kotera N, Ishimoto Y, Tanaka M, Tanaka S, Toda N, et al. AA amyloid nephropathy with predominant vascular deposition in Crohn's disease. Clin Nephrol. 2013;79:229-32. A história natural da amiloidose AA geralmente é progressiva e leva à falência de órgãos e morte, especialmente em pacientes com doenças inflamatórias subjacentes ativas. Existem vários estudos sobre a sobrevida e desfechos renais de pacientes com amiloidose AA.1212 Yilmaz M, Unsal A, Sokmen M, Kaptanogullari OH, Alkim C, Kabukcuoglu F, et al. Renal involvement in AA amyloidosis: clinical outcomes and survival. Kidney Blood Press Res. 2013;37:33-42.
13 Joss N, McLaughlin K, Simpson K, Boulton-Jones JM. Presentation, survival and prognostic markers in AA amyloidosis. QJM. 2000;93:535-42.-1414 Abdallah E, Waked E. Incidence and clinical outcome of renal amyloidosis: a retrospective study. Saudi J Kidney Dis Transplant. 2013;24:950-8. No presente estudo, objetivou-se investigar os pacientes diagnosticados com amiloidose AA com biópsias renais e analisar achados clínicos, sobrevida renal e mortalidade.
Pacientes e métodos
Neste estudo observacional retrospectivo, analisaram-se os resultados das biópsias renais de 531 pacientes admitidos em nosso serviço entre 1 de janeiro de 2006 e 31 de dezembro de 2014. O estudo incluiu 81 pacientes que tiveram o diagnóstico de amiloidose AA. Os pacientes foram divididos em dois grupos segundo o desfecho bom ou ruim, de acordo com os resultados de sobrevida. Excluíram-se da análise os pacientes com outros tipos de amiloidose e aqueles com diagnóstico clínico presuntivo (sem confirmação histológica). O estudo foi feito em conformidade com os princípios de diretrizes de boa prática clínica e com a Declaração de Helsinque.
Coletaram-se do prontuário médico dados sobre a história detalhada, as características clínicas (idade, sexo, peso, altura, pressão arterial, envolvimento de órgãos, indicação da biópsia, relatórios da biópsia, doença de base e causa da morte) e os resultados de exames laboratoriais [hemograma completo, velocidade de hemossedimentação (VHS), creatinina, eletrólitos, proteína total, albumina, AST, ALT, triglicerídeos, colesterol total, colesterol lipoproteína de baixa densidade, colesterol lipoproteína de alta densidade, proteína C reativa (PCR), ASA, hormônio paratireóideo intacto, taxa de filtração glomerular estimada (TFGe) e excreção urinária de proteínas de 24 horas (EUP)] no momento do diagnóstico. Além disso, obtiveram-se os valores séricos de creatinina, albumina, TFGe e EUP 24 horas no fim do seguimento. O período de seguimento incluiu a duração desde o diagnóstico até o último controle clínico ou morte do paciente.
A proteinúria nefrótica foi definida como EUP 24 h ≥ 3 g/dia. Diagnosticou-se cardiomiopatia amiloide na presença de características típicas no ecocardiograma, na ausência de outras causas potenciais de hipertrofia ventricular esquerda. O diagnóstico de FFM foi feito clinicamente e apoiado por testes genéticos moleculares (mutações no gene MEFV).1515 Berkun Y, Eisenstein EM. Diagnostic criteria of familial Mediterranean fever. Autoimmun Rev. 2014;13:388-90. Calculou-se a TFGe com a fórmula de modificação da dieta na doença renal (MDRD) [TFG =186 × CRp (creatinina plasmática) −1,154 × idade −0,203 × 1,212 (se negro) × 0,742 (se feminino)]. O estágio da doença renal crônica foi classificado de acordo com as diretrizes K/DOQI-NKF.1616 KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl. 2013;3:1-150. O índice de massa corporal (IMC) foi calculado como o peso em quilogramas dividido pela altura ao quadrado em metros [peso/altura2 (kg/m2)].
Biópsia renal
Incluíram-se todas as amostras de biópsia com determinados diagnósticos específicos. Fez-se microscopia de luz e imunofluorescência (IF) em todos os pacientes. Os exames de microscopia de luz das seções foram corados com hematoxilina e eosina, tricrômico de Masson, ácido periódico-Schiff, prata-metenamina e vermelho do congo. Os depósitos amiloides homogêneos coraram-se com vermelho do congo e coloração imunocitoquímica da amiloide sérica A; foram sensíveis ao tratamento com permanganato de potássio, o que era compatível com amiloidose secundária. A IF foi usada para a identificação da coloração da imunoglobulina G (IgG), IgM, IgA, complemento 3 (C3), C4 e C1q.
Tratamento
A maior parte dos pacientes foi tratada com colchicina (65,4%, se necessário, ajustados de acordo com a TFGe) e foi aplicada uma terapia de apoio ou específica de acordo com as causas inflamatórias subjacentes e presença de síndrome nefrótica e/ou insuficiência renal; 48% de todos os pacientes receberam bloqueadores dos receptores da angiotensina ou inibidores da enzima de conversão da angiotensina a fim de reduzir a proteinúria.1717 Dilek K, Usta M, Ersoy A, Ozdemir B, Yavuz M, Güllülü M, et al. Long-term effects of losartan on proteinuria and renal function in patients with renal amyloidosis. Scand J Urol Nephrol. 2002;36:443-6. Quando os pacientes com amiloidose AA progrediram para doença renal em estágio terminal, receberam terapia de substituição renal (hemodiálise ou transplante renal).
Análise estatística
As variáveis contínuas foram expressas com medianas (mínimo-máximo) e as categóricas com frequência e valores percentuais correspondentes. Usou-se o Wilcoxon signed rank test para comparações intragrupo. Usaram-se o teste U de Mann-Whitney, exato de Fisher e de Freeman-Halton-Fisher para as comparações entre os grupos. Mudanças percentuais das variáveis numéricas nos grupos foram calculadas com a fórmula: [(segundo valor - primeiro valor)/primeiro valor × 100]. A expectativa de vida foi calculada pelo método de Kaplan-Meier. Usou-se o teste de Logrank para comparar as distribuições de sobrevida entre os grupos. Para determinar os fatores prognósticos que afetam o tempo de sobrevida global, fez-se a análise de regressão do risco proporcional de Cox com procedimento de seleção retrógrada após análise de Kaplan-Meier. Os resultados foram apresentados como taxas de risco (HR) com intervalos de confiança (IC) de 95%. Os dados foram processados estatisticamente pelo software IBM SPSS versão 22 (IBM Acquires SPSS Inc., Somers, NY, USA). Em todas as análises estatísticas foi aceito um p < 0,05 como estatisticamente significativo.
Resultados
Encontrou-se amiloidose AA em 15,2% de todos os pacientes que foram submetidos à biópsia renal em um período de aproximadamente 10 anos. As indicações de biópsia para os pacientes durante o diagnóstico inicial foram proteinúria (na faixa nefrítica ou nefrótica) ou disfunção renal (creatinina sérica > 1,5 mg/dL). As proporções de pacientes com proteinúria na faixa nefrótica (n = 37, 56,1% vs. n = 8, 53,3%, p = 0,848), proteinúria na faixa nefrítica (n = 23; 34,8% vs. n = 6, 40%, p = 0,763) e disfunção renal (n = 6, 9,1% vs. n = 1, 6,7%, p = 0,707) não diferiram nos grupos de desfecho bom e ruim, respectivamente. As características demográficas e laboratoriais de ambos os grupos foram semelhantes. A pressão arterial diastólica no grupo de desfecho bom e o nível de fósforo no grupo de desfecho ruim foram maiores do que no outro grupo (tabela 1).
As causas subjacentes da amiloidose AA no grupo de desfecho bom foram FFM (n = 14, 21,2%), artrite reumatoide (n = 7, 10,6%), tuberculose pulmonar (n = 5, 7,6%), bronquiectasia (n = 3, 4,5%), artrite psoriática (n = 3, 4,5%), osteomielite (n = 2, 3%), espondilite anquilosante (n = 2, 3%), doença de Behçet (n = 2, 3%) e doença de Crohn (n = 2, 3%). No grupo de desfecho ruim, as causas foram FFM em dois pacientes (13,3%), artrite reumatoide em um (6,7%), bronquiectasia em um (6,7%), enteropatia por glúten em um (6,7%) e malignidade em três (20%, tumor vesical, linfoma e carcinoma de células escamosas do pulmão). As distribuições das causas subjacentes em ambos os grupos foram comparáveis (p = 0,058). Não foi detectada doença inflamatória em 26 (39,4%) pacientes no grupo de desfecho bom e sete (46,7%) no grupo de desfecho ruim (p = 0,605).
A distribuição dos estágios da doença renal crônica, de acordo com os valores de TFGe, nos grupos de desfecho bom e ruim foi: Estágio 1: n = 12, 18,2% vs. n = 3, 20%; Estágio 2: n = 13, 19,7% vs. n = 1, 6,7%; Estágio 3: n = 12, 18,2% vs. n = 3, 20%; Estágio 4: n = 15, 22,7% vs. n = 7, 46,7% e Estágio 5: n = 14, 21,2% vs. n = 1, 6,7%, respectivamente, p = 0,278. Não houve diferença significativa nos valores basais de creatinina sérica, albumina, EUP e TFGe entre os dois grupos. Ao comparar com os valores basais, os níveis de creatinina sérica aumentaram e os valores de TFGe diminuíram após o tratamento em ambos os grupos (p < 0,01). Os níveis de EUP após o tratamento no grupo de desfecho bom diminuíram (p = 0,004), enquanto os níveis de albumina sérica não se alteraram significativamente em ambos os grupos (tabela 2). As variações percentuais na mediana dos níveis de albumina sérica (0% vs. −7,4%, p = 0,055) e EUP (−14,7% vs. −10,4%, p = 0, 511) nos grupos de desfecho bom e ruim foram comparáveis. O aumento na creatinina sérica (58,6% vs. 15%, p = 0,042) e a diminuição na taxa de filtração glomerular (−40,6% vs. −13,9%, p = 0,050) do grupo de desfecho ruim foram significativos quando comparados com o grupo de desfecho bom. Não houve diferença estatisticamente significativa nas proporções de proliferação mesangial, envolvimento tubular, intersticial, arterial, arteriolar, fuso fibrilar, imunoglobulina e deposições de complemento entre os grupos de acordo com os achados da biópsia renal (tabela 3).
Diálise
Cinquenta e três (65,4%) pacientes receberam tratamento clínico [44 (66,6%) no grupo de desfecho bom e nove (60%) no grupo de desfecho ruim]. Vinte e dois pacientes (27,1%) começaram hemodiálise [17 (25,7%) no grupo de desfecho bom e cinco (33,3%) no grupo de desfecho ruim] e seis (7,4%) foram submetidos a transplante renal [cinco (7,6%) no grupo de desfecho bom e um (6,6%) no grupo de desfecho ruim]. A distribuição dos tratamentos foi semelhante nos dois grupos (p = 0,386). A mediana da sobrevida renal dos pacientes com ou sem doença renal terminal foi comparável (68,9 ± 7,9 vs. 60,3 ± 5,1 meses, respectivamente, p = 0,976). Em um dos pacientes com amiloidose submetido a transplante renal, a hipoalbuminemia grave e a proteinúria maciça via rim nativo continuaram depois do transplante, apesar das reposições de albumina. Após nefrectomia do rim nativo, os níveis de albumina aumentaram até níveis normais. Não houve diferença significativa na mediana da sobrevida renal entre os grupos de desfecho bom e ruim (p = 0,976) (fig. 1). A análise de regressão de Cox indicou que os níveis mais elevados de pressão arterial sistólica (HR 1,03, IC 95% 1 a 1,06, p = 0,036), creatinina sérica (HR 1,25, IC 95% 1,07 a 1,46, p = 0,006) e EUP (HR 1,08, IC 95% 1,01 a 1,16, p = 0,027) no momento do diagnóstico foram preditores de doença renal terminal.
Sobrevida
Quando foram considerados os índices de morte de acordo com as diferentes causas etiológicas, dois de 16 pacientes com FFM (12,5%) morreram [vs. 13 (20%) em 65 não FFM, p = 0,489], sete de 33 (21,2%) com causas idiopáticas morreram [vs. oito (16,7%) em 48 com causas não idiopáticas, p = 0,605], um de 11 (9,1%) pacientes infecciosos morreu [vs. 14 (20%) em 70 não infecciosos, p = 0,387] e um de 17 (5,8%) com doenças inflamatórias [vs. 14 (21,9%) em 64 com causas não idiopáticas, p = 0,131]. Também não houve diferença significativa entre os tempos médios de sobrevida dos grupos com diferentes causas etiológicas (tabela 4).
Mediana dos tempos de sobrevida na função renal de pacientes com amiloidose AA de acordo com as causas etiológicas
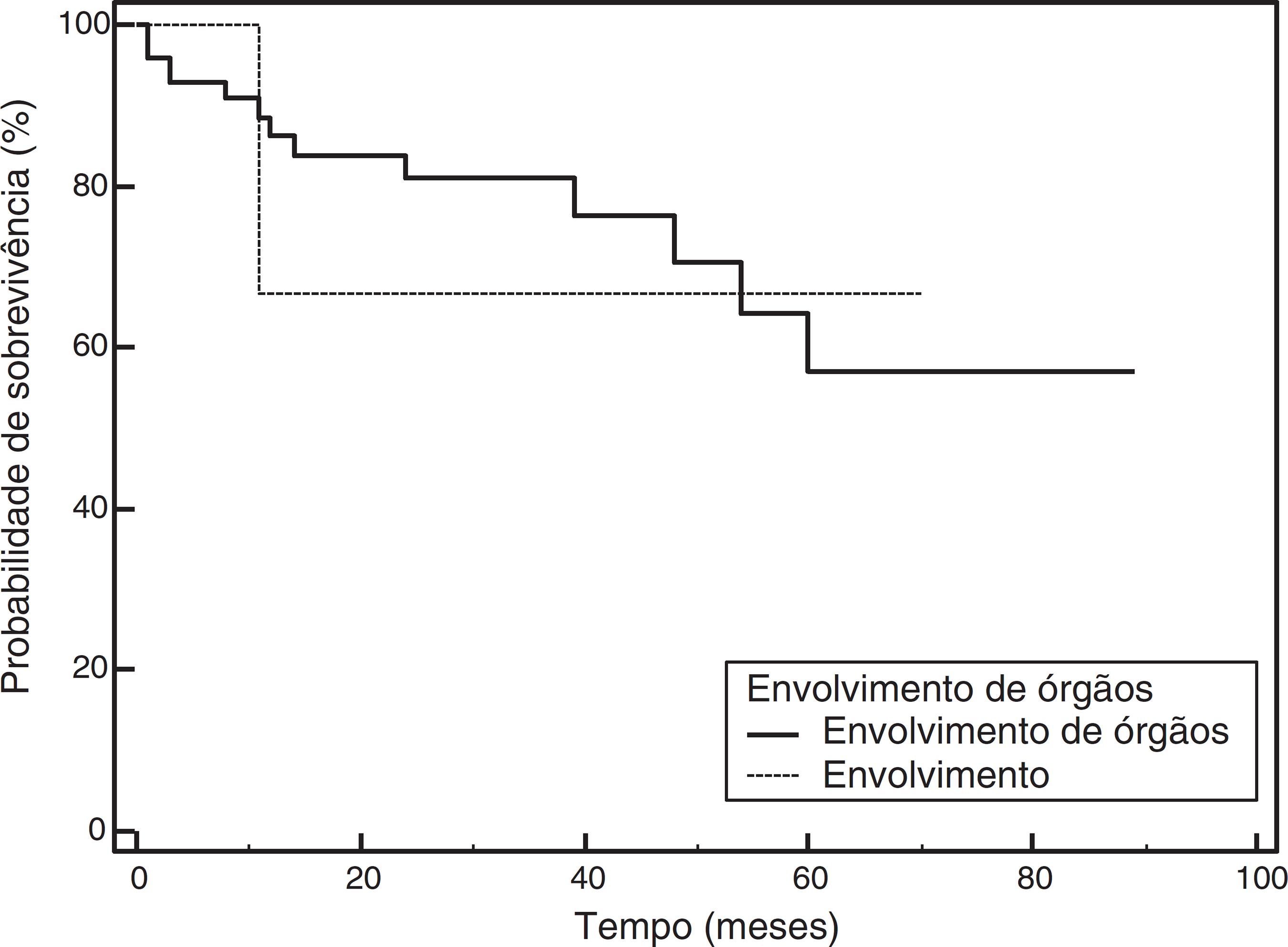
A mediana da sobrevida (50,3 ± 16 meses) em pacientes com envolvimento de órgãos não foi diferente dos pacientes sem envolvimento de órgãos (64,8 ± 5,41 meses) (p = 0,790) (fig. 2). Houve uma diferença significativa na sobrevida média entre os pacientes com e sem comprometimento tubular (57,6 ± 6,4 vs. 67,7 ± 4,2 meses, respectivamente, p = 0,038) no momento do diagnóstico (fig. 3). A análise de regressão de Cox não revelou um modelo significativo na mortalidade.
Comparação da sobrevida nos grupos de desfecho bom e ruim de acordo com a presença de envolvimento de órgãos (p = 0,790).
Comparação da sobrevida nos grupos de desfecho bom e ruim de acordo com a presença de envolvimento tubular (p = 0,038).
Causa da morte
No fim do período de seguimento, as causas de morte foram sepse ou choque séptico (n = 5, 33,3%), insuficiência cardíaca (n = 4, 26,6%), doença cerebrovascular (n = 3, 20%) e insuficiência de múltiplos órgãos (n = 3, 20%). Sete pacientes (7,4%) tiveram achados de organomegalia ou comprometimento de órgãos na presente coorte (quatro tiveram envolvimento cardíaco, um teve envolvimento cerebrovascular e outro teve envolvimento hepático).
Discussão
O envolvimento renal é uma complicação comum na amiloidose sistêmica. A amiloidose AA é a segunda forma mais comum de amiloidose sistêmica. No presente estudo, a amiloidose AA foi encontrada em 81 pacientes (15,2%) de 531 biópsias renais. Quando sete pacientes que receberam o diagnóstico de amiloidose AL nesse período também foram incluídos, a proporção subiu para 16,5%.1818 Ayar Y, Ersoy A, Yildiz A, Isiktas ES, Celikci S, Arslan I, et al. The evaluation of amyloidosis cases with renal involvement: a single-center experience. Turk Nephrol Dial Transplant. 2015;24:68-73. Os dados de 4.004 biópsias do rim nativo feitas na República Tcheca entre 1994 e 2000 mostraram que a amiloidose renal foi responsável por 9,9% dos casos de glomerulonefrite secundária.1919 Rychlík I, Jancová E, Tesar V, Kolsky A, Lácha J, Stejskal J, et al. The Czech registry of renal biopsies. Occurrence of renal diseases in the years 1994-2000. Nephrol Dial Transplant. 2004;19:3040-9. A amiloidose comprovada por biópsia renal constituiu 0,68% (18 casos AL e 22 casos não AL), 2,1% [407 AL/fragmentos de Ig de cadeias pesada e leve (AHL)/fragmentos somente de cadeias pesadas (AH) e 33 casos de AA], 2,5% (32 casos de AA e 8 AL) e 4,65% (46 casos de AA) do total de casos de biópsias de rim nativo feitas em diferentes centros de Taiwan, EUA, Egito e República Tcheca, respectivamente.88 Said SM, Sethi S, Valeri AM, Leung N, Cornell LD, Fidler ME, et al. Renal amyloidosis: origin and clinicopathologic correlations of 474 recent cases. Clin J Am Soc Nephrol. 2013;8:1515-23.,1414 Abdallah E, Waked E. Incidence and clinical outcome of renal amyloidosis: a retrospective study. Saudi J Kidney Dis Transplant. 2013;24:950-8.,2020 Tsai SF, Wen MC, Cheng CH, Wu MJ, Chen CH, Yu TM, et al. Clinical features of renal amyloidosis: an analysis of 40 patients in a 28-year follow-up. Intern Med. 2011;50:2511-7.,2121 Potysová Z, Merta M, Tesar V, Jancová E, Honsová E, Rysavá R. Renal AA amyloidosis: survey of epidemiologic and laboratory data from one nephrology centre. Int Urol Nephrol. 2009;41:941-5. O registro italiano de biópsias renais relatou uma frequência de 2,5% de amiloidose renal entre 14.777 biópsias renais em sete anos.2222 Schena FP, Pannarale G, Carbonara MC. Clinical and therapeutic aspects of renal amyloidosis. Nephrol Dial Transplant. 1996;11(Suppl. 9):63-8. Existem dados limitados sobre a incidência de amiloidose, provavelmente em decorrência de sua raridade e heterogeneidade. Um estudo recente investigou a incidência de amiloidose com base na hospitalização na Suécia.2323 Hemminki K, Li X, Försti A, Sundquist J, Sundquist K. Incidence and survival in non-hereditary amyloidosis in Sweden. BMC Public Health. 2012;12:974. De 2001 a 2008, a incidência de amiloidose não hereditária em 949 pacientes foi de 8,29 por milhão de pessoas/ano. A amiloidose não especificada foi o maior grupo (535 pacientes, incidência: 4,69/milhão), seguida pela amiloidose sistêmica secundária (136 pacientes, 1,18/milhão). Outro centro na região oriental da Turquia avaliou 128 biópsias de vários locais de 111 pacientes com amiloidose comprovada por biópsia.2424 Ensari C, Ensari A, Tümer N, Ertug E. Clinicopathological and epidemiological analysis of amyloidosis in Turkish patients. Nephrol Dial Transplant. 2005;20:1721-5. Houve 101 (90,9%) pacientes diagnosticados com amiloidose AA. Entre 69 biópsias renais, 65 pacientes tinham amiloidose AA e quatro tinham amiloidose mista (tipos AL + AA em dois e tipos AA + ATTR em dois). A taxa relativamente mais elevada de amiloidose em nossa série de biópsias pode ser explicada pelo fato de que nosso hospital é o único centro de referência na região do sul do Mármara na Turquia. Além disso, os pacientes com amiloidose com ou sem proteinúria podem ser encaminhados para outras clínicas, como a reumatologia e a hematologia, e as biópsias podem ser feitas em locais diferentes além do rim e tratadas. Esses pacientes são encaminhados ao nosso serviço após a ocorrência de insuficiência renal grave.
Nos países desenvolvidos, a artrite reumatoide é a causa mais comum de amiloidose AA com comprometimento renal. Enquanto isso, nos países em desenvolvimento, os pacientes com FFM não tratada e infecções crônicas supurativas constituem uma grande proporção de casos de amiloidose AA.2525 Gertz MA, Kyle RA. Secondary systemic amyloidosis: response and survival in 64 patients. Medicine (Baltimore). 1991;70:246-56.
26 Paydas S. Report of 59 cases of renal amyloidosis. Int Urol Nephrol. 1999;31:619-31.-2727 Real de Asúa D, Costa R, Contreras MM, Gutiérrez Á, Filigghedu MT, Armas M. Clinical characteristics of the patients with systemic amyloidosis in 2000-2010. Rev Clin Esp (Barc). 2013;213:186-93. Em diversos estudos, a FFM parece ser a principal causa de amiloidose AA na Turquia, seguida pela tuberculose.1212 Yilmaz M, Unsal A, Sokmen M, Kaptanogullari OH, Alkim C, Kabukcuoglu F, et al. Renal involvement in AA amyloidosis: clinical outcomes and survival. Kidney Blood Press Res. 2013;37:33-42.,2626 Paydas S. Report of 59 cases of renal amyloidosis. Int Urol Nephrol. 1999;31:619-31.,2828 Tuglular S, Yalcinkaya F, Paydas S, Oner A, Utas C, Bozfakioglu S, et al. A retrospective analysis for aetiology and clinical findings of 287 secondary amyloidosis cases in Turkey. Nephrol Dial Transplant. 2002;17:2003-5. Entre 287 casos de amiloidose renal no estudo em 11 centros de nefrologia na Turquia, 64% tinham FFM como a principal causa, seguido pela tuberculose 10%, bronquiectasia e doença pulmonar obstrutiva crônica 6%, artrite reumatoide 4%, espondilartropatia 3%, osteomielite crônica 2%, causas diversas 4% e desconhecidas 7%.2828 Tuglular S, Yalcinkaya F, Paydas S, Oner A, Utas C, Bozfakioglu S, et al. A retrospective analysis for aetiology and clinical findings of 287 secondary amyloidosis cases in Turkey. Nephrol Dial Transplant. 2002;17:2003-5. No presente estudo, a causa subjacente mais frequente de amiloidose AA foi a FFM (19,7%), seguida por doenças reumáticas crônicas (18,5%), infecções crônicas (13,5%) e malignidade (3,7%). Essa observação foi consistente com os resultados previamente relatados nesse país.2626 Paydas S. Report of 59 cases of renal amyloidosis. Int Urol Nephrol. 1999;31:619-31.,2828 Tuglular S, Yalcinkaya F, Paydas S, Oner A, Utas C, Bozfakioglu S, et al. A retrospective analysis for aetiology and clinical findings of 287 secondary amyloidosis cases in Turkey. Nephrol Dial Transplant. 2002;17:2003-5. Também não foi encontrada diferença estatisticamente significativa na distribuição das causas subjacentes entre os desfechos bom e ruim. A FFM é a principal causa de amiloidose AA entre indivíduos com várias origens étnicas, como judeus, árabes, armênios e turcos em regiões do Mediterrâneo-Oriente Médio.2929 Orbach H, Ben-Chetrit E. Familial Mediterranean fever - a review and update. Minerva Med. 2001;92:421-30. A prevalência estimada de FFM na Turquia é de 0,1%. No entanto, acredita-se que a prevalência pode ser maior, pois muitos pacientes não são diagnosticados. Recentemente, determinou-se a frequência da mutação MEFV em 116 adultos com casos de FFM.3030 Öksuz MF, Karkucak M, Görukmez O, Ocakoğlu G, Yıldız A, Ture M, et al. Investigation of MEFV gene polymorphisms (G138G and A165A) in adult patients with familial Mediterranean fever. Rev Bras Reumatol. 2017;57:501-6. Quinze pacientes (12,7%) tinham proteinúria, 10 (8,6%) doença renal crônica e sete (6%) amiloidose. Encontrou-se uma frequência significativamente maior do alelo G do polimorfismo G138G e alelo A do polimorfismo A165A. No entanto, nesses pacientes não foi possível encontrar uma associação significativa entre esses polimorfismos e achados clínicos, inclusive a doença renal crônica, a proteinúria e a amiloidose.
Em um grande estudo, não foi possível detectar uma causa em 23 (6,1%) de 374 pacientes com amiloidose AA.3131 Lachmann HJ, Goodman HJ, Gilbertson JA, Gallimore JR, Sabin CA, Gillmore JD, et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med. 2007;356:2361-71. No momento do diagnóstico e seguimento, não foi possível detectar qualquer doença inflamatória em 33 (40,7%) pacientes. Da mesma maneira, a causa da amiloidose AA no momento do diagnóstico permaneceu obscura em 29,2% e 32,4% dos casos em dois estudos, apesar de ter sido feita uma pesquisa detalhada à procura de causas inflamatórias ou infecciosas subjacentes.3232 Hofer H, Wiech T, Mihatsch MJ. Renal amyloidosis revisited: amyloid distribution, dynamics and biochemical type. Nephrol Dial Transplant. 2011;26:2877-84.,3333 Girnius S, Dember L, Doros G, Skinner M. The changing face of AA amyloidosis: a single center experience. Amyloid. 2011;18(Suppl. 1):226-8. Um estudo retrospectivo que incluiu pacientes com amiloidose AA (95% tinha envolvimento renal) no Monte Sinai de 1997-2012 revelou níveis consistentemente elevados de interleucina-6 na maior parte dos pacientes idiopáticos (21% dos 43 casos) e com mutação E148Q na pirina (em três de nove pacientes testados).3434 Bunker D, Gorevic P. AA amyloidosis: Mount Sinai experience, 1997-2012. Mt Sinai J Med. 2012;79:749-56. A possibilidade de que alguns dos casos idiopáticos na presente coorte possam ser FFM não deve ser ignorada em decorrência da ocorrência generalizada de FFM na Turquia, da metodologia retrospectiva do presente estudo e da avaliação genética à procura da FFM depois de 2011 no presente centro. Portanto, prefere-se iniciar o tratamento com colchicina em pacientes com amiloidose AA idiopática, exceto naqueles com uma doença renal crônica avançada.
Tsai et al. 2020 Tsai SF, Wen MC, Cheng CH, Wu MJ, Chen CH, Yu TM, et al. Clinical features of renal amyloidosis: an analysis of 40 patients in a 28-year follow-up. Intern Med. 2011;50:2511-7. relataram que 80% dos pacientes com amiloidose tinham síndrome nefrótica (EUP média 6,9 ± 4,7 g/dia) e 40% desses apresentavam valores baixos de TFG (< 50 mL/min/m2). Em outro estudo feito na Espanha, 69,5% dos pacientes com amiloidose tinham síndrome nefrótica (EUP 6 g/dia) e os valores de TFG foram menores do que 60 mL/min/m2 em 70% do grupo amiloidose AA.3535 Siddique N, Gillmore JD, Sattianayagam PT. Decreasing incidence of AA amyloidosis in Spain. Eur J Clin Invest. 2013;43:767-73. Um estudo colaborativo italiano sobre a sobrevida e o desfecho renal descreveu que 43% dos pacientes com amiloidose AA tiveram DRC em estágio 5.3636 Bergesio F, Ciciani AM, Manganaro M, Palladini G, Santostefano M, Brugnano R, et al. Renal involvement in systemic amyloidosis: an Italian collaborative study on survival and renal outcome. Nephrol Dial Transplant. 2008;23:941-51. A amiloidose às vezes pode ser diagnosticada acidentalmente. Anteriormente, apresentou-se o caso de um paciente urêmico que recebeu um diagnóstico de amiloidose AA após nefrectomia unilateral por causa de um hematoma perirrenal espontâneo com risco de vida.3737 Kahvecioglu S, Ersoy A, Akdag I, Vuruskan H, Calisir B. Spontaneous perirenal hematoma with AA amyloidosis in a hemodialysis patient after unilateral nephrectomy. Amyloid. 2008;15:65-8. No presente estudo, idade, distribuição de sexo, pressão arterial sistólica, IMC, albumina sérica, creatinina, EUP (proteinúria na faixa nefrótica), TFGe (estágios da doença renal crônica), achados histopatológicos e de imunofluorescência e necessidade de tratamento de diálise nos grupos de desfecho bom e ruim foram comparáveis no momento do diagnóstico. Apenas a pressão arterial diastólica no grupo de desfecho bom e o nível de fósforo no grupo de desfecho ruim foram maiores do que no outro grupo. Os níveis de creatinina sérica aumentaram e os valores de TFGe diminuíram após o tratamento em ambos os grupos. Contudo, as alterações na creatinina sérica e a TFGe do grupo de desfecho ruim foram mais significativas do que no grupo de desfecho bom. Houve síndrome nefrótica em 55,6% de todos os pacientes. Os níveis de EUP diminuíram após o tratamento no grupo de desfecho bom. Os valores de TFGe foram inferiores a 60 mL/min/m2 em 87,5% do grupo de desfecho bom e 73,3% do grupo de desfecho ruim. O envolvimento renal ocorre precocemente no curso da amiloidose AA. Foi observada uma menor sobrevida renal com um maior número de pacientes que evoluíram para doença renal terminal em pacientes com amiloidose AA renal.3636 Bergesio F, Ciciani AM, Manganaro M, Palladini G, Santostefano M, Brugnano R, et al. Renal involvement in systemic amyloidosis: an Italian collaborative study on survival and renal outcome. Nephrol Dial Transplant. 2008;23:941-51. Na presente coorte, a proporção de pacientes que recebeu tratamento de diálise foi de 27,6% e a mediana da sobrevida renal nos grupos de desfecho bom e ruim não foi diferente. Determinou-se que níveis mais elevados de pressão arterial sistólica, creatinina sérica e EUP foram fatores de risco independentes para doença renal terminal. Outros estudos encontraram que a idade, o envolvimento cardíaco, a creatinina sérica e os níveis de albumina eram preditores de doença renal terminal.3636 Bergesio F, Ciciani AM, Manganaro M, Palladini G, Santostefano M, Brugnano R, et al. Renal involvement in systemic amyloidosis: an Italian collaborative study on survival and renal outcome. Nephrol Dial Transplant. 2008;23:941-51.,3838 Ahbap E, Kara E, Sahutoglu T, Basturk T, Koc Y, Sakaci T, et al. Outcome of 121 patients with renal amyloid a amyloidosis. J Res Med Sci. 2014;19:644-9.
A amiloidose AA é uma doença multissistêmica, progressiva e fatal. As complicações da doença renal terminal são as principais causas de morte. A sobrevida média após o diagnóstico varia entre 4 e 10 anos.1313 Joss N, McLaughlin K, Simpson K, Boulton-Jones JM. Presentation, survival and prognostic markers in AA amyloidosis. QJM. 2000;93:535-42.,3939 Obici L, Perfetti V, Palladii G, Moratti R, Merlini G. Clinical aspects of systemic amyloid diseases. Biochim Biophys Acta (BBA) - Proteins Proteomics. 2005;1753:11-22. No presente estudo, a mediana do tempo de sobrevida global foi de 50,3 ± 16,0 meses em pacientes com comprometimento de órgãos. A mediana do tempo de sobrevida renal foi de 65 ± 3,54 meses. As séries de casos publicadas anteriormente relacionadas com a amiloidose AA renal estão resumidas na tabela 5. Não foi encontrada diferença significativa nas taxas de morte e tempo de sobrevida em pacientes com FFM, doença inflamatória crônica, infecção crônica ou distúrbio desconhecido quando consideradas as diferentes causas etiológicas. Além disso, a presença de envolvimento de órgãos não afetou a sobrevida. Houve diferença significativa na sobrevida média apenas entre pacientes com e sem comprometimento tubular. Entre 474 pacientes com amiloidose renal, o envolvimento vascular foi mais frequente e extenso nos tipos AL/AH/AHL e AA em comparação com os outros tipos. O grau de atrofia tubular e fibrose intersticial na AA foi maior do que na AL/AH/AHL.88 Said SM, Sethi S, Valeri AM, Leung N, Cornell LD, Fidler ME, et al. Renal amyloidosis: origin and clinicopathologic correlations of 474 recent cases. Clin J Am Soc Nephrol. 2013;8:1515-23. Diversos estudos relataram que a idade mais elevada, o sexo masculino, a tuberculose como etiologia, a doença renal avançada, os níveis mais baixos de IMC, a TFGe, o cálcio e a albumina e níveis mais elevados de creatinina, EUP, fósforo e hormônio paratireóideo intacto estiveram associados a um pior prognóstico.1212 Yilmaz M, Unsal A, Sokmen M, Kaptanogullari OH, Alkim C, Kabukcuoglu F, et al. Renal involvement in AA amyloidosis: clinical outcomes and survival. Kidney Blood Press Res. 2013;37:33-42.,3838 Ahbap E, Kara E, Sahutoglu T, Basturk T, Koc Y, Sakaci T, et al. Outcome of 121 patients with renal amyloid a amyloidosis. J Res Med Sci. 2014;19:644-9.,4040 Odabas AR, Cetinkaya R, Selcuk Y, Erman Z, Bilen H. Clinical and biochemical outcome of renal amyloidosis. Int J Clin Pract. 2002;56:342-4. Além disso, o envolvimento cardíaco, níveis séricos mais elevados de creatinina, níveis plasmáticos mais baixos de albumina, a exigência de diálise e o tempo curto até a diálise foram preditores de mortalidade.1212 Yilmaz M, Unsal A, Sokmen M, Kaptanogullari OH, Alkim C, Kabukcuoglu F, et al. Renal involvement in AA amyloidosis: clinical outcomes and survival. Kidney Blood Press Res. 2013;37:33-42.,3838 Ahbap E, Kara E, Sahutoglu T, Basturk T, Koc Y, Sakaci T, et al. Outcome of 121 patients with renal amyloid a amyloidosis. J Res Med Sci. 2014;19:644-9. O envolvimento de órgãos (7,4%) foi baixo na presente coorte. No entanto, o envolvimento cardíaco relacionado com a amiloidose no diagnóstico é um dos fatores preditivos desfavoráveis em pacientes com amiloidose AA com doenças reumáticas.4141 Tanaka F, Migita K, Honda S, Fukuda T, Mine M, Nakamura T, et al. Clinical outcome and survival of secondary (AA) amyloidosis. Clin Exp Rheumatol. 2003;21:343-6. Não se determinou fator de risco independente para a mortalidade. Esses resultados podem ser explicados pela quantidade relativamente pequena de pacientes que tiveram envolvimento de órgãos ou morreram.
Número de pacientes, perfil e momento, distribuição das doenças subjacentes, desfechos renais e sobrevida em alguns estudos relacionados com a amiloidose AA em todo o mundo
Os níveis de VHS, PCR e ASA foram elevados na maior parte dos pacientes do presente estudo, mas não houve diferença estatisticamente significativa entre os grupos de desfecho bom e ruim. A PCR e a ASA são reagentes de fase aguda sintetizados por citocinas pró-inflamatórias.33 Westermark GT, Fändrich M, Westermark P. AA amyloidosis: pathogenesis and targeted therapy. Annu Rev Pathol. 2015;10:321-44. A concentração média de ASA no plasma é de cerca de 3 mg/L em indivíduos saudáveis, mas essa concentração pode aumentar para 2.000 mg/L em processos inflamatórios. O nível de ASA é um poderoso preditor da sobrevida e desfecho renal em pacientes com amiloidose AA.1010 Pinney JH, Lachmann HJ. Systemic AA amyloidosis. Subcell Biochem. 2012;65:541-64. Além disso, a ASA está associada à resposta ao tratamento no curso da amiloidose AA. A medição em série dos níveis de ASA pode ser útil. Observou-se que a ASA correlaciona-se com a carga amiloide, o prognóstico renal e a mortalidade no seguimento de 374 pacientes com amiloidose AA.3131 Lachmann HJ, Goodman HJ, Gilbertson JA, Gallimore JR, Sabin CA, Gillmore JD, et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med. 2007;356:2361-71. Um nível de ASA de menos de 4 ou 10 mg/L está associado a um desfecho favorável.3131 Lachmann HJ, Goodman HJ, Gilbertson JA, Gallimore JR, Sabin CA, Gillmore JD, et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med. 2007;356:2361-71.,4242 Gillmore JD, Lovat LB, Persey MR, Pepys MB, Hawkins PN. Amyloid load and clinical outcome in AA amyloidosis in relation to circulating concentration of serum amyloid A protein. Lancet. 2001;358:24-9. A carga amiloide aumentou e a função do órgão deteriorou-se na maior parte dos pacientes nos quais a ASA esteve persistentemente acima de 50 mg/L.4242 Gillmore JD, Lovat LB, Persey MR, Pepys MB, Hawkins PN. Amyloid load and clinical outcome in AA amyloidosis in relation to circulating concentration of serum amyloid A protein. Lancet. 2001;358:24-9.
A limitação mais importante do presente estudo foi a análise de dados retrospectiva e a inclusão de uma quantidade relativamente pequena de pacientes com diferentes etiologias. Observou-se que a incidência de amiloidose renal relacionada com a FFM tem aumentado em nossa região. Surpreendentemente, observa-se um aumento notável na quantidade de pacientes em que a causa subjacente da amiloidose AA não é determinada. Portanto, a amiloidose deve ser considerada no diagnóstico diferencial de pacientes com síndrome nefrótica ou uremia inexplicável e deve-se fazer uma biópsia renal. Os testes genéticos para o diagnóstico de FFM devem ser usados com maior frequência. O diagnóstico e o tratamento de doenças inflamatórias crônicas são cruciais para a redução no desenvolvimento de amiloidose AA no futuro e melhoria na sobrevida.
References
-
1Mohamed N, Nasr SH. Renal amyloidosis. Surg Pathol Clin. 2014;7:409-25.
-
2Real de Asúa D, Costa R, Galván JM, Filigheddu MT, Trujillo D, Cadiñanos J. Systemic AA amyloidosis: epidemiology, diagnosis, and management. Clin Epidemiol. 2014;6:369-77.
-
3Westermark GT, Fändrich M, Westermark P. AA amyloidosis: pathogenesis and targeted therapy. Annu Rev Pathol. 2015;10:321-44.
-
4Murakami T, Inoshima Y, Ishiguro N. Systemic AA amyloidosis as a prion-like disorder. Virus Res. 2015;207:76-81.
-
5Khalighi MA, Dean Wallace W, Palma-Diaz MF. Amyloid nephropathy. Clin Kidney J. 2014;7:97-106.
-
6Nienhuis HL, Bijzet J, Hazenberg BP. The prevalence and management of systemic amyloidosis in Western countries. Kidney Dis (Basel). 2016;2:10-9.
-
7Rivera F, López-Gómez JM, Pérez-García R. Spanish registry of glomerulonephritis frequency of renal pathology in Spain 1994-1999. Nephrol Dial Transplant. 2002;17:1594-602.
-
8Said SM, Sethi S, Valeri AM, Leung N, Cornell LD, Fidler ME, et al. Renal amyloidosis: origin and clinicopathologic correlations of 474 recent cases. Clin J Am Soc Nephrol. 2013;8:1515-23.
-
9von Hutten H, Mihatsch M, Lobeck H, Rudolph B, Eriksson M, Röcken C. Prevalence and origin of amyloid in kidney biopsies. Am J Surg Pathol. 2009;33:1198-205.
-
10Pinney JH, Lachmann HJ. Systemic AA amyloidosis. Subcell Biochem. 2012;65:541-64.
-
11Kurita N, Kotera N, Ishimoto Y, Tanaka M, Tanaka S, Toda N, et al. AA amyloid nephropathy with predominant vascular deposition in Crohn's disease. Clin Nephrol. 2013;79:229-32.
-
12Yilmaz M, Unsal A, Sokmen M, Kaptanogullari OH, Alkim C, Kabukcuoglu F, et al. Renal involvement in AA amyloidosis: clinical outcomes and survival. Kidney Blood Press Res. 2013;37:33-42.
-
13Joss N, McLaughlin K, Simpson K, Boulton-Jones JM. Presentation, survival and prognostic markers in AA amyloidosis. QJM. 2000;93:535-42.
-
14Abdallah E, Waked E. Incidence and clinical outcome of renal amyloidosis: a retrospective study. Saudi J Kidney Dis Transplant. 2013;24:950-8.
-
15Berkun Y, Eisenstein EM. Diagnostic criteria of familial Mediterranean fever. Autoimmun Rev. 2014;13:388-90.
-
16KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl. 2013;3:1-150.
-
17Dilek K, Usta M, Ersoy A, Ozdemir B, Yavuz M, Güllülü M, et al. Long-term effects of losartan on proteinuria and renal function in patients with renal amyloidosis. Scand J Urol Nephrol. 2002;36:443-6.
-
18Ayar Y, Ersoy A, Yildiz A, Isiktas ES, Celikci S, Arslan I, et al. The evaluation of amyloidosis cases with renal involvement: a single-center experience. Turk Nephrol Dial Transplant. 2015;24:68-73.
-
19Rychlík I, Jancová E, Tesar V, Kolsky A, Lácha J, Stejskal J, et al. The Czech registry of renal biopsies. Occurrence of renal diseases in the years 1994-2000. Nephrol Dial Transplant. 2004;19:3040-9.
-
20Tsai SF, Wen MC, Cheng CH, Wu MJ, Chen CH, Yu TM, et al. Clinical features of renal amyloidosis: an analysis of 40 patients in a 28-year follow-up. Intern Med. 2011;50:2511-7.
-
21Potysová Z, Merta M, Tesar V, Jancová E, Honsová E, Rysavá R. Renal AA amyloidosis: survey of epidemiologic and laboratory data from one nephrology centre. Int Urol Nephrol. 2009;41:941-5.
-
22Schena FP, Pannarale G, Carbonara MC. Clinical and therapeutic aspects of renal amyloidosis. Nephrol Dial Transplant. 1996;11(Suppl. 9):63-8.
-
23Hemminki K, Li X, Försti A, Sundquist J, Sundquist K. Incidence and survival in non-hereditary amyloidosis in Sweden. BMC Public Health. 2012;12:974.
-
24Ensari C, Ensari A, Tümer N, Ertug E. Clinicopathological and epidemiological analysis of amyloidosis in Turkish patients. Nephrol Dial Transplant. 2005;20:1721-5.
-
25Gertz MA, Kyle RA. Secondary systemic amyloidosis: response and survival in 64 patients. Medicine (Baltimore). 1991;70:246-56.
-
26Paydas S. Report of 59 cases of renal amyloidosis. Int Urol Nephrol. 1999;31:619-31.
-
27Real de Asúa D, Costa R, Contreras MM, Gutiérrez Á, Filigghedu MT, Armas M. Clinical characteristics of the patients with systemic amyloidosis in 2000-2010. Rev Clin Esp (Barc). 2013;213:186-93.
-
28Tuglular S, Yalcinkaya F, Paydas S, Oner A, Utas C, Bozfakioglu S, et al. A retrospective analysis for aetiology and clinical findings of 287 secondary amyloidosis cases in Turkey. Nephrol Dial Transplant. 2002;17:2003-5.
-
29Orbach H, Ben-Chetrit E. Familial Mediterranean fever - a review and update. Minerva Med. 2001;92:421-30.
-
30Öksuz MF, Karkucak M, Görukmez O, Ocakoğlu G, Yıldız A, Ture M, et al. Investigation of MEFV gene polymorphisms (G138G and A165A) in adult patients with familial Mediterranean fever. Rev Bras Reumatol. 2017;57:501-6.
-
31Lachmann HJ, Goodman HJ, Gilbertson JA, Gallimore JR, Sabin CA, Gillmore JD, et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med. 2007;356:2361-71.
-
32Hofer H, Wiech T, Mihatsch MJ. Renal amyloidosis revisited: amyloid distribution, dynamics and biochemical type. Nephrol Dial Transplant. 2011;26:2877-84.
-
33Girnius S, Dember L, Doros G, Skinner M. The changing face of AA amyloidosis: a single center experience. Amyloid. 2011;18(Suppl. 1):226-8.
-
34Bunker D, Gorevic P. AA amyloidosis: Mount Sinai experience, 1997-2012. Mt Sinai J Med. 2012;79:749-56.
-
35Siddique N, Gillmore JD, Sattianayagam PT. Decreasing incidence of AA amyloidosis in Spain. Eur J Clin Invest. 2013;43:767-73.
-
36Bergesio F, Ciciani AM, Manganaro M, Palladini G, Santostefano M, Brugnano R, et al. Renal involvement in systemic amyloidosis: an Italian collaborative study on survival and renal outcome. Nephrol Dial Transplant. 2008;23:941-51.
-
37Kahvecioglu S, Ersoy A, Akdag I, Vuruskan H, Calisir B. Spontaneous perirenal hematoma with AA amyloidosis in a hemodialysis patient after unilateral nephrectomy. Amyloid. 2008;15:65-8.
-
38Ahbap E, Kara E, Sahutoglu T, Basturk T, Koc Y, Sakaci T, et al. Outcome of 121 patients with renal amyloid a amyloidosis. J Res Med Sci. 2014;19:644-9.
-
39Obici L, Perfetti V, Palladii G, Moratti R, Merlini G. Clinical aspects of systemic amyloid diseases. Biochim Biophys Acta (BBA) - Proteins Proteomics. 2005;1753:11-22.
-
40Odabas AR, Cetinkaya R, Selcuk Y, Erman Z, Bilen H. Clinical and biochemical outcome of renal amyloidosis. Int J Clin Pract. 2002;56:342-4.
-
41Tanaka F, Migita K, Honda S, Fukuda T, Mine M, Nakamura T, et al. Clinical outcome and survival of secondary (AA) amyloidosis. Clin Exp Rheumatol. 2003;21:343-6.
-
42Gillmore JD, Lovat LB, Persey MR, Pepys MB, Hawkins PN. Amyloid load and clinical outcome in AA amyloidosis in relation to circulating concentration of serum amyloid A protein. Lancet. 2001;358:24-9.
Datas de Publicação
-
Publicação nesta coleção
Nov-Dec 2017
Histórico
-
Recebido
18 Abr 2016 -
Aceito
29 Dez 2016