Resumos
Catalisador a base de níquel e cobalto e suportado em zircônia estabilizada por ítria (YSZ) foi desenvolvido, caracterizado e utilizado para a produção de hidrogênio a partir de etanol. O teor de metal do catalisador foi em torno de 35% em massa, apresentando boa atividade a partir de 400ºC. Esse catalisador foi testado na reforma a vapor do etanol na presença de baixo teor de água, condição semelhante à operação da PaCOS. O catalisador produzido foi utilizado como anodo de células a combustível do tipo PaCOS, com protótipo desenvolvido nesse trabalho; as estruturas anodo/eletrólito/catodo (A/E/C) foram caracterizadas por MEV. A PaCOS foi operada com hidrogênio, metano e etanol, mostrando bom desempenho com este último combustível. A mistura de etanol e metano também foi testada, apresentando resultados promissores para a produção de energia elétrica.
PaCOS; etanol; YSZ; níquel; cobalto; reforma a vapor
Catalyst based on nickel and cobalt, supported on zirconia stabilized with ytria (YSZ) was developed, characterized and used for the hydrogen production from ethanol. The catalyst had metal contents of c.a. 35% in weight and presented high activity above 400ºC. This catalyst was tested in ethanol steam reform at very low water concentration, condition similar to that of SOFC operation. The developed catalyst was also used as anode of a unitary solid oxide fuel cell (SOFC); the SOFC unitary cell was developed and manufactured in this work. The anode/electrolyte/cathode structure was characterized by SEM. The SOFC was operated with hydrogen, methane or ethanol and showed good performance with the latter fuel. The ethanol and methane mixture was also tested and presented very promising results for the production of electrical energy.
SOFC; ethanol; YSZ; nickel; cobalt; steam reforming
Desenvolvimento de protótipo de células a combustível do tipo óxido sólido com reforma direta
Prototype development of solid oxide fuel cells with direct reformation
Marcos Aurélio da Silva; Jaime S. Boaventura; Marcelo G. de Alencar; Cláudio P. Cerqueira
GECIM Grupo de Energia e Ciência dos Materiais Instituto de Química, UFBA, Campus Universitário de Ondina, 40190-270 Salvador-BA e-mail: marcosas@ufba.br, bventura@ufba.br, marceloxyz@gmail.com, claudiop@posgrad.unifacs.br
RESUMO
Catalisador a base de níquel e cobalto e suportado em zircônia estabilizada por ítria (YSZ) foi desenvolvido, caracterizado e utilizado para a produção de hidrogênio a partir de etanol. O teor de metal do catalisador foi em torno de 35% em massa, apresentando boa atividade a partir de 400ºC. Esse catalisador foi testado na reforma a vapor do etanol na presença de baixo teor de água, condição semelhante à operação da PaCOS. O catalisador produzido foi utilizado como anodo de células a combustível do tipo PaCOS, com protótipo desenvolvido nesse trabalho; as estruturas anodo/eletrólito/catodo (A/E/C) foram caracterizadas por MEV. A PaCOS foi operada com hidrogênio, metano e etanol, mostrando bom desempenho com este último combustível. A mistura de etanol e metano também foi testada, apresentando resultados promissores para a produção de energia elétrica.
Palavras chaves: PaCOS, etanol, YSZ, níquel, cobalto, reforma a vapor.
ABSTRACT
Catalyst based on nickel and cobalt, supported on zirconia stabilized with ytria (YSZ) was developed, characterized and used for the hydrogen production from ethanol. The catalyst had metal contents of c.a. 35% in weight and presented high activity above 400ºC. This catalyst was tested in ethanol steam reform at very low water concentration, condition similar to that of SOFC operation. The developed catalyst was also used as anode of a unitary solid oxide fuel cell (SOFC); the SOFC unitary cell was developed and manufactured in this work. The anode/electrolyte/cathode structure was characterized by SEM. The SOFC was operated with hydrogen, methane or ethanol and showed good performance with the latter fuel. The ethanol and methane mixture was also tested and presented very promising results for the production of electrical energy.
Keywords: SOFC, ethanol, YSZ, nickel, cobalt, steam reforming.
1 INTRODUÇÃO
As células a combustível são os dispositivos alternativos mais eficientes e para a geração de limpa de eletricidade. Entre os vários modelos, a célula a combustível do tipo óxido sólido (PaCOS) atrai especial interesse [1]. A alta temperatura de operação da PaCOS (acima de 650ºC) permite reformar diretamente o combustível no anodo e oferece elevada flexibilidade na escolha do combustível. Várias opções de combustível, tais como gás natural e etanol, são consideradas exeqüíveis para a operação da PaCOS, oferecendo uma dimensão ecológica significativa no problema da conversão eficaz da energia. Um diferencial do etanol é a possibilidade de sua produção por biomassa. Assim, o etanol pode ser considerado uma alternativa economicamente atraente como fonte de energia verde, apresentando baixas emissões e uma combustão controlada, com impactos positivos tanto na economia como no ambiente. O sistema de reformador a vapor e PaCOS alimentado a etanol alcança eficiência teórica na faixa de 84 a 93%, operando entre 800 a 1200 K [2, 3]. No Brasil, por causa da produção elevada do etanol, há um forte interesse no desenvolvimento de sua utilização em células a combustível. Além disso, o etanol é um combustível renovável, que não contribui com o aumento do efeito estufa [4].
Entre diversas escolhas de materiais para o anodo de SOFC, os cermets de Ni/YSZ são muito usados, devido à alta condutividade elétrica fornecida pelo níquel metálico e a elevada condutividade iônica suprida pelo suporte YSZ [5]. Além disso, o YSZ é freqüentemente usado como eletrólito, fornecendo uma fina camada apropriada para operação a temperaturas mais baixas [6]. Estudos prévios [7] mostraram que cobalto e níquel suportados em alumina exibiram efeitos sinérgicos na reforma auto-térmica do metano. O catalisador Co-Ni bimetálico mostrou também maior resistência à deposição de carbono, comparado com níquel monometálico, e desempenho comparável com o catalisador bimetálico de Pt-Ni. Choudhary e Mamman [8] empregaram o sistema Co-Ni para a produção do hidrogênio para oxidação parcial e reforma do metano com CO2. Esses autores também observaram uma redução na deposição de carbono e aumento na seletividade para a produção de hidrogênio. Catalisadores baseados em óxidos de cério, zircônio ou cobalto foram usados para a produção de hidrogênio a partir da reforma a vapor do etanol. A conversão do etanol diminuiu gradualmente após dez horas; entretanto, a desativação do catalisador não afetou a produção do hidrogênio. Fierro et al. [9] estudou um catalisador bimetálico de cobre e níquel suportado em sílica para a reforma a vapor do etanol; o catalisador apresentou uma atividade moderada, mas baixa formação de carbono. A combinação do cobalto e níquel exibiu propriedades catalíticas acentuadas para a ativação da ligação carbono-carbono [10].
Os cermets para os anodos de SOFC requerem uma carga do metal acima de 35% em massa, a fim de proporcionar uma adequada condutividade elétrica do material [11]. Takahashi et al. [12, 13] concluíram que o uso de nitrato de níquel e ácido cítrico inibiu eficazmente a agregação do níquel sobre a sílica; sob aquecimento, o citrato de níquel decompõe-se em partículas de óxido de níquel, deixando uma distribuição homogênea sobre a matriz de sílica. Assim, os cermets de níquel podem ser preparados com partículas pequenas e área superficial elevada, mesmo em concentrações elevadas de níquel. Além disso, uma dupla função do ácido cítrico é bem descrita na literatura [14]; o ácido cítrico funciona tanto como agente redutor como estabilizante na química nano-coloidal. Sato et al. [15] e Yoshimura et. al. [16] prepararam catalisadores de níquel usando ácido cítrico. Esse produto promoveu o aumento de área superficial, produzindo catalisadores muito ativos para a hidrogenólise do cicloexeno [15], bem como a coordenação do níquel em torno de cristalitos, em catalisadores muito ativos para a hidrogenação do difenilmetano [16].
Goula et al. [17] investigaram a reforma a vapor do etanol para a produção de um gás rico em hidrogênio, catalisada por paládio suportado em alumina, encontrando que a seletividade a hidrogênio foi proporcional à relação água para etanol, o qual era completamente convertido a baixas temperaturas. Seletividades a hidrogênio de 95% foram obtidas próximas a 650ºC; a concentração do monóxido de carbono exibe um mínimo próximo a 450ºC. A formação de carbono é insignificante para relações água/etanol maiores que a estequiométrica. Liguras et al. [18] estudaram catalisadores suportados de ródio, rutênio, platina e paládio para a reforma do etanol entre 600 a 800ºC, observando que o ródio é significativamente mais ativo e seletivo para a formação de H2 e CO. Cavallaro et al. [19, 20] notaram a conversão total do etanol em Rh/Al2O3 a 650ºC, com produção de 40 e 10% de CO e CH4, respectivamente. Em concordância com predições de equilíbrio, o aumento da temperatura resultou no aumentado da quantidade do CO no gás reformado.
Haga et al. [21] investigaram a reforma do etanol a 400ºC em catalisadores suportados de vários metais de transição, concluindo que o Co/Al2O3 era o catalisador mais efetivo para a reforma do etanol, com 8 e 6% de CO e CH4, respectivamente. A mesma reação foi estudada por meio de um catalisador de cobalto sobre diferentes suportes, como zircônia, MgO, SiO2 e Al2O3 [22]; o último sistema foi também preparado usando diversos precursores do cobalto [23]. Observou-se que, enquanto a atividade para a conversão do etanol era independente dos materiais de partida, a seletividade para hidrogênio era relacionada ao tamanho do cristalito de cobalto. Trabalhos complementares mostraram que suportes com propriedades ácidas e baixos teores de cobalto promovem a desidratação do etanol para eteno [24]. Por outro lado, os catalisadores de Co/SiO2 ou Co/MgO impedem a formação de eteno, mas a distribuição de produto (H2, CO, CO2 e CH4), dependendo das condições da reação [25]. Batista et al. [4] estudaram a reforma do etanol com catalisadores do tipo Co/Al2O3 e Co/SiO2, com teor de cobalto entre 8 a 18 % em massa, mostrando uma conversão maior do que 70% a 400ºC, a qual aumentava com o teor de cobalto. Kaddouri e Mazzocchia [26] utilizaram óxidos de cobalto suportados em SiO2 e Al2O3; atividade catalítica elevada foi obtida para a reforma do etanol com 8% em massa do metal. A distribuição dos produtos da reação foi dependente da natureza do suporte e do método de preparação dos catalisadores. Llorca et al. [27], utilizando ZnO e Co/ZnO preparado por impregnação de Co2(CO)8, mostraram que acetaldeído era o produto inicial da reforma do etanol; o cobalto favorece a reforma do acetaldeído, através da quebra de ligações C-C. A adição de sódio a esses catalisadores reduziu a deposição de carbono [28]. A respeito do mecanismo da reação, Cavallaro et al. [29] observaram que o acetaldeído, formado pela dehidrogenação do etanol, era decarbonilado produzindo CH4 e CO, enquanto o eteno, produzido pela desidratação, era convertido a metano. Sun et al. [30] estudaram níquel suportado em Y2O3, apresentando elevada atividade para a reforma do etanol, com conversão constante de 98% e seletividade a hidrogênio de 38% e 55%, a 300 e 380ºC, respectivamente. A 600ºC, a conversão atinge 100%, com seletividade de 58%. Tsiakara e Demin [31] apresentaram uma análise termodinâmica sobre a utilização do etanol como combustível em PaCOS. A máxima eficiência da PaCOS, entre 950 e 1100 K, é conseguida com produtos da reforma do etanol com dióxido de carbono; fora dessa faixa, a máxima eficiência é obtida com produtos da reforma a vapor do etanol.
Esse trabalho estudou um catalisador a base de níquel e cobalto, suportado em zircônia estabilizada por ítria (YSZ). O teor de metal do catalisador foi da ordem de 35% em massa, possibilitando assim sua condutividade elétrica. Na preparação do catalisador, foi utilizado o ácido cítrico, visando melhorar suas propriedades catalíticas. O catalisador foi caracterizado por redução termoprogramada e testado na reforma a vapor do etanol em presença de baixo teor de água, visando simular condições operacionais semelhantes àquelas dos sistemas PaCOS. O catalisador produzido foi utilizado para preparar o anodo de uma célula unitária do tipo PaCOS, de acordo com o modelo desenvolvido neste trabalho; a estrutura anodo/eletrólito/catodo (A/E/C) foi caracterizada por MEV. A PaCOS unitária foi operada com hidrogênio, metano e etanol, ou mistura desses combustíveis, sendo seu desempenho medido por um circuito elétrico externo.
2 EXPERIMENTAL
2.1 Preparação do Catalisador
O catalisador CATA02 foi preparado misturando-se mecanicamente 0,63 g de nitrato de cobalto hexahidratado [Co(NO3)2.6H2O] com 6,24 g de nitrato de níquel hexahidratado [Ni(NO3)2.6H2O], ambos da marca Merck. Posteriormente foram adicionados 2,6 g do suporte YSZ (8% molar de Y2O3 em ZrO2) [NexTech] e mais 2,6 g de ácido cítrico [Merck]. Foi adicionada uma pequena quantidade de água para melhor homogeneização da mistura, que foi calcinada durante três horas a 800°C na presença de ar. A composição química final do catalisador CATA02, em percentagem mássica de metal ,foi de 3,2 % Co e 31,6 % Ni. Os catalisadores CoOYSZ (Co/YSZ), NiOYSZ (Ni/YSZ) e CATY foram preparados de acordo com a metodologia descrita por Silva et al. [11].
Redução Termoprogramada (TPR): O catalisador CATA02 foi analisado por TPR, utilizando-se uma mistura H2/N2 5% molar, entre 30 a 800°C, com uma taxa de aquecimento de 10°C por minuto. Antes do teste de TPR a amostra foi tratada em fluxo de N2 durante uma hora a 400°C. Foi utilizado um reator de quartzo de leito fixo, o qual continha 200 mg do catalisador, e um forno com controlador de temperatura. A mistura gasosa efluente do reator foi analisada em linha por um detector de condutividade térmica (TCD).
2.2 Avaliação Catalítica
O catalisador CATA02 foi testado na reação de reforma a vapor do metano, entre 700 e 850°C, e na reforma a vapor do etanol entre 100 e 800°C. Os testes foram executados em um microreator de quartzo de leito fixo e fluxo contínuo. Inicialmente 100 mg de catalisador foram reduzidos in situ com uma mistura 10% molar de H2/N2, entre 30 e 850°C com taxa de aquecimento de 10°C por minuto, permanecendo em 850°C durante uma hora. Uma mistura 30% molar de CH4/N2 foi introduzida no reator usando um misturador de gases; a vazão da mistura foi ajustada para 60 mL por minuto, usando-se um medidor de fluxo do tipo bolhômetro. Na reforma a vapor do etanol, tanto o álcool quanto a água foram adicionados através de um saturador com temperatura controlada, onde o vapor foi arrastado pelo nitrogênio. Os produtos da reação foram analisados por cromatografia gasosa, utilizando-se uma coluna Carboxen 1010â e detector de condutividade térmica (TCD) em série com um detector de ionização por chama (FID); o gás de arraste utilizado foi uma mistura de 60% molar de hélio em nitrogênio. O etanol foi inicialmente misturado à água, formando uma mistura azeotrópica aproximadamente 10% molar em água. A mistura azeotrópica foi usada para que a composição não variasse durante a vaporização, sendo o saturador mantido a 60°C.
2.3 Preparação do Protótipo de PaCOS
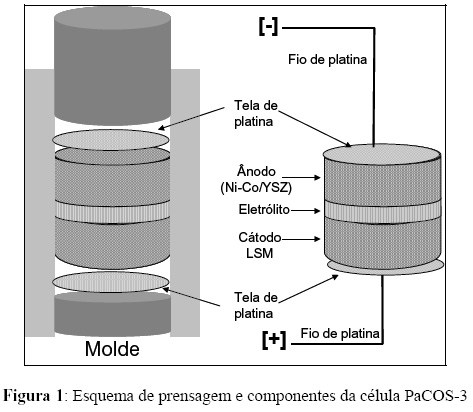
Na preparação do anodo foram usados 3 g do catalisador CATA02, mecanicamente misturados a 1,5 g de grafite [Synth] e 0,5 g de YSZ. A mistura foi controlada de forma tal que a composição de grafite fosse gradativamente menor próximo ao eletrólito da célula. Em contraste, a composição do YSZ foi aumentada gradativamente nas vizinhanças do eletrólito. O catodo foi preparado usando 3 g de LSM [NexTech], 1,5 g de grafite e 0,5 g de YSZ, o procedimento de mistura do LSM com grafite e YSZ foi semelhante à preparação do anodo. Para o eletrólito foi usado 1 g de YSZ puro. A variação da composição da grafite e do YSZ no interior da célula permitiu uma melhor fixação do anodo e do catodo ao eletrólito. O conjunto anodo/eletrólito/catodo foi prensado juntamente com as telas de platina a uma pressão de 165 kgf/cm². Em seguida a célula foi sinterizada a 1380°C durante 5 horas. A Figura 1 mostra os componentes e o esquema de prensagem da célula.
2.4 Avaliação dos Protótipos de PaCOS
Após a sinterização foram colocados os contados elétricos (fios de platina) e a célula foi montada em um reator de alumina com o auxilio de uma cola cerâmica de alta temperatura [Arenco]. O reator foi acoplado em um sistema de alimentação de combustível e a um forno com temperatura controlada. A Figura 2 mostra o esquema de montagem para o teste de desempenho da PaCOS.
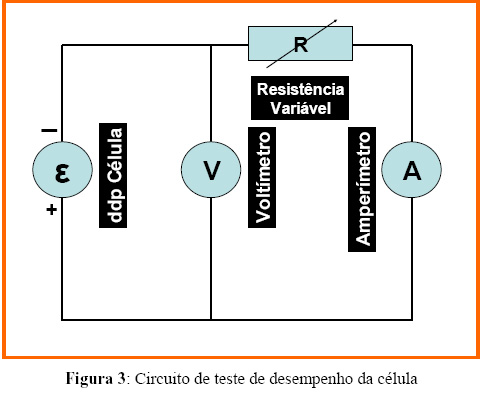
Para os teste de desempenho do protótipo da PaCOS foram utilizados os seguintes combustíveis: etanol, hidrogênio e o metano. Uma mistura de etanol e água foi adicionada ao sistema por meio de um saturador. Os combustíveis, hidrogênio ou metano, foram adicionados ao sistema diluído em um gás inerte (N2). Foram também testadas misturas de combustíveis, ou seja, etanol com hidrogênio e etanol com metano. Os terminais das células foram conectados a um voltímetro e a um amperímetro em paralelo. As medidas de corrente e voltagem foram feitas a 850 e 950°C, variando-se a resistência do circuito de teste. A Figura 3 mostra o circuito elétrico de teste de desempenho da célula.
3 RESULTADOS E DISCUSSÃO
3.1 Microscopia Eletrônica de Varredura (MEV)
Após os testes de desempenho do protótipo de PaCOS, foram feitas micrografias dos componentes da célula utilizando um microscópio eletrônico de varredura (MEV), SHIMADZU S-550. A Figura 4 apresenta micrografias da estrutura anodo/eletrólito/catodo (A/E/C). Um corte transversal do conjunto A/E/C mostra claramente os eletrodos porosos e o eletrólito denso de YSZ, provavelmente cristalizado em sua forma cúbica, com uma espessura de aproximadamente 240 μm; a forma cúbica do cristal de YSZ é a mais apropriada para a condução iônica.
Vários autores [32-35] estudaram a morfologia e a estrutura cristalina de diferentes tipos de YSZ, preparados seguindo uma ampla variedade de metodologias. Esses autores caracterizaram o material por varias técnicas diferentes, mas sempre usando MEV e DRX. O YSZ preparado pelo método sol-gel cristalizou-se com uma estrutura monoclínica, quando calcinado a 500°C, e na estrutura cúbica, quando calcinado a 700°C; as micrografias do YSZ cúbico e monoclínico diferem entre si, principalmente pela presença de arestas definidas na forma cúbica [32]. Micrografias de YSZ sinterizado a 1480°C apresentam claramente as arestas e vértices característicos da estrutura cúbica; a fácil visualização desses elementos foi devido ao crescimento do cristal [35].
A fabricação dessa célula unitária PaCOS, em uma única etapa de sinterização, permitiu grande melhoria dos contactos elétricos dos coletores de corrente, mas apresentou algumas deficiências graves. A principal delas é a interface entre o catodo e o eletrólito, que apresentou uma separação indesejável em vários pontos entre as camadas; esses pontos de descontinuidade entre as interfaces das fases sólidas diminuem significativamente a condutividade iônica da célula. As interfaces entre o eletrólito e os eletrodos (catodo e anodo) foram investigadas por vários autores [36-44], observando que as mesmas apresentam um papel fundamental no desempenho da célula PaCOS. Weber e Ivers-Tiffée [36] encontraram que a interpenetração de uma fase (eletrólito) na outra (eletrodos) diminui consideravelmente a resistência ôhmica da célula; regiões de descontinuidade entre as interfaces reduziam significativamente o desempenho do dispositivo [37].
3.2 Redução Termoprogramada (TPR)
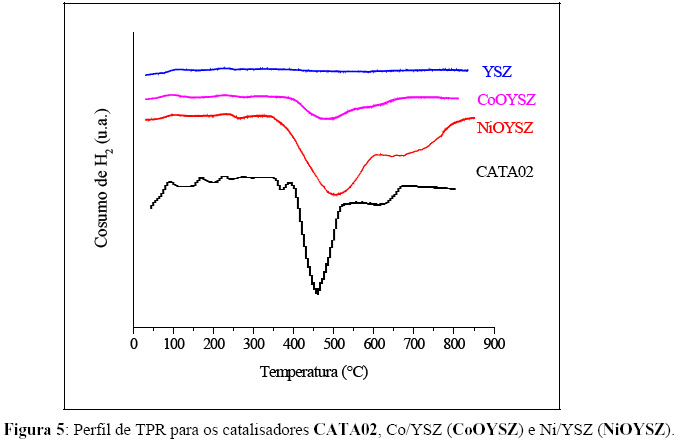
A Figura 5 apresenta os resultados do teste de TPR para a amostra CATA02, do suporte YSZ, YSZ cobaltado (CoOYSZ, 7% massa de Co em YSZ) e um catalisador preparado a partir de YSZ, NiO e resina fenólica (NiOYSZ, 44% em massa de NiO em YSZ), ambos para efeito de comparação. O CATA02 mostra duas temperaturas de redução; uma bem definida a 457°C e outra se iniciando em torno de 550ºC até aproximadamente 650°C. Para comparação, o NiOYSZ e o CoOYSZ apresentam perfil semelhante, mas com picos deslocados para maior temperatura, em torno de 50ºC. A diminuição da temperatura de redução do níquel no CATA02 sugere que o cobalto presente no catalisador facilite esse processo, aumentando assim a sua ação catalítica. O YSZ puro não apresenta redução na faixa de temperatura estudada.
3.3 Avaliação Catalítica
A Figura 6 mostra o desempenho do CATA02 na reforma a vapor do metano em comparação com outro catalisador (CATY). O CATY é um catalisador preparado pela mistura mecânica de óxido de níquel com YSZ com mesma composição metálica do CATA02. As diferenças entre os dois catalisadores são as seguintes: a) o precursor metálico (óxido de níquel para o CATY), b) a presença do cobalto e c) o método de preparação com ácido cítrico. A curva apresenta a formação de hidrogênio em função da temperatura, entre 700 e 850°C; o CATA02 mostrou-se muito mais ativo para a formação do H2 em comparação com o CATY. Esse resultado sugere que o método de preparação com ácido cítrico, o precursor metálico e a presença do cobalto têm influência benéfica na atividade do catalisador; em concordância com vários outros resultados obtidos pela mesmo laboratório [11, 45, 46].
O catalisador CATA02 foi avaliado para a reforma do etanol em presença de pequena quantidade de vapor de água. As reações de reforma do metano e etanol são apresentadas a seguir:
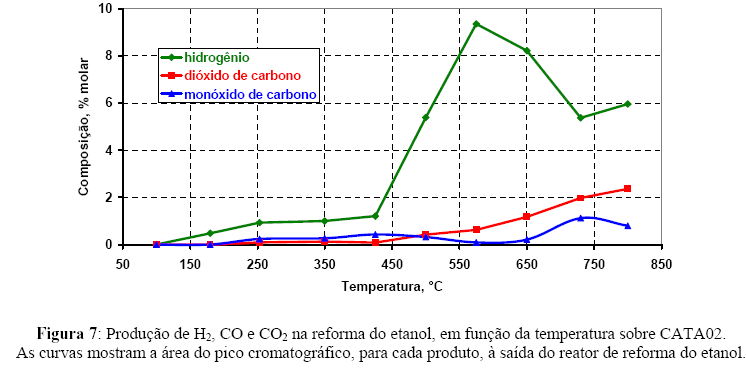
As reações de reforma ocorrem a alta temperatura (acima de 800ºC) em presença de um catalisador a base de metais de transição (níquel ou cobalto para o etanol). A essa elevada temperatura a reação de water gas shift é uma reação rápida, encontrado-se praticamente no equilíbrio, mas fortemente deslocada para a presença de reagentes [45]. A Figura 7 apresenta a concentração molar dos produtos formados na reação (H2, CO e CO2); as concentrações foram determinadas a partir de fatores de multiplicativos da área do cromotograma; para cada analito o fator foi determinado a partir de sua mistura com o gás de arraste, controlada por meio de medidores mássicos de fluxo. Até 400ºC há formação incipiente de hidrogênio, acima desta temperatura a concentração de hidrogênio aumenta rapidamente com a temperatura, para em seguida decrescer, estabilizando ou decrescendo (ou assumindo um comportamento oscilante) acima de 600ºC. Até 200ºC, apesar da pequena formação de hidrogênio, não se observa nenhuma produção de CO ou CO2. Este último produto segue de perto a formação de hidrogênio, isto é, ambos mostram um rápido incremento de produção à 450ºC, entretanto, não apresenta a queda de produção notada para o hidrogênio. O CO por sua vez parece apresentar um comportamento virtualmente inverso à formação do hidrogênio a partir de 300ºC, isto é, o aumento de um produto corresponde à redução na formação do outro e vice-versa; comportamento similar foi observado para outros catalisadores [17].
3.4 Avaliação de desempenho do protótipo de PaCOS
O protótipo de PaCOS foi testado a temperatura de 950ºC, com uma mistura de hidrogênio e nitrogênio, 1:1 molar, e vazão de 60 mL por minuto (mL/min). A Figura 8 apresenta as curvas de desempenho do dispositivo (tensão e potência versus corrente). A corrente deste modelo atingiu 0,6 mA, não sendo possível atingir valores ainda maiores devido às resistências dos terminais elétricos. A tensão variou linear e inversamente com a corrente, enquanto a potência do equipamento apresentou comportamento típico, isto é, aumento inicial de potência, seguindo por decréscimo e passando por um máximo.
O protótipo de PaCOS foi operado com etanol a várias temperaturas, obtendo-se a curva da Figura 9. O combustível foi etanol hidratado (azeótropo com 10% molar de água), com composição controlada pela temperatura do saturador, mantido a 60°C. A tensão da célula, medida entre o anodo e o catodo, apresenta um comportamento praticamente linear e crescente com a temperatura, até aproximadamente 700ºC, quando se estabiliza. A tensão é insignificante enquanto não há formação de hidrogênio, aumentando rapidamente a 300ºC, que corresponde grosso modo ao aumento na formação de hidrogênio na reação de reforma (em torno de 400ºC). A tensão da célula mostra-se estável a partir de 700°C, em torno de 100ºC acima da temperatura na qual ocorre a produção máxima de H2 (Figura 7). Esse comportamento parece refletir o comportamento da cinética das reações eletroquímicas, comparativamente ao pseudo-estado estacionário na qual o eletro-catalisador foi avaliado.
A Figura 10 apresenta as curvas de tensão e potência em função da corrente para a célula estudada, quando operando com etanol diluído em gás inerte. A tensão varia linear e inversamente com a corrente, para todas as temperaturas e combustíveis empregados no teste. Além disso, a tensão produzida pela célula aumenta com o aumento da temperatura de operação. A potência da célula apresenta um comportamento típico para esse tipo de equipamento. Em todos os casos, a célula mostra maior potência para temperatura mais elevada.
A Figura 11 por sua vez mostra as curvas de tensão e potência em função da corrente para a célula estudada, quando alimentada com uma mistura de etanol e um segundo combustível. Observa-se que o desempenho da célula operando a metano a 950ºC é bastante semelhante à mesma operando com hidrogênio a 850ºC. Além disso, a potência máxima ocorreu sempre à mesma corrente, independentemente da temperatura ou combustível. O gás combustível que alimentava a célula foi composto de hidrogênio ou metano, em experimentos diferentes, diluídos em gás inerte, ambos na razão molar de 1:1 (gás combustível para gás inerte) e uma vazão total de 120 mL/min; a essa mistura foi adicionado o etanol hidratado (azeótropo de 10% molar de água), por meio de um saturador mantido a 60ºC. A utilização da mistura etanol e metano trouxe um aumento de mais de 50% na potência máxima, passando de 1,6 para 2,5 mW. Este resultado é consistente com os resultados de reforma do metano em presença de etanol, utilizando o catalisador CATA02 (Figura 3). No caso de misturas de combustíveis, a temperatura de operação praticamente não influenciou o desempenho da célula, para ambos os combustíveis. Para a mistura etanol e metano a 950ºC, a tensão cai rapidamente em presença de corrente no circuito, mantendo-se entretanto constante. Comportamento semelhante para PaCOS a outras temperaturas e misturas de combustíveis seria esperado se fosse possível obter dados intermediários de corrente.
4 CONCLUSÕES
Neste trabalho foi desenvolvido um catalisador a base de níquel e cobalto, muito ativo para a produção de hidrogênio a partir do etanol, em presença de baixa concentração de água. A atividade para a produção de hidrogênio inicia-se em torno de 400°C e aumenta com a temperatura, obtendo-se um máximo de produção de hidrogênio próximo a 600°C. A alta atividade do catalisador pode ser em parte devido à maior facilidade de redução do níquel em presença do cobalto.
O catalisador foi usado como anodo em um protótipo de PaCOS, que mostrou bom desempenho na produção de energia elétrica a partir do etanol. A atividade da célula parece estar correlacionada com a formação de hidrogênio no anodo. A PaCOS operando com uma mistura de combustíveis, etanol e metano, mostrou aumento de potência gerada, sugerindo que esta combinação seja uma boa alternativa para a produção de energia elétrica.
5 AGRADECIMENTOS
Os autores agradecem à Rede Cooperativa Pilha a Combustível de Óxido Sólido (PaCOS), ao CTPETRO/FINEP/CNPq, à Rede Cooperativa Norte/Nordeste de Catálise (RECAT) e à PETROBRAS. Os autores também agradecem ao Sr. Raigenis P. Fiúza pelas análises de MEV .
6 BIBLIOGRAFIA
Data de envio: 18/04/06 Data de aceite: 30/06/06
- [1] ASSABUMRUNGRAT, S., PAVARAJARN, V., CHAROJROCHKUL, S., LAOSIRIPOJANA, N., Chemical Engineering Science, v. 59, 2004, pp. 6015.
- [2] DOUVARTZIDES, S., COUTELIERIS, F., TSIAKARAS, P., Journal of Power Sources, v. 131, pp. 224, 2004.
- [3] DOUVARTZIDES, S.L., COUTELIERIS, F.A., DEMIN, A.K., TSIAKARASA, P.E., International Journal of Hydrogen Energy, v. 29, pp. 375, 2004.
- [4] BATISTA, M.S., R. SANTOS, K.S., ASSAF, E.M., ASSAF, J.M., TICIANELLI, E.A., Journal of Power Sources, v. 134, pp. 27, 2004.
- [5] STEELE, B.C.H., HEINZEL, A., Nature, v. 414, pp. 345, 2001.
- [6] BARNETT, S.A., Energy, v. 15, pp. 1, 1990.
- [7] OPOKU-GYAMFI, K., TAFRESH, Z.M., ADESINA, A.A., Reaction and Kinetics Catalysis Letter , v. 64, pp. 229, 1998.
- [8] CHOUDHARY, V.R., MAMMAN, A.S., Journal of Chemical Technology and Biotechnology , v. 73, pp. 345, 1998.
- [9] FIERRO, V., KLOUZ, V., AKDIM, O., MIRODATOS, C., Catalalys Today, v. 75, pp. 141, 2002.
- [10] SMITH, K., GUO, T., NIKOLAEV, P., THESS, A., European Patent EP 1 015 384 B1, 1998.
- [11] SILVA, M.A., CERQUEIRA, C.P., ALENCAR, M.G., SOUZA, D.R., BOAVENTURA, J.S., Proc. 13ş Congresso Brasileiro de Catálise, Foz do Iguaçu, pp. 123, 11-15 Set., 2005.
- [12] TAKAHASHI, R., SATO, S., SODESAWA, T., KATO, M., TAKENAKA, S., YOSHIDAZ, S., Journal of Catalysis, v. 204, pp. 259, 2001.
- [13] TAKAHASHI, R., SATO, S., SODESAWA, T., SUZUKI, M., ICHIKUNI, N., Microporous and Mesoporous Materials , v. 66, pp. 197, 2003.
- [14] OZKAR, S., FINKE, R.G., Journal of the American Chemical Society, v. 124, pp. 5796, 2002.
- [15] SATO, S., NOZAKI, F., NAKAYAMA, T., Applied Catalysis A: General , v. 139, pp. L1, 1996.
- [16] YOSHIMURA, Y., SATO, T., SHIMADA, H., MATSUBAYASHI, N., IMAMURA, M., NISHIJIMA, A., HIGO, M., YOSHITOMI, S., Catalys Today, v. 29, pp. 221, 1996.
- [17] GOULA, M.A., KONTOU, S.K., TSIAKARAS, P.E., Applied Catalysis B: Environmental, v. 49, pp. 135, 2004.
- [18] LIGURAS, D.K., KONDARIDES, D.I., VERYKIOS, X.E., Applied Catalysis B: Environmental, v. 43, pp. 345, 2003.
- [19] CAVALLARO, S., MONDELLO, N., FRENI, S., Journal of Power Sources, v. 102, pp. 198, 2001.
- [20] FISHTIK, I., ALEXANDER, A., DATTA, R., GEANA, D., International Journal of Hydrogen Energy, v. 25, pp. 31, 2000.
- [21] HAGA, F., NAKAJIMA, T., YAMASHITA, K., MISHIMA, S., SUZUKI, S., Nipon Kagaku Kaishi, v. 1, pp. 33, 1997.
- [22] HAGA, F., NAKAJIMA, T., MIYA, H., MISHIMA, S., Catalysis Letter, v. 48, pp. 223, 1997.
- [23] HAGA, F., NAKAJIMA, T., YAMASHITA, K., MISHIMA, S., Reaction and Kinetics Catalysis Letter, v. 63, pp. 253, 1998.
- [24] BATISTA, M.S., SANTOS, R.K.S., ASSAF, E.M., ASSAF, J.M., TICIANELLI, E.A., Journal of Power Sources, v. 124, pp.99, 2003.
- [25] TANAKA, Y., UTAKA, T., KIKUCHI, R., SASAKI, K., EGUCHI, K., Applied Catalysis A: General, v. 242, pp. 287, 2003.
- [26] KADDOURI, A., MAZZOCCHIA, C., Catalysis Communications, v. 5, pp. 339, 2004.
- [27] LLORCA, J., HOMS, N., DE LA PISCINA, P.R., Journal of Catalysis, v. 227, pp. 556, 2004.
- [28] LLORCA, J., HOMS, N., SALES, J., FIERRO, J.G., DE LA PISCINA, P.R., Journal of Catalysis, v. 222, pp. 470, 2004.
- [29] CAVALLARO, S., CHIODO, V., FRENI, S., MONDELLO, N., FRUSTERI, F., Applied Catalysis A: General, v. 249, pp. 119, 2003.
- [30] SUN, J., QIU, X., WU, F., ZHU, W., WANG, W., HAO, S., International Journal of Hydrogen Energy, v. 29, pp. 1075, 2004.
- [31] TSIAKARAS, P., DEMIN, A., Journal of Power Sources, v. 102, pp. 210, 2001.
- [32] KUO, C.-W., LEE, Y.-H., FUNG, K.-Z., WANG, M.-C., Journal of Non-Crystalline Solids, v. 351, pp. 304, 2005 .
- [33] HENDRIKS, M.G.M., VAN ZYL, W.E., TEN ELSHOF, J.E., VERWEIJ, H., Materials Research Bulletin, v. 36, pp. 2395, 2001 .
- [34] MIURA, N., WANG, J., NAKATOU, M., ELUMALAI, P., ZHUIYKOV, S., HASEI, M., Sensors and Actuators B, v. 114, pp. 903, 2006 .
- [35] CALDERON-MORENO, J. M., YOSHIMURA, M., Materials Science and Engineering A, v. 1250, pp. 375377, 2004 .
- [36] WEBER, A., IVERS-TIFFÉE, E., Journal of Power Sources, v. 127, pp. 273, 2004 .
- [37] LIU, Y.L., PRIMDAHL, S., MOGENSEN, M., Solid State Ionics, v. 161, pp. 1, 2003.
- [38] LIUA, Y.L., JIAO, E.C., Solid State Ionics, v. 176, pp. 435, 2005 .
- [39] MATHER, G.C., FIGUEIREDO, F.M., JURADO, J.R., FRADE, J.R., Electrochimica Acta, v. 49, pp. 2601, 2004.
- [40] KUZNECOV, M., OTSCHIK, P., TROFIMENKO, N., EICHLER, K., Russian Journal of Electrochemistry, v. 40, pp. 1162, 2004 .
- [41] GOURBA, E., BRIOIS, P., RINGUEDÉ, A., CASSIR, M., BILLARD, A., Journal of Solid State Electrochemistry , v. 8, pp. 633, 2004.
- [42] MÜLLER, A.C., HERBSTRITT, D., IVERS-TIFFÉE, E., Solid State Ionics, v. 537, pp. 152153, 2002.
- [43] VIRKAR, A.V., CHEN, J., TANNER, C.W., KIM, J.-W., Solid State Ionics, v. 131, pp. 189, 2000.
- [44] CHARPENTIER, P., FRAGNAUD, P., SCHLEICH, D.M., GEHAIN, E., Solid State Ionics, v. 135, pp. 373, 2000.
- [45] SILVA, M.A., BRANDĂO, S.T., BOAVENTURA, PROC, J.S., XX Simposio Ibero-Americano de Catálise, Gramado, 17-22 Set., pp. 523, 2006.
- [46] CERQUEIRA, C.P., ALENCAR, M.G., SILVA, M. A., SOUZA, D.R., FIUZA, R.P., SANTOS, J.L., BOAVENTURA, PROC, J.S., 13ş Congresso Brasileiro de Catálise, Foz do Iguaçu, 11-15 Set., pp. 129, 2005.
Datas de Publicação
-
Publicação nesta coleção
26 Jun 2007 -
Data do Fascículo
2007
Histórico
-
Recebido
18 Abr 2006 -
Aceito
30 Jun 2006