Resumos
A presença de algumas macromoléculas no sangue esta associada a fenômenos de hiperviscosidade sangüínea e hiperagregação eritrocitária, quadro freqüente em algumas patologias (Diabetes, Hipertensão Arterial,etc). Este estudo investiga a agregação eritrocitária e sedimentação em amostras de sangue suíno, humano e bovino utilizando duas técnicas experimentais. O sangue humano e o de suínos agregam naturalmente formando roleaux enquanto o sangue bovino não agrega. A microestrutura foi investigada por microscopia óptica em amostras de sangue bovino (hematócrito 40%), suíno (hematócrito 1%, 5%, 10%, 30% e 40%) e humano (hematócrito 40%) e amostras de sangue bovino (hematócrito 40%) com adição de fibrinogênio nas concentrações de 5g/l, 10g/l, 20g/l, 25g/l e 30g/l. Os ensaios no Leitor de Microplacas foram realizados para se determinar o comportamento da agregação eritrocitária e sedimentação do sangue em função do hematócrito com e sem adição de fibrinogênio (para o sangue bovino). A microscopia óptica de luz transmitida permite a caracterização das microestruturas do sangue sob diferentes condições experimentais. Com o Leitor de Microplacas é possível distinguir-se três regiões no processo: a- Região I onde ocorre a agregação eritrocitária; b-Região II onde ocorre à predominância da etapa de sedimentação dos eritrócitos; e c- Região III onde ocorre um aumento lento da absorbância ocasionado também pela sedimentação dos eritrócitos. Associando a microscopia óptica com o Leitor de Microplacas é possível criar parâmetros para quantificar o processo de agregação e sedimentação do sangue, ferramentas úteis no diagnóstico e evolução de patologias que afligem tanto seres humanos como animais.
Agregação eritrocitária; fibrinogênio; adesão
The presence of some macromolecules in the blood is associated with blood hiperviscosity and hyperaggregation. We have studied erythrocyte aggregation and blood sedimentation on samples of swine, human and bovine blood. Bovine blood does not present erythrocyte aggregation while human and swine blood naturally aggregates at low shear rates and at stasis. The action of different bovine fibrinogen concentrations on the microstructure of bovine blood was analyzed and compared with swine and human blood. The phenomena were investigated using optical microscopy (to analyze blood microstructures) and Microplate Reader to measure absorbance (at a fixed wavelength, l=655nm) versus time(s). Experiments were performed using samples of bovine blood (hematocrit 40%), swine blood (H= 1%, 5%, 10%, 30% and 40%) and human blood (H= 40%); and samples of bovine blood (H= 40%) with the addition of bovine fibrinogen at different concentrations (5g/l, 10g/l, 20g/l, 25g/l and 30g/l). Using the Microplate Reader it was possible to distinguish three regions in the process: a-The region I where the erythrocyte aggregation occurs; b-region II where the sedimentation process is predominant and c-Region III where a very slow increase indicates that the persistence of sedimentation process. The association of the optical microscopy with the Microplate Reader technique makes possible the determination of quantitative parameters for the process of aggregation and sedimentation. These parameters will facilitate the diagnosis and a more accurate analysis of the evolution of pathologies that afflict both humans as animals.
Erythrocyte aggregation; fibrinogen; aggregation
Influência do fibrinogênio bovino na adesão e agregação eritrocitária
Influence of bovine fibrinogen on erythrocyte adhesion and aggregation
Giuliano S. Martins I ; Antônio V. CardosoI; Marcos H.Pereira II ; Guilherme A. Marcondes I
ILaboratório de Reologia, Setor de Análises Químicas Fundação Centro Tecnológico de Minas Gerais (CETEC) Av. José Candido da Silveira nº 2000, CEP 31170-000, Belo Horizonte (MG), Brasil. e-mail: giulianos@ufmg.br, antonio.cardoso@cetec.br, guilhermemeja@yahoo.com.br
IIDepartamento de Parasitologia Instituto de Ciências Biológicas (ICB), Universidade Federal de Minas Gerais (UFMG) Av. Antonio Carlos,6627, Pampulha, Belo Horizonte (MG), Brasil. e-mail: marcoshp@icb.ufmg.br
RESUMO
A presença de algumas macromoléculas no sangue esta associada a fenômenos de hiperviscosidade sangüínea e hiperagregação eritrocitária, quadro freqüente em algumas patologias (Diabetes, Hipertensão Arterial,etc). Este estudo investiga a agregação eritrocitária e sedimentação em amostras de sangue suíno, humano e bovino utilizando duas técnicas experimentais. O sangue humano e o de suínos agregam naturalmente formando roleaux enquanto o sangue bovino não agrega. A microestrutura foi investigada por microscopia óptica em amostras de sangue bovino (hematócrito 40%), suíno (hematócrito 1%, 5%, 10%, 30% e 40%) e humano (hematócrito 40%) e amostras de sangue bovino (hematócrito 40%) com adição de fibrinogênio nas concentrações de 5g/l, 10g/l, 20g/l, 25g/l e 30g/l. Os ensaios no Leitor de Microplacas foram realizados para se determinar o comportamento da agregação eritrocitária e sedimentação do sangue em função do hematócrito com e sem adição de fibrinogênio (para o sangue bovino). A microscopia óptica de luz transmitida permite a caracterização das microestruturas do sangue sob diferentes condições experimentais. Com o Leitor de Microplacas é possível distinguir-se três regiões no processo: a- Região I onde ocorre a agregação eritrocitária; b-Região II onde ocorre à predominância da etapa de sedimentação dos eritrócitos; e c- Região III onde ocorre um aumento lento da absorbância ocasionado também pela sedimentação dos eritrócitos. Associando a microscopia óptica com o Leitor de Microplacas é possível criar parâmetros para quantificar o processo de agregação e sedimentação do sangue, ferramentas úteis no diagnóstico e evolução de patologias que afligem tanto seres humanos como animais.
Palavras chaves: Agregação eritrocitária, fibrinogênio, adesão.
ABSTRACT
The presence of some macromolecules in the blood is associated with blood hiperviscosity and hyperaggregation. We have studied erythrocyte aggregation and blood sedimentation on samples of swine, human and bovine blood. Bovine blood does not present erythrocyte aggregation while human and swine blood naturally aggregates at low shear rates and at stasis. The action of different bovine fibrinogen concentrations on the microstructure of bovine blood was analyzed and compared with swine and human blood. The phenomena were investigated using optical microscopy (to analyze blood microstructures) and Microplate Reader to measure absorbance (at a fixed wavelength, l=655nm) versus time(s). Experiments were performed using samples of bovine blood (hematocrit 40%), swine blood (H= 1%, 5%, 10%, 30% and 40%) and human blood (H= 40%); and samples of bovine blood (H= 40%) with the addition of bovine fibrinogen at different concentrations (5g/l, 10g/l, 20g/l, 25g/l and 30g/l). Using the Microplate Reader it was possible to distinguish three regions in the process: a-The region I where the erythrocyte aggregation occurs; b-region II where the sedimentation process is predominant and c-Region III where a very slow increase indicates that the persistence of sedimentation process. The association of the optical microscopy with the Microplate Reader technique makes possible the determination of quantitative parameters for the process of aggregation and sedimentation. These parameters will facilitate the diagnosis and a more accurate analysis of the evolution of pathologies that afflict both humans as animals.
Key words: Erythrocyte aggregation, fibrinogen, aggregation.
1 INTRODUÇÃO
As alterações das propriedades reológicas do sangue são responsáveis por diversas doenças causadas pela má circulação do sangue em nosso organismo. A presença de agregados compactos de eritrócitos no sangue constitui-se em sério risco para saúde; estes agregados viajam pela corrente sanguínea podendo causar obstrução de vasos e capilares [1, 2, 3]. Uma das causas da excessiva agregação eritrocitária é a presença de altas concentrações de algumas macromoléculas no sangue. Se, por exemplo, os eritrócitos foram lavados e suspendidos em meio salino livre de macromoléculas, o fenômeno de agregação não ocorre [4].
No sangue normal os agregados desfazem-se a uma taxa de cisalhamento ( ) relativamente baixa (cerca de 20 s 1) sugerindo forças atrativas relativamente fracas [5].
) relativamente baixa (cerca de 20 s 1) sugerindo forças atrativas relativamente fracas [5].
Algumas pesquisas indicam que o nível de agregação é estritamente relacionado com algumas patologias (Diabetes, Isquemia do Miocárdio, Falha Renal, etc). Mas os mecanismos que causam a agregação não são detalhados nestes trabalhos [6, 7, 8].
Existem dois modelos hipotéticos que pretendem descrever o fenômeno de agregação: o modelo de ponteamento e o modelo de depleção [9].
Nordt [10] sugere que fatores como densidade e idade dos eritrócitos são capazes de alterar o grau de agregação; ele acredita que células mais velhas e mais densas possuem um grau de agregação maior. Resultados que correlacionam a agregação apresentada por eritrócitos em plasma autólogo e em solução padrão de polímeros [11, 12, 13] acompanham a posição de Nordt. Estudos utilizando o fibrinogênio humano como agregante, por Chien e Jan [14] e Neu, e Sowemimo-Coker [15] aproximam-se dos resultados apresentados por Nordt.
Pesquisas realizadas com eritrócitos de recém-nascidos indicaram que estas células apresentam um grau de agregação menor do que eritrócitos de indivíduos adultos [16, 17]. Tal agregação depende da idade do bebê. Eritrócitos de recém-nascidos, com idades entre 24 a 28 semanas não apresentam agregação significativa [18]. O comportamento de agregação dos recém-nascidos é atribuído à concentração de proteínas agregantes existentes no plasma dessas crianças: recém-nascidos geralmente possuem o nível de fibrinogênio menor do que indivíduos adultos [19].
John [20] aponta a existência de uma larga diferença no grau de agregação entre diferentes animais: cavalos, leopardos e rinocerontes exibem uma agregação maior enquanto nenhuma agregação é observada em ovelhas, bovinos e caprinos. Vários estudos têm indicado que o fenômeno de agregação requer grandes áreas de membrana para contato entre as células; esta observação permite deduzir que células com baixa capacidade de deforma-se tem baixa capacidade de agregação [21]. No entanto, eritrócitos com alta viscosidade citoplasmática e, conseqüentemente, baixa capacidade de deformação apresentam agregação maior do que células mais novas e com alta capacidade de deformação [22, 23, 24, 25].
A ação de enzimas capazes de atuarem na superfície das hemácias foi investigada por Jan e Chien [26] que utilizaram uma enzima capaz de remover o ácido siálico da superfície das hemácias. Eles constataram um aumento da agregabilidade causada pela redução da densidade de carga da superfície. Nash [11] estendeu esse trabalho para células com diferentes idades e conclui que, para eritrócitos novos e velhos, esse fator não alterava a agregação.
Na realidade, Nash [11] separava as idades das hemácias, por centrifugação, em três tipos: células do topo (novas), células do meio (jovens), células do fundo (velhas). Todas as pesquisas indicaram que a interação do agregante com a célula depende do tipo de agregante; no caso da dextrana (polissacarídeo), por exemplo, existe uma grande dependência com relação à carga elétrica da hemácia [27, 28, 29].
Um caminho para se investigar a influência de macromoléculas na agregação eritrocitária é a utilização de métodos ópticos para determinar a presença de agregados. A utilização desses métodos ocorre de longa data, através do uso de viscosímetros especiais, mas com a desvantagem de necessitarem de grande quantidade de amostra e realizarem apenas um diagnóstico por vez. [30]. O uso de técnicas fotométricas específicas, que necessitam de microlitros de amostra, e permitem um grande número de medidas, podem propiciar soluções para problemas dessa natureza. Seguindo este caminho, sabe-se que para utilização de tal técnica é necessária a compreensão do processo físico de interação de ondas eletromagnéticas (luz visível) com a suspensão (cinética de agregação, tempo de sedimentação, etc). Este trabalho propõe a utilização de microscopia óptica de luz transmitida para caracterizar as microestruturas do sangue sob diferentes condições experimentais e o uso do Leitor de Microplacas para estudo da dinâmica de agregação e sedimentação eritrocitária.
2 MATERIAIS E MÉTODOS
2.1 Coleta e Conservação das Amostras
As amostras de sangue de animais obtidas para essa pesquisa foram provenientes de animais destinados ao abate e consumo humano. As amostras de sangue suíno foram coletadas em matadouros existentes na região metropolitana de Belo Horizonte, e coletadas por agentes do Serviço Sanitário do Ministério da Agricultura, em tubos Falcon de 50ml contendo EDTA (etilenodiaminatetracetato) na proporção de uma gota (~40ml ) para cada 5ml de sangue. O EDTA mantém a morfologia do eritrócito, não interfere nos mecanismos que levam a sedimentação e aumenta a estabilidade da amostra [31]. Posteriormente, o sangue foi armazenado e transportado a uma temperatura de ~10ºC. Em laboratório, as amostras foram conservadas em refrigerador também a ~10ºC [32]. Os ensaios foram realizados em, no máximo, uma hora após a coleta.
As amostras de sangue humano foram coletadas, no momento da realização dos ensaios, por um técnico do Laboratório de Entomologia da Universidade Federal de Minas Gerais (UFMG), segundo protocolo aprovado pelo Comitê de Ética daquela universidade [33]. Foram coletados 10ml de sangue por ensaio com a adição de EDTA (~40ml para cada 5ml).
2.2 Determinação do Hematócrito (H)
O hematócrito das amostras foi determinado utilizando-se uma micro-centrífuga (Centimicro, modelo 211, marca Fanem) e cartão de leitura de hematócrito. As amostras de sangue foram centrifugadas em tubos capilares (quatro tubos por centrifugação) durante 10 minutos. Após centrifugação, a altura da coluna de sangue no capilar era lida com auxílio de um cartão de leitura de hematócrito. O valor final do hematócrito foi a média aritmética dos valores dos quatro tubos.
2.3 Análise de Microestruturas
Para realização dos ensaios de microscopia óptica as concentrações nas amostras de sangue foram reduzidas para os hematócritos (H) de 1%, 5%, 10%, 20%, 30% e 40% (sangue suíno), 40% sangue humano e 40% sangue bovino. Para redução do hematócrito foi adicionado plasma autólogo obtido através de centrifugação (centrifuga da marca FANEM, modelo Excelsa Baby) durante 10 minutos.
Para os ensaios com adição de várias concentrações de fibrinogênio utilizou-se hematócrito de 40%. Para redução de hematócrito utilizou-se plasma autólogo obtido por centrifugação (centrífuga marca FANEM, modelo EXCELSA, Baby). Suspensões de sangue bovino contendo fibrinogênio nas proporções de 5g/l, 10g/l, 20g/l e 30g/l, foram produzidas para esta etapa.
As imagens foram adquiridas com um microscópio óptico de luz transmitida (microscópio óptico marca Leica, modelo DM LS) aclopado a uma câmera (marca MOTIC, modelo MOTICAM). Após a aquisição das imagens, estas foram tratadas no software MOTIC. 3.0.
2.4 Ensaio no Leitor de Microplacas
Para o ensaio utilizando o Leitor de Microplacas (marca Bio-Rad, Benchmark Microplate Reader) foram utilizadas amostras de sangue suíno, sangue bovino e sangue humano. As amostras de sangue suíno, bovino e humano foram reduzidas aos seguintes hematócritos (H): 1%, 5%, 10%, 20% ,30% e 40% (sangue bovino), 1%, 5%, 7,5%, 20% e 40% (sangue suíno) e 1%, 10% e 40% (sangue humano). A redução dos hematócritos foi realizada utilizando-se plasma autológo.
Os ensaios com sangue suíno, bovino e humano foram realizados utilizando-se placas de poço côncavo. O comprimento de onda utilizado para estes ensaios foi de l=655nm. A leitura foi realizada com agitação inicial de 15s, intervalo de 8s e interrompidas no momento de estabilização das leituras. Obteve-se no final um gráfico da absorbância (A655) x tempo. Os dados foram tratados no software EXCEL.
Para os ensaios com várias concentrações de fibrinogênio utilizou-se hematócrito de 10%. Os hematócritos foram produzidos através da adição de plasma autólogo. Após a preparação inicial foram produzidas suspensões sanguíneas com as concentrações de 5g/l, 10g/l, 15g/l, 20g/l, 25g/l e 30g/l através da adição de fibrinogênio.
3 RESULTADOS E DISCUSSÃO
3.1 Microscopia Óptica
A Figura 1 apresenta amostras de sangue humano, suíno e bovino nas condições em que as amostras são coletadas sem adição de qualquer agente agregante ou desagregante nas amostras.
As amostras de sangue humano e de sangue suíno exibem agregação eritrocitária e os agregados formados pelas hemácias suínas apresentam dimensões maiores. As amostras de sangue bovino não exibem o fenômeno de agregação eritrocitária. Analisando-se as dimensões dos agregados formados, espera-se que o processo de sedimentação apresente uma taxa maior para as amostras de sangue suíno, seguido pelas amostras de sangue humano e bovino, nessa ordem.
A Figura 2 apresenta micrografias de sangue suíno com os hematócritos de 1%, 5%, 10%, 20% e 30%:
No repouso, o tamanho dos agregados aumenta com o hematócrito. No hematócrito de 1% por exemplo, o número de agregados é pequeno e de dimensões pequenas contrapondo-se com o hematócrito de 30% onde a suspensão parece ser formada por um único agregado. Como no hematócrito de 1%, o número de eritrócitos é pequeno, a probabilidade desses eritrócitos se encontrarem segue a mesma proporção, daí a existência de pequenos agregados. À medida que o hematócrito aumenta a probabilidade dos eritrócitos se encontrarem também aumenta possibilitando a formação de grandes agregados.
A Figura 2 permite também prever as características de sedimentação da suspensão sangüínea. Nos hematócritos maiores possivelmente a sedimentação apresentaria uma taxa maior devido ao tamanho e massa dos agregados; entretanto, se considerarmos o choque gerado pelos agregados na suspensão plasmática, os hematócritos menores teriam uma taxa de sedimentação maior, pois as colisões entre as partículas são menores.
As Figuras 3, 4 e 5 apresentam amostras de sangue bovino com adição de fibrinogênio nas concentrações de 5g/l, 10g/l, 20g/l e 30g/l:
As micrografias evidenciam que, para ocorrer agregação eritrocitária nas amostras de sangue bovino, é necessário uma concentração alta de fibrinogênio. As imagens demonstram que este valor é próximo de 10g/l (Figura 3). Considerando que a concentração nativa de fibrinogênio para o bovino adulto é cerca de 5g/l necessita-se, desta forma, de uma concentração três vezes maior que a nativa (cerca de 15g/l) para que ocorra agregação eritrocitária.
Portanto, confirma-se que o fibrinogênio é uma macromolécula importante no processo de agregação eritrocitária sem, no entanto podermos definir se ele é o principal agente agregante. Observa-se também que à medida que aumenta a concentração de fibrinogênio, aumentam os espaços entre agregados indicando um maior empacotamento dos agregados.
3.2 Leitor de Microplacas
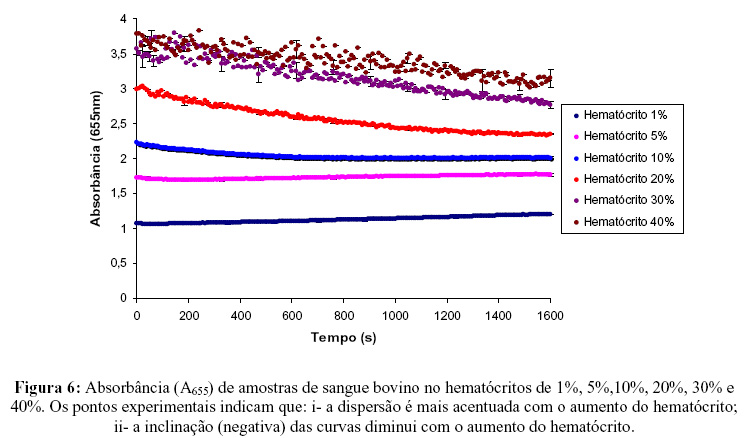
A Figura 6 apresenta o ensaio no Leitor de Microplacas realizado com amostras de sangue bovino nos hematócritos de 1%, 5%,10%, 20%, 30% e 40%. Somente acima de H>10% é possível observar o processo sedimentação, que exige tempos muito longos (acima de 600s para H=10%) para que a sedimentação ocorra. Em hematócritos menores não ocorre sedimentação até t=1600s.
Foram também realizados ensaios com o Leitor de Microplacas em amostras de sangue suíno nos hematócritos de 1%, 5%, 7,5%, 20% e 40% (Figura 7).
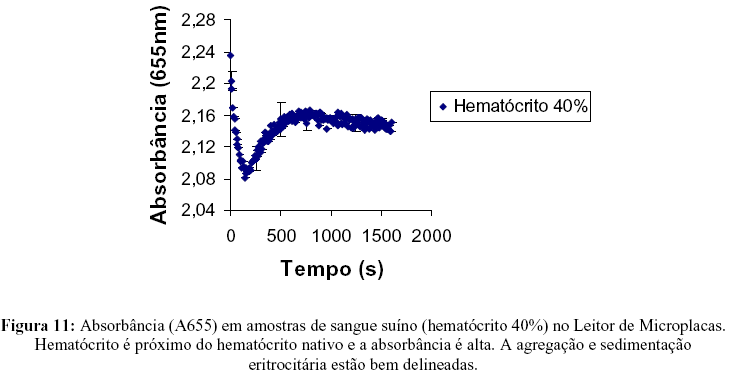
O ensaio com amostras de sangue suíno apresenta uma região de queda da absorbância (0 a aproximadamente <100s). Nesta região ocorra o fenômeno de agregação. A partir de 100s a absorbância começa a aumentar (blindagem). A blindagem consiste no preenchimento do fundo do poço da microplaca pela deposição de sucessivas camadas de eritrócitos. As Figuras 8, 9, 10 e 11 apresentam, em detalhe, algumas dessas curvas com suas respectivas regiões:
À partir dos resultados obtidos com as amostras de sangue suíno (Figuras 8, 9, 10 e 11) propõe-se a curva padrão apresentada na Figura 12.
A Região I corresponde ao processo de agregação. Verificou-se que, para determinar esta região, é necessário que o ensaio se realize imediatamente após a colocação das amostras. O aumento acelerado da absorbância existente na Região II é atribuído à predominância da sedimentação dos eritrócitos e preenchimento do fundo do poço da placa. A Região III é caracterizada por um aumento lento da absorbância ocasionado também pela sedimentação dos eritrócitos.
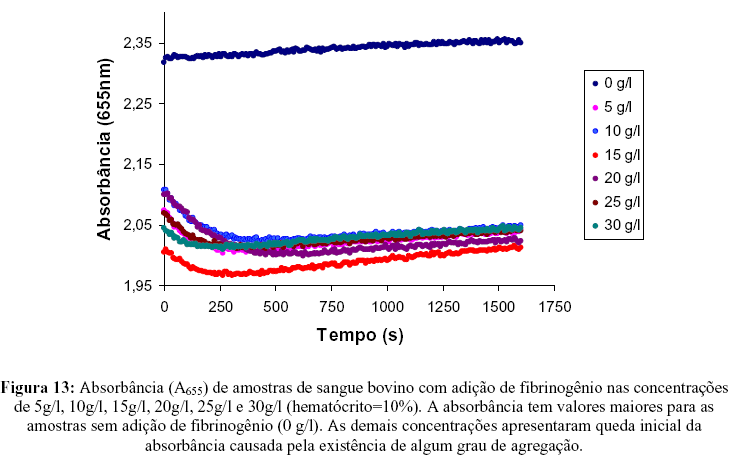
Na Figura 13 são apresentados os resultados dos experimentos de agregação do sangue bovino sob influência do fibrinogênio nas concentrações de 5g/l, 10g/l, 15g/l, 20g/l, 25g/l e 30g/l.
A absorbância inicial assume valores maiores para as amostras de sangue sem adição de fibrinogênio (Figura 13). O acréscimo de fibrinogênio é capaz de alterar a absorbância inicial, mas não se pode afirmar que este fenômeno é causado pela agregação visto que somente concentrações superiores a 15g/l provocariam o fenômeno (veja item 3.1).
A Figura 14 apresenta o comportamento de amostras de sangue humano nos hematócrito de 1%, 10% e 40% em ensaios realizados no Leitor de Microplacas. Observa-se que apenas no hematócrito de 10%, a Região I da curva mestra foi detectada (agregação). O hematócrito de 1% apresenta um decréscimo lento da absorbância com posterior aumento; esse decréscimo corresponde à agregação eritrocitária que ocorre de forma lenta devido ao reduzido número de partículas. No hematócrito 40%, a dispersão dos resultados dificulta a detecção do fenômeno.
4 CONCLUSÕES
A microscopia óptica de luz transmitida auxilia na determinação das concentrações críticas para a ocorrência da agregação eritrocitária em sangue bovino que, naturalmente, não agrega. Concentrações (em g/l) superiores a 15% são necessárias para que o sangue bovino agregue, isto é, 3 vezes a concentração nativa que é de 5 g/l
Como uma alternativa para o estudo dos fenômenos de agregação e sedimentação eritrocitária utilizou-se o Leitor de Microplacas, onde, com microlitros de sangue, é possível realizar um ensaio fotométrico em que as variáveis absorbância e tempo podem ser quantificadas simultaneamente (ensaio cinético). O Leitor de Microplacas também possui a vantagem de realizar, simultaneamente, ensaio em dezenas de amostras.
Com a utilização do Leitor de Microplacas determinou-se uma curva mestra cujas diferentes regiões descrevem o fenômeno de agregação e de sedimentação: i-Região I, correspondente ao processo de agregação; ii-Região II, com a predominância da sedimentação dos eritrócitos e preenchimento do fundo do poço da placa; iii - Região III, caracterizada por um aumento lento da absorbância ocasionado também pela sedimentação dos eritrócitos. A detecção da Região I parece ser dependente das etapas de manuseio da amostra anteriormente à realização dos ensaios. Foi também possível observar que o comportamento do sangue humano também obedece a curva mestra proposta.
A associação entre técnicas ópticas auxilia muito o estudo dos fenômenos de agregação e sedimentação. O uso da microscopia óptica de luz transmitida é uma excelente ferramenta para, através da observação sistemática, caracterizar as microestruturas do sangue sob diferentes condições experimentais. Associando esta técnica com o Leitor de Microplacas é possível criar parâmetros para quantificar o processo de agregação e sedimentação que facilitem o diagnóstico e o estudo da evolução de patologias que afligem tanto seres humanos como animais.
5 AGRADECIMENTOS
Os autores agradecem ao CNPq (Bolsa de Mestrado para GSM) e à FAPEMIG (Bolsa de Iniciação Científica para GAM) pelo apoio financeiro concedido.
6 BIBLIOGRAFIA
Data de envio:02/08/06 Data de aceite: 13/11/06
- [1] KIM, S., POPEL, A.S., INTAGLIETA, M., et al., Aggregate Formation of Erythrocytes in Postcapillary Venules, American Journal of Physiology- Heart and Circulatory Physiology, v. 288, pp. 584-590, 2005.
- [2] BARSHTEIN, G., WAJNBLUYN, D., YEDGAR, S., Kinetics of Linear Rouleaux Formation Studied by Visual Monitoring of Red Cell Dynamic Organization, Journal of Biophysics, v. 78, pp. 24702474, 2000.
- [3] BISHOP, J.J., NANCE, P.R., POPEL, A.S., ITAGLIETTA, M., et al., Relationship between Erythrocyte Aggregate Size and Flow Rate in Skeletal Muscle Venule, American Journal of Physiology- Heart and Circulatory Physiology, v. 286, pp. H113H120, 2004.
- [4] GABRIEL, S.A., TRISĂO, C.K., IZAR, L.C., et al., Avaliaçăo da Agregaçăo Plaquetária e Dosagem de Fibrinogęnio em Pacientes com Doenças Cardiovasculares e Sua Correlaçăo com o Uso de Aspirina e Fatores de Riscos Coronários, Brazilian Journal of Cardiovascular Surgery, v. 21, n. 3, pp. 289-294, 2006.
- [5] BOR-KUCUKATAY, M., WENBY, R.B., MEISELMAN, H.J., et al., Effect of Oxide Nitric on Red Blood Cell Deformability, American Journal of Physiology- Heart and Circulatory Physiology, v. 284, pp. 1577-1584, 2002.
- [6] ELISHKEVITZ, K., FUSMAN, R., KOFLLER, M., Rheological Determinants of Red Blood Cell Aggregation in Diabetics Patients Relation to Their Metabolic Control, Diabetic Medicine, v.16, pp. 152-156, 2002.
- [7] SNYDER, L.M., FORTIER, N.M., TRAINOR, J., et al., Effect of Hidrogen Peroxide Exposure in Normal Human Erythrocyte, Deformability, Morphology, Surface Characteristics and Espectrin Hemoglobin Cross- Linking, The American Society of Clinical Investigation, v. 76, pp. 1971-1977, 1985.
- [8] GIBBS, C.R., BLANN, A.D., WATSON, R.D.S, et al., Abnormalities of Hemorheological, Endothelial, and Platelet Function in Patients With Chronic Heart failure in Sinus Rhythm: Effects of Angitensin Converting Enzyme Inhibitor and Beta Blocker Terapy, Journal of the American Heart Association, n. 103, pp. 1746-1751, 2001.
- [9] MEISELMAN, H.J., Red Blood Cell Role in RBC Aggregation: 1963-1993 and Beyond, Clinical Hemorheology, v. 13, pp. 575-592, 1993.
- [10] NORDT, F.J., Hemorheology in Cardiovascular Diseases: Approaches to Drug Development, Annals of New York Academy of Science, v. 416, pp. 651-663, 1983.
- [11] NASH, G.B., WENBY, S.O., MEISELMAN, H.J., et al., Influence of Cellular Properties on Red Cell Aggregation, Clinical Hemorheology, v.7, pp. 93-108, 1987.
- [12] SOWEMIMO-COKER, S.O., WHITTINGSTALL, P., PIETSCH,L., et al., Effect of Cellular Factors on The Aggregation Behavior of Human, Rat and Bovine Erythrocytes, Clinical Hemorheology, v. 9, pp. 723-737, 1989.
- [13] MURPHY, J.R., Influence of Temperature and Method of Centrifugation on the Separation of Erythrocytes, Journal of Laboratory and Clinical Medicine, v. 82, pp. 334-341, 1995.
- [14] CHIEN, S.J., JAN, K.M., Ultrastructural Basis of the Mechanism of Rouleaux Formation, Microvascular Research, v. 5, pp. 155-166, 1973.
- [15] NEU, B., SOWEMIMO-COKER, S.O., MEISELMAN, H., Cell-Cell Affinity of Senescent Human Erythrocytes, Biophysical Journal, v. 85, pp. 75-84, 2003.
- [16] MEISELMAN, H.J., Rheologic Behavior of Shape-Transformed Human Red Cells, Biorheology, v. 15, pp. 225-237, 1978.
- [17] RAMPLING, M.W., WHITTINGSTALL, P., MARTINS, G., et al., A Comparison of Rheologic Properties of Neonatal and Adult Blood, Pediatric Research, v. 25, pp. 457-460, 1999.
- [18] LINDERKAMP, O., OZANNE, P., YU, P.K.Y., et al., Red Blood Cell Aggregation in Preterm and Term Neonates and Adults, Pediatric Research, v.18, pp. 964-968, 1984.
- [19] ANWAR, M.A., RAMPLING, M.W., BIGNALL, S, et al., The Variation With Gestational Age of the Rheological Properties of the Blood of the New-Born, Britain Journal of Hematology, v. 86, pp. 163-168, 1994.
- [20] JOHN, H., PHIPPS, C., GASCOYNE, S., et al., A Comparasion of Viscometric Properties of Blood from a Wide Range of Mammals, Clinical Hemorheology, v. 12, pp. 639-647, 1992.
- [21] NASH, G.B., MEISELMAN, H.J., Alteration of Cell Membrane Viscoelasticity by Heat Treatment: Effect of Cell Deformability and Suspension Viscosity, Biorheology, v. 22, pp. 73-84, 1985.
- [22] LINDERKAMP, O., MEISELMAN, H.J., Geometric, Osmotic and Membrane Mechanical Properties of Density-Separated Human Red Cells, Blood, v. 59, pp. 1121-1127, 1982.
- [23] LINDERKAMP, O., FRIEDERICHS, E., MEISELMAN, H.J., Mechanical and Geometrical Properties of Density-Separated Neonatal and Adult Erythrocytes, Pediatric Research, v. 34, pp. 688-693, 1993.
- [24] BASKURT, O.K., MEISELMAN, H.J., Cellular Determinants of Low-Shear Blood Viscosity, Biorheology, v. 34, pp. 235-247, 1997.
- [25] MEISELMAN, H.J., Rheological Behavior of Shape- Transformed Human Red Blood Cells, Biorheology, v. 15, pp. 225-237, 1978.
- [26] JAN, K.M.,CHIEN, S.J., Role of Surface Charge in Red Cell Interactions, The Journal of General Physiology, v. 61, pp. 638-654, 1973.
- [27] KAY, M.M.B., Mechanism Of Removal of Senescence Cell by Human Macrophages in Situ, Proceedings of .National Academy of Science, USA, v. 72, pp. 3521-3525, 1975.
- [28] RAMPLING, M.W., An Investigation of the Aggregating Potential of Various Red Cell Aggregating Agents and the Correlations Between Them, International Conference of Haemorheology, Yaroslavi, Russia, pp. 29-31, 2001.
- [29] HONORATO, T.L., Estudo da Massa Molar Viscosimétrica Obtida Via Processo Fermentativo com Dextrana-Sacarose do Leuconostoc Mesenteroids B512 F, In: VI Congresso Brasileiro de Engenharia Química em Iniciaçăo Científica, Brasil, Campinas, 2005.
- [30] WONG, S.Y., Colorimetric Determination of Iron and Hemoglobin in Blood, Journal of Biological Chemistry, n. 77, pp. 409, 1928.
- [31] PLEBANI, M., PIVA, E., Erythrocyte Sedimentation Rate: Use of Fresh Blood for Quality Control, American Journal of Clinical Pathology, n. 117, pp. 621-626, 2002.
- [32] ANVISA, Portaria N. 121 de 24 de Novembro de 1995, pp. 69.
- [33] COMITĘ DE ÉTICA E PESQUISA DA UNIVERSIDADE FEDERAL DE MINAS GERAIS (COEP-UFMG), Parecer: ETIC 0345/06, CAAE-0345.0.203.000-06.
Datas de Publicação
-
Publicação nesta coleção
26 Jun 2007 -
Data do Fascículo
2007
Histórico
-
Aceito
13 Nov 2006 -
Recebido
02 Ago 2006