Resumos
O objetivo foi avaliar o perfil fisiológico do músculo sóleo na fase aguda da imobilização articular na posição de 90o. Ratos Wistar foram divididos em 4 grupos (n=6 cada): controle (C), imobilizado por 1 (Im1), 2 (Im2) e 3 dias (Im3). Após o período experimental, o músculo sóleo foi retirado e foram mensurados: o peso muscular, o índice de hidratação, a concentração de glicogênio e a concentração de DNA/proteínas totais. Os dados foram submetidos a análise estatística, com nível de significância fixado em p<0,05. No primeiro dia não houve alterações nas reservas glicogênicas, sendo observada redução progressiva das reservas: 53% no segundo dia e 65% no terceiro dia de imobilização. O peso muscular sofreu redução de 28,57% apenas no terceiro dia; o índice de hidratação aumentou 6,44% no segundo e 8,58% no terceiro dia. As concentrações de DNA tiveram elevação de 43,18% no primeiro dia, 59,09% no segundo e 75% no terceiro. Quanto à concentração de proteínas totais, houve elevação de 45,9% no primeiro dia, 32,25% no segundo e 58,95% no terceiro dia. Os resultados sugerem que a hipotrofia muscular é um processo desencadeado precocemente, envolvendo alterações quimiofisiológicas que são deflagradas na fase aguda da imobilização.
Atrofia muscular; Imobilização; Músculo esquelético
The purpose of this study was to outline a physiological profile of the soleus muscle during the acute phase of joint immobilization at a 90º position. Male Wistar rats were divided into four groups (n=6): Control (C), immobilised for 1 (Im1), 2 (Im2), and 3 (Im3) days. After the experimental period, the soleus muscle was obtained in order to assess: glycogen content, muscle weight, hydration index, and protein-DNA interactions. Data were statistically analysed and significance level set at p<0.05. On the first day, no changes were observed on glycogen content, but progressive reduction was witnessed along the following days -53% on the second day and 65% on the third day of immobilization. Muscle weight suffered a reduction of 28.57% only on the third day, while hydration index increased 6.44% on the second day and 8.58% on the third day. Concentrations of DNA raised 43.18% on the first day, 59.09% on the second, and 75% on the third day. Protein concentrations also increased, reaching values of 45.9% on the first day, 32.25% on the second day, and 58.95% on the third day. These results suggest that muscular hypotrophy is an early-developing process, involving chemical-physiological alterations that are launched during the acute phase of immobilization.
Immobilisation; Muscle, skeletal; Muscular atrophy
PESQUISA ORIGINAL ORIGINAL RESEARCH
Comportamento quimiometabólico do músculo sóleo na fase aguda da imobilização articular
Chemical metabolic behaviour of the soleus muscle during the acute phase of joint immobilisation
Luciano Júlio ChinguiI; Rommel Padovan BraquinhoI; Maria Theresa Munhoz SeveriI; Carlos Alberto da SilvaII
IFisioterapeutas Ms.
IIProf. Dr. do Programa de Pós-Graduação em Fisioterapia da Unimep
Endereço para correspondência Endereço para correspondência: Luciano J. Chingui R. São Sebastião 125 Vila Monteiro 13418-485 Piracicaba SP e-mail: ljchingui@yahoo.com.br
RESUMO
O objetivo foi avaliar o perfil fisiológico do músculo sóleo na fase aguda da imobilização articular na posição de 90o. Ratos Wistar foram divididos em 4 grupos (n=6 cada): controle (C), imobilizado por 1 (Im1), 2 (Im2) e 3 dias (Im3). Após o período experimental, o músculo sóleo foi retirado e foram mensurados: o peso muscular, o índice de hidratação, a concentração de glicogênio e a concentração de DNA/proteínas totais. Os dados foram submetidos a análise estatística, com nível de significância fixado em p<0,05. No primeiro dia não houve alterações nas reservas glicogênicas, sendo observada redução progressiva das reservas: 53% no segundo dia e 65% no terceiro dia de imobilização. O peso muscular sofreu redução de 28,57% apenas no terceiro dia; o índice de hidratação aumentou 6,44% no segundo e 8,58% no terceiro dia. As concentrações de DNA tiveram elevação de 43,18% no primeiro dia, 59,09% no segundo e 75% no terceiro. Quanto à concentração de proteínas totais, houve elevação de 45,9% no primeiro dia, 32,25% no segundo e 58,95% no terceiro dia. Os resultados sugerem que a hipotrofia muscular é um processo desencadeado precocemente, envolvendo alterações quimiofisiológicas que são deflagradas na fase aguda da imobilização.
Descritores: Atrofia muscular; Imobilização; Músculo esquelético/metabolismo
ABSTRACT
The purpose of this study was to outline a physiological profile of the soleus muscle during the acute phase of joint immobilization at a 90º position. Male Wistar rats were divided into four groups (n=6): Control (C), immobilised for 1 (Im1), 2 (Im2), and 3 (Im3) days. After the experimental period, the soleus muscle was obtained in order to assess: glycogen content, muscle weight, hydration index, and protein-DNA interactions. Data were statistically analysed and significance level set at p<0.05. On the first day, no changes were observed on glycogen content, but progressive reduction was witnessed along the following days -53% on the second day and 65% on the third day of immobilization. Muscle weight suffered a reduction of 28.57% only on the third day, while hydration index increased 6.44% on the second day and 8.58% on the third day. Concentrations of DNA raised 43.18% on the first day, 59.09% on the second, and 75% on the third day. Protein concentrations also increased, reaching values of 45.9% on the first day, 32.25% on the second day, and 58.95% on the third day. These results suggest that muscular hypotrophy is an early-developing process, involving chemical-physiological alterations that are launched during the acute phase of immobilization.
Key words: Immobilisation; Muscle, skeletal/metabolism; Muscular atrophy
INTRODUÇÃO
A musculatura esquelética constitui um dos principais tecidos alvos da fisioterapêutica, uma vez que está envolvida com diversas afecções, em especial as ortopédicas. No âmbito da ortopedia, a imobilização é um recurso terapêutico eficiente e amplamente utilizado, mas que acarreta diversos efeitos indesejados, como o comprometimento da homeostasia das fibras musculares. A literatura científica mostra que, simultaneamente ao desuso, ocorrem alterações como hipotrofia muscular, fibrose intramuscular, redução da extensibilidade muscular, além de limitação de movimento articular1.
Nesse contexto, tem-se caracterizado a hipotrofia como um processo específico em cada tipo de músculo2. As fibras do tipo I têm menor capacidade de adaptação do que as fibras do tipo II, sendo conseqüentemente mais afetadas pelo desuso3. Isso é ratificado por Caiozzo et al.4, segundo os quais músculos cuja ação é antigravitacional têm maior grau de hipotrofia em situações de desuso. Kasper et al.5 observaram maior susceptibilidade à hipotrofia em fibras lentas oxidativas e Tanaka et al.6 observaram no músculo sóleo maior comprometimento em situação de desuso, por ser predominantemente formado por fibras do tipo I, ao passo que o extensor longo dos dedos, que tem predomínio de fibras do tipo II, é menos comprometido. Observou-se ainda que as fibras lentas em situação de desuso apresentam marcantes alterações histofisiológicas como irregularidades no retículo sarcoplasmático, fibrilas desintegradas, lesão mitocondrial, linhas Z estendidas, bem como condensação e fragmentação da cromatina nuclear e redução de sarcômeros em paralelo5,7,8.
Alguns estudos vêm tentando elucidar as alterações metabólicas geradas pela imobilização. Assim, Hilder et al.9 em estudo realizado com suspensão de membros posteriores de ratos, demonstraram que a resistência à insulina acompanha o processo de atrofia muscular induzida pelo desuso em músculos esqueléticos de contração lenta, como o músculo sóleo. Simultaneamente, esses autores observaram uma redução na expressão de proteínas nos músculos hipotrofiados e a correlacionaram à degradação da proteína IRS-1; e, ainda observaram uma redução na atividade da Akt. Esses achados evidenciam uma redução na efetividade da sinalização insulínica.
Diversas pesquisas encontraram perdas de massa muscular em períodos de imobilização. Ohira et al.10 observaram em ratos a implantação rápida da hipotrofia em períodos de sete e dez dias de imobilização por suspensão, sendo evidenciado que, após o 10º dia, a perda de massa ocorre com menor velocidade.
Outros estudos indicam que longos períodos de imobilização promovem redução nas fibras musculares, merecendo destaque o estudo de Veldhuizen et al.11, que verificaram, através de biópsia muscular, redução de 16% no diâmetro da fibra do músculo vasto lateral após quatro semanas de imobilização. Chakravarthy et al.12 demonstraram uma significativa redução na massa do músculo sóleo e no potencial de proliferação das células satélites residentes após três semanas de imobilização.
Outros estudos, como os realizados por Ohira et al.10, Kano et al.13, Edgerton et al.14 e Morris et al.15, também observaram implantação da hipotrofia muscular em períodos de imobilização que variam de cinco dias a várias semanas.
Vale salientar que não há na literatura estudos direcionados à compreensão dos mecanismos fisiológicos deflagrados nos primeiros dias de imobilização, sendo esse considerado o período agudo do desuso.
Diante do exposto, o objetivo deste trabalho foi avaliar o perfil metabólico do músculo sóleo na fase aguda da imobilização do tornozelo de ratos na posição de 90º, com foco no período que se estende do primeiro ao terceiro dia de desuso.
METODOLOGIA
Foram utilizados ratos albinos Wistar com 3 meses de idade, alimentados com ração (Purina® para roedores) e água ad libitum, submetidos a ciclos de 12 h claro/escuro e distribuídos em quatro grupos experimentais com seis animais, a saber: controle (C) e imobilizados 1 dia (Im1), 2 dias (Im2) e 3 dias (Im3). O trabalho foi aprovado pelo comitê de ética em experimentação animal da UFSCar.
Após anestesia com pentobarbital sódico (50 mg/kg, i.p), a pata posterior esquerda dos animais foi imobilizada com o modelo de órtese de resina acrílica proposto por Silva et al.16.
Após a fase de imobilização, os animais foram sacrificados por deslocamento cervical e o músculo sóleo (S) foi retirado e preparado para a determinação de reservas glicogênicas, peso seco, porcentagem de hidratação e concentrações de DNA e proteínas totais.
Para a determinação do glicogênio, as amostras dos músculos foram digeridas em KOH 30% a 100°C e o glicogênio precipitado a partir da passagem por etanol a quente. Entre uma fase e outra da precipitação, a amostra foi centrifugada a 3.000 rpm durante 10 minutos. O glicogênio precipitado foi submetido à hidrólise ácida na presença de fenol, segundo a proposta de Siu et al.17, estando os valores expressos em mg/100mg de peso úmido.
Para a obtenção do índice de hidratação e do peso seco, imediatamente após a retirada do músculo, o mesmo foi pesado em balança semi-analítica e em seguida colocado em uma estufa a 60ºC. Subseqüentemente, o músculo foi pesado a cada 1 hora até permanecer com peso constante (em mg). Assim, pela diferença entre o peso inicial (peso úmido) e o peso final, foi determinado tanto o índice de hidratação muscular (em %) como o peso seco (em mg).
A determinação das proteínas totais foi realizada com kit laboratorial da marca BioDiagnóstica®, e do DNA pela metodologia proposta por Giles e Myers18. Assim, para a determinação do DNA muscular foi preparado inicialmente o homogenato composto por 100 mg de músculo e 1 ml de HclO4, misturando-se em seguida o homogenato com solução de difenilamina e HclO4, seguido de agitação e banho-maria a 30°C durante 12 horas; após esse período foi realizada leitura espectrofotométrica a 595 nm; os valores estão expressos em mg/100mg.
Os valores estão representados pelas médias ± erro padrão (média±ep). Na análise estatística foi utilizado o teste de normalidade de Kolmogorov-Smirnov, seguido da análise de variância ANOVA e teste de Tukey, com nível de significância de 5% (p<0,05).
RESULTADOS
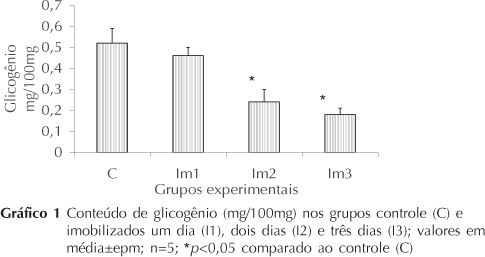
Em relação às reservas glicogênicas (Gráfico 1), a imobilização não provocou alterações significativas nas primeira 24 horas, sendo observados os seguintes valores: C, 0,52±0,07 e Im1, 0,46±0,04 mg/100mg (p>0,05). Por outro lado, houve redução significativa progressiva no segundo e terceiro dias, de 53% no grupo imobilizado 2 dias (C, 0,52±0,07 e Im2, 0,24±0,06 mg/100mg, p<0,05) e 65% no grupo imobilizado 3 dias (C, 0,52±0,07 e Im3, 0,18±0,03 mg/100mg, p<0,05).
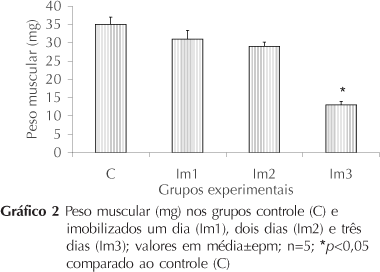
A avaliação do peso muscular revelou diferença significativa apenas no terceiro dia de desuso, quando foi observada redução de 28,57% (C, 35±2 e Im3, 25±1 mg, p<0,05 - Gráfico 2). O Gráfico 3 ilustra o índice de hidratação, observando-se aumento de 6,44% no segundo dia (C, 71,42±0,42 e Im2, 76,02±1%, p<0,05); de 8,58% no terceiro dia (C, 71,42±0,35 e Im3, 77,55±0,38%, p<0,05).
A avaliação das concentrações de DNA (Gráfico 4) mostra elevação de 43,18% (C, 0,044±0,0017 e Im1, 0,063±0,0061 mg/100mg, p<0,05) no primeiro dia; de 59,09% no segundo dia (C, 0,44±0,0017 e Im2, 0,070±0,0047 mg/100mg, p<0,05); e 75% no terceiro dia (C, 0,044±0,0017 e Im3, 0,077±0,011 mg/100mg, p<0,05).
Quanto ao conteúdo de proteínas totais, foi observada no primeiro dia elevação de 45,90% (C, 5,058±0,26 e Im1, 7,38±0,27 mg/100mg, p<0,05); de 32,25%, no segundo (C, 5,58±0,26 e Im2, 7,38±0,78 mg/100mg, p<0,05); e de 58,95% no terceiro dia (C, 5,058±0,26 e Im3, 8,04±0,7 mg/100mg, p<0,05), como mostra o Gráfico 5.
DISCUSSÃO
Desde a década de 1970, não se obtém um consenso frente às alterações histo-quimiofisiológicas induzidas pelo desuso muscular, sendo observados resultados contraditórios, que descrevem graus diferenciados de susceptibilidade à atrofia e relações funcionais diferenciadas de acordo com o tipo da fibra muscular e o local em que esta se encontra19-22.
Alguns estudos sugeriram que as alterações mais evidentes da atrofia ocorrem nos dias iniciais do desuso, indicando a possibilidade de haver certa temporização nas alterações da homeostasia das fibras musculares quando submetidas à imobilização23,24. Nesse sentido, entende-se que os maiores comprometimentos homeostásicos ocorram na fase inicial do desuso, de modo que, à medida que a situação de desuso torna-se crônica, o declínio das funções metabólicas ocorre de forma mais rápida25, como evidenciado em trabalho recente26.
No presente estudo iniciou-se avaliando o conteúdo glicogênico muscular, uma vez que esta reserva é marcadora tanto das condições energéticas quanto da condição de performance do músculo esquelético27. Ao avaliar as reservas de glicogênio, observa-se que, no primeiro dia de desuso, não houve alteração significativa; mas na progressão da análise, observou-se redução no conteúdo, que foi intensificada no segundo e terceiro dias.
O músculo sóleo é composto por 84% de fibras tipo I. Por essa razão, a redução no conteúdo glicogênico pode dever-se ao fato de os músculos vermelhos apresentarem uma maior população de receptores de insulina; dessa maneira, esse trabalho ratifica estudos que sugerem que, entre a terceira e oitava hora após a imobilização, já há significante redução na população dos receptores insulínicos, comprometendo a cascata sinalizadora da insulina, principalmente no que se refere às vias citosólicas ligadas à síntese de glicogênio, predispondo ao quadro de resistência à insulina e concomitante redução nas reservas glicogênicas28-30.
Quanto ao comportamento do peso muscular, foi observado que somente no terceiro dia de imobilização o peso mostrou-se reduzido, fato que pode ter relações com a redução na síntese proteica simultânea à elevação na proteólise26,31-33.
Optou-se por também avaliar o índice de hidratação, sendo verificado que no segundo e terceiro dia da imobilização a hidratação foi significativamente maior. Esse aumento da hidratação pode ser reflexo da liberação local de substâncias vasoativas na tentativa de melhorar a perfusão tecidual e assim modificar o padrão de oferecimento de substratos ou oxigênio34. Assim, a redução no peso observado no terceiro dia de desuso é resultante de um processo de proteólise que ocorre simultaneamente à elevação no índice de hidratação.
Após evidenciar a perda de massa muscular, avaliou-se a concentração de DNA e proteína total, sendo observado que os músculos apresentaram elevação progressiva nas concentrações. Alguns pontos a esse respeito merecem destaque, como por exemplo o fato de que as medidas de proteína e DNA têm sido muito utilizadas em diferentes estudos para indicar tamanho e número de células em um tecido35.
O desenvolvimento de hipotrofia observado nos resultados tem relação direta com o balanço entre a taxa de síntese e degradação das proteínas36. Por outro lado, por haver elevação no índice de hidratação, é sugestivo o fato de neste estudo ter se verificado comprometimento de outros sistemas ativados, concomitante à elevação na permeabilidade capilar, como por exemplo a elevação no extravasamento de proteínas plasmáticas. Levanta-se aqui uma hipótese explicativa. De acordo com observações de Durigan37, o modelo de órtese aqui utilizado geraria redução na deambulação logo no primeiro dia do desuso. Assim, sincronicamente à imobilização também ocorre edema leve, contribuindo ainda mais para a redução na movimentação exploratória. Possivelmente, os resultados da mensuração da concentração de DNA e proteínas totais podem representar um somatório do conteúdo pertencente às fibras musculares in situ e do proveniente de outros fatores decorrentes do maior índice de hidratação, como um possível infiltrado de células do sistema imunológico e/ou de outras estruturas.
CONCLUSÃO
Durante a imobilização, uma diversidade de fatores compromete a homeostasia do tecido muscular desencadeando hipotrofia. Tais fatores são ativados logo nos primeiros três dias do desuso.
Apresentação set. 2007
Aceito para publicação jun. 2008
Este estudo contou com apoio financeiro da Capes - Coordenação de Aperfeiçoamento de Pessoal de Nível Superior.
Estudo desenvolvido no Programa de Pós-Graduação em Fisioterapia da Unimep - Universidade Metodista de Piracicaba, Piracicaba, SP, Brasil
- 1 Reardon KA, Fracp BS, Davis J, Kapsa RMI, Choong P, Fracs MD, et al. Myostatin, insulin-like growth factor-1, and leukemia inhibitory factor are up-regulated in chronic human disuse muscle atrophy. Muscle Nerve. 2001;24:893-9.
- 2 Castro MJ, Apple DF, Staron RS, Campos GE, Dudley GA. Influence of complete spinal cord injury on skeletal muscle within 6 mo of injury. J Appl Physiol. 1999;86:350-8.
- 3 Talmadge RJ. Mechanical properties of rat soleus after long-term spinal cord transection. J Appl Physiol. 2002;93(4):1487-97.
- 4 Caiozzo VJ, Haddad F, Baker MJ, Henrrick RE, Pritto N, Baldwin KM. Microgravity-induced transformations of myosin isoforms and contractile properties of skeletal muscle. J Appl Physiol. 1996;81(1):123-32.
- 5 Kasper CE, Talbot LA, Gaines JM. Skeletal muscle damage and recovery. AACN Clin Issues. 2002;13(2):237-47.
- 6 Tanaka T, Kariya Y, Hoshino Y. Histochemical study on the changes in muscle fibers in relation to the effects of aging on recovery from muscular atrophy caused by disuse in rats. J Orthop Sci. 2004;9:76-85.
- 7 Smith HK, Maxwell L, Martyn JA, Bass JJ. Nuclear DNA fragmentation and morphological alterations in adult rabbit skeletal muscle after short-term immobilization. Cell Tissue Res. 2000;302(2):235-41.
- 8 Lu DX, Huang SK, Carlson BM. Electron microscopic study of long-term denervated rat skeletal muscle. Anat Rec. 1997;248(3):355-65.
- 9 Hilder TL, Tou JC, Grindeland RE, Wade CE, Graves LM. Phosphorylation of insulin receptor substrate-1 serine 307 correlates with JNK activity in atrophic skeletal muscle. FEBS Lett. 2003;553:63-7.
- 10 Ohira Y, Yoshinaga T, Ohara M, Nonaka I, Yoshioka T, Yamashita-Goto K, Shenkman BS, et al. Myonuclear domain and myosin phenotype in human soleus after bed rest with or without loading. J Appl Physiol. 1999;87(5):1776-85.
- 11 Veldhuizen JW, Yerstappen FT, Yroemen JP, Kuipers H, Greep JM. Functional and morphological adaptations following four weeks of knee immobilization. Int J Sports Med. 1993;14(5):291-2.
- 12 Chakravarthy MV, Abraha TW, Schwartz RJ, Fiorotto ML, Booth FW. Insulin-like growth factor-I extend in vitro replicative life span of skeletal muscle satellite cells by enhancing G1/S cell cycle progression via the activation of phosphatidylinositol 3'-kinase/Akt signaling pathway. J Biol Chem. 2000;275(46):35942-52.
- 13 Kano Y, Shimegi S, Takahashi H, Masuda K, Katsuta S. Changes in capulary luminal diameter in rat soleus muscle after hind-limb suspension. Acta Physiol Scand 2000;169(4):271-76.
- 14 Edgerton VR, Roy RR, Allen DL, Monti RJ. Adaptations in skeletal muscle disuse or decreased-use atrophy. Am J Phys Med Rehabil. 2002;81(11):127-47.
- 15 Morris RT, Spangenburg EE, Booth F. Responsiveness of cell signaling pathways during the failed 15-day regrowth of aged skeletal muscle. J Appl Physiol. 2004;96:337-404.
- 16 Silva CA, Guirro RRJ, Polacow MLO, Cancelliero KM, Durigan JLQ. Proposal for rat hindlimb joint immobilization: orthosis with acrylic resin model. Braz J Med Biol Res. 2006;39:979-85.
- 17 Siu LO, Russeau JC, Taylor AW. Determination of glycogen in small tissue samples. J Appl Physiol. 1970;28(2):234-6.
- 18 Giles KW, Myers A. An improved diphenylamine method for the estimation of deoxyribonucleic acid. Nature. 1965;206:4979-93.
- 19 Edgerton VR, Barnard RJ, Peter JB, Maier A, Simpson DR. Properties of immobilized hind-limb muscle of the galago senegalensis. Exp Neurol. 1975;46:115-31.
- 20 Mc Conell GK, Kingwell BA. Does nitric oxide regulate skeletal muscle glucose uptake during exercise? Exerc Sport Sci Rev. 2006;34(1):36-41.
- 21 Zhong H, Roy RR, Woo J, Kim JA, Edgerton VR. Differential modulation of myosin heavy chain phenotype in an inactive extensor and flexor muscle of adult rats. J Anat. 2007;210:19-31.
- 22 Yu ZB, Gao FG, Feng HZ, Jin JP. Unloading underlying the contractility changes in skeletal muscle: differential regulation of myofilament protein isoforms. Am J Physiol Cell Physiol. 2007;292:1192-203.
- 23 Appell HJ. Skeletal muscle atrophy during immobilization Int J Sports Med. 1986;7:1-5.
- 24 Haddad F, Roy RR, Zhong H, Edgerton VR, Baldwin KM. Atrophy responses to muscule inactivite, II: molecular markers of protein deficits. J Appl Physiol. 2003;95(2):791-802.
- 25 Appell HJ. Muscular atrophy following immobilization: a review. Sports Med. 1990;10(1):42-58.
- 26 Kim JW, Kwon OY, Kim MH.Differentially expressed genes and morphological changes during lengthened immobilization in rat soleus muscle. Diferentiation. 2007;75(2):147-57.
- 27 Sesti G. Pathophysiology of insulin resistance. Best Pract Res Clin Endocrinol Metab. 2006;20(4):665-79.
- 28 Nicholson WF, Watson PA. Glucose uptake and glycogen synthesis in muscles from immobilized limbs. J Appl Physiol. 1984;56:431-5.
- 29 Hirose M, Kaneki M, Sugita H, Yasuhara S, Martyn JA. Immobilization depresses insulin signaling in skeletal muscle. Am J Physiol Endocrinol Metab. 2000;279(6):E1235-41.
- 30 Zhang P, Chen X, Fan M. Signaling mechanisms involved in disuse muscle atrophy. Med Hypotheses. 2007;69(2):310-21.
- 31 Goldspink DF, Morton AJ, Loughna P, Goldospink G. The effect of hypokinesia and hypodynamia on protein turnover and the growth of four skeletal muscle. Pflugers Arch. 1986;407:333-40.
- 32 Jasper SR, Tischer ME. Role of glucocorticoids in the responses of rat leg muscles to reduced activity. Muscle Nerve. 1986;9:554-61.
- 33 Di Prampero PE, Narici MV. Muscles in microgravity: from fibres to human motion. J Biomech. 2003;36(3):403-12.
- 34 Yoshida, WB. Angiogênese, arteriogênese e vasculogênese: tratamento do futuro para isquemia crítica do membro. J Vasc Br. 2005;4(4):316-8.
- 35 Luciano E, Mello, MAR. Efeitos do exercício físico crônico sobre as proteínas no diafragma de ratos diabéticos. Motriz. 1999;5(2):146-51.
- 36 Kimball SR, Vary TC, Jefferson LS. Regulation of protein synthesis by insulin. Annu Rev Physiol. 1994;56:321-48.
- 37 Durigan JLQ. Estudo morfométrico do músculo sóleo de ratos submetidos à imobilização associada à estimulação elétrica neuromuscular [dissertação]. Piracicaba: Faculdade de Ciências da Saúde, Universidade Metodista de Piracicaba; 2006.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
15 Maio 2012 -
Data do Fascículo
2008
Histórico
-
Aceito
Jun 2008 -
Recebido
Set 2007