Resumos
FUNDAMENTO: Os portadores de resistência à insulina apresentam maior predisposição para desenvolver posteriormente Síndrome Metabólica (SM), Diabetes Mellitus tipo 2 e Doença Cardiovascular (DCV). OBJETIVO: Avaliar a associação entre resistência insulínica (RI) e os componentes da síndrome metabólica. MÉTODOS: Estudo transversal envolvendo 196 indivíduos entre 2 e 18 anos, usuários do sistema único de saúde. A associação da RI com os componentes da SM foi avaliada pelo teste do qui-quadrado, adotando-se o valor do índice da homeostase glicêmica (HOMA-RI) > 2,5, e pelo teste de variância (ANOVA) e Tukey, por meio da comparação das médias dos componentes nos quartis do HOMA-RI. A análise estatística foi realizada através do SPSS 17.0, com a adoção do nível de significância de 5%. RESULTADOS: RI foi observada em 41,3% da população estudada e esteve associada à faixa etária entre 10-18 anos (p = 0,002 RP = 3,2), à SM em ambos os sexos [Masculino (p = 0,022 RP = 3,7) e Feminino (p = 0,007 RP = 2,7)] e ao triglicerídeo alterado (p = 0,005 RP = 2,9) no sexo feminino. Os valores médios dos componentes da SM diferiram significativamente entre os quartis do HOMA-RI (p < 0,01), com exceção do HDL-colesterol. CONCLUSÃO: A resistência insulínica pode ser considerada um marcador de risco cardiovascular.
Resistência à Insulina; síndrome metabólica; sobrepeso; obesidade; índice de massa corporal
BACKGROUND: Individuals with insulin resistance are more prone to the development of metabolic syndrome (MS), Type 2 Diabetes Mellitus and Cardiovascular Disease (CVD) OBJECTIVE: To evaluate the association between insulin resistance (IR) and metabolic syndrome components. METHODS: Cross-sectional study of 196 individuals between 2 and 18 years, treated at the Brazilian Public Healthcare system. The association of IR with the MS components was evaluated by Chi-square test, adopting the Homeostasis model assessment-insulin resistance (HOMA-IR) value > 2.5, and by analysis of variance (ANOVA) and Tukey's test, by comparing the means of the components in the HOMA-IR quartiles. Statistical analysis was performed using SPSS 17.0 software and significance level was set at 5%. RESULTS: IR was observed in 41.3% of the studied population and was associated with age between 10-18 years (p = 0.002 PR = 3.2), to MS in both sexes [Male (p = 0.022 PR = 3.7) and female (p = 0.007 PR = 2.7)] and altered triglycerides (p = 0.005 PR = 2.9) in females. The mean values of the MS components differed significantly between HOMA-IR quartiles (p <0.01), except for HDL-cholesterol. CONCLUSION: Insulin resistance can be considered a marker of cardiovascular risk.
Insulin ressitance; metabolic syndrome; obesity; body mass index
Resistência insulínica e sua relação com os componentes da síndrome metabólica
Carla Campos Muniz Medeiros; Alessandra Teixeira Ramos; Maria Aparecida Alves Cardoso; Inácia Sátiro Xavier França; Anajás da Silva Cardoso; Nathalia Costa Gonzaga
Universidade Estadual da Paraíba (UEPB)/Núcleo de Estudos e Pesquisas Epidemiológicas (NEPE) - Campina Grande - PB, Brasil
Correspondência Correspondência: Anajás da Silva Cardoso Rua Baraúnas, 351 - Bairro Universitário - Prédio dos Mestrados 58429-500 - Campina Grande-PB, Brasil E-mail: jajas-cardoso@hotmail.com, anajascardoso@gmail.com
RESUMO
FUNDAMENTO: Os portadores de resistência à insulina apresentam maior predisposição para desenvolver posteriormente Síndrome Metabólica (SM), Diabetes Mellitus tipo 2 e Doença Cardiovascular (DCV).
OBJETIVO: Avaliar a associação entre resistência insulínica (RI) e os componentes da síndrome metabólica.
MÉTODOS: Estudo transversal envolvendo 196 indivíduos entre 2 e 18 anos, usuários do sistema único de saúde. A associação da RI com os componentes da SM foi avaliada pelo teste do qui-quadrado, adotando-se o valor do índice da homeostase glicêmica (HOMA-RI) > 2,5, e pelo teste de variância (ANOVA) e Tukey, por meio da comparação das médias dos componentes nos quartis do HOMA-RI. A análise estatística foi realizada através do SPSS 17.0, com a adoção do nível de significância de 5%.
RESULTADOS: RI foi observada em 41,3% da população estudada e esteve associada à faixa etária entre 10-18 anos (p = 0,002 RP = 3,2), à SM em ambos os sexos [Masculino (p = 0,022 RP = 3,7) e Feminino (p = 0,007 RP = 2,7)] e ao triglicerídeo alterado (p = 0,005 RP = 2,9) no sexo feminino. Os valores médios dos componentes da SM diferiram significativamente entre os quartis do HOMA-RI (p < 0,01), com exceção do HDL-colesterol.
CONCLUSÃO: A resistência insulínica pode ser considerada um marcador de risco cardiovascular.
Palavras-chave: Resistência à Insulina/fisiologia, síndrome metabólica/diagnóstico, sobrepeso, obesidade, índice de massa corporal.
Introdução
Na infância e na adolescência, a obesidade é reconhecida pela Organização Mundial de Saúde (OMS) como um problema de saúde pública. Mudanças no estilo de vida desencadeado pela evolução técnico-científica têm sido apontadas como um dos fatores determinantes dessa condição1.
A obesidade está associada a várias doenças crônicas, dentre as quais se destaca a Síndrome Metabólica (SM), presente já em fases iniciais da vida. Esse fato tem condicionado o desenvolvimento de doenças cardiovasculares mais precocemente2.
No Brasil, a prevalência da SM varia de 1,1%3 na população de adolescentes estudantes de escola pública, 6% em adolescentes com história familiar de diabetes tipo 2 e 26,1% em crianças e adolescentes obesos4.
Entre as alterações associadas à obesidade que contribuem para o aumento da prevalência da SM, a Resistência Insulínica (RI) tem-se destacado5. Estudos verificaram que os portadores de resistência à insulina apresentam maior predisposição para desenvolver posteriormente SM, Diabetes Mellitus tipo 2 (DM tipo 2) e Doença cardiovascular (DCV)6,7.
A resistência insulínica é definida como a ineficiência da insulina plasmática, em concentrações usuais, na promoção adequada de captação periférica de glicose, suprimir a gliconeogênese hepática e inibir a produção de lipoproteína de muito baixa densidade8.
O Colégio Americano de Endocrinologia9 considera presença de triglicerídeos elevados, HDL-c reduzido, pressão arterial aumentada e glicemia de jejum ou pós-prandial elevada como "anormalidades identificadoras" de possíveis portadores de RI. Sinakio e cols.10 encontraram forte correlação entre resistência insulínica, colesterol HDL (HDL-c), triglicerídeos (TG) e pressão arterial sistólica em indivíduos entre 13 a 23 anos.
Na faixa etária pediátrica, a obesidade parece ser importante gatilho de resistência insulínica11, o que torna as crianças obesas um grupo de risco. A despeito disso, não existe consenso para a definição da síndrome metabólica em crianças. Uma revisão recente sobre o tema encontrou 40 diferentes definições adaptadas a partir daquelas propostas para adultos12.
Dessa forma o presente estudo tem por finalidade verificar a associação existente entre resistência insulínica e os demais componentes da SM em crianças e adolescentes com diagnóstico de sobrepeso e obesidade.
Procedimentos metodológicos
Este estudo transversal foi realizado entre abril/2009 e abril/2010, como parte de um projeto maior intitulado: "Prevalência de fatores de risco cardiometabólico entre crianças e adolescentes obesos ou com sobrepeso".
Incluíram-se crianças e adolescentes entre 2 e 18 anos, usuários do Sistema Único de Saúde (SUS), do município de Campina Grande-PB. A captação foi realizada através da divulgação da pesquisa nas Unidades Básicas de Saúde, pela Secretaria de Saúde do município. Os indivíduos eram encaminhados pelas equipes de saúde ao Centro de Obesidade Infantil (COI), implantado no Instituto de Saúde Elpídio de Almeida (ISEA), em Campina Grande-PB, especificamente para atender à demanda deste estudo. O COI é formado por pesquisadores e equipe multidisciplinar, composta por endocrinologista, nutricionista, psicóloga, enfermeira, assistente social e preparador físico.
A população infanto-juvenil do município de Campina Grande, cadastrada em dezembro de 2008 no sistema de informação de atenção básica (SIAB), era de 65.890 crianças e adolescentes entre 1 e 19 anos13. Para cálculo da amostra, considerou-se inicialmente a prevalência de sobrepeso e obesidade de 25%4 e, posteriormente, a de SM de 42% em crianças e adolescentes brasileiras com essa condição14, perfazendo um total de 194 crianças e adolescentes, após acréscimo de 20% de eventuais perdas.
Seguindo as diretrizes éticas, após o esclarecimento dos objetivos e métodos a serem seguidos, os pais ou responsáveis pelas crianças e adolescentes que concordaram em participar assinaram o Termo de Consentimento Livre e Esclarecido.
No primeiro encontro, realizou-se uma triagem para se avaliar se os indivíduos encaminhados atendiam aos critérios de inclusão do estudo. Do total de 200 casos, foram excluídos aqueles que, no momento da coleta de dados, fossem portadores de alguma doença ou que estivessem em uso de medicação que interferisse no metabolismo glicídico ou lipídico. Foram registradas duas perdas por não comparecimento à coleta sanguínea e duas exclusões por uso de corticoide, perfazendo, no final, um total de 196 indivíduos acompanhados. Nessa ocasião, aplicou-se o primeiro questionário, que abordava questões socioeconômicas, de história pessoal e familiar; aferidas as medidas antropométricas e agendados os exames laboratoriais para determinação do perfil lipídico, estes foram realizados em até 15 dias após a entrevista.
Os dados antropométricos (peso, estatura e circunferência abdominal) foram coletados em duplicata, sendo considerado o valor médio das duas aferições. Para obtenção do peso, utilizou-se uma balança digital tipo plataforma da marca Welmy® com capacidade para 150 kg e precisão de 0,1 kg. A altura foi aferida por meio de um estadiômetro da marca Tonelli® com precisão de 0,1 cm. Durante a aferição, o indivíduo estava vestindo roupas leves e foram seguidos os procedimentos recomendados pela OMS15.
Para a classificação do estado nutricional, calculou-se o índice de massa corpórea (IMC) conforme as recomendações do Centers of Disease Control and Prevention (CDC)16, trabalhando-se com as seguintes categorias: sobrepeso (85 > IMC < 95), obesidade (percentil 95 > IMC < 97) e obesidade grave (IMC > percentil 97).
A circunferência abdominal foi avaliada com fita métrica inelástica da marca Cardiomed®, com precisão de 0,1 cm, no ponto médio entre a borda superior da crista ilíaca e o último rebordo costal, com o paciente de pé, sem roupa, com os braços posicionados ao longo do corpo e na fase expiratória da respiração. Foram considerados aumentados os valores acima do percentil 90, porém com limite máximo de 88 cm para meninas e 102 cm para os meninos17,18.
A coleta sanguínea foi realizada após jejum de 10 a 12 horas, no Laboratório de Análises Clínicas da Universidade Estadual da Paraíba (LAC/UEPB).
Colesterol total, HDL-c, triglicerídeos e glicemia foram avaliados pelo método colorimétrico enzimático, em equipamento automático (Modelo BioSystems 310), de acordo com as recomendações do fabricante do kit Labtest®, no LAC/UEPB, e a insulina foi mensurada através do método de radioimunoensaio INSULIN-CT da CIS Bio International®, utilizando-se contador gama Abbott® (coeficiente de variação intraensaio 2,6%) em um laboratório terceirizado com selo de qualidade.
Para avaliação da resistência insulínica, utilizou-se o índice HOMA-RI, descrito por Mattews e cols.19 e validado por diversos autores para estudos epidemiológicos, que é o produto da insulina de jejum (µUI/mL) e da glicemia de jejum (mmol/L) dividido por 22,520. Como ponto de corte, utilizou-se HOMA-RI > 2,58,21.
O diagnóstico de SM foi realizado através dos critérios recomendados pela National Cholesterol Education Program/Adult Treatment Panel III (NCEP/ATPIII), adaptados para a faixa etária que considera a presença de pelo menos três dos seguintes itens: CA acima ou no percentil 90 para sexo, idade e raça; Triglicerídeos > 100 mg/dL e/ou HDL-c < 45 mg/dL, glicemia de jejum > 100mg/dL, pressão sistólica e/ou diastólica acima do percentil 90 para sexo, estatura e idade. Os pontos de corte para TG, HDL-c e glicemia de jejum seguiram os valores recomendados na I Diretriz de Aterosclerose na infância22,23.
Os dados foram apresentados através de proporções, médias ± desvios-padrão (DP). A comparação da resistência insulínica entre os grupos foi realizada pelo teste de qui-quadrado ou Fisher. Para avaliação do grau de resistência e sua relação com os componentes da SM, o HOMA-RI foi distribuído em quartis, em quatro categorias de acordo com os percentis: < 25, 25-49, 9, 50-74,9 e > 75 e comparado o valor médio de cada componente da SM de acordo com os quartis por meio da análise de variância (ANOVA) e do teste Pos Hoc de Tukey.
As análises foram realizadas com a versão 17.0 do SPSS (SPSS Inc, Chicago, EUA) e foi considerado o nível de significância de 5%.
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa da Universidade Estadual da Paraíba, sob o número de processo nº 0040.0.133.000-08.
Resultados
Das 196 crianças e adolescentes avaliados, a maioria (64,8%) era do sexo feminino. A média da idade foi 11,1+/- 3,8 anos. De acordo com a faixa etária, 9,7% eram pré-escolares, 26,5% escolares e 63,8% adolescentes. Quanto ao estado nutricional, 15,8% apresentaram sobrepeso; 18,9%, obesidade; e 65,3%, obesidade acentuada.
A síndrome metabólica foi diagnosticada em 59,7% dos avaliados; desses, 39,8% tinham três componentes; 19,4%, quatro; e 0,5%, cinco. As alterações mais frequentes foram HDL-c baixo, 80,6%; CA alterada, 79,6%; hipertensão, 69,4%; hipertrigliceridemia, 36,7%, e glicemia elevada, 1% (Tabela 1).
A resistência insulínica foi observada em 41,3% da população estudada e sua presença esteve associada à faixa etária entre 10-18 anos (p = 0,000) (Tabela 1).
Na Tabela 2, verifica-se associação significativa do TG alterado (p = 0,005) e diagnóstico da SM (p = 0,007) com RI no sexo feminino; e SM e presença de RI (p = 0,022) no masculino. A chance de o sexo feminino na presença de RI ter triglicerídeos alterados é de 2,9 (1,3-6,1) vezes e SM 2,7 (1,3-5,7). Já o sexo masculino apresenta 3,7 (1,2-11,5) mais chances de ter SM cursando com RI.
Não se observou associação entre presença de RI com SM ou seus componentes na faixa etária entre 2-5 anos. Já nos adolescentes (10 a 18 anos), a presença de RI esteve associada a alteração no TG, HDL-c e SM (Tabela 3). A chance de um adolescente na presença de RI ter os triglicerídeos alterados é de 3,4 (1,6-7,4); HDL, 3 vezes (1,1-7,5); e SM, 3,2 (1,5-6,7).
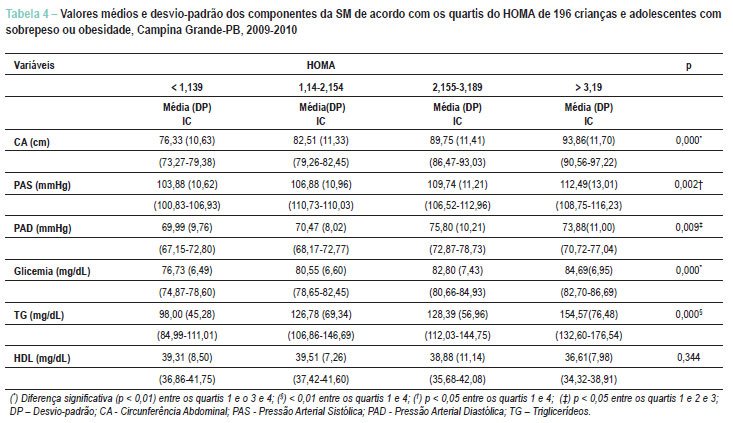
Os valores médios dos componentes da SM comportam-se de maneira diferente de acordo com o quartil do HOMA-RI. Observa-se que praticamente todos os componentes da SM aumentaram suas médias à medida que os valores ou o percentil do HOMA-RI se elevaram (Tabela 4). Não se observou variação de HDL-c de acordo com o quartil.
Houve diferença estatisticamente significativa entre o núm ero de componentes e os valores médios do HOMA-RI (p = 0,008), sendo essa diferença observada no grupo com um e dois componentes em relação àquele com quatro componentes (p < 0,05).
O valor médio do HOMA-RI na população estudada foi de 2,4 (± 1,55). Naqueles que tinham três componentes, diagnóstico de SM, o valor médio foi de 2,5 (± 1,71) (Figura 1).
Houve variação do valor médio do HOMA-RI de acordo com o número de componentes da SM. Observou-se diferença estatisticamente significativa entre o valor médio dos que apresentavam um ou dois componentes e o daqueles com quatro componentes (p < 0,05).
Discussão
A detecção precoce de crianças e adolescentes com SM é importante para a estratificação do risco global de um indivíduo em relação a futuros eventos cardiovasculares. Nesse sentido, é importante conhecer os fatores de risco que apontam sua presença ou a probabilidade maior de seu acontecimento, como a presença de RI, uma vez que esta é forte preditor para o desenvolvimento de SM e, conseqüentemente, das DCV23.
O presente estudo mostrou que a maioria das crianças e dos adolescentes obesos ou com sobrepeso avaliados já apresenta SM (59,7%) e que 41,3% cursavam com RI.
Estudos que associaram RI com a presença de SM e seus componentes na infância, como, por exemplo, o realizado por Ferreira e cols.2, com 52 crianças obesas, entre 7 e 10 anos, encontraram prevalência de síndrome metabólica de 17,3%. Ao analisarem a média do HOMA-RI por tercil, também verificaram que a ocorrência simultânea dos fatores de risco determinantes da SM está fortemente associada à resistência à insulina, medida por meio do modelo de avaliação da homeostase glicêmica (HOMA-RI).
A prevalência de SM e RI observada no presente estudo mostrou-se superior à encontrada por Cárceres e cols.15, que avaliaram 61 crianças e adolescentes obesos bolivianos entre 5 e 18 anos, e encontraram que 36% tinham SM e 39,4%, RI, e, por Souza e cols.24, em um estudo envolvendo 84 adolescentes obesos ou com sobrepeso entre 10 e 19 anos em São Paulo, que verificaram prevalência de SM de 40% e de RI em 57% dos indivíduos; López e cols.25, avaliando 466 adolescentes obesos mexicanos, verificaram prevalência semelhante de RI (51%), mas menor de SM (20%).
Não há um consenso na faixa etária pediátrica para diagnóstico de SM, nem um ponto de corte para seus componentes. Além disso, o comportamento de cada componente e sua relação entre eles variam de acordo com a etnia. Em afro-americanos, apesar de o aumento da circunferência abdominal estar relacionado a um aumento mais rápido dos fatores cardiovasculares do que os hispânicos e caucasianos, a relação entre a resistência insulínica e a triglicerídeos é inversa, ou seja, à medida que a resistência insulínica aumenta, os triglicerídeos diminuem26.
A diferença observada entre as prevalências de RI nos estudos supracitados se deve à faixa etária avaliada, visto que adolescentes são mais insulino-resistentes quando comparados a crianças. Na estratificação por faixa etária, observou-se que o grupo dos adolescentes apresentou 53,6% de RI, enquanto o das crianças, 19,7%. Além disso, é importante ressaltar que os diferentes critérios diagnósticos de SM dificultam a comparação de prevalências e que, apesar disso, os resultados encontrados já se mostram elevados em crianças e adolescentes.
Não houve diferença na distribuição dos componentes da SM em relação à idade e ao sexo, porém a presença de resistência insulínica esteve associada aos adolescentes, possivelmente porque as mudanças hormonais da puberdade contribuem para a exacerbação da doença27.
Há evidências de que a resistência insulínica varia de acordo com o estágio puberal: aumenta significativamente entre os estágios 1 e 2 de Tanner; permanece estável nos estágios 2, 3 e 4; e cai significativamente no estágio 528. Dessa forma, as diferenças observadas em relação a sexo e faixa etária podem ser justificadas pela influência da maturação sexual nos valores de RI e no desenvolvimento dos componentes da SM29,30.
Hiperinsulinemia é considerada fator de risco independente para a doença cardiovascular, uma vez que desempenha importante papel no desenvolvimento de outros componentes da síndrome metabólica, como dislipidemia, hipertensão e hiperurecemia. Bao e cols.31, avaliando no longo prazo os níveis de insulina plasmática em crianças (5 a 9 anos) e em adultos jovens (17 a 23 anos) da população do Bogalusa Heart Study, observaram que, após 8 anos, nos indivíduos que apresentavam níveis de insulina persistentemente elevados, os casos de hipertensão e dislipidemia foram de 2,5 a 3 vezes maiores, respectivamente.
Quando avaliada a presença dos componentes da SM de acordo com a presença de resistência insulínica, sexo ou faixa etária, observou-se que, na presença de RI, as meninas apresentavam um risco 2,9 vezes maior que os meninos de ter TG elevado e os adolescentes de 3 e 3,4 vezes maior que as crianças de ter TG e HDL-c alterados. A insulina tem várias ações na regulação do metabolismo lipídico, como, por exemplo, a regulação da síntese de triglicerídeos pelos adipócitos e a participação na captação de ácidos graxos provenientes de lipoproteínas circulantes, fato não observado em indivíduos obesos, devido às freqüentes alterações que ocorrem na atuação de determinadas enzimas e no metabolismo lipídico em função da RI17.
A RI intensifica a oxidação dos ácidos graxos livres (AGL) no soro, fornece substrato para a síntese de TG no fígado e aumenta a liberação hepática de very low density lipoprotein (LDL), rica em TG, para o soro, aumentando, dessa forma, seus valores32.
Em condições normais, a insulina tem várias ações na regulação do metabolismo lipídico; no entanto, nos indivíduos obesos esse quadro não é observado, em razão das frequentes alterações que ocorrem na atuação de determinadas enzimas e no metabolismo lipídico, devido à resistência à insulina. As principais alterações do perfil lipídico são: níveis aumentados de VLDL-c, devido à maior produção de triglicerídeos pelo fígado e ao menor catabolismo; redução dos níveis e do tamanho de HDL-C, relacionada à diminuição da subfração HDL-c e ao maior catabolismo decorrente da maior concentração de triglicerídeos nessas partículas e partículas de LDL-c menores e mais densas, mais ricas em apolipoproteína B33.
No presente estudo, observou-se que a RI esteve associada à SM em ambos os sexos e na faixa etária entre 10 a 18 anos. A associação da RI com a faixa etária pode dever-se a uma redução fisiológica na sensibilidade à insulina, que é compensada pelo aumento em sua secreção, fato observado em adolescentes34.
O valor médio do HOMA-RI foi de 2,4, menor do que o encontrado por Ferrreira e cols.2 (3,2 +/- 1,9) em 52 obesas entre 7 a 10 anos. Por outro lado, estudo realizado na Argentina verificou um HOMA-RI entre crianças obesas de 2,76 e, nos Estados Unidos, variando de 3,12 entre as portadoras de sobrepeso a 8,69 entre as severamente obesas. Esse fato talvez se deva à interação entre fatores nutricionais, etnia e tempo de obesidade7.
Schmidt e cols.35 observaram que os valores encontrados no quintil mais elevado da RI apresentaram maiores valores de odds ratio para a síndrome metabólica (SM) quando havia agrupamento de duas, três e especialmente quatro ou mais dessas anormalidades metabólicas (hipertensão, diabetes, hipertrigliceridemia, HDL-colesterol baixo e TG elevado).
Os resultados do presente estudo também revelam que os valores mais elevados do HOMA- RI estavam associados à presença de maior número de componentes da SM e que os valores médios de cada componente aumentavam à medida que o percentil do HOMA-RI ascendia, fato também observado por Oliveira e cols.36, em cujo estudo realizado os valores de HOMA-RI se elevaram de zero a cinco componentes de SM e com maior significância entre indivíduos com dois e com três componentes isolados. Esse fato pode ser explicado pela produção e a secreção dos diversos fatores que se intensificam com a obesidade, como, por exemplo, o fator α de necrose tumoral (TNF-α), a resistina, o inibidor 1 de ativador de plasminogênio (PAI-1), a Interleucina-6 e a proteína 1 quimioatrativa de macrófagos (MCP-1), e estão diretamente associados à indução de resistência à insulina, à hipercoagulabilidade e à aterogênese, as quais, por sua vez, geram hipertensão e intensificação de estados pró-inflamatórios, que representam alguns dos critérios da SM e conduzem ao aumento do risco cardiovascular e acidentes tromboembólicos37.
Além disso, o excesso de AGL circulantes, resultante do processo de lipotoxicidade, é forte indutor de resistência periférica à ação da insulina, aumentando a probabilidade de desenvolvimento de DMT2 e de SM37.
A revelação de um crescimento da frequência de SM à medida que se elevam os valores de HOMA-RI, sobretudo de SM associada a componentes mais especificamente relacionados à RI, pode estar apontando para a possibilidade de utilização do índice como indicador da presença de RI associada à SM, o que poderia vir a favorecer a definição da abordagem terapêutica e, consequentemente, o prognóstico dos indivíduos acometidos, mais especificamente os não diabéticos36.
Verificou-se, ainda, que o valor médio do HOMA-RI para quem apresentava três componentes da SM foi igual a 2,5 ponto de corte utilizado no estudo para diagnóstico de RI, e que a média observada no grupo dos indivíduos que não tinham nenhum componente da SM (2,3), superior ao grupo com um componente, deve-se ao HOMA-RI igual a 5 apresentado por um dos avaliados que se enquadravam nesse grupo.
Assim, fica evidente que a prevalência de fatores de risco individuais para a SM aumenta em conjunto com o aumento dos valores da resistência à insulina28,38,39.
Alguns estudos apontam para a hipótese de que o impacto negativo do aumento da quantidade de tecido adiposo nos organismos sobre a sensibilidade à insulina pode ser claramente demonstrado na maioria dos indivíduos, assim como o aumento da sensibilidade à insulina observada com a redução do peso corporal e exercício físico40.
A despeito da falta de uma hipótese unânime sobre os caminhos fisiopatológicos que levam ao aparecimento da síndrome metabólica, sugere-se que os níveis de insulina plasmática, bem como a simples avaliação do IMC, são indicadores valiosos de distúrbios clínicos compatíveis com a SM em crianças40.
O fato de estarmos apresentando resultados de um estudo de delineamento transversal, que não permite a identificação da verdadeira relação de causalidade, uma vez que causa e efeito são medidos no mesmo instante, consiste em uma limitação do estudo. Há uma possibilidade de causalidade reversa, uma vez que indíviduos com RI tem maiores chances de desenvolver SM, porém não podemos afirmar que esse fato ocorre na população estudada. Um estudo longitudinal dessa população, excluindo-se os indivíduos com SM, e dividindo-os em grupos de acordo com a presença ou não de RI, permitiria a avaliação de seu efeito sobre a SM.
Apesar dessa limitação, os resultados indicam que um fator que deve ser monitorado em crianças e adolescentes obesos é o nível de resistência à insulina, pois, quanto maior o nível de resistência à insulina, maior a presença dos fatores de risco cardiovasculares, maior a prevalência de SM e, consequentemente, maior o risco de desenvolvimento prematuro de DMT2 e DCV.
Conclusões
Os resultados do presente estudo mostraram que a SM já é uma realidade para muitas crianças e adolescentes obesos. Observou-se também que, quanto maior o nível de resistência à insulina, maior o número de fatores cardiometabólicos presentes, o que revela uma predisposição para o desenvolvimento futuro de DMT2 e DCV. Dessa forma, os altos percentuais de RI associados aos componentes da SM nessa população alertam para a necessidade de se implementarem programas de prevenção, com a detecção e a intervenção precoce das complicações associadas à obesidade, em particular SM e RI, permitindo a redução do risco cardiovascular nessa população, que compõe parte significativa da população em geral. Esse fato evidencia a necessidade de se fortalecer o novo modelo de saúde, que preconiza proteção e promoção da saúde e prevenção de doenças, além de estimular a formulação de políticas intersetoriais capazes de favorecer a adesão a um estilo de vida mais saudável.
Artigo recebido em 02/02/11; revisado recebido em 11/04/11; aceito em 31/05/11.
- 1. World Health Organization. Obesity: preventing and managing the global epidemic. Geneva: WHO; 2004.
- 2. Ferreira AP, Oliveira CER, França MN. Metabolic syndrome and risk factors for cardiovascular disease in obese children: the relationship with insulin resistance (HOMA-IR). J Pediatr (Rio J). 2007;83(1):21-6.
- 3. Rodrigues AN, Perez AJ, Pires JG, Carletti L, Araújo MT, Moyses MR, et al. Cardiovascular risk factors, their associations and presence of metabolic syndrome in adolescents. J Pediatr (Rio J). 2009;85(1):55-60.
- 4. Silva RC, Miranda WL, Chacra AR, Dib AS. Metabolic syndrome and insulin resistance in normal glucose tolerant Brazilian adolescents with family history of type 2 diabetes. Diabetes Care. 2005;28(3):716-8.
- 5. Oliveira CL, Mello MT, Cintra IP, Fisberg M. Obesidade e síndrome metabólica na infância e adolescência. Rev Nutr. 2004;17(2):237-45.
- 6. Sung RY, Tong PC, Yu CW, Lau PW, Mok GT, Yam MC, et al. High prevalence of insulin resistance and metabolic syndrome in overweight / obese preadolescent Hong Kong Chinese children aged 9-12 years. Diabetes Care. 2003;26(1):250-1.
- 7. Weiss R, Dziura J, Burgert TS, Tamborlane W, Taksali SE, Yeckcel CW. Obesity and the metabolic syndrome in children and adolescents. N Engl J Med. 2004;350(23):2362-74.
- 8. Madeira IR, Carvalho CN, Gazolla FM, de Matos HJ, Borges MA, Bordallo MA. Ponto de corte do índice Homeostatic Model Assessment for Insulin Resistance (HOMA-IR) avaliado pela curva Receiver Operating Characteristic (ROC) na detecção de síndrome metabólica em crianças pré-púberes com excesso de peso. Arq Bras Endocrinol Metab. 2008;52(9):1466-73.
- 9. Einhorn D, Reaven GM, Cobin RH, Ford E, Ganda OP, Handelsman Y, et al. American College of Endocrinology position statement on the insulin resistance syndrome. Endocr Pract. 2003;9(3):237-52.
- 10. Sinaiko AR, Donahue RP, Jacobs DR Jr, Prineas RJ. Relation of weight and rate of increase in weight during childhood and adolescence to body size, blood pressure, fasting insulin, and lipids in young adults. The Minneapolis Children's Blood Pressure Study. Circulation. 1999;99(11):1471-6.
- 11. Ten S, Maclaren N. Insulin resistance syndrome in children. J Clin Endocrinol Metab. 2004;89(6):2526-39.
- 12. Ford ES, Li C. Defining the metabolic syndrome in children and adolescents: will the real definition please stand up? J Pediatr. 2008;152(2):160-4.
- 13. Ministério da Saúde. Sistema de Informação da Atenção Básica (SIAB), Brasilía, FNS: 2010. [Acesso em 2010 out 23]. Disponível em:<http://siab.datasus.gov.br
- 14. Buff CG, Ramos E, Souza FI, Sarni RO. Frequência de síndrome metabólica em crianças e adolescentes com sobrepeso e obesidade. Rev paul pediatr. 2007;25(3):221-6.
- 15. World Health Organization (WHO). Physical Status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. Technical Report Series nş 854. Geneva; 1995.
- 16. CDC Table for calculated body mass index values for selected highs and weights for ages 2 to 20 years. [Acesso em 2010 out 23]. Disponível em: http://www.cdc.gov/growthcharts
- 17. International Diabetes Federation (IDF) Worldwide Definition of Metabolic Syndrome. [Acesso em 2010 out 24]. Disponível em: http://www.idf.org/home/index.cfm?node=1429
- 18. Third Report of the National Cholesterol Education Program (NCEP). Expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (adult treatment panel III) final report. Circulation. 2002;106(25):3143-421.
- 19. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28(7):412-9.
- 20. Huang TT, Johnson MS, Goran MI. Development of a prediction equation for insulin sensitivity from anthropometry and fasting insulin in prepubertal and early pubertal children. Diabetes Care. 2002;25(7):1203-10.
- 21. Vasques AC, Rosado LE, Cássia G, Alfenas R, Geloneze B. Análise crítica do uso dos índices do Homeostasis Model Assessment (HOMA) na avaliação da resistência à insulina e capacidade funcional das células-b pancreáticas. Arq Bras Endocrinol Metabol. 2008;52(1):32-9
- 22. Giuliano ICB, Caramelli B, Pellanda L, Duncan B, Mattos S, Fonseca FAH / Sociedade Brasileira de Cardiologia. I Diretriz de prevenção da aterosclerose do Departamento de Aterosclerose da Sociedade Brasileira de Cardiologia. Arq Bras Cardiol. 2001;77(3):1-48.
- 23. Nakazone MA, Pinheiro A, Braile MC, Pinhel MA, de Sousa GF, Pinheiro S Jr, et al. Prevalência de síndrome metabólica em indivíduos brasileiros pelos critérios de NCEP-ATPIII e IDF. Rev Assoc Med Bras. 2007;53(5):407-13.
- 24. Souza MSF, Leme RB, Franco RR, Romaldini CC, Tumas R, Cardoso AL, et al. Síndrome metabólica em adolescentes com sobrepeso e obesidade. Rev paul pediatr. 2007;25(3):214-20.
- 25. Juárez-López C, Klünder-Klünder M, Medina-Bravo P, Madrigal-Azcárate A, Mass-Díaz E, Flores-Huerta S. Insulin resistance and its association with the components of the metabolic syndrome among obese children and adolescents BMC Public Health. 2010;10:318.
- 26. Lopes HF, Egan BM. Desequilíbrio autonômico e síndrome metabólica: parceiros patológicos em uma pandemia global emergente. Arq Bras Cardiol. 2006;87(4):538-47.
- 27. Lottenberg SA, Glezer A, Turatti LA. Metabolic syndrome: definition and prevalence in children. J Pediatr. 2007;83(5 Suppl.):S204-8.
- 28. Pankow JS, Jacobs DR Jr, Steinberger J, Moran A, Sinaiko AR. Insulin resistance and cardiovascular disease risk factors in children of parents with the insulin resistance (metabolic) syndrome. Diabetes Care. 2004;27(3):775-80.
- 29. Hoffman RP, Vicini P, Sivitz WI, Cobelli C. Pubertal adolescent male-female differences in insulin sensitivity and glucose effectiveness determined by the one compartment minimal model. Pediatr Res. 2000;48(3):384-8.
- 30. Moran A, Jacobs DR Jr, Steinberger J, Hong CP, Prineas R, Luepker R, et al. Insulin resistance during puberty: results from clamp studies in 357 children. Diabetes. 1999;48(10):2039-44.
- 31. Bao W, Srinivasan SR, Berenson GS. Persistent elevation of plasma insulin levels is associated with increased cardiovascular risk in children and young adults. The Bogalusa Heart Study. Circulation. 1996;93(1):54-9.
- 32. Alvaréz MM, Vieira ACR, Sichieri R, Veiga, GV. Associação das medidas antropométricas de localização de gordura central com os componentes da síndrome metabólica em uma amostra probabilística de adolescentes de escolas públicas. Arq Bras Endocrinol Metab. 2008;52(4):649-57.
- 33. Després JP, Lemieux I, Tchernof A, Couillard C, Pascot A, Lemieux S. [Fat distribution and metabolism]. Diabetes Metab. 2001;27(2 Pt 2):209-14.
- 34. Alvarez MM, Vieira AC, Moura AS, da Veiga GV. Insulin resistance in Brazilian adolescent girls: association with overweight and metabolic disorders. Diabetes Res Clin Pract. 2006;74(2):183-8.
- 35. Schmidt MI, Duncan BB, Watson RL, Sharrett AR, Brancati FL, Heiss G. Metabolic syndrome in whites and African-Americans: The Atherosclerosis Risk in Communities baseline study. Diabetes Care. 1996;19(5):414-8.
- 36. Oliveira EP, Lima MDA, Souza MLA. Síndrome metabólica seus fenótipos e resistência à insulina pelo HOMA-RI. Arq Bras Endocrinol Metab. 2007;51(9):1506-15.
- 37. Queiroz JCF, Alonso-Vale MIC, Curi R, Lima FB. Controle de adipogênse por ácidos graxos. Arq Bras Endocrinol Metab. 2009;53(5):582-94.
- 38. Cruz ML, Weigensbeg MJ, Huang TT, Ball G, Shaibi GQ, Goran MI. The metabolic syndrome in overweight Hispanic youth and the role of insulin sensitivity. J Clin Endocrinol Metab. 2004;89(1):108-13.
- 39. Sinaiko AR, Steinberger J, Moran A, Prineas RJ, Vessby B, Basu S, et al. Relation of body mass index and insulin resistance to cardiovascular risk factors, inflammatory factors, and oxidative stress during adolescence. Circulation. 2005;111(15):1985-91.
- 40. Ferreira AP, Nóbrega OT, França NM. Associação do índice de massa corporal e da resistência à insulina com síndrome metabólica em crianças brasileiras. Arq Bras Cardiol. 2009;93(2):147-53.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
30 Set 2011 -
Data do Fascículo
Nov 2011
Histórico
-
Revisado
11 Abr 2011 -
Recebido
02 Fev 2011 -
Aceito
31 Maio 2011