Resumo
Introdução/Objetivo:
Evidências recentes sugerem que anormalidades que envolvem os linfócitos Th17 estão associadas à fisiopatologia do lúpus eritematoso sistêmico (LES). Além disso, os linfócitos T multifuncionais (LTM), ou seja, aqueles que produzem múltiplas citocinas simultaneamente, estão presentes no meio inflamatório e podem estar implicados no processo autoimune observado no LES. No presente estudo, objetiva-se caracterizar o estado funcional dos linfócitos T CD4+ no LES e determinar simultaneamente a concentração de IL-2, IFN-γ e IL-17 em culturas de linfócitos sob estímulos exógenos e autoantigênicos.
Pacientes e métodos:
Dezoito pacientes com doença ativa, 18 com doença inativa e 14 controles saudáveis foram submetidos à análise do estado funcional dos linfócitos T CD4+.
Resultados:
Encontrou-se que os pacientes com LES apresentaram uma diminuição na quantidade total de células CD4+, um aumento na quantidade de linfócitos T ativados e um aumento na frequência de linfócitos Th17 em comparação com controles saudáveis (HC). As células LTM tinha frequência aumentada em pacientes com LES e houve um aumento na frequência de LTM trifuncionais em pacientes com LES ativo em comparação com aqueles com LES inativo. Curiosamente, as células MTF produziram quantidades maiores de IFN-γ do que os linfócitos T monofuncionais em pacientes e controles.
Conclusão:
Analisados em conjunto, esses dados indicam a participação dos linfócitos Th17 recentemente ativados e células MTF na fisiopatologia do LES.
Palavras-chave:
Lúpus eritematoso sistêmico; Linfócitos T; Th17; Linfócitos T multifuncionais
Abstract
Introduction/Objective:
Recent evidence suggests that abnormalities involving Th17 lymphocytes are associated with the pathophysiology of systemic lupus erythematosus (SLE). In addition, multifunctional T cells (MFT), i. e., those producing multiple cytokines simultaneously, are present in the inflammatory milieu and may be implicated in the autoimmune process observed in SLE. In the present study, we aimed to characterize the functional status of CD4+ T cells in SLE by simultaneously determining the concentration of IL-2, IFN-γ and IL-17 in lymphocyte cultures under exogenous and self-antigenic stimuli.
Patients and methods:
Eighteen patients with active disease, 18 with inactive disease, and 14 healthy controls had functional status of CD4+ T cells analyzed.
Results:
We found that SLE patients presented a decreased number of total CD4+ cells, an increased number of activated T cells, and an increased frequency of Th17 cells compared to healthy controls (HC). MFT cells had increased frequency in SLE patients and there was an increased frequency of tri-functional MFT in patients with active SLE compared with those with inactive SLE. Interestingly, MTF cells produced larger amounts of IFNγ than mono-functional T cells in patients and controls.
Conclusion:
Taken together these data indicate the participation of recently activated Th17 cells and MTF cells in the SLE pathophysiology.
Keywords:
Systemic lupus erythematosus; T lymphocytes; Th17; Multifunctional T cells
Introdução
Os linfócitos T CD4+ efetores foram inicialmente classificados em dois subgrupos, de acordo com as citocinas que produzem.11 Mosmann TR, Cherwinski H, Bond MW, Giedlin MA, Coffman RL. Twc types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J Immunol. 1986;136(7):2348-57.
2 Mosmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu Rev Immunol. 1989;7:145-73.-33 Nakayamada S, Takahashi H, Kanno Y, O'Shea JJ. Helper T cell diversity and plasticity. Curr Opin Immunol. 2012;24(3):297-302. Os linfócitos Th17 fazem parte desse novo panorama de linfócitos T e mostram um fenótipo de linfócitos T CD4+ ativados caracterizado pela produção de elevadas quantidades de IL-17.44 Infante-Duarte C, Horton HF, Byrne MC, Kamradt T. Microbial lipopeptides induce the production of IL-17 in Th cells. J Immunol. 2000;165(11):6107-15.–66 Harrington LE, Hatton RD, Mangan PR, Turner H, Murphy TL, Murphy KM, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat Immunol. 2005;6(11):1123-32. Os linfócitos Th17 parecem desempenhar um papel crucial no desenvolvimento de uma ampla gama de transtornos inflamatórios crônicos e autoimunes.77 Park H, Li Z, Yang XO, Chang SH, Nurieva R, Wang YH, et al. A distinct lineage of CD4T cells regulates tissue inflammation by producing interleukin 17. Nat Immunol. 2005;6(11):1133-41.–99 Crispin JC, Tsokos GC. Interleukin-17-producingT cells in lupus. Curr Opin Rheumatol. 2010;22(5):499-503. Na verdade, sugeriu-se que a regulação inapropriada dos linfócitos Th17 pode ser um evento-chave na patogênese da artrite reumatoide e do lúpus eritematoso sistêmico (LES).1010 Garrett-Sinha LA, John S, Gaffen SL. IL-17 and the Th17 lineage in systemic lupus erythematosus. Curr Opin Rheumatol. 2008;20(5):519-25.–1414 Prado C, de Paz B, Gomez J, Lopez P,Rodriguez-Carrio J, Suarez A. Glucocorticoids enhance Th17/Th1 imbalance and signal transducer and activator of transcription 3 expression in systemic lupus erythematosus patients. Rheumatology (Oxford). 2011;50(10):1794-801. Diversos estudos relataram níveis séricos significativamente mais altos de IL-17 e uma frequência mais elevada de células mononucleadas do sangue periférico (CMSP) produtoras de IL-17 em pacientes com LES, em comparação com indivíduos normais.1313 Bălănescu P, Bălănescu E, Tănăsescu C, Nicolau A, Tănăsescu R, Grancea C, et al. T helper 17 cell population in lupus erythematosus. Rom J Intern Med. 2010;48(3):255-9.,1515 Wong CK, Ho CY, Li EK, Lam CW. Elevation of proinflammatory cytokine (IL-18, IL-17, IL-12) and Th2 cytokine (IL-4) concentrations in patients with systemic lupus erythematosus. Lupus. 2000;9(8):589-93.–1818 Dong G, Ye R, Shi W, Liu S, Wang T, Yang X, et al. IL-17 induces autoantibody overproduction and peripheral blood mononuclear cell overexpression of IL-6 in lupus nephritis patients. Chin Med J (Engl). 2003;116(4):543-8. Mostrou-se também que a resposta do Th17 está correlacionada com a atividade da doença em pacientes com LES.1717 Shah K, Lee WW, Lee SH, Kim SH, Kang SW, Craft J, et al. Dysregulated balance of Th17 and Th1 cells in systemic lupus erythematosus. Arthritis Res Ther. 2010;12(2):R53.
Uma estratégia inovadora para a avalição da funcionalidade do linfócito T se baseia na determinação simultânea de várias citocinas expressas por subtipos de células. De acordo com essa abordagem, os linfócitos T que produzem múltiplas citocinas simultaneamente são chamados de linfócitos T multifuncionais. Foram documentadas respostas dos linfócitos T multifuncionais no HIV-11919 Betts MR, Nason MC, West SM, De Rosa SC, Migueles SA, Abraham J, et al. HIV nonprogressors preferentially maintain highly functional HIV-specific CD8+ T cells. Blood. 2006;107(12):4781-9. e na resposta imune à vacina contra o vírus da hepatite B2020 De Rosa SC, Lu FX, Yu J, Perfetto SP, Falloon J, Moser S, et al. Vaccination in humans generates broad T cell cytokine responses. J Immunol. 2004;173(9):5372-80. e HIV.1919 Betts MR, Nason MC, West SM, De Rosa SC, Migueles SA, Abraham J, et al. HIV nonprogressors preferentially maintain highly functional HIV-specific CD8+ T cells. Blood. 2006;107(12):4781-9.,2020 De Rosa SC, Lu FX, Yu J, Perfetto SP, Falloon J, Moser S, et al. Vaccination in humans generates broad T cell cytokine responses. J Immunol. 2004;173(9):5372-80. Essa nova abordagem tem sido possível em grande parte em razão dos avanços tecnológicos na citometria de fluxo, que na atualidade possibilita a detecção simultânea de diversos marcadores funcionais, fenotípicos e de linhagem nos linfócitos T.2121 Chattopadhyay PK, Price DA, Harper TF, Betts MR, Yu J, Gostick E, et al. Quantum dot semiconductor nanocrystals for immunophenotyping by polychromatic flow cytometry. Nat Med. 2006;12(8):972-7.
No presente estudo, buscou-se caracterizar o estado funcional dos linfócitos T CD4+ em pacientes com LES com doença ativa e inativa e determinar simultaneamente a concentração de várias citocinas em culturas de linfócitos com diferentes estímulos antigênicos. Também se quantificou a proporção de Th17 e linfócitos T multifuncionais e se a correlacionou com a pontuação no Sledai (Systemic Lupus Erythematosus Disease Activity Index) e com a frequência de linfócitos T ativados e linfócitos TREG.
Materiais e métodos
Trinta e seis pacientes adultos (33 mulheres e três homens, de 40 ± 7,2 anos) com diagnóstico de LES de acordo com os critérios do Colégio Americano de Reumatologia2222 Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum. 1997;40(9):1725. foram consecutivamente incluídos no estudo, depois de fornecer seu consentimento informado. Todos os pacientes foram encaminhados do ambulatório da Divisão de Reumatologia da Universidade Federal de São Paulo. Os pacientes foram divididos em dois grupos, de acordo com a sua pontuação no SLE Disease Activity Index (Sledai).2323 Bombardier C, Gladman DD, Urowitz MB, Caron D, Chang CH, Derivation of the Sledai. A disease activity index for lupus patients. The Committee on Prognosis Studies in SLE. Arthritis Rheum. 1992;35(6):630-40.,2424 Cook RJ, Gladman DD, Pericak D, Urowitz MB. Prediction of short term mortality in systemic lupus erythematosus with time dependent measures of disease activity. J Rheumatol. 2000;27(8):1892-5. O grupo LES ativo (LES-A) era composto por 18 pacientes (pontuação no Sledai ≥ 6; 17 mulheres e um homem, idade 36,7 ± 10,2 anos) e o grupo LES inativo (LES-I) era composto por 18 pacientes (pontuação no Sledai = 0; 16 mulheres e dois homens, idade 39,2 ± 13,9 anos). A tabela 1 mostra as características demográficas e clínicas de todos os pacientes incluídos no estudo. Como controle, foram incluídos 14 funcionários do laboratório (13 mulheres e um homem, de 33,9 ± 10,4 anos), saudáveis, depois de darem seu consentimento informado. Os pacientes e os controles saudáveis foram submetidos a um questionário estruturado e cederam 60 mL de sangue venoso. O protocolo do estudo foi revisado e aprovado pelo comitê de ética em pesquisa da instituição.
Foram isoladas células mononucleares do sangue periférico (CMSP) por sedimentação em gradiente de densidade sobre Ficoll-Paque (Pharmacia Biotech, Uppsala, Suécia) e lavadas duas vezes em solução salina balanceada de Hank (Gibco, Grand Island, NY). Para a criopreservação, as células foram lentamente congeladas em soro fetal bovino a 90% (FBS; HyClone Laboratories, Logan, UT) e armazenadas em nitrogênio líquido. No momento do ensaio, as CMSP foram rapidamente descongeladas em um banho com água a 37 °C e lavadas em RPMI 1640 pré-aquecido suplementado com soro fetal de vitelo a 10%, 100 U/mL de penicilina, 100 µg/mL de estreptomicina e 20 mM de glutamina (R10). As células foram contadas, foi verificada sua viabilidade e foram suspensas em R10 a uma concentração de 1 × 106 células viáveis/mL.
As CMSP descongeladas foram incubadas em placas de 96 alvéolos (200 µL/alvéolo) (Becton Dickinson, San José, CA) na presença de 100 ng/mL de forbol 12-miristato 13-acetato (PMA; Sigma) e 500 ng/mL de ionomicina ou com 100 ng/mL de extrato de células HEp-2 durante 16 horas. Após a estimulação, as células foram centrifugadas a 1.500 g durante cinco minutos, suspensas em tampões Macs e transferidas para placas de 96 alvéolos com base em V (Nunc, Roskilde, Dinamarca) em 100 µL de tampão de coloração [solução salina tamponada com fosfato (PBS) suplementada com azida de sódio a 0,1% (Sigma) e FBS a 1%, pH 7,4] com o painel de anticorpos monoclonais de superfície (CD4-PerCP, CD3-APC-CY7 e CD69-PE-Cy7). As células foram incubadas a 4° C no escuro durante 30 min, lavadas duas vezes com PBS e, em seguida, suspensas em 100 µL de tampão de fixação [paraformaldeído a 1% (Polysciences, Warrington, PA) em PBS, pH 7,4]. Para a coloração intracelular, as células previamente marcadas para marcadores de superfície foram incubadas com 100 µL de tampão de fixação a 4% e lavadas com tampão de permeabilização (PBS suplementado com azida de sódio a 0,1%, FBS a 1% e saponina a 0,1%; Sigma). Cada amostra foi suspensa em 100 µL de tampão de permeabilização, incubada durante 15 min à temperatura ambiente no escuro, lavada com 100 µL de tampão de coloração e incubada durante 30 min a 4° C no escuro sem qualquer anticorpo (tubo não corado) nem acúmulo de anticorpos monoclonais anti-IL-2-PE, anti-IFN-γ-APC e anti-IL-17-FITC em 50 µL de tampão de coloração.2525 Kallas EG, Gibbons DC, Soucier H, Fitzgerald T, Treanor JJ, Evans TG. Detection of intracellular antigen-specific cytokines in human T cell populations. J Infect Dis. 1999;179(5):1124-31. As células foram lavadas com 200 µL de tampão de coloração e suspensas em 100 µL de paraformaldeído (PFA) a 1% recentemente preparado de pH 7,4.
Os linfócitos TREG e os linfócitos T CD25+ efetores foram identificados conforme um protocolo anteriormente estabelecido.2626 Mesquita D, de Melo Cruvinel W,Araujo J, Pucci F, Salmazi K, Kallas E, et al. Systemic lupus erythematosus exhibits a dynamic and continuum spectrum of effector/regulatory T cells. Scand J Rheumatol. 2011;40(1):41-50. Resumidamente, as CMSP foram lavadas em PBS e 0,5 × 106 células viáveis foram incubadas com anticorpos anti-CD127 marcados com isotiocianato de fluoresceína (ITCF), anti-CD3 marcado com aloficocianina-Cy3 (APC-Cy3), anti-CD4 marcado com PerCP e anti-CD25 marcado com ficoeritrina (PE)-Cy7 (Becton Dickinson, San José, CA, EUA), segundo as instruções do fabricante. Após 30 min de incubação a 4° C no escuro, as células foram lavadas com tampão de Macs, fixadas e permeabilizadas com tampão de fixação/permeabilização FoxP3 (eBioscience, San Diego, CA, EUA) e então processadas para coloração com FoxP3 com o uso do kit de coloração FoxP3 e anti-Foxp3 marcado com APC (eBioscience), de acordo com as instruções do fabricante.
As amostras foram processadas em um FACSCanto Flow Cytometer, com o uso do software FACSDIVA (BD Biosciences). Os dados obtidos foram analisados com o software FLOWJO (Tree Star, San Carlo, CA). As voltagens de fluorescência foram determinadas com o uso de células não coradas correspondentes. A compensação foi feita com o uso de CompBeads (BD Biosciences) único corado com CD3-PerCP, CD4-FITC, CD8-APC-CY7, CD4-PE-CY7, CD3-PE ou CD3-APC, respectivamente. As amostras eram adquiridas até que fossem obtidos pelo menos 500 mil eventos em uma janela de células vivas.
Os dados foram descritos com a mediana e intervalo interquartil (IQR). As comparações entre os grupos foram feitas com o teste não paramétrico de Kruskal-Wallis, seguido de comparações entre os grupos com o teste de Dunnett. As correlações foram feitas com o método não paramétrico de Spearman. Estabeleceu-se um nível de inferência estatística de 5% (p < 0,05).
Resultados
Frequência reduzida de linfócitos T CD4+ e frequência aumentada de linfócitos recentemente ativados no lúpus eritematoso sistêmico
A frequência relativa de linfócitos CD4+ em relação aos linfócitos CD3+ totais em culturas de CMSP estimuladas com o extrato para células HEp-2 foi significativamente inferior em amostras de pacientes com LES-A (18,4 ± 8,9) e LES-I (17,3 ± 7,6) em comparação com os controles (24,0 ± 8,2) (fig. 1A). Do mesmo modo, as culturas de CMSP estimuladas com PMA/Io apresentaram uma frequência relativa menor de células CD4+ em relação aos linfócitos CD3+ totais em amostras de pacientes com LES-A (16,6 ± 8,4) e LES-I (19,6 ± 7,6), em comparação com os controles (25,3 ± 6,4) (fig. 1B). O mesmo foi observado em culturas de CMSP não estimuladas (dados não mostrados). Em contraste, quando foram avaliadas células recém-ativadas, caracterizadas pela expressão da molécula CD69, foi observada uma frequência relativa maior de linfócitos CD4+CD69+ em relação ao total de linfócitos CD4+ em pacientes com LES-A (5,1 ± 6,6) e LES-I (4,9 ± 5,2) quando comparados com os controles (2,8 ± 1,9) em culturas estimuladas com o extrato para células HEp-2 (fig. 1C), bem como com PMA/Io: LES-A (6,6 ± 8,3), LES-I (5,9 ± 5,5) e controles (3,5 ± 2,0) (fig. 1D). Mais uma vez, foi observado um comportamento semelhante em culturas de CMSP não estimuladas (dados não mostrados).
Frequência relativa de linfócitos T CD4+em pacientes com LES ativo, LES inativo e controles (A) e frequência relativa de linfócitos T CD4+CD69+ em pacientes com LES ativo, LES inativo e controles na estimulação com HEp-2 (A, C) e com PMA/Io (B, D). As barras representam a mediana para cada grupo. *p < 0,05; ** p < 0,01; *** p < 0,001.
Perfil multifuncional dos linfócitos T CD4+ no lúpus eritematoso sistêmico
Em seguida, analisou-se o perfil funcional dos linfócitos T CD4+ após estímulos autoantígeno-específico (extrato HEp-2) e não específico (PMA/Io). Isso foi feito determinando-se simultaneamente a IL-2, IL-17 e INF-γ intracelular pela citometria de fluxo após a estimulação in vitro com o extrato para células HEp-2 e PMA/Io, respectivamente. A figura 2 mostra a estratégia de janela e a caracterização multiparamétrica dos padrões de resposta monofuncionais, bifuncionais e trifuncionais em um paciente com LES ativo representativo. A frequência desses subconjuntos funcionais de linfócitos T foi, então, explorada em controles saudáveis e em pacientes com LES ativo e inativo.
(A) Estratégia de análise multiparâmetros para identificar os linfócitos Th17 e linfócitos polifuncionais nas CMSP de HC estimuladas com PMA/Io. Inicialmente, foi estabelecida uma janela para a população de linfócitos (R1), então apenas a população CD3+CD4+ foi selecionada (R2). A partir dessa população, foram obtidas células que expressam IL-2 (R3) IL-17 (R4) e INF-γ (R5). Frequência relativa de linfócitos T CD4+ que produzem citocinas (IL-2, IL-17 ou INF-γ) pela estimulação com HEp-2 (B) e PMA/Io (C). As barras representam o erro padrão para cada grupo. (D) Diagrama ilustrando o comportamento de subconjuntos funcionais de linfócitos T CD4+ de pacientes com LES-A, LES-I e controles. O gráfico box plot representa a frequência relativa de cada subconjunto funcional de linfócitos T CD4+ nos três grupos, sob duas condições de estímulo (extrato para células HEp-2 e PMA/Io, respectivamente). Os padrões de resposta são agrupados e codificados por cores pelo número de funções positivas e resumidos em gráficos em forma de pizza, em que cada fatia de pizza representa a percentagem média da resposta dos linfócitos T CD4+ contribuída pelos padrões de resposta com as três funções medidas (verde), qualquer combinação de duas funções (vermelho) ou uma (azul) das funções medidas. *p < 0,05; ** p < 0,01; *** p < 0,001.
Foi encontrado um aumento na frequência relativa de células que produziram pelo menos uma das três citocinas analisadas em pacientes com LES-A e LES-I em comparação com os controles quando estimuladas pelo HEp-2 (fig. 2B) ou PMA/Io (fig. 2C), mas não em culturas não estimuladas (dados não mostrados). Não houve diferença na frequência relativa de células trifuncionais entre pacientes com LES e controles em culturas estimuladas com o extrato para células HEp-2 ou PMA/Io (fig. 2D, tabela 2). Além disso, não houve diferença relativa na frequência de células monofuncionais ou bifuncionais em culturas dos três grupos estimulados com o extrato para células HEp-2 ou PMA/Io (fig. 2D, tabela 2). A maior parte dos linfócitos T bifuncionais e monofuncionais teve frequência similar em amostras de pacientes com LES e controles. No entanto, amostras de pacientes com LES-A e LES-I apresentaram maior frequência de células produtoras de IL-17 em culturas estimuladas com PMA/Io, mas não nas estimuladas com o extrato para células HEp-2 (fig. 2D e tabela 2). Além disso, as células bifuncionais produtoras de IL-17 e INF-γ mostraram uma forte tendência a uma maior frequência em culturas estimuladas por PMA de pacientes com LES-A e LES-I em comparação com os controles normais (fig. 2D e tabela 2). Como pode ser visto na figura 2D, houve uma grande variação na frequência de células monofuncionais em culturas estimuladas de pacientes com LES. Vários pacientes apresentaram uma frequência muito alta de células que expressam IL-17 e INF-γ.
Frequência relativa de células produtoras de citocinas em relação ao total de linfócitos T CD4+em culturas estimuladas por extrato para células HEp‐2 ou PMA/Io
Os linfócitos T CD4+ IL-2+/INF-γ+ bifuncionais produzem mais INF-γ do que os linfócitos T CD4+ IL-2+/INF-γ+ monofuncionais
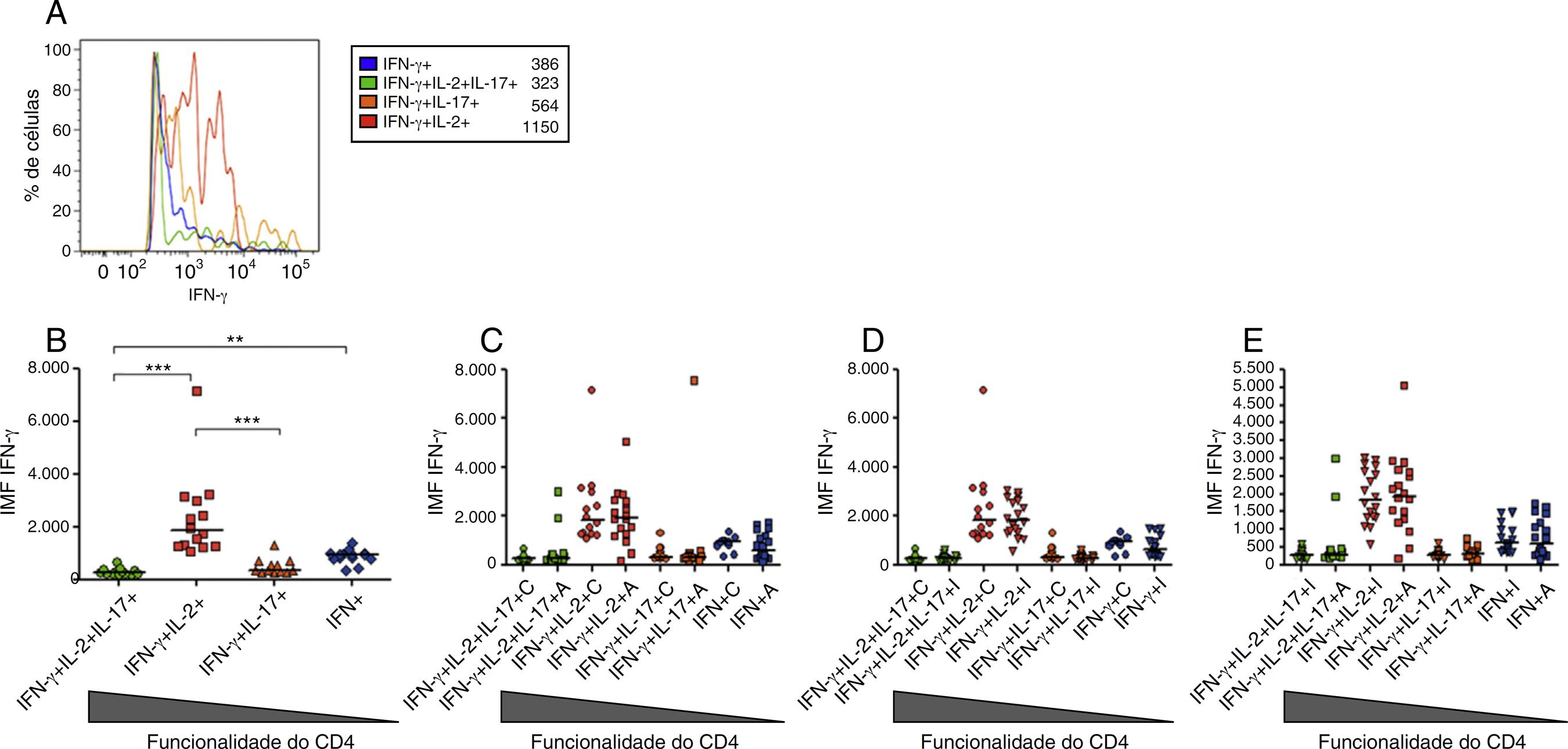
A seguir, perguntou-se se a quantidade de citocinas produzidas pelos linfócitos T multifuncionais e monofuncionais era equivalente. Para avaliar esse parâmetro, avaliou-se a intensidade média de fluorescência (IMF) de cada uma das três citocinas avaliadas. Como pode ser visto em experimentos com amostras estimuladas por PMA/Io de controles, a IMF do IFN-γ em linfócitos IL-2+/INF-γ+ foi significativamente maior do que em outras subpopulações de linfócitos T, mesmo naquelas que produzem apenas INF-γ (fig. 3A e B). Essa característica foi igualmente observada em amostras de pacientes com LES e controles (fig. 3C-E). Esse fenômeno não foi observado nas culturas sem estimulação ou naquelas estimuladas com o extrato para células HEp-2 (dados não mostrados). Esse comportamento foi observado em todos os 36 pacientes com LES e 14 voluntários saudáveis examinados. Esse comportamento não foi observado na IL-17 e IL-2 em linfócitos T CD4+ em qualquer dos três grupos estudados (dados não mostrados).
(A) Histograma que representa a intensidade média da fluorescência (IMF) do INF-γ após a estimulação com PMA/Io nas diferentes subpopulações de linfócitos T CD4+ funcionais de uma amostra representativa do controle normal. A linha azul representa a IMF das células com uma função, a linha verde representa as células com três funções e as linhas laranja e vermelha representam as células com duas funções para o INF-γ + IL-17 e INF- γ + IL-2, respectivamente. (B) Gráfico representando a diferença entre a IMF do IFN-γ entre diferentes subpopulações funcionais de linfócitos T CD4+ nos controles pela estimulação com PMA/Io. Comparação da IMF do IFN-γ por diferentes tipos de linfócitos CD4+ após estimulação com PMA/Io entre o controle e LES-A (C), controle e LES-I (D) e LES-I e LES-A (E). ** p < 0,01; *** p < 0,001.
Correlação entre a frequência de linfócitos Th17 e células recém-ativadas em pacientes com lúpus eritematoso sistêmico inativo e com linfócitos T CD4+ efetores no lúpus eritematoso sistêmico ativo
Foi encontrada uma correlação positiva entre a frequência de linfócitos Th17 e linfócitos recentemente ativados em amostras de CMSP de pacientes com LES-I em culturas não estimuladas (fig. 4A) ou sob estímulo do extrato para células HEp-2 (fig. 4B), mas não quando as células foram estimuladas com PMA/Io (fig. 4C). Houve também uma correlação positiva entre a frequência de linfócitos Th17 e linfócitos CD4+CD25+Foxp3∅ em amostras de pacientes com LES ativo sem estímulos ou sob diferentes estímulos (fig. 4D-F). Nas amostras de controle, houve também uma correlação positiva entre a frequência de linfócitos Th17 e linfócitos CD4+CD25+Foxp3∅ quando a cultura foi estimulada com extrato para células HEp-2 e em culturas não estimuladas, mas não naquelas estimuladas com PMA/Io (dados não mostrados). Essa correlação não foi encontrada em culturas de amostras de pacientes com LES inativo (dados não apresentados). Não foi encontrada correlação entre a frequência relativa de linfócitos Th17 e linfócitos TREG (CD4highCD27∅Foxp3+) em amostras de controles e pacientes com LES, independentemente da existência de estímulo da cultura (dados não mostrados). Por fim, não houve correlação entre a atividade do LES medida pelo Sledai e a frequência relativa de linfócitos Th17 ou qualquer outro subconjunto de linfócitos T investigado em culturas estimuladas e não estimuladas.
Correlação entre a frequência relativa de linfócitos Th17 e linfócitos T CD4+ CD69+ em culturas de CMSP de pacientes com LES-I sem estimulação (A), cultura estimulada com extrato para células HEp-2 (B) e cultura estimulada com PMA/Io (C) n = 18. Correlação entre a frequência relativa de linfócitos Th17 e CD4+CD25+Foxp3− em culturas de CMSP de pacientes com LES-A sem estimulação (D), culturas estimuladas com extrato para células HEp-2 (E) e culturas estimuladas com PMA/Io (F) n = 11.
Discussão
O objetivo do presente estudo foi avaliar o sistema imune de pacientes com LES em relação às vias efetoras dos linfócitos T CD4+ produtores de IL-17 (Th17) e linfócitos T CD4+ multifuncionais. Portanto, estimularam-se as culturas de CMSP com extrato para células HEp-2, que expressam a maior parte dos autoantígenos de importância clínica no LES, incluindo os polipeptídeos Sm/RNP, SS-A/Ro e SS-B/La, bem como os antígenos de cromatina. Esse estímulo possibilitou avaliar, entre os agrupamentos de linfócitos T CD4+, aqueles com capacidade autorreativa em comparação com as células não estimuladas e as células estimuladas com PMA/Io (estimulação policlonal). Esses experimentos mostraram que as CMSP de pacientes com LES responderam à estimulação com autoantígenos. Além disso, observou-se que, mesmo em indivíduos saudáveis, havia linfócitos T CD4+ sensíveis à estimulação com autoantígenos derivados de células HEp-2, mas em proporções menores em comparação com os pacientes com LES.
Nesse contexto, observou-se que as culturas de pacientes com LES ativo apresentaram menor frequência relativa de linfócitos T CD4+, conforme previamente relatado por Wouters et al.2727 Wouters CH, Diegenant C, Ceuppens JL, Degreef H, Stevens EA. The circulating lymphocyte profiles in patients with discoid lupus erythematosus and systemi lupus erythematosus suggest a pathogenetic relationship. Br J Dermatol. 2004;150(4):693-700. Por outro lado, amostras de pacientes com LES ativo e inativo tinham uma frequência aumentada de linfócitos T recentemente ativados (CD4+CD69+). A redução na frequência relativa de linfócitos CD4+ pode estar relacionada com os efeitos da terapia imunossupressora, uma vez que vários dos pacientes estudados estavam sob esse tratamento. Em contraste, o aumento na frequência de linfócitos T CD4+CD69+ possivelmente corresponde à fração de linfócitos T recentemente ativados que pode contribuir para a manutenção da resposta autoimune exacerbada e atividade da doença apesar do tratamento.
Houve um aumento na frequência relativa de linfócitos T CD4+ produtores de IL-2, IL-17 ou INF-γ em amostras de pacientes com LES-A e LES-I depois de estímulo com PMA/Io ou extrato para células HEp-2. O aumento na proporção de células circulantes capaz de assumir um fenótipo de secreção de citocinas após estimulação indica que o sistema imunológico nos pacientes com LES apresenta um acúmulo expressivo de células parcialmente diferenciadas prontas para assumir funções efetoras. É possível que isso se estenda a locais inflamatórios de órgãos alvo e contribua, assim, para a perpetuação da inflamação nesses locais.
O próximo passo foi avaliar a frequência relativa de células capazes de produzir cada citocina individualmente e de células capazes de adquirir um fenótipo multifuncional pela produção de mais de uma citocina. Na verdade, encontrou-se um aumento relativo na frequência de linfócitos T CD4+ produtores de IL-17 (Th17 linfócitos) em culturas estimuladas pelo PMA/Io de pacientes com LES-A e LES-I. Esse achado corrobora relatos anteriores da literatura que mostram uma frequência aumentada de linfócitos Th17 e níveis séricos elevados de IL-17 nos pacientes com LES.1010 Garrett-Sinha LA, John S, Gaffen SL. IL-17 and the Th17 lineage in systemic lupus erythematosus. Curr Opin Rheumatol. 2008;20(5):519-25.,1515 Wong CK, Ho CY, Li EK, Lam CW. Elevation of proinflammatory cytokine (IL-18, IL-17, IL-12) and Th2 cytokine (IL-4) concentrations in patients with systemic lupus erythematosus. Lupus. 2000;9(8):589-93.,1616 Wong CK, Lit LC, Tam LS, Li EK, Wong PT, Lam CW. Hyperproduction of IL-23 and IL-17 in patients with systemic lupus erythematosus: implications for Th17-mediated inflammation in auto-immunity. Clin Immunol. 2008;127(3):385-93.,1818 Dong G, Ye R, Shi W, Liu S, Wang T, Yang X, et al. IL-17 induces autoantibody overproduction and peripheral blood mononuclear cell overexpression of IL-6 in lupus nephritis patients. Chin Med J (Engl). 2003;116(4):543-8.,2828 Yu JJ, Gaffen SL. Interleukin-17: a novel inflammatory cytokine that bridges innate and adaptive immunity. Front Biosci. 2008;13:170-7.
29 Yang J, Yang X, Zou H, Chu Y, Li M. Recovery of the immune balance between Th17 and regulatory T cells as a treatment for systemic lupus erythematosus. Rheumatology (Oxford). 2011;50(8):1366-72.
30 Mok MY, Wu HJ, Lo Y, Lau CS. The relation of interleukin 17 (IL-17) and IL-23 to Th1/Th2 cytokines and disease activity in systemic lupus erythematosus. J Rheumatol. 2010;37(10):2046-52.-3131 Henriques A, Inês L, Couto M, Pedreiro S, Santos C, Magalhães M, et al. Frequency and functional activity of Th17, Tc17 and other T-cell subsets in Systemic Lupus Erythematosus. Cell Immunol. 2010;264(1):97-103. No entanto, não se pode excluir a participação dos linfócitos Th1 e da citocina INF-γ relacionada no processo inflamatório do LES. Na verdade, os dados do presente estudo mostram que a frequência de células produtoras de IFN-γ foi consistentemente mais elevada em amostras de pacientes com LES do que nas amostras de controle, sob estímulo da PMA/Io ou HEp-2.
Que se tem conhecimento, este é o primeiro estudo que avalia a frequência relativa de linfócitos T multifuncionais no LES. Esse tipo de análise possibilita uma definição flexível dos subtipos funcionais de linfócitos T que contrasta com a classificação tradicional polarizada de subtipos definidos por marcadores de superfície. De acordo com esse conceito, analisou-se a atividade multifuncional dos linfócitos T CD4+. Não foi encontrada diferença na frequência relativa de linfócitos T CD4+ bifuncionais (INF-γ+/IL-2+; IL-2+/IL-17+; IFN-γ+/IL-17+) e trifuncionais (INF-γ+ IL-2+ IL-17+) em pacientes com LES-A, LES-I e controles. No entanto, quando se analisou a frequência de células trifuncionais em relação à quantidade total de células que produzem qualquer uma das citocinas analisadas, conseguiu-se encontrar uma diferença significativa nas culturas estimuladas com PMA/Io, em que as amostras de pacientes com LES-A tinham uma frequência relativa significativamente maior de linfócitos T multifuncionais do que as amostras daqueles com LES-I. Esse achado sugere que pacientes com LES-A mostram uma subpopulação aumentada de linfócitos T auxiliares capaz de produzir um amplo espectro de citocinas pró-inflamatórias depois de um estímulo forte, como pelo PMA/Io. Essa subpopulação aumentada pode contribuir para os transtornos imunológicos no processo autoimune do LES. Outro achado interessante relativo aos linfócitos T multifuncionais se deu na observação de que os linfócitos T CD4+ que expressam IL-2 e INF-γ produziram mais IFN-γ do que as células que expressam apenas IFN-γ. Isso foi igualmente observado em amostras de pacientes e controles. Betts et al., 2006, demonstraram um fenômeno semelhante e observaram um aumento na produção de INF-γ por células tri-funcionais em pacientes infectados pelo HIV.1919 Betts MR, Nason MC, West SM, De Rosa SC, Migueles SA, Abraham J, et al. HIV nonprogressors preferentially maintain highly functional HIV-specific CD8+ T cells. Blood. 2006;107(12):4781-9.
Foi encontrada uma correlação significativa entre a frequência de linfócitos Th17 e linfócitos recentemente ativados (CD4+CD69+) em pacientes com LES-I, bem como uma correlação entre a frequência de linfócitos Th17 e CD4+CD25+Foxp3∅ em pacientes com LES-A. Esses resultados sugerem que a produção de IL-17 é predominantemente associada aos linfócitos T recentemente ativados no LES em estágio inativo e aos linfócitos T efetores regulares ativados no LES em estágio ativo. Esse conceito é ilustrado na figura 5. Não foi encontrada correlação entre a atividade do LES, medida pela Sledai, e a frequência de linfócitos T produtores de IL-17 em pacientes com LES-A, como também observado por Wong et al., 2000. No entanto, outros estudos mostraram uma correlação significativa entre o Sledai e a frequência do Th17.1616 Wong CK, Lit LC, Tam LS, Li EK, Wong PT, Lam CW. Hyperproduction of IL-23 and IL-17 in patients with systemic lupus erythematosus: implications for Th17-mediated inflammation in auto-immunity. Clin Immunol. 2008;127(3):385-93.,2929 Yang J, Yang X, Zou H, Chu Y, Li M. Recovery of the immune balance between Th17 and regulatory T cells as a treatment for systemic lupus erythematosus. Rheumatology (Oxford). 2011;50(8):1366-72.
Proposta de concepção de correlação entre a frequência relativa de linfócitos Th17 e linfócitos T CD4+CD69+ em pacientes com LES-I e correlação entre a frequência relativa de linfócitos Th17 e linfócitos T CD4+CD25+Foxp3− em pacientes com LES-A. Evidencia-se que a maior parte dos linfócitos responsáveis pela produção de IL-17 são os recém-ativados em pacientes com LES-I, enquanto em pacientes com LES-A a maior parte dos IL-17 produtores de células são aqueles cronicamente ativados.
A análise combinada dos dados aqui apresentados, juntamente com as informações existentes na literatura, fornece pistas para uma melhor compreensão da fisiopatologia do LES e abre perspectivas para o desenvolvimento de terapias opcionais para essa doença. Acredita-se que o padrão imunológico observado no presente estudo ocorre em pacientes com LES em geral, mas há uma heterogeneidade considerável no grupo. O presente estudo não teve como objetivo investigar a associação desse fenômeno com as diversas manifestações do LES. Esse é um ponto relevante a ser investigado em um estudo futuro, projetado especialmente para esse objetivo. É concebível que uma terapia de bloqueio personalizado de citocinas, especificamente projetada de acordo com o perfil predominante de linfócitos T efetores multifuncionais, seja eficaz em ajudar a restaurar o equilíbrio imunológico em cada paciente. Os linfócitos T produtores de IL-17 parecem desempenhar um papel proeminente na fisiopatologia do LES e podem representar um alvo em potencial para a terapia. Na verdade, é possível que a terapia personalizada e segmentada por citocina possa contribuir para melhorar o equilíbrio da resposta imune efetora, evitar ou minimizar os danos causados pela resposta autoimune.
Referências
-
1Mosmann TR, Cherwinski H, Bond MW, Giedlin MA, Coffman RL. Twc types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J Immunol. 1986;136(7):2348-57.
-
2Mosmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu Rev Immunol. 1989;7:145-73.
-
3Nakayamada S, Takahashi H, Kanno Y, O'Shea JJ. Helper T cell diversity and plasticity. Curr Opin Immunol. 2012;24(3):297-302.
-
4Infante-Duarte C, Horton HF, Byrne MC, Kamradt T. Microbial lipopeptides induce the production of IL-17 in Th cells. J Immunol. 2000;165(11):6107-15.
-
5Shin MS, Lee N, Kang I. Effector T-cell subsets in systemic lupus erythematosus: update focusing on Th17 cells. Curr Opin Rheumatol. 2011;23(5):444-8.
-
6Harrington LE, Hatton RD, Mangan PR, Turner H, Murphy TL, Murphy KM, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat Immunol. 2005;6(11):1123-32.
-
7Park H, Li Z, Yang XO, Chang SH, Nurieva R, Wang YH, et al. A distinct lineage of CD4T cells regulates tissue inflammation by producing interleukin 17. Nat Immunol. 2005;6(11):1133-41.
-
8Tesmer LA, Lundy SK, Sarkar S, Fox DA. Th17 cells in human disease. Immunol Rev. 2008;223:87-113.
-
9Crispin JC, Tsokos GC. Interleukin-17-producingT cells in lupus. Curr Opin Rheumatol. 2010;22(5):499-503.
-
10Garrett-Sinha LA, John S, Gaffen SL. IL-17 and the Th17 lineage in systemic lupus erythematosus. Curr Opin Rheumatol. 2008;20(5):519-25.
-
11Lubberts E. IL-17/Th17 targeting: on the road to prevent chronic destructive arthritis? Cytokine. 2008;41(2):84-91.
-
12Ma J, Yu J, Tao X, Cai L, Wang J, Zheng SG. The imbalance between regulatory and IL-17-secreting CD4+ T cells in lupus patients. Clin Rheumatol. 2010;29(11):1251-8.
-
13Bălănescu P, Bălănescu E, Tănăsescu C, Nicolau A, Tănăsescu R, Grancea C, et al. T helper 17 cell population in lupus erythematosus. Rom J Intern Med. 2010;48(3):255-9.
-
14Prado C, de Paz B, Gomez J, Lopez P,Rodriguez-Carrio J, Suarez A. Glucocorticoids enhance Th17/Th1 imbalance and signal transducer and activator of transcription 3 expression in systemic lupus erythematosus patients. Rheumatology (Oxford). 2011;50(10):1794-801.
-
15Wong CK, Ho CY, Li EK, Lam CW. Elevation of proinflammatory cytokine (IL-18, IL-17, IL-12) and Th2 cytokine (IL-4) concentrations in patients with systemic lupus erythematosus. Lupus. 2000;9(8):589-93.
-
16Wong CK, Lit LC, Tam LS, Li EK, Wong PT, Lam CW. Hyperproduction of IL-23 and IL-17 in patients with systemic lupus erythematosus: implications for Th17-mediated inflammation in auto-immunity. Clin Immunol. 2008;127(3):385-93.
-
17Shah K, Lee WW, Lee SH, Kim SH, Kang SW, Craft J, et al. Dysregulated balance of Th17 and Th1 cells in systemic lupus erythematosus. Arthritis Res Ther. 2010;12(2):R53.
-
18Dong G, Ye R, Shi W, Liu S, Wang T, Yang X, et al. IL-17 induces autoantibody overproduction and peripheral blood mononuclear cell overexpression of IL-6 in lupus nephritis patients. Chin Med J (Engl). 2003;116(4):543-8.
-
19Betts MR, Nason MC, West SM, De Rosa SC, Migueles SA, Abraham J, et al. HIV nonprogressors preferentially maintain highly functional HIV-specific CD8+ T cells. Blood. 2006;107(12):4781-9.
-
20De Rosa SC, Lu FX, Yu J, Perfetto SP, Falloon J, Moser S, et al. Vaccination in humans generates broad T cell cytokine responses. J Immunol. 2004;173(9):5372-80.
-
21Chattopadhyay PK, Price DA, Harper TF, Betts MR, Yu J, Gostick E, et al. Quantum dot semiconductor nanocrystals for immunophenotyping by polychromatic flow cytometry. Nat Med. 2006;12(8):972-7.
-
22Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum. 1997;40(9):1725.
-
23Bombardier C, Gladman DD, Urowitz MB, Caron D, Chang CH, Derivation of the Sledai. A disease activity index for lupus patients. The Committee on Prognosis Studies in SLE. Arthritis Rheum. 1992;35(6):630-40.
-
24Cook RJ, Gladman DD, Pericak D, Urowitz MB. Prediction of short term mortality in systemic lupus erythematosus with time dependent measures of disease activity. J Rheumatol. 2000;27(8):1892-5.
-
25Kallas EG, Gibbons DC, Soucier H, Fitzgerald T, Treanor JJ, Evans TG. Detection of intracellular antigen-specific cytokines in human T cell populations. J Infect Dis. 1999;179(5):1124-31.
-
26Mesquita D, de Melo Cruvinel W,Araujo J, Pucci F, Salmazi K, Kallas E, et al. Systemic lupus erythematosus exhibits a dynamic and continuum spectrum of effector/regulatory T cells. Scand J Rheumatol. 2011;40(1):41-50.
-
27Wouters CH, Diegenant C, Ceuppens JL, Degreef H, Stevens EA. The circulating lymphocyte profiles in patients with discoid lupus erythematosus and systemi lupus erythematosus suggest a pathogenetic relationship. Br J Dermatol. 2004;150(4):693-700.
-
28Yu JJ, Gaffen SL. Interleukin-17: a novel inflammatory cytokine that bridges innate and adaptive immunity. Front Biosci. 2008;13:170-7.
-
29Yang J, Yang X, Zou H, Chu Y, Li M. Recovery of the immune balance between Th17 and regulatory T cells as a treatment for systemic lupus erythematosus. Rheumatology (Oxford). 2011;50(8):1366-72.
-
30Mok MY, Wu HJ, Lo Y, Lau CS. The relation of interleukin 17 (IL-17) and IL-23 to Th1/Th2 cytokines and disease activity in systemic lupus erythematosus. J Rheumatol. 2010;37(10):2046-52.
-
31Henriques A, Inês L, Couto M, Pedreiro S, Santos C, Magalhães M, et al. Frequency and functional activity of Th17, Tc17 and other T-cell subsets in Systemic Lupus Erythematosus. Cell Immunol. 2010;264(1):97-103.
Datas de Publicação
-
Publicação nesta coleção
Jan-Feb 2016
Histórico
-
Recebido
4 Abr 2014 -
Aceito
22 Ago 2015