Resumos
O desenvolvimento puberal acompanha-se de aceleração da velocidade de crescimento, secundária à elevação dos esteróides sexuais, do hormônio de crescimento e do IGF-1. O número de centímetros ganhos nesse período representa 16% da estatura adulta. A puberdade precoce (PP) pode levar à fusão prematura da cartilagem de crescimento, reduzindo a duração do crescimento e a estatura final. Assim, o principal objetivo do tratamento frenador da PP é evitar o comprometimento estatural. É importante ressaltar que a PP não evolui uniformemente, podendo ter curso lento (slow evolutive form) e não requerer tratamento. Os autores abordam aspectos do crescimento puberal normal, da puberdade precoce e suas variantes, destacando os efeitos do tratamento com GnRHa (análogos de GnRH) na estatura adulta. Situações especiais, como as puberdades avançada e acelerada, são também discutidas.
Puberdade precoce; Puberdade avançada; Puberdade acelerada; Crescimento; Análogos de GnRH
Pubertal development is associated with increased growth velocity secondary to the interaction of three hormones: sex steroids, growth hormone and IGF-1. The pubertal spurt represents 16% of adult height. Precocious puberty (PP) may induce early fusion of growth plates, reducing growth duration and, consequently, adult height. Thus, the main objective of the treatment with GnRH analogues is to avoid the height commitment. It is important to emphasize that PP does not evolve uniformly, sometimes having a slow course (slow evolutive form), which does not require treatment. The authors discuss aspects of normal pubertal growth, precocious puberty and its variants, and the effects of treatment on final height. Special situations as early and fast puberty are also mentioned.
Precocious puberty; Early puberty; Fast puberty; Growth; GnRH analogues
REVISÃO
Crescimento em meninos e meninas com puberdade precoce
Growth in boys and girls with precocious puberty
Ana Cláudia C.S. da Silva; Luís Fernando F. Adan
Serviço de Endocrinologia Pediátrica, Centro de Diabetes e Endocrinologia do Estado da Bahia CEDEBA (ACCSS); e Departamento de Pediatria, Universidade Federal da Bahia (LFFA), Salvador, BA
Endereço para correspondência Endereço para correspondência Luís Fernando Fernandes Adan Rua Leonor Calmon 256, salas 203/204 40280-620 Salvador, BA E-mail: luis.adan@uol.com.br
RESUMO
O desenvolvimento puberal acompanha-se de aceleração da velocidade de crescimento, secundária à elevação dos esteróides sexuais, do hormônio de crescimento e do IGF-1. O número de centímetros ganhos nesse período representa 16% da estatura adulta. A puberdade precoce (PP) pode levar à fusão prematura da cartilagem de crescimento, reduzindo a duração do crescimento e a estatura final. Assim, o principal objetivo do tratamento frenador da PP é evitar o comprometimento estatural. É importante ressaltar que a PP não evolui uniformemente, podendo ter curso lento (slow evolutive form) e não requerer tratamento. Os autores abordam aspectos do crescimento puberal normal, da puberdade precoce e suas variantes, destacando os efeitos do tratamento com GnRHa (análogos de GnRH) na estatura adulta. Situações especiais, como as puberdades avançada e acelerada, são também discutidas.
Descritores: Puberdade precoce; Puberdade avançada; Puberdade acelerada; Crescimento; Análogos de GnRH
ABSTRACT
Pubertal development is associated with increased growth velocity secondary to the interaction of three hormones: sex steroids, growth hormone and IGF-1. The pubertal spurt represents 16% of adult height. Precocious puberty (PP) may induce early fusion of growth plates, reducing growth duration and, consequently, adult height. Thus, the main objective of the treatment with GnRH analogues is to avoid the height commitment. It is important to emphasize that PP does not evolve uniformly, sometimes having a slow course (slow evolutive form), which does not require treatment. The authors discuss aspects of normal pubertal growth, precocious puberty and its variants, and the effects of treatment on final height. Special situations as early and fast puberty are also mentioned.
Keywords: Precocious puberty; Early puberty; Fast puberty; Growth; GnRH analogues
A PUBERDADE É O PERÍODO DE TRANSIÇÃO entre a infância e a idade adulta, durante o qual os caracteres sexuais secundários aparecem, o estirão puberal ocorre, e profundas mudanças psicológicas acontecem. Ao final dessa fase, o indivíduo está apto para a reprodução. O mecanismo neuro-endócrino responsável pelo desencadeamento da puberdade não está totalmente esclarecido, mas evidências sugerem que aminoácidos com ações inibidoras ou estimuladoras estão envolvidos no processo. Acredita-se que o glutamato desempenha um papel facilitador, enquanto o ácido gama-amino-butírico (GABA) exerce uma ação inibidora (1,2). O fator de crescimento transformante a (TGF a, transforming growth factor) e as IGFs (insulin-like growth factors) também teriam um papel regulador da puberdade. Assim, o mecanismo de puberdade precoce (PP) de alguns hamartomas hipotalâmicos, parece não envolver a produção ectópica de GnRH (gonadotropin releasing hormone), como anteriormente suposto, e sim a secreção de TGF a (3), estimulador da liberação de GnRH. O mecanismo da PP idiopática, a forma mais freqüentemente vista, permanece uma incógnita. Recentemente, foi demonstrado que a leptina in vitro é capaz de desencadear a secreção pulsátil de GnRH (4), mas seu papel na puberdade em humanos permanece controverso.
A influência de fatores ambientais, incluindo a ingestão de substâncias estrogênio-símiles, na patogênese da PP é subestimada. Uma observação intrigante relacionada ao ambiente é a alta incidência de casos de PP em crianças adotadas (1). Esse fenômeno pode estar relacionado à melhora do estado nutricional, mas o papel da leptina, como agente facilitador ou desencadeador, associado ao de outros neuropeptídeos, ainda não está claro.
CRESCIMENTO PUBERAL NORMAL
O desenvolvimento puberal é acompanhado de aceleração da velocidade de crescimento, o chamado "estirão da puberdade", ao qual se segue um período de desaceleração e, finalmente, a parada do crescimento resultante do fechamento das epífises ósseas. Durante a puberdade, o ganho estatural anual passa de 5,3 a 7,0cm nas meninas e de 5,0 a 7,5cm nos meninos, no momento do pico de crescimento (5), que ocorre em torno de 12 e 14 anos nos sexos feminino e masculino, respectivamente. O número total de centímetros ganhos durante a puberdade é, em média, de 25,3 ± 4,1cm nas meninas e 27,6 ± 3,6cm nos meninos. Isso representa, aproximadamente, 16% da estatura adulta (6).
Durante a puberdade, eleva-se a secreção de três hormônios: os esteróides sexuais, o hormônio de crescimento (GH, growth hormone) e o IGF-1. A seqüência de intervenção de cada um deles na aceleração estatural não está bem esclarecida. Há um aumento na amplitude dos picos de GH e da quantidade total de GH secretado, sem modificação na freqüência desses picos (7). O mecanismo pelo qual os esteróides sexuais aumentam a secreção de GH é impreciso. Em adolescentes com atraso puberal, a diminuição na secreção de GH parece resultar da diminuição do seu estimulador hipotalâmico, o GHRH (GH releasing hormone) (8). Normalmente, a secreção de GHRH aumenta durante a puberdade, enquanto a de somatostatina se mantém estável. Os níveis plasmáticos de GHBP (growth hormone binding protein) parecem não se modificar durante a puberdade (9), mas os níveis de IGF-1 e IGFBP-3 (insulin growth factor binding protein 3) se alteram consideravelmente. O IGF-1 começa a aumentar e tem seu pico de secreção aos 11 e 13,5 anos nas meninas e aos 12 e 14 anos nos meninos. Esse incremento corresponde ao dobro dos níveis detectados antes da puberdade (10).
RELAÇÃO ENTRE ESTERÓIDES SEXUAIS, IGF-1 E VELOCIDADE DE CRESCIMENTO
No sexo feminino, o aumento de secreção de estradiol se acompanha de aceleração da velocidade de crescimento desde o aparecimento da telarca, sugerindo que níveis moderados desse esteróide sexual são capazes de estimular o crescimento puberal. Brauner e cols. (11) encontraram uma associação positiva entre os níveis de estradiol e IGF-1 e ganho estatural similar (número de centímetros crescidos por ano) em meninas com PP inicial, classificadas em dois grupos em função da secreção de estradiol (ponto de corte 25pg/ml), com picos de GH e avanço de idade óssea semelhantes. Esses achados sugerem que o estradiol tem um efeito direto sobre o crescimento, não relacionado ao aumento da secreção de IGF-1, e que é capaz, ainda que discretamente, de induzir a aceleração da velocidade de crescimento.
No sexo masculino, o aumento da secreção de testosterona parece estimular o aumento de GH e de IGF-1 antes de promover a aceleração do crescimento. Adan e cols. (12), usando como modelo clínico 78 meninos com atraso puberal, sugeriram: a) que a velocidade de crescimento está associada positivamente com o volume testicular e a testosterona plasmática; b) que um nível de testosterona > 1ng/ml parece ser necessário para aumentar a secreção de GH e IGF-1 a níveis púberes.
PUBERDADE PRECOCE
Definição de Critérios
A PP é dita central (PPC) quando há ativação do eixo hipotálamo-hipófise-gonadal, podendo ser orgânica (PPCO), quando está associada à lesão do sistema nervoso central (SNC) ou idiopática (PPCI). Em meninas, a PPC é, na maioria das vezes, idiopática, enquanto que, em meninos, encontra-se lesão orgânica em 50% dos casos. A PP é dita periférica (PPP) ou pseudopuberdade precoce quando o eixo hipotálamo-hipófise-gonadal não está ativado, decorrendo, na maioria das vezes, de patologias primárias das gônadas ou das supra-renais.
O marcador clínico de puberdade de origem central é o surgimento de telarca nas meninas e de aumento do volume testicular nos meninos. Define-se como PP o desenvolvimento dos caracteres sexuais secundários antes de oito anos no sexo feminino e antes de nove anos no sexo masculino. Em meninas, menarca antes dos 10 anos pode servir de critério adicional. Recentemente, nos EUA, o Comitê da Sociedade de Endocrinologia Pediátrica Lawson Wilkins propôs a modificação desses critérios etários no sexo feminino para as idades de 7 e 6 anos, respectivamente em crianças brancas e afro-americanas (13). O tema, contudo, permanece controverso. Estudo recente (14) observou que 12,3 % de 223 meninas cuja puberdade iniciou-se entre 6 e 8 anos apresentavam doenças endócrinas que mereciam investigação e justificavam a precocidade sexual. No Brasil e em outros países, mantêm-se os limites anteriormente definidos.
Algumas variantes da puberdade merecem ser comentadas, embora não haja consenso em relação a essas entidades. Em algumas crianças, a puberdade pode iniciar-se em idade normal e progredir rapidamente, resultando, quando não tratada, em perda estatural importante. Essa situação, definida como Puberdade Acelerada é freqüente em crianças submetidas à radioterapia craniana (15,16), mas pode ser encontrada também em crianças ditas normais. Segundo Lazar e cols. (17), puberdade acelerada corresponde à passagem do estágio 2 para 3 (segundo Tanner) em período inferior a 1,5 e 1,3 anos nos sexos masculino e feminino, respectivamente, associada ao avanço da idade óssea.
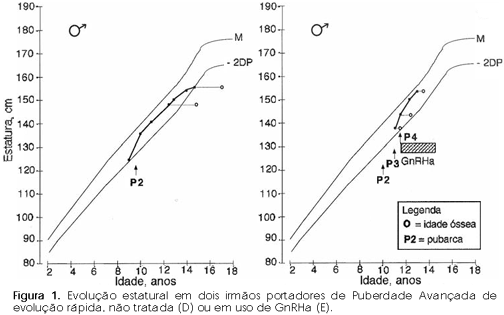
Esse conceito é algumas vezes confundido com o de Puberdade Avançada, que diz respeito à puberdade normal que surge entre 8 e 9 anos (17,18) em meninas e entre 9 e 10,5 anos em meninos (19). A puberdade avançada pode ou não ter evolução acelerada. A figura 1 ilustra a evolução estatural de dois irmãos com puberdade avançada.
A PPCI pode evoluir de formas distintas. Em meninas, em 60% dos casos, a secreção de estradiol é regular, progressiva e resulta, se não tratada, em redução da estatura adulta e menarca antes de 10 anos; é a PP que, efetivamente, merece ser bloqueada. Em 10%, a secreção de estradiol e os sinais clínicos regridem espontaneamente, podendo corresponder a uma ativação transitória do eixo. Nos 30% restantes, a estrogenização e a progressão dos caracteres sexuais são lentas, resultando em estatura adulta adequada e menarca em idade normal (slow evolutive form) (20). Nesses casos, a perda estatural, calculada em função da estatura-alvo, não é significativa. Em meninos com PPCI, observam-se também graus distintos de evolução do processo puberal (19).
O principal diagnóstico diferencial de PPC em meninas é a telarca precoce isolada (TPI). Nesta, o aparecimento do broto mamário não se faz acompanhar de aceleração da velocidade de crescimento ou de avanço significativo de idade óssea. Entretanto, é necessário manter-se a vigilância periódica dessas crianças, já que 4 a 18% dos casos de TPI podem progredir para PPCI (21,22).
EPIDEMIOLOGIA
PPC é uma desordem rara, com incidência de 1:5.000-1:10.000 (23,24). A distribuição de acordo com o sexo (meninas para meninos) é estimada em 3:1 (25) e 23:1 (26). A distribuição entre as formas idiopática e orgânica varia largamente: 69 a 98% de casos idiopáticos em meninas e 0 a 60% em meninos.
A obesidade parece ser um dos fatores responsáveis pela tendência atual de aparecimento mais precoce dos caracteres puberais. Estudo recente (27) demonstrou que a obesidade está significantemente associada à precocidade puberal, principalmente em meninas brancas. Nas afro-americanas, além da obesidade, outros fatores genéticos e/ou ambientais teriam implicação no avanço da idade puberal. Níveis mais altos de leptina para uma mesma quantidade de tecido adiposo são encontrados nesse grupo racial quando comparado a meninas brancas.
DIAGNÓSTICO DA PPC
Clínico
O diagnóstico de PP é clínico. Deve-se considerar, além do aparecimento dos caracteres sexuais secundários, a velocidade de progressão dos mesmos para os estágios subseqüentes de Tanner. A curva de crescimento é elemento de fundamental importância, pois a velocidade de crescimento costuma estar aumentada para a faixa etária e é um dos critérios que pode interferir na conduta terapêutica.
Laboratorial
a. Esteróides Sexuais: enquanto a elevação da testosterona em meninos é achado adicional útil na avaliação da PP, o valor diagnóstico do estradiol é limitado, já que metade das meninas com PPC mostra estradiol em níveis pré-puberais (28).
b. Dosagem de Gonadotrofinas: é importante na identificação do mecanismo gerador do processo (central ou periférico) e da evolução do mesmo. A avaliação dos níveis de gonadotrofinas basais depende do método utilizado: ensaios mais antigos mostram valores superponíveis nas populações pré-puberal e puberal, enquanto que, em ensaios mais sensíveis e específicos, a dosagem de LH em amostra isolada pode ser útil. Entretanto, o "padrão-ouro" continua sendo o teste de estimulação com GnRH. A interpretação do teste, contudo, não é uniforme: alguns estudos consideram a relação pico LH/pico FSH, outros valorizam o pico isolado de LH.
c. Outras dosagens hormonais: em alguns casos, exames adicionais, como função tireoidiana, 17 OH progesterona e determinação de hCG são necessários para excluir causas secundárias de PP.
Exames de Imagem
a. Ultra-sonografia pélvica:o volume e o aspecto dos ovários parecem ser de pouco valor no diagnóstico de PP (29-31). Aparentemente, a medida longitudinal do útero e o seu volume são melhores indicadores de puberdade. Embora alguns autores (29) atribuam sensibilidade e especificidade de 100% ao volume uterino (ponto de corte 1,8ml), o tema permanece controverso e outros instrumentos diagnósticos são mais utilizados. Estudo recente (32) observou que o Doppler das artérias uterinas pode ajudar na seleção de meninas a serem tratadas. Resposta púbere ao teste de GnRH está associada a baixo índice de pulsatilidade das artérias uterinas em análise com Doppler colorido.
b. Idade óssea: avanço de idade óssea igual ou superior a dois anos é um dos critérios de maior peso na decisão terapêutica. Sempre que possível, a razão D idade óssea/D idade cronológica deve ser calculada durante um período de observação. Razão maior que 1,2 costuma indicar PP evolutiva (28).
c. A tomografia computadorizada de alta resolução (TC) e a ressonância magnética (RM) são fundamentais na definição etiológica da PPC. A RM é o método de escolha, pois pode evidenciar alterações não visualizadas na TC. Todos os pacientes devem ser submetidos à avaliação por imagem da região hipotálamo-hipofisária. Restringir essa avaliação a certos grupos de pacientes com PPC, como em meninos ou apenas meninas muito jovens, não parece adequado, pois lesões intracranianas podem estar presentes em ambos os sexos e em qualquer grupo etário (33,34).
TRATAMENTO DA PUBERDADE PRECOCE CENTRAL
As drogas utilizadas para o bloqueio puberal são os análogos de GnRH (GnRHa), conhecidos desde os meados dos anos 80. No Brasil, os mais utilizados são a triptorelina, o acetato de leuprolida e a goserelina. Essas drogas, após um curto período de ação estimuladora, bloqueiam a secreção hipofisária de gonadotrofinas, ocupando os receptores e evitando a ação estimuladora intermitente do GnRH endógeno. Dá-se preferência às formas de ação prolongada, que permitem injeções mensais, aumentando a aderência ao tratamento. Em alguns casos, fenômenos de escape podem ocorrer, daí a recomendação de um novo teste de estímulo de GnRH pouco antes da injeção seguinte. Para reduzir custos e a manipulação excessiva das crianças, essa conduta não é indicada de forma sistemática. Valorizam-se sobremaneira os dados clínicos indicadores de bloqueio puberal. A avaliação semestral da idade óssea associada à dosagem de gonadotrofinas e esteróides sexuais 12 horas após a injeção mensal do análogo parece uma forma mais adequada de avaliação (35).
Efeitos Colaterais do Tratamento
Após a suspensão do tratamento, observa-se reversão completa do bloqueio do eixo hipotálamo-hipófise-gonadal (36-38). Há discrepância quanto à morfologia dos ovários após tratamento com GnRHa. Prevalência aumentada de ovários policísticos foi observada em meninas que usaram GnRHa e GH associados (39); entretanto, ovários policísticos-símile foram vistos raramente em pacientes tratadas com GnRHa isoladamente (38,40,41). A fertilidade e a gestação são normais mesmo após uso prolongado de GnRHa (28). Em meninos, observa-se que a espermatogênese não é afetada após suspensão do tratamento.
A densidade mineral óssea (DMO) está freqüentemente aumentada para a idade por ocasião do diagnóstico de PPC, e declina durante o tratamento agonista (42-44) ou não se modifica (45). Entretanto, em longo prazo, a DMO permanece dentro de níveis normais em pacientes do sexo feminino quando alcançam a estatura final (38). Sugere-se, contudo, que a massa óssea é mais bem preservada com a suplementação de 1 grama de cálcio/dia (46).
Embora a obesidade seja freqüente em crianças com PP, não existem evidências de risco de ganho de peso secundário ao uso prolongado de GnRHa (38,47).
RESULTADOS DO TRATAMENTO DA PUBERDADE PRECOCE SOBRE O CRESCIMENTO
São inúmeros os estudos que mostram os resultados benéficos desse tratamento sobre a estatura final (tabela 1 e figura 2). Utilizando-se como critérios de seleção os termos final height and precocious puberty, publicados após 1994, foram indexados ao Medline 21 artigos científicos. Os critérios de exclusão foram o termo near-final height e séries com menos de 20 pacientes.
Existem evidências de que o risco de redução da estatura adulta em alguns pacientes tem sido superestimado nos últimos anos, e que muitos pacientes têm sido tratados sem indicação formal (13,48). Independente dos custos da medicação, que são altíssimos, o uso de análogos não representa necessariamente melhora do prognóstico estatural, quando a indicação não está bem fundamentada. Alguns critérios têm sido propostos como bons indicadores para o tratamento com GnRHa:
a. auxológicos: diferença > 5cm entre a estatura-alvo e a estatura adulta predita (tabela de Bayley e Pinneau). Baseado nesta indicação, o prognóstico estatural não se deteriorou ao longo do tratamento com os análogos (49).
b. idade de início da puberdade: a estatura final seria superior à estatura predita ao início do tratamento quando a puberdade inicia-se antes dos 5 anos de idade (38). Esse trabalho reforça ainda a importância do critério que leva em consideração as estaturas alvo e predita.
c. relação idade óssea/idade estatural (IO/IE): segundo Carel e cols. (50), esse seria o critério mais importante na predição da estatura final. Quanto maior a razão IO/IE, pior o prognóstico estatural.
Brauner e cols. (51) descreveram uma série de 19 pacientes com diagnóstico de PPC tratados por um período mínimo de dois anos (tabela 1). A decisão de tratamento foi baseada em uma predição estatural <155cm. O ganho estatural calculado (estatura adulta estatura predita no início do tratamento) foi de 6,5cm. Posteriormente esta série foi ampliada para 43 pacientes (52) e o ganho estatural foi de apenas 3,4cm. Os autores postulam que os critérios menos rígidos adotados após larga experiência e maior disponibilidade dos análogos podem justificar essa aparente redução no ganho estatural. É provável que o tratamento com GnRHa preserve o potencial de crescimento, sem necessariamente resultar em "ganho estatural". As séries históricas, nas quais as estaturas adultas de crianças com PPC são desalentadoras, confirmam o grande avanço que representou o uso de GnRHa no tratamento dessa patologia. Além disso, vale frisar que o cálculo do ganho estatural é baseado na avaliação da idade óssea, um parâmetro de incontestável subjetividade (tabela 1).
QUANDO SUSPENDER O TRATAMENTO
A idade ideal para suspensão do tratamento com GnRHa é tema controverso. Para obtenção de melhor crescimento residual, sugere-se a descontinuação do tratamento, no sexo feminino, ao se atingir a idade óssea de 12-12,5 anos (54,58,68). Por outro lado, Carel e cols. (50) consideram que o tratamento não deve ser mantido além da idade cronológica de 11 anos. Essas indicações não se aplicam a pacientes do sexo masculino.
ASSOCIAÇÃO DE GnRHa E GH OU BAIXAS DOSES DE ESTRÓGENO
Alguns pacientes sob tratamento com os análogos apresentam acentuada desaceleração da velocidade de crescimento causada pela supressão dos efeitos dos esteróides sexuais sobre o GH e o IGF-1. Por essa razão, alguns estudos têm defendido o uso combinado de GnRHa e o GH recombinante (69-72). Antes de se recomendar formalmente o tratamento combinado, é necessária a realização de estudos randomizados com pacientes que efetivamente tenham atingido a estatura adulta. Não existem, no momento, elementos que confirmem o benefício dessa associação.
O uso concomitante de GnRHa e estrógeno em baixa dose é outra proposta para tentar minimizar a desaceleração acentuada da velocidade do crescimento que ocorre em algumas pacientes. Resultados encorajadores foram encontrados em projeto piloto (73), com duração de 24 meses, no qual a associação de GnRHa e estrógeno não se fez acompanhar de avanço de idade óssea ou de progressão puberal.
ESTATURA FINAL NA PUBERDADE PRECOCE POUCO EVOLUTIVA
São escassos os artigos sobre a estatura final em pacientes com PP pouco evolutiva (slow evolutive form), mas a abstenção terapêutica parece ser a conduta mais adequada (20) (figura 3). Palmert e cols. (67) publicaram uma coorte de 20 pacientes não tratadas que alcançaram estatura adulta em média 1,5cm acima da estatura alvo calculada. Quando comparadas com a PPCI clássica, essas pacientes apresentam velocidade de crescimento similar, mas menor avanço de idade óssea e pico mais baixo de LH após teste de GnRH. Outros estudos que avaliam a estatura final nesse grupo de pacientes são apresentados na tabela 1.
ESTATURA FINAL NA PUBERDADE AVANÇADA
Sendo uma variante da puberdade normal, não surpreende o fato de serem descritos na literatura estudos randomizados (59,60) que mostram não haver diferenças em termos de estatura final em crianças com puberdade avançada tratadas ou não, mesmo no sexo masculino (66). A puberdade avançada em meninas com história de baixo peso ao nascimento pode ter rápida progressão, levando ao risco de baixa estatura final. Não há, entretanto, nenhum estudo avaliando a resposta ao tratamento com GnRHa nesse grupo de pacientes (18).
ESTATURA FINAL NA PUBERDADE PRECOCE CENTRAL ORGÂNICA
A PP pode ser secundária a uma série de patologias: hamartoma hipotalâmico, tumores intracranianos, hidrocefalia, infecções e malformações congênitas do SNC, trauma, entre outras. De particular interesse é a associação entre PP e deficiência de GH, fenômeno que pode agravar, em potencial, os resultados sobre a estatura adulta. Essa associação pode ser secundária a uma lesão da região hipotálamo-hipofisária (cisto aracnoideano supra-selar, gliomas da via óptica) e/ou à irradiação craniana para tratamento de linfomas, leucemias, meduloblastoma, retinoblastoma. A PP e a secreção de esteróides sexuais permitem a manutenção de uma velocidade de crescimento normal a despeito da deficiência de GH. Há, nesses pacientes, uma elevação dos níveis plasmáticos de IGF-1, seja por ação direta dos esteróides sexuais, seja por um incremento moderado, mas significativo, na secreção de GH.
Em um estudo realizado com 24 pacientes portadores de deficiência de GH e puberdade avançada ou precoce (15) tratados com GH recombinante e GnRHa, observou-se uma estatura final adequada, similar à estatura projetada antes do tratamento, mas ainda inferior à estatura-alvo. Essa aparente incoerência pode ser atribuída ao retardo no diagnóstico de deficiência de GH, dificultado pela manutenção da velocidade de crescimento normal secundária ao incremento na secreção de GH induzida pelos esteróides sexuais.
PUBERDADE PRECOCE PERIFÉRICA
Dentre as causas de PPP, destacam-se a síndrome de McCune Albright, a hiperplasia congênita das supra-renais e a testotoxicose. Essas situações levam à aceleração da velocidade de crescimento e avanço de idade óssea, com conseqüente redução de estatura final. A instituição do tratamento da patologia de base, após exposição prolongada aos esteróides sexuais, pode levar à PPC secundária. Nesses casos, o tratamento com GnRHa deve ser instituído.
CONCLUSÕES
Na abordagem da PP, deve-se levar em consideração que a seleção adequada das crianças a serem tratadas é fundamental para a melhora do prognóstico estatural. Importante ainda enfatizar a existência das formas pouco evolutivas, que não comprometem a estatura final e não requerem tratamento. Entretanto, algumas vezes, mesmo sem risco de comprometimento estatural, o tratamento medicamentoso se impõe, para minimizar o impacto psicológico da PP.
Recebido em 23/04/03
Aceito em 18/06/03
- 1. Lebrethon MC, Bourguignon JP. Management of central isosexual precocity: diagnosis, treatment, outcome. Curr Opin Pediatr 2000;12:394-9.
- 2. Grumbach MM. The neuroendocrinology of human puberty revisited. Horm Res 2002;57/2:2-14.
- 3. Jung H, Carmel P, Schwartz MS, et al. Some hypothalamic hamartomas contain transforming growth factor a, a puberty-inducing growth factor, but not luteinizing hormone-releasing hormone neurons. J Clin Endocrinol Metab 1999;84:4695-701.
- 4. Lebrethon MC, Vandersmissen E, Gérard A, et al. Cocaine and amphetamine-regulated-transcript peptide mediation of leptin stimulatory effect on the rat gonadotropin releasing hormone pulse generator in vitro. J Neuroendocrinol 2000;12:383-5.
- 5. Sempé M, Pedron G, Roy-Pernot MP. Auxologie, méthode et séquences. Paris, Théraplix, 1979
- 6. Tanner JM, Whitehouse RH. The adolescent growth spurt of boys and girls on the Harpenden growth study. Ann Hum Biol 1976;3:109-12.
- 7. Martha PM, Rogol AD, Veldhuis JD, Kerrigan JR, Goodman DW, Blizzard RM. Alterations in the pulsatile properties of circulating growth hormone concentrations during puberty in boys. J Clin Endocrinol Metab 1989;69:563-70.
- 8. Saggese G, Cesaretti G, Giannessi N, Bracaloni C, Cinquanta L, Cioni C. Stimulated growth hormone (GH) secretion in children with delays in pubertal development before and after the onset of puberty: relationship with peripheral plasma GH-releasing hormone and somatostatin levels. J Clin Endocrinol Metab 1992;74:272-8.
- 9. Massa G, Bouillon R, Vanderschueren-Lodeweyckx M. Serum levels of growth hormone-binding protein and insulin-like growth factor I during puberty. Clin Endocrinol 1992;37:175-80.
- 10. Cara JF, Rosenfield RL, Furlanetto RW. A longitudinal study of the relationship of plasma somatomedin C concentration to the pubertal growth spurt. Am J Dis Child 1987;141:562-4.
- 11. Brauner R, Malandry F, Fontoura M, Prevot C, Souberbielle JC, Rappaport R. Idiopathic central preocious puberty in girls as a model of the effect of plasma estradiol level on growth skeletal maturation and plasma insulin-like growth factor. Horm Res 1991;36:116-20.
- 12. Adan L, Souberbielle JC, Brauner R. Management of the short stature due to pubertal delay in boys. J Clin Endocrinol Metab 1994;78:478-82.
- 13. Kaplowitz PB, Oberfield SE, and the Drug and Therapeutics and Executive Committees of the Lawson Wilkins Pediatric Endocrine Society: reexamination of the age limit for defining when puberty is precocious in girls in the United States: implications for evaluation and treatment. Pediatrics 1999;104:936-41.
- 14. Midyett LK, Moore WV, Jacobson JD. Are pubertal changes in girls before age 8 benign? Pediatrics 2003;111:47-51.
- 15. Adan L, Souberbielle JC, Zucker JM, Pierre-Kahn C, Kalifa C, Brauner R. Adult height in 24 patients treated for growth hormone deficiency and early puberty. J Clin Endocrinol Metab 1997;82:229-33.
- 16. Melin AE, Adan L, Leverger G, Souberbielle JC, Schaison G, Brauner. Growth hormone secretion, puberty and adult height after cranial irradiation with 18 Gy for leukaemia. Eur J Pediatr 1998;157:703-7.
- 17. Lazar R, Kauli A, Pertzelan A, Phillip M. Gonadotropin-suppressive therapy in girls with early and fast puberty affects the pace of puberty but not total pubertal growth or final height. J Clin Endocrinol Metab 2002;87:2090-4.
- 18. Ibáñez L, Ferrer A, Marcos MV, Hierro FR, de Zegher F. Early puberty: rapid progression and reduced final height in girls with low birth weight. Pediatrics 2000;106:1-3.
- 19. Lazar L, Pertzelan A, Weintrob N, Phillip M, Kauli R. Sexual precocity in boys: accelerated versus slowly progressive puberty gonadotropin-suppressive therapy and final height. J Clin Endocrinol Metab 2001;86:4127-32.
- 20. Fontoura M, Brauner R, Prevot C, et al. Precocious puberty in girls: early diagnosis of a slowly progressing variant. Arch Dis Child 1989;64:1170-6.
- 21. Pasquino AM, Pucarelli I, Passeri F, et al. Progression of premature thelarche to central precocious puberty. J Pediatr 1995;126:11-4.
- 22. Volta C, Bernasconi S, Cisternino M, et al. Isolated premature thelarche and thelarche variant: clinical and auxological follow-up of 119 girls. J Endocrinol Invest 1998;21:180-3.
- 23. Gonzalez ER. For puberty that comes too soon, new treatment highly effective. JAMA 1982;248:1149-52.
- 24. Cutler GB. Precocious puberty. In: Hurst JW, ed. Medicine for the Practicing Physician; 2nd, Butterworth: Woburn, 1988:526-30.
- 25. Kappy MS, Ganong CS. Advances in the treatment of precocious puberty. Adv Pediatr 1994;41:223-61.
- 26. Bridges NA, Christopher JA, Hindmarsh PC, Brook CG. Sexual precocity: sex incidence and etiology. Arch Dis Child 1994;10:116-8.
- 27. Kaplowitz PB, Slora EJ, Wasserman RC, Pedlow SE, Herman-Giddens ME. Earlier onset of puberty in girls relation to increased body mass index and race. Pediatrics 2001;108:347-53.
- 28. Partsch CJ, Heger S, Sippell W. Management and outcome of central precocious puberty. Clin Endocrinol 2002;56:129-48.
- 29. Haber HP, Wollmann HA, Ranke MB. Pelvic ultrasonography: early differentiation between isolated premature thelarche and central precocious puberty. Eur J Pediatr 1995;154:182-6.
- 30. Griffin IJ, Cole TJ, Duncan KA, et al. Pelvic ultrasound findings in different forms of sexual precocity. Acta Paediatr 1995;84:544-9.
- 31. Buzi F, Pilotta A, Dordoni D, et al. Pelvic ultrasonography in normal girls and in girls with pubertal precocity. Acta Paediatr 1998;87:1138-45.
- 32. Battaglia C, Regnani G, Mancini F, Iughetti L, Venturolli S, Flamigni C. Pelvic sonography and uterine artery color Doppler analysis in the diagnosis of female precocious puberty. Ultrasound Obstet Gynecol 2002;19:386-91.
- 33. Chalumeau M, Chemaitilly W, Trivin C, Adan L, Bréart G, Brauner R. Central precocious puberty in girls: an evidence-based diagnosis tree to predict central nervous system abnormalities. Pediatrics 2002;109:61-7.
- 34. Chemaitilly W, Trivin C, Adan L, Gall V, Sainte-Rose C, Brauner R. Central precocious puberty: clinical and laboratory features. Clin Endocrinol 2001;54:289-94.
- 35. Salerno M, Di Maio S, Gasparini N, et al. Central precocious puberty: a single blood sample after gonadotropin-releasing hormone agonist administration in monitoring treatment. Horm Res 1998;50:205-11.
- 36. Jay N, Mansfield MJ, Blizzard RM, et al. Ovulation and menstrual function of adolescent girls with central precocious puberty after therapy with gonadotropin-releasing hormone agonists. J Clin Endocrinol Metab 1992;75:890-4.
- 37. Manasco PK, Pescovitz OH, Feuillan PP, et al. Resumption of puberty after long term luteinizing hormone-releasing hormone agonist treatment of central precocious puberty. J Clin Endocrinol Metab 1988;67:368-72.
- 38. Heger S, Partsch CJ, Sippell WG. Long-term outcome after depot gonadotropin-releasing hormone agonist treatment of central precocious puberty: final height, body proportions, body composition, bone mineral density and reproductive function. J Clin Endocrinol Metab 1999;84:4583-90.
- 39. Bridges NA, Cooke A, Healy MJ, Hindmarsh PC, Brook CG. Ovaries in sexual precocity. Clin Endocrinol 1995;42:135-40.
- 40. Ambrosino MM, Hernanz-Schulman M, Genieser NB, Sklar CA, Fefferman NR, David R. Monitoring of girls undergoing medical therapy for isosexual precocious puberty. J Ultrasound Med 1994;501-8.
- 41. Jensen AM, Brocks V, Holm K, Laursen EM, Muller J. Central precocious puberty in girls: internal genitalia before, during and after treatment with long-acting gonadotropin-releasing hormone analogues. J Pediatr 1998;132:105-8.
- 42. Antoniazzi F, Bertoldo F, Zamboni G, et al. Bone mineral metabolism in girls with precocious puberty during gonadotropin-releasing hormone agonist treatment. Eur J Endocrinol 1995;133:412-7.
- 43. Neely EK, Bachrach LK, Hintz RL, et al. Bone mineral density during treatment of central precocious puberty. J Pediatr 1995;127:819-22.
- 44. Verrotti A, Chiarelli F, Montanaro AF, Morgese G. Bone mineral content in girls with precocious puberty treated with gonadotropin-releasing hormone analog. Gynecol Endocrinol 1995;9:277-81.
- 45. Boot AM, De Muinck Keizer-Schrama S, Pols HA, Krenning EP, Drop SL. Bone mineral density and body composition before and during treatment with gonadotropin-releasing hormone agonist in children with central precocious and early puberty. J Clin Endocrinol Metab 1999;83:370-3.
- 46. Antoniazzi F, Zamboni G, Bertoldo F, et al. Bone mass at final height in precocious puberty after gonadotropin-releasing hormone agonist with and without calcium supplementation. J Clin Endocrinol Metab 2003;88:1096-101.
- 47. Palmert MR, Mansfield MJ, Crowley Jr WF, Crigler Jr JF, Crawford JD, Boepple PA. Is obesity an outcome of gonadotropin-releasing hormone agonist administration? Analysis of growth and body composition in 110 patients with central precocious puberty. J Clin Endocrinol Metab 1999;84:4480-8.
- 48. Oerter KK. Precocious puberty: who has it? Who should be treated? J Clin Endocrinol Metab 1999;84:411-4.
- 49. Kreiter M, Burstein S, Rosenfield RL, et al. Preserving adult height potential in girls with idiopathic true precocious puberty. J Pediatr 1990;117:364-70.
- 50. Carel JC, Roger M, Ispas S, et al. and the French study group of Decapeptyl in precocious puberty. Final height after long-term treatment with triptorelin slow release for central precocious puberty: importance of statural growth after interruption of treatment. J Clin Endocrinol Metab 1999;84:1973-8.
- 51. Brauner R, Adan L, Malandry F, Zantleifer D. Adult height in girls with true precocious puberty. J Clin Endocrinol Metab 1994;79:415-20.
- 52. Adan L, Chemaitilly W, Trivin C, Brauner R. Factors predicting adult height in girls with idiopathic central precocious puberty: implications for treatment. Clinical Endocrinology 2002;56:297-302.
- 53. Antoniazzi F, Cisternino M, Nizzoli G, et al. Final height in girls with central precocious puberty: comparison of two different luteinizing hormone-releasing hormone agonist treatments. Acta Pediatr 1994;83:1052-6.
- 54. Oostdijk W, Rikken B, Schreuder S, et al. Final height in central precocious puberty after long-term treatment with slow release GnRH. Arch Dis Child 1996;75:292-7.
- 55. Kauli R, Galatzer A, Kornreich L, Lazar L, Pertzelan A, Laron Z. Final height of girls with central precocious puberty, untreated versus treated with cyproterone acetate or GnRH analogue. A comparative study with re-evaluation of predictions by the Bayley Pinneau method. Horm Res 1997;47:54-61.
- 56. Bertelloni S, Baroncelli GI, Sorrentino MC, Perri G, Saggese G. Effect of central precocious puberty and gonadotropin-releasing hormone analogue treatment on peak bone mass and final height in females. Eur J Pediatr 1998;157:363-7.
- 57. Galluzzi F, Salti R, Bindi G, Pasquini E, La Cauza C. Adult height comparison between boys and girls with precocious puberty after long-term gonadotropin-releasing hormone analogue therapy. Acta Paediatr 1998; 87:521-7.
- 58. Arrigo T, Cisternino M, Galluzzi F, et al. Analysis of the factors affecting auxological response to GnRH agonist treatment and final height outcome in girls with idiopathic central precocious puberty. Eur J Endocrinol 1999;141:140-4.
- 59. Bouvattier C, Coste J, Rodrigue D, et al. Lack of effect of GnRH agonists on final height in girls with advanced puberty: a randomized long-term pilot study. J Clin Endocrinol Metab 1999;84:3575-8.
- 60. Cassio A, Cacciari E, Balsamo A, et al. Ramdomized trial of LHRH analogue treatment on final height in girls with onset of puberty aged 7.5-8.5 years. Arch Dis Child 1999;81:329-32.
- 61. Partsch CJ, Heger S, Sippell WG. Treatment of central precocious puberty: lessons from a 15-year prospective trial. German Decapeptyl Study Group. J Pediatr Endocrinol Metab 2000;13:747-58.
- 62. Mul D, Oostdijk W, Otten BJ, et al. Final height after gonadotropin releasing hormone agonist treatment for central precocious puberty: the Dutch experience. J Pediatr Endocrinol Metab 2000;13:765-72.
- 63. Oerter KK, Barnes KM, Jones JV, Feuillan P, Cutler GB. Increased final height in precocious puberty after long-term treatment with LHRH agonists: the National Institutes of Health Experience. J Clin Endocrinol Metab 2001;86:4711-6.
- 64. Bajpai A, Sharma J, Kabra M, Gupta AK, Menon PS. Long-acting GnRH analogue triptorelin therapy in central isosexual precocious puberty. Indian Pediatr 2002;39:633-9.
- 65. Mul D, Bertelloni S, Carel JC, Saggese G, Chaussain JL, Oostdijk W. Effect of gonadotropin-releasing hormone agonist treatment in boys with central precocious puberty: final height results. Horm Res 2002;58:1-7.
- 66. Couto-Silva, Adan L, Trivin C, Brauner R. Adult height in advanced puberty with or without gonadotropin hormone releasing hormone analog treatment. J Pediatr Endocrinol Metab 2002;15:297-305.
- 67. Palmert MR, Malin HV, Boepple PA. Unstained or slowly progressive puberty in young girls: initial presentation and long-term follow-up of 20 untreated patients. J Clin Endocrinol Metab 1999;84:415-23.
- 68. Ohyama K, Tanaka T, Tachibana K, et al. Timing for discontinuation of treatment with long-acting gonadotropin-releasing hormone analog in girls with central precocious puberty. Endocr J 1998;45:351-6.
- 69. Walvoord EC, Pescovitz OH. Combined use of growth hormone and gonadotropin-releasing hormone analogues in precocious puberty: theoretic and practical considerations. Pediatrics 1999;104:1010-4.
- 70. Pasquino AM, Pucarelli I, Segni M, et al. Adult height in girls with central precocious puberty treated with gonadotropin-releasing hormone analogues and growth hormone. J Clin Endocrinol Metab 1999;84:449-52.
- 71. Tuvemo T, Gustafsson J, Proos LA, and the Swedish Growth Hormone Advisory Group: Growth hormone treatment during suppression of early puberty in adopted girls. Acta Paediatr 1999;88:928-32.
- 72. Kohn B, Julius JR, Blethen S. Combined use of growth hormone and gonadotropin-releasing hormone analogues: The National Cooperative Growth Study experience. Pediatrics 1999;104:1014-7.
- 73. Lampit M, Golander A, Guttmann H, Hochberg Z. Estrogen mini-dose replacement during GnRH agonist therapy in central precocious puberty: a pilot study. J Clin Endocrinol Metab 2002;87:687-90.
Datas de Publicação
-
Publicação nesta coleção
10 Nov 2003 -
Data do Fascículo
Ago 2003
Histórico
-
Aceito
18 Jun 2003 -
Recebido
23 Abr 2003