Resumos
As opções terapêuticas para a hipertireoidismo da doença de Graves são as drogas antitireoidianas, a cirurgia e o radioiodo, porém nenhuma delas é considerada ideal pois não atuam diretamente na etiopatogênese da doença. O radioiodo vem sendo cada vez mais utilizado como primeira escolha, sendo um tratamento definitivo, seguro e de fácil administração. Há autores que preferem doses mais altas para induzir deliberadamente o hipotireoidismo, enquanto outros recomendam doses mais baixas que, a curto prazo, implicam menor incidência de hipotireoidismo e maior de eutireoidismo. Não há consenso sobre o melhor esquema de doses fixas a ser utilizado, sendo esse o principal enfoque deste estudo, no qual comparamos doses de 10 e 15 mCi. Dos 164 pacientes analisados, 61 (37,2%) foram submetidos a 10 mCi e 103 (62,8%), a 15 mCi de 131I. Na análise longitudinal, observou-se que a remissão do hipertireoidismo foi estatisticamente diferente no sexto mês (p < 0,001), sendo maior no grupo em que foi empregada a dose de 15 mCi. Contudo, foi semelhante nos dois grupos após 12 e 24 meses. É possível concluir que doses fixas de 10 e 15 mCi promovem semelhante remissão do hipertireoidismo após 12 meses de tratamento. A remissão do hipertireoidismo não teve associação com idade, sexo ou uso prévio de drogas antitireoidianas.
Doença de Graves; Hipertireoidismo; Radioiodo; Drogas antitireoidianas
The treatment options for the hyperthyroidism of Graves’ disease are antithyroid drugs, surgery and radioiodine, none of which is considered ideal, as they do not act directly on the etiopathogenesis of the disease. Radioiodine has been increasingly used as the treatment of choice because it is a safe and definitive therapy whose administration is very easy. Some authors prefer to administer higher doses in order to deliberately induce hypothyroidism, while others recommend lower doses that result in a lower incidence of hypothyroidism and a greater incidence of euthyroidism. There is no consensus for the optimal regimen of fixed doses to be used and this is the main focus of the present study, where doses of 10 and 15 mCi of 131I were compared. Among the 164 patients analyzed, 61 (37.2%) were submitted to 10 mCi and 103 (62.8%) to 15 mCi. In the longitudinal analysis it was observed that remission of the hyperthyroidism was statistically different in the sixth month (p < 0.001), being higher in the group that used the dose of 15 mCi, but similar in both groups at 12 and 24 months. It may be concluded that the administration of fixed doses of 10 and 15 mCi of 131I brought about a similar remission of the hyperthyroidism after 12 months of treatment. Moreover, the remission rate of the hyperthyroidism had no association with age, sex or previous therapy with antithyroid drugs.
Graves’ disease; Hyperthyroidism; Radioiodine; Antithyroid drugs
ARTIGO ORIGINAL
Avaliação da radioiodoterapia com doses fixas de 10 e 15 mCi em pacientes com doença de graves
Evaluation of radioiodine therapy with fixed doses of 10 and 15 mCi in patients with graves disease
Viviane Canadas; Lucio Vilar; Eliane Moura; Ana Brito; Ênio Castellar
Serviço de Endocrinologia do Hospital das Clínicas da UFPE, Recife, PE
Endereço para correspondência Endereço para correspondência: Viviane Canadas Rua Agenor Lopes 424, apto. 501 51021-110 Recife, PE E-mail: vivi2207@ig.com.br
RESUMO
As opções terapêuticas para a hipertireoidismo da doença de Graves são as drogas antitireoidianas, a cirurgia e o radioiodo, porém nenhuma delas é considerada ideal pois não atuam diretamente na etiopatogênese da doença. O radioiodo vem sendo cada vez mais utilizado como primeira escolha, sendo um tratamento definitivo, seguro e de fácil administração. Há autores que preferem doses mais altas para induzir deliberadamente o hipotireoidismo, enquanto outros recomendam doses mais baixas que, a curto prazo, implicam menor incidência de hipotireoidismo e maior de eutireoidismo. Não há consenso sobre o melhor esquema de doses fixas a ser utilizado, sendo esse o principal enfoque deste estudo, no qual comparamos doses de 10 e 15 mCi. Dos 164 pacientes analisados, 61 (37,2%) foram submetidos a 10 mCi e 103 (62,8%), a 15 mCi de 131I. Na análise longitudinal, observou-se que a remissão do hipertireoidismo foi estatisticamente diferente no sexto mês (p < 0,001), sendo maior no grupo em que foi empregada a dose de 15 mCi. Contudo, foi semelhante nos dois grupos após 12 e 24 meses. É possível concluir que doses fixas de 10 e 15 mCi promovem semelhante remissão do hipertireoidismo após 12 meses de tratamento. A remissão do hipertireoidismo não teve associação com idade, sexo ou uso prévio de drogas antitireoidianas.
Descritores: Doença de Graves; Hipertireoidismo; Radioiodo; Drogas antitireoidianas
ABSTRACT
The treatment options for the hyperthyroidism of Graves disease are antithyroid drugs, surgery and radioiodine, none of which is considered ideal, as they do not act directly on the etiopathogenesis of the disease. Radioiodine has been increasingly used as the treatment of choice because it is a safe and definitive therapy whose administration is very easy. Some authors prefer to administer higher doses in order to deliberately induce hypothyroidism, while others recommend lower doses that result in a lower incidence of hypothyroidism and a greater incidence of euthyroidism. There is no consensus for the optimal regimen of fixed doses to be used and this is the main focus of the present study, where doses of 10 and 15 mCi of 131I were compared. Among the 164 patients analyzed, 61 (37.2%) were submitted to 10 mCi and 103 (62.8%) to 15 mCi. In the longitudinal analysis it was observed that remission of the hyperthyroidism was statistically different in the sixth month (p < 0.001), being higher in the group that used the dose of 15 mCi, but similar in both groups at 12 and 24 months. It may be concluded that the administration of fixed doses of 10 and 15 mCi of 131I brought about a similar remission of the hyperthyroidism after 12 months of treatment. Moreover, the remission rate of the hyperthyroidism had no association with age, sex or previous therapy with antithyroid drugs.
Keywords: Graves disease; Hyperthyroidism; Radioiodine; Antithyroid drugs
HÁ MAIS DE 50 ANOS, AS TRÊS opções básicas de tratamento do hipertireoidismo na doença de Graves são as drogas antitireoidianas (DAT), o iodo radioativo (131I) e a cirurgia (1-5). Nenhuma delas é considerada ideal, visto que não atuam diretamente na etiopatogênese da disfunção. A escolha do tratamento é influenciada por diferentes fatores, como a idade do paciente, o volume glandular, a intensidade do hipertireoidismo, a preferência do paciente e a do médico, os recursos disponíveis e a prática médica local (6-10). Há uma variação regional quanto ao tratamento de primeira linha, diferindo entre os diferentes países. As DAT são mais freqüentemente usadas na Europa e Japão. O 131I tem sido cada vez mais utilizado, principalmente na América do Norte, como primeira escolha terapêutica, por ser um tratamento definitivo, de fácil administração, com baixo custo e seguro (11,12). A cirurgia é cada vez menos utilizada mas permanece uma alternativa útil (13,14).
O 131I vem sendo consolidado como o tratamento definitivo mais efetivo, de menor custo e seguro, podendo ocasionar como efeito colateral mais significativo o hipotireoidismo, que poderá ser transitório ou definitivo (15-18). As taxas de remissão do hipertireoidismo (pacientes que evoluem para eutireoidismo e hipotireoidismo após administração do 131I) podem chegar a 100% (19-21). As doses usualmente empregadas variam de 7 a 20 mCi, conforme a região e experiência do Serviço de Saúde, não havendo consenso sobre o melhor esquema (20,21). Alguns autores advogam o uso de doses elevadas, ablativas, para provocar um hipotireoidismo intencional precoce, seguido de reposição permanente com levotiroxina (18,20). Essa conduta vem tendo aceitação crescente nos Estados Unidos, sendo pouco utilizada no Japão e na Europa (11). Outros acreditam que as doses mais baixas levariam a um controle semelhante da doença, com menor incidência de hipotireoidismo precoce (19).
A utilização de doses calculadas pelo volume glandular e captação tireoidiana parece não oferecer vantagens em relação a doses fixas, apenas elevando o seu custo operacional (1,5,6). A taxa de remissão do hipertireoidismo não parece diferir entre pacientes submetidos ao 131I com doses fixas ou calculadas, de acordo com a captação do iodo e o tamanho da glândula (21,22). No Brasil, são utilizadas preferencialmente as doses fixas entre 10 e 15 mCi (23). Apesar do largo emprego dessas doses fixas também na região Norte-Nordeste, não há registros de levantamentos locais das doses empregadas e seus respectivos efeitos a curto e longo prazos (6, 12 e 24 meses).
O presente estudo teve como objetivo principal avaliar a eficácia da terapia com radioiodo em doses fixas de 10 e 15 mCi no tratamento do hipertireoidismo em pacientes com doença de Graves, sendo também avaliada a eventual influência de fatores com sexo, idade e tratamento prévio com tionamidas sobre a eficácia do 131I.
PACIENTES E MÉTODOS
O presente estudo observacional, longitudinal, retrospectivo e tipo coorte histórica analisou a função tireoidiana de pacientes com doença de Graves atendidos no Serviço de Endocrinologia e Metabologia do HC-UFPE e submetidos à terapia com radioiodo. Foram incluídos no estudo todos os pacientes que, no período 1 de janeiro de 2000 a 31 de dezembro de 2002, receberam terapia com 131I nas doses de 10 e 15 mCi, e que tiveram seguimento laboratorial por pelo menos 24 meses.
Foram excluídos do estudo os pacientes que tiveram o seguimento perdido por abandono do acompanhamento ao longo dos 24 meses. Os pacientes com contra-indicação absoluta à radioiodoterapia (gravidez, lactação e presença ou suspeita de malignidade) e pacientes com bócios muito volumosos ao exame clínico (mais de quatro vezes o volume normal da glândula) já haviam sido excluídos previamente pelos médicos do Serviço de Endocrinologia.
Os pacientes foram divididos em dois grupos: aqueles tratados com 10 mCi de 131I (Grupo 1) e os que receberam 15 mCi de 131I (Grupo 2). A avaliação da função tireoidiana levou em consideração os dados existentes nos prontuários referentes aos valores do TSH e T4 livre (quimioluminescência) no sexto, 12o e 24o meses após o 131I. Os pacientes foram considerados em eutireoidismo quando o TSH estava entre 0,35,0 mcIU/mL e o T4 livre, entre 0,701,80 ng/dL, em hipotireoidismo diante de TSH > 5 mcIU/mL e T4 livre < 0,70 ng/dL, e em hipertireoidismo se TSH < 0,3 mcIU/mL e T4 livre > 1,8 ng/dL. Foram também avaliadas as seguintes co-variáveis: faixa etária (entre 20 e 60 anos, e < 20 e > 60 anos), sexo (masculino ou feminino) e tratamento prévio com as tionamidas metimazol ou propiltiouracil (sim ou não).
Durante a análise estatística dos dados, os pacientes foram divididos em dois grupos: pacientes em remissão do hipertireoidismo, ou seja, em eutireoidismo ou hipotireoidismo, e pacientes com hipertireoidismo. Foi realizada análise descritiva para apresentação das informações coletadas. A apresentação das variáveis qualitativas foi realizada através de gráfico e tabelas e as quantitativas foram apresentadas em tabelas contendo a média, desvio-padrão, máximo e mínimo. Para a análise longitudinal, foi ajustado um modelo longitudinal de equações generalizadas para 6, 12 e 24 meses com estrutura de correlação independente. Valores de p > 0,05 foram considerados estatisticamente significativos. Os softwares utilizados foram o SPSS v 8.0 e o R v 2.1.1.
RESULTADOS
A amostra foi composta por 211 pacientes, dos quais 47 (22,3%) foram excluídos por perda de seguimento ao longo dos 24 meses. Portanto, foram analisados 164 (77,7%) pacientes. Na tabela 1, constam algumas características dos pacientes quanto ao sexo, tratamento prévio com tionamidas, faixa etária e dose de 131I. Dos 164 pacientes analisados por 24 meses, 133 (81,1%) eram mulheres. Quanto à utilização de tratamento prévio, verifica-se que foi realizado por 132 pacientes (80,5%). No que se refere à dose do 131I, 61 (37,2%) pacientes receberam 10 mCi e 103 (62,8%), 15 mCi. A idade média dos pacientes foi de 39,8 ± 13,2 anos.
Na tabela 2, as características dos pacientes quanto ao sexo, faixa etária e tratamento prévio com tionamidas estão discriminadas segundo a dose de 131I utilizada (10 ou 15 mCi), com análise estatística das mesmas. Assim, é observado que os grupos não diferiram em relação ao sexo e faixa etária (p > 0,05 para todas as variáveis). No entanto, quanto ao tratamento prévio com tionamidas, o percentual foi significativamente maior no grupo que recebeu a dose de radioiodo de 15 mCi (p = 0,0377).
A tabela 3 apresenta a classificação dos pacientes quanto à função tireoidiana (eutireoidismo, hipotireoidismo e hipertireoidismo) para 6, 12 e 24 meses de tratamento, segundo a dose de 131I utilizada (10 ou 15 mCi). Não há diferença entre os grupos em nenhum dos tempos observados; ou seja, a distribuição percentual de eutireoidismo, hipotireoidismo e hipertireoidismo nos dois grupos não difere estatisticamente após 6, 12 ou 24 meses (p > 0,05 para todos os momentos avaliados).
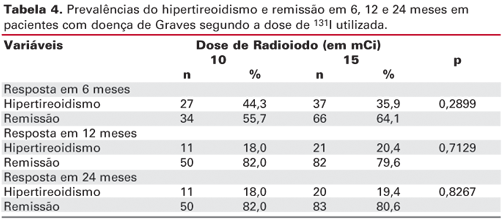
Na tabela 4 está avaliada a resposta ao tratamento. O percentual de pacientes em remissão (presença de eutireoidismo e hipotireoidismo) ou com hipertireoidismo é similar entre os grupos de estudo para 6, 12 e 24 meses (p > 0,05 em todos os momentos).
A análise longitudinal está apresentada na tabela 5. A observação dessa tabela permite afirmar que nenhum dos fatores analisados (sexo, faixa etária ou tratamento prévio com tionamidas) influenciou a resposta ao tratamento, embora tenha havido uma tendência (p = 0,058) a uma maior remissão do hipertireoidismo nos pacientes submetidos à radioiodoterapia sem uso prévio de tionamidas.
Observando, ainda, a tabela 5, é possível afirmar também que a resposta ao radioiodo após 12 meses nos grupos submetidos a 10 e 15 mCi foi estatisticamente diferente da resposta após 6 meses (p < 0,0001), o mesmo ocorrendo para 24 meses (p < 0,0001). Após 12 meses, as respostas nos grupos de 10 e 15 mCi foram iguais (os intervalos de confiança das odds são praticamente semelhantes).
DISCUSSÃO
Não há consenso sobre o melhor esquema para administração do radioiodo, sendo a dose ideal ainda controversa (16,18). As taxas de remissão do hipertireoidismo após administração do 131I, em doses variando entre 7 a 20 mCi, são de 59 a 100% (16,20,25-29). Até cerca de 40% dos pacientes podem requerer mais de uma dose do 131I para debelar o hipertireoidismo, mas somente poucos necessitarão de três ou mais doses. Em um estudo recente no qual uma dose fixa de 7 mCi foi administrada (16), 75% dos pacientes curados requereram apenas uma dose de 131I para obterem reversão do hipertireoidismo. Nos demais, duas a seis doses se fizeram necessárias.
A amostra do presente estudo constou de 164 pacientes, 133 (81,1%) mulheres e 31 (18,9%) homens. Segundo a literatura, a doença de Graves predomina em mulheres, com prevalência de 0,2 a 0,6% no sexo masculino e 2 a 2,5%, no sexo feminino (1-3). A média de idade encontrada foi de 38,9 ± 13,2 anos, confirmando os dados da literatura que mostram o pico de prevalência da doença entre a segunda e quarta décadas de vida (1-3). Entretanto, a doença de Graves pode se manifestar em qualquer faixa etária, sendo incomum abaixo dos cinco anos de idade (1).
Em pacientes acima de 21 anos, cerca de 80% dos especialistas da Europa iniciam o tratamento com tionamidas, enquanto 70% daqueles dos Estados Unidos optam inicialmente pelo 131I (11). No Brasil, as tionamidas também representam, para a maioria dos endocrinologistas, a opção inicial de tratamento (1). Essa tendência se refletiu no presente estudo, onde apenas 32 (19,5%) pacientes foram submetidos ao 131I como modalidade inicial de tratamento. Portanto, 132 (80,5%) pacientes foram previamente tratados com tionamidas.
No grupo submetido ao tratamento com 131I na dose 15 mCi, o uso prévio de tionamidas teve uma maior freqüência do que no grupo submetido a 10 mCi (p < 0,05). Uma provável explicação seria uma maior tendenciosidade ao uso de tionamidas em pacientes com hipertireoidismo mais grave, sendo também esses pacientes submetidos a doses mais elevadas de 131I (3,8).
No presente estudo, a função tireoidiana foi avaliada após administração do 131I através do TSH e T4 livre, sendo os pacientes classificados como eutireóideos, hipotireóideos ou hipertireóideos ao longo da observação em intervalos de 6, 12 e 24 meses. Não houve diferença estatística entre os grupos submetidos a 10 e 15 mCi em nenhum dos intervalos avaliados. No entanto, após a realização de uma análise longitudinal, foi observado que a resposta terapêutica, ou seja, remissão do hipertireoidismo, foi semelhante nos dois grupos apenas a partir de 12 meses. Estatisticamente, houve diferença nos primeiros seis meses, sendo notada maior remissão no grupo submetido a 15 mCi. Tal achado encontra respaldo na literatura, pois estudos comprovaram que as doses mais altas de 131I promovem uma maior remissão do hipertireoidismo e indução do hipotireoidismo a curto prazo (2,12,15,19).
A remissão do hipertireoidismo, definida como estabelecimento do eutireoidismo ou hipotireoidismo, foi observada em 82% dos pacientes do grupo de 10 mCi e em 79,5% do grupo de 15 mCi após 12 meses de seguimento. Quatro estudos publicados na década de 90 mostraram uma taxa de cura variando de 59 a 100% (22,26,27,34).
Em consonância com nossos resultados, na série de Grosso e cols. (18), a taxa de persistência do hipertireoidismo também independeu da dose de 131I: 15% com 150 Gy, 14% com 300 Gy e 14% com dose superior a 300 Gy (p = 0,72). Da mesma forma, em um estudo finlandês, o uso de doses fixas de 7 mCi (259 MBq) curou 80% dos pacientes (16). Finalmente, Erem e cols. (36) constataram que uma dose fixa de 10 mCi é altamente eficaz para reverter o hipertireoidismo em casos de doença de Graves ou bócio multinodular tóxico.
Classicamente, a freqüência de hipotireoidismo a curto prazo (por exemplo, no primeiro ano pós-tratamento com 131I) vai depender da dose utilizada (maior com doses de 1215 mCi do que com 810 mCi) (2-6). A longo prazo, entretanto, o número de pacientes com hipotireoidismo independerá da dose do 131I e pelo menos 7080% daqueles adequadamente tratados desenvolverão tal complicação (1,2-6). Em um estudo publicado com 187 pacientes submetidos a baixas doses de 131I, o hipotireoidismo esteve presente em 12% dos pacientes no primeiro ano de seguimento e em 76% após 11 anos (19). Na experiência de alguns autores, na dose de 1215 mCi, a taxa de hipotireoidismo foi de aproximadamente 50% no primeiro ano, com uma progressão de 35% ao ano (1,9,12,28). Na série de Grosso e cols. (18), a taxa de hipotireoidismo correlacionou-se com a dose empregada: 30% com 150 Gy, 46% com 300 Gy e 71% com doses maiores de 300 Gy (p = 0,0003). Raramente a recidiva do hipertireoidismo acontece em pacientes que se tornaram hipotireóideos após o radioiodo (1). Em um caso raro, essa recidiva manifestou-se após 22 anos de reposição com levotiroxina (37).
No presente estudo, após 12 meses de tratamento, hipotireoidismo foi observado em 23% dos pacientes submetidos a 10 mCi e em 24,3% daqueles que tomaram 15 mCi. Esses achados estão condizentes com os do mencionado estudo finlandês, em que o uso de doses fixas de 7 mCi propiciou a ocorrência de hipotireoidismo em 24%, 59% e 82% dos pacientes após 1, 10 e 25 anos, respectivamente (16).
A literatura atual mostra que a remissão do hipertireoidismo pós-131I pode ser influenciada por alguns fatores como gênero, idade, tamanho da glândula, captação do radioiodo (RAIU) nas 24 h, níveis séricos de T3, títulos de anticorpos antitireoidianos e anti-receptor do TSH, além do uso prévio de tionamidas (1,3,8). Uma análise de 274 pacientes mostrou que a remissão do hipertireoidismo foi maior naqueles com tireóides menores (até 50 g) e com anticorpos antitireoglobulina em títulos mais elevados (27). Outros autores mostraram ser a chance de remissão maior em mulheres, adultos jovens e pacientes com glândulas menores (1,2,38). Ademais, quanto mais elevados os níveis de T3 e TRAb previamente ao radioiodo, menor seria a chance de remissão do hipertireoidismo (1).
Classicamente, quanto mais elevada for a RAIU nas 24 h, maior tende a ser a probabilidade de uma boa resposta ao radioiodo (3,6,8). Contudo, Ruchala e cols. (40) evidenciaram maior chance de remissão nos pacientes com menor RAIU nas 24 h (40). Além disso, em um outro estudo recente, não se observou diferença na resposta terapêutica ao 131I em pacientes com RAIU nas 24 h entre 11 e 30% ou maior que 30% (41).
Existem evidências de que a utilização prévia de tionamidas pode influenciar negativamente a resposta ao radioiodo (42,43). Tal fato pode estar ligado a uma provável radioproteção fornecida por essa classe de droga, principalmente o propiltiouracil (PTU) (44,45). Sendo assim, deve ser dada uma maior preferência ao metimazol (MMI) (1). Rotineiramente, o MMI não parece interferir na resposta ao 131I, caso seja suspenso 3 a 5 dias antes da administração do radioiodo (46). Contudo, Marcocci e cols. (27) mostraram que o uso de MMI imediatamente após o 131I pode diminuir a chance de remissão do hipertireoidismo.
No presente estudo, foi evidenciado que nenhum dos fatores analisados (sexo, idade e tratamento prévio com tionamidas) influenciou a resposta ao radioiodo nos dois grupos (10 e 15 mCi). Contudo, notou-se uma tendência de maior remissão nos pacientes submetidos ao radioiodo sem tratamento prévio com MMI ou PTU (p = 0,0585). Talvez, aumentando o tamanho da amostra, o p-valor seria significativo, revelando uma maior chance de remissão naqueles pacientes submetidos à radioiodoterapia sem uso prévio de tionamidas.
Considerando o perfil sócio-econômico e cultural da nossa população, qualquer modalidade terapêutica que possa ser administrada em dose única e com níveis de resposta de controle da doença adequados torna-se mais atrativa em relação a esquemas mais laboriosos, de custo mais elevado e, principalmente, menos efetivos. Tal paradoxo se aplica, hoje, no manuseio de portadores de hipertireoidismo por doença de Graves em centros brasileiros, onde há uma nítida predileção pela terapia com tionamidas (1).
Em comparação à radioiodoterapia, a escolha das tionamidas como tratamento de primeira linha apresenta um custo mais elevado e uma menor efetividade (1,2,9). De fato, enquanto quase 100% dos pacientes tratados com tionamidas por pelo menos 12 meses atinge o eutireoidismo, somente cerca de 50% (variação de 10 a 98%) permanecerão em remissão um ano após a suspensão do tratamento (1,8,38). No nosso estudo, a maioria dos pacientes (80,5%) só foi encaminhada à radioiodoterapia após não ter obtido remissão do hipertireoidismo com o uso de tionamidas nas doses e duração preconizadas pela literatura. Portanto, ao mostrarem que remissão do hipertireoidismo ocorreu em cerca de 80% dos casos após 12 meses da administração do 131I, nossos resultados corroboram uma tendência já vigente em vários centros mundiais para utilização do radioiodo como modalidade primária de tratamento e poderão fomentar subsídios para a mudança do algoritmo de tratamento regional do hipertireoidismo da doença de Graves.
CONCLUSÃO
Nossos resultados claramente demonstram que: (1) o 131I é uma modalidade terapêutica efetiva para a doença de Graves, com a remissão do hipertireoidismo observada em aproximadamente 80% dos pacientes após 12 meses de seguimento; (2) as doses de 10 e 15 mCi apresentaram igual efetividade na reversão do hipertireoidismo e na indução do hipotireoidismo após o primeiro ano. No entanto, um número maior de pacientes do grupo de 15 mCi apresentou uma remissão mais precoce do hipertireoidismo nos primeiro semestre pós-radioiodo; (3) não houve associação dos fatores como idade, sexo e uso prévio de tionamidas com a remissão do hipertireoidismo da doença de Graves após a radioiodoterapia.
Recebido em 07/11/06
Revisado em 14/06/07
Aceito em 20/07/07
- 1. Jeffcoate W, Rea R, Vilar L. Diagnóstico e tratamento da doença de Graves. In: Vilar L, Kater CE, Naves LA, Cavalcanti N, Lyra R, Moura E, et al. (eds). Endocrinologia Clínica 3a ed. Rio de Janeiro: Guanabara Koogan-Medsi, 2006 pp. 274-91.
- 2. Weetman AP. Medical progress: Graves disease. N Engl J Med 2000;343:1236-48.
- 3. Cooper DS. Hyperthyroidism. Lancet 2003;362:459-68.
- 4. Solomon B, Glinoer D, Lagasse R, Wartofsky L. Current trends in the management of Graves disease. J Clin Endocrinol Metab 1990;70:1518-24.
- 5. Pearce EN. Diagnosis and management of thyrotoxicosis. BMJ 2006;332:1369-73.
- 6. Reid JR, Wheeler SF. Hyperthyroidism: diagnosis and treatment. Am Fam Physician 2005;72:623-30.
- 7. Bartalena L, Tanda ML, Bogazzi F, Piantanida E, Lai A, Martino E. An update on the pharmacological management of hyperthyroidism due to Graves disease. Expert Opin Pharmacother 2005;6:851-61.
- 8. Leech NJ, Dayan CM. Controversies in the management of Graves disease. Clin Endocrinol (Oxf) 1998;49:273-80.
- 9. Wemeau JL. Hyperthyroidism: current concepts and management. Rev Prat 2005;55:149-57.
- 10. Abraham P, Avenell A, Park CM, Watson WA, Bevan JS. A systematic review of drug therapy for Graves hyperthyroidism. Eur J Endocrinol 2005;153:489-98.
- 11. Wartofsky L, Glinoer D, Solomon B, Nagataki S, Lagasse R, Nagayama Y, et al. Differences and similarities in the diagnosis and treatment of Graves disease in Europe, Japan, and the United States. Thyroid 1991;1:129-35.
- 12. Marti J, Anton E, Laborda E, Santisteban P. Outcome of Graves disease after radioiodine therapy. An Med Interna 2005;22:303-4.
- 13. Schussler-Fiorenza CM, Bruns CM, Chen H. The surgical management of Graves disease. J Surg Res 2006;133:207-14.
- 14. Cooper DS. Antithyroid drugs in the management of patients with Graves disease: an evidence-based approach to therapeutic controversies. J Clin Endocrinol Metab 2003;88:3474-81.
- 15. Tamagna EI, Levine GA, Hershman JM. Thyroid hormone concentrations after radioiodine therapy for hyperthyroidism. J Nucl Med 1979;20:387-91.
- 16. Metso S, Jaatinen P, Huhtala H, Luukkaala T, Oksala H, Salmi J. Long-term follow-up study of radioiodine treatment of hyperthyroidism. Clin Endocrinol (Oxf) 2004;61:641-8.
- 17. Velkeniers B, Vanhaelst L, Cytryn R, Jonckheer MH. Treatment of hyperthyroidism with radioiodine: adjunctive therapy with antithyroid drugs reconsidered. Lancet 1988;1127-9.
- 18. Grosso M, Traino A, Boni G, Banti E, Della Porta M, Manca G, et al. Comparison of different thyroid committed doses in radioiodine therapy for Graves hyperthyroidism. Cancer Biother Radiopharm 2005;20:218-23.
- 19. Sridama V, McCormick M, Kaplan EL, Fauchet R, DeGroot LJ. Long-term follow-up study of compensated low-dose 131I therapy for Graves disease. N Engl J Med 1984;311:426-32.
- 20. Singer PA, Cooper DS, Levy EG, Ladenson PW, Braverman LE, Daniels G, et al. Treatment guidelines for patients with hyperthyroidism and hypothyroidism. Standards of Care Committee, American Thyroid Association. JAMA 1995;273:808-12.
- 21. Leslie WD, Ward L, Salamon EA, Ludwig S, Rowe RC, Cowden EA. A randomized comparison of radioiodine doses in Graves hyperthyroidism. J Clin Endocrinol Metab 2003;88:978-83.
- 22. Jarlov AE, Hegedüs L, Kristensen L, Nygaard B, Hansen JM. Is calculation of the dose in radioiodine therapy of hyperthyroidism worthwhile? Clin Endocrinol (Oxf) 1995;43:325-9.
- 23. Ward LS, Filho AC, Menabó E, Ribeiro SRR, Lima MC, Maciel RMB. Estudo da relação custo/efetividade no tratamento da doença de Basedow-Graves. Rev Ass Med Brasil 1986;32:147-54.
- 24. Streetman DD, Khanderia U. Diagnosis and treatment of Graves disease. Ann Pharmacother 2003;37:1100-9.
- 25. DeGroot LJ. Radioiodine and the immune system. Thyroid 1997;7:259-63.
- 26. Hardisty CA, Jones SJ, Hedley AJ, Munro DS, Bewsher PD, Weir RD. Clinical outcome and costs of care in radioiodine treatment of hyperthyroidism. R Coll Physicians Lond 1990;24:36-42.
- 27. Marcocci C, Gianchecchi D, Masini I, Golia F, Ceccarelli C, Bracci E, et al. A reappraisal of the role of methimazole and other factors on the efficacy and outcome of radioiodine therapy of Graves hyperthyroidism. J Endocrinol Invest 1990;13:513-20.
- 28. Hershman JM, Resnick NM. Hypothyroidism and hyperthyroidism. In: Lavin N (ed). Manual of Endocrinology and Metabolism 2nd ed. Boston: Little, Brown and Company, 1994 pp. 367-80.
- 29. Bogazzi F, Bartalena L, Campomori A, Brogioni S, Traino C, De Martino F, et al. Treatment with lithium prevents serum thyroid hormone increase after thionamide withdrawal and radioiodine therapy in patients with Graves disease. J Clin Endocrinol Metab 2002;87:4490-5.
- 30. Gittoes NJ, Franklyn JA. Hyperthyroidism Current treatment guidelines. Drugs 1998;55:543-53.
- 31. Bartalena L, Maracocci C, Bogazzi F, Panicucci M, Lepri A, Pinchera A. Use of corticosteroids to prevent progression of Graves ophthalmopathy after radioiodine therapy for hyperthyroidism. N Engl J Med 1989;321:1349-52.
- 32. Bartalena L, Marcocci C, Bogazzi F, Manetti L, Tanda ML, DellUnto E, et al. Relation between therapy for hyperthyroidism and the course of Graves ophthalmopathy. N Engl J Med 1998;338:73-8.
- 33. Huysmans D, Hermus A, Edelbroek M, Barentsz J, Corstens F, Kloppenborg P. Radioiodine for nontoxic multinodular goiter. Thyroid 1997;7:235-9.
- 34. Torring O, Tallstedt L, Wallin G, Lundell G, Ljunggren JG, Taube A, et al. Graves hyperthyroidism: Treatment with antithyroid drugs, surgery, or radioiodine-A prospective randomized study. J Clin Endocrinol Metab 1996;81:2986-93.
- 35. Walter MA, Christ-Crain M, Eckard B, Schindler C, Nitzsche EU, Muller-Brand J, et al. Radioiodine therapy in hyperthyroidism: inverse correlation of pretherapeutic iodine uptake level and post-therapeutic outcome. Eur J Clin Invest 2004;34:365-70.
- 36. Erem C, Kandemir N, Hacihasanoglu A, Ersoz HO, Ukinc K, Kocak M. Radioiodine treatment of hyperthyroidism: prognostic factors affecting outcome. Endocrine 2004;25:55-60.
- 37. Tan GH, Gharib H. Recurrent hyperthyroidism after radioiodine-induced hypothyroidism: report of two cases and literature review. Endocr Pract 1995;1:158-60.
- 38. Cooper DS. Antithyroid drugs. N Engl J Med 2005;352:905-17.
- 39. Graham GD, Burman KD. Radioiodine treatment for Graves disease. An assessment of its potential risks. Ann Intern Med 1986;105:900-5.
- 40. Ruchala M, Sowinski J, Dolata M, Junik R, Gembicki M, Skiba A. Radioiodine treatment of hyperthyroidism in patients with low thyroid uptake. Nucl Med Rev Cent East Eur 2005;8:28-32.
- 41. Razvi S, Basv A, McIntyre EA, Wahid ST, Bartholomeu PH, Weaver JV. Low failure rate of fixed administered activity of 400 mBq 131I with pre-treatment with carbimazole for thyrotoxicosis: The gastesheal protocol. Nucl Med Commun 2004;25:675-82.
- 42. Perros P. Anti-thyroid drug treatment before radioiodine in patients with Graves disease: soother or menace? Clin Endocrinol (Oxf) 2000;53:1-2.
- 43. Tuttle RM, Patience T, Budd S. Treatment with propylthiouracil before radioactive iodine therapy is associated with a higher treatment failure rate than therapy with radioactive iodine alone in Graves disease. Thyroid 1995; 5:243-7.
- 44. Santos RB, Romaldini JH, Ward LS. Propylthiouracil reduces the effectiveness of radioiodine treatment in hyperthyroid patients with Graves disease. Thyroid 2004;14:525-30.
- 45. Hancock L, Tuttle M, LeMar H, Bauman J, Patience T. The effect of propylthiouracil on subsequent radioactive iodine therapy in Graves disease. Clin Endocrinol (Oxf) 1997;47:425-30.
- 46. VA, Gross JL, Maia AL. Effect of methimazole on the efficacy of radioiodine therapy in Graves hyperthyroidism. J Clin Endocrinol Metab 2001;86:3488-93.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
17 Dez 2007 -
Data do Fascículo
Out 2007
Histórico
-
Revisado
14 Jun 2007 -
Recebido
07 Nov 2006 -
Aceito
20 Jul 2007