Resumos
Crianças com doenças crônicas freqüentemente apresentam crescimento inadequado e baixa estatura. A falência do crescimento é multifatorial. Nas doenças inflamatórias, como na artrite juvenil idiopática e nas doenças inflamatórias intestinais, o crescimento é comprometido também pelo processo inflamatório. Muitas vezes, o tratamento da doença de base compromete o crescimento, especialmente quando é necessário glicocorticóides. Em algumas situações é possível comprovar a deficiência associada de hormônio de crescimento (GH, do inglês growth hormone). Em outras, os exames sugerem certo grau de insensibilidade ao GH. O tratamento destes pacientes com GH tem se mostrado útil e seguro com melhora do crescimento e da qualidade de vida. Nesta revisão, são apresentados resultados do tratamento com GH em pacientes com baixa estatura decorrente de doenças crônicas, algumas indicações já bem definidas e outras ainda em investigação.
Hormônio do crescimento; Baixa estatura; Doenças crônicas
Growth disorders are commonly observed in children suffering from chronic diseases. The pathogenesis of growth failure is multifactorial. In chronic inflammatory diseases such as juvenile idiopathic arthritis and inflammatory bowel disease, growth is also affected by pro-inflammatory cytokines. Patients with chronic diseases might also become growth hormone (GH) deficient. However, normal or increased GH secretion with reduced plasma concentrations of insulin-like growth factor-I indicate a degree of GH insensitivity in some patients. Growth damage can increase with specific treatments, especially if glucocorticoids are used. GH therapy has been used to reduce the consequences of the disease and long-term steroid therapy in these patients. In this review, it is reported the encouraging results of GH treatment in growth-retarded children with chronic diseases, both in well defined indications as well in situations still under investigation.
Growth hormone; Short stature; Chronic diseases
REVISÃO
Tratamento com hormônio de crescimento em crianças com doenças crônicas
Growth hormone therapy for children with chronic diseases
Alexandre M. Barreto; Michele C. Bigolin; Juliana C. R. Rojas Ramos; Lucianna P. R. R. Machado; Letícia dos Reis Silva; Rodrigo B. da Silveira; Margaret C. S. Boguszewski
Unidade de Endocrinologia Pediátrica do Departamento de Pediatria da Universidade Federal do Paraná (UFP), Curitiba, PR, Brasil
Endereço para correspondência Endereço para correspondência: Margaret C. S. Boguszewski Unidade de Endocrinologia Pediátrica Rua Padre Camargo, 250 80060-240 Curitiba, PR E-mail: margabogus@uol.com.br
RESUMO
Crianças com doenças crônicas freqüentemente apresentam crescimento inadequado e baixa estatura. A falência do crescimento é multifatorial. Nas doenças inflamatórias, como na artrite juvenil idiopática e nas doenças inflamatórias intestinais, o crescimento é comprometido também pelo processo inflamatório. Muitas vezes, o tratamento da doença de base compromete o crescimento, especialmente quando é necessário glicocorticóides. Em algumas situações é possível comprovar a deficiência associada de hormônio de crescimento (GH, do inglês growth hormone). Em outras, os exames sugerem certo grau de insensibilidade ao GH. O tratamento destes pacientes com GH tem se mostrado útil e seguro com melhora do crescimento e da qualidade de vida. Nesta revisão, são apresentados resultados do tratamento com GH em pacientes com baixa estatura decorrente de doenças crônicas, algumas indicações já bem definidas e outras ainda em investigação.
Descritores: Hormônio do crescimento; Baixa estatura; Doenças crônicas
ABSTRACT
Growth disorders are commonly observed in children suffering from chronic diseases. The pathogenesis of growth failure is multifactorial. In chronic inflammatory diseases such as juvenile idiopathic arthritis and inflammatory bowel disease, growth is also affected by pro-inflammatory cytokines. Patients with chronic diseases might also become growth hormone (GH) deficient. However, normal or increased GH secretion with reduced plasma concentrations of insulin-like growth factor-I indicate a degree of GH insensitivity in some patients. Growth damage can increase with specific treatments, especially if glucocorticoids are used. GH therapy has been used to reduce the consequences of the disease and long-term steroid therapy in these patients. In this review, it is reported the encouraging results of GH treatment in growth-retarded children with chronic diseases, both in well defined indications as well in situations still under investigation.
Keywords: Growth hormone; Short stature, Chronic diseases
INTRODUÇÃO
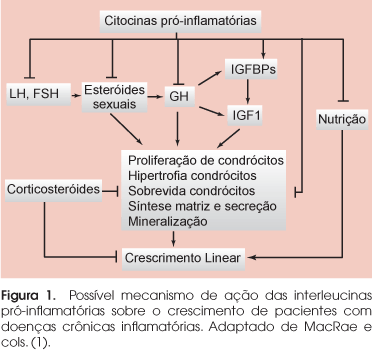
CRIANÇAS COM DOENÇAS CRÔNICAS freqüentemente apresentam crescimento inadequado e baixa estatura. A falência do crescimento é multifatorial, relacionada com o comprometimento dos órgãos envolvidos, a atividade e a extensão da doença, a nutrição deficiente, a má-absorção, o aumento do catabolismo, as complicações e as infecções associadas e o efeito do tratamento da doença de base. Nas doenças inflamatórias, como na artrite juvenil idiopática (AJI) e nas doenças inflamatórias intestinais, o crescimento é comprometido também pelo processo inflamatório com participação das interleucinas pró-inflamatórias, como interleucina-1β (IL-1β), interleucina-6 (IL-6) e fator de necrose tumoral α (TNF-α) (Figura 1). O tratamento instituído, especialmente o uso de glicocorticóides, também compromete o crescimento. O grau de comprometimento do crescimento vai depender da idade de início da doença, da sua gravidade, da resposta ao tratamento e do tempo e dose do glicocorticóide administrado.
TRATAMENTO COM GH NA DOENÇA RENAL CRÔNICA
A falência do crescimento nas crianças com insuficiência renal crônica (IRC) é um problema relativamente comum e de extrema importância clínica. Historicamente, o termo IRC tem sido utilizado para descrever pacientes com taxa de filtração glomerular (TFG) < 75 ml/min por 1,73 m2 de superfície corpórea. Atualmente, tem-se utilizado o termo doença renal crônica (DRC) e uma classificação que identifica cinco estágios, fundamentados na presença de lesão renal e no grau de comprometimento funcional, independente da doença de base. A maioria das crianças com DRC apresenta doenças renais congênitas, enquanto uma porcentagem menor apresenta doenças adquiridas, como glomerulonefrites ou insuficiência renal aguda, por exemplo, síndrome hemolítico-urêmico (2).
Falência de crescimento na doença renal crônica
A baixa estatura é um dos principais obstáculos à reabilitação da criança com DRC. A estatura média no início da terapia de substituição renal fica em torno de -2 DP, visto que aproximadamente metade das crianças tem baixa estatura. O relatório anual do North American Pediatric Renal Transplant Colaborative Study fornece o perfil de crescimento das crianças com IRC em diálise ou após transplante renal. Avaliações subseqüentes dos pacientes que iniciaram diálise não demonstraram melhora na estatura (3). Além disso, a maioria dos pacientes transplantados tem estatura adulta abaixo do terceiro percentil (4).
A patogênese do distúrbio de crescimento na DRC é multifatorial sendo importantes as alterações nutricionais, as anormalidades no eixo GH/IGF-1, a acidose metabólica, a osteodistrofia renal, entre outros (2). A idade do paciente, o tipo, a duração e a gravidade da doença renal, a modalidade de tratamento e o ambiente social do paciente também interferem no crescimento. Crianças com IRC apresentam níveis elevados de GH circulante como resultado do aumento da secreção e da diminuição do clearence renal do hormônio. A resposta ao GH endógeno está diminuída na uremia com desenvolvimento de resistência ao GH (5). As alterações na sinalização pós-receptor na via JAK/STAT e a diminuição dos receptores de GH nos órgãos-alvo foram descritos nos pacientes com IRC (5). Como conseqüência, há diminuição da produção de IGF-1. No entanto, os níveis séricos de IGF-1 e IGF-2 podem estar normais na DRC pré-terminal, enquanto na doença terminal o IGF-1 está discretamente diminuído e o IGF-2 aumentado. Isso acontece pelo aumento na concentração das proteínas ligadoras (IGFPBs). O soro do paciente renal crônico tem capacidade de ligação ao IGF sete a dez vezes maior, levando à diminuição da bioatividade do IGF, independente dos níveis séricos totais (6). Uma TFG diminuída e uma produção hepática aumentada de IGFBP-1 e IGFBP-2 contribuem para os níveis elevados das IGFBPs. Esses eventos, juntos, reduzem os efeitos diretos e indiretos do GH no crescimento das crianças com IRC. Além das anormalidades no eixo GH/IGF-1, distúrbios no eixo gonadotrófico têm sido descritos nos pacientes com DRC, sendo comum o atraso na progressão da puberdade e no estirão puberal de menor intensidade (7).
Tratamento da baixa estatura
O tratamento com GH deve ser considerado para os pacientes com controle adequado do déficit nutricional e das alterações metabólicas existentes. O uso de GH nestes pacientes foi aprovado, em 1994, nos Estados Unidos e, em 1995, na Europa. Os pacientes com IRC requerem doses maiores do que as crianças com deficiência de GH e, de acordo com os resultados de inúmeros estudos clínicos, a dose recomendada é de 0,35 mg/kg por semana (28 UI/m2 por semana ou 0,15 UI/kg/dia) (2).
Vários estudos clínicos têm demonstrado a eficácia e a segurança do tratamento com GH nas crianças com IRC. Em um estudo multicêntrico, Fine e cols. demonstraram os efeitos de dois anos de tratamento em crianças pré-púberes com IRC e baixa estatura. Houve melhora da estatura de -2,9 DP para -1,6 DP após os dois anos de tratamento (8). No estudo de Hokken-Koelega e cols., os pacientes atingiram altura no limite inferior da normalidade após três anos de terapia e atingiram a estatura-alvo com seis anos de tratamento (9). Analisando o ganho total de altura antes da puberdade, Haffner e cols. demonstraram aumento médio de 18,6 ± 9,3 cm nos meninos tratados por aproximadamente cinco anos, comparado com o crescimento de 9,9 ± 4,8 cm nos sem GH. Nas meninas, os valores correspondentes foram 16,6 ± 8,7 cm versus 9,1 ± 9,8 cm. Dois terços dos pacientes tratados atingiram estatura final acima do -1,88 DP (10).
Uma avaliação de 240 pacientes registrados no banco de dados do KIGS (Pfizer International Growth Database), com pacientes pré-púberes e púberes no início do tratamento, 45% dos pacientes em tratamento conservador, 28% em diálise e 27% após transplante renal, demonstrou os fatores preditivos da resposta ao tratamento com GH até altura próxima da final. A altura aumentou gradativamente durante todo o período de tratamento com aumento de 1,2 DP na altura nos meninos e 1,6 DP nas meninas. Os pacientes com maior atraso na puberdade foram os que tiveram maior comprometimento da altura final. A altura final também foi mais comprometida naqueles que iniciaram tratamento com GH já fazendo diálise (11). Resultados semelhantes foram publicados por Haffner e cols., que demonstraram aumento de 7,7 cm na previsão de altura adulta durante os primeiros três anos de tratamento. O aumento mais significativo ocorreu no grupo em tratamento conservador (10).
Nas crianças transplantadas, a resposta ao tratamento com GH pós-transplante está relacionada a vários fatores, como dose de glicocorticóide, TFG e alterações no eixo GH/IGF-1. Apesar de o tratamento com GH aumentar significativamente a velocidade de crescimento pós-transplante (12), a resposta é menor do que a observada nas crianças em IRC pré-transplante. Fine e Stablein demonstraram altura adulta média de -1,83 ± 0,14 DP nos pacientes transplantados que usaram GH comparado com -2,6 ± 0,05 DP nos que não receberam o tratamento com GH (13). Uma metanálise reforçou os efeitos benéficos do tratamento com GH nas crianças com DRC em diálise ou pós-transplante (14).
Além de promover o crescimento longitudinal, o hormônio do crescimento oferece outros benefícios importantes às crianças com IRC. Fine e cols. demonstraram os efeitos anabólicos relacionados ao GH, evidenciando aumento de peso e ganho de massa magra (15). Foi demonstrada melhora na qualidade de vida dessas crianças (16), além de melhora da densidade mineral óssea (17).
Segurança do hormônio do crescimento na DRC
Apesar de a segurança do tratamento demonstrada na maioria das publicações, alguns cuidados durante o tratamento com GH são particulares às crianças com DRC. A hipertensão intracraniana (HIC) benigna é raramente observada nas crianças com DRC em tratamento conservador, diálise ou pós-transplante, com ou sem GH. Entretanto, análise do banco de dados do KIGS demonstrou freqüência maior de HIC nos pacientes com DRC, comparado com as outras indicações de tratamento com GH (18). Apesar de pouco freqüente, recomenda-se realizar a fundoscopia de rotina antes e durante o tratamento com GH, principalmente se houver sintomas sugestivos de HIC. A intolerância à glicose e a resistência insulínica foram descritas, principalmente nos pacientes transplantados e em uso de glicocorticóide. Não há relato de diabetes melito irreversível (18). Apesar disso, aconselha-se monitoração rotineira do metabolismo da glicose. Já a epifisiólise e a necrose da cabeça do fêmur podem ser observadas em pacientes com DRC, independente do uso de GH (2,18). Fine e cols. não identificaram aumento de eventos adversos entre pacientes em tratamento conservador, diálise e portadores de aloenxertos tratados e não-tratados com GH (19). Em relação à função renal, não há evidências de deterioração da TFG com a terapia com o GH (2,18). Também é controverso o efeito do tratamento com GH sobre os aloenxertos renais, uma vez que o GH sendo uma substância moduladora do sistema imune poderia desencadear rejeição. Fine e cols., avaliando 63 crianças transplantadas, não demonstram nenhum caso de rejeição no primeiro ano de tratamento com GH, enquanto no grupo-controle ocorreu três casos de rejeição aguda (20). Não houve aumento na incidência de rejeição ou perda do enxerto quando analisado um grupo maior de pacientes com cinco anos de tratamento com GH (13).
TRATAMENTO COM GH NA ARTRITE JUVENIL IDIOPÁTICA
A baixa estatura é freqüente nos pacientes com AJI e ocorre tanto pelo processo inflamatório em si quanto pelo tratamento instituído, especialmente pelo uso de glicocorticóides. O comprometimento do crescimento depende da idade no início da doença, da gravidade da doença e do tempo e dose do glicocorticóide administrado. Os glicocorticóides, necessários para o controle da doença, agravam ainda mais a perda de altura destes pacientes (21). Zak e cols., avaliando a altura adulta de 65 pacientes com diferentes formas de AJI, demonstraram que 11% ficaram com altura final abaixo de -2 DP. Todos apresentavam a forma poliarticular da doença e receberam glicocorticódes (22). Simon e cols. relataram a altura final de 24 pacientes com AJI com início da doença em média aos 3,4 ± 2,4 anos. O tratamento com prednisona foi mantido pelo tempo médio de 13,6 ± 5,0 anos. A perda de altura foi de 2,7 ± 1,5 DP ocorrida principalmente durante os primeiros quatro anos de tratamento. Depois da suspensão da prednisona, 17 pacientes (70%) apresentaram alguma recuperação do crescimento. Entretanto, 87% apresentaram altura adulta abaixo do alvo familiar e 41% ficaram com altura abaixo de -2 DP (23). Os glicocorticóides interferem no eixo GH/IGF-1, diminuindo a secreção pulsátil do GH por aumento da somatostatina e também reduzem a expressão dos receptores de GH nos hepatócitos, causando certo grau de resistência ao GH com conseqüente diminuição dos níveis de IGF-1. Além disso, os glicocorticódes exercem ação direta sobre a placa de crescimento, diminuindo a proliferação dos condrócitos, estimulando a atividade dos osteoclastos, diminuindo a osteoblastogênese e aumentando a apoptose de osteoblastos maduros (24).
Tratamento com GH na AJI
Vários estudos têm mostrado melhora da velocidade de crescimento e da altura em pacientes com AJI tratados com GH (21,25). Certa variabilidade na resposta ao tratamento tem sido observada, porquanto em alguns casos o tratamento leva à recuperação do crescimento e em outros apenas previne a perda de altura geralmente observada durante o curso natural da doença. A variação da resposta ao tratamento correlaciona-se com o tipo de AJI (poliarticular ou sistêmica) e com a gravidade da doença. As doses variam de 0,33 a 0,46 mg/kg/semana (0,15 a 0,20 UI/kg/dia) (25). Bechtold e cols. demonstraram ganho médio de 1 DP na altura de 13 pacientes com AJI sistêmica ou poliarticular tratados com GH comparados com a perda de 0,7 DP no grupo não-tratado (26). Simon e cols. avaliaram 30 crianças com AJI grave, tratadas com GH na dose de 0,46 mg/kg/semana, 12 a 15 meses após o início da terapia com glicocorticóde. Após três anos de tratamento com GH, a altura no grupo tratado com GH era 0,37 ± 1,5 DP comparado a -0,96 ± 1,2 DP no grupo-controle. A média da velocidade de crescimento atingiu valores normais após um ano de tratamento com GH enquanto no grupo-controle diminuiu nos dois primeiros anos melhorando apenas no terceiro ano de acompanhamento. Os autores sugerem que o tratamento precoce com GH, antes de maior comprometimento da altura pela corticoterapia, é a melhor opção na tentativa de preservação da altura final (27).
Segurança do tratamento com GH
Dois aspectos devem ser observados: o impacto do tratamento com GH no curso da doença e o efeito diabetogênico do GH em crianças em uso de glicocorticóides em altas doses. Em relação ao primeiro, nenhuma mudança significativa no curso da AJI foi relatada nas diversas publicações (21,26,27). Os níveis de insulina foram maiores no grupo tratado com GH comparado com o grupo-controle (27) e alguns estudos mostraram pacientes com intolerância à glicose ou diabetes (21). Assim, pacientes em uso crônico de glicocorticóides em tratamento com GH devem ser monitorados rotineiramente quanto a glicemia, insulina e hemoglobina glicosilada, além da realização do teste oral de tolerância à glicose anualmente.
TRATAMENTO COM GH NA FIBROSE CÍSTICA
A fibrose cística (FC) é a doença autossômica letal mais comum em indivíduos caucasianos, com incidência de 1:2.500 nascidos vivos (28). A doença pulmonar e a insuficiência pancreática são as manifestações clínicas mais importantes. O comprometimento pulmonar favorece a ocorrência de infecções e a falência respiratória. A insuficiência pancreática exócrina acarreta má-absorção e desnutrição. Avanços no tratamento medicamentoso, incluindo antibioticoterapia e suporte nutricional intenso, têm melhorado o prognóstico da doença e aumentado o número de pacientes que vivem até a idade adulta (28). Entretanto, a altura e o peso dos pacientes com FC geralmente estão nos percentis mais baixos e o baixo peso é associado com o aumento da morbi e mortalidade (29).
O tratamento com GH tem sido proposto em crianças com FC para melhorar o crescimento e, também, na tentativa de melhorar as condições clínicas dos pacientes. Alguns autores sugerem condição de resistência ao GH nos pacientes com FC (30). O aumento das citoquinas pró-inflamatórias na doença levaria à diminuição na produção hepática de Igf-1, além de diminuir a bioatividade do IGF-1 circulante (31,32). Hardin e cols. avaliaram os efeitos do tratamento com GH em 19 pacientes pré-púberes com FC com estatura e peso abaixo do 10º percentil, todos com ingestão calórica adequada e sem deficiência de GH. Após um ano de tratamento houve melhora significativa da velocidade de crescimento e ganho de peso com aumento da massa magra. Além disso, os autores observaram diminuição do número de hospitalizações e da freqüência de antibioticoterapia endovenosa (33). Outro estudo avaliou os efeitos do tratamento com GH em pacientes com FC que recebiam suplementação nutricional enteral, mas com altura e peso abaixo do 10º percentil.
O tratamento com GH aumentou de maneira significativa a altura, o peso, a densidade mineral óssea, a massa magra e diminuiu o número de hospitalizações (34). Durante a puberdade, o tratamento com GH resultou aumento na velocidade de crescimento, maior ganho de peso, melhora do índice de massa corporal e do conteúdo mineral ósseo. Como nos estudos anteriores, houve melhora da função pulmonar e diminuição do número de hospitalizações. Outros estudos confirmam estes achados, porém a melhora na função pulmonar não foi confirmada em todos (35,36).
As doenças caracterizadas por inflamação crônica, como a FC, estão associadas à resistência à insulina mediada por citocinas pró-inflamatórias. A intolerância à glicose afeta cerca de 40% dos pacientes com FC e 10% a 15% dos pacientes apresentam diabetes (37). Nos estudos anteriormente citados, não foi observado desenvolvimento de intolerância à glicose ou diabetes durante o tratamento com GH, apesar de a concentração de insulina ser maior no grupo tratado (33).
Assim, o tratamento em curto prazo com GH em pacientes com FC parece melhorar o ganho de peso e o crescimento, aumentar a massa magra, melhorar a qualidade mineral óssea e a qualidade de vida. A melhora da função pulmonar ainda é discutível. Entretanto, mais estudos são necessários para avaliar a eficácia e a segurança do tratamento com GH em crianças com FC.
TRATAMENTO COM GH NA DOENÇA INFLAMATÓRIA INTESTINAL
O déficit de crescimento é uma complicação freqüente em crianças com doença inflamatória intestinal. Tem sido observado em mais de 88% das crianças afetadas, mais freqüentemente na doença de Crohn do que na colite ulcerativa. Caracteriza-se por ser multifatorial: efeito do processo inflamatório com produção de TNF, IL-1 e IL-6, entre outras citocinas, redução da ingestão alimentar, má-absorção intestinal, perdas intestinais excessivas, aumento do gasto energético e uso crônico de corticóides. Pelo menos 30% dos pacientes têm redução da velocidade de crescimento antes de qualquer perda de peso. Além disso, os pacientes costumam apresentar puberdade atrasada com idade óssea também atrasada (38).
Doença de Crohn
A doença de Crohn é uma das formas mais comuns de doença inflamatória intestinal e caracteriza-se por inflamação crônica e recidivante de uma ou mais partes do tubo digestivo. O diagnóstico pode ser difícil, uma vez que os sintomas iniciais costumam ser principalmente extra-intestinais, como anorexia, perda de peso, déficit de crescimento, febre e anemia ferropriva (39). Cezard e cols. observaram que 30% a 40% dos pacientes com doença de Crohn até 18 anos de idade apresentavam peso e estatura abaixo do esperado, idade óssea atrasada e atraso da maturação sexual. O déficit de estatura foi observado em 40% dos pacientes antes do início dos sintomas específicos da doença intestinal e em 60% no momento do diagnóstico (40). Em um grupo de 123 pacientes com doença de Crohn atendidos em centro especializado e recebendo nutrição enteral, Sawczenko e cols. demonstraram prognóstico favorável do crescimento durante o período de crescimento até atingir a altura adulta. Aproximadamente 20% dos pacientes ficaram com altura final mais de 8 cm abaixo do alvo familiar, sendo mais comprometidos aqueles que já apresentavam baixa estatura no diagnóstico da doença e aqueles com comprometimento de jejuno (41). A suplementação nutricional adequada e a ressecção cirúrgica da porção intestinal acometida levam à melhora do crescimento, porém alguns pacientes não conseguem recuperar totalmente o crescimento (42).
Alguns estudos têm demonstrado os efeitos do tratamento com GH nestes pacientes. Mauras e cols. avaliaram 10 pacientes com doença de Crohn e uso crônico de corticóide, demonstraram os efeitos benéficos nos pacientes córtico-dependentes. Todos receberam GH na dose de 0,05 mg/kg/dia. A velocidade de crescimento passou de 3,5 cm/ano quando os pacientes estavam recebendo apenas prednisona para 7,7 cm/ano após seis meses de associação com GH, com aumento significativo nos níveis séricos de IGF-1 e IGFBP-3. A composição corporal mudou favoravelmente com o aumento da massa magra e a diminuição da massa gorda. Também houve melhora no metabolismo ósseo sem comprometimento do metabolismo de carboidratos (43). Já Wong e cols., avaliando retrospectivamente a resposta ao GH em sete pacientes com doença de Crohn, demonstraram aumento da velocidade de crescimento e parada da deterioração do crescimento, porém sem diferença significativa no DP da altura após 12 meses de tratamento. Entretanto, a idade média no início do tratamento com GH era de 15,9 anos, apesar de o atraso da idade óssea (44). Mais estudos são necessários para confirmar a eficácia e o melhor esquema terapêutico para estes pacientes.
Doença celíaca
A doença celíaca é uma condição auto-imune que ocorre em pacientes geneticamente suscetíveis, caracterizada por inflamação da mucosa do intestino delgado após ingestão de glúten (trigo, cevada, centeio). Ocorre atrofia das vilosidades intestinais que resulta má-absorção intestinal. O diagnóstico é confirmado pelo padrão histológico na biópsia intestinal e remissão clínica após instituição de dieta isenta de glúten. Algumas crianças podem permanecer assintomáticas por longos períodos, outras apresentam sintomas gastrintestinais sutis, como constipação, dor abdominal recorrente, náuseas ou vômitos. A baixa estatura pode ser considerada uma característica dominante da doença celíaca e, muitas vezes, o único sintoma da doença (45). A dieta adequada geralmente leva à recuperação do crescimento, sendo a recuperação do peso mais rápida, geralmente nos primeiros seis meses de dieta. Já a recuperação da altura é mais lenta e pode levar até dois anos. O período de recuperação do crescimento varia na dependência da extensão da doença, da idade do paciente e da intensidade do déficit de crescimento em relação à estatura familiar. Alguns pacientes apresentam características laboratoriais de deficiência de GH que devem normalizar após o início da dieta. Quando não ocorre normalização do crescimento com a dieta adequada, a deficiência de GH pode estar associada (46). Na avaliação de Giovenale e cols. (47), 16 pacientes de um grupo de 60 apresentavam deficiência de GH associada à doença celíaca. Uma possibilidade é que ocorra formação de anticorpos anti-hipófise em crianças com doença celíaca, levando à deficiência de GH associada (47). Como a doença em si pode simular situação de deficiência de GH, recomenda-se que a investigação seja feita apenas após a instituição da dieta sem glúten e comprovação da não recuperação do crescimento. Comprovada a deficiência, o tratamento com GH está indicado e a resposta ao tratamento é semelhante à observada em pacientes com deficiência de GH idiopática (48).
TRATAMENTO COM GH NAS DOENÇAS HEMATOLÓGICAS CRÔNICAS
Os pacientes com doenças hematológicas crônicas na infância costumam apresentar déficit de crescimento e atraso no desenvolvimento da puberdade. Zemel e cols. avaliaram longitudinalmente 148 crianças com anemia falciforme. Os autores demonstraram diminuição do crescimento, peso ou índice de massa corporal em 84% dos pacientes entre os 10 e 15 anos de idade, porquanto 38% dos pacientes ficaram abaixo do quinto percentil em pelo menos um destes parâmetros (49). Outro estudo avaliou 110 pacientes com anemia falciforme e 72 pacientes com talassemia em protocolo de transfusão sangüínea e quelação de ferro, com concentração de hemoglobina sempre maior que 9 g/dl. Destes, 51% dos pacientes com falciforme e 56% dos talassêmicos apresentavam velocidade de crescimento abaixo de -1 DP. Já 49% dos talassêmicos e 27% dos pacientes com falciforme apresentavam estatura menor do que -2 DP. Quanto maior a concentração de ferritina sérica, melhor a velocidade de crescimento (50).
A patogênese dos distúrbios do crescimento nestes pacientes é complexa. As anemias hemolíticas podem evoluir com alterações hormonais em decorrência da acentuada afinidade da hipófise para a deposição de ferro. Pacientes com anemia falciforme podem apresentar deficiência de GH em decorrência da injúria hipóxico-vascular do eixo hipotalámo-hipofisário após alguns episódios de crise vasooclusiva. Nos pacientes com talassemia major, a hipóxia tecidual crônica associada à sobrecarga de ferro, deficiência de zinco e os efeitos tóxicos da terapia de quelação de ferro podem comprometer a secreção hormonal (51,52). Ainda na talassemia, o comprometimento hepático pode levar à situação de resistência ao GH com diminuição da produção de IGF-1 (53). Em virtude dos avanços recentes no manejo destas doenças, o retardo de crescimento permanece como uma das principais complicações, em associação com o atraso da puberdade (52).
O tratamento com GH tem sido sugerido como opção terapêutica, especialmente para os pacientes com talassemia. Cavallo e cols. demonstraram a altura final em 25 pacientes com talassemia major politransfundidos e com diminuição da secreção de GH. Os pacientes foram tratados por 3,3 ± 1,2 anos com GH na dose de 0,2 mg/kg/semana (aproximadamente 0,09 UI/kg/dia). Todos os pré-púberes no início do tratamento, com idade média de 13,6 ± 2,0 anos. Apesar de a altura para a idade cronológica ter melhorado, os autores não observaram melhora da altura final para a idade óssea. Aproximadamente metade dos pacientes iniciou a puberdade durante o tratamento com GH e a dose ficou abaixo da recomendada para deficientes de GH (54). Já Masala e cols. (55) e Wu, Tsai e Peng (56) encontraram resultados mais promissores com melhora da velocidade de crescimento e dos níveis de IGF-1 durante todo o período de tratamento. O tratamento com GH nestes pacientes parece ser seguro e levam à certa recuperação do crescimento, porém mais estudos são necessários para mostrar os benefícios desta indicação.
Conflito de interesses
O autor MCSB é membro do Strategic Advisory Board, Pfizer International.
Recebido em 1/5/2008
Aceito em 20/5/2008
- 1. MacRae VE, Wong SC, Farquharson C, Ahmed SF. Cytokine actions in growth disorders associated with pediatric chronic inflammatory diseases (review). Int J Mol Med. 2006; 18(6):1011-8.
- 2. Mahan JD, Warady BA. Assessment and treatment of short stature in pediatric patients with chronic kidney disease: a consensus statement. Pediatr Nephrol. 2006;21(7):917-30.
-
3North American Pediatric Renal Trials and Collaborative Studies (NAPRTCS): annual report. Renal transplantation, dialysis, chronic renal insufficiency. 2006. Disponível em: https://web.emmes.com/study/ped/annlrept/annlrept2006.pdf
- 4. Seikaly MG, Salhab N, Gipson D, Yiu V, Stablein D. Stature in children with chronic kidney disease: analysis of NAPRTCS database. Pediatr Nephrol. 2006;21(6):793-9.
- 5. Mahesh S, Kaskel F. Growth hormone axis in chronic kidney disease. Pediatr Nephrol. 2008;23(1):41-8.
- 6. Tönshoff B, Kiepe D, Ciarmatori S. Growth hormone/insulin-like growth factor system in children with chronic renal failure. Pediatr Nephrol. 2005;20:279-89.
- 7. Schaefer F, Veldhuis JD, Robertson WR, Dunger D, Scharer K. Immunoreactive and bioactive luteinizing hormone in pubertal patients with chronic renal failure. Cooperative Study Group on Pubertal Development in Chronic Renal Failure. Kidney Int. 1994;45:1465-76.
- 8. Fine RN, Kohaut EC, Brown D, Perlman AJ. Growth after recombinant human growth hormone treatment in children with chronic renal failure: report of a multicenter randomized double-blind placebo-controlled study. Genentech Cooperative Study Group. J Pediatr. 1994;124:374-82.
- 9. Hokken-Koelega A, Mulder P, De Jong R, Lilien M, Donckerwolcke R, Groothof J. Long-term effects of growth hormone treatment on growth and puberty in patients with chronic renal insufficiency. Pediatr Nephrol. 2000;14:701-6.
- 10. Haffner D, Schaefer F, Nissel R, Wuhl E, Tönshoff B, Mehls O. Effects of growth hormone treatment on the adult height of children with chronic renal failure. German Study Group for Growth Hormone Treatment in Chronic Renal Failure. N Engl J Med. 2000;343:923-30.
- 11. Nissel R, Lindberg A, Mehls O, Haffner D. On behalf of the Pfizer International Growth Database (KIGS) International Board. Factors Predicting the Near-Final Height in Growth Hormone-Treated Children and Adolescents with Chronic Kidney Disease. J Clin Endocrinol Metab. 2008;93(4):1359-65.
- 12. Guest G, Berard E, Crosnier H, Chevallier T, Rappaport R, Broyer M. Effects of growth hormone in short children after renal transplantation. French Society of Pediatric Nephrology. Pediatr Nephrol. 1998;12:437-46.
- 13. Fine RN, Stablein D. Long-term use of recombinant human growth hormone in pediatric allograft recipients: a report of the NAPRTCS transplant registry. Pediatr Nephrol. 2005; 20:404-8.
- 14. Vimalachandra D, Craig JC, Cowell CT, Knight JF. Growth hormone treatment in children with chronic renal failure: a meta-analysis of randomized controlled trials. J Pediatr. 2001;139: 560-7.
- 15. Fine RN, Yadin O, Moulton L, Nelson PA, Boechat MI, Lippe BM. Five years experience with recombinant human growth hormone treatment of children with chronic renal failure. J Pediatr Endocrinol Metab. 1994;7:1-12.
- 16. Stabler B, Clopper RR, Siegel PT, Stoppani C, Compton PG, Underwood LE. Academic achievement and psychological adjustment in short children. The National Cooperative Growth Study. J Dev Behav Pediatr. 1994;15:1-6.
- 17. van Dyck M, Gyssels A, Proesmans W, Nijs J, Eeckels R. Growth hormone treatment enhances bone mineralization in children with chronic renal failure. Eur J Pediatr. 2001; 160:359-63.
- 18. Mehls O, Lindberg A, Nissel R, Wühl E, Schaefer F, Tönshoff B, et al. Growth hormone treatment in short children with chronic kidney disease. In: Ranke MB, Price DA, Reiter EO, editors. Growth hormone therapy in pediatrics - 20 years of KIGS. Basel: Karger; 2007.
- 19. Fine RN, Kohaut E, Brown D, Kuntze J, Attie KM. Long-term treatment of growth retarded children with chronic renal insufficiency, with recombinant human growth hormone. Kidney Int. 1996;49:781-5.
- 20. Fine RN, Stablein D, Cohen AH, Tejani A, Kohaut E. Recombinant human growth hormone post-renal transplantation in children: a randomized controlled study of the NAPRTCS. Kidney Int. 2002;62:688-96.
- 21. Simon D, Lucidarme N, Prieur AM, Ruiz JC, Czernichow P. Linear growth in children suffering from juvenile idiopathic arthritis requiring steroid therapy: natural history and effects of growth hormone treatment on linear growth. J Pediatr Endocrinol Metab. 2001;14 Suppl 6:1483-6.
- 22. Zak M, Müller J, Karup Pedersen F. Final height, armspan, subischial leg length and body proportions in juvenile chronic arthritis. A long-term follow-up study. Horm Res. 1999; 52(2):80-5.
- 23. Simon D, Fernando C, Czernichow P, Prieur AM. Linear growth and final height in patients with systemic juvenile idiopathic arthritis treated with longterm glucocorticoids. J Rheumatol. 2002;29(6):1296-300.
- 24. Stratakis CA. Cortisol and growth hormone: clinical implications of a complex, dynamic relationship. Pediatr Endocrinol Rev. 2006;3 Suppl 2:333-8.
- 25. Simon D. Management of growth retardation in juvenile idiopathic arthritis. Horm Res. 2007;68 Suppl 5:122-5.
- 26. Bechtold S, Ripperger P, Dalla Pozza R, Bonfig W, Häfner R, Michels H, et al. Growth hormone increases final height in patients with juvenile idiopathic arthritis: data from a randomized controlled study. J Clin Endocrinol Metab. 2007; 92(8):3013-8
- 27. Simon D, Prieur AM, Quartier P, Charles Ruiz J, Czernichow P. Early recombinant human growth hormone treatment in glucocorticoid-treated children with juvenile idiopathic arthritis: a 3-year randomized study. J Clin Endocrinol Metab. 2007; 92(7):2567-73.
- 28. Ratjen F, Doring G. Cystic fibrosis. Lancet. 2003;361:681-9.
- 29. Sinaasappel M, Stern M, Littlewood J, Wolfe S, Steinkamp G, Heijerman HG, et al. Nutrition in patients with cystic fibrosis: a european consensus. J Cyst Fibros. 2002;1(2):51-75.
- 30. Laursen EM, Lanng S, Rasmussen MH, Koch C, Skakkebaek NE, Müller J. Normal spontaneous and stimulated GH levels despite decreased IGF-I concentrations in cystic fibrosis patients. Eur J Endocrinol. 1999;140(4):315-21.
- 31. Boguszewski MC, Kamoi TO, Bento Radominski R, Boguszewski CL, Rosberg S, Filho NA, et al. Insulin-like growth factor-1, leptin, body composition, and clinical status interactions in children with cystic fibrosis. Horm Res. 2007; 67(5):250-6.
- 32. Street MA, Ziveri MA, Spaggiari C, Viani I, Volta C, Grzincich GL, et al. Inflammation is a modulator of the insulin-like growth factor (IGF)/IGF-binding protein system inducing reduced bioactivity of IGFs in cystic fibrosis. Eur J Endocrinol. 2006;154:47-52
- 33. Hardin DS, Ellis KJ, Dyson M, Rice J, McConnell R, Seilheimer DK. Growth hormone improves clinical status in prepubertal children with cystic fibroses: results of a randomized controlled trial. J Pediatr. 2001;139(5):636-42.
- 34. Hardin DS, Rice J, Ahn C, Ferkol T, Howenstine M, Spears S, et al. Growth hormone treatment enhances nutrition and growth in children with cystic fibrosis receiving enteral nutrition. J Pediatr. 2005;146(3):303-5.
- 35. Schibler A, von der Heiden R, Birrer P, Mullis PE. Prospective randomized treatment with recombinant human growth hormone in cystic fibrosis. Arch Dis Child. 2003;88:1078-81.
- 36. Schnabel D, Grasemann C, Staab D, Wollmann H, Ratjen F. German cystic fibrosis growth hormone study group. A multicenter, randomized, double- blind, placebo-controlled trial to evaluate the metabolic and respiratory effects of growth hormone in children with cystic fibrosis. Pediatrics. 2007(6):1230-8.
- 37. Costa M, Potvin S, Berthiaume Y, Gauthier L, Jeanneret A, Lavoie A, et al. Diabetes: a major co-morbidity of cystic fibrosis. Diabetes Metab. 2005;31:221-32.
- 38. Shamir R, Phillip M, Levine A. Growth retardation in pediatric Crohn's disease: pathogenesis and interventions. Inflamm Bowel Dis. 2007;13(5):620-8.
- 39. Ponsky T, Hindle A, Sandler A. Inflammatory bowel disease in the pediatric patient. Surg Clin North Am. 2007;87(3):643-58.
- 40. Cezard JP, Touati G, Alberti C, Hugot JP, Brinon C, Czernichow P. Growth in paediatric Crohn's disease. Horm Res. 2002;58 Suppl 1:11-5.
- 41. Sawczenko A, Ballinger AB, Savage MO, Sanderson IR. Clinical features affecting final adult height in patients with pediatric-onset Crohn's disease. Pediatrics. 2006 Jul;118(1):124-9.
- 42. Beattie RM, Camacho-Hübner C, Wacharasindhu S, Cotterill AM, Walker-Smith JA, Savage MO. Responsiveness of IGF-I and IGFBP-3 to therapeutic intervention in children and adolescents with Crohn's disease. Clin Endocrinol. 1998;49(4):483-9.
- 43. Mauras N, George D, Evans J, Milov D, Abrams S, Rini A, et al. Growth hormone has anabolic effects in glucocorticosteroid-dependent children with inflammatory bowel disease: a pilot study. Metabolism. 2002;51(1):127-35.
- 44. Wong SC, Hassan K, McGrogan P, Weaver LT, Ahmed SF. The effects of recombinant human growth hormone on linear growth in children with Crohn's disease and short stature. J Pediatr Endocrinol Metab. 2007;20(12):1315-24.
- 45. Tully MA. Pediatric celiac disease. Gastroenterol Nurs. 2008;31(2):132-40.
- 46. Giovenale D, Meazza C, Cardinale GM, Sposito M, Mastrangelo C, Messini B, et al. The prevalence of growth hormone deficiency and celiac disease in short children. Clin Med Res. 2006;4(3):180-3.
- 47. Giovenale D, Meazza C, Cardinale GM, Farinelli E, Mastrangelo C, Messini B, et al. Growth hormone treatment in prepubertal children with celiac disease and growth hormone deficiency. J Pediatr Gastroenterol Nutr. 2007;45(4):433-7.
- 48. Iughetti L, De Bellis A, Predieri B, Bizzarro A, De Simone M, Balli F, et al. Growth hormone impaired secretion and antipituitary antibodies in patients with coeliac disease and poor catch-up growth after a long gluten-free diet period: a causal association? Eur J Pediatr. 2006;165(12):897-903.
- 49. Zemel BS, Kawchak DA, Ohene-Frempong K, Schall JI, Stallings VA. Effects of delayed pubertal development, nutritional status, and disease severity on longitudinal patterns of growth failure in children with sickle cell disease. Pediatr Res. 2007;61(5 Pt 1):607-13.
- 50. Soliman AT, elZalabany M, Amer M, Ansari BM. Growth and pubertal development in transfusion-dependent children and adolescents with thalassaemia major and sickle cell disease: a comparative study. J Trop Pediatr. 1999;45(1):23-30.
- 51. Hauschild M, Theintz G. Severe chronic anemia and endocrine disorders in children. Rev Med Suisse. 2007;3(107):988-91.
- 52. De Sanctis V, Eleftheriou A, Malaventura C. Thalassaemia International Federation Study Group on Growth and Endocrine Complications in Thalassaemia. Prevalence of endocrine complications and short stature in patients with thalassaemia major: a multicenter study by the Thalassaemia International Federation (TIF). Pediatr Endocrinol Rev. 2004;2 Suppl 2:249-55.
- 53. Karamifar H, Karimi M, Amirhakimi G, Sharbatialaei M, De Sanctis V. Reduced insulin growth factor I concentrations in iron-overloaded beta thalassaemic patients with normal growth hormone secretion and liver function. Pediatr Endocrinol Rev. 2004;2 Suppl 2:256-8.
- 54. Cavallo L, De Sanctis V, Cisternino M, Caruso Nicoletti M, Galati MC, Acquafredda A, et al. Final height in short polytransfused thalassemia major patients treated with recombinant growth hormone. J Endocrinol Invest. 2005;28(4):363-6.
- 55. Masala A, Atzeni MM, Alagna S, Gallisai D, Burrai C, Mela MG, et al. Growth hormone secretion in polytransfused prepubertal patients with homozygous beta-thalassemia. Effect of long-term recombinant GH (recGH) therapy. J Endocrinol Invest. 2003;26(7):623-8.
- 56. Wu KH, Tsai FJ, Peng CT. Growth hormone (GH) deficiency in patients with beta-thalassemia major and the efficacy of recombinant GH treatment. Ann Hematol. 2003;82(10):637-40.
Datas de Publicação
-
Publicação nesta coleção
22 Ago 2008 -
Data do Fascículo
Jul 2008
Histórico
-
Aceito
20 Maio 2008 -
Recebido
01 Maio 2008