Resumos
JUSTIFICATIVA E OBJETIVOS: A cirurgia cardíaca é a especialidade cirúrgica que com mais freqüência está associada a sangramento, coagulopatia e necessidade de derivados de sangue. Os agentes farmacológicos aprotinina, ácido epsilon-aminocapróico e ácido tranexâmico são os mais utilizados para auxiliar na hemostasia dos pacientes submetidos à circulação extracorpórea. O objetivo deste trabalho foi apresentar a fisiopatologia do sangramento em cirurgia cardíaca e a atual situação dos antifibrinolíticos quanto à sua eficácia e complicações quando usados nesses procedimentos, dando maior ênfase ao ácido tranexâmico e à aprotinina. CONTEÚDO: São discutidos os mecanismos pelos quais a circulação extracorpórea provoca alteração na hemostasia e de que maneira os antifibrinolíticos agem para diminuir o sangramento e o uso de sangue alogênico em cirurgia cardíaca. É dada ênfase ao problema do tromboembolismo que pode ocorrer com o emprego desses antifibrinolíticos, com revisão da literatura. CONCLUSÃO: A fibrinólise é um dos principais fatores relacionados com o aumento do sangramento em cirurgia cardíaca com circulação extracorpórea. A inibição da fibrinólise, juntamente com a preservação da função plaquetária, é, provavelmente, o mecanismo pelo qual os antifibrinolíticos diminuem o sangramento. O emprego desses fármacos reduz o sangramento em cirurgia cardíaca com circulação extracorpórea num percentual que pode chegar a 50%. Com relação à preocupação com o tromboembolismo, os ácidos tranexâmico e epsilon-aminocapróico são opções que oferecem maior segurança que a aprotinina.
CIRURGIA, Cardíaca; DROGAS, Antifibrinolíticos; SANGUE
JUSTIFICATIVA Y OBJETIVOS: La cirugía cardiaca es la especialidad quirúrgica que más frecuentemente está asociada al sangramiento, cuagulopatía y con necesidad de derivados de sangre. Los agentes farmacológicos aprotinina, ácido epsilon-aminocapróico y el ácido tranexámico son los más utilizados para auxiliar en la hemostasia de los pacientes sometidos a la circulación extracorpórea. El objetivo de este trabajo fue presentar la fisiopatología del sangramiento en cirugía cardiaca y la actual situación de los antifibrinolíticos en cuanto a su eficacia y complicaciones cuando usados en estos procedimientos dando más énfasis al ácido tranexámico y a la aprotinina. CONTENIDO: Son discutidos los mecanismos por los cuales la circulación extracorpórea provoca alteración en la hemostasia y de que manera los antifibrinolíticos actúan para disminuir el sangramiento y el uso de sangre alogénica en cirugía cardiaca. Se le da énfasis al problema del trombo embolismo que puede ocurrir con el uso de esos antifibrinolíticos, con revisión de la literatura. CONCLUSIONES: La fibrinólisis es uno de los principales factores relacionados con el aumento del sangramiento en cirugía cardiaca con circulación extracorpórea. La inhibición de la fibrinólisis, conjuntamente con la preservación de la función plaquetaria es probablemente el mecanismo por el cual los antifibrinolíticos disminuyen el sangramiento. El uso de esos fármacos reduce el sangramiento en cirugía cardiaca con circulación extracorpórea en un porcentaje que puede alcanzar el 50%. Con relación a la preocupación con el trombo embolismo, el ácido tranexámico y el ácido epsilon-aminocapróico son opciones que ofrecen una mayor seguridad que la aprotinina.
BACKGROUND AND OBJECTIVES: Cardiac surgery is the surgical subspecialty most often associated with bleeding, bleeding disorders, and the need of blood products. Agents such as aprotinin, episilon-aminocaproic acid, and tranexamic acid are frequently used to aid the hemostasis of patients undergoing cardiopulmonary bypass. The objective of this report is to present the physiopathology of bleeding during cardiac surgeries and the current role of antifibrinolytics regarding their efficacy and complications when used in those procedures, with emphasis on tranexamic acid and aprotinin. CONTENTS: The mechanisms of changes in hemostasis caused by cardiopulmonary bypass, how antifibrinolytics decrease bleeding, and the use of alogenic blood in cardiac surgery are discussed. A review of the literature emphasizes the thromboembolism secondary to the use of those antifibrinolytics. CONCLUSION: Fibrinolysis is one of the main factors related with increased bleeding during cardiac surgery with cardiopulmonary bypass. Inhibition of fibrinolysis associated with the preservation of platelet function is, probably, the mechanism by which anti-fibrinolytics decrease bleeding. Those agents reduce bleeding in up to 50% in cardiac surgeries with cardiopulmonary bypass. Tranexamic acid and episilon-aminocaproic acid are safer than aprotinin in the prevention of thromboembolism.
BLOOD; DRUGS, Antifibrinolytic agents; SURGERY, Cardiac
ARTIGO DE REVISÃO
Antifibrinolíticos e cirurgia cardíaca com circulação extracorpórea* Endereço para correspondência: Unidade de Pesquisa do IC/FUC Dr. Ari-Tadeu L. Santos Av. Princesa Isabel, 370, Santana 90620-001 Porto Alegre, RS E-mail: editoracao-pc@cardiologia.org.br
Antifibrinolíticos y cirugía cardíaca con circulación extracorpórea
Ari-Tadeu Lírio dos Santos, TSAI; João Carlos Splettstosser, TSAII; Paulo WarpechowskiIII; Mariana Mariz Pinto GaidzinskiIV
IMestre em Ciências da Saúde pelo IC/FUC; Co-Responsável pelo CET/SBA do SANE
IIInstrutor do CET/SBA do SANE
IIIAnestesiologista do SANE
IVME2 do CET/SBA do SANE
Endereço para correspondência Endereço para correspondência: Unidade de Pesquisa do IC/FUC Dr. Ari-Tadeu L. Santos Av. Princesa Isabel, 370, Santana 90620-001 Porto Alegre, RS E-mail: editoracao-pc@cardiologia.org.br
RESUMO
JUSTIFICATIVA E OBJETIVOS: A cirurgia cardíaca é a especialidade cirúrgica que com mais freqüência está associada a sangramento, coagulopatia e necessidade de derivados de sangue. Os agentes farmacológicos aprotinina, ácido epsilon-aminocapróico e ácido tranexâmico são os mais utilizados para auxiliar na hemostasia dos pacientes submetidos à circulação extracorpórea. O objetivo deste trabalho foi apresentar a fisiopatologia do sangramento em cirurgia cardíaca e a atual situação dos antifibrinolíticos quanto à sua eficácia e complicações quando usados nesses procedimentos, dando maior ênfase ao ácido tranexâmico e à aprotinina.
CONTEÚDO: São discutidos os mecanismos pelos quais a circulação extracorpórea provoca alteração na hemostasia e de que maneira os antifibrinolíticos agem para diminuir o sangramento e o uso de sangue alogênico em cirurgia cardíaca. É dada ênfase ao problema do tromboembolismo que pode ocorrer com o emprego desses antifibrinolíticos, com revisão da literatura.
CONCLUSÃO: A fibrinólise é um dos principais fatores relacionados com o aumento do sangramento em cirurgia cardíaca com circulação extracorpórea. A inibição da fibrinólise, juntamente com a preservação da função plaquetária, é, provavelmente, o mecanismo pelo qual os antifibrinolíticos diminuem o sangramento. O emprego desses fármacos reduz o sangramento em cirurgia cardíaca com circulação extracorpórea num percentual que pode chegar a 50%. Com relação à preocupação com o tromboembolismo, os ácidos tranexâmico e epsilon-aminocapróico são opções que oferecem maior segurança que a aprotinina.
Unitermos: CIRURGIA, Cardíaca: circulação extracorpórea, DROGAS, Antifibrinolíticos: aprotinina, ácido epsilon-aminocapróico, ácido tranexâmico; SANGUE: coagulação.
RESUMEN
JUSTIFICATIVA Y OBJETIVOS: La cirugía cardiaca es la especialidad quirúrgica que más frecuentemente está asociada al sangramiento, cuagulopatía y con necesidad de derivados de sangre. Los agentes farmacológicos aprotinina, ácido epsilon-aminocapróico y el ácido tranexámico son los más utilizados para auxiliar en la hemostasia de los pacientes sometidos a la circulación extracorpórea. El objetivo de este trabajo fue presentar la fisiopatología del sangramiento en cirugía cardiaca y la actual situación de los antifibrinolíticos en cuanto a su eficacia y complicaciones cuando usados en estos procedimientos dando más énfasis al ácido tranexámico y a la aprotinina.
CONTENIDO: Son discutidos los mecanismos por los cuales la circulación extracorpórea provoca alteración en la hemostasia y de que manera los antifibrinolíticos actúan para disminuir el sangramiento y el uso de sangre alogénica en cirugía cardiaca. Se le da énfasis al problema del trombo embolismo que puede ocurrir con el uso de esos antifibrinolíticos, con revisión de la literatura.
CONCLUSIONES: La fibrinólisis es uno de los principales factores relacionados con el aumento del sangramiento en cirugía cardiaca con circulación extracorpórea. La inhibición de la fibrinólisis, conjuntamente con la preservación de la función plaquetaria es probablemente el mecanismo por el cual los antifibrinolíticos disminuyen el sangramiento. El uso de esos fármacos reduce el sangramiento en cirugía cardiaca con circulación extracorpórea en un porcentaje que puede alcanzar el 50%. Con relación a la preocupación con el trombo embolismo, el ácido tranexámico y el ácido epsilon-aminocapróico son opciones que ofrecen una mayor seguridad que la aprotinina.
INTRODUÇÃO
O sangramento excessivo ainda constitui uma complicação grave em cirurgia cardíaca. Quando ocorre, pode causar aumento da morbidade e mortalidade. Além disso, o sangramento e a reintervenção provocam aumento dos custos do tratamento. Há maior consumo de componentes e derivados do sangue, aumento do tempo cirúrgico e pode estar associado a maior tempo na unidade de pós-operatório e internação hospitalar. Embora a freqüência e os critérios para transfusão sangüínea não sejam uniformes entre os serviços de cirurgia cardíaca, cerca de 60% a 75% dos pacientes recebem transfusão 1,2. A ocorrência de reintervenção por sangramento nesses tipos de procedimento é de 2% a 6%, com mortalidade de 10% a 22% 3,4.
As causas mais freqüentes de sangramento são hemostasia cirúrgica inadequada ou alteração da hemostasia em conseqüência da circulação extracorpórea (CEC).
Pelos motivos citados, várias estratégias têm sido desenvolvidas com a finalidade de evitar o sangramento excessivo e diminuir o número de transfusões.
Essas estratégias podem ser divididas em farmacológicas e não-farmacológicas. Das farmacológicas, as estratégias mais estudadas e empregadas são as que utilizam os antifibrinolíticos: ácido tranexâmico (AT), ácido epsilon aminocapróico (AEAC) e a aprotinina. Doação pré-operatória autóloga, recuperação de hemácias por centrifugação intra-operatória e hemodiluição normovolêmica são as estratégias não-farmacológicas mais empregadas.
HEMOSTASIA NORMAL
A resposta hemostática normal compreende três fases: hemostasia primária, coagulação e fibrinólise. A hemostasia primária, que depende fundamentalmente das plaquetas e a sua interação com o vaso, tem início logo após a ruptura vascular, com o objetivo de formar o tampão plaquetário para estancar, por algum tempo, o sangramento. A coagulação reforça esse tampão friável, com a formação de fibrina. Esse processo necessita de até quatro horas e estanca o sangramento enquanto ocorre a cicatrização do vaso. A fibrinólise, que ocorre após 24 horas, remove o coágulo e permite a restauração do fluxo sangüíneo no segmento vascular afetado.
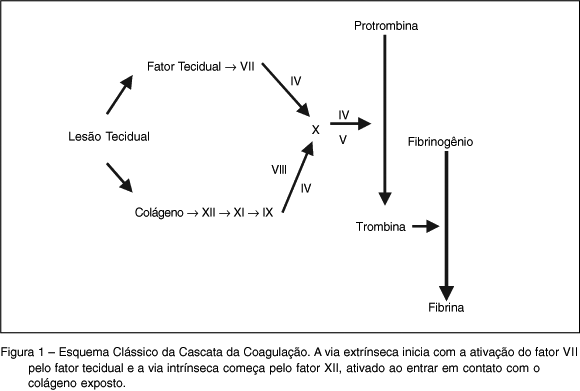
A coagulação forma a rede de fibrina que estabiliza o tampão plaquetário. Essa fase é dividida, didaticamente, em duas vias: via intrínseca, ou via do fator de contato, e via extrínseca, ou via do fator tecidual (FT) (Figura 1). A divisão rígida das duas vias perdeu importância porque ocorre participação de fatores nas duas vias ao mesmo tempo. É importante ressaltar que, in vitro, a ativação da coagulação pode ocorrer por qualquer uma dessas vias. A via extrínseca é ativada quando o FT é exposto devido à lesão vascular 5, fase em que participam o fator V e o fator X e é chamada de via comum, ou fase final da cascata de coagulação, cujo objetivo é formar a trombina (Figura 1).
Atualmente é aceito que o início da coagulação ocorre quando o FT é exposto ao espaço intravascular após a lesão do endotélio ou pela liberação de citocinas. Esse fator liga-se ao fator VII ativado (FVIIa) que corresponde a 1% de todo fator VII circulante. O complexo FT-FVIIa ativa o fator X (FXa) e o fator IX (FIXa). O FXa, por sua vez, ativa o fator V (FVa). Esses dois fatores também formam um complexo que tem como resultado final a formação de pequena quantidade de trombina. Essa trombina formada é capaz de ativar plaquetas, fator VIII, fator V e fator XI. A superfície da plaqueta ativada serve como local onde o complexo FVIIIa-FIXa ativa o fator X com eficiência 50 vezes maior que o complexo FT-FVIIa. O FXa liga-se ao FVa em outro local da superfície plaquetária formando o complexo protrombinase, que é capaz de formar grandes quantidades de trombina a partir do FXa 6. A trombina converte fibrinogênio em fibrina, promove a ativação plaquetária e ativa o fator XIII, responsável pela polimerização da fibrina, que torna o coágulo mais resistente.
Além desse mecanismo, denominado via extrínseca, que inicia a coagulação em resposta ao trauma, há outra via que envolve o fator XII, cininogênios de alto peso molecular, pré-calicreína e fator XI com posterior ativação do fator IX. A importância dessa via ainda não é bem entendida, porque a deficiência do fator XII não provoca alteração da coagulação. Pelo contrário, a deficiência do fator XI poderia ocasionar problemas moderados de sangramento 7. Segundo Roberts e col. 6, a deficiência do fator XI ocasiona alterações da coagulação de pequena importância clínica.
A coagulação deve ser controlada para ficar restrita ao local da lesão vascular.
Há vários mecanismos que impedem a coagulação disseminada. O fato de o sangue permanecer na forma líquida, apesar de estímulo intenso, como acontece no politraumatizado, mostra que esses mecanismos são efetivos. O mais importante é o sistema da antitrombina III (ATIII). A heparina potencializa a ação da ATIII. Na ausência de ATIII, a heparina não tem ação anticoagulante e plasma deve ser administrado ao paciente.
A fibrinólise é o processo para destruir os trombos que são formados. Participam dela o plasminogênio e o ativador tecidual do plasminogênio (t-PA), protease que transforma o plasminogênio em plasmina. Devido ao fato de ser uma enzima proteolítica de amplo espectro, a plasmina digere fibrina, fibrinogênio, e a maioria dos fatores e co-fatores de coagulação 8. A fibrina é estabilizada com formação de ligações cruzadas pela ação do fator XIII. A lise do coágulo antes da formação das ligações cruzadas origina os produtos de degradação da fibrina e do fibrinogênio (PDF). A lise do coágulo após a estabilização da fibrina origina os D-dímeros.
ALTERAÇÕES DA HEMOSTASIA DURANTE A CEC
Quando o sangue circula dentro do sistema cardiovascular, está sempre em contato com uma camada contínua de endotélio capaz de mantê-lo na forma líquida. O endotélio é de importância vital para o sistema hemostático porque participa das três fases da hemostasia 9. As células endoteliais liberam fatores que controlam a ativação e a inibição plaquetárias, a coagulação e a fibrinólise.
Durante a circulação extracorpórea, o sangue entra em contato com superfícies artificiais de cerca de 12 m2, que fazem parte do sistema de CEC. O material de revestimento dos oxigenadores, filtros, linhas e demais componentes do sistema é derivado de compostos químicos como cloreto de polivinil, silicone, poliuretano, policarbonato e poliesterano 10. Apesar das tentativas para melhorar a biocompatibilidade desses materiais, esse sistema ainda é ativador das células do sangue, provocando liberação do FT.
Até pouco tempo achava-se que as superfícies artificiais da CEC seriam o maior estímulo para a formação de trombina. Atualmente, as evidências indicam que a lesão tecidual é mais importante. A via extrínseca é ativada quando o sangue entra em contato com o pericárdio e com os tecidos lesados, ricos em FT 11-13. Por isso, Tabuchi e col. 14 recomendam que, sempre que possível, o sangue acumulado no pericárdio não seja aspirado e nem misturado com o perfusato circulante. Esse sangue coletado deveria ser lavado e concentrado, para que somente as hemácias retornassem à circulação, exceto em situações críticas de sangramento. Outra alternativa é a adição de anticorpos contra o FT ou a administração do inibidor da via do FT diretamente no sangue acumulado no pericárdio para impedir a ativação da via extrínseca 15.
É provável que a via intrínseca não provoque a formação de trombina in vivo, mas quando o sangue entra em contato com o material da CEC o processo de formação de trombina é ativado 16.
A heparina não é o anticoagulante ideal para ser empregado durante a CEC, pois não impede totalmente a formação de trombina. Kojima e col. 17 mostraram que níveis séricos elevados de trombina ocorrem durante a CEC. É importante ressaltar que com a ativação da trombina ocorre formação de fibrina e, conseqüentemente, presença de fibrinólise. A trombina, além de converter o fibrinogênio em fibrina, é potente ativador plaquetário por meio da mudança conformacional do receptor IIb/IIIa da plaqueta, permitindo a ligação do fibrinogênio a esse local com conseqüente agregação plaquetária e liberação de ADP, serotonina e indução da síntese de prostaglandinas com formação de tromboxano A218. A trombina também ativa os fatores V, VIII e XI 19, que promovem maior formação da própria trombina e ativação do fator XIII 20.
Outro efeito da trombina que ocorre na terceira fase da hemostasia é a liberação do t-PA produzido pelo endotélio com conversão do plasminogênio em plasmina e conseqüente ativação do sistema fibrinolítico. A plasmina formada degrada a fibrina formando os PDF e os D-dímeros. Os PDF inibem a agregação plaquetária, provavelmente por se ligarem ao receptor plaquetário GPIIb/IIIa, importante para a agregação plaquetária (Figura 2) 21. Esses PDF têm outras ações que favorecem a anticoagulação, como degradação dos fatores V e VIII e interferência na polimerização da fibrina, ou seja, interferem na ação do fator XIII na formação das ligações cruzadas 22.
Há evidências que a plasmina, além da ação na fibrina, altera os receptores plaquetários, sobretudo a glicoproteína Ib-IX, principal receptor do fator de von Willebrand 23 e provoca destruição dos fatores V e VIII 24.
A CEC induz alteração do complexo sistema da fibrinólise, porque promove desequilíbrio entre o t-PA e o inibidor do ativador do plasminogênio tipo 1. Inicialmente predomina a fibrinólise e posteriormente pode ocorrer tendência à trombose. Por isso é que há o risco teórico de complicações trombóticas no pós-operatório após CEC.
A heparina empregada durante a CEC participa na alteração da função plaquetária que ocorre nesse período. As plaquetas são ativadas pela heparina com aumento da sua capacidade de agregação. Essas plaquetas ativadas formam microagregados e desaparecem rapidamente da circulação, explicando a plaquetopenia que ocorre durante a CEC 25. As plaquetas, além disso, sofrem alteração da função pela heparina, por refratariedade temporária ao estímulo pelo ADP 26.
O sistema da CEC, por meio dos roletes, filtros, aspiradores, oxigenador e demais componentes da máquina de perfusão, provoca lesão mecânica das plaquetas e, assim, contribuem para alteração da hemostasia.
ANTIFIBRIONOLÍTICOS
As estratégias farmacológicas com antifibrinolíticos para reduzir o sangramento em cirurgia cardíaca levam em conta as alterações da hemostasia provocadas pela CEC e o mecanismo de ação dos fármacos.
Até meados da década de 1980, as estratégias farmacológicas mais empregadas para reduzir o sangramento cirúrgico consistiam na utilização de desmopressina e prostaciclinas, com resultados pouco efetivos 27-29.
Os antifibrinolíticos inibem a fibrinólise e, conseqüentemente, impedem ou diminuem a formação dos PDF, que têm ação deletéria sobre a função plaquetária. Além dessa ação, diminuem a conversão do plasminogênio em plasmina, que tem atividade proteolítica nos receptores plaquetários.
Atualmente, são três os agentes antifibrinolíticos mais empregados: um inibidor de proteases séricas de amplo espectro, a aprotinina, e dois análogos do aminoácido lisina, o AEAC e o AT, que inibem a fibrinólise. A diminuição do sangramento com esses fármacos varia, na maioria dos estudos, entre 30% e 50%.
APROTININA
A aprotinina é um polipeptídeo inibidor de proteases séricas, de amplo espectro, isolada do pulmão bovino. A eficácia da aprotinina está relacionada com o seu amplo espectro. Inibe várias proteases plasmáticas: plasmina, calicreína sérica e tecidual, plasmina, tripsina e uroquinase 30. A ação antifibrinolítica está associada à inibição da plasmina. O efeito inibidor nas proteases parece ser dose-dependente 31. É a estratégia farmacológica mais empregada atualmente para diminuir o sangramento em cirurgia cardíaca após CEC.
Estudos in vitro mostram que a concentração sérica de 125 UIK (unidades calicreína-inibidora) .mL-1 inibe mais de 90% da atividade da plasmina. Para ocorrer inibição da calicreína é preciso uma concentração sérica de 300-500 UIK.mL-132. A eliminação da aprotinina é feita pelos rins. Em quatro horas, 80% do fármaco já foi eliminado.
A aprotinina teve o seu emprego comprovado como fármaco poupador de sangue em vários ensaios clínicos com distribuição aleatória de pacientes e três metanálises 33-35. Inclusive em pacientes com alto risco para sangramento, a aprotinina demonstrou ser efetiva para reduzir sangramento e transfusões em cirurgia cardíaca com CEC 36-38.
Na maioria das vezes, a aprotinina é utilizada em altas doses que foram estabelecidas por Roystron e col. 36, no Hospital Hammersmith. Devido ao fato de a meia-vida de eliminação situar-se entre uma e sete horas, o regime recomendado consta de uma dose inicial é de 2 ´ 106 UIK (2.000.000 UIK), outra dose igual na CEC e infusão contínua de 5 ´ 105 UIK.h-1 durante todo o procedimento cirúrgico. Esse regime mostrou, em vários estudos, reduzir a perda de sangue em até 50% e diminuir a necessidade de transfusão de 40% a 80% em intervenção cirúrgica cardíaca com CEC 39-42.
Além desse, que é o mais adota e estudado, têm sido empregados regimes com doses mais baixas. A administração inicial é de 1 ´ 106 UIK, dose igual na CEC e infusão contínua de 2,5 ´ 105 UIK, durante a operação. Estudos têm demonstrado que essa dose diminui a perda de sangue e a necessidade de transfusão sangüínea 43-46.
Um dos problemas adicionais para a utilização da aprotinina é o seu alto custo. Além disso, apresenta maior incidência de reações alérgicas que os antifibrinolíticos sintéticos 47. Pinosky e col. advertiram que o uso de aprotinina pode provocar reação anafilática, em exposições repetidas, em 5% a 6% dos pacientes 48. A prevalência de reações alérgicas em primeira exposição é menor. No trabalho realizado por Levy e col., com 287 pacientes, em que 215 receberam o fármaco, a prevalência de reação alérgica foi de 0,5%. Essa reação foi caracterizada por reação cutânea restrita ao tórax e pescoço, sem alterações hemodinâmicas 49.
Como a aprotinina se acumula nos túbulos, há a preocupação com complicações renais. Em estudos com animais a administração de aprotinina provocou diminuição da filtração glomerular, fluxo plasmático renal e excreção de sódio e potássio 50. As ações da aprotinina na função renal são complexas e causam alterações importantes no rim de humanos 51.
ÁCIDO TRANEXÂMICO
O ácido tranexâmico (AT), bem como o AEAC, faz parte dos antifibrinolíticos derivados do aminoácido lisina. Esses antifibrinolíticos sintéticos apresentam fórmulas estruturais semelhantes (Figura 3).
O AT é de seis a dez vezes mais potente que o AEAC 52. Apresenta maior afinidade pelo plasminogênio, sua atividade antifibrinolítica é mais sustentada e tem tempo de ação mais prolongado. Tem um volume de distribuição de 9 a 12 litros e meia-vida de eliminação em torno de duas horas 53. Após a injeção venosa, somente 3% liga-se a proteínas. Mais de 95% do fármaco é eliminado pela urina 54, portanto, em pacientes com insuficiência renal a dose deve ser reduzida.
Vários ensaios clínicos recentes comparativos entre AT e aprotinina não têm demonstrado diferença quanto a sangramento no pós-operatório e transfusão de sangue alogênico 55-58.
Com o uso do AEAC, vários trabalhos também mostraram diminuição do sangramento após cirurgia cardíaca com CEC 59-61. Em estudos comparativos entre AT e AEAC, o AT apresentou melhores resultados 48,62.
A dose de AT empregada de forma profilática para prevenir sangramento excessivo em cirurgia cardíaca com CEC varia muito entre as instituições. As doses variam de 150 mg.kg-1 em dose única, até 10 mg.kg-1, como dose inicial, seguida de infusão de 1 mg.kg-1.h-1. O maior estudo prospectivo e duplamente encoberto que comparou cinco doses diferentes realizado por Horrow e col. 63, demonstrou que a dose inicial de 10 mg.kg-1, seguida da infusão de 1 mg.kg.-1h-1, é a mais adequada. Essa dose proporciona níveis séricos acima de 10 µg.mL-1, que é suficiente para suprimir a atividade fibrinolítica 64. Em trabalho recente, publicado por Fiechtner e col. 65, a dose descrita manteve níveis séricos adequados ( 10 µg.mL-1). Esse regime de administração foi questionado por estudo preliminar, realizado por Dowd e col. 66, que mediram níveis séricos de TA durante a CEC. A administração de 10 mg.kg-1 de AT, seguida de infusão de 1 mg.kg-1.h-1, não manteve níveis terapêuticos em determinados momentos da CEC. Outro trabalho que questiona a dose empregada foi o de Karski e col. 67, que comparou três grupos com doses de 50 mg.kg-1, 100 mg.kg-1 e 150 mg.kg-1 respectivamente, administradas antes da CEC em 20 minutos. O sangramento foi muito maior no grupo que recebeu 50 mg.kg-1.
10 µg.mL-1). Esse regime de administração foi questionado por estudo preliminar, realizado por Dowd e col. 66, que mediram níveis séricos de TA durante a CEC. A administração de 10 mg.kg-1 de AT, seguida de infusão de 1 mg.kg-1.h-1, não manteve níveis terapêuticos em determinados momentos da CEC. Outro trabalho que questiona a dose empregada foi o de Karski e col. 67, que comparou três grupos com doses de 50 mg.kg-1, 100 mg.kg-1 e 150 mg.kg-1 respectivamente, administradas antes da CEC em 20 minutos. O sangramento foi muito maior no grupo que recebeu 50 mg.kg-1.
O início da administração influencia os resultados. Em dois trabalhos publicados que mostraram que o AT não reduz o sangramento em cirurgia cardíaca com CEC, Filipescu e col. 68 e o de Ævrum e col. 69 essa questão metodológica deve ter tido papel importante. O AT não foi iniciado após a incisão da pele, o que pode prejudicar a sua eficácia. Soslau 70 comparou dois grupos, em que um grupo começou a receber o AT antes da incisão da pele e outro após a CEC. O sangramento foi maior no segundo grupo. Além disso, os níveis séricos de PDF foram mais elevados nesse último grupo.
Além da dose e o início da administração, outra variável é o tempo de administração. Casati e col. 71 demonstraram que o prolongamento da infusão de AT, além do momento cirúrgico, não oferece vantagens com relação à redução de sangramento ou ao número de transfusões homólogas. A explicação é baseada na meia-vida de eliminação do AT que é de 80 minutos. Cerca de 30% do fármaco aparece na urina em uma hora e 45% nas duas horas seguintes e 90% são eliminados em 24 horas. Logo, a quantidade administrada durante a intervenção cirúrgica é suficiente para o período pós-operatório imediato, quando acaba o estímulo que provoca alteração da hemostasia.
O tratamento com AT aumenta a deposição de fibrina e pode ocasionar trombose e diminuição da função renal em pacientes com doença glomerular. O emprego desse tipo de fármaco é potencialmente perigoso para pacientes com glomerulonefrite ou síndrome nefrótica, podendo precipitar insuficiência renal por deposição de fibrina intratubular. Teoricamente, o AT também pode potencializar o problema de pacientes com hematúria do trato urinário superior porque previne a dissolução dos coágulos realizada pela enzima uroquinase. Esses coágulos podem obstruir as vias urinárias 72.
O emprego tópico do AT no sistema nervoso central, em humanos e animais, tem sido relacionado com convulsões 73-74, porém essas observações não têm sido relatadas nos estudos clínicos e metanálises realizadas em cirurgia cardíaca. O único trabalho realizado em humanos, encontrado nessa revisão, que referiu uma possível correlação entre AT e convulsão foi o publicado por Couto e col. 75, pelo fato de ter ocorrido um caso de convulsão no grupo que recebeu AT.
A atividade antifibrinolítica se deve à formação de complexos reversíveis com o plasminogênio. O AT e o AEAC bloqueiam quase completamente a interação entre o t-PA, o plasminogênio e o monômero de fibrina em virtude da alta afinidade pelos locais de ligação da lisina do plasminogênio 76. Esse processo inibe ou retarda a fibrinólise porque a plasmina, embora esteja formada, não pode se ligar à fibrina.
ÁCIDO EPSILON-AMINOCAPRÓICO
O AEAC é um inibidor competitivo da ativação do plasminogênio, como o AT. Tem sido empregado em várias doses e regimes. A dose recomendada e utilizada na maioria das vezes é de 100-150 mg.kg-1, por via venosa, seguida de infusão de 10-15 mg.kg-1, durante a intervenção cirúrgica. O nível sérico de 70 a 75 µg.mL-1 inibe a fibrinólise em 50% e níveis sangüíneos por volta de 130 µg.mL-1 apresentam efeito máximo 77. A redistribuição é de 10 a 25 minutos e a meia-vida de eliminação é de uma a três horas. A maior parte da eliminação ocorre pelo rim e cerca de 35% sofrem metabolismo hepático 78.
O AEAC tem molécula pequena e sintética, o que assegura um risco muito pequeno de reação alérgica. O efeito colateral mais freqüente é a hipotensão, que em geral está associada a administração rápida 79.
DISCUSSÃO
Uma das principais preocupações com o emprego dos antifibrinolíticos em revascularização do miocárdio com CEC é o risco de obstrução de enxertos coronarianos e infarto agudo do miocárdio (IAM). A supressão da fibrinólise sem redução da formação de trombina pode, teoricamente, levar a uma situação de hipercoagulabilidade e, conseqüentemente, a IAM.
O antifibrinolítico mais estudado é a aprotinina. O emprego em baixas doses tem sido questionado há bastante tempo. Hoje, esse regime não é recomendado pela preocupação com complicações tromboembólicas 80. Mesmo no regime com altas doses, o emprego da aprotinina tem sido questionado com relação ao aumento de complicações tromboembólicas. No estudo multicêntrico IMAGE 81, patrocinado pelo fabricante da aprotinina com 870 pacientes submetidos à revascularização primária do miocárdio, a oclusão de enxerto com veia safena foi muito maior no grupo que recebeu aprotinina. Houve 15,4% de oclusão de enxerto no grupo da aprotinina e 10,9% no grupo placebo (p = 0,03). Após a realização de discutível análise estatística com ajuste para fatores de risco associados a oclusão de enxerto de safena, que incluía entre os fatores analisados até o possível uso de sangue com aprotinina para preservar o enxerto de safena, a relação diminuiu. No grupo que recebeu aprotinina o percentual de oclusão ficou em 1,7% e no grupo do placebo ficou em 1,09%. De qualquer maneira, os autores afirmaram nesse estudo que o emprego de aprotinina pode afetar a permeabilidade do enxerto em vasos com diâmetro inferior a 1,5 mm ou em pacientes com leito distal comprometido, o que é muito comum atualmente com a mudança da população operada, por causa do aumento da freqüência das intervenções hemodinâmicas que tratam os casos menos graves.
Na metanálise realizada por Laupacis e col., com 5.808 pacientes de ensaios clínicos com distribuição aleatória dos pacientes nos grupos, comparando grupos que receberam a aprotinina com grupos placebo houve uma tendência, sem significância estatística, para maior incidência de IAM no grupo tratado com a aprotinina 34.
Em outra metanálise, realizada em 1999, com 72 ensaios clínicos com distribuição aleatória de pacientes nos grupos e 8.409 pacientes, os autores mostraram que a freqüência de IAM foi duas vezes mais alta, com significância estatística, quando foram comparados os pacientes que receberam doses convencionais (altas) com os pacientes que receberam doses baixas de aprotinina. Na comparação entre os pacientes que receberam aprotinina, independentemente da dose, com os que receberam placebo houve maior número de IAM no grupo que recebeu aprotinina, sem significância estatística. Porém, apesar dessa tendência, a mortalidade hospitalar nessa metanálise foi sempre menor no grupo que recebeu aprotinina. Na comparação entre os pacientes que receberam aprotinina, independentemente da dose, com o grupo placebo, a mortalidade hospitalar foi duas vezes menor no grupo que recebeu aprotinina 82. É importante ressaltar que o valor científico da avaliação da mortalidade seria maior se o seguimento não fosse restrito ao período de internação.
Também o trabalho realizado por Cosgrove e col. mostrou uma tendência para maior prevalência de IAM nos pacientes tratados com aprotinina, em revascularização do miocárdio 83. Nesse trabalho, a heparina foi administrada para manter o TCA acima de 400 segundos e sabe-se hoje que a aprotinina prolonga artificialmente o TCA realizado com celite. Nesse trabalho, a justificativa para a maior incidência de IAM observado no grupo da aprotinina foi anticoagulação inadequada. A dose de heparina foi menor que a usual e teria provocado maior formação de fibrina com aumento do consumo de fatores e diminuição da função plaquetária, pelos mecanismos já referidos.
Em recente trabalho muito importante com repercussão mundial, inclusive originando uma recomendação no portal da Sociedade de Anestesiologistas Cardiovasculares (Society of Cardiovascular Anesthesiologists), Mangano e col. 51 mostraram, em um estudo que incluiu 4.374 pacientes, que o uso de aprotinina está associado a lesão renal, IAM, insuficiência cardíaca e acidente vascular encefálico, em contraste com o emprego de AT e AEAC, que são recomendados como alternativas mais baratas e seguras. Esses fármacos não foram relacionados com aumento de risco para eventos renais, cardíacos e encefálicos.
Por causa do problema de custo, que torna inviável o uso de aprotinina como rotina na cirurgia cardíaca com CEC, da sensibilização com possibilidade de reação alérgica em nova exposição e do risco de complicações tromboembólicas e renais o interesse pelo AT e pelo AEAC tem aumentado, pois a redução no sangramento após intervenção cirúrgica cardíaca não é muito diferente entre esses fármacos.
A fibrinólise está relacionada com as alterações da hemostasia que ocorrem durante a CEC. Para detectar a intensidade da fibrinólise, um dos testes mais utilizados é a dosagem dos D-dímeros, teste específico para medir fibrinólise 53,84,85 que quantifica a lise da fibrina com ligações cruzadas. Níveis séricos dos D-dímeros elevados refletem aumento da lise de fibrina, ou seja, aumento da fibrinólise. Em trabalho publicado recentemente, com pacientes submetidos a procedimento cirúrgico cardíaco com a CEC, no grupo que recebeu AT, as concentrações de D-dímeros no sangue foram significativamente menores, o que demonstra atividade fibrinolítica diminuída, quando comparada com a do grupo que recebeu placebo 86.
Outro recurso muito utilizado para medir fibrinólise após a CEC é o tromboelastógrafo, executado com facilidade e rapidez 87.
Como já foi enfatizada, uma das principais preocupações com o emprego dos antifibrinolíticos é o risco de IAM. A supressão da fibrinólise sem redução da formação de trombina pode, teoricamente, levar a uma situação de hipercoagulabilidade, porém, os trabalhos com o AT não têm demonstrado maior ocorrência e nem tendência a complicações tromboembólicas como IAM. Na metanálise realizada por Laupacis e col. 34, com 12 estudos e 882 pacientes, a prevalência de IAM foi de 0,4% no grupo AT e 1,8% no grupo-controle. Em outra metanálise, realizada por Levi e col. 35, em que foram comparados o AT e o EACA juntos, como análogos da lisina, houve uma tendência para menor prevalência de infarto no grupo tratado com os análogos da lisina, quando comparados com o grupo placebo.
CONCLUSÃO
O risco de IAM não aumentou com o uso dos antifibrinolíticos análogos da lisina (AT e AEAC), conforme demonstrado por vários estudos e metanálises, porém a fibrinólise e o sangramento diminuíram de maneira significativa, o que assegura que o uso desses fármacos é benéfico para os pacientes submetidos a cirurgia cardíaca com CEC. Pelo seu baixo custo e segurança, esses antifibrinolíticos podem ser recomendados rotineiramente.
Apresentado em 21 de agosto de 2006
Aceito para publicação em 22 de junho de 2007
* Recebido do Serviço de Cirurgia Cardiovascular do Instituto de Cardiologia do Rio Grande do Sul/Fundação Universitária de Cardiologia (IC/FUC)
- 01. Øvrum E, Am Holen E, Abdelnoor M, et al. Conventional blood conservation tecniques in 500 consecutive coronary bypass operation. Ann Thorac Surg, 1991;52:500-505.
- 02. Bidstrup BP, Royston D, Sapsford RN et al. Reduction in blood loss and blood use after cardiopulmonary bypass with high dose aprotinin. J Thorac Cardiovasc Surg, 1989;97:364-372.
- 03. DelRossi AJ, Cernaianu AC, Botros S et al. Prophylatic treatment of postperfusion bleeding using EACA. Chest, 1989;96:27-30.
- 04. Salzman EW, Weinstein MJ, Weintraub RM et al. Treatment with desmopressin acetate to reduce blood loss after cardic surgery. A double-blind randomized trial. N Engl J Med, 1986; 314:402-406.
- 05. Carson SD, Brozna JP The role of tissue factor in the production of thrombin. Blood Coagul Fibrinolysis, 1993;4:282-492.
- 06. Roberts HR, Monroe DM, Escobar MA Current concepts of hemostasis. Anesthesiology, 2004;100:722-730.
- 07. Dahlback B Blood coagulation and its regulation by anticoagulant pathways: genetic pathogenesis of bleeding and thrombotic diseases. J Intern Med, 2005,57:209-223.
- 08. Thorsen S Differences in the binding to fibrin of native plasminogen and plasminogen modified by proteolytic degradation. Influence of omega-aminocarboxylic acids. Biochim Biophys Acta, 1995;393:55-56.
- 09. Pearson JD The control of production and release of haemostatic factors in the endothelial cell. Ballieres Clin Haematol, 1995;90:244-248.
- 10. Pereira JCD, Auler JOC Antifibrinolíticos em cirurgia cardíaca: estado atual. Rev Bras Anestesiol, 1994;44:205-210.
- 11. Boisclair MD, Lane DA, Philippou H et al. Mechanisms of thrombin generation during surgery and cardiopulmonary bypass. Blood, 1993;82:3350-3357.
- 12. de Haan J, Boonstra PW, Monnink SH et al. Retransfusion of suctioned blood during cardiopulmonary bypass impairs hemostasis. Ann Thorac Surg, 1995;59:901-907.
- 13. Philipou H, Davidson SJ, Mole MT et al. Two chain factor VIIa generated in the pericardium during surgery with cardiopulmonary bypass: relationship to increase thrombin generation and heparin concentration. Arterioscler Thromb Vasc Biol, 1999;19:248-254.
- 14. Tabuchi N, Haan J, Boonstra PW et al. Activation of fibrinolysis in the pericardial cavity during cardiopulmonary bypass. J Thorac Cardiovasc Surg, 1993;106:828-833.
- 15. Chung JH, Gikakis N, Rao K et al. Pericardial blood activates the extrinsic coagulation pathway during clinical cardiopulmonary bypass. Circulation, 1996;93:2014-2018.
- 16. Cohn LH, Edmunds LH Cardiac Surgery in the Adult. New York, McGraw-Hill, 2003;338-348.
- 17. Kojima T, Gando S, Kemmotsu O et al. Another point of view on the mechanism of thrombin generation during cardiopulmonary bypass: role of tissue factor pathway inhibitor. J Cardiothorac Vasc Anesth, 2001;15:60-64.
- 18. Harker LA Bleeding after cardiopulmonary bypass. N Engl J Med, 1986;314:1446-1448.
- 19. Bouma BN, von dem Borne PA, Meijers JCM Fator XI protection of the fibrin clot against lysis A role for the intrinsic pathway of coagulation in fibrinolysis. Thromb Haemost, 1998;80:24-27.
- 20. Despostis GJ, Joist JH Anticoagulation and anticoagulation reversal with cardiac surgery involving cardiopulmonary bypass: un update. J Cardiothorac Vasc Anesth, 1999;13:18-29.
- 21. Coller BS Platelets and thrombolytic therapy. N Eng J Med, 1990;322:33-42.
- 22. Bucur SZ, Levy JH, Despotis G et al. Use of antithrombin III in congenital and adquired deficiency states. Transfusion, 1998; 38:481-498.
- 23. Adelman B, Michelson AD, Loscalzo J Plasmin effect on platelet glycoprotein Ib-von Willebrand factor interactions. Blood, 1985; 65:32-40.
- 24. Spiess BD The contribution of fibrinolysis to postbypass bleeding. J Cardiothorac Vasc Anesth, 1991;5:13-17.
- 25. Murithi EW, Belcher PR, Rao JN et al. The effects of heparin and extracorporeal circulation on platelets counts and platelet microaggregation during cardiopulmonary bypass. J Thorac Cardiovasc Surg, 2000;120:538-43.
- 26. Hines RL, Rinder C Perioperative Coagulopathy: cardiac surgery, em: Lake CL, Moore RA Blood: Hemostasis, Transfusion and Alternatives in the Perioperative Period. New York: Raven, 1995;465-481.
- 27. Salzman EW, Weinstein MJ, Weintraub RM et al. Treatment with desmopressin acetate to reduce blood loss after cardiac surgery: a double-blind randomized trial. N Engl J Med, 1986; 314:1402-1406.
- 28. Rocha E, Llorens R, Paramo JA et al. Does desmopressin acetate reduce blood loss after surgery in patients on cardiopulmonary bypass? Circulation, 1988;77:1319-1323.
- 29. Fish KJ, Sarnquist FH, van Steennis C et al. A prospective randomized study of the effects of prostacyclin on platelet and blood loss during coronary bypass operations. J Thorac Cardiovasc Surg, 1986;91:436-442.
- 30. Royston D High-dose aprotinin therapy: a review of the first five years' experience. J Cardiothorac Anesth, 1992;6:76-100.
- 31. Royston D Aprotinin versus lysine analogues: the debate continues. Ann Thorac Surg, 1998;65:S9-S19.
- 32. HoffmannH, Siebeck M, Thetter O et al. Aprotinin concentrations effective for the inhibition of tissue kalikrein and plasma kalikrein in vitro and in vivo. Adv Exp Med Biol, 1998;247B:35-42.
- 33. Fremes SE, Wong BI, Lee E et al. Meta-analysis of prophylatic drug treatment in the prevention of postoperative bleeding. Ann Thorac Surg, 1994;58:1580-1588.
- 34. Laupacis A, Fergusson D Drugs to minimize perioperative blood loss in cardiac surgery: meta-analysis using perioperative blood transfusion as the outcome. Anesth Analg, 1997;85:1258-1267.
- 35. Levi M, Cromheecke EM, Jonge et al. Pharmacological strategies to decrease excessive blood loss in cardiac surgery: a meta-analysis of clinically relevant endpoints. Lancet, 1999;354:1940-1948
- 36. Royston D, Bidstrup BP, Taylor KM et al. Effect of aprotinin on the need for blood transfusion after repeat open heart surgery. Lancet 1987;2:1289-1291.
- 37. Dietrich W, Spannagl M, Jochum M et al. Influence of high-dose aprotinin treatment on blood loss and coagulation patterns in patients undergoing myocardial revascularization. Anesthesiology, 1990;73:119-126.
- 38. Harder MP, Eijsman L, Roozendaal et al. Aprotinin reduces intraoperative and postoperative blood loss in membrane oxygenator cardiopulmonary bypass. Ann Thorac Surg, 1991;51: 936-941.
- 39. Blauhut B, Gross C, Necek S Effects of high-dose aprotinin on blood loss, platelet function, fibrinolysis, complement, and renal function after cardiopulmonary bypass. J Thorac Cardiovasc Surg, 1991;101:958-967.
- 40. Havel M, Teufelsbauer H, Knobl P et al. Effect of intraoperative aprotinin administration on postoperative bleeding in patients undergoing cardiopulmonary bypass operation. J Thorac Cardiovasc Surg, 1991;101:968-972.
- 41. Lemmer JH, Stanford W, Bonney SL et al. Aprotinin for coronary bypass surgery; efficacy, safety, and influence on early saphenous vein graft patency. J Thorac Cardiovasc Surg, 1994; 107:543-453.
- 42. Marx G, Pokar H, Reuter H et al. The effects of aprotinin on hemostatic function during cardiac surgery. J Cardiothor Vasc Anesth, 1991;5:467-474.
- 43. Carrel T, Bauer E, Laske A et al. Low-dose aprotinin also allows for reduction of blood loss after cardiopulmonary bypass. J Thorac Cardiovasc Surg, 1991;102:801-802.
- 44. Schonberger JP, Everts PA, Ercan H et al. Low-dose aprotinin in internal mammary artery bypass operations contributes to important blood saving. Ann Thorac Surg, 1992;54:1172-1176
- 45. Kawasuji M, Ueyama K, Sakakibara N et al. Effect of low-dose of aprotinin on coagulation and fibrinolysis in cardiopulmonary bypass. Ann Thorac Surg, 1993;55:1205-1209.
- 46. Isetta C, Samat C, Jourdan I et al. Aprotinin treatment in cardiac surgery: low-doses versus high doses. Anesthesiology, 1992; 77:A139.
- 47. Mannucci PM Hemostatic drugs. N Engl J Med, 1998;339:245-253.
- 48. Pinosky ML, Kennedy DJ, Fishman RL et al. Tranexamic acid reduces bleeding after cardiopulmonary bypass when compared to epsilon aminocaproic acid and placebo. J Card Surg, 1997;12:330-338.
- 49. Levy JH, Pifarre R, Shaff HV et al. A multicenter, double-blind, placebo-controlled trial of aprotinin for reducing blood loss and the requirement for donor-blood transfusion in patients undergoing repeat coronary artery bypass grafting. Circulation, 1995; 92:2236-2244.
- 50. D'Ambra MN, Risk SC Aprotinin, erythropoietin and blood substitutes. Int Anesthesiol Clin, 1990;28:237-240.
- 51. Mangano DT, Tudor IT, Dietzel C The risk associated with aprotinin in cardiac surgery. N Engl J Med, 2006;354:353-365.
- 52. Levy JH Hemostatic agents and their safety. J Cardiothorac Vasc Anesth, 1999;13(Suppl 1):6-11.
- 53. Franck M, Sladen RN Drugs to prevent and reverse anticoagulation. Anesthesiol Clin North Am, 1999;17:799-811.
- 54. Horrow JC, Hlavacek J, Strong MD et al. Tranexamic acid decreases bleeding after cardiac operations. J Cardiovasc Surg 1990;99:70-74.
- 55. Casati V, Guzzon D, Oppizzi M et al. Tranexamic acid compared with high-dose aprotinin in primary elective heart operations: effects on perioperative bleeding and allogenic transfusions. J Thorac Cardiovasc Surg, 2000;120:520-527.
- 56. Wong BI, McLean RF, Fremes SE et al. Aprotinin and tranexamic acid for high transfusion risk cardiac surgery. Ann Thorac Surg, 2000;69:808-816.
- 57. Pugh SC, Wielogorski AK A comparison of the effects of tranexamic acid and low-dose of aprotinin on blood loss and homologous blood usage in patients undergoing cardiac surgery. J Cardiothoracic Vasc Anesth, 1995;9:240-244.
- 58. Bernet F, Carrel T, Marbet G et al. Reduction of blood loss and transfusion requirements after coronary artery bypass grafting: similar efficacy of tranexamic acid and aprotinin in aspirin-treated patients. J Card Surg 1999;14:92-7.
- 59. Del Rossi AJ, Cernaianu AC, Botros S et al. Prophylatic treatment of postperfusion bleeging using EACA. Chest, 1989;96:27-30.
- 60. Arom KV, Emery RW Decrease posoperative drainage with addition of å-aminocaproic acid before cardiopulmonary bypass. Ann Thorac Surg, 1994;57:1108-1113.
- 61. Daily PO, Lamphere JE, Dembiski WP et al. Effect of prophylatic epsilon-aminocaproic acid on blood loss and transfusion requirements in patients undergoing first-time coronary artery bypass grafting. A randomized, prospective, double-blind study. J Thorac Cardiovasc Surg, 1994;108:99-108.
- 62. Hardy JF, Bélisle S, Dupont C et al. Prophylatic tranexamic and e-aminocaproic acid for primary myocardial revascularization. Ann Thorac Surg, 1998;65:371-376.
- 63. Horrow JC, Van Riper DF, Strong MD et al. The dose response relationship of tranexamic acid. Anesthesiology, 1995;82:383-392.
- 64. Andersson L, Nilsoon IM, Collen S et al. Role of urokinase and tissue activator in sustaining bleeding and the management thereof with EACA and AMCA. Ann N Y Acad Sci, 1968;28:642-658.
- 65. Fiechtner BK, Nuttal GA, Johnson ME et al. Plasma tranexamic acid concentrations during cardiopulmonary bypass. Anesth Analg, 2001;92:1131-1136.
- 66. Dowd N, Karski J, Cheng DCH et al. Pharmacokinetics of tranexamic acid during cardiopulmonary bypass. Anesth Analg, 1999;88:SCA 112.
- 67. Karski JM, Dowd NP, Joiner R et al. The effect of three different doses of tranexamic acid on blood loss after cardiac surgery with mild systemic hypothermia (32 degrees C). J Cardiothoracic Vasc Anesth, 1998;12:642-646.
- 68. Filipescu D, Giurgiman L, Bubenek S et al. No benefit of tranexamic acid on blood transfusion requirements in primary cardiac surgery. Br J Anaesth, 1999;82:31.
- 69. Øvrum E, Am Holen E, Abdelnoor M et al. Tranexamic acid is not necessary to reduce blood loss after coronary artery bypass operations. J Thorac Cardiovasc Surg, 1993;105:78-83.
- 70. Soslau G, Horrow J, Brodsky I Effect of tranexamic acid on platelet ADP during extracorporeal circulation. Am J Hematol, 1991;38:113-119.
- 71. Casati V, Bellotti F, Gerli C et al. Tranexamic acid administration after cardiac surgery: a prospective, randomized, double blind, placebo controlled study. Anesthesiology, 2001; 94:8-14.
- 72. Sagripanti A, Sarteschi LM, Camici M et al. Non-tranfusional haemostatic agents in the management of bleeding disorders. Intern Med, 2001;9:10-18.
- 73. Pellegrini A, Giaretta D, Chemello R et al. Feline generalized epilepsy induced by tranexamic acid. Epilepsia 1982;23:35-45.
- 74. Schlag MG, Hopt R, Redi H Convulsive seizures following subdural application of fibrin sealant containing tranexamic acid in a rat model. Neurosurgery, 2000;47:1463-1467.
- 75. Couto WJ, Gregori F, Cordeiro CO et al. Emprego do ácido tranexâmico para controle de sangramento em cirurgia de revascularização miocárdica. Arq Bras Cardiol,1994;63:485-487.
- 76. Hoylaerts M, Lijnen HR, Col.len D Studies on the mechanism of the antifibrinolytic action of tranexamic acid. Biochim Biophys Acta, 1981;18:75-85.
- 77. Bennet-Guerrero E, Sorohan JG, Canada AT et al. e-Aminocaproic acid plasma levels during cardiopulmonary bypass. Anesth Analg, 1997;85:248-251.
- 78. Mahdy AM, Webster NR Perioperative systemic haemostatic agents. Br J Anaesth, 2004;93:842-858
- 79. Maslow A, Schwartz C Cardiopulmonary bypass-associated coagulopathies and prophylatic therapy. Int Anesthesiol Clin, 2004;42:103-133.
- 80. Smith PK, Muhlbaier LH Aprotinin: safe and effective only with the full dose regimen. Ann Thorac Surgery, 1996;621575-1577.
- 81. Alderman EL, Levy JH, Rich JB et al. Analyses of coronary graft patency after aprotinin use; results from the International Multicenter Aprotinin Graft Patency Experience (IMAGE) Trial. J Thorac Cardiovasc Surg, 1998;116:716-730.
- 82. Levi M, Cromheecke EM, Jonge E et al. Pharmacological strategies to decrease excessive blood loss in cardiac surgery: a meta-analysis of clinically relevant endpoints. Lancet, 1999; 354:1940-1948.
- 83. Cosgrove DM 3rd, Heric B, Lytle BW et al. Aprotinin therapy for reoperative myocardial revascularization. Ann Thorac Surg, 1992;54:1031-1038.
- 84. Greenberg CS, Devine DV, McCrae KM Measurement of plasma fibrin D-dimer levels with the use of monoclonal antibody coupled to latex beads. Am J Clin Pathol, 1987;87:94-100.
- 85. Shore-Lesserson L, Reich DL, Vela-Cantos F et al. Tranexamic acid reduces transfusion and mediastinal drainage in repeated cardiac surgery. Anesth Analg, 1996;83:18-26.
- 86. Santos ATL, Kalil RA, Bauermann C et al. A randomized, double-blind, and placebo-controlled study with tranexamic acido f bleeding and fibrinolytic activity after primary coronary artery bypass grafting. Braz J Med Biol Res, 2006;39:63-69.
- 87. Maia PV, Araújo GZ, Faria MD Tromboelastógrafo em cirurgia cardíaca: estado atual. Rev Bras Anestesiol, 2006;56:78-88.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
14 Set 2007 -
Data do Fascículo
Out 2007
Histórico
-
Aceito
22 Jun 2007 -
Recebido
21 Ago 2006