Resumos
A hepatite C é uma das principais causas de doença hepática crônica em todo o mundo. Existe grande variação na prevalência da infecção pelo vírus da hepatite C (HCV) de acordo com a região geográfica estudada, refletindo não só características epidemiológicas distintas entre as populações, mas diferenças nas metodologias utilizadas para a realização das estimativas. Apesar dos dados escassos, estimativas indicam que o Brasil é um país com prevalência intermediária, variando entre 1% e 2%. Os principais fatores de risco para a infecção pelo HCV são a transfusão de hemoderivados de doadores não rastreados com anti-HCV, uso de drogas intravenosas, transplante de órgãos, hemodiálise, transmissão vertical, exposição sexual e ocupacional. Pela ausência de vacina ou profilaxia pós-exposição eficaz, o foco principal da prevenção está no reconhecimento e controle desses fatores de risco. Neste artigo será feita uma revisão da literatura com enfoque na prevalência da hepatite C, especialmente no Brasil. Além disso, serão discutidos aspectos relacionados à distribuição da infecção pelo HCV de acordo com as faixas etárias e também os principais fatores de risco para a hepatite C.
Hepatite C; epidemiologia; transmissão de doença infecciosa; prevalência; fatores de risco
Hepatitis C is a major cause of chronic liver disease worldwide. There is a significant variation in the prevalence of hepatitis C virus (HCV) infection according to the geographic region studied. These discrepancies reflect not only distinct epidemiological characteristics among the populations, but also differences in the methodologies used for the estimates. Despite scarce data, estimates indicate that Brazil is a country with an intermediate prevalence of HCV infection, ranging from 1% to 2%. The most important risk factors for HCV acquisition include injection drug use, blood product transfusion, organ transplantation, hemodialysis, occupational injury, sexual transmission and vertical transmission. Because there is no vaccine and no post-exposure prophylaxis for HCV, the focus of primary prevention efforts should be identification and removal of the risk factors. In this article we review literature regarding the prevalence of HCV infection, particularly in Brazil. In addition, we discuss the pattern of HCV infection according to the age groups and risk factors for HCV acquisition.
Hepatitis C; epidemiology; disease transmission, infectious; prevalence; risk factors
ARTIGO DE REVISÃO
Epidemiologia da infecção pelo vírus da hepatite C
Tatiana MartinsI; Janaína Luz Narciso-SchiavonII; Leonardo de Lucca SchiavonII
IGraduação em Farmácia e Bioquímica pela Universidade do Sul de Santa Catarina - UNISUL; Aluna do Programa de Pós-Graduação em Ciências da Saúde da UNISUL, Tubarão, SC
IIDoutorado em Gastroenterologia e Hepatologia pela Universidade Federal de São Paulo - UNIFESP; Professor(a) do Programa de Pós-Graduação em Ciências da Saúde da UNISUL, Tubarão, SC
Correspondência para Correspondência para: Tatiana Martins Avenida José Acácio Moreira, 787, Bairro Dehon Tubarão - SC, CEP: 88704-900 Tel: (48) 3621-3363 martins.tatiana@unisul.br
RESUMO
A hepatite C é uma das principais causas de doença hepática crônica em todo o mundo. Existe grande variação na prevalência da infecção pelo vírus da hepatite C (HCV) de acordo com a região geográfica estudada, refletindo não só características epidemiológicas distintas entre as populações, mas diferenças nas metodologias utilizadas para a realização das estimativas. Apesar dos dados escassos, estimativas indicam que o Brasil é um país com prevalência intermediária, variando entre 1% e 2%. Os principais fatores de risco para a infecção pelo HCV são a transfusão de hemoderivados de doadores não rastreados com anti-HCV, uso de drogas intravenosas, transplante de órgãos, hemodiálise, transmissão vertical, exposição sexual e ocupacional. Pela ausência de vacina ou profilaxia pós-exposição eficaz, o foco principal da prevenção está no reconhecimento e controle desses fatores de risco. Neste artigo será feita uma revisão da literatura com enfoque na prevalência da hepatite C, especialmente no Brasil. Além disso, serão discutidos aspectos relacionados à distribuição da infecção pelo HCV de acordo com as faixas etárias e também os principais fatores de risco para a hepatite C.
Unitermos: Hepatite C; epidemiologia; transmissão de doença infecciosa; prevalência; fatores de risco.
Introdução
Desde o isolamento do DNA complementar do vírus da hepatite C (HCV) por Choo et al. em 19891, a hepatite C vem sendo reconhecida como uma das principais causas de doença hepática crônica em todo o mundo.
A prevenção e o controle da hepatite C dependem de uma complexa avaliação da distribuição global da infecção pelo HCV, determinação de seus fatores de risco associados e estimativa dos fatores que aceleram a progressão da doença. Além disso, devido à inexistência de uma vacina ou alguma forma de profilaxia pós-exposição, torna-se indispensável uma correta avaliação epidemiológica para o planejamento de ações de prevenção primária em qualquer população2.
Critério de busca
Foi realizada uma revisão não exaustiva da literatura referente à epidemiologia da hepatite C. Foram pesquisados os bancos de dados do Medline e Scielo por meio dos seguintes unitermos usados em combinação: hepatite C (hepatitis C); epidemiologia (epidemiology); prevalência (prevalence); fatores de risco (risk factors); transmissão (transmission). Estudos ou relatos de casos, correspondências, comentários ou estudos não publicados não foram incluídos.
Prevalência global
Umas das maneiras de estimar a prevalência de hepatite C é por meio de estudos de soroprevalência realizados em doadores de sangue. No entanto, por se tratar de uma população com características específicas, tais estudos podem não representar de forma acurada a verdadeira prevalência da doença. Tal discrepância foi demonstrada na população norte-americana, a qual apresentava na década de 1990 prevalência estimada de infecção pelo HCV de 0,6% nos estudos com doadores de sangue e de 1,8% na população geral3. Outros levantamentos, como aqueles realizados em portadores de doença hepática crônica, também devem ser interpretados de forma cuidadosa, pois esses indivíduos não representam de forma adequada a população total residente em determinada área. Apesar de estudos populacionais com amostras representativas de uma ou mais comunidades serem mais adequados, esse tipo de estudo possui maior complexidade e custo elevado e não pode ser executado na maior parte das regiões do mundo. Mesmo com essas ponderações, as estimativas apontam para prevalência global em torno de 2% a 3%, ou seja, entre 123 milhões e 170 milhões de pessoas infectadas pelo HCV em todo o mundo2,4-7.
Apesar de a hepatite C ser considerada endemia mundial, existe um elevado grau de variação geográfica de sua distribuição2,4-7. Em muitos países faltam dados, e as estimativas são baseadas em médias ponderadas para as regiões. A Figura 1 mostra a prevalência estimada de infecção pelo HCV de acordo com a região geográfica.
A prevalência da infecção pelo HCV é considerada baixa no Reino Unido, Escandinávia (0,01% a 0,1%), Américas, Europa Ocidental, Austrália e África do Sul (0,2% a 0,5%)8. Prevalências intermediárias são encontradas no Leste Europeu, Mediterrâneo, Oriente Médio e Índia8. Outros países com prevalência intermediária incluem Brasil, Europa Oriental, partes da África e Ásia4,8. O Egito possui alta prevalência de infecção pelo HCV (17% a 26%), além de Hubei, Mongólia, Paquistão4,6.
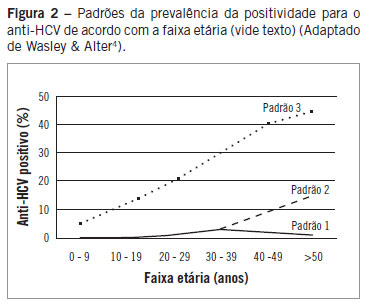
Existe apenas um número limitado de trabalhos relacionando a prevalência da infecção pelo HCV às diferentes faixas etárias, e esses demonstram não apenas as variações regionais, mas temporais que refletem épocas de maior risco de transmissão do HCV em cada região6. Nesses trabalhos percebem-se ao menos três padrões epidemiológicos distintos (Figura 2). O primeiro deles ocorre em países como Estados Unidos e Austrália, em que há maior prevalência do HCV na população entre 30 e 39 anos e menor prevalência nas pessoas abaixo de 20 e acima de 50 anos4. Nesse caso, especula-se que as maiores taxas de transmissão do HCV tenham acontecido em um passado recente, aproximadamente entre 10 e 30 anos4. Em outro padrão, como o que ocorre na Turquia, Espanha, Itália, Japão e China, a maioria dos infectados pelo HCV estão acima dos 50 anos, o que pode indicar maior risco de infecção em um passado distante, aproximadamente entre 40 e 60 anos4. O terceiro padrão é aquele que ocorre no Egito, em que há aumento do número de casos com a idade e ao mesmo tempo grande número de casos em todos os grupos etários, indicando risco aumentado de transmissão em um passado distante que se mantém de forma contínua2,7. A identificação desses padrões específicos de prevalência da infecção pelo HCV nas diferentes faixas etárias demonstra, provavelmente, características epidemiológicas peculiares de cada região. O reconhecimento do padrão de prevalência nos diferentes países e localidades pode permitir maior eficácia das medidas de detecção e de controle da infecção pelo HCV.
Prevalência no Brasil
O Brasil é um país de proporções continentais e, portanto, com grandes variações demográficas, sociais e culturais entre as diferentes regiões. Por esse motivo, os estudos que avaliam a prevalência do HCV no Brasil são escassos e pouco precisos, englobando, no geral, áreas geográficas restritas ou populações específicas, como os doadores de sangue9. Relatos de diversos estudos trazem informações contraditórias, o que sugere a necessidade de estudos com metodologia mais adequada.
Um inquérito realizado pela Sociedade Brasileira de Hepatologia revelou que dos 1.173.406 doadores de sangue avaliados, 14.527 (1,23%) foram reativos para o anti-HCV. A Figura 3 exibe a distribuição espacial da prevalência de positividade para o anti-HCV segundo os Estados10. As maiores taxas de prevalência foram observadas nos Estados da região Norte (2,12%)10. A região Sul, por sua vez, mostrou baixa prevalência de positividade para o anti-HCV (0,65%)10. As regiões Centro-Oeste, Nordeste e Sudeste apresentaram taxas intermediárias (1,04%, 1,19% e 1,43%, respectivamente)10. No entanto, conforme discutido anteriormente, a utilização de um grupo específico como os doadores de sangue limita a extrapolação dessas estimativas para a população geral.
Em 1998, um estudo de base populacional publicado por Focaccia et al., relatou prevalência de 1,42% de positividade para o anti-HCV em 1049 residentes do município de São Paulo11. As maiores prevalências foram observadas nos indivíduos acima de 30 anos, sendo o pico de 3,8% observado na faixa etária entre 50 e 59 anos11. Como discutido anteriormente, a maior prevalência de hepatite C observada após os 50 anos de idade sugere infecção em um passado distante, sendo possível um deslocamento gradual entre as faixas etárias, com tendência de a maioria dos casos se concentrar entre os idosos.
Fatores de risco e transmissão
A investigação dos fatores de risco para infecção pelo HCV pode ser realizada por estudos prospectivos ou retrospectivos, sendo que diversos trabalhos apontam como principais fatores de risco: transfusão de sangue e hemoderivados de doadores não testados para anti-HCV; transplantes de órgãos de doadores infectados; uso de drogas injetáveis; terapias injetáveis com equipamento contaminado (ou não seguro); hemodiálise; exposição ocupacional ao sangue; transmissão perinatal e transmissão sexual12-16. Além disso, em decorrência da grande variedade de atividades humanas com potencial exposição ao sangue, existem diversos outros modelos biológicos possíveis de transmissão do HCV. Alguns exemplos incluem procedimentos estéticos, culturais e religiosos como: tatuagem; piercing; serviços de barbearia; rituais de escarificação; circuncisão e acupuntura.
Entre os diversos fatores de risco, os mais descritos na literatura são a transfusão sanguínea, uso de drogas injetáveis e terapias invasivas com equipamentos contaminados (ou não seguros)12,13. Entretanto, ao longo do tempo e em cada região, ocorreu variação significativa na importância de cada um desses fatores na transmissão da doença7.
Transfusão de hemoderivados
A transfusão de sangue e hemoderivados de doadores não testados para HCV é considerada forma importante de transmissão. Porém, após a padronização dos processos de triagem pré-doação, houve significativa redução na transmissão do HCV por meio da transfusão de hemoderivados17. Estima-se que entre 1960 e 1991, 5% a 15% dos receptores de produtos sanguíneos infectaram-se com HCV e que, atualmente, após a adoção dos testes de rastreamento, o risco de infecção por transfusão sanguínea está em torno de 0,001% por unidade de sangue transfundida18. Apesar dessa significativa redução observada nos últimos anos, um estudo realizado no maior banco de sangue de Santa Catarina revelou que a probabilidade de contaminação pelo HCV ainda se mantinha na ordem de uma para 13.721 unidades de sangue transfundidas19, valor este, no mínimo, 10 vezes mais alto que o encontrado em países desenvolvidos19.
Uso de drogas intravenosas (div)
Após a redução na transmissão do HCV por transfusão de hemoderivados, o compartilhamento de material contaminado pelos usuários de DIV tornou-se o maior fator de risco para transmissão desta doença. O uso de DIV foi uma das principais formas de transmissão do HCV nos últimos 40 anos em países como os Estados Unidos e a Austrália12,20 e é atualmente considerado o principal fator de risco em países desenvolvidos12,20. Nesses países, o uso de DIV responde por cerca de 70% a 80% das contaminações pelo HCV ocorridas nos últimos 30 anos12,20.
Um estudo publicado por Thorpe et al. mostrou que a prevalência de infecção pelo HCV entre usuários de DIV variou de 70% a 90%21 e parece aumentar com o tempo de uso22,23. No entanto, alguns estudos mostram que mesmo usuários recentes (há menos de seis meses) podem apresentar taxas de prevalência superiores a 75%21. No Brasil, as estatísticas são escassas. No entanto, um trabalho que avaliou a prevalência do anti-HCV em usuários de DIV da cidade de Santos demonstrou taxa de 75%24, comparável às taxas relatadas na maioria dos países.
Procedimentos médicos e exposição nosocomial
As terapias injetáveis com equipamentos contaminados (ou não seguros) se apresentam como outra forma possível de transmissão do HCV25. Apesar da escassez de dados confiáveis, estima-se que aproximadamente dois milhões de indivíduos se infectem anualmente por esta via25. Em países em desenvolvimento, o suprimento de materiais esterilizados pode ser inadequado ou inexistente. Além disso, fora dos centros médicos, terapias injetáveis podem ser realizadas por indivíduos não habilitados; assim, ao longo da vida, uma pessoa pode receber múltiplas injeções com material contaminado, o que aumenta significativamente o risco acumulado de infecção pelo HCV25. No Egito, o país com a maior prevalência de hepatite C no mundo, a maioria dos indivíduos foi contaminada pela reutilização de seringas de vidro durante campanhas nacionais de tratamento da esquistossomose entre 1960 e 198726. Do mesmo modo, na Índia, a prevalência de HCV entre os pacientes que receberam múltiplos tratamentos injetáveis para calazar é de 31,1%, o que é significativamente maior do que a prevalência observada na população geral27.
Pacientes que realizam hemodiálise possuem maiores prevalências de infecção pelo HCV5 com porcentuais que variam entre 19% e 47,2%10. Entre os fatores associados a maiores taxas de infecção pelo HCV entre os pacientes em hemodiálise estão o tempo em diálise e a região demográfica6. A transmissão do HCV entre pacientes hemodialisados é principalmente nosocomial, sendo considerados possíveis fatores de risco o compartilhamento dos equipamentos e instrumentos de hemodiálise e a falta de adesão a medidas de precaução padrão e esterilização dos equipamentos28.
Transplante de órgãos sólidos
A estimativa da prevalência do HCV em receptores de órgãos é complicada pela influência da imunossupressão sobre a acurácia dos testes sorológicos habitualmente empregados. A prevalência do anti-HCV em doadores de órgãos, segundo estudos em cadáveres, varia de 4,2% a 5,1% dependendo do teste realizado29. Receptores de órgãos sólidos de doadores anti-HCV positivos parecem apresentar elevadas taxas de soroconversão, sendo que em um estudo com transplantados renais 35% dos receptores de doadores com anti-HCV reagente desenvolveram doença hepática no pós-transplante, e 74% apresentaram evidências de viremia30. Apesar desses dados, as evidências ainda são limitadas e é clara a necessidade de novos estudos para avaliar o impacto do transplante de órgãos na prevalência do HCV.
Exposição ocupacional
Acidentes perfurocortantes com inoculação percutânea são uma forma bem documentada de transmissão do HCV, com taxas de soroconversão após uma única exposição percutânea com objeto sabidamente contaminado variando entre 3% e 10%31,32. Por esse motivo, vários autores avaliaram a prevalência do HCV nos profissionais de saúde. Estudos do início da década de 1990 apontavam que a prevalência da infecção do HCV era três vezes maior nos trabalhadores da área da saúde do que em outros profissionais31. No entanto, outros estudos indicavam uma prevalência em profissionais da saúde de 0,7% a 2%, taxa esta semelhante à da população em geral33-37. Entre os cirurgiões-dentistas, a prevalência de HCV foi de 0,7% a 1,7%, e entre cirurgiões bucomaxilos a prevalência foi de 2% a 9,3%38,39. Um estudo realizado entre cirurgiões ortopedistas que negaram fatores de risco não ocupacionais demonstrou uma prevalência de menos de 1%40. Apesar desses dados conflitantes, a exposição ocupacional permanece como potencial fator de risco para infecção pelo HCV, especialmente devido à ausência de medidas profiláticas pós-exposição eficazes nesse contexto.
Transmissão vertical
As taxas de transmissão vertical do HCV variam entre 0% a 20%, com média em torno de 5% na maioria dos estudos41-43. Os fatores de risco para transmissão vertical incluem elevada carga viral da mãe, trabalho de parto prolongado, monitoração fetal interna e coinfecção HIV-HCV15,44. Mães coinfectadas foram 3,8 vezes mais propensas a transmitir o HCV ao filho42. O aleitamento materno parece não contribuir de modo importante para a transmissão do HCV43.
Transmissão sexual
O risco relacionado à transmissão sexual pelo HCV ainda não está completamente elucidado5, sendo esse fator de risco um dos mais controversos na epidemiologia da hepatite C pelos resultados divergentes observados nos diferentes estudos45,46. Maior prevalência de infecção pelo HCV tem sido encontrada entre pacientes atendidos em clínicas especializadas em doenças sexualmente transmissíveis, entre prostitutas e seus parceiros e entre pacientes coinfectados HIV-HCV47-52,54.
Outros fatores de risco relacionados a hábitos sexuais parecem contribuir para maior transmissão do HCV, entre eles: maior número de parceiros sexuais46, presença de outras doenças de transmissão sexual como tricomoníase, HIV/AIDS, sífilis e infecção por Clamídia47,48, baixa adesão ao uso de preservativos46,53, experiências sexuais traumáticas46,50,53 e homossexualismo masculino46,47,53-55. Além disso, a transmissão homem-mulher parece ocorrer mais facilmente do que a transmissão mulher-homem56.
Apesar dessas evidências, estudos envolvendo casais monogâmicos demonstraram baixo risco de transmissão sexual55. Além disso, a possibilidade de transmissão intrafamiliar por compartilhamento de material de higiene pessoal ou eventual exposição a sangue contaminado dificulta a interpretação dos estudos que avaliaram a transmissão sexual do HCV57,58.
Conclusão
A hepatite C é atualmente uma das causas mais comuns de doença hepática crônica em todo o mundo. Evidências sugerem que a maioria dos casos no Brasil esteja nos indivíduos com idade superior aos 50 anos. No entanto, com a importante diminuição da transmissão relacionada à transfusão de hemoderivados, o papel do compartilhamento de material contaminado por usuários de DIV vem crescendo e pode ser responsável por um número significativo de casos, especialmente entre os mais jovens. Estudos com metodologia adequada, visando o conhecimento da prevalência da hepatite C, bem como os fatores de risco para a sua aquisição na população brasileira são necessários para que as medidas de controle e a alocação de recursos para combate à infecção pelo HCV sejam implantadas corretamente.
Artigo recebido: 07/07/2010
Aceito para publicação: 24/10/2010
Conflito de interesses: Não há.
Trabalho realizado no programa de pós-graduação em Ciências da Saúde da Universidade do Sul de Santa Catarina, Tubarão, SC
- 1. Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science. 1989; 244:359-62.
- 2. Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection. Lancet Infect Dis. 2005; 5:558-67.
- 3. Alter MJ, Kruszon-Moran D, Nainan OV, McQuillan GM, Gao F, Moyer LA, et al. The prevalence of hepatitis C virus infection in the United States, 1988 through 1994. N Engl J Med. 1999; 341:556-62.
- 4. Wasley A, Alter MJ. Epidemiology of hepatitis C: geographic differences and temporal trends. Semin Liver Dis. 2000; 20:1-16.
- 5. Sy T, Jamal MM. Epidemiology of hepatitis C virus (HCV) infection. Int J Med Sci. 2006; 3:41-6.
- 6. Yen T, Keeffe EB, Ahmed A. The epidemiology of hepatitis C virus infection. J Clin Gastroenterol. 2003; 36:47-53.
- 7. Alter MJ. Epidemiology of hepatitis C virus infection. World J Gastroenterol. 2007; 13:2436-41.
- 8. Perz JF, Farrington LA, Pecoraro C, Hutin YJF, Armstrong GL. Estimated global prevalence of hepatitis C virus infection. In: 42nd Annual Meeting of the Infectious Diseases Society of America. Boston; Sept 30-Oct 3, 2004. Abstract.
- 9. Ferreira CT, Silveira TR. Hepatites virais: aspectos da epidemiologia e da prevenção. Rev Bras Epidemiol .2004; 7:473-87.
-
10SBH. Relatório do Grupo de Estudo da Sociedade Brasileira de Hepatologia. Epidemiologia da infecção pelo vírus da hepatite C no Brasil. GED. 1999; 18:53-58.
- 11. Focaccia R, da Conceicao OJ, Sette H Jr, Sabino E, Bassit L, Nitrini DR, et al. Estimated prevalence of viral hepatitis in the general population of the Municipality of Sao Paulo, Measured by a Serologic Survey of a Stratified, Randomized and Residence-Based Population. Braz J Infect Dis. 1998; 2:269-84.
- 12. Alter MJ. Prevention of spread of hepatitis C. Hepatology. 2002; 36:93-8.
- 13. Centers for Disease Control and Prevention. Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. MMWR Recomm Rep. 1998; 47:1-39.
- 14. Puro V, Petrosillo N, Ippolito G. Risk of hepatitis C seroconversion after occupational exposures in health care workers. Italian Study Group on Occupational Risk of HIV and Other Bloodborne Infections. Am J Infect Control. 1995; 23:273-7.
- 15. Roberts EA, Yeung L. Maternal-infant transmission of hepatitis C virus infection. Hepatology. 2002; 36:106-13.
- 16. Terrault N. Sexual activity as a risk factor for hepatitis C. Hepatology. 2002; 36:99-105.
- 17. Busch MP, Kleinman SH, Nemo GJ. Current and emerging infectious risks of blood transfusions. JAMA. 2003; 289:959-62.
- 18. Donahue JG, Munoz A, Ness PM, Brown DE Jr, Yawn DH, McAllister HA Jr, et al. The declining risk of post-transfusion hepatitis C virus infection. N Engl J Med. 1992; 327:369-73.
- 19. Kupek E. Transfusion risk for hepatitis B, hepatitis C and HIV in the state of Santa Catarina, Brazil, 1991-2001. Braz J Infect Dis. 2004; 8:236-40.
- 20. Dore GJ, Law M, MacDonald M, Kaldor JM. Epidemiology of hepatitis C virus infection in Australia. J Clin Virol. 2003; 26:171-84.
- 21. Thorpe LE, Ouellet LJ, Levy JR, Williams IT, Monterroso ER. Hepatitis C virus infection: prevalence, risk factors, and prevention opportunities among young injection drug users in Chicago, 1997-1999. J Infect Dis. 2000; 182:1588-94.
- 22. Diaz T, Des Jarlais DC, Vlahov D, Perlis TE, Edwards V, Friedman SR, et al. Factors associated with prevalent hepatitis C: differences among young adult injection drug users in lower and upper Manhattan, New York City. Am J Public Health. 2001; 91:23-30.
- 23. Thomas DL, Vlahov D, Solomon L, Cohn S, Taylor E, Garfein R, et al. Correlates of hepatitis C virus infections among injection drug users. Medicine. 1995; 74:212-20.
- 24. de Carvalho HB, Mesquita F, Massad E, Bueno RC, Lopes GT, Ruiz MA, et al. HIV and infections of similar transmission patterns in a drug injectors community of Santos, Brazil. J Acquir Immune Defic Syndr Hum Retrovirol. 1996; 12:84-92.
- 25. Hauri AM, Armstrong GL, Hutin YJ. The global burden of disease attributable to contaminated injections given in health care settings. Int J Std Aids. 2004; 15:7-16.
- 26. Frank C, Mohamed MK, Strickland GT, Lavanchy D, Arthur RR, Magder LS, et al. The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet. 2000; 355:887-91.
- 27. Singh S, Dwivedi SN, Sood R, Wali JP. Hepatitis B, C and human immunodeficiency virus infections in multiply-injected kala-azar patients in Delhi. Scand J Infect Dis. 2000; 32:3-6.
- 28. Zampieron A, Jayasekera H, Elseviers M, Lindley E, De Vos JY, Visser R, et al. European study on epidemiology and the management of HCV in the haemodialysis population--Part 1: centre policy. EDTNA ERCA J. 2004; 30:84-90.
- 29. Pereira BJ, Milford EL, Kirkman RL, Quan S, Sayre KR, Johnson PJ, et al. Prevalence of hepatitis C virus RNA in organ donors positive for hepatitis C antibody and in the recipients of their organs. N Engl J Med. 1992; 327:910-5.
- 30. Pereira BJ, Levey AS. Hepatitis C virus infection in dialysis and renal transplantation. Kidney Int. 1997; 51:981-99.
- 31. Lanphear BP, Linnemann CC, Jr., Cannon CG, DeRonde MM, Pendy L, Kerley LM. Hepatitis C virus infection in healthcare workers: risk of exposure and infection. Infect Control Hosp Epidemiol. 1994; 15:745-50.
- 32. Mitsui T, Iwano K, Masuko K, Yamazaki C, Okamoto H, Tsuda F, et al. Hepatitis C virus infection in medical personnel after needlestick accident. Hepatology 1992; 16:1109-14.
- 33. Thomas DL, Factor SH, Kelen GD, Washington AS, Taylor E, Jr., Quinn TC. Viral hepatitis in health care personnel at The Johns Hopkins Hospital. The seroprevalence of and risk factors for hepatitis B virus and hepatitis C virus infection. Arch Intern Med. 1993; 153:1705-12.
- 34. Polish LB, Tong MJ, Co RL, Coleman PJ, Alter MJ. Risk factors for hepatitis C virus infection among health care personnel in a community hospital. Am J Infect Control. 1993; 21:196-200.
- 35. Cooper BW, Krusell A, Tilton RC, Goodwin R, Levitz RE. Seroprevalence of antibodies to hepatitis C virus in high-risk hospital personnel. Infect Control Hosp Epidemiol. 1992; 13:82-5.
- 36. Hofmann H, Kunz C. Low risk of health care workers for infection with hepatitis C virus. Infection. 1990; 18:286-8.
- 37. Haley RW, Fischer RP. Commercial tattooing as a potentially important source of hepatitis C infection. Clinical epidemiology of 626 consecutive patients unaware of their hepatitis C serologic status. Medicine 2001; 80:134-51.
- 38. Thomas DL, Gruninger SE, Siew C, Joy ED, Quinn TC. Occupational risk of hepatitis C infections among general dentists and oral surgeons in North America. Am J Med. 1996; 100:41-5.
- 39. Klein RS, Freeman K, Taylor PE, Stevens CE. Occupational risk for hepatitis C virus infection among New York City dentists. Lancet 1991; 338:1539-42.
- 40. Shapiro CN, Tokars JI, Chamberland ME. Use of the hepatitis-B vaccine and infection with hepatitis B and C among orthopaedic surgeons. The American Academy of Orthopaedic Surgeons Serosurvey Study Committee. J Bone Joint Surg Am. 1996; 78:1791-800.
- 41. Tajiri H, Miyoshi Y, Funada S, Etani Y, Abe J, Onodera T, et al. Prospective study of mother-to-infant transmission of hepatitis C virus. Pediatr Infect Dis J. 2001; 20:10-4.
- 42. Gibb DM, Goodall RL, Dunn DT, Healy M, Neave P, Cafferkey M, et al. Mother-to-child transmission of hepatitis C virus: evidence for preventable peripartum transmission. Lancet. 2000; 356:904-7.
- 43. Thaler MM, Park CK, Landers DV, Wara DW, Houghton M, Veereman-Wauters G, et al. Vertical transmission of hepatitis C virus. Lancet 1991; 338:17-8.
- 44. Mast EE, Hwang LY, Seto DS, Nolte FS, Nainan OV, Wurtzel H, et al. Risk factors for perinatal transmission of hepatitis C virus (HCV) and the natural history of HCV infection acquired in infancy. J Infect Dis. 2005 ;192:1880-9.
- 45. Alter MJ, Gerety RJ, Smallwood LA, Sampliner RE, Tabor E, Deinhardt F, et al. Sporadic non-A, non-B hepatitis: frequency and epidemiology in an urban U.S. population. J Infect Dis. 1982; 145:886-93.
- 46. Alter MJ, Coleman PJ, Alexander WJ, Kramer E, Miller JK, Mandel E, et al. Importance of heterosexual activity in the transmission of hepatitis B and non-A, non-B hepatitis. JAMA. 1989; 262:1201-5.
- 47. Tedder RS, Gilson RJ, Briggs M, Loveday C, Cameron CH, Garson JA, et al. Hepatitis C virus: evidence for sexual transmission. BMJ 1991; 302:1299-302.
- 48. Petersen EE, Clemens R, Bock HL, Friese K, Hess G. Hepatitis B and C in heterosexual patients with various sexually transmitted diseases. Infection 1992; 20:128-31.
- 49. Wu JC, Wang YJ, Hwang SJ, Chen TZ, Wang YS, Lin HC, et al. Hepatitis D virus infection among prostitutes in Taiwan. J Gastroenterol Hepatol. 1993; 8:334-7.
- 50. Sanchez-Quijano A, Rey C, Aguado I, Pineda JA, Perez-Romero M, Torres Y, et al. Hepatitis C virus infection in sexually promiscuous groups. Eur J Clin Microbiol Infect Dis. 1990; 9:610-2.
- 51. Filippini P, Coppola N, Scolastico C, Rossi G, Onofrio M, Sagnelli E, et al. Does HIV infection favor the sexual transmission of hepatitis C? Sex Transm Dis. 2001; 28:725-9.
- 52. Eyster ME, Alter HJ, Aledort LM, Quan S, Hatzakis A, Goedert JJ. Heterosexual co-transmission of hepatitis C virus (HCV) and human immunodeficiency virus (HIV). Ann Intern Med. 1991; 115:764-8.
- 53. Stevens CE. Perinatal and sexual transmission of hepatitis C virus: a preliminary report. In: Hollinger FB, Lemon SM, Margolis HS, editors. Viral hepatitis and liver disease. Philadelphia: Williams & Wilkins; 1991. p.407-10.
- 54. Thomas DL, Zenilman JM, Alter HJ, Shih JW, Galai N, Carella AV, et al. Sexual transmission of hepatitis C virus among patients attending sexually transmitted diseases clinics in Baltimore--an analysis of 309 sex partnerships. J Infect Dis. 1995; 171:768-75.
- 55. Zylberberg H, Thiers V, Lagorce D, Squadrito G, Leone F, Berthelot P, et al. Epidemiological and virological analysis of couples infected with hepatitis C virus. Gut. 1999; 45:112-6.
- 56. Magder LS, Fix AD, Mikhail NN, Mohamed MK, Abdel-Hamid M, Abdel-Aziz F, et al. Estimation of the risk of transmission of hepatitis C between spouses in Egypt based on seroprevalence data. Int J Epidemiol. 2005; 34:160-5.
- 57. Cavalheiro NP, De La Rosa A, Elagin S, Tengan FM, Araújo ES, Barone AA. Hepatitis C: sexual or intrafamilial transmission? Epidemiological and phylogenetic analysis of hepatitis C virus in 24 infected couples. Rev Soc Bras Med Trop. 2009; 42:239-44.
- 58. Waure C, Cefalo C, Chiaradia G, Sferrazza A, Miele L, Gasbarrini G, et al. Intrafamilial transmission of hepatitis C virus in Italy: a systematic review. J Epidemiol Community Health. 2010; 64:843-8.
Correspondência para:
Datas de Publicação
-
Publicação nesta coleção
25 Fev 2011 -
Data do Fascículo
Fev 2011
Histórico
-
Aceito
24 Out 2010 -
Recebido
07 Jul 2010