Resumos
As amostras de líquido pleural obtidas por toracocentese para o diagnóstico de transudatos e exsudatos devem obedecer a uma rotina de coleta e preservação para a realização de uma análise laboratorial adequada. Igualmente, fragmentos de biópsia de pleura obtidos para o diagnóstico diferencial dos exsudatos devem ser coletados de forma sistemática com o objetivo de otimizar o diagnóstico e facilitar a instituição da terapêutica adequada.
Derrame pleural; Meios de cultura; Biopsia; Pleura; Exudatos e transudatos
The samples of pleural fluid obtained by thoracentesis for the diagnosis of transudates and exudates shall follow a routine of collection and preservation for an appropriate laboratorial analysis. Equally, fragments of pleura biopsy obtained for the differential diagnosis of the exudates should be collected in a systematic way in order to optimize the diagnosis and facilitate the institution of appropriate therapeutics actions.
Pleural effusion; Culture media; Biopsy; Pleura; Exudates and transudates
Coleta e preservação do líquido pleural e biópsia pleural* * Trabalho realizado na Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil.
Collection and preservation of the pleural fluid and pleural biopsy
Leila AntonangeloI; Vera Luiza CapelozziII
IProfessora Livre-Docente da Faculdade de Medicina da Universidade de São Paulo - FMUSP. Médica Chefe do Laboratório de Pleura do Instituto do Coração (InCor) e da Secção de Citologia do Laboratório Central do Hospital das Clínicas - FMUSP - São Paulo (SP) Brasil
IIProfessora Livre Docente de Patologia. Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil
Endereço para correspondência Endereço para correspondência: Leila Antonangelo Rua Dr. Enéas de C. Aguiar, 44, Laboratório de Pleura, Prédio II, 10º andar, Cerqueira César CEP: 01246-903. São Paulo, SP, Brasil Tel: 55 11 3069-5695 E-mail: l.antonangelo@hcnet.usp.br
RESUMO
As amostras de líquido pleural obtidas por toracocentese para o diagnóstico de transudatos e exsudatos devem obedecer a uma rotina de coleta e preservação para a realização de uma análise laboratorial adequada. Igualmente, fragmentos de biópsia de pleura obtidos para o diagnóstico diferencial dos exsudatos devem ser coletados de forma sistemática com o objetivo de otimizar o diagnóstico e facilitar a instituição da terapêutica adequada.
Descritores: Derrame pleural/microbiologia; Meios de cultura; Biopsia; Pleura/patologia; Exudatos e transudatos
ABSTRACT
The samples of pleural fluid obtained by thoracentesis for the diagnosis of transudates and exudates shall follow a routine of collection and preservation for an appropriate laboratorial analysis. Equally, fragments of pleura biopsy obtained for the differential diagnosis of the exudates should be collected in a systematic way in order to optimize the diagnosis and facilitate the institution of appropriate therapeutics actions.
Keywords: Pleural effusion/microbiology; Culture media; Biopsy; Pleura/pathology; Exudates and transudates
INTRODUÇÃO
Os derrames pleurais são sistematicamente classificados como transudatos ou exsudatos, de acordo com sua composição bioquímica.(1-2) Essa classificação é fundamental para se definir quais derrames necessitam de investigação laboratorial. Se o derrame é um transudato, freqüentemente não há necessidade de estudos laboratoriais adicionais, ao contrário dos exsudatos, que requerem a continuidade da investigação para estabelecimento do diagnóstico etiológico.
A toracocentese para coleta de líquido pleural é um procedimento seguro, de baixo custo e que fornece grande eficiência diagnóstica.(2) Essa técnica é responsável pela obtenção de mais de 90% das amostras de fluido pleural que são encaminhadas para diagnóstico laboratorial. Entretanto, amostras obtidas através de drenagem torácica, por coleta durante a toracoscopia ou mesmo durante a toracotomia também se prestam para análises bioquímicas e citológicas.
CARACTERÍSTICAS DOS TRANSUDATOS E EXSUDATOS
Os transudatos geralmente são límpidos, amarelo-claros e não se coagulam espontaneamente. Em contraposição, os exsudatos podem ser hemorrágicos, turvos ou purulentos e freqüentemente se coagulam devido à presença de fibrinogênio. Quilotórax e pseudoquilotórax cursam com líquidos branco-leitosos em cerca de 50% dos casos.(3)
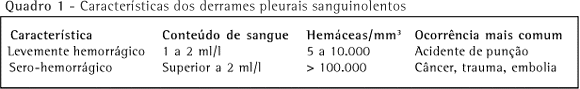
Os derrames hemorrágicos são geralmente secundários a acidentes de punção, traumas torácicos, neoplasia, embolia pulmonar, ruptura de aneurisma de aorta, pancreatite e, menos freqüentemente, tuberculose. Ressalta-se que os transudatos podem ser discretamente hemorrágicos, uma vez que são necessários apenas 1 a 2 ml de sangue em um litro de líquido pleural ou a presença de 5.000 a 10.000 eritrócitos/mm3 para produzir um aspecto hemorrágico no líquido.(4)
Nos derrames neoplásicos, pós-trauma ou por embolia pulmonar, a contagem de eritrócitos geralmente é superior a 100.000/mm3 (Quadro 1). Neste sentido, em derrames pleurais francamente sanguinolentos recomenda-se a realização do hematócrito do líquido pleural. Hematócritos inferiores a 1% freqüentemente não estão associados a sangramentos importantes.(4) Hematócritos superiores a 1% são observados em derrames neoplásicos, traumáticos e na embolia pulmonar.(5) Líquidos francamente hemorrágicos, com hematócrito superior a 50% do hematócrito do sangue periférico, são compatíveis com hemotórax.(6) O hematócrito pode ser realizado no tubo colhido para o exame citológico, ou seja, no mesmo tubo utilizado para hemograma (tubo contendo o anticoagulante ácido etilenodiaminotetracético - EDTA).
Quando o fluido pleural é turvo, leitoso e/ou sanguinolento, a amostra deve ser centrifugada a fim de se examinar o sobrenadante. Se a turbidez diminuir com a centrifugação, usualmente é porque estava associada com número aumentado de células ou debris. Este fato torna-se evidente quando se consideram os empiemas. Nestes casos, após a centrifugação, o sobrenadante do líquido pleural clareia, diminuindo o aspecto turvo observado durante a punção. Caso a turbidez persista após a centrifugação, o diagnóstico a ser considerado é quilotórax e/ou pseudoquilotórax. A observação de um derrame pleural quiloso sugere a presença de linfoma, carcinoma ou etiologia traumática. Em muitas situações o trauma é iatrogênico, como no pós-operatório de cirurgia cardiovascular ou de esôfago e nas grandes dissecações do mediastino. O pseudoquilotórax é mais freqüentemente observado em derrames pleurais crônicos, como aqueles que ocorrem na artrite reumatóide e na tuberculose (Quadro 2).(7-8)
RECOMENDDAÇÕES PARA A COLETA DO LÍQUIDO PLEURAL
Durante o procedimento da toracocentese, a seringa utilizada na aspiração deve ser levemente heparinizada, ou seja, deve-se aspirar a heparina em quantidade suficiente para que a seringa seja internamente umedecida, desprezando-se o excesso. Quando utilizamos seringa de 20 ml, um volume de 0,5 ml de heparina é suficiente para evitar a coagulação do líquido. Este procedimento deve ser repetido com todas as seringas utilizadas na coleta do líquido pleural, a fim de se evitar a coagulação do líquido durante a aspiração.
O volume recomendado de líquido pleural para análise laboratorial completa é em torno de 50 a 60 ml. O líquido pleural obtido deve ser distribuído nos tubos apropriados (tubos de 5 a 10 ml), de acordo com as análises a serem realizadas. Recomenda-se o encaminhamento imediato da amostra ao laboratório. Se, eventualmente, o material não puder ser enviado logo após a coleta, sugere-se que o mesmo seja mantido em geladeira comum (4 a 8 ºC), e não no congelador, até o encaminhamento ao laboratório, que deve ser o mais precoce possível.
ANÁLISES LABORATORIAIS
O volume total do líquido coletado deve ser distribuído em alíquotas e encaminhado às diversas seções do laboratório para as dosagens solicitadas (Quadro 3).
Como o líquido pleural é um ultrafiltrado do plasma, de maneira geral todas as determinações bioquímicas habitualmente realizadas no soro são passíveis de serem nele realizadas.
Para as determinações bioquímicas recomenda-se a coleta de 7 a 10 ml de líquido, utilizando-se seringa heparinizada (conforme orientação anterior). Imediatamente após a coleta, a amostra deve ser transferida para um tubo seco siliconizado estéril, sem adição de anticoagulante, com ou sem gel. Com este volume é possível a realização dos exames bioquímicos convencionais como glicose, proteínas (totais e frações), desidrogenase lática, colesterol, triglicérides e amilase.
Caso seja solicitada a determinação de marcadores tumorais, de outras proteínas como ceruloplasmina, imunoglobulinas e beta-2 microglobulina, ou ainda a realização de eletroforese das proteínas, há necessidade de um volume maior de líquido (tubos adicionais), que deve ser colhido nas mesmas condições descritas anteriormente.
Para a avaliação do fibrinogênio e dos produtos de degradação do fibrinogênio, o líquido deve ser colhido em um tubo próprio para exames de coagulação (tubos com citrato de sódio - tampa azul).
Para as determinações imunológicas como proteína C-reativa, látex, fator antinúcleo ou complemento, as amostras devem ser colhidas de maneira estéril, em tubos secos, sem anticoagulante, com ou sem gel.
Para a dosagem de interleucinas utiliza-se o sobrenadante de amostras colhidas em tubos secos, sem anticoagulantes, e as amostras devem ser armazenadas em freezer a -70 ºC ou -80 ºC até o momento da realização das determinações.
Para a caracterização dos derrames pleurais como transudatos ou exsudatos, recomenda-se que a amostra de sangue seja colhida simultaneamente à coleta do líquido para que a interpretação da relação pleural-sérica de proteínas e desidrogenase lática seja confiável. Outros exames laboratoriais realizados no líquido pleural, como marcadores tumorais, perfil reumatológico (fator antinúcleo, proteína C-reativa, prova do látex, complemento) e perfil de coagulação (fibrinogênio, produtos de degradação do fibrinogênio) também levam em consideração os valores séricos na interpretação dos resultados.
Para a determinação do pH no líquido pleural, utilizável no diagnóstico diferencial dos exsudatos, os mesmos cuidados dispensados para a análise do pH arterial devem ser tomados. A amostra deve ser colhida anaerobicamente em seringa heparinizada e mantida em condição anaeróbica até o encaminhamento ao laboratório.(9-10) O transporte deve ser em recipiente com gelo e o exame deve ser processado dentro de uma hora desde a coleta.
Para a dosagem de adenosina deaminase, o líquido pleural pode ser encaminhado em tubo seco estéril (sem adição de anticoagulante) ou em tubo anticoagulado (EDTA). Em uma série de casos de derrames cavitários onde testamos a influência do anticoagulante na concentração da enzima, pudemos constatar que, embora a adenosina deaminase tenda a ser discretamente mais baixa nos tubos anticoagulados, esta diferença não é significativa para propósitos clínicos. Desta maneira, do mesmo tubo encaminhado para o exame citológico é possível determinar-se a atividade da adenosina deaminase. As amostras também devem ser encaminhadas acondicionadas em recipiente com gelo, ou imediatamente após a coleta. No caso de o laboratório não realizar o exame nas primeiras quatro horas desde a coleta, recomenda-se centrifugar o material e congelar alíquotas do sobrenadante para posterior determinação.
Para o estudo microbiológico (baciloscopia de Gram, culturas para bactérias aeróbicas e anaeróbicas, pesquisa de micobactéria e fungos) são necessários de 7 a 10 ml de líquido, obtidos com seringa heparinizada e transferidos para frasco estéril, para frascos de hemocultura, ou encaminhados na própria seringa de coleta em condição absolutamente estéril, em temperatura ambiente. Culturas para bacilos álcool-ácido resistentes e fungos geralmente requerem volumes maiores de líquido (20 a 30 ml), pois estas culturas dificilmente se positivam se grandes quantidades de líquido não forem submetidas a rigorosas técnicas de concentração.(11-12)
O estudo citológico quantitativo (contagem de eritrócitos, leucócitos e demais células nucleadas) requer o envio de material em tubo contendo anticoagulante para evitar a coagulação do líquido e, conseqüentemente, a imprecisão nos resultados.(13) O tubo utilizado é o mesmo utilizado para hemograma (tubo com o anticoagulante EDTA, de tampa roxa), sendo o volume necessário entre 5 e 7 ml.
Para a citologia oncótica diferencial, recomenda-se um volume maior, de aproximadamente 25 ml, pois a acurácia diagnóstica da citologia oncótica é absolutamente dependente das técnicas de concentração utilizadas na preparação das lâminas e do número de lâminas examinadas em cada caso.(14-15) Como a amostra também deve ser colhida em tubo com anticoagulante, sugere-se o envio de quatro a cinco tubos de líquido pleural. Se o exame citológico não puder ser realizado logo após a coleta, a amostra deve ser mantida em refrigerador, sendo viável para análise por um período aproximado de 48 horas. Salientamos que este encaminhamento pressupõe que o exame citológico quantitativo e a citologia oncótica sejam realizados por laboratórios de Patologia Clínica. Nos casos em que a citologia oncótica for realizada por laboratório de Anatomia Patológica, o procedimento é diverso, devendo a amostra de líquido pleural obtida ser transferida para tubo de ensaio com igual quantidade de álcool a 90%.
Para a imunofenotipagem do líquido pleural por técnica de citometria de fluxo, recomenda-se a coleta de pelo menos quatro tubos de 5 ml de líquido colhido com o anticoagulante EDTA.(16) É importante que o médico entre em contato com o laboratório combinando o horário de encaminhamento, pois este exame é de preparação demorada e as células a serem analisadas têm viabilidade por apenas 24 horas.
Para a realização de exames que utilizam técnicas de biologia molecular, como pesquisa de micobactérias,(17) clamídia, adenovírus ou Pneumocystis carinii, recomenda-se a coleta da amostra em tubo seco, estéril, pois geralmente os agentes patológicos são pesquisados no sedimento do líquido, obtido por centrifugação. Não se devem encaminhar amostras em tubos que contenham anticoagulantes, pois estes podem interferir em algumas técnicas moleculares utilizadas.
Em resumo, a toracocentese diagnóstica é um procedimento rápido, seguro, de baixo custo, indicado na maioria dos pacientes com derrame pleural de etiologia desconhecida. A incidência de complicações é baixa e a principal contra-indicação para o procedimento é a presença de discrasias sanguíneas graves. A grande eficiência diagnóstica atribuída ao exame depende, entre outras coisas, do volume e das condições do derrame, da habilidade de quem executa a toracocentese e do encaminhamento correto ao laboratório, pois a inadequação do material inevitavelmente leva a resultados não confiáveis. Finalmente, a estrutura e as condições técnicas do laboratório, que deve estar preparado para receber e processar amostras dentro das normas de padronização internacionais e com aferição através de programas de qualidade conhecidos, são fatores fundamentais para a obtenção de elementos diagnósticos fidedignos.
BIÓPSIA PLEURAL
A biópsia pleural é um procedimento auxiliar de extrema importância no diagnóstico das doenças da cavidade pleural. Os fragmentos podem ser obtidos por agulha ou sob visão direta através de toracoscopia ou toracotomia. Sob o ponto de vista do patologista, alguns aspectos são importantes e podem facilitar sobremaneira a análise e o diagnóstico.
Número de fragmentos
Quando as biópsias são realizadas por agulha, o número ideal de fragmentos é três e o tamanho de cada fragmento obtido deve ser de 3 X 10mm. É importante que o clínico, no momento de obter o material, tome cuidado para não comprimir os fragmentos com pinças.
Fixação
Para rotina diagnóstica (colorações Hematoxilina & Eosina e Imunohistoquímica), os fragmentos devem ser acondicionados imediatamente após coleta em formalina a 10% tamponada e não precisam ser guardados em geladeira.
Para microscopia eletrônica, os fragmentos devem ser acondicionados em glutaraldeido 2% em tampão fosfato 0,1 molar durante 2 horas, e a seguir para transporte em soro fisiológico com sacarose.
Para cultura, os fragmentos deverão ser acondicionados em frascos apropriados fornecidos pelo Laboratório de Patologia e contendo solução específica para cultura (micobactérias, fungos). Além do encaminhamento de fragmentos para a anatomia patológica, os fragmentos devem ser encaminhados também para o Laboratório de Patologia Clínica.
Procedimentos recomendados em biópsias obtidas por pleuroscopias
Cortes por congelamento de porções representativas da pleura podem ser necessários em pacientes com quadros clínicos graves. Colorações de rotina para doenças infecciosas poderão ser feitas nos cortes por congelamento, para pesquisa de BAAR e fungos. No quadro 4 estão listados os procedimentos recomendados para biópsias em pleuroscopias.
A seguir, apresentamos uma sugestão de rotina de encaminhamento de tecido para exame de anatomia patológica utilizada em nosso serviço. Salientamos a necessidade de encaminhamento do material aliada a uma minuciosa informação dos dados clínicos e hipóteses dos médicos que conduzem o caso. Com isto o patologista acrescenta informações importantes que podem subsidiar seus achados, informando com maior precisão o diagnóstico ao clínico ou cirurgião. (Anexo 1 Anexo 1 )
- 1. Paddock FK. The diagnostic significance of serous fluids in disease. N Engl J Med. 1940;223:1010-5.
- 2. Light RW, Macgregor MI, Luchsinger PC, Ball WC Jr. Pleural effusions: the diagnostic separation of transudates and exudates. Ann Intern Med. 1972;77(4):507-13. Comment in: Chest. 2002;122(5):1505-6.
- 3. Roy DH, Corr DT, Payne WS: The problem of chylothorax. Mayo Clin Proc. 1967;42(7):457-67.
- 4. Light RW, Erozan YS, Ball WC Jr. Cells in pleural fluid. Their value in differential diagnosis. Arch Intern Med. 1973;132(6):854-60.
- 5. Jay SJ. Pleural effusions. 2. Definitive evaluation of the exudate. Postgrad Med. 1986;80(5):181-8.
- 6. Weil PH, Margolis IB. Systematic approach to traumatic hemothorax. Am J Surg. 1981142(6):692-4.
- 7. Hamm H, Pfalzer B, Fabel H. Lipoprotein analysis in a chyliform pleural effusion: implications for pathogenesis and diagnosis. Respiration. 1991;58(5-6):294-300.
- 8. Hillerdal G. Chyliform (cholesterol) pleural effusion. Chest. 1985;88(3):426-8.
- 9. Cheng DS, Rodriguez RM, Rogers J, Wagster M, Starnes DL, Light RW. Comparison of pleural fluid pH values obtained using blood gas machine, pH meter, and pH indicator strip. Chest. 1998;114(5):1368-72.
- 10. Sarodia BD, Goldstein LS, Laskowski DM, Mehta AC, Arroliga AC. Does pleural fluid pH change significantly at room temperature during the first hour following thoracentesis? Chest. 2000;117(4):1043-8.
- 11. Kumar S, Seshadri MS, Koshi G, John TJ. Diagnosing tuberculous pleural effusion: comparative sensitivity of mycobacterial culture and histopathology. Br Med J (Clin Res Ed). 1981;283(6283):20-4.
- 12. Levine H, Metzger W, Lacera D, Kay L. Diagnosis of tuberculous pleurisy by culture of pleural biopsy specimen. Arch Intern Med. 1970;126(2):269-71.
- 13. Ayo DS, Lee YC, Conner B, Branca P, Rogers JT, Rodriguez RM, et al. Pleural fluid white blood cell count variation using different sample containers and methods at 4 and 24 hours after collection. Chest. 1999;116:357S.
- 14. Starr RL, Sherman ME. The value of multiple preparations in the diagnosis of malignant pleural effusions. A cost-benefit analysis. Acta Cytol. 1991;35(5):533-7.
- 15. Venrick MG, Sidawy MK. Cytologic evaluation of serous effusions. Processing techniques and optimal number of smears for routine preparation. Am J Clin Pathol. 1993;99(2):182-6.
- 16. Ceyhan BB, Demiralp E, Celikel T. Analysis of pleural effusions using flow cytometry. Respiration. 1996;63(1): 17-24.
- 17. Querol JM, Minguez J, Garcia-Sanchez E, Farga MA, Gimeno C, Garcia-de-Lomas J. Rapid diagnosis of pleural tuberculosis by polymerase chain reaction. Am J Respir Crit Care Med. 1995;152(6 Pt 1):1977-81. Comment in: Am J Respir Crit Care Med. 1996;154(6 Pt 1):1919.
Anexo 1

Datas de Publicação
-
Publicação nesta coleção
15 Mar 2007 -
Data do Fascículo
Ago 2006