Resumos
O hipertireoidismo da doença de Graves, a forma mais comum de hipertireoidismo, é diretamente causado por auto-anticorpos que ativam o receptor do TSH. A etiologia parece ser multifatorial, envolvendo fatores genéticos e não genéticos. As opções terapêuticas atualmente disponíveis são as drogas antitireoidianas (DAT), a cirurgia e o iodo radioativo (131I), sendo que nenhuma delas é considerada ideal, visto que não atuam diretamente na etiologia/patogênese da disfunção. O 131I tem sido cada vez mais utilizado como primeira escolha terapêutica por tratar-se de um tratamento definitivo, de fácil administração e seguro. A associação com DAT, fatores prognósticos de falência e o cálculo da dose administrada são alguns dos aspectos controversos na utilização do 131I, sendo este o principal foco desta revisão. As DAT ainda são utilizadas como primeira escolha nos casos de pacientes com bócios pequenos, crianças e adolescentes, e na gravidez. A tireoidectomia é, atualmente, quase um tratamento de exceção, com indicação restrita para casos em que as DAT ou o 131I sejam contra-indicados.
Doença de Graves; Hipertireoidismo; Drogas antitireoidianas; Iodo radioativo
Graves' disease is the most frequent cause of hyperthyroidism. Clinical thyrotoxicosis is directly caused by autoantibodies that activate the TSH receptor. The etiology is multifactorial, with genetic and nongenetic factors involveld. Current treatment options are antithyroid drugs (ATD), radioiodine (131I) and surgery. Radioactive iodine is increasingly being used as definitive therapy, because it long has proven to be a safe, nonexpensive and effective treatment. Recent publications have discussed the use of 131I associated with ATD as well as the identification of predictors of treatment failure, which are discussed in this review. Antityhyroid drugs are still the first choice therapy in patients with mild disease, small goiters, children, adolescents, and in pregnancy. Surgery is now rarely performed. It is indicated only in cases where ATD have not been effective and radioiodine is contraindicated or not acceptable by the patients.
Graves' disease; Hyperthyroidism; Antithyroid drugs; Radioactive iodine
REVISÃO
Iodo radioativo no manejo do hipertireoidismo da doença de Graves
Radioactive iodine therapy in Graves' hyperthyroidism
Vânia A. Andrade; Jorge Luiz Gross; Ana Luiza Maia
Serviço de Endocrinologia, Hospital de Clínicas de Porto Alegre, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS
Endereço para correspondência Endereço para correspondência Ana Luiza Maia Serviço de Endocrinologia Hospital de Clínicas de Porto Alegre Rua Ramiro Barcelos 2350 90035-003 Porto Alegre, RS Fax: (51) 3332-5188 e.mail: almaia@vortex.ufrgs.br
RESUMO
O hipertireoidismo da doença de Graves, a forma mais comum de hipertireoidismo, é diretamente causado por auto-anticorpos que ativam o receptor do TSH. A etiologia parece ser multifatorial, envolvendo fatores genéticos e não genéticos. As opções terapêuticas atualmente disponíveis são as drogas antitireoidianas (DAT), a cirurgia e o iodo radioativo (131I), sendo que nenhuma delas é considerada ideal, visto que não atuam diretamente na etiologia/patogênese da disfunção. O 131I tem sido cada vez mais utilizado como primeira escolha terapêutica por tratar-se de um tratamento definitivo, de fácil administração e seguro. A associação com DAT, fatores prognósticos de falência e o cálculo da dose administrada são alguns dos aspectos controversos na utilização do 131I, sendo este o principal foco desta revisão. As DAT ainda são utilizadas como primeira escolha nos casos de pacientes com bócios pequenos, crianças e adolescentes, e na gravidez. A tireoidectomia é, atualmente, quase um tratamento de exceção, com indicação restrita para casos em que as DAT ou o 131I sejam contra-indicados.
Descritores: Doença de Graves; Hipertireoidismo; Drogas antitireoidianas; Iodo radioativo
ABSTRACT
Graves' disease is the most frequent cause of hyperthyroidism. Clinical thyrotoxicosis is directly caused by autoantibodies that activate the TSH receptor. The etiology is multifactorial, with genetic and nongenetic factors involveld. Current treatment options are antithyroid drugs (ATD), radioiodine (131I) and surgery. Radioactive iodine is increasingly being used as definitive therapy, because it long has proven to be a safe, nonexpensive and effective treatment. Recent publications have discussed the use of 131I associated with ATD as well as the identification of predictors of treatment failure, which are discussed in this review. Antityhyroid drugs are still the first choice therapy in patients with mild disease, small goiters, children, adolescents, and in pregnancy. Surgery is now rarely performed. It is indicated only in cases where ATD have not been effective and radioiodine is contraindicated or not acceptable by the patients.
Keywords: Graves' disease; Hyperthyroidism; Antithyroid drugs; Radioactive iodine
A DOENÇA DE GRAVES É UMA ENFERMIDADE autoimune, órgão-específica, que difere de todas as outras doenças autoimunes por estar associada mais freqüentemente ao aumento de função do orgão alvo (1-3). É a causa mais que comum de hipertireoidismo em pacientes com menos de 50 anos e é caracterizada por infiltração linfocitária da glândula tireóide e ativação do sistema imune com elevação dos linfócitos T circulantes, aparecimento de autoanticorpos que se ligam ao receptor do TSH (TRAb). Do ponto de vista clínico, a doença de Graves caracteriza-se por aumento difuso e hiperatividade da glândula tireóide, associada ou não a oftalmopatia infiltrativa e, mais raramente, ao mixedema localizado (4). A tireotoxicose clínica é diretamente causada pelos auto-anticorpos que ativam o receptor do TSH.
A elevação dos níveis circulantes dos hormônios tireoidianos é responsável por diversos efeitos deletérios em múltiplos órgãos, principalmente no sistema cardiovascular e ósseo. O excesso de hormônios tireoidianos causa aumento da freqüência cardíaca, pressão arterial sistólica e da massa e contração ventricular esquerda (5,6). A tireotoxicose pode levar ao desenvolvimento de complicações graves, como insuficiência cardíaca congestiva, cardiomiopatia e arritmias, principalmente fibrilação atrial (10-30%) (7,8). O hipertireoidismo também está associado ao aumento da reabsorção óssea, elevação da excreção de cálcio e fósforo na urina e fezes, com conseqüente diminuição na densidade mineral óssea e risco de fraturas em mulheres idosas (9,10). De acordo, estudos de base populacional demonstram que pacientes com hipertireoidismo apresentaram maior risco de mortalidade devido a doenças cerebrovasculares, cardiovasculares e fraturas do colo do fêmur (11).
As opções terapêuticas atualmente utilizadas no tratamento do hipertireoidismo de Graves são as drogas antitireoidianas (DAT), a cirurgia e o iodo radioativo (131I). Nenhuma delas é considerada ideal, visto que não atuam diretamente etiologia/patogênese da disfunção. A escolha do tratamento é influenciada por diferentes fatores, como idade do paciente, volume da tireóide, severidade do hipertireoidismo, preferência do paciente e do médico, recursos disponíveis e prática médica local (1,12). De acordo, o tratamento de primeira escolha difere entre os diferentes países ou regiões (13-15). No entanto, o 131I tem sido cada vez mais utilizado como primeira opção terapêutica, por tratar se de um tratamento definitivo, de fácil administração e seguro.
Iodo Radioativo no Tratamento do Hipertireoidismo de Graves
O 131I foi empregado pela primeira vez em 1941 no Massachussets General Hospital, quando Hertz e Roberts trataram pacientes com hipertireoidismo. Esta forma de tratamento já vem sendo utilizada há aproximadamente 60 anos, sendo considerada de fácil administração, efeito rápido e de baixo custo. O tratamento com 131I produz uma tireoidite intensa secundária à radiação, seguida por progressiva fibrose intersticial e atrofia glandular, resultando em destruição da capacidade de síntese da glândula tireóide. Inicialmente, ocorre morte das células tireoidianas e liberação de antígenos na circulação, associada com elevação das imunoglobulinas e na imunorreatividade celular contra o receptor do TSH (16). Posteriormente, pode ocorrer ablação de todo o tecido tireoidiano, e a conseqüente ausência de antígenos tireoidianos levaria à redução da autoimunidade.
O tratamento com 131I é bem tolerado e, exceto pela indução de hipotireoidismo iatrogênico transitório ou permanente, nenhum efeito colateral significativo tem sido relatado (17). Um estudo comparativo entre custo de tratamento com drogas antitireoidianas, radioterapia com 131I ou cirurgia realizado no Brasil (18) demonstrou que o tratamento com 131I apresenta menor custo, melhores índices custo/eficácia e custo/efetividade e a vantagem adicional da redução do volume glandular. Estima-se que mais de 2 milhões de pacientes com a Doença de Graves já tenham sido tratados com 131I, sem evidências de elevação da freqüência de defeitos congênitos em crianças cujos pais realizaram esta forma de tratamento. A Comissão Internacional de Proteção Radiológica estima que o risco de dano genético associado à exposição ao tratamento seja de, aproximadamente, 0,005%, considerado menor que o risco espontâneo de tais anormalidades (19). O tratamento com 131I, nas doses utilizadas para o hipertireoidismo de Graves, parece não afetar a fertilidade, e doses de irradiação gonadal relacionadas com o tratamento (máximo de 3rads) são similares ou menores que as doses utilizadas durante a realização de tomografia computadorizada de abdome, pielografia endovenosa ou enema baritado. Quanto à preocupação com a possibilidade do tratamento induzir carcinogênese, não existem evidências de aumento de risco de leucemia, câncer da tireóide ou outras malignidades. Franklyn e cols. (20), em estudo populacional envolvendo 7417 pacientes com hipertireoidismo tratados com 131I, demonstraram uma redução na incidência e mortalidade por câncer em geral, com pequeno aumento de risco de câncer de tireóide e intestino delgado. Entretanto, como não houve relação entre essas malignidades e dose de 131I utilizada, tempo ou idade de tratamento, os autores sugerem que esse achado pode refletir associação com tireotoxicose e não com exposição ao 131I.
O tratamento com 131I apresenta, como principal efeito colateral, uma alta incidência de hipotireoidismo permanente, cuja freqüência no primeiro ano de tratamento varia de acordo com a dose de 131I administrada (21), enquanto que a incidência posterior (3% ao ano) depende de fatores imunológicos (22), da associação ou não com drogas antitireoidianas, tamanho do bócio, radiossensibilidade individual, homogeneidade da distribuição de iodo na glândula tireóide e duração do seguimento dos pacientes tratados (23-27). Hipotireoidismo transitório pode ocorrer no período de 2 a 5 meses após o uso do radioisótopo (17).
Eficácia e Fatores Prognósticos de Falência ao Tratamento
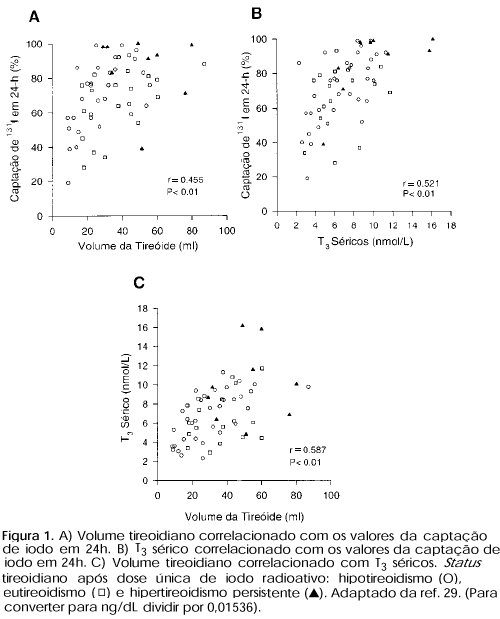
Com a utilização cada vez mais freqüente do 131I, tem aumentado o interesse pela eficácia dessa forma de tratamento. As taxas de cura do hipertireoidismo após administração do iodo radioativo variam de 60-90% e são dependentes da dose utilizada. Vários fatores prognósticos têm sido associados com falência à terapia 131I, como bócio volumoso pré-tratamento, não redução do bócio após a administração do radioisótopo, níveis basais de anticorpos elevados, associação com DAT. Allahabadia e cols. (28) identificaram sexo masculino, níveis séricos basais de T4 livre elevados e administração de baixas doses de 131I como fatores prognósticos de falência ao tratamento com o 131I. Recentemente, demonstramos que pacientes com bócios volumosos (> 50g), captação do 131I em 24hs > 90% e/ou níveis séricos basais de T3 >500ng/ml, apresentam taxas de falência ao tratamento com 131I bem maiores que pacientes sem essas características (figura 1) (29). Esses 3 parametros fazem parte da avaliação inicial do paciente com hipertireoidismo e devem auxiliar o médico assistente no delineamento do plano terapêutico.
Modo de Administração
Não existe consenso sobre a melhor forma de administração do 131I. Os esquemas terapêuticos são múltiplos, com variação da dose ou associação com drogas antitireoidianas utilizadas antes, durante ou após o 131I. Estudos comparando doses variadas de 131I demonstraram que doses reduzidas estão associadas à menor incidência de hipotireoidismo, porém, às custas de menor taxa de cura do hipertireoidismo, e que doses altas do radioisótopo aumentam a incidência do hipotireoidismo (30). A utilização de doses calculadas parece não oferecer vantagens em relação às doses fixas (31,32).
A associação de drogas antitireoidianas e 131I tem sido utilizada por cerca de 20-40% dos tireoidologistas americanos (13) e por 44,5% dos membros da SLAT (15). O principal fundamento para o tratamento prévio com drogas antitireoidianas seria a redução da quantidade de hormônios armazenados na tireóide e a liberação dos mesmos na circulação com o uso do 131I, evitando o quadro de exacerbação do hipertireoidismo conseqüente à tireoidite provocada pela radiação, ou mesmo a denominada "tempestade tireoidiana" (33). A revisão da literatura, no entanto, revela dados discordantes sobre o tema. Alguns estudos sugerem elevação, outros redução ou mesmo não modificação nos níveis séricos dos hormônios tireoidianos após o tratamento (34-38). O efeito do pré-tratamento com drogas antitireoidianas nos níveis séricos dos hormônios tireoidianos após administração do 131I foi avaliado, recentemente, em estudo realizado pelo nosso Grupo (39). Nós demonstramos que a interrupção do metimazol é responsável por aumento significativo das concentrações plasmáticas dos hormônios tireoidianos e que, após administração de 131I, ocorre estabilização ou redução dos níveis séricos desses hormônios (figura 2). Os pacientes tratados apenas com 131I referiam melhora clínica já a partir do segundo dia após uso do radioisótopo, o que pode talvez ser explicado, em parte, pela diminuição dos níveis de T3, fração hormonal que apresentou uma correlação quase perfeita com a sintomatologia clínica. Outra observação importante foi que, apesar da elevação dos níveis hormonais após a suspensão do metimazol nos pacientes que receberam pré-tratamento, houve estabilização ou declínio desses hormônios após a administração do 131I, indicando não haver necessidade da reintrodução do medicamento, conduta recomendada por alguns autores.
Na discussão sobre a necessidade ou não da utilização prévia das drogas antitireoidianas no tratamento com 131I, um aspecto importante a ser considerado é que, embora os pacientes tratados somente com 131I tenham apresentado reduções dos níveis séricos dos hormônios tireoidianos, esses valores permaneceram significativamente mais elevados durante todo o período de acompanhamento, quando comparados com o grupo de pacientes previamente tratados com drogas antitireoidianas (figura 2) (39). Essa situação pode significar uma potencial desvantagem do tratamento com 131I isolado, principalmente para pacientes com maior risco de complicações, como idosos e cardiopatas. A elevação abrupta dos hormônios tireoidianos livres, que ocorre como conseqüência da suspensão das drogas antitireoidianas, também pode exacerbar o hipertireoidismo e aumentar o risco de complicações, como tempestade tireoidiana. A utilização de lítio pode prevenir a elevação dos níveis séricos dos hormônios tireoidianos e sua utilização deve ser avaliada em pacientes considerados de risco (40). De modo geral, o emprego do 131I em pacientes com hipertireoidismo de Graves sem uso prévio de drogas antitireoidianas pode representar uma alternativa de tratamento eficaz, pois tem desfecho previsível, reduz a freqüência das consultas médicas e custo do tratamento, evita a elevada taxa de abandono ao tratamento clínico, além de evitar a exposição dos pacientes ao risco adicional dos efeitos colaterais das drogas antitireoidianas.
Interferência das Drogas Antitireoidianas na Eficácia da Radioiodoterapia
A interferência das drogas antitireoidianas na eficácia do tratamento com 131I é outro aspecto bastante discutido na literatura. Esses agentes inibem a organificação do iodo radioativo, reduzem a formação de radicais livres de O2 pelas células mononucleares ativadas e podem limitar a eficácia do tratamento com 131I (41). Vários trabalhos referidos na literatura exibem resultados controversos, alguns concluindo que a eficácia do tratamento não é modificada, enquanto outros estudos evidenciam maior falência ao tratamento atribuída à radiorresistência ao 131I induzida pelas drogas antitireoidianas (42-44). Em estudo clínico, avaliando 2 grupos de pacientes com hipertireoidismo de Graves tratados apenas com 131I ou previamente tratados com MMI, verificamos que não houve diferenças entre os grupos com relação às taxas de persistência de hipertireoidismo (15,6% vs. 13,8%), eutireoidismo (28,1% vs. 31,0%) ou hipotireoidismo (56,3% vs. 55,2%) após 1 ano de seguimento, indicando que o uso prévio de MMI não interfere na eficácia do tratamento com 131I (29). A taxa de cura 3 meses após 131I, independente do paciente ter recebido ou não pré-tratamento, foi de aproximadamente 80%, sendo que 90% dos pacientes curados com dose única de 131I responderam nesse período. Esses resultados, no entanto, talvez não possam ser aplicados quando o propiltiouracil for a droga escolhida. Imseis e cols. (45), comparando o uso do propiltiouracil e do metimazol na eficácia do tratamento com 131I, demonstraram que a redução da eficácia do radioisótopo ocorre apenas nos pacientes tratados com propiltiouracil, devido, talvez, à permanência mais prolongada dessa droga na tireóide quando comparada com o metimazol. Esses autores demonstraram interferência do propiltiouracil mesmo com longo intervalo (> 55 dias) entre suspensão da droga e administração do 131I.
O uso simultâneo de 131I e de DAT parece reduzir de modo significativo a taxa de cura do hipertireoidismo. Sabri e cols. (46) realizaram um estudo prospectivo envolvendo 207 pacientes tratados apenas com 131I ou simultaneamente tratados com carbimazole, demonstrando que pacientes que utilizaram carbimazole apresentaram maior falência ao radioisótopo. O menor sucesso do tratamento simultâneo foi verificado apesar da utilização de dose mais elevada do radioisótopo para correção da menor captação e meia-vida do 131I relacionados com uso da medicação. Outros estudos têm demonstrado que a utilização de DAT após 131I também pode reduzir a eficácia do tratamento (47).
Radioiodoterapia e Oftalmopatia de Graves
Um dos aspectos mais controversos do uso do iodo radioativo seria a possibilidade de desencadear o surgimento ou interferir na evolução da oftalmopatia pré-existente. Alguns estudos descreveram agravamento da doença ocular possivelmente secundário à liberação dos antígenos tireoidianos na circulação, favorecendo reação cruzada entre esses antígenos e fibroblastos da órbita, com infiltração da mesma pelas células T ativadas (48). No entanto, outros autores observaram que o 131I não influencia (49), ou que pode melhorar, a oftalmopatia (50). Embora o efeito do 131I na oftalmopatia ainda seja controverso (51), estudos recentes demonstram que a piora da oftalmopatia relacionada ao tratamento pode ser prevenida pelo uso concomitante de glicocórticoides (52).
Contra-Indicações ao Uso do 131I
As contra-indicações absolutas ou relativas ao tratamento com 131I incluem pacientes grávidas ou lactantes, níveis baixos da captação de 131I, presença de nódulo tireoidiano maligno ou suspeito de malignidade. O paciente deve ser informado sobre essa forma de terapia e, principalmente, sobre a elevada incidência do hipotireoidismo iatrogênico. A recusa ou o receio à utilização do iodo radioativo pelo paciente deve ser considerada uma contra-indicação relativa.
Considerações Finais
A maioria dos autores considera que as drogas antitireoidianas ainda constituem a primeira escolha no tratamento de pacientes jovens, com bócios pequenos (< 30g), crianças e adolescentes, e em situações especiais, como na gravidez. Apesar das controvérsias na literatura, é razoável supor que pacientes com bócios volumosos, aumento da razão T3/T4 e níveis de T3 acima de 500ng/dL apresentem menor chance de remissão da doença após uso de DAT, e, nesses casos, o tratamento definitivo deve ser considerado como primeira escolha.
A terapia cirúrgica tem indicações bem limitadas na doença de Graves, sendo considerada quase que um tratamento de exceção atualmente. Embora associado à maior probabilidade de eutireoidismo a longo prazo, apresenta como principal desvantagem o risco de complicações cirúrgicas, diretamente relacionadas com a experiência do cirurgião que realiza o procedimento. Essa modalidade de tratamento é preferida por apenas 1,3% dos profissionais membros da SLAT (15). De acordo com a literatura, estaria indicada a tireoidectomia sub-total em crianças e gestantes que apresentem efeitos colaterais às medicações antitireoidianas ou que não apresentem aderência ao tratamento, pacientes com bócios volumosos ou que desejam tratamento definitivo e recusam o uso do iodo radioativo.
Recebido em 30/11/03
Aceito em 10/12/03
- 1. Cooper DS. Hyperthyroidism. Lancet 2003;362:459-68.
- 2. Tunbridge WMG, Evered DC, Hall R. The spectrum of thyroid disease in a community: the Wickham Survey. Clin Endocrinol 1977;7:481-93.
- 3. Chen CR, Pichurin P, Nagayama Y, Latrofa F, Rapoport B, McLachlan SM. The thyrotropin receptor autoantigen in Graves' disease is the culprit as well as the victim. J Clin Invest 2003;111:1897-904.
- 4. Dabon-Almirante CL, Surks MI. Clinical and laboratory diagnosis of thyrotoxicosis. Endocrinol Metab Clin North Am 1998;27:25-35.
- 5. Klein I, Ojama K. Thyroid hormone and the cardiovascular system. N Engl J Med 2001;344:501-9.
- 6. Polikar R, Burger AG, Scherrer U, Nicod P. The thyroid and the heart. Circulation 1993;87:1435-41.
- 7. Koshiyama H, Sellitti D F, Akamizu T, Doi SQ, Takeuchi Y, Inoue D, et al. Cardiomyopathy associated with Graves' disease. Clin Endocrinol 1996;45:111-6.
- 8. Gross JL, Caramori ML, Ribeiro JP. Hipertireoidismo com fibrilação atrial: é necessário anticoagular todos os pacientes? Arq Bras Endocrinol Metab 1996;40:54-7.
- 9. Franklin J, Betterridge J, Holder R, Daykin J, Lilley J, Sheppard M. Bone mineral density in thyroxine treated females with or without a previous history of thyrotoxicosis. Clin Endocrinol 1994;41:425-32.
- 10. Cummings SR, Nevitt MC, Browner WS, Stone K, Fox KM, Ensrud KE, et al. Risk factors for hip fracture in white women. N Engl J Med 1995;332:767-73.
- 11. Franklyn JA, Maisonneuve P, Sheppard MC, Betteridge J, Boyle P. Mortality after the treatment of hyperthyroidism with radioactive iodine. N Engl J Med 1998;338:712-8.
- 12. Singer PA, Cooper DS, Levy EG, Ladenson PW, Braverman LE, Daniels G, et al. Treatment guidelines for patients with hyperthyroidism and hypothyroidism. JAMA 1995;273:808-12.
- 13. Solomon B, Glinoer D, Lagasse R, Wartofsky L. Current trends in the management of Graves' disease. J Clin Endocrinol Metab 1990;70:1518-24.
- 14. Wartofsky L, Glinoer D, Solomon B, Nagataki S, Lagasse R, Nagayama Y, et al. Differences and similarities in the diagnosis and treatment of Graves' disease in Europe, Japan, and the United States. Thyroid 1991;1:129-35.
- 15. Romaldini JH. Case selection and restrictions recommended to patients with hyperthyroidism in South America. Thyroid 1997;7:225-8.
- 16. DeGroot LJ. Radioiodine and the immune system. Thyroid 1997;7:259-63.
- 17. Aizawa Y, Yoshida K, Kaise N, Fukazawa H, Kiso Y, Sayama N, et al. The development of transient hypothyroidism after iodine-131 treatment in hyperthyroid patients with Graves' disease: prevalence, mechanism and prognosis. Clin Endocrinol 1997;46:1-5.
- 18. Ward LS, Filho AC, Menabó E, Ribeiro SRR, Lima MC, Maciel RMB. Estudo da relação custo/efetividade no tratamento da doença de Basedow-Graves. Rev Ass Med Brasil 1986;32:147-54.
- 19. Graham GD, Burman KD. Radioiodine treatment for Graves' disease. An assessment of its potential risks. Ann Intern Med 1986;105:900-5.
- 20. Franklyn JA, Maisonneuve P, Sheppard MC, Betteridge J, Boyle P. Mortality after the treatment of hyperthyroidism with radioactive iodine. N Engl J Med 1998;338:712-8.
- 21. Sridama V, McCormick M, Kaplan EL, Fauchet R, DeGroot LJ. Long-term follow-up study of compensated low-dose 131I therapy for Graves' disease. N Engl J Med 1984;311:426-32.
- 22. Chiovato L, Fiore E, Vitti P, Rocchi R, Rago T, Dokic D, et al. Outcome of thyroid function in Graves' patients treated with radioiodine: role of thyroid-stimulating and thyrotropin-blocking antibodies and of radioiodine-induced thyroid damage. J Clin Endocrinol Metab 1998;83:40-6.
- 23. Marcocci C, Gianchecchi D, Masini I, Golia F, Ceccarelli C, Bracci E, et al. A reappraisal of the role of methimazole and other factors on the efficacy and outcome of radioiodine therapy of Graves' hyperthyroidism. J Endocrinol Invest 1990;13:513-20.
- 24. Tuttle RM, Patience T, Budd S. Treatment with propyltiouracil before radioactive iodine therapy is associated with a higher treatment failure rate than therapy with radioactive iodine alone in Graves' disease. Thyroid 1995;5:243-7.
- 25. Hancock L, Tuttle M, LeMar H, Bauman J, Patience T. The effect of propylthiouracil on subsequent radioactive iodine therapy in Graves' disease. Clin Endocrinol 1997;47:425-30.
- 26. Sabri O, Zimny M, Schulz G, Schreckenberger M, Reinartz P, Willmes K, et al. Success rate of radioiodine therapy in Graves' disease: the influence of thyrostatic medication. J Clin Endocrinol Metab 1999;84:1229-33.
- 27. Velkeniers B, Vanhaelst L, Cytryn R, Jonckheer MH. Treatment of hyperthyroidism with radioiodine: adjunctive therapy with antithyroid drugs reconsidered. Lancet 1988;1127-9.
- 28. Allahabadia A, Daykin J, Holder RL, Sheppard MC, Gough SCL, Franklin JA. Age and gender predict the outcome of treatment for Graves' hyperthyroidism. J Clin Endocrinol Metab 2000;85:1038-42.
- 29. Andrade VA, Gross JL, Maia AL. Effect of methimazole on the efficacy of radioiodine therapy in Graves' hyperthyroidism. J Clin Endocrinol Metab 2001;86:3488-93.
- 30. Sridama V, McCormick M, Kaplan EL, Fauchet R, DeGroot LJ. Long-term follow-up study of compensated low-dose 131I therapy for Graves' disease. N Engl J Med 1984;311:426-32.
- 31. Leslie WD, Ward L, Salamon EA, Ludwig S, Rowe RC, Cowden EA. A randomized comparison of radioiodine doses in Graves' hyperthyroidism. J Clin Endocrinol Metab 2003;88:978-83.
- 32. Jarlov AE, Hegedüs L, Kristensen L, Nygaard B, Hansen JM. Is calculation of the dose in radioiodine therapy of hyperthyroidism worth while? Clin Endocrinol 1995;43:325-9.
- 33. Perros P. Anti-thyroid drug treatment before radioiodine in patients with Graves' disease: soother or menace? Clin Endocrinol 2000;53:1-2.
- 34. McDermott MT, Kidd GS, Dodson LE, Hofeldt FD. Radioiodine-induced thyroid storm. Case report and literature review. Am J Med 1983;75:353-9.
- 35. Shafer RB, Nuttall FQ. Acute changes in thyroid function in patients treated with radioactive iodine. Lancet 1975;2:635-7.
- 36. Wise PH, Burnet RB, Ahmad A, Harding PE. Intentional radioiodine ablation in Graves' disease. Lancet 1975;231-3.
- 37. Burch HB, Solomon BL, Wartofsky L, Burman KD. Discontinuing antithyroid drug therapy before ablation with radioiodine in Graves' disease. Ann Inter Med 1994;121:553-9.
- 38. Tamagna EI, Levine GA, Hershman JM. Thyroid hormone concentrations after radioiodine therapy for hyperthyroidism. J Nucl Med 1979;20:387-91.
- 39. Andrade VA, Gross JL, Maia AL. Effect of methimazole pretreatment on serum thyroid hormone levels after radioactive treatment in Graves' hyperthyroidism. J Clin Endocrinol Metab 1999;84:4012-6.
- 40. Bogazzi F, Bartalena L, Campomori A, Brogioni S, Traino C, De Martino F, et al. Treatment with lithium prevents serum thyroid hormone increase after thionamide withdrawal and radioiodine therapy in patients with Graves' disease. J Clin Endocrinol Metab 2002;87:4490-5.
- 41. Weetman AP, Holt ME, Campbell AK, Hall R, McGregor AM. Methimazole and generation of oxygen radicals by monocytes: potential role in immunosuppression. Br Med J 1984;288:518-20.
- 42. Marcocci C, Gianchecchi D, Masini I, Golia F, Ceccarelli C, Bracci E, et al. A reappraisal of the role of methimazole and other factors on the efficacy and outcome of radioiodine therapy of Graves' hyperthyroidism. J Endocrinol Invest 1990;13:513-20.
- 43. Tuttle RM, Patience T, Budd S. Treatment with propyltiouracil before radioactive iodine therapy is associated with a higher treatment failure rate than therapy with radioactive iodine alone in Graves' disease. Thyroid 1995;5:243-7.
- 44. Hancock L, Tuttle M, LeMar H, Bauman J, Patience T. The effect of propylthiouracil on subsequent radioactive iodine therapy in Graves' disease. Clin Endocrinol 1997;47:425-30.
- 45. Imseis RE, Vanmiddlesworth L, Massie JD, Bush AJ, Vanmiddlesworth NR. Pretreatment with propylthiouracil but not methimazole reduces the therapeutic efficacy of iodine-131 in hyperthyroidism. J Clin Endocrinol Metab 1998;83:685-7.
- 46. Sabri O, Zimny M, Schulz G, Schreckenberger M, Reinartz P, Willmes K, et al. Success rate of radioiodine therapy in Graves' disease: the influence of thyrostatic medication. J Clin Endocrinol Metab 1999;84:1229-33.
- 47. Velkeniers B, Vanhaelst L, Cytryn R, Jonckheer MH. Treatment of hyperthyroidism with radioiodine: adjunctive therapy with antithyroid drugs reconsidered. Lancet 1988;1127-9.
- 48. Bartalena L, Maracocci C, Bogazzi F, Panicucci M, Lepri A, Pinchera A. Use of corticosteroids to prevent progression of Graves' ophthalmopathy after radioiodine therapy for hyperthyroidism. N Engl J Med 1989;321:1349-52.
- 49. Manso PG, Furlanetto RP, Wolosker AM, Paiva ER, Abreu MT, Maciel RMB. Prospective and controlled study of ophthalmopathy after radioiodine therapy for Graves' hyperthyroidism. Thyroid 1998;8:49-52.
- 50. DeGroot LJ, Gorman CA, Pinchera A, Bartalena L, Marocci C, Wiersinga WM, et al. Radiation and Graves' ophthalmopathy. J Clin Endocrinol Metab 1995;80:339-49.
- 51. Bonnema SJ, Bartalena L, Toft AD, Hegedüs L. Controversies in radioiodine therapy: relation to ophthalmopathy, the possible radioprotective effect of antithyroid drugs, and use in large goitres. Eur J Endocrinol 2002;147:1-11.
- 52. Bartalena L, et al. Relation between therapy for hyperthyroidism and the course of Graves' ophthalmopathy. N Engl J Med 1998;338:73-8.
Endereço para correspondência
Datas de Publicação
-
Publicação nesta coleção
28 Maio 2004 -
Data do Fascículo
Fev 2004
Histórico
-
Aceito
10 Dez 2003 -
Recebido
30 Nov 2003