Resumos
A relação tireóide-gônadas sobre o perfil hematológico foi investigada em ratas Wistar adultas castradas e não castradas mantidas em hipotireoidismo induzido pela administração diária de propiltiouracil por 120 dias. Dois grupos eutireóideos não castrado e castrado foram mantidos nas mesmas condições e serviram como controle. Foram colhidos o plasma para dosagem de T4 livre e o sangue para análise hematológica. Os valores de T4 livre significativamente menores nas ratas tratadas confirmaram seu estado hipotireóideo. O hipotireoidismo causou anemia apenas em ratas com gônadas funcionais, já que a castração reverteu os efeitos do déficit de tiroxina sobre o eritrograma. Tanto o hipotireoidismo quanto o hipogonadismo apresentaram pouco significado sobre o leucograma.
Rata; Hipotireoidismo; Castração; Hematologia
The relationship between thyroid-gonads on the blood profile was investigated in adult Wistar female rats. These animals were either castrated or intact and were kept under hypothyroidism, induced by daily administration of propylthiouracil (PTU) during 120 days. Two groups (castrated and intact) were kept in an euthyroid condition and used as controls. It was collected plasma for free T4 dosage and blood for hematological analysis. The significant low values of free T4 in the treated rats confirmed their hypothyroid state. The hypothyroidism caused anemia in the rats with functional gonads. The castration reverted the effects of thyroxine deficit in the erythrogram. Both the hypothyroidism and the hypogonadism showed just a discret effect on the leucogram.
Rat; Hypothyroidism; Castration; Hematology
ARTIGO ORIGINAL
Perfil hematológico de ratas adultas hipotireóideas castradas e não castradas
Blood profile of hypothyroid castrated or intact adult female rats
Mardelene G. Gomes; Rogéria Serakides; Vera Alvarenga Nunes; Cristiana M. da Silva; Rubens A. Carneiro; Natália de M. Ocarino
Departamento de Clínica e Cirurgia Veterinárias, Universidade Federal de Minas Gerais - Escola de Veterinária, Setor de Patologia, Belo Horizonte, MG
Endereço para correspondência Endereço para correspondência Rogéria Serakides Setor de Patologia Depto. de Clínica e Cirurgia Veterinárias da UFMG Av. Antônio Carlos 6627 Caixa Postal 567 31270-901 Belo Horizonte, MG Fax: (31) 3499-2230 e.mail: serakide@dedalus.lcc.ufmg.br
RESUMO
A relação tireóide-gônadas sobre o perfil hematológico foi investigada em ratas Wistar adultas castradas e não castradas mantidas em hipotireoidismo induzido pela administração diária de propiltiouracil por 120 dias. Dois grupos eutireóideos não castrado e castrado foram mantidos nas mesmas condições e serviram como controle. Foram colhidos o plasma para dosagem de T4 livre e o sangue para análise hematológica. Os valores de T4 livre significativamente menores nas ratas tratadas confirmaram seu estado hipotireóideo. O hipotireoidismo causou anemia apenas em ratas com gônadas funcionais, já que a castração reverteu os efeitos do déficit de tiroxina sobre o eritrograma. Tanto o hipotireoidismo quanto o hipogonadismo apresentaram pouco significado sobre o leucograma.
Descritores: Rata; Hipotireoidismo; Castração; Hematologia
ABSTRACT
The relationship between thyroid-gonads on the blood profile was investigated in adult Wistar female rats. These animals were either castrated or intact and were kept under hypothyroidism, induced by daily administration of propylthiouracil (PTU) during 120 days. Two groups (castrated and intact) were kept in an euthyroid condition and used as controls. It was collected plasma for free T4 dosage and blood for hematological analysis. The significant low values of free T4 in the treated rats confirmed their hypothyroid state. The hypothyroidism caused anemia in the rats with functional gonads. The castration reverted the effects of thyroxine deficit in the erythrogram. Both the hypothyroidism and the hypogonadism showed just a discret effect on the leucogram.
Keywords: Rat; Hypothyroidism; Castration; Hematology
TODAS AS CÉLULAS HEMATOPOIÉTICAS originam-se de células-tronco pluripotentes da medula óssea e passam por um processo complexo de diferenciação e maturação, envolvendo uma série de mediadores e sinalizadores (fatores de crescimento, interleucinas, hormônios). Os hormônios tireoidianos, com a miríade de seus efeitos fisiológicos, categorizados em duas amplas classes interdependentes: 1) diferenciação e desenvolvimento celular e 2) metabolismo, influenciam direta ou indiretamente a hematopoiese (1).
É bem conhecida, por exemplo, a redução da massa de eritrócitos e a diminuição dos níveis de eritropoietina no hipotireoidismo (2-4). Entretanto, o mecanismo de interferência da tireóide na eritropoiese é controverso, existindo afirmativas que imputam à anemia uma simples adaptação fisiológica ao decréscimo da demanda de oxigênio (3) e outras a processos mais complexos, como a indiferenciação eritróide (5), a redução da ação do ácido retinóico no programa de diferenciação eritróide (6) e a interferência na síntese de eritropoietina (7).
Não somente a série mielóide das células hematopoiéticas sofrem influência da tireóide. Os hormônios tireoidianos parecem agir como reguladores obrigatórios e positivos na linfopoiese B primária (8,9) e são requeridos para a produção normal das células B na medula óssea, pelo controle da proliferação das células pró-B (10), além de estimularem a síntese de nucleoproteínas, com conseqüente aumento do número de células, principalmente no baço e na medula óssea.
Além dos hormônios tireoidianos afetarem a hematopoiese, os esteróides sexuais masculinos e femininos são reconhecidos como inibidores da produção de linfócitos (11) e afetam o processo de imunorregulação (12,13). Na castração de ratos, independente do sexo, há aumento do número de linfócitos imaturos no timo, com conseqüente aumento periférico das células T e B (14).
Hipotireoidismo e afuncionalidade das gônadas é uma associação freqüente na mulher (15,16) e, embora a influência do eixo tireóide-gônadas seja bem conhecida em vários aspectos (17), é pouco explorada com relação à constituição do sangue periférico. Assim, verificar a influência dos hormônios sexuais e tireoidianos sobre o perfil hematológico foi o escopo desse estudo, feito em ratas adultas hipotireóideas castradas e não castradas e seus pares eutireóideos.
MATERIAL E MÉTODOS
Foram utilizadas 40 ratas Wistar com 2 meses de idade, alojadas em caixas plásticas (cinco ratas/caixa) e recebendo ração comercial (1,4% de cálcio, 0,6% de fósforo e 22% de proteína, além de micronutrientes em concentrações adequadas) e água ad libitum. Os animais foram separados em quatro grupos de 10 e mantidos em regime de 12 horas de luz e 12 horas sem luz. Em dois grupos, as ratas foram castradas e junto com seus pares não castrados (intactos) foram mantidas em estado eutireóideo ou hipotireóideo por 120 dias, constituindo quatro tratamentos, a saber: 1) hipotireóideo castrado; 2) hipotireóideo não castrado; 3) eutireóideo castrado e 4) eutireóideo não castrado.
As ratas submetidas à castração (20 ratas) receberam 0,1ml/100gpv de penicilina G-procaína associada à estreptomicina, por via intramuscular, 24 horas antes da cirurgia. No pré-operatório foi administrado sulfato de atropina (0,2mg/kg), por via subcutânea, e a indução anestésica foi conseguida pelo uso concomitante de Quetalar® (40mg/kg) e Rompum® (10mg/kg), administrados por via intramuscular. Foram realizadas duas incisões látero-dorsais de aproximadamente 1cm de extensão, pelas quais foram exteriorizados os cornos uterinos e os ovários. Após ligadura dos cornos, seguiu-se a extirpação dos ovários e a sutura das incisões cirúrgicas. As ratas foram acompanhadas diariamente até a recuperação completa (sete dias), sendo esta o marco inicial do experimento.
O hipotireoidismo foi induzido pela administração diária de propiltiouracil (Sigma, USA), na dose de 1mg/animal, diluído em 5ml de água destilada, por sonda orogástrica. A ratas mantidas em estado eutireóideo receberam 5ml de água destilada, como placebo, nas mesmas condições.
Aos 120 dias foram colhidas, por punção cardíaca e em tubos heparinizados, amostras de sangue de todos os animais para análise hematológica. Foram determinados o número global de eritrócitos e leucócitos, os valores do hematócrito e da hemoglobina, além dos seguintes índices hematimétricos: volume globular médio (VGM), hemoglobina globular média (HGM) e concentração de hemoglobina globular média (CHGM). O número relativo de reticulócitos (proporcional a 1000 hemácias) foi estabelecido em esfregaços corados pelo azul de cresil brilhante e seu número total estimado, levando-se em conta o número global de hemácias. Esfregaços diretos de sangue periférico foram também obtidos e corados pelo método de MaygrünwaldGiemsa e destinados à contagem diferencial das células sangüíneas. A dosagem plasmática de tiroxina livre foi realizada pela técnica de quimioluminescência em sistema totalmente automático com CV intra-ensaio de 4% e CV inter-ensaio de 7% (Access Immunoassay System, Sanofi Diagnostics Pasteur Inc., Chaska, MN, USA ) a fim de confirmar a indução do estado hipotireóideo. À necropsia, o útero foi avaliado para confirmar o sucesso da castração.
O delineamento experimental foi inteiramente ao acaso, com quatro tratamentos e 10 repetições por tratamento, sendo cada animal uma repetição. A verificação da significância da diferença entre as médias foi realizada pelo teste Student Newman Keuls (SNK) (18,19).
RESULTADOS E DISCUSSÃO
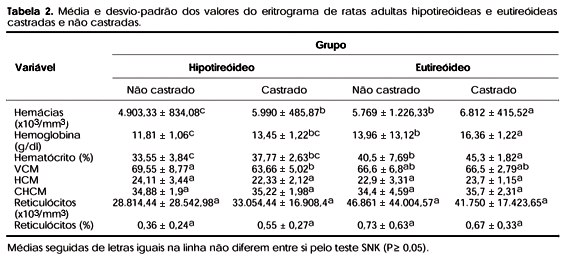
As tabelas 1 a 3 sumariam os resultados do perfil hormonal e hematológico das ratas nos quatro tratamentos após 120 dias de experimentação.
As concentrações plasmáticas de T4 livre foram significativamente menores nos grupos tratados com propiltiouracil, confirmando a indução do hipotireoidismo após 120 dias de administração da droga (tabela 1). Interessante é que a manutenção das gônadas (ratas não castradas) parece ter facilitado a indução da hipofunção tireoidiana pelo propiltiouracil, fazendo com que o nível de T4 livre ficasse cerca de 3,5 vezes menor do que nas ratas castradas, apesar de não ter ocorrido diferença significativa entre os dois grupos hipotireóideos. Por outro lado, a castração por si só foi capaz de induzir à elevação significativa da T4 livre. Mas seria interessante verificar se o hipogonadismo pode compensar o estado de hipofunção tireoidiana, mesmo aquele desencadeado por drogas antitireoidianas em um período mais curto de indução. Já foi verificado que a castração eleva os níveis de T4 livre em ratas no eutireoidismo e no hipertireoidismo (20). Embora a deficiência de estrógeno diminua a concentração da globulina ligadora de tiroxina humana (TBG), elevando a fração livre da tiroxina e a elevação de estrógeno aumente a síntese hepática de TBG, reduzindo T4 livre, diferenças entre homens e mulheres são pequenas, excetuando-se em mulheres gestantes (21). Há resultados de pesquisa que demonstram que ratas castradas não apresentam elevação da TBG plasmática (22), mas o tratamento crônico de ratas com estradiol apesar de não alterar o clearance da TBG injetada, aumentou seu conteúdo de ácido siálico, aumentando a meia vida plasmática da TBG (23). No entanto, mais estudos são necessários para explicar se a elevação de T4 livre na rata induzida pela castração é mediada por alterações na TBG ou por outros mecanismos.
O útero visivelmente atrofiado nas ratas castradas, independente do estado funcional da tireóide, confirmou a eficácia da castração na indução da afuncionalidade das gônadas.
O declínio de T4 livre reduziu o número de eritrócitos circulantes nos animais não castrados (tabela 2). Isto não chega a surpreender, pois o grupo era exatamente o que exibia menor concentração plasmática de T4 livre (tabela 1) e já é bem conhecido que a anemia é quase que uma constante no hipotireoidismo (24). Os valores da hemoglobina e do hematócrito estavam também reduzidos, o que, por definição, significa anemia. Como a hemoglobina corpuscular média (HCM) e a concentração de hemoglobina corpuscular média (CHCM) não variaram em nenhum dos tratamentos, poder-se-ia classificar a anemia do grupo hipotireóideo como isocrômica. Considerando o volume corpuscular médio (VCM), a classificação mais correta seria anemia normocítica e normocrômica. Seria um tipo de anemia não complicada, devido apenas ao déficit dos hormônios tireoidianos, não seguida de qualquer depleção nutricional (24). Este tipo de anemia é considerado como uma adaptação à redução do metabolismo basal e à menor demanda de oxigênio pelos tecidos (3,24). Há de se levar em conta também que a falta dos hormônios tireoidianos possa inibir o crescimento das colônias eritróides, redundando em menor número de células circulantes. A hipótese de que o hipotireoidismo interfere com a diferenciação e maturação das células eritróides (5) não pôde ser confirmado, já que o número de reticulócitos e a morfologia das células não variaram entre os tratamentos.
Já foi descrito que a anemia no hipotireoidismo pode ser normocítica normocrômica, microcítica hipocrômica ou macrocítica. A incidência de anemia normocítica normocrômica no hipotireoidismo é de cerca de 25% (24) e tem sido encontrada em praticamente todos os estudos com indução experimental de hipotireoidismo no homem e em animais. Alguns pacientes hipotireóideos podem apresentar anemia microcítica hipocrômica desencadeada pela deficiência secundária de ferro pelo hipotireoidismo. A anemia macrocítica tem sido associada à deficiência secundária de vitamina B12 e de folato (3).
Interessante é o achado de que o hipotireoidismo não induziu anemia no grupo de ratas castradas. Se a hipotrofia uterina é suficiente para demonstrar o sucesso na indução da afuncionalidade das gônadas, haveria algum efeito da castração em minorar o descenso de T4 livre no estado hipotireóideo? Haveria alguma ação dos andrógenos produzidos pelas adrenais no estímulo da eritropoese como uma tentativa de suplantar a deficiência dos esteróides sexuais ovarianos? Já foi demonstrado que os andrógenos são eficientes no tratamento de anemia induzida pela insuficiência renal crônica (25,26). Mas o mecanismo pelo qual a anemia não ocorre na associação hipotireoidismo-castração necessita ser investigado. Além do mais, esse achado merece ser também investigado em mulheres, a fim de verificar se a associação hipotireoidismo e afuncionalidade das gônadas, tão freqüente (15,16), causa alterações similares às encontradas no eritrograma de ratas hipotireóideas castradas.
A relação tireóide-gônadas não se demonstrou clara apenas no estado hipotireóideo. Nas ratas mantidas em estado eutireóideo e hipogonádico (castradas), o número de eritrócitos circulantes suplantou aquele de todos os outros grupos, inclusive seu par não castrado (tabela 2). Coincidentemente, neste mesmo grupo o nível de T4 livre foi o maior. Isso faz pensar num possível estímulo da eritropoiese, direta ou indiretamente mediada pela T4 livre, o que já foi reconhecido por vários autores (2,27). Como os hormônios sexuais femininos são inibidores da eritropoiese (28), sua falta deveria resultar em aumento da produção de eritrócitos tal como ocorrida. Mas também não se pode afastar a possibilidade da elevação de T4 livre, induzida pela castração, ter estimulado a eritropoiese (tabela 1).
Bem mais estudada que a ação dos hormônios tireoidianos sobre a série eritróide é a atuação da tireóide sobre a formação, diferenciação e competência das células brancas do sangue, principalmente as células do sistema imune. Entretanto, os dados aqui obtidos (tabela 3 ) são pouco esclarecedores e aquelas células ou linhagens normalmente mais sujeitas à ação hormonal tiveram seus parâmetros pouco influenciados, seja pela falta dos hormônios tireoidianos ou dos ovarianos.
Em camundongos, os hormônios tireoidianos agem como reguladores obrigatórios e positivos na linfopoiese B primária (8,9) e são requeridos para a produção normal das células B na medula óssea, pela regulação da proliferação das células pró-B (10). Já os hormônios sexuais femininos e masculinos inibem a produção de linfócitos (11). Ratos fêmeas e machos castrados apresentam aumento do número de linfócitos imaturos no timo, com conseqüente aumento periférico das células T e B (14). Mas, no presente estudo, tanto o hipotireoidismo quanto a castração não alteraram o número global de leucócitos. Apenas algumas poucas alterações foram evidenciadas na contagem diferencial (tabela 3 ), mas sem significado aparente.
Conclui-se que o hipotireoidismo causa anemia normocítica e normocrômica apenas em ratas com gônadas funcionais; que a castração estimula a eritropoiese e é capaz de reverter os efeitos do déficit de tiroxina sobre o eritrograma, e que tanto o hipotireoidismo quanto a castração têm pouco significado sobre o leucograma.
Recebido em 21/01/03
Revisado em 11/06/03, em 14/08/03 e em 10/11/03
Aceito em 14/11/03
- 1. Brent GA. The molecular basis of thyroid hormone action. N Engl J Med 1994;331:847-53.
- 2. Das KC, Mukherjee M, Sarkar TK, Dash RJ, Rastogi GK. Erythropoiesis and erythropoietin in hypo- and hyperthyroidism. J Clin Endocrinol Metab 1975;40:211-20.
- 3. Horton L, Coburn RJ, England JM, Himsworth RL. The haematology of hypothyroidism. Quart J Med 1975;45:101-24.
- 4. Utiger RD. Hypothyroidism. In: De Groot LJ, editor. Endocrinology. v.1 Philadelphia: W.B. Saunders, 1995p.752-68.
- 5. Dinnen RD, White SR, Elsayed S, et al. An endogenous signal triggering erythroid differentiation: identification as thyroid hormone. Cell Growth Differ 1994;5:855-61.
- 6. Schroeder C, Gibson L, Zenke M, Beug H. Modulation of normal erythroid differentiation by endogenous thyroid hormone and retinoic acid receptors: a possible target for v-erbA oncogene action. Oncogene 1992;7:217-27.
- 7. Peterson ME. Hyperthyroidism diseases. In: Ettinger SJ, Feldman EC (eds). Textbook of veterinary internal medicine 2nd ed. Philadelphia: W.B. Saunders, 1995p.1466-87.
- 8. Montecino-Rodriguez E, Clark R, Johnson A, Collins L, Dorshkind K. Defective B cell development in snell dwarf (dw/dw) mice can corrected by thyroxine treatment. J Immunol 1996;157:3334-40.
- 9. Montecino-Rodriguez E, Clark R, Powell-Braxton L, Dorshkind K. Primary B cell development is impaired in mice with defects of the pituitary/thyroid axis. J Immunol 1997;159:2712-9.
- 10. Foster MP, Montecino-Rodriguez E, Dorshkind K. Proliferation of bone marrow pro-B cells is dependent on stimulation by the pituitary/thyroid axis. J Immunol 1999;163:5883-90.
- 11. Kiess W, Belohradsky BH. Endocrine regulation of immune system. Klin Wochemschr 1986;64:1-7.
- 12. Holdstock G, Chastenay B, Krawitt EL. Effects of testosterone, oestradiol and progesterone on immune regulation. Clin Exp Immunol 1982;47:449-56.
- 13. McKenzie CE, Berczi I. Oestrogen dependent suppression of mitogen response in rat lynphocytes. Acta Endocrinol 1987;116:200-4.
- 14. Windinill KF, Lee VWK. Effects of castration on lymphocytes of thymus, spleen an lymph nodes. Tissue & Cell 1998;30:104-11.
- 15. Faughnan M, Lepage R, Fugere P, Bissonnette F, Brossard JH, D'Amour P. Screening for thyroid disease at the menopausal clinic. Clin Invest Med 1995;18:11-8.
- 16. Bilous RW, Tunbridge WM. The epidemiology of hypothyroidism - an update. Baillieres Clin Endocrinol Metab 1988;2:531-40.
- 17. Serakides R. Relaçăo tireóide, gônadas e metabolismo ósseo em ratas adultas hipertireóideas e eutireóideas. Belo Horizonte, Escola de Veterinária, UFMG, 2001 90p. (Tese, doutor em Cięncia Animal).
- 18. Sampaio IBM. Estatística aplicada ŕ experimentaçăo animal. Belo Horizonte: FEP/MVZ, 1998 211p.
- 19. Snedecor GW, Cochran WG. Statistical methods 8th ed. Ames: Iowa State University Press, 1994 503p.
- 20. Serakides R, Nunes VA, Nascimento EF, Ribeiro AFC, Zibaoui HM, Silva CM. Arq Bras Med Vet Zootec 2000;52:571-8.
- 21. Refetoff S, Nicoloff JT. Thyroid hormone and metabolism. In: DeGroot LJ, editor. Endocrinology. v.1 Philadelphia: W.B. Saunders, 1995p.560-82.
- 22. Emerson CH, Cohen JH, Young RA, Alex S, Fang SL. Gender-related differences of serum thyroxine-binding proteins in the rat. Acta Endocrinol (Copenh) 1990;123:72-8.
- 23. Ain KB, Mori Y, Refetoff S. Reduced clearance rate of thyroxine-binding globulin (TBG) with increased sialylation: a mechanism for estrogen-induced elevation of serum TBG concentration. Clin Endocrinol Metab 1987;65:689-96.
- 24. Antonijevic N, Nesovic M, Trbojevic B, Milosevic R. Anemia in hypothyroidism. Med Pregl 1999;52:136-40.
- 25. Lee MS, Ahn SH, Song JH. Effects of adjuvant androgen on anemia and nutritional parameters in chronic hemodialysis patients using low-dose recombinant human erythropoietin. Korean J Intern Med 2002;17:167-73.
- 26. Navarro JF, Mora C. Androgen therapy for anemia in elderly uremic patients. Int Urol Nephrol 2001;32:549-57.
- 27. Sainteny F, Larras-Regard E, Frindel E. Thyroid hormones induce hemopoietic pluripotent stem cell differentiation toward erythropoiesis through the production of pluripoietin-like factors. Esp Cell Res 1990;187:174-6.
- 28. Zucali JR, Mirand EA. Effect of testosterone and oestradiol on erythroprotein production in vitro. Br J Haematol 1977;35:639-45.
Endereço para correspondência
Datas de Publicação
-
Publicação nesta coleção
08 Jul 2004 -
Data do Fascículo
Abr 2004
Histórico
-
Aceito
14 Nov 2003 -
Revisado
10 Nov 2003 -
Recebido
21 Jan 2003