Resumos
Doença celíaca (DC) é uma doença autoimune do intestino delgado com importante associação com HLA-DQ2 e DQ8. Tem o glúten como fator etiológico e a enzima transglutaminase (TGase) tecidual como autoantígeno. A DC é associada a outras doenças autoimunes como diabetes mellitus tipo 1, lupus eritematoso sistêmico, artrite reumatóide, síndrome de Sjögren e doenças autoimunes da tireóide. O objetivo deste estudo foi investigar a ocorrência de anticorpos séricos da classe IgA anti-endomísio e anti-TGase tecidual humana em indivíduos com anticorpo anti-tireoidiano (AAT) positivo. Foi também pesquisada a concordância destes dois marcadores. Anticorpos anti-endomísio foram positivos em 10 de 456 (2,2%) e anti-TGase tecidual foi positiva em 14 de 454 (3,1%) dos indivíduos com AAT positivo. No grupo controle, 1 de 197 (0,5%) e 2 de 198 (1%) foram positivos para anticorpo anti-endomísio e anti-TGase tecidual humana, respectivamente. A chance de positividade dos anticorpos anti-endomísio foi de 4,42 e do anti-TGase tecidual humana 3,12 vezes maior nos indivíduos com positividade para AAT que nos controles. Um elevado índice de concordância (k= 0,84) foi obtido entre os testes para anticorpos anti-endomísio e anti-TGase. Os resultados obtidos neste trabalho não justificam uma triagem rotineira de DC em portadores de AAT. Concluímos que a pesquisa de anticorpos anti-TGase mostrou-se um teste útil para rastrear DC.
Doença celíaca; Doença autoimune da tireóide; Marcadores sorológicos; Transglutaminase tecidual
Celiac disease (CD) is an autoimmune disease of the small bowel characterized by a strong genetic association with HLA - DQ2 and DQ8. Gluten is the etiological factor and the tissue enzyme transglutaminase (TGase) is its autoantigen. CD is associated with several autoimmune diseases such as type 1 diabetes, systemic lupus erythematous, rheumatoid arthritis, Sjögren’s syndrome and autoimmune thyroid diseases. The aim of this study was to investigate the occurrence of serum IgA anti-endomysial and anti-human TGase antibodies in individuals with positive anti-thyroid antibody (ATA). The concordance between these two tests was also evaluated. Anti-endomysial antibodies were positive in 10 out of 456 (2.2%) and anti-human TGase were positive in 14 of 454 (3.1%) individuals with positive ATA. In control subjects they were positive in 1 of 197 (0.5%) and 2 of 198 (1%) for anti-endomysial and anti-human tissue TGase antibodies, respectively. The odds ratio (OR) for the anti-endomysial antibodies was 4.42 and for the anti-human TGase 3.12 in individuals with ATA when compared with controls. An elevated concordance index (k= 0.84) was observed between anti-endomisyal antibodies and anti-human TGase. We conclude that the determination of anti-TGase antibodies is a good test for DC screening.
Celiac disease; Thyroid autoimmune disease; Serum markers; Human tissue transglutaminase
ARTIGO ORIGINAL
Associação entre marcadores sorológicos de doença celíaca e das doenças autoimunes da tireóide
Association between serum markers for celiac and thyroid autoimmune diseases
Francisco M. de Melo; Maria S.M. Cavalcanti; Severino B. dos Santos; Ana K.B.F. Lopes; Felipe A.A. de Oliveira
Departamento de Patologia (FMM, MSMC), ICB; e Departamento de Medicina Clínica (SBS), Faculdade de Ciências Médicas, Universidade de Pernambuco, Recife, PE
Endereço para correspondência Endereço para correspondência Maria do Socorro de Mendonça Cavalcanti Rua Monsenhor Silva 145, apto. 202 50610-360 Recife, PE E-mail: socorro@icb.upe.br
RESUMO
Doença celíaca (DC) é uma doença autoimune do intestino delgado com importante associação com HLA-DQ2 e DQ8. Tem o glúten como fator etiológico e a enzima transglutaminase (TGase) tecidual como autoantígeno. A DC é associada a outras doenças autoimunes como diabetes mellitus tipo 1, lupus eritematoso sistêmico, artrite reumatóide, síndrome de Sjögren e doenças autoimunes da tireóide. O objetivo deste estudo foi investigar a ocorrência de anticorpos séricos da classe IgA anti-endomísio e anti-TGase tecidual humana em indivíduos com anticorpo anti-tireoidiano (AAT) positivo. Foi também pesquisada a concordância destes dois marcadores. Anticorpos anti-endomísio foram positivos em 10 de 456 (2,2%) e anti-TGase tecidual foi positiva em 14 de 454 (3,1%) dos indivíduos com AAT positivo. No grupo controle, 1 de 197 (0,5%) e 2 de 198 (1%) foram positivos para anticorpo anti-endomísio e anti-TGase tecidual humana, respectivamente. A chance de positividade dos anticorpos anti-endomísio foi de 4,42 e do anti-TGase tecidual humana 3,12 vezes maior nos indivíduos com positividade para AAT que nos controles. Um elevado índice de concordância (k= 0,84) foi obtido entre os testes para anticorpos anti-endomísio e anti-TGase. Os resultados obtidos neste trabalho não justificam uma triagem rotineira de DC em portadores de AAT. Concluímos que a pesquisa de anticorpos anti-TGase mostrou-se um teste útil para rastrear DC.
Descritores: Doença celíaca; Doença autoimune da tireóide; Marcadores sorológicos; Transglutaminase tecidual
ABSTRACT
Celiac disease (CD) is an autoimmune disease of the small bowel characterized by a strong genetic association with HLA DQ2 and DQ8. Gluten is the etiological factor and the tissue enzyme transglutaminase (TGase) is its autoantigen. CD is associated with several autoimmune diseases such as type 1 diabetes, systemic lupus erythematous, rheumatoid arthritis, Sjögrens syndrome and autoimmune thyroid diseases. The aim of this study was to investigate the occurrence of serum IgA anti-endomysial and anti-human TGase antibodies in individuals with positive anti-thyroid antibody (ATA). The concordance between these two tests was also evaluated. Anti-endomysial antibodies were positive in 10 out of 456 (2.2%) and anti-human TGase were positive in 14 of 454 (3.1%) individuals with positive ATA. In control subjects they were positive in 1 of 197 (0.5%) and 2 of 198 (1%) for anti-endomysial and anti-human tissue TGase antibodies, respectively. The odds ratio (OR) for the anti-endomysial antibodies was 4.42 and for the anti-human TGase 3.12 in individuals with ATA when compared with controls. An elevated concordance index (k= 0.84) was observed between anti-endomisyal antibodies and anti-human TGase. We conclude that the determination of anti-TGase antibodies is a good test for DC screening.
Keywords: Celiac disease; Thyroid autoimmune disease; Serum markers; Human tissue transglutaminase
A DOENÇA CELÍACA (DC) é uma síndrome que afeta crianças e adultos e tem, classicamente, sintomatologia gastrointestinal com conseqüente má absorção de alimentos, embora outras formas oligossintomática, atípica, latente, silenciosa ou em potencial também possam ocorrer. Alguns pacientes podem desenvolver complicações sem diagnóstico prévio de DC, como a osteoporose, fraturas ósseas, sangramento intestinal agudo, ulceração intestinal com ou sem perfurações e tumores malignos, particularmente linfomas (1-3).
Essa sintomatologia clássica se deve à intolerância do intestino, principalmente da porção proximal, com potencial genético definido, à gliadina presente no glúten e a outras prolaminas encontradas em cereais tais como trigo, centeio e cevada, os quais causam lesões características, embora não específicas, que dificultam a absorção de nutrientes (2,4).
A DC está associada ao sistema HLA classe II, DQ2 (Alelos DQ A1*0501 e B1*02) e DQ8 (Alelos DQA1*03 e DQB1*0302) encontrado no braço curto do cromossomo 6 (5).
A DC era de confirmação difícil até a introdução de testes sorológicos que permitem o rastreamento populacional e a identificação dos casos oligossintomáticos ou assintomáticos (6,7). Um desses testes, utilizando a transglutaminase humana como antígeno (tTG-H), tem mostrado sensibilidade e especificidade próxima de 100% (8,9).
A co-existência da DC com outras doenças autoimunes, como o diabetes mellitus tipo 1, doença de Addison, lupus eritematoso sistêmico, artrite reumatóide, síndrome de Sjögren, hepatite autoimune, cirrose biliar primária e estomatite de repetição, tem sido relatada com freqüência, sugerindo anormalidade intrínseca na regulação do sistema imune (10-12). A freqüência da DC nos pacientes com doenças autoimunes da tireóide (DAT) tem se mostrado de quatro a oito vezes maior do que na população geral ou em doadores de sangue (13,14).
O objetivo deste estudo foi determinar a freqüência de marcadores sorológicos da DC em indivíduos com anticorpo anti-tireoidiano positivo.
MATERIAL E MÉTODOS
O desenho do estudo foi analítico, do tipo corte transversal, e os sujeitos do estudo foram indivíduos atendidos em um laboratório privado da cidade de Recife, PE, que realizaram coleta de sangue no período de março a setembro de 2003, seguindo critérios de conveniência. Essa amostra foi estratificada segundo o sexo e faixa etária. O grupo de casos foi constituído de 457 indivíduos com idade variando entre 8 e 71 anos, de ambos os sexos, e que apresentaram positividade dos anticorpos anti-tireoidianos aos exames; e o grupo controle foi de 198 indivíduos de ambos os sexos, com idade variando entre 10 e 69 anos, que realizaram coleta de sangue para testes solicitados por seu médico assistente não relacionados diretamente a doenças da tireóide ou doença celíaca.
Os incluídos e considerados como casos, foram aqueles com concentrações ou títulos dos anticorpos anti-peroxidase tireoidiana > 60UI/ml ou anti-microssomal > 1/200 ou anti-tireoglobulina > 1/200; já o grupo controle foi formado por indivíduos eutireóideos, com ausência de todos os anticorpos anti-tireoidianos pesquisados ou níveis não significativos (anti-peroxidase tireoidiana < 40UI/ml, ou anticorpo anti-microssomal < 1/100 e anticorpo anti-tireoglobulina < 1/100).
Foram considerados como critérios de exclusão para o grupo de casos pacientes com síndrome de Down, com diabetes mellitus tipo 1 e com deficiência de IgA; e para o grupo controle, os pacientes em uso de drogas anti-tireoidianas ou hormônio tireoidiano e TSH e/ou T4 livre fora dos limites da normalidade.
Todos os pacientes, casos e controles, foram informados sobre o estudo e assinaram um termo de participação em pesquisa, após a aprovação do Comitê de Ética da Universidade de Pernambuco (UPE).
Nos indivíduos considerados como casos e nos controles foram pesquisados ou dosados os seguintes parâmetros: Imunoglobulina A sérica (IgA) (Imunoturbidimetria, Biosystems, Espanha), Anticorpo Anti-peroxidase Tireoidiana (Anti-TPO), (ELISA, Wallac Oy, Finlândia) ou Anticorpo Antimicrossomal (AcAM) (Microaglutinação de gelatina, Serodia, Japão) ou Anticorpo Anti-tireoglobulina (AcAT) (Microaglutinação de gelatina, Serodia, Japão), Tetraiodotironina Livre (T4 Livre) e Hormônio estimulador da Tireóide (TSH) (Imunofluorimetria, Wallac, Oy, Finlândia), Anticorpo Anti-endomísio da classe IgA (EMA) (Imunofluorescência, Biosystems, Espanha), e Anticorpo anti-transglutaminase humana da classe IgA (tTG-H) (ELISA, Biosystems, Espanha).
No processamento dos dados foi considerado um "poder do teste" de 80%, um intervalo de confiança (IC) de 95% e p< 0,05. Os graus de concordância entre os testes sorológicos foram determinados pelos cálculos de freqüência de resultados concordantes (índice de KAPPA). A diferença de ocorrência dos marcadores sorológicos de DC entre os grupos casos/controle foi analisada pelo teste Qui-Quadrado (c2).
RESULTADOS
A amostra utilizada no presente estudo foi composta de 69,8% de indivíduos com positividade para anticorpos anti-tireoidianos (AAT) e 30,2% de controles sem positividade para este anticorpo. Na distribuição de indivíduos segundo o sexo, verificou-se que a grande maioria, 89,6%, foi do sexo feminino, sendo apenas 10,4% (68/655) do sexo masculino. Entre os casos, 91% eram do sexo feminino e 86,4% controles. Quando analisados em relação ao sexo, não houve diferença significativa entre indivíduos com AAT e os controles.
Na distribuição dos pacientes por faixa etária, a idade variou nos casos entre 8 e 71 anos, sendo a média de 43,8 anos. A média de idade dos EMA positivos foi de 34,5 anos. Nos controles a idade variou de 10 a 69 anos, sendo a média de 38 anos. Distribuídos em faixas etárias, 50,3% dos casos estão na faixa etária entre 40 e 59 anos, enquanto nos controles o maior percentual (38,9%) foi na faixa entre 20 e 39 anos de idade. Observamos uma associação significativa entre a idade e a presença de AAT, sendo que nas faixas de 40 a 59 anos e maiores de 60 anos, as chances (OR) de ter estes anticorpos foram de 4,38 e 3,20 vezes maior, respectivamente, quando comparados aos indivíduos com idade abaixo de 13 anos.
Em relação aos níveis de IgA, a média nos doentes com positividade para anticorpos anti-tireoidianos foi de 257mg/dl, e nos controles a média foi de 176,5mg/dl, havendo diferença estatisticamente significativa (p< 0,001).
Na população estudada, o percentual de positividade do EMA foi de 1,7% (tabela 1); nos portadores de anticorpo anti-tireoidianos positivo, o percentual foi de 2,2%, enquanto que nos controles este percentual foi de 0,5%, demonstrando chance (OR) de se encontrar positividade para EMA de 4,42 vezes maior nos portadores de anticorpo anti-tireoidianos positivo, embora esta associação não tenha sido significativa (p= 0,186).
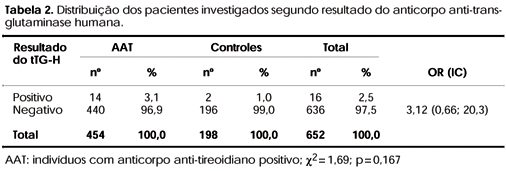
Utilizando o tTG-H, o percentual de positivos nos casos foi de 3,1% e de 1,0% nos controles. Não houve associação estatística significativa (p= 0,167), mas a chance (OR) de um teste tTG-H ser positivo foi de 3,12 vezes maior nos casos do que nos controles (tabela 2).
Avaliando sensibilidade e especificidade do tTG-H, comparando com o padrão-ouro sorológico (EMA), obtivemos uma alta sensibilidade (100%), especificidade (99,2%) e valor preditivo positivo (VPP) de 100.
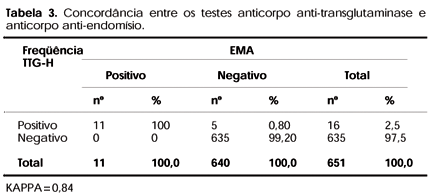
Verificando a concordância entre os testes tTG-H e EMA (tabela 3), encontramos que o tTG-H foi 100% concordante com o EMA positivo, e em 99,2% quando negativo, mostrando um índice de KAPPA igual a 0,84.
DISCUSSÃO
A disponibilidade de técnicas sorológicas sensíveis e específicas para o diagnóstico de DC possibilitou estudos de triagem populacional que demonstraram ser esta doença relativamente comum. Antes destes testes, só critérios clínicos e histológicos eram disponíveis, e as formas assintomáticas ou oligossintomáticas de DC não eram diagnosticadas, e os pacientes eram submetidos a técnicas de diagnóstico invasivas desnecessárias (2,15).
A padronização da imunofluorescência indireta para pesquisa de EMA tem demonstrado sensibilidade e especificidade próximas de 100%, mas é um teste de custo elevado, laborioso e depende do operador, portanto não indicado para triagem populacional (7,16).
A ocorrência de tTG-H (1%) e EMA (0,5%) nos controles deste estudo foi próxima à prevalência de DC encontrada em diferentes regiões. Poucos são os estudos de prevalência de DC realizados no Brasil, particularmente na população geral ou de adultos, que possam ser comparados com os indivíduos testados neste estudo (17-20).
Em estudo realizado no Recife, PE, foi utilizado anti-transglutaminase de fígado de cobaia da classe IgA (tTG-gp) para triagem inicial de DC e, depois, EMA e tTG-H para confirmação. O estudo encontrou uma soroprevalência de tTG-H de 2,6% e de EMA próxima a 1,6%, acima do encontrado no presente trabalho. Este estudo difere do nosso em diversos aspectos, pois foi realizado em crianças e adolescentes, nos quais a DC sintomática é mais freqüente. A população estudada foi inicialmente atendida em ambiente hospitalar (17).
Um estudo realizado na Argentina contribuiu para esclarecer as características epidemiológicas de DC na América do Sul. Neste estudo foram triados por AGA IgG e AGA IgA, 2000 indivíduos e depois testados por EMA. Só os pacientes EMA positivos foram biopsiados. A prevalência definida de 0,75%, neste estudo, é similar à encontrada por nós (21).
Recentemente foi divulgado um estudo multicêntrico de larga escala nos Estados Unidos da América que envolveu 13.145 indivíduos que, utilizando AGA e EMA como método de triagem, definiu uma prevalência de 0,75% de DC naquele país, semelhante às maiores prevalências descritas nos países europeus (22).
Encontramos na DC praticamente todos os critérios definidos pela OMS para doenças que devem ser triadas na população geral; é uma doença relativamente comum, a retirada do glúten da dieta é um tratamento efetivo, complicações tardias podem ser evitadas e existem testes sorológicos de baixo custo, facilmente realizáveis, muito sensíveis e específicos, sendo a tTG-H um deles.
Utilizando neste estudo o EMA, teste sorológico considerado "padrão ouro" laboratorial e o tTG-H, encontramos 11 casos positivos com o primeiro teste, sendo 10 nos casos e 1 nos controles. No segundo, encontramos 15 casos positivos, 14 nos casos e 1 nos controles. Considerando os indivíduos com EMA positivo como casos verdadeiros de DC, baseando-se na especificidade de 100% deste testes, teríamos para tTG-H sensibilidade de 100%, especificidade de 99,2%, VPP de 68,8% e valor preditivo negativo (VPN) de 100%. Estes testes apresentaram nível de concordância elevado (índice KAPPA 0,85). Estes dados estão compatíveis com o encontrado em outros estudos (22-24).
Em um estudo que envolveu 130 indivíduos submetidos a biopsia duodenal, 15 pacientes apresentaram atrofia total ou parcial das vilosidades. Os 115 pacientes com biopsia duodenal normal formaram o grupo controle. Todos os pacientes com DC foram EMA e tTG-H positivos (15/130), e no grupo controle todos os indivíduos foram EMA negativo (0/115) e cinco foram tTG-H positivo. A especificidade foi de 100% para EMA e tTG-H. O VPP foi de 100% para o EMA e 71% para o tTG-H. Este estudo, como o nosso, apresentou alguns casos de possíveis falso-positivos com tTG-H (15).
No estudo de Tesei e cols. (2003), ficou evidente o que foi relatado no parágrafo acima. Eles testaram 250 pacientes com DC e 176 indivíduos sabidamente não celíacos para EMA e tTG-H, e encontraram sensibilidade, especificidade, VPP e VPN para tTG-H de 91%, 96%, 97% e 87% respectivamente, enquanto o EMA mostrou valores de 86%, 100%, 100% e 83% para os mesmos parâmetros. Estes autores concluíram que tTG-H identificou paciente com DC que não foi identificado pelo EMA (25). Trevisol e cols. 2002 relataram a superioridade da tTG-H em relação ao EMA. Eles testaram 1158 indivíduos, dos quais 146 foram tTG-H positivo, destes 140 tiveram DC confirmada por biopsia e só 126 foram identificados pelo EMA (26).
A maior prevalência de DC nos pacientes com DAT tem sido demonstrada por vários autores (14,27,28).
Neste estudo, evidenciamos uma chance (OR) de 3,12 e 4,42 vezes maior de se encontrar um teste positivo para tTG-H e EMA, respectivamente, nos indivíduos com positividade para anticorpos anti-tireoidianos do que nos controles. O EMA foi positivo em 2,2% dos pacientes com anticorpos anti-tireoidianos positivos e 0,5% nos controles, enquanto o tTG-H foi positivo em 3,1% dos indivíduos com anticorpos anti-tireoidianos e em 1% nos indivíduos do grupo controle. Tais diferenças não foram significativas. Estes dados são divergentes de alguns estudos que encontraram associação entre doença autoimune da tireóide diagnosticada por outros critérios, além dos autoanticorpos tireoidianos.
Utilizando EMA como triagem, um estudo da Itália realizado em ambiente hospitalar, selecionando os pacientes com DAT segundo as recomendações da Sociedade Americana de Tireóide, encontrou o teste positivo em 3,3% dos pacientes que foram confirmados por biopsia (5/152), 10 vezes mais do que o esperado na população geral (29).
Outros pesquisadores italianos, também utilizando EMA para triagem de DC, identificaram 3,4% (6/172) pacientes com DAT e com DC. Comparando com a prevalência de 0,75% (3/396) do grupo controle, a diferença foi significativa (13).
Volta e cols. (2001) encontraram prevalência de DC significativamente maior em pacientes com DAT do que em doadores de sangue (0,4%) (p= 0,022). Estes autores recomendam a triagem de DC rotineira nos pacientes com DAT. O grupo controle deste estudo, que é de indivíduos supostamente sadios (doadores de sangue), difere do nosso, que teve base laboratorial (28).
Ravaglia e cols. (2003), testando 737 pacientes com DAT e um grupo controle com 600 indivíduos sem DAT para Ttg-H e EMA, só identificaram associação significativa de DAT e DC nos pacientes com > 65 anos de idade (> 65 anos, p= 0,024) (< 65 anos, p= 0,6%). O número de pacientes com 65 anos ou mais em nosso estudo não permite esta análise (30).
Os resultados obtidos neste trabalham não justificam uma triagem rotineira de DC em portadores de anticorpos anti-tireoidianos, embora os intervalos de confiança encontrados apontem para uma necessidade de aumento da amostragem, o que poderia resultar em um "p" significativo.
AGRADECIMENTOS
À empresa Biosystems, Espanha, pelo fornecimento dos kits utilizados no presente estudo.
Recebido em 04/08/04
Revisado em 05/04/05 e 22/06/05
Aceito em 28/06/05
- 1. Fitzpatrick LA. Sencondary causes of osteoporosis. Mayo Clin Proc 2002;77:453-68.
- 2. Hill ID, Bhatnagar S, Cameron DJ, De Rosa S, Maki M, Russell GJ, et al. Celiac disease: working group report of the first World Congress of Pediatric, Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2002;35:78-88.
- 3. Kumar V, Rajadhyaksha M, Wortsman J. Celiac disease associated autoimmune endocrinopathies. Clin Diagn Lab Immunol 2001;8:678-85.
- 4. Preiser CMF. Gastrointestinal Pathology: an atlas and text. In: Gastrointestinal pathology an atlas and text. 2nd ed. Philadelphia: Lippincott-Raven; 1999 p.419-27.
- 5. Fasano A. Tissue transglutaminase: The holy grail for diagnosis of celiac disease, at last? J Pediatr 1999;2:134-5.
- 6. Vogelsang H, Genser D, Wyatt J, Lochs H, Ferenci P, Granditsch G, et al. Screening for celiac disease: a prospective study on the value of noninvasive tests. Am J Gastroenterol 1995;90:394-8.
- 7. Volta U, Molinaro N, Fusconi M, Cassani F, Bianchi FB. IgA antiendomysial antibody test. A step forward in celiac disease screening. Dig Dis Sci 1999;36:752-6.
- 8. Hansson T, Dahlbom I, Hall J, Holtz A, Elfman L, Dannaeus A, et al. Antibody reactivity against human and guinea pig tissue transglutaminase in children with celiac disease. J Pediatr Gastroenterol Nutr 2000;30:379-84.
- 9. Hin H, Bird G, Fisher P, Mahy N, Jewell D. Coeliac disease in primary care: case of study. BMJ 1999;318:164-71.
- 10. Buchanan WW. The Relationship of Hashimotos thyroiditis to rheumatoid arthritis. Geriatrics 1965;20:941-8.
- 11. Morita S, Matsuda M. Prevalence of nonthyroid specific autoantibodies in autoimmune thyroid disease. J Clin Endocrinol Metab 1995;80:1203-6.
- 12. Mulhern LM, Masi AT, Shulman LE. Hashimotos disease. A search for associated disorders in 170 clinically detected cases. Lancet 1966;2:508.
- 13. Berti I, Trevisiol C, Tommasini A, Citta A, Neri E, Geatti O, et al. Usefulness of screening of celiac disease in autoimmune thyroiditis. Diag Dis Scio 2000;45:403-6.
- 14. Collin P, Maki M. Associated disorders in coeliac disease. Clinical aspects. Scand J Gastroenterol 1994;29:769-75.
- 15. Carroccio A, Di Prima L, Falci C, Le Moli C, Soresi M, Montalto G, et al. Predictive value of serological test in diagnosis of celiac disease. Ann Ital Med Int 2002;17:102-7.
- 16. Dieterich W, Laag E, Schopper H, Volta U, Ferguson A, Gillett H, et al. Antibodies to tissue transglutaminase as predictors of celiac disease. Gastroenterology 1998;115:1317-21.
- 17. Brant TKG. Soroprevalência de doença celíaca em crianças atendidas no IMIP 2000. Dissertação (Mestrado em Pediatria) Universidade Federal de Pernambuco 2000.
- 18. de Freitas IN, Sipahi AM, Damiao AO, de Brito T, Cancado EL, Leser PG, et al. Celiac disease in Brazilian adults. J Clin Gastroenterol 2002;34:430-4.
- 19. Gandolfi L, Pratesi R, Cordoba JC, Tauil PL, Gasparin M, Catassi C. Prevalence of celiac disease among blood donors in Brazil. Am J Gastroenterol 2000;95:579-80.
- 20. Utiyama S, Kotze L, Nisihara R, et al. Correlação dos anticorpos anti-endomísio e anti-transglutaminase com a doença celíaca. RBAC SP 2002;34:39-45.
- 21. Gomez JC, Selvaggio GS, Viola M, Pizarro B, la Motta G, de Barrio S, et al. Prevalence of celiac disease in Argentina: screening of an adult population in the La Plata area. Am J Gastroenterol 2001;96:2700-4.
- 22. Fasano A, Berti I, Gerarduzzi T, Not T, Colletti RB, Drago S, et al. Prevalence of celiac disease in at-risk and not-at-risk groups in United States: A large multicenter study. Arch Intern Med 2003;163:286-92.
- 23. Corazza GR, Biagi F, Andreani ML, Gasbarrini G. Screening test for coelic disease. Lancet 1997;349:325-6.
- 24. Carroccio A, Vitale G, Di Prima L, Chifari N, Napoli S, La Russa C, et al. Comparison of anti-transglutaminase ELISAS and anti-endomysial antibodies assay in the diagnosis of celiac disease: a prospective study. Clin Chem 2002;48:1546-50.
- 25. Tesei N, Sugai E, Vazquez H, Smecuol E, Niveloni S, Mazure R, et al. Antibodies to human recombinant tissue transglutaminase may detect coeliac disease patients undiagnosed by endomysial antibodies. Aliment Pharmacol Ther 2003;17:1415-23.
- 26. Trevisiol C, Ventura A, Baldas V, Tommasini A, Santon D, Martelossi S, et al. A reliable screening procedure for coeliac disease in clinical practice. Scand J Gastroenterol 2002;37:679-84.
- 27. Valentino R, Savastano S, Tommaselli AP, Dorato M, Scarpitta MT, Gigante M, et al. Prevalence of coeliac disease in patients with thyroid autoimmunity. Horm res 1999;51:124-7.
- 28. Volta U, Ravaglia G, Granito A, Forti P, Maioli F, Petrolini N, et al. Coeliac disease in patients with autoimmune thyroiditis. Digestion 2001;64:61-5.
- 29. Sategna-Guidetti C, Bruno M, Mazza E, Carlino A, Predebon S, Tagliabue M, et al. Autoimmune thyroid diseases and coeliac disease. EUR Gastroenterol Hepatol 1998;10:927-31.
- 30. Ravaglia G, Forti P, Maioli F, Volta U, Arnone G, Pantieri G, et al. Increased prevalence of coeliac disease in autoimmune thyroiditis is restricted to aged patients. Exp Gerontol 2003;38:589-95.
Datas de Publicação
-
Publicação nesta coleção
19 Out 2005 -
Data do Fascículo
Ago 2005
Histórico
-
Revisado
05 Abr 2005 -
Recebido
04 Ago 2004 -
Aceito
28 Jun 2005