Resumos
A suspensão da corticoterapia é a causa mais comum de insuficiência supra-renal, e ainda persistem dúvidas quanto à melhor forma de avaliação da inibição e recuperação do eixo hipotalâmico-hipofisário-adrenal (HHA) provocada pelos glicocorticóides. O objetivo deste estudo foi avaliar a utilidade da dosagem do cortisol basal na avaliação desta insuficiência. Foram avaliadas 35 crianças (mediana da idade de 6,9 anos) submetidas ao tratamento preconizado pelo Grupo Brasileiro para o tratamento da Leucemia Linfocítica Aguda (LLA). O teste de estímulo com o hormônio liberador da corticotrofina (CRH 1 mcg/kg) foi realizado antes da introdução da dexametasona (6 mg/m²/dia, por 28 dias), no 8º e no 28º dias do uso do glicocorticóide e 48 horas e um mês após sua retirada. Houve inibição da secreção do cortisol basal e da concentração máxima (após CRH) durante a corticoterapia e 48 horas após sua suspensão, em relação ao valor obtido antes do tratamento (p< 0,01 e p< 0,0001, respectivamente, para os três exames). Um mês após o término da corticoterapia, o valor do cortisol basal e a concentração máxima não apresentavam diferença significativa em relação ao aferido antes do tratamento. Observou-se correlação positiva e significativa entre as concentrações basais e máximas do cortisol em todos os testes realizados. Observou-se, ainda, que ao considerarmos o limite inferior de cortisol basal de 8,5 mcg/dl obtivemos 95% de especificidade para o diagnóstico da insuficiência adrenal. Concluímos que o uso do cortisol basal é de utilidade como marcador da função supra-renal em crianças durante a suspensão do tratamento e após corticoterapia.
Cortisol basal; Glicocorticóides; LLA; Insuficiência adrenal
The glucocorticoid-induced inhibition that occurs after discontinuation of treatment is the most frequent cause of adrenal insufficiency. There are yet some doubts about the best way of evaluating the hypothalamic-pituitary-adrenal (HPA) axis in those patients. The main objective of this study was to evaluate the utility of basal cortisol in diagnosing adrenal insufficiency. Thirty-five children with acute lymphoid leukemia (ALL) receiving glucocorticoid therapy (median age of 6.9 years) were evaluated. A stimulus test with corticotropin releasing hormone (CRH 1 mcg/kg) was performed before the introduction of dexamethasone (6 mg/m²/day, for 28 days), in the 8th and the 28th days of glucocorticoid therapy, and 48 hours and one month after discontinuation of therapy. Suppression of the basal secretion as well as the maximum concentration of cortisol (post-CRH) occurred during glucocorticoid therapy, which persisted for 48 hours after the steroid was removed from treatment (p< 0.01 and p< 0.0001, respectively, for the three tests). One month after ceasing the administration of the glucocorticoid, the basal secretion, as well as the maximum concentration of cortisol, were similar to that before glucocorticoid therapy. There was a positive and statistically significant correlation between basal secretion and maximum concentration of cortisol in all tests. We observed 95% of specificity for the diagnosis of adrenal insufficiency when the inferior limit of basal cortisol was 8.5 mcg/dl. According to these results we concluded that basal secretion of cortisol is a good marker of supra-renal function in evaluating children after discontinuation of glucocorticoid therapy.
Basal cortisol; Glucocorticoids; ALL; Adrenal insufficiency
ARTIGO ORIGINAL
Avaliação da recuperação do eixo hipotalâmico-hipofisário-adrenal após corticoterapia por meio do cortisol basal
Evaluation of hypothalamic-pituitary-adrenal axis recovery after corticotherapy by using basal cortisol secretion
Ivani N. Silva; Cristiane F. Cunha; Francisca L. Finch; Enrico A. Colosimo
Divisão de Endocrinologia Infantil e do Adolescente, Departamento de Pediatria da Faculdade de Medicina, Hospital das Clínicas, UFMG, Belo Horizonte, MG
Endereço para correspondência Endereço para correspondência: Ivani Novato Silva Divisão de Endocrinologia Infantil e do Adolescente Hospital das Clínicas / Faculdade de Medicina da UFMG Av. Alfredo Balena 190, sala 4061 30130-100 Belo Horizonte, MG E-mail: ivanins@medicina.ufmg.br
RESUMO
A suspensão da corticoterapia é a causa mais comum de insuficiência supra-renal, e ainda persistem dúvidas quanto à melhor forma de avaliação da inibição e recuperação do eixo hipotalâmico-hipofisário-adrenal (HHA) provocada pelos glicocorticóides. O objetivo deste estudo foi avaliar a utilidade da dosagem do cortisol basal na avaliação desta insuficiência. Foram avaliadas 35 crianças (mediana da idade de 6,9 anos) submetidas ao tratamento preconizado pelo Grupo Brasileiro para o tratamento da Leucemia Linfocítica Aguda (LLA). O teste de estímulo com o hormônio liberador da corticotrofina (CRH 1 mcg/kg) foi realizado antes da introdução da dexametasona (6 mg/m2/dia, por 28 dias), no 8º e no 28º dias do uso do glicocorticóide e 48 horas e um mês após sua retirada. Houve inibição da secreção do cortisol basal e da concentração máxima (após CRH) durante a corticoterapia e 48 horas após sua suspensão, em relação ao valor obtido antes do tratamento (p< 0,01 e p< 0,0001, respectivamente, para os três exames). Um mês após o término da corticoterapia, o valor do cortisol basal e a concentração máxima não apresentavam diferença significativa em relação ao aferido antes do tratamento. Observou-se correlação positiva e significativa entre as concentrações basais e máximas do cortisol em todos os testes realizados. Observou-se, ainda, que ao considerarmos o limite inferior de cortisol basal de 8,5 mcg/dl obtivemos 95% de especificidade para o diagnóstico da insuficiência adrenal. Concluímos que o uso do cortisol basal é de utilidade como marcador da função supra-renal em crianças durante a suspensão do tratamento e após corticoterapia.
Descritores: Cortisol basal; Glicocorticóides; LLA; Insuficiência adrenal
ABSTRACT
The glucocorticoid-induced inhibition that occurs after discontinuation of treatment is the most frequent cause of adrenal insufficiency. There are yet some doubts about the best way of evaluating the hypothalamic-pituitary-adrenal (HPA) axis in those patients. The main objective of this study was to evaluate the utility of basal cortisol in diagnosing adrenal insufficiency. Thirty-five children with acute lymphoid leukemia (ALL) receiving glucocorticoid therapy (median age of 6.9 years) were evaluated. A stimulus test with corticotropin releasing hormone (CRH 1 mcg/kg) was performed before the introduction of dexamethasone (6 mg/m2/day, for 28 days), in the 8th and the 28th days of glucocorticoid therapy, and 48 hours and one month after discontinuation of therapy. Suppression of the basal secretion as well as the maximum concentration of cortisol (post-CRH) occurred during glucocorticoid therapy, which persisted for 48 hours after the steroid was removed from treatment (p< 0.01 and p< 0.0001, respectively, for the three tests). One month after ceasing the administration of the glucocorticoid, the basal secretion, as well as the maximum concentration of cortisol, were similar to that before glucocorticoid therapy. There was a positive and statistically significant correlation between basal secretion and maximum concentration of cortisol in all tests. We observed 95% of specificity for the diagnosis of adrenal insufficiency when the inferior limit of basal cortisol was 8.5 mcg/dl. According to these results we concluded that basal secretion of cortisol is a good marker of supra-renal function in evaluating children after discontinuation of glucocorticoid therapy.
Keywords: Basal cortisol; Glucocorticoids; ALL; Adrenal insufficiency
A SUSPENSÃO DA CORTICOTERAPIA é a causa mais comum de insuficiência da glândula supra-renal
A demora na detecção da insuficiência adrenal põe em risco a vida do paciente. Por outro lado, o diagnóstico incorreto leva à reposição desnecessária do glicocorticóide, com os efeitos adversos e morbidade relacionados à corticoterapia (1).
Os dados do exame clínico habitualmente não são elucidativos, porque a insuficiência da supra-renal apresenta sintomatologia inespecífica, muitas vezes superpondo-se à da doença de base (2). A falência adrenal pode ser mascarada pela corticoterapia, pois a inibição do eixo hipotalâmico-hipofisário-adrenal (HHA) pode coexistir com sinais e sintomas de hipercortisolismo (3). O diagnóstico laboratorial torna-se, assim, imprescindível. No entanto, a correlação entre o resultado dos exames habitualmente usados e a resposta do paciente ao estresse pode não ser precisa (4).
A concentração do cortisol basal, aferido pela manhã, é empregada como indicador da função do eixo HHA, porque reflete o pico da sua ativação. Contudo, é difícil estabelecer um valor de corte acima do qual seja possível a previsão de uma resposta adequada ao estresse. A dosagem do cortisol basal é extremamente simples e valores extremos podem indicar função supra-renal normal ou inibida, sendo portanto considerada útil como primeira avaliação do eixo HHA (5).
Como parte de um estudo no qual se avaliou o eixo HHA de crianças submetidas à corticoterapia, verificamos a utilidade da dosagem do cortisol basal no diagnóstico da insuficiência supra-renal secundária à retirada do glicocorticóide.
CASUÍSTICA E MÉTODOS
Foram estudadas 35 crianças com Leucemia Linfocítica aguda (LLA), sendo 30 provenientes de uma mesma instituição, tratadas de acordo com o protocolo do Grupo Brasileiro para o tratamento da LLA (GBTLI-93) (6).
A dexametasona foi administrada por 28 dias na dose de 6 mg/m2/dia; a redução da dose foi efetuada em dez dias (50% a cada três dias, com suspensão completa no 10º dia).
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da UFMG. As crianças, quando possível, e suas famílias concordaram em participar da pesquisa fornecendo consentimento por escrito, após terem recebido informação detalhada sobre o estudo.
Pacientes que usaram corticóide no ano anterior ao diagnóstico de LLA, com história pessoal ou familiar de doenças relacionadas ao eixo HHA ou que apresentavam instabilidade hemodinâmica à avaliação inicial, não foram admitidos na pesquisa. Após inclusão no estudo, observou-se perda do seguimento de pacientes devido à administração inadequada do corticóide, óbito (em dois casos) e recusa da família em continuar; as perdas ocorreram especialmente na 1ª semana do tratamento e após 1 mês do seguimento.
A mediana da idade dos pacientes foi de 6,9 anos (valores mínimo e máximo de 1,2 e de 14,4 anos). Dezessete pacientes eram do sexo masculino e 29 eram pré-púberes, de acordo com os critérios de Tanner (7,8).
As crianças foram submetidas à dosagem do cortisol antes e após estímulo com o CRH ovino (1 mcg/kg, EV, às 8:00 horas). Os pacientes permaneceram em repouso durante o procedimento, acompanhados por seus pais. As crianças apresentavam-se hidratadas, hemodinamicamente estáveis e afebris durante os testes de estímulo.
O CRH ovino liofilizado (500 mcg/ampola) foi obtido da Peninsula Laboratories Inc. (Belmont, CA, EUA) e diluído na Central de Preparações Estéreis do Setor de Farmácia do Hospital das Clínicas da UFMG. Soluções com volume final de 10 ml, contendo 12,5 ou 25,0 mcg do CRH, foram armazenadas a -80°C por até três meses.
As amostras de sangue para determinação do cortisol foram coletadas imediatamente antes da administração do CRH e 30, 60 e 90 minutos após. As coletas foram efetuadas por um acesso venoso periférico mantido pérvio com infusão de salina a 0,9%. O volume de sangue retirado para cada amostra foi de 4 ml. As determinações foram feitas antes do início da corticoterapia (n= 35), no 8º dia do tratamento (n= 28), no 28º dia do tratamento (n= 28), 48 horas após suspensão da corticoterapia (n= 27) e um mês após suspensão da corticoterapia (n= 20). Todos os exames referentes a um paciente foram efetuados simultaneamente, utilizando-se um mesmo kit.
Para a avaliação do cortisol, foi utilizado um radioimunoensaio de fase sólida Coat-A-Count (Diagnostic Products Corporation, Los Angeles, CA, EUA). O coeficiente de variação intra-ensaio foi 5,1% e inter-ensaio, 6,4%. O nível mínimo de cortisol detectável pelo ensaio foi de 1,0 mcg/dl. O valor de referência para o valor basal adotado pelo laboratório era de 5 a 25 mcg/dl.
Análise estatística
Para cada criança foram determinadas as concentrações séricas do cortisol, basais e 30, 60 e 90 minutos após estímulo com CRH. A avaliação do paciente antes do tratamento foi o parâmetro para comparação dos dados obtidos durante e após administração do glicocorticóide.
Foram calculadas as medianas das concentrações basais e máximas (após CRH) do cortisol. Os valores basais e máximos do cortisol, em todas as determinações, foram subtraídos dos valores basais e máximos, respectivamente, obtidos antes do início da corticoterapia. Como a distribuição das diferenças dos valores não era normal, utilizou-se um teste não paramétrico (Wilcoxon), com correção de Bonferroni, para comparação das medianas.
As correlações entre as concentrações basais e máximas do cortisol foram avaliadas utilizando-se o teste de Spearman (9). O nível de significância utilizado foi de 0,05.
RESULTADOS
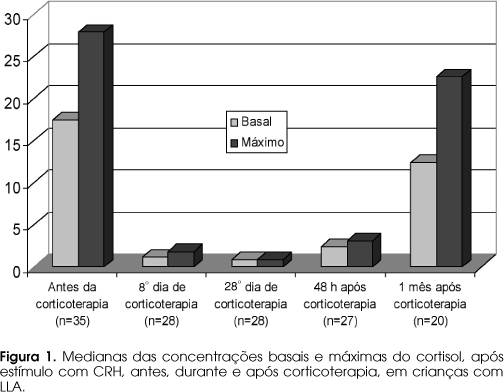
As concentrações medianas (e os valores mínimos e máximos) do cortisol nos exames efetuados antes, durante e após a corticoterapia, são apresentados na tabela 1.
Valores do cortisol basal inferiores a 5 mcg/dl foram observados em 21 (75%) e em 27 (96%) pacientes no 8º e no 28º dias da corticoterapia, respectivamente. Dezoito crianças (67%) apresentavam valores abaixo de 5 mcg/dl 48 horas após suspensão do corticóide, e 2 (10%), um mês após o término da corticoterapia.
Observamos concentrações do cortisol basal superiores a 15,0 mcg/dl em 22 pacientes (63%), antes da corticoterapia. Três (11%) apresentavam concentrações maiores que 15,0 mcg/dl, no 8º dia da corticoterapia. Um mês após a retirada do corticóide, nove (45%) apresentavam valores do cortisol basal superiores a 15,0 mcg/dl.
Houve inibição da secreção do cortisol basal durante a corticoterapia (8º e 28º dias) e 48 horas após a suspensão da dexametasona, em relação ao valor obtido antes do tratamento (p¾ 0,01, respectivamente, para os três exames). Também houve diminuição, com significado estatístico, da concentração máxima do cortisol em relação ao nível obtido antes do tratamento, durante a administração da dexametasona e 48 horas após sua retirada (p¾ 0,001, para os três exames). Um mês após o término do tratamento, o valor do cortisol basal e a concentração máxima observada após a corticoterapia não apresentavam diferença significativa em relação ao aferido antes do tratamento (p= 0,103 e p= 0,162, respectivamente). Esses dados são mostrados na figura 1.
Observou-se, portanto, inibição do cortisol basal e da resposta supra-renal ao CRH durante a corticoterapia, persistindo até 48 horas após a retirada do corticóide. Trinta dias depois da suspensão da dexametasona, observou-se recuperação da secreção basal do cortisol e após estímulo com o CRH, em relação aos valores aferidos antes da corticoterapia. Observou-se correlação positiva (de moderada a forte) e significativa entre as concentrações basais e máximas do cortisol em todos os testes realizados (tabela 2).
Baseado nos resultados encontrados antes da corticoterapia, observou-se que o limite inferior de secreção do cortisol, com aproximadamente 95% de confiança, estava em torno de 8,5 mcg/dl. Esta probabilidade de 95% pode ser interpretada como sendo a especificidade de um teste cujo valor de referência é 8,5 mcg/dl. Se utilizarmos este ponto de corte para os resultados do 28º dia da corticoterapia e do 30º dia, após a retirada do corticóide e quando a maioria das crianças já se recuperaram, obtemos que no primeiro caso todas as crianças estão abaixo deste valor enquanto no segundo caso somente 14% delas estão. Isto corresponderia a uma sensibilidade de 100% (no 30º dia após a suspensão) para diagnosticar a recuperação e a uma especificidade de 86%.
DISCUSSÃO
A secreção do cortisol apresenta um padrão circadiano, sendo observadas concentrações mais elevadas pela manhã. Tem sido sugerido que a dosagem isolada do cortisol sérico às 8:00 horas reflete a atividade do eixo HHA.
Muitos estudos de avaliação da função supra-renal têm sido realizados em pacientes asmáticos em uso de corticoterapia inalatória. Brown e col. avaliaram a supressão do eixo HHA em 78 pacientes asmáticos em uso de corticóide inalatório, comparando o cortisol basal (aferido às 9:00) com a resposta supra-renal ao ACTH sintético. Houve boa correlação (r= 0,87; p< 0,01) entre os níveis séricos do cortisol basal e pós-estímulo. Estudando o valor dos exames citados para avaliação da supressão do eixo HHA, os autores encontraram os seguintes resultados para o cortisol basal: sensibilidade de 37%, especificidade de 98%, valores preditivos positivo e negativo de 86% (10).
Clark e Lipworth realizaram um estudo duplo-cego, randomizado e controlado, com o intuito de comparar o nível basal do cortisol com a resposta supra-renal ao CRH em asmáticos em uso de corticóide inalatório. O cortisol basal e a resposta supra-renal ao CRH foram suprimidos durante o uso do corticóide inalatório, em comparação com os resultados obtidos durante a administração do placebo. Os autores ressaltam a importância de dosar o cortisol às 8:00, para a detecção do pico secretório (11).
Morris e Jorgensen estudaram um grupo de 24 crianças e adolescentes com asma, que haviam recebido corticóide por um período médio de dois anos e que, imediatamente antes da pesquisa, receberam prednisona por pelo menos um mês, na dose diária de 10 a 15 mg. A avaliação do eixo HHA foi efetuada durante e após a retirada do corticóide, com os testes da hipoglicemia insulínica e da metirapona e com o cortisol basal. Houve boa correlação entre o cortisol basal e pós-estímulo, mostrando que a recuperação do ritmo circadiano de secreção do cortisol ocorreu simultaneamente à recuperação da resposta supra-renal ao estresse. As autoras indicam o emprego do cortisol basal para avaliar a possibilidade de insuficiência supra-renal após corticoterapia, devido à acurácia e simplicidade do exame (12).
Contudo, níveis de corte para as diferentes situações ainda não são bem definidos.
Agwu e col. observaram que um valor acima de 18 mcg/dl (500 nmol/l) apresentou sensibilidade de 100% para detecção da insuficiência supra-renal, quando comparado à hipoglicemia insulínica, porém com baixa especificidade. O cortisol basal, aferido pela manhã, inferior a 4 mcg/dl (100 nmol/l) indicaria insuficiência supra-renal. Valores intermediários (entre 4 e 18 mcg/dl) tornariam necessária a realização de outro exame para investigação do eixo HHA (2).
Pavord e col. efetuaram um estudo em 197 pacientes com doenças ou suspeita de alterações do eixo HHA, realizando 232 testes de estímulo com hipoglicemia insulínica. A comparação entre o cortisol basal e a resposta do eixo à hipoglicemia insulínica mostrou que os pacientes com nível plasmático do cortisol inferior a 4 mcg/dl (100 nmol/l) apresentaram resposta sub-normal à hipoglicemia insulínica. Quando o cortisol era superior a 14,5 mcg/dl (400 nmol/l), a resposta à hipoglicemia insulínica era adequada, exceto em alguns pacientes que haviam recebido corticóide em um período recente em relação à avaliação laboratorial. Todos os pacientes com cortisol basal superior a 20 mcg/dl (550 nmol/l) responderam ao estímulo com insulina. Os autores argumentam que 55% dos testes com insulina teriam sido evitados se a reserva supra-renal basal tivesse sido avaliada (13).
Stewart e col., em estudo comparativo do teste de estímulo com o ACTH sintético e a hipoglicemia insulínica, observaram que nenhum indivíduo com nível basal do cortisol acima de 14,5 mcg/dl (400 nmol/l) deixou de responder à hipoglicemia (14).
Baxter propõe que a aferição do cortisol basal, pela manhã, seja efetuada mensalmente durante a retirada do glicocorticóide. O tratamento seria suspenso quando o cortisol basal estivesse normal; um mês após, um teste de estímulo com o CRH ou com o ACTH sintético seria realizado. Devido ao caráter pulsátil da secreção supra-renal dos esteróides, o nível plasmático do cortisol pode estar normal durante o curso da insuficiência supra-renal. Contudo, se um nível maior que 15 mcg/dl é observado, a probabilidade de insuficiência supra-renal é pequena; um valor acima de 20 mcg/dl exclui esse diagnóstico (15).
Honour, discutindo a supressão do eixo HHA pela corticoterapia, diz que o cortisol basal (aferido às 8:00) superior a 11 mcg/dl (300 nmol/l) indica que a resposta supra-renal aos testes de estímulo seria normal (16).
Orth e Kovacs sugerem que valores do cortisol basal acima de 11 mcg/dl tornam improvável o diagnóstico de insuficiência supra-renal significativa. Com um nível inferior a 3 mcg/dl, a probabilidade de insuficiência supra-renal é alta (17).
Observamos, portanto, consenso entre os autores em relação aos valores sugestivos de insuficiência supra-renal: cortisol basal, aferido pela manhã, inferior a 4 mcg/dl. Por outro lado concentrações acima de 20 mcg/dl parecem excluir esse diagnóstico. Os valores intermediários exigiriam outros testes para confirmação.
A dosagem do cortisol a qualquer hora do dia pode ser feita durante uma situação de estresse, quando a ativação do eixo HHA é máxima. É útil também quando há suspeita de insuficiência supra-renal e não há tempo para efetuar um teste de estímulo ou para esperar a dosagem matinal do cortisol. Valores do cortisol abaixo de 5 mcg/dl, durante o estresse, indicam insuficiência supra-renal. Níveis superiores a 18 mcg/dl são uma evidência de função normal. Valores intermediários requerem avaliação laboratorial mais detalhada e consideração sobre a necessidade de corticoterapia, durante o estresse (5).
Por outro lado, é fato reconhecido que inúmeros fatores, incluindo o procedimento de coleta, podem afetar os valores aferidos do cortisol basal, especialmente nas crianças. Em estudo anterior, realizado em crianças hospitalizadas, sem corticoterapia, observamos uma concentração sérica basal média do cortisol de 26,3 ± 9,6 (725,6 ± 264,9 nmol/dl) (18). No presente estudo, partimos do princípio de que todas as coletas de sangue foram realizadas com algum grau de estresse. Apesar de estarem acompanhadas de seus pais e não hospitalizadas, é evidente a falta de colaboração das crianças aos procedimentos, em geral, ainda mais devido ao fato de esses pacientes estarem diante de um diagnóstico recente de doença grave e perspectiva de terapêutica complexa. Em discussão prévia, registramos que a elevação das concentrações basais do cortisol provavelmente interferiu com a resposta ao CRH (19). Observa-se que os valores medianos do cortisol, antes do início da corticoterapia, encontravam-se acima da faixa relatada na literatura, isto é, concentrações de 20 a 25 mcg/dl após a administração do CRH (17).
Pudemos observar, também, não só a variabilidade na extensão da resposta de supressão e recuperação do eixo HHA, como a variabilidade individual do momento da resposta: algumas crianças não suprimidas no 8º dia da corticoterapia evoluíram com supressão nas outras avaliações e mostraram recuperação um mês após a retirada do tratamento.
Considerando-se como valor de corte concentrações basais de cortisol abaixo de 5 mcg/dl (5), o diagnóstico de insuficiência supra-renal seria estabelecido para a maioria dos pacientes durante a corticoterapia e 48 horas após a suspensão da dexametasona. Em 10% dos casos esse valor ainda foi observado um mês após o término da corticoterapia, caracterizando a extensão da insuficiência até aquele momento.
Nove pacientes apresentaram cortisol basal superior a 15,0 mcg/dl um mês após a retirada da dexametasona. Segundo a maioria dos autores, o diagnóstico de insuficiência supra-renal seria improvável com essa concentração (1,2,14). Nessa circunstância, portanto, avaliação laboratorial mais complexa seria evitada em 45% das crianças, após avaliação do cortisol basal.
Diferentemente do observado com as crianças hospitalizadas, observou-se no presente estudo que o valor de cortisol basal superior a 8,5 mcg/dl foi o resultado apresentado por cerca de 95% das crianças, antes de qualquer terapêutica. Com base nesses achados, julgamos necessário considerar com cautela valores basais de cortisol abaixo de 8,5 mcg/dl em crianças com fatores de risco para insuficiência adrenal, em situações de estresse.
Acreditamos que este estudo reafirma a eficácia do cortisol basal para detecção de insuficiência supra-renal. Observamos forte correlação entre as concentrações basais e máximas do cortisol após o estímulo com CRH, justificando o seu uso como marcador da função supra-renal em crianças, especialmente durante a suspensão do tratamento e após corticoterapia.
AGRADECIMENTO
Agradecemos à Fundação de Amparo à Pesquisa do Estado de Minas Gerais FAPEMIG, pelo apoio financeiro.
Recebido em 28/01/05
Revisado em 19/07/05 e 14/12/05
Aceito em 28/12/05
- 1. Kong WM, Alaghband-Zadeh J, Carter G, O'Shea D. The midnight to morning urinary cortisol increment is an accurate, noninvasive method for assessment of the hypothalamic-pituitary-supra-renal axis. J Clin Endocrinol Metab 1999;84:3093-8.
- 2. Agwu JC, Spoudeas H, Hindmarsh PC, Pringle PJ, Brook CGD. Tests of supra-renal insufficiency. Arch Dis Child 1999;80:330-3.
- 3. Chrousos GP, Harris AG. Hypothalamic-pituitary-supra-renal axis suppression and inhaled corticosteroid therapy. Neuroimmunomodulation 1998;5:277-87.
- 4. Lamberts SWJ, Bruining HA, de Jong FH. Corticosteroid therapy in severe illness. N Engl J Med 1997;337:1285-92.
- 5. Grinspoon SK, Biller BMK. Laboratory assessment of supra-renal insufficiency. J Clin Endocrinol Metab 1994;79:923-31.
- 6. Sociedade Brasileira de Oncologia Pediátrica GBTLI. Protocolo de tratamento da leucemia linfóide aguda em crianças 1993
- 7. Marshall WA, Tanner JM. Variations in pattern of pubertal changes in girls. Arch Dis Child 1969;44:291-303.
- 8. Marshall WA, Tanner JM. Variations in pattern of pubertal changes in boys. Arch Dis Child 1970;45:13-23.
- 9. Snedecor GW, Cochran WG. Statistical Methods, 8th ed. Iowa State University Press, 1989
- 10. Brown PH, Blundell G, Greening AP, Crompton GK. Screening for hypothalamo-pituitary-supra-renal axis in asthmatics taking high dose inhaled corticosteroids. Respir Med 1991;85:511-6.
- 11. Clark DJ, Lipworth BJ. Evaluation of corticotropin releasing factor stimulation and basal markers of hypothalamic-pituitary -supra-renal axis suppression in asthmatic patients. Chest 1997;112:1248-52.
- 12. Morris HG, Jorgensen JR. Recovery of endogenous pituitary-supra-renal function in corticosteroid-treated children. J Pediatrics 1971;79:480-8.
- 13. Pavord SR, Girach A, Price DE, Absalom SR, Falconer-Smith J, Howlett TA. A retrospective audit of the combined pituitary function test, TRH and GnRH in a district laboratory. Clin Endocrinol (Oxf) 1992;36:135-9.
- 14. Stewart PM, Corrie J, Seckl JR, Edwards CRW, Padfield PL. A rational approach for assessing the hypothalamo-pituitary-supra-renal axis. Lancet 1968;28:1208-10.
- 15. Baxter JD. The effects of glucocorticoid therapy. Hosp Practice 1992;15:111-34.
- 16. Honour JW. Hypothalamic-pituitary-supra-renal axis. Respiratory Medicine 1994;88(supppl. A):9-15.
- 17. Orth DN, Kovacs WJ. The supra-renal cortex. In: Wilson JD, Foster DW, Kronenberg HM, Larsen PR, eds. Williams Textbook of Endocrinology, 9th ed. Philadelphia: WB Saunders, 1998 p. 517-664.
- 18. Cunha CF, Silva IN. Resposta hipofisária-adrenal ao teste de estímulo com o hormônio liberador da corticotrofina em crianças hospitalizadas. Arq Bras Endocrinol Metab 2002;46:161-6.
- 19. Cunha CF, Silva IN, Finch FL. Early adrenocortical recovery after glucocorticoid therapy in children with leukemia. J Clin Endocrinol Metab 2004;89:2797-802.
Datas de Publicação
-
Publicação nesta coleção
17 Abr 2006 -
Data do Fascículo
Fev 2006
Histórico
-
Aceito
28 Dez 2005 -
Revisado
14 Dez 2005 -
Recebido
28 Jan 2005