Resumos
O presente estudo teve como objetivo investigar o efeito da ingestão de dietas ricas em sacarose (DRS) e em lipídio (DRL) nas concentrações de glicose e leptina plasmáticas. Foram selecionadas 20 mulheres hígidas, 13 com peso normal (G1) e 7 com sobrepeso (G2). As dietas testes DRS (23,0% de sacarose) e DRL (45,0% de lipídio) foram calculadas para consumo em condições de vida livre, por 14 dias. Foram realizadas determinações de antropometria, de composição corporal, de glicose e leptina plasmáticas. Os valores de leptina plasmática de jejum e pós-prandiais foram maiores em G2 (p< 0,05) e correlacionaram-se positivamente com os dados antropométricos e de composição corporal (p< 0,05), destacando-se sua correlação positiva com a circunferência do quadril. As concentrações de glicose e leptina de jejum e pós-prandiais não diferiram entre as dietas. A glicemia nos tempos de 30 (p< 0,01) e 60 (p< 0,05) minutos após a ingestão de DRS correlacionou-se positivamente com a leptinemia pós-prandial. Os resultados confirmam a relação positiva entre a leptinemia e a gordura corporal, especificamente com o tecido adiposo subcutâneo e indicam que mais estudos são necessários para identificar o papel modulador da ingestão energética e do perfil de macronutrientes na leptinemia.
Leptina; Glicose; Sacarose; Carboidrato; Lipídio; Obesidade
The aim of this study was to investigate the effect of ingesting high-sucrose (HSD) and high-lipid diets (HLD) on the concentrations of plasma glucose and leptin in lean and overweight women. Twenty healthy women were selected: 13 lean (G1) and 7 overweight (G2). The test diets HSD (23% sucrose) and HLD (45% lipid) were calculated for intake under non-restrictive conditions during 14 days. Anthropometry, body composition, plasma glucose and leptin determinations were carried out. The fasting and postprandial plasma leptin values were higher in G2 (p< 0.05), correlating positively with the anthropometry and body composition data (p< 0.05), and special positive correlation with hip circumference. Glucose and leptin concentrations did not differ between diets. Circulating glucose 30 (p< 0.01) and 60 (p< 0.05) minutes after ingestion of HSD were positively correlated with postprandial leptin concentration. The results confirm the positive association between plasma leptin concentration and body fat, specifically the subcutaneous fat tissue, and suggest that more studies are necessaries to identify the modulating role of energy intake and macronutrients profile on leptin concentration.
Leptin; Glucose; Sucrose; Carbohydrate; Lipid; Obesity
ARTIGO ORIGINAL
Efeito do perfil de macronutrientes da dieta na leptinemia
Effect of diet macronutrients profile on leptin concentration
Helen H.M. Hermsdorff; Ana Carolina P. Volp; Rosana G.C. Santos; Mirelle L. Viana; Josefina Bressan
Departamento de Nutrição e Saúde da Universidade Federal de Viçosa UFV, Viçosa, MG
Endereço para correspondência Endereço para correspondência: Josefina Bressan Campus Universitário, Departamento de Nutrição e Saúde Universidade Federal de Viçosa UFV 36571-000 Viçosa, MG E-mail: jbrm@ufv.br
RESUMO
O presente estudo teve como objetivo investigar o efeito da ingestão de dietas ricas em sacarose (DRS) e em lipídio (DRL) nas concentrações de glicose e leptina plasmáticas. Foram selecionadas 20 mulheres hígidas, 13 com peso normal (G1) e 7 com sobrepeso (G2). As dietas testes DRS (23,0% de sacarose) e DRL (45,0% de lipídio) foram calculadas para consumo em condições de vida livre, por 14 dias. Foram realizadas determinações de antropometria, de composição corporal, de glicose e leptina plasmáticas. Os valores de leptina plasmática de jejum e pós-prandiais foram maiores em G2 (p< 0,05) e correlacionaram-se positivamente com os dados antropométricos e de composição corporal (p< 0,05), destacando-se sua correlação positiva com a circunferência do quadril. As concentrações de glicose e leptina de jejum e pós-prandiais não diferiram entre as dietas. A glicemia nos tempos de 30 (p< 0,01) e 60 (p< 0,05) minutos após a ingestão de DRS correlacionou-se positivamente com a leptinemia pós-prandial. Os resultados confirmam a relação positiva entre a leptinemia e a gordura corporal, especificamente com o tecido adiposo subcutâneo e indicam que mais estudos são necessários para identificar o papel modulador da ingestão energética e do perfil de macronutrientes na leptinemia.
Descritores: Leptina; Glicose; Sacarose; Carboidrato; Lipídio; Obesidade
ABSTRACT
The aim of this study was to investigate the effect of ingesting high-sucrose (HSD) and high-lipid diets (HLD) on the concentrations of plasma glucose and leptin in lean and overweight women. Twenty healthy women were selected: 13 lean (G1) and 7 overweight (G2). The test diets HSD (23% sucrose) and HLD (45% lipid) were calculated for intake under non-restrictive conditions during 14 days. Anthropometry, body composition, plasma glucose and leptin determinations were carried out. The fasting and postprandial plasma leptin values were higher in G2 (p< 0.05), correlating positively with the anthropometry and body composition data (p< 0.05), and special positive correlation with hip circumference. Glucose and leptin concentrations did not differ between diets. Circulating glucose 30 (p< 0.01) and 60 (p< 0.05) minutes after ingestion of HSD were positively correlated with postprandial leptin concentration. The results confirm the positive association between plasma leptin concentration and body fat, specifically the subcutaneous fat tissue, and suggest that more studies are necessaries to identify the modulating role of energy intake and macronutrients profile on leptin concentration.
Keywords: Leptin; Glucose; Sucrose; Carbohydrate; Lipid; Obesity
A OBESIDADE É UMA ENFERMIDADE multicausal e dentre os fatores envolvidos na etiopatogenia da obesidade pode-se citar a leptina, proteína codificada pelo gene ob e sintetizada pelo tecido adiposo (1). É um hormônio de papel importante no controle do estoque de gordura corporal por influenciar tanto no decréscimo do consumo quanto no aumento do gasto energético pela sinalização no hipotálamo e ativação do sistema nervoso simpático (2,3).
Em humanos, a leptina está associada ao peso corporal, índice de massa corporal (IMC) e gordura corporal total (GCT), apresentando-se, portanto, em maior concentração em obesos, em conseqüência do aumentado estoque de gordura corporal total destes indivíduos. O tipo de obesidade também é um fator envolvido na variação dos níveis de leptina, visto que a obesidade periférica é maior determinante da concentração de leptina, quando comparada à obesidade central (4,5).
Apesar da forte relação da secreção de leptina com a GCT, em humanos, os níveis de leptina se elevam durante períodos de superalimentação e decrescem durante o jejum e longos períodos de restrição calórica (6,7). Estudos em relação ao perfil dos macronutrientes são ainda controversos, em que dietas ricas em lipídios apresentaram relação positiva (8) ou negativa (9,10) com os níveis de leptina, ou ainda nenhum efeito, quando o peso corporal foi mantido (11). A redução dos níveis de leptina, associada à ingestão de dietas ricas em lipídio, pode estar relacionada a menores níveis de saciedade e maiores de fome, causando hiperfagia, principalmente em obesos que têm preferência por alimentos com maior densidade calórica (12). Dietas ricas em carboidrato podem aumentar a leptinemia, devido ao aumento da insulina e conseqüente aumento da captação e metabolização da glicose no tecido adiposo, mecanismo estimulante da secreção de leptina (13,14). A leptina de adipócitos, in vitro, é dependente da captação de glicose e de seu metabolismo, o que suporta a hipótese de que mudanças na secreção de leptina, in vivo, depois de restrição energética ou realimentação, refletem a redução ou aumento na captação da glicose no tecido adiposo, respectivamente (14-16).
O presente estudo teve como objetivo investigar o efeito de dietas ricas em sacarose e em lipídio nas concentrações plasmáticas de glicose e leptina em jejum e pós-prandial de mulheres com peso normal e sobrepeso.
CASUÍSTICA E MÉTODOS
Casuística
Foram selecionadas 20 mulheres, 13 com peso normal (Grupo G1: idade 22,5 ± 2,1 anos; IMC 22,2 ± 1,9 kg/m2) e 7 com sobrepeso (Grupo G2: idade 21,8 ± 2,8 anos; IMC 28,4 ± 3,2 kg/m2), incluídas nos grupos G1 e G2, respectivamente, segundo os valores de IMC para cada grupo, definidos pela WHO (17). Todas apresentavam peso estável nos últimos três meses, não fumavam, não praticavam atividade física intensa, não faziam uso de qualquer medicamento (exceto anticoncepcional) e apresentaram-se hígidas de acordo com os exames bioquímicos realizados como glicose, colesterol total e triglicérides séricos.
Antes do início do estudo, as participantes fizeram registro alimentar de 3 dias não consecutivos (dois dias da semana e um do final de semana) para avaliação do consumo calórico habitual e sua distribuição energética entre os macronutrientes, o que caracterizou a dieta habitual das mesmas (DH).
As mulheres também responderam ao Three Factor Eating Questionnaire TFEQ (18), o que permitiu a avaliação do grau de restrição alimentar (controle consciente da ingestão alimentar para ganho ou perda de peso corporal), de desinibição alimentar (interrupção deste controle cognitivo) e de fome (suscetibilidade ao sentimento de falta do alimento) das mesmas.
As mulheres selecionadas assinaram um termo de consentimento livre e esclarecido para participação das mesmas no estudo, previamente aprovado pelo Comitê de Ética na Pesquisa em Seres Humanos da Universidade Federal de Viçosa.
Protocolo do estudo
O desenho do estudo foi prospectivo, randomizado e cego simples. No período basal (antecedente às dietas testes), as voluntárias, em estado de jejum de 12 horas, chegavam ao Laboratório de Composição Corporal e Metabolismo Energético (LCCME) às 7:00 h da manhã, sendo orientadas a evitarem a ingestão de álcool e o excesso de atividade física no dia anterior ao teste. Foram realizadas medidas antropométricas e determinação da composição corporal. Foi feita a primeira coleta de sangue (em jejum) para as dosagens de glicose e leptina, e o desjejum foi servido às 8:00 h. O desjejum apresentava conteúdo energético equivalente a um terço do gasto energético em repouso de cada voluntária (448,1 ± 59,8 kcal) e composição nutricional balanceada, de acordo com o preconizado pela WHO (19) (53,0% ± 4,2 de carboidrato, com 15,0% ± 0,6 de sacarose; 15,0% ± 0,1 de proteína; 32,0% de lipídio e 6,7 ± 1,0 g de fibras) (Dieta Basal DB). Novas amostras de sangue foram coletadas 30, 60, 180 e 240 minutos após a ingestão alimentar.
Após o dia de teste basal, cada voluntária seguiu uma das dietas testes em condições de vida livre, num período de 14 dias: dieta rica em sacarose (DRS) ou rica em lipídio (DRL). A dietas foram selecionadas para cada voluntária de forma aleatória, e as participantes não foram esclarecidas a respeito das diferenças entres as dietas. Depois do seguimento da dieta (dia 15) foi realizado o mesmo protocolo para as medidas antropométricas, de composição corporal e de coletas de sangue. As dietas oferecidas nos testes seguintes ao plano alimentar apresentavam a mesma proporção de macronutrientes que as dietas testes DRS e DRL e conteúdo calórico equivalente a um terço do gasto energético em repouso.
Períodos de dietas testes
Cada voluntária seguiu uma das dietas testes em condições de vida livre, num período de 14 dias: DRS ou DRL. As duas dietas testes tinham conteúdo calórico baseado nas necessidades energéticas de cada participante, calculadas de acordo com a necessidade energética estimada (EER Estimated Energy Requirement), preconizada pela Dietary Reference Intake DRI (20).
A composição dos macronutrientes, nos 14 dias das dietas, foi: DRS (59,0% ± 1,3 de carboidratos com 23,0% ± 0,7 de sacarose; 28,0% ± 0,7 de lipídios; 13,0% ± 0,4 de proteínas; 20,2 g ± 2,6 de fibras) e DRL (42,0% ± 1,4 de carboidratos com 1,3% ± 1,3 de sacarose; 45,0% ± 1,2 de lipídios; 13,0% ± 1,0 de proteínas; 22,2 ± 1,4 g de fibras). A alimentação diária foi distribuída em 5 a 6 refeições. O consumo de café, chás e água foi permitido, mas em quantidades e número de vezes semelhantes nos períodos de cada dieta.
O programa de análises de dietas DietPro®, versão 4.0, foi usado para determinar o consumo energético de nutrientes das dietas. Juntamente com cada dieta prescrita, uma lista de substituições foi entregue para adequar a mesma ao cotidiano e à disponibilidade de alimentos de cada participante, sendo seu modo de aplicação orientado por uma nutricionista (ACPV). As mulheres foram orientadas quanto à importância da adesão e seguimento das dietas testes de forma a garantir resultados confiáveis. Durante o período de dietas testes, realizaram-se 3 registros alimentares para avaliação do consumo médio das dietas e sua adesão.
Avaliação antropométrica e da composição corporal
As determinações antropométricas foram realizadas no momento basal e após cada dieta teste pelo mesmo profissional (HHMH). Cada mulher foi avaliada no mesmo período do seu ciclo menstrual. O peso corporal (kg) e a altura (m) foram medidos de manhã, após 12 horas de jejum. As circunferências da cintura e do quadril também foram aferidas (21) e a razão entre as mesmas foi calculada (22).
As pregas cutâneas tricipital, bicipital, subescapular e suprailíaca foram aferidas segundo técnica descrita por Durnin & Rahaman (23), e o somatório das mesmas foi utilizado para cálculo da porcentagem de GCT, segundo Durnin & Womersley (24).
A composição corporal também foi determinada por bioimpedância elétrica de freqüência simples (50 kHz) (Biodynamics, modelo 310, TBW) (25,26).
Determinações bioquímicas
As amostras de sangue foram coletadas antes (dia basal) e após cada dieta (dia 15), em jejum e 30, 60, 180 e 240 minutos após a ingestão alimentar. A determinação plasmática da glicose foi realizada por meio de colorimetria enzimática, com o kit da Bioclin (Lote 025), no autoanalizador paramétrico de bioquímica Clin line 150-Alizé (Ref. 21711188; Lisabio, França). A determinação da leptina plasmática baseou-se na técnica de radioimunoensaio, utilizando-se o kit Human Leptin RIA (HL-81 HK) (LINCO Research, St. Charles, MO, EUA), com sensibilidade de 0,5 ng/mL e especificidade de 100%.
Análises estatísticas
As estatísticas descritivas estão apresentadas em mediana (mínimo-máximo). As análises estatísticas basearam-se em testes não paramétricos devido ao tamanho da amostra e foram realizadas no software SigmaStat 2.0. As variáveis foram comparadas entre as dietas por Kruskall-Wallis e teste de Dunn e, entre grupos, por Mann-Whitney. As diferenças entre glicose e leptina em relação ao tempo foram avaliadas por teste de Friedman e teste de Tukey. As correlações entre as variáveis foram feitas usando correlação de Spearman. O nível de significância usado foi de 5% e o poder do estudo de 0,80.
As áreas abaixo da curva (AAC) da glicemia e leptinemia pós-prandial foram calculadas separadamente, para cada indivíduo, como a diferença entre a área integrada da curva resposta e a área retangular determinada pelos valores basais.
RESULTADOS
Casuística
De acordo com TFEQ, o G1 apresentou alto escore para restrição alimentar, baixo para desinibição alimentar e médio para percepção da fome, enquanto G2 apresentou escores médio, baixo e alto, respectivamente (tabela 1). O grupo G1 apresentou peso, IMC, circunferências da cintura e do quadril, pregas cutâneas, soma das pregas, GCT (%) por pregas cutâneas e valores de GCT (%), GCT (kg), massa livre de gordura (kg) e metabolismo em repouso (kcal) pela bioimpedância elétrica, significantemente menores (p< 0,05) em relação ao grupo G2 (tabela 2). Não houve diferença estatisticamente significante nestes parâmetros após o seguimento das dietas testes DRS e DRL.
Dietas
Os registros alimentares, realizados para estimar a ingestão calórica e perfil dos macronutrientes na dieta habitual (DH) e no consumo em condições de vida livre das dietas testes DRS e DRL, estão apresentados na tabela 3.
A DH não apresentou diferença estatisticamente significante quando comparada a DRS e DRL, para os dois grupos. Também não houve diferença entre DH, DRS e DRL para a ingestão calórica total e proteínas. Por sua vez, DRS apresentou consumo maior de carboidrato total, sacarose e fibras (em gramas) e menor de lipídio (em gramas), para ambos os grupos, quando comparada a DRL (p< 0,05).
Quando as quantidades de macronutrientes estipuladas para o consumo em carga de sacarose e lipídio foram comparadas às estimadas nos registros alimentares preenchidos pelas voluntárias durante o seguimento das dietas testes, houve diferença significante entre o calculado e o ingerido. Em DRS, a sacarose planejada para compor 23% da ingestão calórica total foi de apenas 18,4% para G1 (p< 0,05) e de 8,4% para G2 (p< 0,01). Em DRL, o lipídio planejado para compor 45% da ingestão calórica total foi de apenas 30,0% para G1 (p< 0,01) e 34,0% para G2 (p< 0,05).
Glicemia
As concentrações de glicose plasmática de jejum e pós-prandiais não diferiram entre os grupos, tampouco se correlacionaram com características antropométricas e de composição corporal dos mesmos (Correlação de Spearman, p > 0,05; dados não mostrados). As concentrações de glicose não diferiram entre as dietas para os grupos, nos estados de jejum e pós-prandiais (figura 1).
Não houve interação entre glicemia e tempo, não diferindo entre os tempos de determinações para os grupos e dietas (Teste de Friedman, p > 0,05) (figura 1).
Leptinemia
Os valores de leptina plasmática de jejum e pós-prandiais foram significantemente maiores (p< 0,05) para G2, em todas as dietas. Apesar dos níveis de leptina de jejum e pós-prandiais não diferirem entre as dietas de forma estatisticamente significante, seus valores, após seguimento da DRL, apresentaram-se bem inferiores, comparados aos encontrados no teste com DB e depois de DRS, para G1 (figura 1).
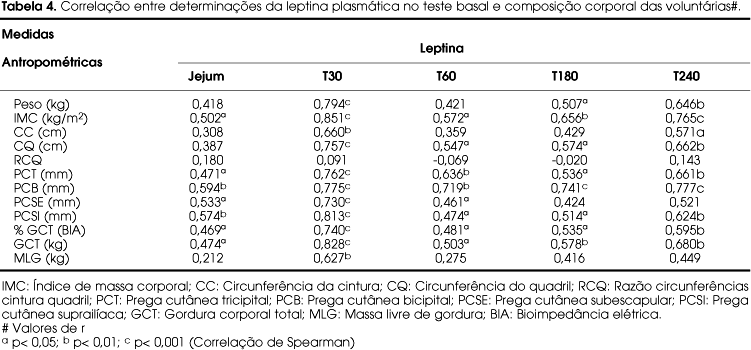
Quando correlacionados os níveis de leptina de jejum e pós-prandiais dos dois grupos, em DB com as características antropométricas e de composição corporal do teste basal, o peso, IMC, circunferência do quadril, pregas cutâneas, GCT (%) (BIA), GCT (kg) foram fortemente associados em todos os tempos em que a leptina foi determinada (tabela 4).
As concentrações de glicose e leptina correlacionaram-se, significantemente, apenas após seguimento da DRS, sendo que a glicemia após 30 minutos da ingestão alimentar teve relação positiva com as concentrações de leptina em todos os tempos, e a de 60 minutos após ingestão alimentar apresentou relação direta com todas as concentrações de leptina pós-prandiais (tabela 5). Após o seguimento de DRL, entretanto, não houve correlações significantes entre glicemia e leptinemia (p > 0,05; dados não mostrados).
Não houve interação entre leptinemia e tempo, não diferindo entre os tempos de determinações para os grupos e dietas (Teste de Friedman, p > 0,05) (figura 1).
DISCUSSÃO
As concentrações de glicose não diferiram entre os grupos em estado de jejum e pós-prandiais. Isto pode ser justificado pelo critério de inclusão no estudo em que os voluntários deveriam apresentar glicemias em jejum normais, pois a presença de hiperglicemia, hiperinsulinemia ou diabetes poderiam também ser fatores confundidores no estudo.
Os valores de leptina plasmática foram significativamente maiores em G2, para todas as dietas e nos estados de jejum e pós-prandial. Este resultado já era esperado, pois a leptina é produzida pelo tecido adiposo e serve ao SNC como sinalizador do estoque de gordura corporal atual (27). Desta forma, indivíduos obesos que têm, caracteristicamente, reserva de gordura corporal aumentada, apresentam maior expressão de RNAm e da proteína e maior secreção da mesma em estados de jejum e pós-prandial. As correlações positivas e significantes entre os níveis séricos de leptina e peso, IMC, pregas cutâneas, GCT (%) e GCT (kg), obtidas neste estudo, confirmam a relação positiva entre GCT e leptinemia e são corroborados por extensa literatura científica (28-31).
Outro resultado interessante a respeito da relação entre a adiposidade e a concentração de leptina é a correlação mais expressiva desta com a circunferência do quadril, comparada à circunferência da cintura e à razão entre as circunferências de cintura e quadril, também encontrada em outros estudos (30,32). A explicação para esta relação parece estar associada ao tipo de depósito de gordura corporal (tecido adiposo subcutâneo) presente na região glúteo-femural. Estudos in vitro e in vivo encontraram expressão de RNAm e secreção de leptina 2 a 5 vezes maior em obesos, nos depósitos de gordura abdominal e subcutâneo. Entretanto, o tecido adiposo subcutâneo pode secretar 2 a 3 vezes mais leptina que o tecido adiposo abdominal, estando o tamanho e volume dos adipócitos maiores nos depósitos subcutâneos, intimamente ligados ao aumento da expressão gênica e secreção de leptina (4,5,28,33).
Apesar do papel modulador da adiposidade na leptinemia, ela explica em parte as variações da mesma. A composição da dieta também tem sido investigada como importante determinante da leptinemia. Em estudos de restrição energética de 2 a 7 dias (36 a 70% das necessidades energéticas), ou ainda de 12 semanas (80% das necessidades energéticas), houve a redução dos níveis plasmáticos da leptina, independentemente da perda de gordura corporal (16,34-36). Em relação aos macronutrientes, Otukonyong e cols. (37) observaram, em ratos, o aumento da concentração de leptina após 12 semanas de ingestão de dieta hiperlipídica (45% do conteúdo energético). Este resultado é semelhante ao de estudos anteriores que utilizaram 56 a 58% do conteúdo energético em lipídio/ 25 a 30% em carboidrato (8,12,38). Entretanto, Ainslie e cols. (39) obtiveram concentrações de leptina 24% a 36% menores após a ingestão de dieta com 36% do conteúdo energético em lipídio. Em humanos, os efeitos da quantidade de carboidrato e lipídio na dieta sobre a leptinemia também são controversos. Alguns estudos não encontraram efeito do lipídio na leptinemia (14,40-42), enquanto que outros verificaram concentrações de leptina aumentadas em dietas ricas em carboidrato/pobre em lipídio (59 a 67% e 15 a 26% do conteúdo energético, respectivamente) e reduzidas em dietas pobres em carboidrato/ricas em lipídio (20 a 43% e 46 a 60% do conteúdo energético, respectivamente) (9,13,43). Raben & Astrup (44), por sua vez, encontraram maiores níveis de leptina em dieta rica em sacarose (23%) em comparação com dieta rica em lipídio (46%). Em outra pesquisa, os níveis de leptina foram superiores após ingestão de dieta com 30% de frutose, comparada a dieta com 30% em glicose, mesmo sendo normoglicídica e normolipídica (45).
No presente estudo, mulheres com peso normal e com sobrepeso não apresentaram alterações na leptinemia de jejum e pós-prandial após ingestão das dietas ricas em sacarose e lipídio. Há algumas hipóteses que poderiam justificar este resultado. Primeiramente, as dietas atendiam às necessidades energéticas das voluntárias, ou seja, tinham objetivo de manter o peso e a composição corporal das mesmas. Deste modo, em nosso estudo, não houve influência da ingestão energética na leptinemia, como em outros estudos (16,35,36). Em relação ao perfil de macronutrientes, de acordo com os registros alimentares obtidos, DRS favoreceu o maior conteúdo de carboidrato total e de sacarose, comparada a DRL, que, por sua vez, apresentou maior conteúdo de lipídio, mas ambas não obtiveram valores estatisticamente superiores aos consumidos habitualmente pelas voluntárias. Isto devido ao consumo de sacarose e lipídio no período das dietas testes ter sido muito inferior ao estipulado nos planos alimentares. As quantidades consumidas (sacarose: 8,4 a 18,4%; lipídio: 30 a 34%) são, portanto, também inferiores às cargas de sacarose (23%) e de lipídio (46 a 60%) utilizadas em estudos anteriores, que apresentaram alterações na leptinemia (9,43,44). Baseadas nestas observações, as diferenças nas quantidades de carboidrato total, sacarose e lipídio entre DRS e DRL podem não ter sido suficientes para alterar a leptinemia, diferentemente se consumidas as quantidades calculadas, o que gera ainda dúvidas a respeito do efeito dos macronutrientes na leptinemia e sua relação com a ingestão energética total. O período de seguimento das dietas testes e o tamanho da amostra também têm sido apresentados por outros pesquisadores como causa das controvérsias entre os estudos (42).
Outro resultado do presente estudo foi obtido após seguimento de DRS, em que as concentrações de glicose aos 30 e 60 minutos pós-ingestão tiveram relação direta e significante com as concentrações de leptina pós-prandiais. Apesar de não ter sido determinada a concentração de insulina em nosso trabalho, a possível explicação para este resultado estaria na relação entre secreção de leptina e captação e utilização de glicose pelo tecido adiposo, mediadas pela insulina, de acordo com resultados de outros estudos bem conduzidos (31,39,44). A dieta rica em carboidrato, simples ou complexo, poderia estimular a secreção de insulina 30 a 60 minutos depois de sua ingestão, para captação da glicose no tecido adiposo, que por sua vez estimula secreção de leptina. Yannakoulia e cols., por exemplo, obtiveram maiores concentrações de leptina após acréscimo de 400 kcal na dieta na forma de carboidrato. Deste modo, não a sacarose, mas o carboidrato total teria papel modulador desta relação entre glicemia e leptinemia.
Em suma, o presente estudo confirma os valores aumentados da leptina plasmática em indivíduos com sobrepeso, bem como sua relação com o estoque de gordura corporal. A ingestão das dietas ricas em sacarose e em lipídio não apresentou alterações na glicemia e leptinemia de mulheres com peso normal e sobrepeso. Entretanto, a correlação entre glicemia e leptinemia, após DRS, bem como resultados controversos na literatura científica atual, indicam que mais estudos são necessários para identificar o papel determinante da ingestão energética e do perfil de macronutrientes na leptinemia.
NOTA
Este artigo foi elaborado a partir da dissertação de HHM Hermsdorff, intitulada "Influência do perfil de macronutrientes da dieta na leptinemia, no balanço energético e na saciedade", apresentada ao Curso de Pós-Graduação em Ciência da Nutrição, Strictu Sensu, da Universidade Federal de Viçosa, em 2005.
AGRADECIMENTOS
Os autores agradecem à Nestlé e à Nutrimed, pelos suplementos doados para confecção das dietas oferecidas nos dias de teste, à FAPEMIG (Fundação de Amparo a Pesquisa de Minas Gerais), pelos recursos concedidos à execução do estudo, e à CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior), pela concessão das bolsas de estudos. Também agradecem ao Prof. Giovanni Ribeiro e ao Departamento de Zootecnia Universidade Federal de Viçosa, pelo auxílio nas determinações da leptina plasmática.
Recebido em 17/08/05
Revisado em 23/01/06 e 04/07/06
Aceito em 14/07/06
- 1. Zhang YY, Proença R, Maffei M, Barone M, Leopold L, Friedman JM. Positional of the mouse obese gene and its human homologue. Nature 1994;372(6505):425-32.
- 2. Suviolahti E, Ridderstrale M, Almgren P, Klannemark M, Melander O, Calrsson E, et al. Pro-opipomelanocortin gene in associated with serum leptin levels in lean but not in obese individuals. Int J Obes 2003;27(10):1204-11.
- 3. Velkoska E, Morris MJ, Burns P, Weisinger RS. Leptin reduces food intake but does not alter weight regain following food deprivation in the rat. Int J Obes Relat Metab Disord 2003;27(1):48-54.
- 4. Van Harmelen V, Reynisdottir S, Eriksson P, Thome A, Hoffstedt J, Lönnqvist F, et al. Leptin secretion from subcutaneous and visceral adipose tissue in women. Diabetes 1998;47(6):913-7.
- 5. Cnop M, Landchild MJ, Vidal J, Havel PJ, Knowles NG, Carr DR, et al. The current accumulation of intra-abdominal subcutaneous fat explains the association between insulin resistance and plasma leptin concentrations. Diabetes 2002;51(4):1005-15.
- 6. Dallongeville J, Hecquet B, Lebel P, Edmé JL, Le Fur C, Fruchart JC, et al. Short-term response of circulating leptin to feeding and fasting in man: influence of circadian cycle. Int J Obes Relat Metab Disord 1998;22(8):728-33.
- 7. Reseland JE, Anderssen SA, Solvoll K, Hjermann I, Urdal P, Holme I, et al. Effect of long-term changes in diet and exercise on plasma leptin concentrations. Am J Clin Nutr 2001;73(2):240-5.
- 8. Ahrén B, Mannsson S, Gingerich RL, Havel PJ. Regulation of plasma leptin in mice: influence of age, high-fat diet, and fasting. Am J Physiol 1997;273(1 Pt 2):R113-20.
- 9. Havel PJ, Townsend R, Chaump L, Teff K. High-fat meals reduce 24-h circulating leptin concentrations in women. Diabetes 1999;48(2):334-41.
- 10. Yannakoulia M, Yiannakouris N, Bluher S, Matalas AL, Klimis-Zacas, Mantzoros CS. Body fat mass and macronutrient intake in relation to circulating soluble leptin receptor, free leptin index, adiponectin, and resistin concentrations in healthy humans. J Clin Endocrinol Metab 2003;88(4):1730-6.
- 11. Colling J, Blundell J. Differences in energy expenditure and substrate oxidation between habitual high fat and low fat consumers. Int J Obes Relat Metab Disord 1998;22(7):612-8.
- 12. Lin X, Chavez MR, Bruch RC, Kilroy GE, Simmons LA, Lin L, et al. The effects of a high fat diet on leptin mRNA, serum leptin and the response to leptin are not altered in a rat strain susceptible to high fat diet-induced obesity. J Nutr 1998;128(10):1606-13.
- 13. Agus MSD, Swain JF, Larson CL, Eckert EA, Ludwing DS. Dietary composition and physiologic adaptations to energy restriction. Am J Clin Nutr 2000;71(4):901-7.
- 14. Wisse BE, Campfield LA, Marliss EB, Morais JA, Tenebaum R, Gougeon R. Effect of prolonged moderate and severe energy restriction and refeeding on plasma leptin concentrations in obese women. Am J Clin Nutr 1999;70(3):321-30.
- 15. Havel PJ. Leptin production and action: relevance to energy balance in humans. Am J Clin Nutr 1998; 67(3):355-6.
- 16. Keim NL, Stern JS, Havel PJ. Relation between circulating leptin concentrations and appetite during a prolonged, moderate energy deficit in women. Am J Clin Nutr 1998;68(4):794-801.
- 17. WHO (World Health Organization)/ FAO (Food and Agriculture Organization): Consultation on Obesity. Preventing and managing the global epidemic. Report of a joint FAO/WHO Expert Consultation. Geneva, 1998
- 18. Stunkard AJ, Messick S. The three-factor eating questionnaire to measure to dietary restraint, disinhibition and hunger. J Psychosom Res 1985;29(1):71-83.
- 19. WHO (World Health Organization)/ FAO (Food and Agriculture Organization): Diet, nutrition and the prevalence of chronic diseases. Report of a joint FAO/WHO Expert Consultation. Technical Report Series 916, Geneva, 2003 211p.
- 20. Institute of Medicine. Energy. In: Dietary Reference Intakes Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids Cap 5. The National Academy Press, Washington, D.C., 2002 Pt 1:5.1 5.114.
- 21. McArdle WC, Katch FI, Katch VL. Fisiologia do exercício. Energia, nutrição e desempenho humano 3Ş ed. Rio de Janeiro: Koogan, 1991 pp.387-409.
- 22. van der Kooy K, Seidell JC. Techniques for the measurement for visceral fat: a practical guide. Int J Obes Relat Metab Disord 1993;17(4):187-96.
- 23. Durnin JVGA, Rahaman MM. The assessment of the amount of fat in the human body from measurements of skinfold thickness. Br J Nutr 1967;21(3):681-9.
- 24. Durnin JVGA, Womersley J. Body fat assessed from total body density and its estimation from sinkfold thickness: measurements on 481 men and women aged from 16 to 72 years. Br J Nutr 1974;32(1):77-97.
- 25. Lukaski HC, Jonhson PE, Bolonchuk WW, Lykken GI. Assessment of fat-free mass using bioelectrical impedance measurements of the human body. Am J Clin Nutr 1985;41(4):810-7.
- 26. Vaché C, Rousset P, Gachon P, Gachon AM, Morio B, Boulier A, et al. Bioeletrical impedance analysis measurements of total body water and extracellular water in healthy elderly subjects. Int J Obes Relat Metab Disord 1998;22(6):537-43.
- 27. Speakman JR, Stubbs RJ, Mercer JG. Does body mass play a role in the regulation of food intake? Proc Nutr Soc 2002;61(4):473-87.
- 28. Lönnqvist F, Nordfors L, Jansson M, Thome A, Schalling M, Arner P. Leptin secretion from adipose tissue in women. J Clin Invest 1997;99(10):2398-404.
- 29. Rosenbaum M, Nicolson M, Hirsch J, Murphy E, Chu F, Leibel RL. Effects of weight change on plasma leptin concentrations and energy expenditure. J Clin Nutr Endocrinol Metab 1997;82(11):3647-54.
- 30. Ho SC, Tai ES, Eng PHK, Ramli A, Tan CE, Fok ACK. A study in the relationships between leptin, insulin, and body fat in Asian subjects. Int J Obes Relat Metab Disord 1999;23(3):246-52.
- 31. Horowitz JF, Coppack SW, Klein S. Whole-body and adipose tissue glucose metabolism in response to short-term fasting in lean and obese women. Am J Clin Nutr 2001;73(3):517-22.
- 32. Bennett FI, McFarlane-Anderson N, Wilks R, Luke A, Cooper RS, Forrester TE. Leptin concentration in women is influenced by regional distribution of adipose tissue. Am J Clin Nutr 1997;66(6):1340-4.
- 33. Park KG, Park KS, Kim MJ, Kim HS, Suh YS, Ahn JD, et al. Relationship between serum adiponectin and leptin concentrations and body fat distribution. Diabetes Res Clin Pract 2004;63(2):135-42.
- 34. Dubuc GR, Phinney SD, Stern JS, Havel PJ. Changes of serum leptin and endocrine and metabolic parameters after 7 days of energy restriction in men and women. Metabolism 1998;47(4):429-34.
- 35. Mars M, Graaf C, Groot LCPGM, van Rossum CTM, Kok FJ. Fasting leptin and appetite responses induced by 4-day 65%-energy restricted diet. Int J Obes 2006;30(1):122-8.
- 36. Mars M, Graaf C, Groot CPGM, Kok FJ. Decreases in fasting leptin and insulin concentration after acute energy restriction and subsequent compensation in food intake. Am J Clin Nutr 2005;81(3):570-7.
- 37. Otukonyong EE, Dube MG, Torto R, Kalra PS, Kalra SP. High-fat diet-induced ultradian leptin and insulin hypersecretion are absent in obesity-resistant rats. Obes Res 2005;13(6):991-9.
- 38. Lin L, Martin R, Schaffhauser AO, York DA. Acute changes in the changes in the response to peripheral leptin with alteration in the diet composition. Am J Physiol Regul Integr Comp Physiol 2001;280(2):R504-9.
- 39. Ainslie DA, Proietto J, Fam BC, Thorburn W. Short-term, high-fat diets lower leptin circulating concentrations in rats. Am J Clin Nutr 2000;71(2):438-42.
- 40. Havel PJ, Kasim-Karakas GRD, Mueller W, Johnson PR, Gingerich RL, Stern JS. Relationship of plasma leptin to plasma insulin and adiposity in normal weight and overweight women: effects of dietary fat content and sustained weight loss. J Clin Endocrinol Metab 1996;81(12):4406-13.
- 41. Weigle DS, Duell PB, Connor WE, Steiner RA, Soules MR, Kuijper JL. Effect of fasting, refeeding, and dietary fat restriction on plasma leptin levels. J Clin Endocrinol Metab 1997;82(2):561-5.
- 42. Berk ES, Kovera AJ, Boozer CN, Pi-Sunyer FX, Johnson JA, Albu JB. Adiponectin levels during low- and high-fat eucaloric diets in lean and obese women. Obes Res 2005;13(9):1566-71.
- 43. Weigle DS, Cummings DE, Newby PD, Breen PA, Frayo RS, Matthys CC, et al. Roles of leptin and ghrelin in the loss of body weight caused by a low fat, high carbohydrate diet. J Clin Endocrinol Metab 2003;88(4):1577-86.
- 44. Raben A, Astrup A. Leptin is influenced both by prediposition to obesity and diet composition. Int J Obes Relat Metab Disord 2000;24(4):450-9.
- 45. Teff KL, Elliott SS, Tschop M, Kieffer TJ, Rader D, Heiman M, et al. Dietary fructose reduces circulating insulin and leptin, attenuates postprandial suppression of ghrelin, and increases triglycerides in women. J Clin Endocrinol Metab 2004;89(6):2963-72.
Datas de Publicação
-
Publicação nesta coleção
04 Dez 2006 -
Data do Fascículo
Out 2006
Histórico
-
Aceito
14 Jul 2006 -
Revisado
23 Jan 2006 -
Recebido
17 Ago 2005