Resumos
Atualmente, a insuficiência/deficiência de vitamina D tem sido considerada um problema de saúde pública no mundo todo, em razão de suas implicações no desenvolvimento de diversas doenças, entre elas, o diabetes melito tipo 2 (DMT2), a obesidade e a hipertensão arterial. A deficiência de vitamina D pode predispor à intolerância à glicose, a alterações na secreção de insulina e, assim, ao desenvolvimento do DMT2. Esse possível mecanismo ocorre em razão da presença do receptor de vitamina D em diversas células e tecidos, incluindo células-β do pâncreas, no adipócito e no tecido muscular. Em indivíduos obesos, as alterações do sistema endócrino da vitamina D, caracterizada por elevados níveis de PTH e da 1,25(OH)2D3 são responsáveis pelo feedback negativo da síntese hepática de 25-OHD3 e também pelo maior influxo de cálcio para o meio intracelular, que pode prejudicar a secreção e a sensibilidade à insulina. Na hipertensão, a vitamina D pode atuar via sistema renina-angiotensina e também na função vascular. Há evidências de que a 1,25(OH)2D3 inibe a expressão da renina e bloqueia a proliferação da célula vascular muscular lisa. Entretanto, estudos prospectivos e de intervenção em humanos que comprovem a efetividade da adequação do status da vitamina D sob o aspecto "prevenção e tratamento de doenças endocrinometabólicas" são ainda escassos. Mais pesquisas são necessárias para se garantir o benefício máximo da vitamina D nessas situações.
Vitamina D; diabetes melito; obesidade; hipertensão
Vitamin D insufficiency/deficiency has been worldwide reported in all age groups in recent years. It has been considered a Public Health matter since decreased levels of vitamin D has been related to several chronic diseases, as type 2 diabetes mellitus (T2DM), obesity and hypertension. Glucose intolerance and insulin secretion has been observed during vitamin D deficiency, both in animals and humans resulting in T2DM. The supposed mechanism underlying these findings is presence of vitamin D receptor in several tissues and cells, including pancreatic β-cells, adipocyte and muscle cells. In obese individuals, the impaired vitamin D endocrine system, characterized by high levels of PTH and 1,25(OH)2D3 could induce a negative feedback for the hepatic synthesis of 25(OH)D and also contribute to a higher intracellular calcium, which in turn secrete less insulin and deteriorate insulin sensitivy. In hypertension, vitamin D could act on renin-angiotensin system and also in vascular function. Administration of 1,25(OH)2D3 could decreases renin gene expression and inhibit vascular smooth muscle cell proliferation. However, prospective and intervention human studies that clearly demonstrates the benefits of vitamin D status adequacy in the prevention and treatment of endocrine metabolic diseases are lacking. Further research still necessary to assure the maximum benefit of vitamin D in such situations.
Vitamin D; diabetes mellitus; obesity; hypertension
REVISÃO
Vitamina D e doenças endocrinometabólicas
Vitamin D and endocrine diseases
Natielen Jacques Schuch; Vivian Cristina Garcia; Ligia Araújo Martini
Departamento de Nutrição, Faculdade de Saúde Pública, Universidade de São Paulo (FSP/USP), São Paulo, SP, Brasil
Correspondência para Correspondência para: Ligia Araújo Martini Departamento de Nutrição Faculdade de saúde pública da Universidade de São Paulo Av. Doutor Arnaldo, 715, 2º andar 01246-904 - São Paulo, SP, Brasil lmartini@usp.br
RESUMO
Atualmente, a insuficiência/deficiência de vitamina D tem sido considerada um problema de saúde pública no mundo todo, em razão de suas implicações no desenvolvimento de diversas doenças, entre elas, o diabetes melito tipo 2 (DMT2), a obesidade e a hipertensão arterial.
A deficiência de vitamina D pode predispor à intolerância à glicose, a alterações na secreção de insulina e, assim, ao desenvolvimento do DMT2. Esse possível mecanismo ocorre em razão da presença do receptor de vitamina D em diversas células e tecidos, incluindo células-β do pâncreas, no adipócito e no tecido muscular. Em indivíduos obesos, as alterações do sistema endócrino da vitamina D, caracterizada por elevados níveis de PTH e da 1,25(OH)2D3 são responsáveis pelo feedback negativo da síntese hepática de 25-OHD3 e também pelo maior influxo de cálcio para o meio intracelular, que pode prejudicar a secreção e a sensibilidade à insulina. Na hipertensão, a vitamina D pode atuar via sistema renina-angiotensina e também na função vascular. Há evidências de que a 1,25(OH)2D3 inibe a expressão da renina e bloqueia a proliferação da célula vascular muscular lisa. Entretanto, estudos prospectivos e de intervenção em humanos que comprovem a efetividade da adequação do status da vitamina D sob o aspecto "prevenção e tratamento de doenças endocrinometabólicas" são ainda escassos. Mais pesquisas são necessárias para se garantir o benefício máximo da vitamina D nessas situações.
Descritores: Vitamina D; diabetes melito; obesidade; hipertensão
ABSTRACT
Vitamin D insufficiency/deficiency has been worldwide reported in all age groups in recent years. It has been considered a Public Health matter since decreased levels of vitamin D has been related to several chronic diseases, as type 2 diabetes mellitus (T2DM), obesity and hypertension. Glucose intolerance and insulin secretion has been observed during vitamin D deficiency, both in animals and humans resulting in T2DM. The supposed mechanism underlying these findings is presence of vitamin D receptor in several tissues and cells, including pancreatic β-cells, adipocyte and muscle cells. In obese individuals, the impaired vitamin D endocrine system, characterized by high levels of PTH and 1,25(OH)2D3 could induce a negative feedback for the hepatic synthesis of 25(OH)D and also contribute to a higher intracellular calcium, which in turn secrete less insulin and deteriorate insulin sensitivy. In hypertension, vitamin D could act on renin-angiotensin system and also in vascular function. Administration of 1,25(OH)2D3 could decreases renin gene expression and inhibit vascular smooth muscle cell proliferation. However, prospective and intervention human studies that clearly demonstrates the benefits of vitamin D status adequacy in the prevention and treatment of endocrine metabolic diseases are lacking. Further research still necessary to assure the maximum benefit of vitamin D in such situations.
Keywords: Vitamin D; diabetes mellitus; obesity; hypertension
VITAMINA D, NOVOS HORIZONTES
A atuação da vitamina D em processos metabólicos é pesquisada desde o século 17 e foi objeto de prêmio Nobel em 1938 (1). Atualmente, são conhecidos aproximadamente 41 metabólitos da vitamina D e um hormônio principal, a 1,25(OH)2D3, que atua como ligante para o fator de transcrição nuclear VDR (do inglês vitamin D receptor, receptor da vitamina D), regulando a transcrição gênica e a função celular em diversos tecidos. Há evidências de que 3% do genoma humano seja regulado pela 1,25(OH)2D3 (1).
A vitamina D é bastante conhecida pela sua função no desenvolvimento e na manutenção do tecido ósseo, bem como pela manutenção da homeostase normal do cálcio e do fósforo. Porém, evidências recentes sugerem o envolvimento dessa vitamina em diversos processos celulares vitais, como: diferenciação e proliferação celular, secreção hormonal (por exemplo: insulina), assim como no sistema imune e em diversas doenças crônicas não transmissíveis (1-5).
Na maioria dos indivíduos, a síntese cutânea é a principal fonte de vitamina D, sendo o restante obtido pela alimentação e pelo uso de suplementos (2). Após a síntese cutânea, a vitamina D entra na circulação e é transportada para o fígado, unida à proteína ligante da vitamina D (DBP). No fígado, ocorre a primeira hidroxilação para a 25(OH)D, que será secretada no plasma. Para se tornar ativa, a 25(OH)D é metabolizada pela enzima 25-hidroxivitamina D 1α-hidroxilase (CYP27B1) nos rins, formando 1,25(OH)2D3. A produção desse metabólito é controlada principalmente pela concentração de paratormônio (PTH), cálcio e fósforo séricos.
Os efeitos biológicos da forma ativa da vitamina D são mediados pelo VDR, presente nos principais sítios de ação da vitamina D, como rim, glândulas paratireoides, intestino e osso. No núcleo das células-alvo, a 1,25(OH)2D3 se associa ao VDR. Esse complexo se liga ao receptor de ácido retinoico (RXR), formando heterodímeros que atuam nos elementos-resposta da vitamina D (VDRE), iniciando, assim, a cascata de interações moleculares que modulam a transcrição de genes específicos (3).
Apesar de o rim ser o principal sítio de hidroxilação para a forma ativa da vitamina D, a presença de CYP27B1 e do VDR foi identificada em outros tecidos, como próstata, mama, cólon, pâncreas e células do sistema imune. Acredita-se, porém, que a hidroxilação extrarrenal tenha efeito autócrino e parácrino local e não faça parte da circulação (6).
O nível individual do status da vitamina D é mensurado por meio dos níveis plasmáticos da 25(OH)D. A forma biologicamente ativa da vitamina D, 1,25(OH)2D3, não é indicada para esse propósito devido a razões como: a) os níveis plasmáticos da 1,25(OH)2D3 são rigidamente mantidos em concentração normais; b) os níveis plasmáticos de 25(OH)D são aproximadamente cem vezes maiores do que os de 1,25(OH)2D3; c) a hidroxilação da 25(OH)D a 1,25(OH)2D3 ocorre em diversos tecidos, cobrindo as necessidades locais; e d) a meia-vida da 1,25(OH)2D3 é de aproximadamente seis horas, enquanto a da 25(OH)D, de duas a três semanas (7).
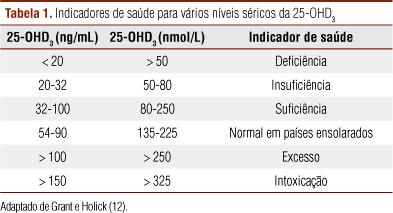
Os níveis séricos tidos como adequados ou não ainda são muito discutidos na literatura. Hollis (8) considera que o nível ótimo de vitamina D seria aquele necessário para manter o PTH em níveis adequados, visto que a deficiência de vitamina D leva à diminuição do cálcio sérico, o qual, em consequência, estimula as glândulas paratireoides a liberar o PTH, a fim de elevar a reabsorção renal e óssea do cálcio (8). Neste sentido, vários estudos têm encontrado um platô de absorção de cálcio e níveis adequados de PTH, com níveis de 25(OH)D próximos a 50 nmol/L (9-11).
Revisando estudos sobre os pontos de corte da vitamina D, Grant e Holick, em 2005 (12), propuseram que a concentração abaixo de 50 nmol/L seja considerada como deficiência de vitamina D; as concentrações entre 50 e 80 nmol/L seriam indicadoras de insuficiência. Os valores de 25(OH)D normalmente são expressos em nmol/L ou ng/mL (1 ng/mL corresponde a 2,496 nmol/L). Os pontos de corte estão ilustrados na tabela 1.
Atualmente, a insuficiência/deficiência de vitamina D tem sido considerada um problema de saúde pública no mundo todo, em razão de suas implicações no desenvolvimento de diversas doenças (3). Em 2008, a publicação referente ao 22ndMarabou Symposium: the changing faces of vitamin D relatou insuficiência de vitamina D em 1 bilhão de indivíduos ao redor do mundo (4).
Apesar da suposta maior exposição solar em nosso meio, concentrações insuficientes de 25(OH)D sérica são também reportadas. Saraiva e cols. (13) e de Souza Genaro e cols. (14) encontraram concentrações inadequadas em 42% de idosos na cidade de São Paulo e em 24% de mulheres com osteoporose. Em adolescentes saudáveis e adultos jovens, a prevalência foi de 60% e 50%, respectivamente (15,16).
O marcante número de publicações que identificam uma inadequação na concentração sérica de vitamina D em todo o mundo tem despertado o interesse de pesquisadores, que frequentemente identificam a relação dessa vitamina não somente com a osteoporose, mas também com o desenvolvimento de doenças endocrinometabólicas (5,6,17). Este artigo revisou as evidências sobre a participação da vitamina D nessas doenças, assim como elucidou os prováveis mecanismos de ação.
DIABETES MELITO
É bem conhecida a relação do cálcio sérico e do PTH com o desenvolvimento do diabetes melito tipo 2 (DMT2) (18); entretanto, atualmente, estudos em humanos sugerem que a 25(OH)D pode atuar como potente agente modificador do risco para o aparecimento dessa doença (19,20). Estudos clínicos e epidemiológicos confirmam essa hipótese, pois demonstram que indivíduos com redução na concentração de 25(OH)D sérica apresentam maior risco para desenvolver DMT2 (21,23).
O desenvolvimento de DMT2 envolve alterações na função das células-β do pâncreas e resistência periférica à ação da insulina. A 25(OH)D pode atuar nesses mecanismos em virtude da presença (VDR) nas células-β e de proteínas ligadoras de cálcio dependente de vitamina D (DBP) no tecido pancreático (24).
A vitamina D pode afetar a resposta insulínica ao estímulo da glicose direta ou indiretamente (25). O efeito direto parece ser mediado pela ligação da 1,25(OH)2D3 ao VDR da célula-β. Alternativamente, a ativação da vitamina D pode ocorrer dentro das células-β pela enzima 1α-hidroxilase, expressa nessas células (26).
O efeito indireto é mediado pelo fluxo de cálcio intra e extracelular nas células-β. Zemel (17) demonstrou que o aumento na 1,25(OH)2D3 e no PTH induz maior influxo de cálcio para o interior das células. Como a secreção de insulina é um processo cálcio-dependente mediado pela 1,25(OH)2D3 e pelo PTH, o aumento nas concentrações destes, devido à insuficiência de 25(OH)D, pode reduzir a capacidade secretora dessas células (25,27). Adicionalmente, a deficiência de 25(OH)D parece dificultar a capacidade das células-β na conversão da pró-insulina à insulina (28,29).
Com relação à ação da 25(OH)D na resistência à insulina, os efeitos podem também ser diretos (via estímulo da vitamina D para expressão do receptor da insulina, aumentando, assim, a resposta insulínica ao estímulo da glicose) ou indiretos (via concentração de cálcio intracelular) (30). O cálcio intracelular é essencial para mediar a resposta insulínica nos tecidos muscular e adiposo; desse modo, alterações na concentração de cálcio nesses tecidos podem contribuir para elevar a resistência periférica à ação da insulina, via redução da transdução de sinal e redução na atividade do transportador de glicose 4 (GLUT-4) (23). De fato, alguns autores (22,31), mas não todos (32), encontraram associação inversa entre o status da vitamina D e/ou do cálcio à resistência à insulina.
Evidências em estudos in vivo e em humanos
Ismail e Namala (27) demonstraram em ratos Wistar que uma dieta deficiente em vitamina D prejudica a tolerância à glicose, causando a alteração da sensibilidade à insulina. Em camundongos com VDR inativo nas ilhotas pancreáticas, observou-se diminuição na tolerância à glicose, quando eles eram submetidos à sobrecarga oral ou subcutânea de glicose. Adicionalmente, os autores observaram diminuição no mRNA da insulina (25). Por outro lado, Mathieu e cols. (33) não encontraram o mesmo efeito. Esses resultados controversos podem ser atribuídos às diferentes linhagens genéticas usadas para gerar esses animais sem VDR.
Em humanos, há também evidências da associação inversa entre resistência à insulina e 25(OH)D. Alguns autores (34,35) observaram reduzidas concentrações séricas de 25(OH)D em indivíduos com intolerância à glicose e/ou com diabetes. Chiu e cols. (22) avaliaram a associação entre 25(OH)D sérica e sensibilidade à insulina e função das células-β, por meio da técnica do clamp de insulina em indivíduos saudáveis, além de demonstrar correlação positiva entre 25(OH)D e o índice de sensibilidade à insulina. Liu e cols. (36), analisando a existência de relação entre 25(OH)D e resistência à insulina representada pelo modelo de avaliação da homeostase da sensibilidade à insulina (HOMA-IR) e o índice de sensibilidade à insulina (ISI0-120) em 808 participantes não diabéticos do Framingham Offspring Study, encontraram que as concentrações séricas de 25(OH)D foram inversamente associadas às concentrações de glicemia de jejum, insulina de jejum e HOMA-IR. A concentração de 25(OH)D foi positivamente associada com ISI0-120, adiponectina e colesterol de alta densidade (HDL) e inversamente associada a triacilgliceróis.
Corroborando esses dados, estudo de coorte realizado na Finlândia comprovou associação inversa entre 25(OH)D e o risco de desenvolvimento de DMT2. Matilla e cols. (37), avaliando 4.423 indivíduos de ambos os sexos e idade média entre 40 e 69 anos, com o objetivo de determinar a incidência de DMT2, encontraram risco relativo para desenvolver diabetes melito de 0,7 (IC 95% 0,42-1,16; P trend = 0,07), ajustado para índice de massa corpórea (IMC), exercício nas horas de lazer, fumo e nível educacional, quando comparados o maior e o menor quintil de concentrações de 25(OH)D.
Evidências de estudos de intervenção
Resultados de estudos referentes à suplementação com 25(OH)D sugerem melhora na secreção de insulina em indivíduos com DMT2. Borissova e cols. (38) observaram que o aumento na 25(OH)D sérica de 10 para 30 ng/mL pode melhorar a sensibilidade à insulina em 60%. Outros pesquisadores confirmam que a suplementação de 25(OH)D em humanos pode aumentar a secreção de insulina estimulada em resposta à carga de glicose oral em pacientes com DMT2 (sem glicemia de jejum alterada) em adultos saudáveis não diabéticos e em indivíduos com deficiência de vitamina D sem DMT2 estabelecida (22,32).
Pittas e cols. (39), analisando a população do Nurses' Health Study, com 84 mil mulheres sem história de DMT2 no início do estudo, encontraram incidência de 4.843 casos de diabetes decorridos 20 anos nessa população. O risco relativo para DMT2 foi de 0,87 (IC 95% 0,75-1,00; P trend = 0,04), quando comparada a maior (800UI) com a menor (400UI) concentração de suplementação de 25(OH)D.
De fato, a suplementação de vitamina D em concentração de 400UI também não mostrou efeito positivo na prevenção de DMT2 no Women's Heatlth Initiative, estudo prospectivo placebo-controlado com 33.951 mulheres, durante sete anos (40).
Em 2007, uma metanálise de estudos clínicos e observacionais sobre o papel da 25(OH)D e do cálcio em relação ao DMT2 foi realizada. Os estudos observacionais demonstram que o baixo status de 25(OH)D, cálcio e derivados do leite está relacionado à maior prevalência de DMT2 e síndrome metabólica. Nos indivíduos com maiores concentrações de 25(OH)D, a razão de chance para desenvolver DMT2 foi de 0,36 (IC95% = 0,16-0,80), quando estes foram comparados aos indivíduos com menores concentrações. O mesmo fator protetor esteve presente para a incidência de DMT2, em que a razão de chance foi 0,82 (IC95% = 0,72-0,93). Além disso, os estudos de intervenção sugerem que a suplementação de 25(OH)D e/ou cálcio parece ser importante para a prevenção de DMT2, particularmente em indivíduos com intolerância à glicose (23).
Comparação dos efeitos da vitamina D com mudanças no estilo de vida e medicamentos no controle glicêmico
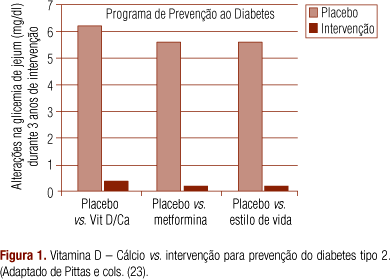
Utilizando dados de estudo de suplementação com 700UI de vitamina D3 e 500 mg de cálcio, durante três anos, em mulheres com mais de 65 anos, Pittas e cols. (41) demonstraram redução na glicemia de jejum semelhante à observada no estudo de prevenção de diabetes do Diabetes Prevention Program (DPP) por meio de mudanças do estilo de vida e também pelo uso da metformina (42). Esses dados estão ilustrados na figura 1.
Apesar da semelhança na concentração da glicemia de jejum, ainda são necessários estudos futuros que comparem o efeito da adequação do status da vitamina D somado às mudanças no estilo de vida na prevenção do DMT2.
Em resumo, os resultados dos estudos sobre os efeitos da vitamina D no diabetes melito evidenciam que a deficiência de 25(OH)D altera a síntese e a secreção de insulina, tanto em modelos animais como em humanos. Além disso, a deficiência dessa vitamina parece acarretar a intolerância à glicose e a secreção de insulina prejudicada e contribuir para o maior risco de DMT2. Entretanto, o diabetes melito é uma doença multifatorial, cuja prevenção envolve alterações significantes no estilo de vida, como adequação na alimentação e na prática de atividade física. As recentes evidências da participação da vitamina D nos processos de secreção e ação da insulina e no controle glicêmico sugerem que a vitamina D deve ser mais um fator considerado tanto na prevenção como no tratamento do diabetes melito.
OBESIDADE
Reduzidas concentrações de 25(OH)D são frequentemente observadas em indivíduos obesos (43-47). Especula-se que a insuficiência de vitamina D não seja apenas consequência da menor exposição solar em obesos, mas também um dos fatores que desencadeia o acúmulo de gordura corporal.
Evidências sugerem que uma das causas da deficiência de 25(OH)D em indivíduos obesos e com DMT2 possa estar ligada ao depósito de vitamina D nos adipócitos, diminuindo a sua biodisponibilidade e acionando o hipotálamo para desenvolver uma cascata de reações que resulta no aumento da sensação de fome e na diminuição do gasto energético (48). Tal situação também gera aumento nos níveis de PTH, consequente diminuição da sensibilidade à insulina e aumento desproporcional na concentração de cálcio intracelular (44,49-52).
Evidências em estudos epidemiológicos
Correlação negativa entre gordura corporal total com concentração sérica de 25(OH)D foi demonstrada em estudos de base populacional. Tal correlação permaneceu significante, mesmo após o ajuste para idade, estação do ano, ingestão de vitamina D e raça (43,44).
Snidjer e cols. (44), no Longitudinal Aging Study Amsterdam (LASA), observaram que a soma das dobras cutâneas e o percentual de gordura corporal estiveram fortemente associados à baixa concentração de 25(OH)D e à maior concentração de PTH.
A hipótese de que indivíduos obesos apresentam maiores concentrações de PTH foi confirmada por Bell e cols. (45). Maior secreção de PTH é sinal para hidroxilação da forma ativa da vitamina D. Os autores sugerem que, devido à elevação na 1,25(OH)2D3, ocorra feedback negativo à síntese hepática de 25(OH)D.
Posteriormente, estudo avaliando as concentrações de micronutrientes em homens e mulheres que participaram do National Health and Nutrition Examination Survey III (NHANES III) demonstrou que somente nas mulheres pré e pós-menopausadas (n = 8.137) houve associação negativa da vitamina D com o IMC (46). Entretanto, associação da relação entre obesidade e PTH não foi demonstrada.
Evidências in vivo e in vitro
Foi demonstrado que, em culturas de adipócitos, o PTH (47) e a 1,25(OH)2D3 podem elevar a concentração de cálcio intracelular, fato que impede a lipólise induzida por catecolaminas e promove a expressão do ácido graxo sintase, contribuindo para o acúmulo de gordura (48).
Recentes estudos feitos com modelos de culturas de pré-adipócitos de camundongos levantaram a hipótese de que o papel da 25(OH)D na inibição da adipogênese é mediado em nível molecular por meio da inibição do VDR e da expressão do regulador-mestre da adipogênese (PPARγ), reduzindo, consequentemente, sua atividade (49). No entanto, estudos realizados há mais de 20 anos indicaram que culturas de pré-adipócitos tratados com 1,25(OH)2D3 tiveram sua diferenciação para adipócito afetada. Esse estudo mostrou que concentrações nanomolares de 1,25(OH)2D3 podem inibir a adipogênese e reduzir o acúmulo de triacilglicerol em até 50%, em comparação com as células-controle diferenciadas (24). Essas descobertas são condizentes com a ideia de que qualquer influência da 1,25(OH)2D3 na adipogênese poderia ser exercida antes da transição de pré-adipócito para o adipócito, quando existe maior disponibilidade de VDR. Essa importante observação sugere também que o papel principal da 1,25(OH)2D3 na adipogênese parece ser a supressão de um evento molecular-chave primário ou anterior no processo de diferenciação do pré-adipócito (49).
De fato, Blumberg e cols. (50), utilizando uma linhagem de células de pré-adipócitos 3T3-L15B2, demonstraram que o tratamento com a 1,25(OH)2D3 inibiu parcialmente a formação endógena de ligantes de PPARγ. Assim, com a redução da expressão do PPARγ e consequente diminuição de sua atividade na presença de 1,25(OH)2D3, ocorre inibição da adipogênese. Contudo, pesquisas adicionais são necessárias para melhor esclarecer o decréscimo de PPARγ na presença de 1,25(OH)2D3 e investigar a extensão da interação entre VDR e PPARγ em pré-adipócitos in vivo (49).
Evidências em estudo de suplementação
Caan e cols. (51), analisando dados de 36.282 mulheres na pós-menopausa com idade entre 50 e 79 anos participantes do Women's Health Initiative (WHI), encontraram menor ganho de peso durante o uso de suplementação (1.000 mg de cálcio e 400UI de colecalciferol) quando comparadas ao grupo controle.
Estudo duplo-cego placebo-controlado, realizado com 445 indivíduos de 21 a 70 anos e IMC entre 28 e 47 kg/m2, utilizou suplementação de colecalciferol em três grupos:
1) 20.000UI duas vezes por semana;
2) 20.000UI uma vez por semana + placebo uma vez por semana;
3) placebo duas vezes por semana.
Todos os participantes receberam 500 mg de cálcio. Houve aumento significante na concentração de 25(OH)D e redução no PTH, mas não houve mudanças significantes em peso, relação cintura-quadril e percentual de gordura corporal intragrupo e intergrupo, mesmo quando avaliados a partir das concentrações séricas basais de 25(OH)D (52). Entretanto, estudos que avaliem os efeitos da suplementação da vitamina D na prevenção da obesidade ainda são necessários.
HIPERTENSÃO
Dados do Intersalt Study, importante trabalho sobre fatores de risco e controle de hipertensão com mais de 10.000 indivíduos de diversos países, mostram pressão arterial sistólica e diastólica positivamente associada à distância do equador, elucidando que a exposição solar e, supostamente, a menor concentração de 25(OH)D estariam relacionadas à pressão arterial (53).
Adicionalmente, em estudo realizado por Krause e cols. (54) com pacientes hipertensos submetidos à radiação ultravioleta três vezes por semana, durante três meses, foi demonstrado aumento de 180% nos níveis séricos de 25(OH)D e redução de 6 mmHg na pressão arterial sistólica e diastólica.
A hipertensão ocorre principalmente pela ativação inadequada do sistema renina-angiotensina. São vários os estudos que apontam níveis séricos de 1,25(OH2)D3 inversamente associados à pressão arterial ou à atividade da renina plasmática em normotensos e hipertensos (55-57). A ação da 1,25(OH2)D3 influenciando a expressão gênica ocorre por meio do receptor de vitamina D (VDR) presente em vários tecidos/células, como no aparelho justaglomerular (58). Em 2008, Kong e cols. (59) demonstraram que a supressão da expressão de renina pela 1,25(OH2)D3in vivo é independente do PTH e do cálcio.
Estudos experimentais demonstraram que a 1,25(OH2)D3 inibe a expressão da renina no aparelho justaglomerular (60) e bloqueia a proliferação de célula vascular muscular lisa (VSMC) (61). Assim, a relação vitamina D/hipertensão pode ocorrer via sistema renina-angiotensina e função vascular. Além disso, a 1-α hydroxilase, enzima de conversão da 25(OH)D em 1,25(OH2)D3, tem expressão em diversos tecidos, como células endoteliais, VSMC, além das células renais (62,63), sugerindo um efeito parácrino da 25(OH)D independente dos níveis circulantes de 1,25(OH2)D3.
Evidências em estudos epidemiológicos
Analisando a população com mais de 20 anos que participou do NHANES III, Scragg e cols. (64) encontraram pressão arterial sistólica e diastólica (3,0 e 1,6 mmHg, respectivamente) menor no maior quintil (25(OH)D > 85,7 nmol/L), em comparação ao menor quintil de vitamina D (25(OH)D < 40 nmol/L). Adicionalmente, Martins e cols. (65) encontraram em adultos americanos prevalência de hipertensão 30% maior no menor quartil, quando comparada ao maior quartil de vitamina D.
Recentemente, a associação entre os níveis séricos de 25(OH)D e o risco de doença coronariana nos indivíduos que participaram do Health Professionals Follow-up Study (HPFS) foi avaliada. Homens com deficiência de vitamina D (< 15 ng/mL ou 37 nmol/L) apresentam risco significantemente maior de desenvolver infarto do miocárdio quando comparados àqueles com níveis suficientes de vitamina D (> 30 ng/mL ou 75 nmol/L) (RR = 2,09; IC95% = 1,24-3,54) (66). Resultados semelhantes foram observados por Kendrick e cols. (67) ao avaliarem a população acima de 18 anos do NHANES III, na qual indivíduos com deficiência de vitamina D (25(OH)D < 20 ng/mL) apresentaram maior risco de doença cardiovascular (OR = 1,2; IC95% = 1,01-1,36) após os ajustes por potenciais fatores de confusão.
Utilizando ainda os dados do HPFS e do Nurses' Health Study, a relação negativa entre níveis séricos de vitamina D e hipertensão foi também demonstrada (68). Aos quatro anos de seguimento, o risco relativo, para homens com reduzidos níveis de 25(OH)D sérica desenvolverem hipertensão, foi de 6,13 (IC95% = 1,00-37,80), enquanto, nas mulheres, foi de 2,67 (IC95% = 1,05-6,97). Após oito anos de seguimento, nos homens, o risco relativo foi de 3,53 (IC95% = 1,02-12,3) e, nas mulheres, 1,7 (IC95% = 0,92-3,16).
Em outra análise, esta com 1.484 mulheres participantes do Nurses' Health Study que foram divididas em 742 casos que desenvolveram hipertensão e em 742 controles que não desenvolveram hipertensão, foi observado que a concentração de 25(OH)D era menor nos casos (25,6 ng/mL) do que nos controles (27,3 ng/mL; p = 0,001). As mulheres que se encontravam no menor quartil de vitamina D apresentaram maior risco de desenvolver hipertensão do que as mulheres no maior quartil (razão de chance ajustada de 1,66; IC95% = 1,11-2,48; p = 0,01). O mesmo foi observado quando comparadas mulheres com níveis suficientes e deficientes de vitamina D (razão de chance ajustada de 1,47; IC95% = 1,10-1,97) (69).
Evidências in vivo
Zhou e cols. (70) demonstraram regulação do sistema renina-angiotensina por meio da suplementação de 1,25(OH2)D3 em ratos isentos da enzima 1-α hydroxilase. Entretanto, Thierry-Palmer e cols. (71) aumentaram a oferta de vitamina D pela dieta em ratos sal-sensíveis com alimentação salgada e, apesar do aumento dos níveis séricos de 25(OH)D, a hipertensão não foi atenuada.
Evidências em estudos de suplementação
Em estudo duplo-cego placebo-controlado, foi observada a redução na pressão arterial de 39 indivíduos hipertensos com a suplementação de vitamina D (72). Essa redução também foi ressaltada em mulheres idosas suplementadas com cálcio e vitamina D (73).
Em outro ensaio clínico, foi observado que administração de 1,25(OH2)D3 reduziu a pressão arterial, além da atividade da renina plasmática e dos níveis de angiotensina II (74).
No entanto, ainda é preciso avaliar os efeitos da suplementação de 25(OH)D em estudos de base populacional e também em subgrupos específicos na prevenção da hipertensão arterial, além de analisar o status da vitamina D necessário em diferentes populações para garantir o benefício máximo desta na pressão arterial.
CONSIDERAÇÕES FINAIS
Evidências recentes demonstram que a insuficiência da vitamina D pode estar relacionada ao diabetes melito, à obesidade e à hipertensão. Entretanto, estudos prospectivos e de intervenção em humanos que comprovem a efetividade da adequação do status da vitamina D, tanto na prevenção como no tratamento dessas doenças, ainda são escassos. Mais ainda, a compreensão dos mecanismos exatos pelos quais a 25(OH)D ou a forma ativa 1,25(OH)2D3 promovem melhor funcionamento das células-β, do sistema renina-angiotensina e da regulação da quantidade de gordura corporal são também incompletos.
Contudo, considerando que a insuficiência de vitamina D é comumente observada e que há importantes lacunas no conhecimento sobre a ação dessa vitamina em relação à prevenção e ao tratamento de doenças endocrinometabólicas, a investigação da adequação do status da vitamina D nessas situações deve ser objeto de futuras pesquisas.
Declaração: os autores declaram não haver conflitos de interesse científico neste estudo.
Recebido em 14/Abr/2009
Aceito em 26/Abr/2009
- 1. Bouillon R, Carmeliet G, Verlinden L, van Etten E, Verstuyf A, Luderer HF, et al. Vitamin D and human health: lessons from vitamin D receptor null mice. Endocr Rev. 2008;29(6):726-76.
- 2. Heaney RP, Armas LAG, Shary JR, Bell NH, Binkley N, Hollis BW. 25-hydroxilation of vitamin D3: relation to circulating vitamin D3 under various input conditions. Am J Clin Nut. 2008; 87(6):1738-42.
- 3. Kimball S, Fuleihan Gel-H, Vieth R. Vitamin D: a growing perspective. Crit Rev Clin Lab Sci. 2008;45(4):339-414.
- 4. James WP. 22nd Marabou Symposium: the changing faces of vitamin D. Nut Rev. 2008;66(5):286-90.
- 5. Peterlick M, Cross HS. Vitamin D and calcium deficits predispose for multiple chronic diseases. Eur J Clin Invest. 2005;35(5):290-304.
- 6. Prentice A, Goldberg G, Schoenmakers I. Vitamin D across the lifecycle: physiology and biomarkers. Am J Clin Nut. 2008;88(2):500S-506S.
- 7. Mosekilde L. Vitamin D and the elderly. Clin Endocrinol. 2005; 62(3):265-81.
- 8. Hollis BW. Circulating 25-hydroxyvitamin D levels indicative of vitamin D sufficiency: implications for establishing a new effective dietary intake recommendation for vitamin D. J Nutr. 2005;135(2):317-22.
- 9. Chapuy MC, Preziosi P, Maamer M, Arnaud S, Galan P, Hercberg S, et al. Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int. 1997;7(5):439-43.
- 10. Tangpricha V, Pearce EN, Chen TC, Holick MF. Vitamin D insufficiency among free-living healthy young adults. Am J Med. 2002;112(8):659-62.
- 11. Vieth R, Ladak Y, Walsh PG. Age-related changes in the 25-hydroxyvitamin D versus parathyroid hormone relationship suggest a different reason why older adults require more vitamin D. J Clin Endocrinol Metab. 2003;88(1):185-91.
- 12. Grant WB, Holick MF. Benefits and requirements of vitamin D for optimal health: a review. Altern Med Rev. 2005;10(2):94-111.
- 13. Saraiva GL, Cendoroglo MS, Ramos LR, Araújo LMQ, Vieira JGH, Kunii I, et al. Influence of ultraviolet radiation on the production of 25 hidroxyvitamin D in the elderly population in the city of São Paulo (23 o 34'S), Brazil. Osteoporos Int. 2005;16(12):1649-54.
- 14. de Souza Genaro P, de Paiva Pereira GA, de Medeiros Pinheiro M, Szejnfeld VL, Araújo Martini L. Relationship between nutrient intake and vitamin D status in osteoporotic women. Int J Vitam Nutr Res. 2007;77(6):376-81.
- 15. Peters BSE, dos Santos LC, Fisberg M, Wood RJ, Martini LA. Prevalence of vitamin D insufficiency in Brazilian adolescents. Ann Nutr Metab. 2009;54(1):15-21.
- 16. Maeda SS, Kuni IS, Hayashi L, Lazaretti-Castro M. The effects of sun exposure on 25-hydroxyvitamin D concentrations in young healthy subjects living in the city of São Paulo, Brazil. Braz J Med Biol Res. 2007;40(12):1653-9.
- 17. Zemel MB. Mechanisms of dairy modulation of adiposity. J Nutr. 2003;133:252S-256S.
- 18. Levy J. Abnormal cell calcium homeostasis in type 2 diabetes mellitus: a new look on old disease. Endocrine. 1999;10(1):1-6.
- 19. Gregori S, Giarratana N, Smiroldo S, Uskokovic M, Adorini L. A 1alpha,25-dihydroxyvitamin D(3) analog enhances regulatory T cells and arrests autoimmune diabetes in NOD mice. Diabetes. 2002;51(5):1367-74.
- 20. Zipitis CS, Akobeng AK. Vitamin D supplementation in early childhood and risk of type 1 diabetes: a systematic review and meta-analysis. Arch Dis Child. 2008;93(6):512-7.
- 21. Hyppönen E, Lärä E, Reunanen A, Järvelin M-R, Virtanen SM. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study. Lancet. 2001;358(9292):1500-3.
- 22. Chiu KC, Chu A, Go VL, Saad MF. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction. Am J Clin Nutr. 2004;79(5):820-5.
- 23. Pittas AG, Lau J, Hu FB, Dawson-Hughes B. The role of vitamin D and calcium in type 2 diabetes. A systematic review and meta-analysis. J Clin Endocrinol Metab. 2007;92(6):2017-29.
- 24. Ishida H, Norman AW. Demonstration of a high affinity receptor for 1,25-dihydroxyvitamin D3 in rat pancreas. Moll Cell Endocrinol. 1988;60(2-3):109-17.
- 25. Zeitz U, Weber K, Soegiarto DW, Wolf E, Balling R, Erben RG. Impaired insulin secretory capacity in mice lacking a functional vitamin D receptor. FASEB J. 2003;17(3):509-11.
- 26. Bland R, Markovic D, Hills CE, Hughes SV, Chan SL, Squires PE, et al. Expression of 25-hydroxivitamin D3-alpha-hydroxylase in pancreatic islets. J Steroid Biochem Mol Biol. 2004;89-90(1-5):121-5.
- 27. Ismail A, Namala R. Impaired glucose tolerance in vitamin D deficiency can be corrected by calcium. J Nutr Biochem. 2000;11(3):170-5.
- 28. Bourlon PM, Billaudel B, Faure-Dussert A. Influence of vitamin D3 deficiency and 1,25 dihydroxyvitamin D3 on de novo insulin biosynthesis in the islets of the rat endocrine pancreas. J Endocrinol. 1999;160(1):87-95.
- 29. Ayesha I, Bala TS, Reddy CV, Raghuramulu N. Vitamin D deficiency reduces insulin secretion and turnover in rats. Diabetes Nutr Metab. 2001;14(2):78-84.
- 30. Maestro B, Campión J, Dávila N, Calle C. Stimulation by 1,25-dihydroxyvitamin D3 of insulin receptor expression and insulin responsiveness for glucose transport in U-937 human promonocytic cells. Endocr J. 2000;47(4):383-91.
- 31. Scragg R, Sowers M, Bell C; Third National Health and Nutrition Examination Survey. Serum 25-hydroxyvitamin D, diabetes, and ethnicity in the Third National Health and Nutrition Examination Survey. Diabetes Care. 2004;27(12):2813-8.
- 32. Orwoll E, Riddle M, Prince M. Effects of vitamin D on insulin and glucagon secretion in non-insulin-dependent diabetes mellitus. Am J Clin Nutr. 1994;59(5):1083-7.
- 33. Mathieu C, Van Etten E, Gysemans C, Decallonne B, Kato S, Laureys J, et al. In vitro and in vivo analysis of the immune system of vitamin D receptor knockout mice. J Bone Miner Res. 2001;16(11):2057-65.
- 34. Boucher BJ, Mannan N, Noonan K, Hales CN, Evans SJ. Glucose intolerance and impairment of insulin secretion in relation to vitamin D deficiency in east London Asians. Diabetologia. 1995; 38(10):1239-45.
- 35. Morris KL, Zemel MB. 1,25-dihydroxyvitamin D3 modulation of adipocyte glucocorticoid function. Obes Res. 2005;13(4):670-9.
- 36. Liu E, Meigs JB, Pittas AG, McKeown NM, Economos CD, Booth SL, et al. Plasma 25-hydroxyvitamin D is associated with markers of the insulin resistant phenotype in nondiabetic adults. J Nutr. 2009;139(2):329-34.
- 37. Mattila C, Knekt P, Männistö S, Rissanen H, Laaksonen MA, Montonen J, et al. Serum 25-hydroxyvitamin D concentration and subsequent risk of type 2 diabetes. Diabetes Care. 2007;30(10):2569-70.
- 38. Borissova AM, Tankova T, Kirilov G, Dakovska L, Kovacheva R. The effect of vitamin D3 on insulin secretion and peripheral insulin sensitivity in type 2 diabetic patients. Int J Clin Pract. 2003;57(4):258-61.
- 39. Pittas AG, Dawson-Hughes B, Li T, Van Dam RM, Willett WC, Manson JE, et al. Vitamin D and calcium intake in relation to type 2 diabetes in women. Diabetes Care. 2006; 29(3):650-6.
- 40. de Boer IH, Tinker LF, Connelly S, Curb JD, Howard BV, Kestenbaum B, Larson JC, Manson JE, Margolis KL, Siscovick DS, Weiss NS; Women's Health Initiative Investigators. Calcium plus vitamin D supplementation and the risk of incident diabetes in the Women's Health Initiative. Diabetes Care. 2008;31(4):701-7.
- 41. 41. Pittas AG, Harris SS, Stark PC, Dawson-Hughes B. The effects of calcium and vitamin D supplementation on blood glucose and markers of inflammation in nondiabetic adults. Diabetes Care. 2007;30(4):980-6.
- 42. Knowler WC, Barrett-Connor E, Fowler SE, Hamman RF, Lachin JM, Walker EA, Nathan DM; Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. 2002;346(6):393-403.
- 43. Arunabh S, Pollack S, Yeh J, Aloia JF. Body fat content and 25-hydroxivitamin D levels in healthy women. J Clin Endocrinol Metab. 2003;88(1):157-61.
- 44. Snijder MB, van Dam RM, Visser M, Deeg DJ, Dekker JM, Bouter LM, et al. Adiposity in relation to vitamin D status and parathyroid hormone levels: a population-based study in older men and women. J Clin Endocrinol Metab. 2005;90(7):4119-23.
- 45. Bell NH, Epstein S, Greene A, Shary J, Oexmann MJ, Shaw S. Evidence for alteration of the vitamin D-endocrine system in obese subjects. J Clin Invest. 1985;76(1):370-3.
- 46. Kimmons JE, Blanck HM, Tohill BC. Associations between body mass index and the prevalence of low micronutrient levels among US adults. Med Gen Med. 2006;8(4):59.
- 47. Ni Z, Smogorjewski M, Massry SG. Effects of parathyroid hormone on cytosolic calcium of rat adipocytes. Endocrinology. 1994; 135(5):1837-44.
- 48. Su X, Zemel MB. 1alpha, 25-dihydroxyvitamin D and corticosteroid regulate adipocyte nuclear vitamin D receptor. Int J Obes (Lond). 2008;32(8):1305-11.
- 49. Wood RJ. Vitamin D and adipogenesis: new molecular insights. Nutn Rev. 2007; 66(1):40-6.
- 50. Blumberg JM, Tzameli I, Astapova I, Lam FS, Flier JS, Hollenberg AN. Complex role of the vitamin D receptor and its ligand in adipogenesis in 3T3-L1 cells. J Biol Chem. 2006;281(16):11205-13.
- 51. Caan B, Neuhouser M, Aragaki A, Lewis CB, Jackson R, LeBoff MS, et al. Calcium plus vitamin D supplementation and the risk of postmenopausal weight gain. Arch Intern Med. 2007; 14;167(9):893-902.
- 52. Sneve M, Figenschau Y, Jorde R. Supplementation with cholecalciferol does not result in weight reduction in overweight and obese subjects. Eur J Endocrinol. 2008;159(6):675-84.
- 53. INTERSALT Cooperative Research Group. Intersalt: an international study of electrolyte excretion and blood pressure. Results for 24 hour urinary sodium and potassium excretion. Intersalt Cooperative Research Group. BMJ. 1988;297(6644):319-28.
- 54. Krause R, Bühring M, Hopfenmüller W, Holick MF, Sharma AM. Ultraviolet B and blood pressure. Lancet. 1998;352(9129):709-10.
- 55. Resnick LM, Nicholson JP, Laragh JH. Calcium metabolism in essential hypertension: relationship to altered renin system activity. Fed Proc. 1986;45(12):2739-45.
- 56. Burgess ED, Hawkins RG, Watanabe M. Interaction of 1,25-dihydroxyvitamin D and plasma renin activity in high renin essential hypertension. Am J Hypertens. 1990;3(12 Pt 1):903-5.
- 57. Imaoka M, Morimoto S, Kitano S, Fukuo F, Ogihara T. Calcium metabolism in elderly hypertensive patients: possible participation of exaggerated sodium, calcium and phosphate excretion. Clin Exp Pharmacol Physiol. 1991;18(9):631-41.
- 58. Li YC. Vitamin D regulation of the rennin-angiotensin system. J Cell Biochem. 2003;88(2):327-31.
- 59. Kong J, Qiao G, Zhang Z, Liu SQ, Li YC. Targeted vitamin D receptor expression in juxtaglomerular cells suppresses renin expression independent of parathyroid hormone and calcium. Kidney Int. 2008;74(12):1577-81.
- 60. Li YC, Kong J, Wei M, Chen ZF, Liu SQ, Cao LP. 1,25-dihydroxivitamin D3 is a negative endocrine regulator of renin-angiotensin system. J Clin Invest 2002;110(2):229-38.
- 61. Carthy EP, Yamashita W, Hsu A, Ooi BS. 1,25-dihydroxivitamin D3 and rat vascular smooth muscle cell growth. Hypertension. 1989;13(6 Pt 2):954-9.
- 62. Merke J, Milde P, Lewieka S, Hügel U, Klaus G, Mangelsdorf DJ, et al. Identification and regulation of 1,25-dihydroxivitamin D3 receptor activity and biosynthesis of 1,25-dihydroxivitamin D3. Studies in cultured bovine aortic endothelial cells and human dermal capillaries. J Clin Invest. 1989;83(6):1903-15.
- 63. Zehnder D, Bland R, Walker EA, Bradwell AR, Howie AJ, Hewison M et al. Expression of 25-hydroxyvitamin D3-1alpha-hydroxylase in the human kidney. J Am Soc Nephrol. 1999;10(12):2465-73.
- 64. Scragg R, Sowers MF, Bell C. Serum 25-hydroxyvitamin D, ethnicity, and blood pressure in the Third National Healthy and Nutrition Examination Survey. J Am Hyper. 2007;20(7):713-9.
- 65. Martins D, Wolf M, Pan D, Zadshir A, Tareen N, Thadhani R, et al. Prevalence of cardiovascular risk factors and the serum levels of 25-hydroxyvitamin D in the United States: data from the Third National Healthy and Nutrition Examination Survey. Arch Intern Med. 2007;167(11):1159-65.
- 66. Giovannucci E, Liu Y, Hollis BW, Rimm EB. 25-hydroxyvitamin D and risk of myocardial infarction in men: a prospective study. Arch Intern Med. 2008;168(11):1174-80.
- 67. Kendrick J, Targher G, Smits G, Chonchol M. 25-Hydroxyvitamin D deficiency is independently associated with cardiovascular disease in the Third National Health and Nutrition Examination Survey. Atherosclerosis. 2008:1-6.
- 68. Forman JP, Giovannucci E, Holmes MD, Bischoff-Ferrari HA, Tworoger SS, Willet WC, et al. Plasma 25-hydroxyvitamin D levels and risk of incident hypertension. Hypertension. 2007;49(5):1063-9.
- 69. Forman JP, Curhan GC, Taylor EN. Plasma 25-hydroxyvitamin D levels and risk of incident hypertension among young women. Hypertension. 2008;52(5):828-32.
- 70. Zhou C, Lu F, Cao K, Xu D, Goltzman D, Miao D. Calcium-independent and 1,25(OH2)D3-dependent regulation of the renin-angiotensin system in 1alpha-hydroxylase knockout mice. Kidney Int. 2008;74(2):170-9.
- 71. Thierry-Palmer M, Cephas S, Muttardy FF, Al-Mahmoud A. High dietary cholecalciferol increases plasma 25-hydroxycholecalciferol concentration, but does not attenuate the hypertension of Dahl salt-sensitive rats fed a high salt diet. J Steroid Biochem Mol Biol. 2008;111(1-2):7-12.
- 72. Lind L, Wengle B, Ljunghall S. Blood pressure is lowered by vitamin D (alphacalcidol) during long-term treatment of patients with intermittent hypercalcemia. A double-blind, placebo-controlled study. Acta Med Scand. 1987;222(5):423-7.
- 73. Pfeifer M, Begerow B, Minne HW, Nachtigall D, Hansen C. Effects of short-term vitamin D3 and calcium supplementation on blood pressure and parathyroid hormone levels in elderly women. J Clin Endocrinol Metab. 2001;86(4):1633-7.
- 74. Kimura Y, Kawamura M, Owada M, Oshima T, Murooka M, Fujiwara T, et al. Effectiveness of 1,25-dihydroxyvitamin D supplementation on blood pressure reduction in pseudohypoparathyroidism patient with high renin activity. Intern Med. 1999;38(1):31-5.
Datas de Publicação
-
Publicação nesta coleção
11 Set 2009 -
Data do Fascículo
Jul 2009
Histórico
-
Recebido
14 Abr 2009 -
Aceito
26 Abr 2009