Resumos
INTRODUÇÃO: O hipertireoidismo é caracterizado pelo aumento da síntese e liberação dos hormônios tireoidianos pela glândula tireoide. A tireotoxicose refere-se à síndrome clínica decorrente do excesso de hormônios tireoidianos circulantes, secundário ao hipertireoidismo ou não. Este artigo descreve diretrizes baseadas em evidências clínicas para o manejo da tireotoxicose. OBJETIVO: O presente consenso, elaborado por especialistas brasileiros e patrocinado pelo Departamento de Tireoide da Sociedade Brasileira de Endocrinologia e Metabologia, visa abordar o manejo, diagnóstico e tratamento dos pacientes com tireotoxicose, de acordo com as evidências mais recentes da literatura e adequadas para a realidade clínica do país. MATERIAIS E MÉTODOS: Após estruturação das questões clínicas, foi realizada busca das evidências disponíveis na literatura, inicialmente na base de dados do MedLine-PubMed e posteriormente nas bases Embase e SciELO - Lilacs. A força das evidências, avaliada pelo sistema de classificação de Oxford, foi estabelecida a partir do desenho de estudo utilizado, considerando-se a melhor evidência disponível para cada questão. RESULTADOS: Foram definidas 13 questões sobre a abordagem clínica inicial visando ao diagnóstico e ao tratamento que resultaram em 53 recomendações, incluindo investigação etiológica, tratamento com drogas antitireoidianas, iodo radioativo e cirurgia. Foram abordados ainda o hipertireoidismo em crianças, adolescentes ou pacientes grávidas e o manejo do hipertireoidismo em pacientes com oftalmopatia de Graves e com outras causas diversas de tireotoxicose. CONCLUSÕES: O diagnóstico clínico do hipertireoidismo, geralmente, não oferece dificuldade e a confirmação diagnóstica deverá ser feita com as dosagens das concentrações séricas de TSH e hormônios tireoidianos. O tratamento pode ser realizado com drogas antitireoidianas, administração de radioiodoterapia ou cirurgia de acordo com a etiologia da tireotoxicose, as características clínicas, disponibilidade local de métodos e preferências do médico-assistente e paciente.
Tireotoxicose; doença de Graves; bócio nodular tóxico; drogas antitireoidianas
INTRODUCTION: Hyperthyroidism is characterized by increased synthesis and release of thyroid hormones by the thyroid gland. Thyrotoxicosis refers to the clinical syndrome resulting from excessive circulating thyroid hormones, secondary to hyperthyroidism or due to other causes. This article describes evidence-based guidelines for the clinical management of thyrotoxicosis. OBJECTIVE: This consensus, developed by Brazilian experts and sponsored by the Department of Thyroid Brazilian Society of Endocrinology and Metabolism, aims to address the management, diagnosis and treatment of patients with thyrotoxicosis, according to the most recent evidence from the literature and appropriate for the clinical reality of Brazil. MATERIALS AND METHODS: After structuring clinical questions, search for evidence was made available in the literature, initially in the database MedLine, PubMed and Embase databases and subsequently in SciELO - Lilacs. The strength of evidence was evaluated by Oxford classification system was established from the study design used, considering the best available evidence for each question. RESULTS: We have defined 13 questions about the initial clinical approach for the diagnosis and treatment that resulted in 53 recommendations, including the etiology, treatment with antithyroid drugs, radioactive iodine and surgery. We also addressed hyperthyroidism in children, teenagers or pregnant patients, and management of hyperthyroidism in patients with Graves' ophthalmopathy and various other causes of thyrotoxicosis. CONCLUSIONS: The clinical diagnosis of hyperthyroidism usually offers no difficulty and should be made with measurements of serum TSH and thyroid hormones. The treatment can be performed with antithyroid drugs, surgery or administration of radioactive iodine according to the etiology of thyrotoxicosis, local availability of methods and preferences of the attending physician and patient.
Thyrotoxicosis; Graves' disease; toxic nodular goiter; antithyroid drugs
CONSENSO EM TIREOIDE
Consenso brasileiro para o diagnóstico e tratamento do hipertireoidismo: recomendações do Departamento de Tireoide da Sociedade Brasileira de Endocrinologia e Metabologia
Ana Luiza MaiaI; Rafael S. ScheffelI; Erika Laurini Souza MeyerII; Glaucia M. F. S. MazetoIII; Gisah Amaral de CarvalhoIV; Hans GrafIV; Mario VaismanV; Lea M. Z. MacielVI; Helton E. RamosVII; Alfio José TincaniVII; Nathalia Carvalho de AndradaIX; Laura S. WardVIII
IUnidade de Tireoide, Serviço de Endocrinologia, Hospital de Clínicas de Porto Alegre, Universidade Federal do Rio Grande do Sul (HC-UFRGS), Porto Alegre, RS, Brasil
IIDepartamento de Medicina Interna, Universidade Federal de Ciências da Saúde de Porto Alegre (UFCSPA), Porto Alegre, RS, Brasil
IIIDepartamento de Clínica Médica, Faculdade de Medicina de Botucatu, Universidade Estadual Paulista (Unesp), Botucatu, SP, Brasil
IVServiço de Endocrinologia e Metabologia, Hospital de Clínicas, Universidade Federal do Paraná (SEMPR-HC-UFPR), Curitiba, PR, Brasil
VServiço de Endocrinologia, Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil
VIDivisão de Endocrinologia e Metabologia, Departamento de Clínica Médica, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo (FMRP-USP), SP, Brasil
VIIDepartamento de Biorregulação, Instituto de Ciências da Saúde, Universidade Federal da Bahia (UFBA), Salvador, BA, Brasil
VIIIFaculdade de Ciências Médicas, Universidade Estadual de Campinas (FCM/Unicamp), Campinas, SP, Brasil
IXProjeto Diretrizes da Associação Médica Brasileira, Conselho Federal de Medicina (AMB/CFM), São Paulo, SP, Brasil
Correspondência para Correspondência para: Ana Luiza Maia Serviço de Endocrinologia, Hospital de Clínicas de Porto Alegre Rua Ramiro Barcelos, 2350 90035-003 - Porto Alegre, RS, Brasil almaia@ufrgs.br
RESUMO
INTRODUÇÃO: O hipertireoidismo é caracterizado pelo aumento da síntese e liberação dos hormônios tireoidianos pela glândula tireoide. A tireotoxicose refere-se à síndrome clínica decorrente do excesso de hormônios tireoidianos circulantes, secundário ao hipertireoidismo ou não. Este artigo descreve diretrizes baseadas em evidências clínicas para o manejo da tireotoxicose.
OBJETIVO: O presente consenso, elaborado por especialistas brasileiros e patrocinado pelo Departamento de Tireoide da Sociedade Brasileira de Endocrinologia e Metabologia, visa abordar o manejo, diagnóstico e tratamento dos pacientes com tireotoxicose, de acordo com as evidências mais recentes da literatura e adequadas para a realidade clínica do país.
MATERIAIS E MÉTODOS: Após estruturação das questões clínicas, foi realizada busca das evidências disponíveis na literatura, inicialmente na base de dados do MedLine-PubMed e posteriormente nas bases Embase e SciELO - Lilacs. A força das evidências, avaliada pelo sistema de classificação de Oxford, foi estabelecida a partir do desenho de estudo utilizado, considerando-se a melhor evidência disponível para cada questão.
RESULTADOS: Foram definidas 13 questões sobre a abordagem clínica inicial visando ao diagnóstico e ao tratamento que resultaram em 53 recomendações, incluindo investigação etiológica, tratamento com drogas antitireoidianas, iodo radioativo e cirurgia. Foram abordados ainda o hipertireoidismo em crianças, adolescentes ou pacientes grávidas e o manejo do hipertireoidismo em pacientes com oftalmopatia de Graves e com outras causas diversas de tireotoxicose.
CONCLUSÕES: O diagnóstico clínico do hipertireoidismo, geralmente, não oferece dificuldade e a confirmação diagnóstica deverá ser feita com as dosagens das concentrações séricas de TSH e hormônios tireoidianos. O tratamento pode ser realizado com drogas antitireoidianas, administração de radioiodoterapia ou cirurgia de acordo com a etiologia da tireotoxicose, as características clínicas, disponibilidade local de métodos e preferências do médico-assistente e paciente.
Descritores: Tireotoxicose; doença de Graves; bócio nodular tóxico; drogas antitireoidianas
1) INTRODUÇÃO
O termo hipertireoidismo refere-se ao aumento da síntese e liberação dos hormônios tireoidianos pela glândula tireoide. Tireotoxicose refere-se à síndrome clínica decorrente do excesso de hormônios tireoidianos circulantes, secundário à hiperfunção da glândula tireoide ou não. A tireotoxicose por T3 decorre do aumento isolado dos níveis séricos de T3 e supressão do TSH.
As manifestações clínicas comumente encontradas no hipertireoidismo estão listadas na tabela 1. De modo geral, é observada uma correlação entre os níveis hormonais e a apresentação clínica, sendo que os sinais e sintomas secundários ao estímulo adrenérgico, como taquicardia e ansiedade, são mais evidentes em pacientes jovens e com bócios volumosos (1,2) (A). Perda de peso é um achado frequente, no entanto alguns pacientes, especialmente os mais jovens, podem relatar ganho ponderal devido ao aumento do apetite (3) (B). Em idosos, predominam sintomas cardiopulmonares, tais como taquicardia (ou fibrilação atrial), dispneia e edema. O termo "tireotoxicose apática" é utilizado para descrever o paciente idoso assintomático, exceto pela presença de fraqueza e astenia (2,4) (A,D).
2) COMO AVALIAR E MANEJAR INICIALMENTE O PACIENTE COM TIREOTOXICOSE?
O paciente com suspeita de tireotoxicose deve ser submetido a anamnese e exame físico cuidadosos, no intuito de buscar o diagnóstico e estabelecer sua etiologia (Tabela 2). O tempo de início dos sintomas, uso de medicamentos, exposição ao iodo (realização de exames com contraste iodado ou uso de compostos com alto teor de iodo), gestação recente e história familiar de doença autoimune da tireoide devem ser questionados. No exame físico, a determinação do peso corporal, pressão arterial e frequência cardíaca são particularmente importantes. Taquicardia sinusal e hipertensão arterial sistólica são comuns, e a fibrilação atrial pode estar presente, principalmente em idosos. Sinais oculares como retração palpebral, olhar fixo ou assustado e sinal de lid-lag são decorrentes da hiperatividade adrenérgica e podem ser observados em qualquer quadro de tireotoxicose. No entanto, a presença de sinais como hiperemia conjuntival e palpebral, edema palpebral, quemose, paralisia de músculos extraoculares ou exoftalmia são característicos da oftalmopatia da doença de Graves (DG). No quadro de tireotoxicose, a pele geralmente é quente e úmida. Tremor fino de extremidades, fraqueza muscular proximal e hiperreflexia são achados frequentes. Dermatopatia infiltrativa (mixedema pré-tibial) é uma manifestação rara da DG. A palpação e ausculta da glândula tireoide permitem avaliar o tamanho, a consistência, a presença de nódulos ou o sopro tireoidiano. Bócio de tamanho variado é geralmente observado na DG e no bócio multinodular tóxico (BMNT). Dor espontânea ou à palpação da tireoide é característica da tireoidite subaguda, enquanto a presença de nódulo único leva à suspeita de adenoma folicular hiperfuncionante.
Nos pacientes com suspeita clínica de tireotoxicose, a avaliação inicial consiste na determinação dos níveis séricos do TSH e dos hormônios tireoidianos. A determinação dos níveis do TSH, por meio de metodologia ultrassensível (sensibilidade funcional < 0,02 mUI/L), é o método mais sensível para diagnóstico de tireotoxicose (sensibilidade de 95%, especificidade de 92%) (5) (B). Sempre que possível, deve ser solicitada a determinação da fração livre da tiroxina (T4L), visto que anormalidades nas proteínas carreadoras dos hormônios tireoidianos (secundárias ao uso de medicações ou determinadas condições clínicas) podem alterar a concentração total do T4 ou T3 (6,7) (D,B). Exceto nos raríssimos casos de hipertireoidismo secundário ao adenoma produtor de TSH (< 1%, vide item 13) ou à síndrome de resistência aos hormônios tireoidianos (doença autossômica dominante, com incidência de 1:40.000 nascidos vivos, vide item 13), o excesso de hormônios tireoidianos circulantes, independente da causa, resultará em supressão do TSH (usualmente < 0,1 mUI/L). No hipertireoidismo franco, tanto o T4L quanto o T3 séricos estão aumentados e o TSH está indetectável. No entanto, em fases iniciais da DG ou do adenoma funcionante, pode ocorrer aumento isolado do T3, condição clínica denominada de "T3-tireotoxicose". Em casos suspeitos de tireotoxicose factícia (ingestão de hormônios tireoidianos), níveis séricos baixos ou indetectáveis de tireoglobulina sérica podem ser úteis no diagnóstico (8) (D).
A dosagem do anticorpo antirreceptor do TSH (TRAb) é raramente necessária para o diagnóstico do hipertireoidismo de Graves, sendo indicada apenas em casos selecionados. Como regra, considera-se adequado determinar os níveis de TRAb em gestantes com DG ou história médica pregressa de DG para avaliação do risco de tireotoxicose neonatal por passagem transplacentária dos anticorpos (9) (B); no diagnóstico diferencial da tireotoxicose gestacional (10) e nos indivíduos eutireoidianos com exoftalmopatia, especialmente bilateral.
O iodo é um elemento fundamental para síntese dos hormônios tireoidianos, sendo a captação de iodo um excelente indicador da função tireoidiana. A taxa de captação de iodo pela tireoide pode ser avaliada utilizando-se iodo radioativo (131I ou 123I) e permite diferenciar as causas de tireotoxicose associadas ao aumento da captação (hipertireoidismo) daquelas com captação baixa ou ausente (Tabela 2) (11) (B). A captação de iodo é geralmente elevada em pacientes com DG ou bócio multinodular tóxico (BMNT), estando praticamente ausente nas tireoidites ou na tireotoxicose factícia. A captação também diminui em indivíduos que usaram contrastes radiológicos iodados nos 30 a 60 dias prévios ou que possuem dieta muito rica em iodo (alimentos como algas marinhas). No entanto, de modo interessante, a captação de iodo pode estar presente em usuários de amiodarona, apesar de a droga ser altamente iodada (12)(B).
A cintilografia de tireoide evidencia a distribuição do radiomarcador na glândula e tem indicações limitadas na avaliação do hipertireoidismo. É caracteristicamente difusa na DG e heterogênea no BMNT (focos de hipercaptação entremeados com áreas hipocaptantes). A principal indicação da cintilografia é na suspeita de adenoma folicular hiperfuncionante (nódulo quente) (11) (B).
A ultrassonografia (US) da tireoide não está indicada rotineiramente na avaliação do hipertireoidismo e está reservada somente nos casos de nódulo tireoidiano pela palpação (13) (D). No entanto, quando o exame da captação de iodo não pode ser realizado ou é contraindicado (gestação e amamentação), ou ainda não for elucidativo no diagnóstico (exposição recente ao iodo), a US da tireoide com Doppler pode ser útil no diagnóstico etiológico (14,15) (C,D). A Dopplerfluxometria da tireoide pode contribuir no diagnóstico diferencial dos subtipos de tireotoxicose induzida por amiodarona (tipos 1 e 2) e entre DG e tireoidite destrutiva (14,16) (C,B).
O tratamento com betabloqueadores deve ser considerado em pacientes sintomáticos, com suspeita ou diagnóstico de tireotoxicose (17,18) (B,D). Esses medicamentos diminuem a frequência cardíaca, a pressão arterial, os tremores, a labilidade emocional e a intolerância aos exercícios (18) (D). O betabloqueador não seletivo propranolol é o mais utilizado, com melhora dos movimentos hipercinéticos, tremores finos de extremidades e mãos úmidas (19) (B), mas também podem ser prescritos betabloqueadores cardiosseletivos (atenolol, metoprolol) ou com meia-vida mais curta (esmolol) (19,20) (B,C). A dose oral habitual de propranolol ou atenolol varia de 20 a 80 mg a cada 6 a 12 horas e 50 a 100 mg uma vez ao dia, respectivamente, e deve ser ajustada conforme a resposta clínica (21) (D). Os bloqueadores de canais de cálcio, verapamil e diltiazem, administrados oralmente, podem ser utilizados nos casos de contraindicação ao uso de betabloqueadores (22,23) (B).
Recomendação 1
O diagnóstico de hipertireoidismo de Graves pode ser estabelecido com relativa segurança em pacientes com quadro moderado ou grave de tireotoxicose, oftalmopatia de início recente e bócio difuso, não sendo necessários exames adicionais para investigação etiológica.
Recomendação 2
A suspeita clínica de tireotoxicose deve ser confirmada por meio da determinação concomitante dos níveis séricos do TSH e hormônios tireoidianos (B). A maioria dos pacientes com tireotoxicose apresenta TSH baixo ou indetectável. Níveis elevados de T4L e/ou T3 confirmam o diagnóstico de tireotoxicose.
Recomendação 3
A determinação sérica do TRAb está indicada em gestantes com DG ou história médica pregressa de DG, para avaliação de risco da tireotoxicose neonatal por passagem transplacentária dos anticorpos; no diagnóstico diferencial da tireotoxicose gestacional (1º trimestre) e em indivíduos eutireoidianos com oftalmopatia (B).
Recomendação 4
A captação de iodo radioativo (131I ou 123I) é útil no diagnóstico diferencial da causa da tireotoxicose, especialmente para diferenciar as tireoidites da DG e do BMNT (B). É contraindicada na gestação e na lactação (D).
Recomendação 5
US da tireoide não é indicada rotineiramente na avaliação do hipertireoidismo (D). A Dopplerfluxometria pode ser útil no diagnóstico diferencial dos subtipos de tireotoxicose induzida por amiodarona (B).
Recomendação 6
A prescrição de betabloqueadores está indicada em pacientes sintomáticos com suspeita ou diagnóstico de tireotoxicose (B).
3) COMO TRATAR O PACIENTE COM HIPERTIREOIDISMO SECUNDÁRIO A DG?
A DG é a causa mais comum de tireotoxicose e sua patogênese envolve a formação do TRAb. Esses anticorpos se ligam aos receptores de TSH, presentes na membrana da célula folicular tireoidiana, causando, assim, a hiperfunção glandular. O excesso de hormônios tireoidianos secundário ao hipertireoidismo de Graves pode ser controlado por meio da inibição da síntese hormonal, utilizando-se drogas antitireoidianas (DAT), destruição de tecido tireoidiano com iodo radioativo (131I) ou tireoidectomia total (TT). Os três tratamentos apresentam vantagens e desvantagens, sendo que os dois últimos são considerados tratamentos definitivos. A escolha de uma modalidade em detrimento de outras deve ser feita com base em características clínicas, socioeconômicas e preferências do médico-assistente e do paciente.
A. O USO DE DAT COMO TRATAMENTO INICIAL NO HIPERTIREOIDISMO DE GRAVES
A utilização de DAT é a única modalidade de tratamento que possibilita a cura sem necessidade de intervenção cirúrgica ou exposição radioativa. As DAT são as tionamidas: propiltiouracil (PTU), metimazol (MMI) e carbimazol, este último não disponível no Brasil. Essas drogas inibem a síntese dos hormônios tireoidianos por interferência na utilização do iodeto intratireoidiano e na reação de acoplamento, ambas as reações catalisadas pela peroxidase tireoidiana (24) (D). As tionamidas também têm efeito imunomodulador, embora o mecanismo ainda não tenha sido esclarecido. Doses elevadas de PTU inibem a conversão periférica de T4 em T3, ação adicional benéfica quando se deseja um controle mais rápido do quadro de tireotoxicose. No entanto, devido aos efeitos hepatotóxicos do PTU e à redução da eficácia do 131I em possível terapia no futuro (vide abaixo), a utilização dessa droga como primeira opção terapêutica deve ser restrita aos casos de hipertireoidismo grave, crise tireotóxica e no primeiro trimestre da gestação (25,26) (B,D). O uso do MMI está associado à aplasia cútis congênita, sendo contraindicado no primeiro trimestre gestacional (27) (C).
A dose inicial do MMI em paciente com tireotoxicose leve a moderada é de 10 a 30 mg, em dose única diária. Em casos de hipertireoidismo grave, a dose diária pode variar de 40 a 60 mg (28) (B). A maioria dos pacientes alcança o eutireoidismo após seis a oito semanas de tratamento. Nessa fase, a dose pode ser reduzida gradativamente, sendo o MMI mantido entre 5 e 10 mg por dia e o PTU entre 50 e 100 mg por dia.
Os efeitos colaterais leves ocorrem em 1% a 5% dos pacientes em uso de tionamidas. São considerados como efeitos leves: rash cutâneo, prurido, urticária ou artralgia. Caso não ocorra desaparecimento espontâneo dos sintomas, pode ser feita a substituição de uma DAT pela outra, embora haja reação cruzada em até 50% dos casos. Anti-histamínicos podem ser utilizados para controle das manifestações cutâneas (24) (D). Efeitos colaterais graves são descritos em aproximadamente 1% dos pacientes e incluem poliartrite grave, agranulocitose e, mais raramente, anemia aplástica, trombocitopenia, hepatite tóxica (PTU), vasculites, síndrome lúpus-like, hipoprotrombinemia (PTU) e hipoglicemia (MMI) (29,30) (B,C). A agranulocitose é o mais frequente dos efeitos colaterais graves, ocorrendo em 0,5% dos pacientes em uso de DAT (31) (C). Desse modo, ao iniciar o tratamento, o paciente deve ser orientado a procurar o médico e suspender a DAT se apresentar febre, odinofagia ou lesões na mucosa oral. Se confirmado o diagnóstico, o paciente deve ser hospitalizado para uso de antibioticoterapia de amplo espectro e fator estimulador de colônia de granulócito (1 a 5 µg/kg/dia, por via subcutânea) (32) (D). Quando ocorre um efeito colateral grave, o medicamento deve ser suspenso imediatamente e não deve ser reintroduzido.
O monitoramento da função tireoidiana deve ser feito com medida de T4L e T3 total após aproximadamente quatro a seis semanas do início do tratamento e depois em intervalos de quatro a oito semanas até que o eutireoidismo seja alcançado com a menor dose do medicamento. Nesse momento, a avaliação clínica e laboratorial pode ser realizada a cada dois a três meses. O TSH pode permanecer suprimido por meses após o início do tratamento e não deve ser utilizado para monitorização na fase inicial (33,34) (B).
Após 12 a 24 meses de tratamento, a DAT deve ser descontinuada. A taxa de remissão da DG varia de 30% a 50% (35,36) (B, A). Pacientes com doença de longa duração, bócio volumoso e níveis elevados de T3 (> 500 ng/dL) têm maior probabilidade de recidiva (33,34,37) (B). Como a maioria das recidivas ocorre nos primeiros meses após a suspensão da DAT, é recomendado que a função tireoidiana seja monitorada mensalmente nos primeiros seis meses, depois a cada três meses e, após o primeiro ano de remissão, o paciente deve ser monitorado anualmente por tempo indeterminado (38-40) (B).
Recomendação 7
O tratamento com DAT é eficaz no controle do hipertireoidismo de Graves e pode ser utilizado como tratamento inicial, na tentativa de remissão da disfunção autoimune. A taxa de remissão da doença após 12 a 24 meses de tratamento varia de 30% a 50% (B).
Recomendação 8
Devido aos potenciais efeitos hepatotóxicos do PTU, a utilização dessa droga como primeira opção terapêutica deve ser restrita aos casos de hipertireoidismo grave, crise tireotóxica e no primeiro trimestre da gestação (B). O uso do MMI tem sido associado à aplasia cútis congênita, sendo contraindicado no primeiro trimestre gestacional (C).
Recomendação 9
Efeitos colaterais de graus variados são descritos em 1% a 5% dos pacientes em uso de tionamidas. Quando ocorre um efeito colateral grave, a DAT deve ser suspensa imediatamente e não deve ser reintroduzida (D).
B. QUANDO UTILIZAR O 131I COMO TRATAMENTO INICIAL DO PACIENTE COM HIPERTIREOIDISMO DE GRAVES
O 131I foi introduzido na prática clínica em meados de 1940, sendo hoje amplamente utilizado na terapia do hipertireoidismo. Assim como a cirurgia, é classificado como um tratamento definitivo do hipertireoidismo. É considerado um tratamento simples, seguro e até mesmo a opção mais econômica quando comparada aos outros tratamentos disponíveis, incluindo as DAT (41-43) (B,D,D).
O 131I é indicado como primeira escolha terapêutica nos casos de pacientes com contraindicações para o uso de DAT e/ou cirurgia, ou recidiva do hipertireoidismo após tratamento com DAT. Também deve ser considerado como terapia inicial em casos em que o controle definitivo e rápido do hipertireoidismo é desejado, como em pacientes cardiopatas e idosos, e mulheres em idade fértil que planejam gravidez no futuro, evitando os riscos do hipertireoidismo para a gestação e puerpério. O tratamento é contraindicado na gestação, lactação, na presença de lesão suspeita ou confirmada de câncer de tireoide, e em mulheres com planos de gestação em período inferior a quatro a seis meses. Deve ser solicitado exame para exclusão de gravidez a todas as mulheres em idade fértil, antes da administração da dose (43) (D).
A administração do 131I é realizada por via oral e este pode ser dissolvido em água ou em cápsula, sendo prontamente absorvido e organificado pelas células foliculares da tireoide. A radiação induzida pelo 131I provoca uma resposta inflamatória seguida de destruição local e fibrose progressiva, contribuindo para a redução do volume da glândula, mais pronunciada no primeiro ano após a dose (43) (D). Não é necessário recomendar uma dieta especial, mas apenas deve ser evitada a ingestão de quantidades excessivas de iodo (por exemplo, compostos contendo multivitaminas). O uso prévio de betabloqueadores deve ser considerado em pacientes muito sintomáticos e/ou com risco aumentado para complicações no caso de piora do quadro de tireotoxicose (17,18) (B, D).
A indicação do tratamento prévio com DAT para evitar a exacerbação do quadro de tireotoxicose é controversa. Estudos prospectivos e randomizados que avaliaram os níveis dos hormônios tireoidianos após administração do 131I observaram diminuição significativa dos níveis de T4L e T3 em pacientes pré-tratados ou não com MMI (1,44) (A). No caso de ser realizado o pré-tratamento com DAT, estas devem ser interrompidas por quatro a sete dias antes do tratamento com 131I. O pré-tratamento com MMI não altera a eficácia do tratamento do hipertireoidismo (45) (A), mas o pré-tratamento com PTU pode resultar em aumento da falência terapêutica (46,47) (B). A reintrodução do MMI após sete dias da terapia com 131I parece evitar a exacerbação da tireotoxicose, não interferindo na eficácia do tratamento (48) (B).
A dose escolhida pode ser calculada para cada paciente considerando a captação de iodo e o volume da glândula ou fixa (49) (D). Ensaios prospectivos indicam que a dose fixa ou regime individualizado têm eficácia similar sobre a taxa de cura do hipertiroidismo (50,51) (A). A dose é geralmente calculada em microcuries (uCi) ou megabecquerels (MBq) por grama (g) de tecido da tireoide, com base no tamanho da tireoide e captação de iodo de 24 horas. Recomenda-se 160-200 uCi/g [5,9-7,4 MBq/g] para assegurar o tratamento bem-sucedido. Alternativamente, uma dose fixa de 10 a 15 mCi [MBq 370-555] pode ser utilizada (52-54) (B,D,D). A administração de doses baixas de iodo pode ser uma tentativa de curar o hipertireoidismo sem causar hipotireoidismo, mas essa abordagem resulta numa maior taxa de falha de tratamento (55) (B). Doses maiores são recomendadas em pacientes com comorbidades que podem ser agravadas pela persistência do hipertireoidismo, em condições de aumento de radiorresistência (bócios com maior volume, hipertireoidismo grave) (42,56) (D). Usando cálculo de dose, as atividades ficam tipicamente na faixa de 5 a 15 mCi 131I (correspondente a 185-555 MBq).
Aproximadamente 20% dos pacientes tratados com 131I apresentam falha terapêutica. As características associadas a uma maior taxa de falha são a presença de bócio volumoso (> 50 ml), captação de iodo elevada (> 90%) e níveis séricos de T3 elevados (> 500 ng / mL) no diagnóstico (45) (A).
A administração de glicocorticoide não tem se mostrado eficaz na melhoria do hipertireoidismo, mas é indicada na profilaxia de desenvolvimento ou progressão de oftalmopatia da doença de Graves e no tratamento da crise tireotóxica (vide item 10).
Recomendação 10
O tratamento com 131I é eficaz no controle do hipertireoidismo de Graves e pode ser utilizado como tratamento inicial, principalmente em pacientes com baixa probabilidade de remissão com o uso de DAT, necessidade de controle definitivo e rápido da tireotoxicose ou com contraindicações ao uso de DAT e/ou cirurgia (B).
Recomendação 11
O tratamento com 131I é contraindicado na gestação, na lactação e na presença de lesão suspeita ou confirmada de câncer de tireoide. Também deve ser evitado em mulheres que planejam engravidar em período inferior a quatro a seis meses (D).
Recomendação 12
O 131I é administrado por via oral, em dose fixa ou calculada. Pré-tratamento com betabloqueadores e DAT devem ser considerados em pacientes com risco para complicações (B).
C. QUAL A CONDUTA NA RECIDIVA APÓS DOSE TERAPÊUTICA 131I?
A taxa de resposta satisfatória ao tratamento com 131I, com desenvolvimento de hipotireoidismo ou eutireoidismo, é de cerca de 80% a 90% (42,43) (D). O desenvolvimento de hipotireoidismo ocorre não só pela ação da radiação sobre a glândula, mas também pela história natural da doença autoimune. Bócios volumosos, com hipoecogenicidade ao exame ultrassonográfico, presença de anticorpos contra a tireoperoxidase (anti-TPO) e doses maiores de 131I aumentam a chance de hipotireoidismo (42,45,52) (D,A,B).
A resposta ao 131I deve ser avaliada por meio dos sinais e sintomas de tireotoxicose, volume e função tireoidiana. O seguimento após um a dois meses da administração do iodo radioativo deve incluir uma avaliação do T4L e T3 total. Se o paciente permanece hipertireóideo, essa monitorização deve ser continuada em intervalos de quatro a seis semanas. Quando o hipertireoidismo persiste seis meses após o tratamento, deve ser considerada uma nova dose de 131I. A presença de TSH suprimido com T3 total e T4L normais não requer novo tratamento imediato, mas deve ser cuidadosamente monitorizada quanto à recidiva ou ao desenvolvimento de hipotireoidismo (43) (D).
Os fatores associados à falência do tratamento são sexo masculino, tabagismo, bócios volumosos (maiores que 50 g), captação de iodo elevada em 24h, administração de doses baixas de 131I e níveis de T3 muito elevados (> 500 ng/dL) (45) (A). A presença de tecido autônomo com diferenças funcionais na captação e organificação do iodo pode ser uma explicação adicional em alguns casos (57) (B). A persistência de níveis elevados de TRAb e do aumento do fluxo sanguíneo ao Doppler de tireoide são fatores que aumentam a chance de recidiva (42,52) (D,B). Em geral, recomenda-se uma segunda dose 131I para os pacientes que não responderam à primeira dose terapêutica (58) (D). Na pequena porcentagem de pacientes com hipertireoidismo refratário ao 131I, a utilização de lítio (900 mg/dia, durante 12 dias) (59) (B) ou intervenção cirúrgica pode ser considerada.
Em longo prazo, além do hipotireoidismo, existe um risco pequeno, mas significativo, do aumento de eventos cardiovasculares em pacientes tratados com 131I. Contudo, não se sabe ao certo se isso é um efeito do hipertireoidismo ou da própria terapia (56) (D). Não existem evidências de aumento de incidência de câncer de tireoide ou aumento de mortalidade por qualquer outra forma de neoplasia (42,60,61) (D,B,B). No entanto, é descrito um pequeno aumento na incidência de tumores em pacientes portadores de hipertireoidismo após cinco anos de tratamento com 131I, em relação à população geral, de 118,9 vs. 94,9 por 10.000 pessoas-ano (RR = 1,25 com IC 95% 1,08-1,46). Esse aumento da incidência está relacionado com a dose utilizada do 131I, especialmente nas faixas etárias entre 50 e 59 anos (RR = 1,44) ou mais de 70 anos (RR = 1,39), particularmente para tumores de rim (RR = 2,32), estômago (RR = 1,75) e mama (RR = 1,07) (60) (B). Em alguns homens, há uma queda modesta da testosterona e do hormônio luteinizante, subclínica e reversível. A prole de pacientes tratados não mostra maior prevalência de anomalias congênitas em relação à população em geral (42,62) (D,C). É recomendado adiar a concepção por quatro a seis meses em mulheres, de forma a garantir um eutireoidismo estável, e três a quatro meses em homens. Recomenda-se também evitar lactação por, no mínimo, seis semanas após administração do radioiodo (42) (D).
Recomendação 13
A resposta ao 131I deve ser acompanhada por meio do seguimento clínico e laboratorial. Se o paciente permanece tireotóxico, a monitorização laboratorial com T3 e T4L deve ser continuada em intervalos de quatro a seis semanas. Em pacientes com hipertireoidismo persistente após seis meses do tratamento com 131I, a administração de nova dose deve ser considerada. A presença de TSH suprimido com T3 total e T4L dentro dos limites da normalidade deve ser monitorizada quanto à possibilidade de recidiva (D).
D. QUANDO DEVE SER INDICADA A TIREOIDECTOMIA PARA O PACIENTE COM DG?
A cirurgia é o tratamento mais antigo da DG (63) (B). O objetivo principal é o controle rápido e definitivo dos efeitos do excesso dos hormônios tireoidianos. Isso é conseguido pela remoção de todo ou quase todo o tecido funcionante da glândula tireoide.
As indicações de cirurgia no tratamento da DG não são bem estabelecidas na literatura, sendo classificadas por alguns autores em indicações absolutas e relativas. As indicações consideradas absolutas são bócio volumoso com sintomas compressivos, nódulo suspeito ou maligno, gestante que não obtém controle com DAT, recusa ao tratamento com 131I, mulher planejando gravidez dentro de seis a 12 meses e intolerância a DAT. As indicações relativas são bócio volumoso, oftalmopatia grave, pouca aderência e ausência de resposta ao tratamento com DAT (63,64) (B).
As vantagens da tireoidectomia sobre as demais formas de tratamento incluem a rápida normalização da disfunção hormonal e maior efetividade nos casos com sintomas compressivos (42) (D). As desvantagens são o custo, a necessidade de internação hospitalar, o risco anestésico, e os riscos inerentes ao ato cirúrgico (hipoparatireoidismo, lesão do nervo recorrente, sangramento, infecção, cicatriz e hipotireoidismo) (42) (D). Liu e cols. (65) (B), analisando 58 pacientes tratados cirurgicamente por DG, descrevem como as principais indicações de cirurgia: persistência da doença após tratamento clínico (47%), preferência do paciente (21%), doença multinodular ou nódulo frio (20%), falha do tratamento com 131I (16%) e oftalmopatia (12%).
Após a definição pelo tratamento cirúrgico, alguns cuidados pré e pós-operatórios são essenciais. Deve ser considerada a administração prévia de DAT associada ou não à administração de betabloqueador, na tentativa do controle da função tireoidiana para diminuir o risco de crise tireotóxica, que pode ser desencadeada pelo estresse cirúrgico, anestesia ou manipulação da glândula (66) (B). A administração pré-operatória, por sete a dez dias antes da cirurgia, de iodeto de potássio ou solução saturada de iodeto de potássio pode ajudar a diminuir o fluxo sanguíneo intraglandular, a vascularização e reduzir a perda sanguínea durante a cirurgia. As doses sugeridas são: iodeto de potássio = SSKI (50 mg/gota) 1 gota três vezes ao dia ou solução de Lugol (6 mg/gota) - 5-10 gotas três vezes ao dia (67,68) (B).
No pós-operatório imediato, devem ser pesquisados os sintomas (parestesias, câimbras) e sinais (Chevostek e Trousseau) sugestivos de hipocalcemia, e os níveis séricos de cálcio devem ser monitorados (em especial nos pacientes que apresentam sintomas). A administração de cálcio oral suplementar e calcitriol reduz o risco de desenvolvimento de hipocalcemia sintomática e da necessidade de administração de cálcio endovenoso (69) (B). A disfunção do nervo recorrente deve ser avaliada por meio do exame de mobilidade das pregas vocais pela laringoscopia, quando houver manifestações clínicas desta (70) (D). Apesar de a tireoidectomia parcial (TP) ou subtotal (TST) ter sido o tratamento cirúrgico de escolha durante décadas, não é possível determinar a quantidade de tecido remanescente da glândula para manter o estado eutireóideo (63) (B). De outra forma, a chance de recorrência da doença deixando-se tecido residual varia de 5% a 20% (71,72) (B), enquanto o risco de recorrência é praticamente zero na TT (72) (B). Em relação às complicações, o risco de paralisia permanente do nervo recorrente é de 0,9% para TT e de 0,7% para TST. A hipocalcemia transitória é observada em 9,6% dos casos de TT e 7,4% de TST (sendo o risco de hipoparatireoidismo definitivo de 0,9% e 1,0%, respectivamente) (73) (B). Dessa forma, quando indicado, o tratamento cirúrgico para DG deve ser a TT, se possível com cirurgião experiente (volume cirúrgico acima de 100 tireoidectomias/ano) (74) (B). A reposição hormonal com levotiroxina sódica deve ser realizada no dia subsequente à cirurgia nos casos de TT.
Recomendação 14
O tratamento cirúrgico (tireoidectomia total) está indicado nos pacientes com DG que apresentam bócios volumosos associados a sintomas compressivos, nódulos suspeitos ou com confirmação de doença maligna, gestantes sem controle da doença com DAT, pacientes com intolerância a DAT ou recusa ao tratamento com 131I (B).
4) COMO DEVE SER AVALIADO E TRATADO O PACIENTE COM DG E NÓDULOS TIREOIDIANOS?
O câncer de tireoide ocorre em menos de 2% dos pacientes com DG, sendo a maioria microcarcinoma papilar com excelente prognóstico (75,76) (D,B). Os pacientes com DG que apresentam nódulos tireoidianos pela palpação e/ou US da tireoide devem ser avaliados antes da dose terapêutica de 131I. Os nódulos maiores do que 1 cm devem ser submetidos à punção aspirativa com agulha fina (PAAF) guiada por US para descartar malignidade. Ocasionalmente, nódulos menores do que 1 cm requerem avaliação adicional caso apresentem achados ecográficos suspeitos, associação com linfoadenomegalia cervical, história prévia de irradiação de cabeça e/ou pescoço ou história familiar de câncer de tireoide (13,77) (D). Se a citologia for indeterminada ou maligna, a TT está indicada após a normalização dos níveis hormonais com DAT (13,77) (D).
Recomendação 15
Pacientes com DG e nódulos tireoidianos maiores do que 1 cm devem ser avaliados seguindo os mesmos critérios propostos para nódulos em geral, antes da administração de dose terapêutica de 131I (B).
5) COMO TRATAR O PACIENTE COM HIPERTIREOIDISMO DEVIDO A BMNT E ADENOMA TÓXICO (AT)?
O BMNT e o AT constituem as principais causas de hipertireoidismo no paciente idoso (70) (D) e são frequentes em regiões com ingestão insuficiente de iodo. O AT comumente resulta de mutações ativadoras no receptor do TSH. O BMNT resulta da história natural do BMNA, quando áreas autônomas se tornam evidentes, muitas vezes também devido a mutações no receptor do TSH (78) (D). O controle do hipertireoidismo por meio do uso de DAT é temporário e o tratamento de escolha deve ser a ablação com 131I ou tireoidectomia. A alcoolização dos nódulos por injeção percutânea guiada por US ou mesmo a ablação térmica com laser podem ser utilizadas como tratamentos alternativos em casos selecionados (70) (D).
A. O USO DE DAT NO PACIENTE COM BMNT OU AT
O tratamento do hipertireoidismo com DAT nos pacientes com doença nodular não autoimune não induz à remissão da doença. No entanto, pacientes com BMNT ou AT que apresentam hipertireoidismo importante devem ser tratados com DAT até atingir o eutireoidismo no preparo para a cirurgia. A droga de escolha é o MMI na dose de 10 a 30 mg/dia. Pacientes idosos, com contraindicação para cirurgia ou 131I, podem ser mantidos de forma contínua com doses baixas MMI (79) (D).
Recomendação 16
Pacientes com BMNT ou AT que apresentam hipertireoidismo importante devem ser tratados com DAT no preparo para a cirurgia ou tratamento com 131I, preferencialmente MMI (10 a 30 mg/dia) até atingir o eutireoidismo. Em casos de hipertireoidismo leve/moderado ou em bócios de tamanho moderado, pode-se utilizar apenas betabloqueadores no preparo (D).
Recomendação 17
Em pacientes idosos, com contraindicação para cirurgia ou 131I, pode-se manter o tratamento contínuo com doses baixas de MMI (D).
B. INDICAÇÃO DO 131I NO PACIENTE COM BMNT OU AT
O uso do 131I pode ser indicado no tratamento do BMNT ou AT em pacientes com contraindicação ou que recusam a cirurgia (42) (D). O uso do 131I está especialmente indicado em pacientes idosos que apresentam comorbidades e com captação de 131I nas 24 horas suficientemente elevadas para permitir um tratamento adequado com radioiodo. Em pacientes idosos, com doença cardiovascular e que podem potencialmente desenvolver taquiarritmias após o 131I, está indicado o uso de betabloqueadores (21,80,81) (D,D,C).
O tratamento com 131I está contraindicado em pacientes grávidas, ou que planejam engravidar nos próximos seis meses, e durante a amamentação. Como a incidência de câncer de tireoide é a mesma em nódulos únicos ou bócio multinodular (82) (B), o paciente com BMNT deve ser submetido à PAAF para análise citológica do nódulo suspeito e/ou nódulo dominante, antes de receber a dose terapêutica de 131I (13,26,83) (D,D,B).
Frequentemente, o BMNT apresenta captação baixa de 131I necessitando de doses terapêuticas elevadas e consequente necessidade de internação hospitalar. Uma alternativa é o uso do TSH recombinante que, por meio do aumento da captação, permite uma maior redução do tamanho do BMNT (83) (B). A terapia com 131I em pacientes com BMNT usualmente leva à redução do tamanho do bócio em cerca de 40% a 50% após seis a 36 meses, permitindo que mesmo pacientes com bócios volumosos apresentem melhora dos sintomas compressivos (84) (D). Aproximadamente 40% a 50% dos pacientes apresentam hipotireoidismo pós-tratamento (82) (B). A dose de 131I, calculada para o tamanho do bócio para liberar 150-200 µCi por grama de tecido corrigido para a captação de 131I em 24h, é usualmente maior do que a necessária para tratar a DG, ficando na faixa de 30 a 50 mCi.
No AT, apesar de a captação se concentrar no nódulo dominante, também pode ocorrer hipotireoidismo após o 131I, sendo que a incidência aumenta com o tempo pós-tratamento. A dose para o tratamento do AT é semelhante à descrita para o BMNT (150-200 µCi por grama corrigido para a captação de 131I em 24h), calculada de acordo com o tamanho do nódulo. Dessa maneira, a dose total em geral é menor (10-20 mCi) (85) (B). Raramente um paciente com AT submetido à dose terapêutica adequada de 131I necessita de uma segunda dose (42) (D).
Recomendação 18
Pacientes com BMNT ou AT que não apresentam condições clínicas para o tratamento cirúrgico ou que não querem ser submetidos à cirurgia são candidatos para o tratamento com 131I (D). Pacientes sintomáticos devem ser tratados previamente com DAT e betabloqueadores ou, em casos leves, apenas com betabloqueadores (C).
Recomendação 19
As doses terapêuticas de 131I recomendadas para pacientes com BMNT e AT estão na faixa de 150-200 µCi por grama de tecido corrigido para a captação de 131I em 24h (B).
C. INDICAÇÃO DE TIREOIDECTOMIA PARA O PACIENTE COM BMNT OU AT
A primeira opção de tratamento para os pacientes com BMNT ou AT deve ser cirúrgica (86) (B). Os pacientes podem ser tratados previamente com DAT e betabloqueadores até a obtenção do eutireoidismo. A droga de escolha é o MMI na dose de 10 a 30 mg/dia. A recorrência após a realização da TT é menor de 1% e as indicações para a TT estão associadas a sintomas de disfunção tireoidiana, sintomas compressivos (dispneia e disfagia), suspeita de malignidade e bócio mergulhante ou intratorácico (70,87,88) (D,D,B). Nos AT, que se caracteriza por lesão única, está indicada a TP por meio da lobectomia total (retirada do lado com nódulo e extensão da ressecção para o istmo até o lobo contralateral) (70,87,88) (D,D,B).
O acompanhamento após a realização de TT deve ser feito como descrito no item 3, com avaliação da possibilidade de complicações pós-operatórias (hipocalcemia, disfunção de cordas vocais) e reposição de levotiroxina 70 (D).
A necessidade de uma nova cirurgia é praticamente nula no paciente submetido à TT (89,90) (B). No entanto, quando ocorre a recidiva do hipertireoidismo, nos casos de TP ou TST, está indicada a complementação para TT após a avaliação do lobo remanescente da tireoide pela US (70) (D). Caso a opção seja para o tratamento com 131I, o tecido remanescente deve ser avaliado para descartar nódulos e, em caso positivo, estes devem ser avaliados de acordo com os critérios recomendados (13,70,87,88) (D, D,D,B).
Recomendação 20
O tratamento cirúrgico oferece boas chances de controle do hipertireoidismo nos pacientes com BMNT e AT. A TT é o tratamento definitivo de escolha no BMNT, enquanto nos casos de AT está indicada a lobectomia (B).
Recomendação 21
O preparo, as complicações e o acompanhamento no pós-operatório são semelhantes aos descritos no tratamento cirúrgico para DG (D).
6) O USO DE OUTRAS MODALIDADES TERAPÊUTICAS NO TRATAMENTO DO BMNT E AT
O uso do etanol constitui uma alternativa terapêutica no tratamento de nódulos císticos (91-93) (B) e nódulos autônomos (94-98) (B,B,B,B,C). A injeção de etanol é bem tolerada com descrição de dor leve ao procedimento na maioria dos pacientes (96) (B). Esse procedimento é eficaz, seguro, de baixo custo e apresenta resultados adequados em longo prazo. No entanto, essa modalidade vem sendo abandonada quando os nódulos tireoidianos são sólidos. A ablação de nódulos sólidos com o método de ablação percutânea a laser (97,99) (C,B) ou radiofrequência tem se mostrado eficaz no tratamento de nódulos tireoidianos benignos, independente da extensão do componente sólido (100) (D).
Recomendação 22
A escleroterapia de nódulos císticos ou autônomos é uma opção terapêutica segura em pacientes nos quais os tratamentos tradicionais (cirurgia ou 131I) estão contraindicados ou foram recusados pelos pacientes (B).
7) COMO DIAGNOSTICAR E TRATAR A CRISE TIREOTÓXICA?
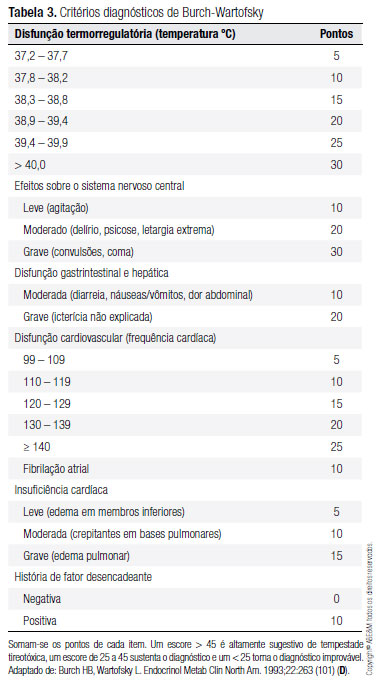
O diagnóstico de crise ou tempestade tireotóxica é essencialmente clínico. As manifestações são as mesmas apresentadas pelos pacientes com tireotoxicose, porém de forma exacerbada. Essas incluem taquicardia (habitualmente > 140 batimentos por minuto), insuficiência cardíaca, hipertermia, agitação, ansiedade, delírio, psicose, coma, náuseas, vômitos, diarreia, dor abdominal, insuficiência hepática e icterícia. Em 1993, foi proposto um escore por Burch e Wartofsky para avaliação objetiva desses pacientes, com pontos de corte para o diagnóstico de crise tireotóxica (Tabela 3) (101) (D). Recentemente, novos critérios foram propostos. Esses envolvem as mesmas alterações apresentadas no critério anterior: combinação de tireotoxicose e manifestações em outros sistemas do organismo (alterações em sistema nervoso central, taquicardia, insuficiência cardíaca, alterações em sistema gastrintestinal, febre) (102) (B).
A avaliação laboratorial da função tireoidiana apresenta o mesmo padrão encontrado no hipertireoidismo (elevação dos níveis séricos dos hormônios da tireoide e supressão do TSH). Uma vez que o diagnóstico depende de julgamento clínico, recomenda-se que pacientes com suspeita de crise tireotóxica sejam tratados como tendo a condição. Os fatores desencadeantes descritos incluem cessação abrupta das DAT, cirurgias tireoidianas e não tireoidianas e enfermidades agudas graves (infecções, cetoacidose diabética, eventos vasculares) (66) (B).
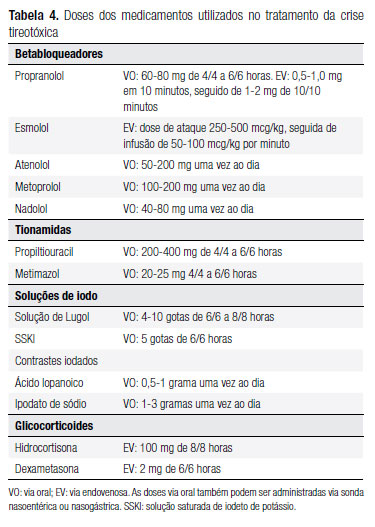
O tratamento deve ser feito com múltiplos medicamentos, objetivando o bloqueio do sistema adrenérgico, a síntese de hormônios tireoidianos e a liberação dos hormônios já formados. As classes farmacológicas utilizadas são os betabloqueadores, as tionamidas e os compostos com iodo inorgânico (Tabela 4). Adicionalmente, é importante o manejo de suporte, preferencialmente em ambiente de unidade de terapia intensiva (66) (B).
O uso de betabloqueadores tem como objetivo controlar os sinais e sintomas de hiperativação do sistema adrenérgico. O medicamento mais utilizado é o propranolol, porém também podem ser utilizados betabloqueadores cardiosseletivos (atenolol, metoprolol) ou com menor meia-vida (esmolol) (20) (C). Em pacientes com contraindicações ao uso de betabloqueadores, o diltiazem pode ser uma alternativa (22) (B).
As tionamidas têm como objetivo bloquear a síntese de hormônios tireoidianos. Essa ação se inicia cerca de uma a duas horas após sua administração. O PTU é considerado a droga de escolha na crise tireotóxica, devido a seu efeito adicional no bloqueio da conversão periférica do T4 para o T3, especialmente em doses elevadas (Tabela 2) (103) (B). Os dois medicamentos podem ser administrados por vias alternativas (retal e endovenosa) quando os pacientes não tiverem a via oral disponível (104-109) (C,B,C,C,B,C) (Tabela 5). Naqueles pacientes que desenvolverem efeitos colaterais graves ou alergia às tionamidas, recomenda-se a realização de TT. O preparo deve ser realizado com betabloqueadores, glicocorticoides e soluções de iodo por cerca de cinco a sete dias, sendo a tireoidectomia realizada entre o 8º e 10º dia (110) (C). O uso de soluções de iodo tem como objetivo bloquear a liberação dos hormônios tireoidianos já formados. O uso desses compostos deve ser precedido pela administração de tionamidas. Os dois compostos com iodeto disponíveis são a solução de Lugol e a solução saturada de iodeto de potássio (SSKI). Esses medicamentos também podem ser administrados por via retal. Os meios de contraste com iodo (ácido iopanoico, ipodato de sódio) também podem ser utilizados e apresentam a vantagem de bloquear simultaneamente a liberação dos hormônios tireoidianos e a conversão periférica de T4 para T3) (111) (B). Da mesma maneira que as soluções de iodo, estes só devem ser utilizados após o bloqueio da síntese dos hormônios tireoidianos com uma tionamida.
Os glicocorticoides, em altas doses, têm o papel de reduzir a conversão periférica de T4 para T3. Além disso, existem evidências de que os pacientes com hipertireoidismo grave apresentem reserva adrenal diminuída, podendo ocorrer necessidade de reposição desses hormônios (112) (B). O uso de colestiramina, no intuito de diminuir a circulação entero-hepática, também está descrito (113) (C). O uso de plasmaférese, em pacientes que não responderam às terapias descritas, tem sido descrito com melhora do quadro clínico e laboratorial (114) (C).
O fator desencadeante, quando identificado, deve ser agressivamente tratado. Além disso, a hipertermia deve ser corrigida, evitando-se o uso de salicilatos, pois esses medicamentos podem aumentar a fração livre dos hormônios tireoidianos (66) (B). Recomenda-se hidratação endovenosa e reposição com multivitamínicos, especialmente tiamina.
Recomendação 23
O diagnóstico de tempestade tireotóxica deve ser feito por meio de critérios clínicos (D). Para o tratamento, são utilizados betabloqueadores, DAT, compostos iodados e glicocorticoides (B). Naqueles pacientes que não respondem, deve ser considerada a tireoidectomia total (C). Os pacientes devem receber tratamento de suporte em unidade de terapia intensiva e fatores desencadeantes devem ser identificados e tratados (B).
8) COMO TRATAR CRIANÇAS OU ADOLESCENTES COM DG?
Crianças com DG podem ser tratadas com DAT, 131I ou tireoidectomia. Apesar de o tratamento com DAT constituir-se na abordagem inicial, a maioria dos pacientes pediátricos necessitará de terapia definitiva com 131I ou cirurgia (115) (B).
A. O USO DE DAT COMO TRATAMENTO INICIAL DA CRIANÇA COM DG
Como a remissão com o uso de DAT por um a dois anos ocorre em algumas crianças, esse tipo de tratamento ainda é considerado a primeira linha de terapia para a maioria dos casos (26) (D).
O eutireoidismo é alcançado na maioria dos casos durante o tratamento com DAT (116) (B). Apesar disso, as taxas de remissão são modestas e as de recidivas são elevadas. A taxa de remissão, com tratamento inicial apenas com DAT, é de cerca de 30%, nos casos que recebem a medicação por dois anos (113,117) (B). São fatores associados à remissão: concentrações baixas de hormônios tireoidianos, resposta mais rápida ao tratamento e idade (115) (B). As taxas de recidivas do hipertireoidismo são de cerca de 60% após 1 ano e 70% após dois anos do tratamento e os fatores de risco associados a recidivas são pacientes não caucasianos e níveis elevados das concentrações de TRAb e T4L ao diagnóstico. Por outro lado, o risco de recidiva diminui com o aumento da idade e com o aumento da duração do primeiro curso de DAT (118) (B).
A duração do tratamento com DAT é um dos pontos-chave da abordagem da DG, e maiores tempos de uso da medicação têm sido associados a remissões prolongadas em crianças (119) (B). Uma metanálise recente sobre o tratamento do hipertireoidismo da DG demonstrou que a duração ótima para o tratamento com DAT seria de 12 a 18 meses (120) (B). Porém, a idade e o desenvolvimento puberal parecem influenciar no tempo necessário para remissão, sendo este maior em crianças pré-púberes do que em púberes, com correlação positiva entre as concentrações de TRAb ao diagnóstico e a duração do tratamento com DAT, nos casos com remissão (117) (B). Assim, o MMI poderia ser administrado por um a dois anos e então interrompido, ou sua dose reduzida, para avaliar se o paciente está em remissão. Se após a interrupção do MMI a remissão não for atingida, 131I ou cirurgia devem ser considerados, dependendo da idade da criança. Alternativamente, o MMI pode ser mantido por períodos mais longos. Essa abordagem pode ser usada como uma ponte para, mais tarde, em uma idade apropriada, a utilização de terapia com 131I ou cirurgia, caso a remissão não ocorra. Em situações selecionadas, em que o 131I ou a cirurgia podem não ser adequados ou possíveis, o uso de baixas doses de MMI pode ser mantido. Recentemente, foi relatado impacto positivo da utilização de DAT por um tempo mais longo sobre a taxa de remissão da DG (121) (A).
As doses diárias habituais de MMI variam de 0,2 a 0,5 mg/kg de peso, podendo variar de 0,1 até 1,0 mg/kg, com dose máxima diária de 30 mg (116,122-127) (B, D,B,B,B,D,B). Nos casos em que o MMI, a tireoidectomia e o 131I não possam ser utilizados, o PTU pode ser considerado uma opção, por um curto período de tempo, com doses de 4,7 a 8,6 mg/kg de peso (116) (B), com acompanhamento clínico e laboratorial rigoroso.
O principal problema com o uso de DAT são as reações adversas. São relatados efeitos colaterais em cerca de 6% a 35% dos casos, os quais são mais frequentes e/ou graves com o uso de PTU, o que faz do MMI a DAT de escolha em pacientes pediátricos (115,117,118,128,129) (B). Entre os efeitos colaterais atribuídos particularmente ao PTU em crianças e adolescentes, destacam-se os relacionados à hepatotoxicidade e à vasculite (130) (B). O uso do PTU também está associado à maior prevalência de anticorpos citoplasmáticos antineutrofílicos, mesmo sem evidências de vasculite ou nefrite (131) (B). Apesar de o MMI estar relacionado a um melhor perfil de segurança do que o PTU, efeitos colaterais podem ocorrer em até 20% das crianças tratadas (128) (B). Dessa forma, antes de se iniciar o tratamento, sugere-se que os pacientes pediátricos sejam submetidos a exames de hemograma completo e dosagens séricas de bilirrubinas, transaminases e fosfatase alcalina (132,133) (C,B). Os pacientes e seus cuidadores devem ser informados dos efeitos colaterais das DAT e da necessidade de informar imediatamente seu médico se ocorrer: erupção pruriginosa, icterícia, acolia fecal ou colúria, náuseas, artralgias, dor ou aumento abdominal, mal-estar, fadiga, febre ou faringite (134) (D). Apesar de a agranulocitose ser raramente descrita na América Latina (0,38 casos/milhão de habitantes/ano), o MMI é a principal droga relacionada à sua ocorrência, principalmente em doses mais elevadas (135,136) (B). Dados sobre a prevalência de agranulocitose em crianças não estão disponíveis, mas estima-se ser muito baixa (26) (D).
Reações cutâneas leves e persistentes ao MMI em crianças podem ser tratadas com anti-histamínicos. Com o PTU, elevações das transaminases de duas a três vezes o limite superior da normalidade, sem melhora dentro de uma semana, indicam a retirada da DAT. Após a retirada da droga, as concentrações de bilirrubinas, fosfatase alcalina e transaminases devem ser monitoradas semanalmente até que haja evidência de melhora. Se esta não ocorrer, o paciente deve ser encaminhado a um gastroenterologista ou hepatologista (26) (D).
Em crianças com hipertireoidismo que apresentam sintomas significativos, incluindo taquicardia, fraqueza muscular, tremor, ou alterações neuropsicológicas, o tratamento com betabloqueadores pode levar à melhora das queixas (134) (D). Nos casos com doença reativa das vias aéreas, betabloqueadores cardiosseletivos podem ser usados, com observação quanto à exacerbação desta (137) (A).
Após o início da terapia com DAT, testes de função tireoidiana devem ser solicitados mensalmente nos primeiros meses e depois a cada dois a quatro meses. Dependendo da gravidade do hipertireoidismo, vários meses são necessários para que as concentrações hormonais atinjam a faixa de normalidade (138) (B).
Recomendação 24
O MMI constitui-se a droga de escolha no tratamento do hipertireoidismo da DG em crianças e adolescentes (B). Em função da maior incidência de efeitos colaterais graves associados ao uso do PTU, essa droga deve ser evitada (B).
Recomendação 25
O uso de betabloqueadores pode ser indicado em crianças e adolescentes com hipertireoidismo para o controle dos sintomas (D).
Recomendação 26
Reações cutâneas leves ou persistentes as DAT em crianças podem ser tratadas com anti-histamínicos (D). No caso de efeito colateral grave a uma DAT, não é recomendada a troca por outra DAT e a opção pelo iodo radioativo ou tireoidectomia deve ser considerada (D).
Recomendação 27
O acompanhamento de crianças com DG, com avaliação clínica e dosagens hormonais, deve ser mensal inicialmente e depois, de acordo com o controle, a cada dois a quatro meses (D).
Recomendação 28
Em geral, as DAT deveriam ser mantidas pelo menos 12 a 18 meses, podendo ser utilizadas, em crianças, por até dois anos, buscando-se a remissão (A).
B. O USO DO 131I NA CRIANÇA E ADOLESCENTE COM DG
Vários estudos têm demonstrado que o tratamento com 131I, quando comparado às DAT, é superior na obtenção do eutireoidismo (RR 1,70; intervalo de confiança de 95% 1,29-2,24) em pacientes pediátricos com DG (139-141) (B).
As doses de 131I utilizadas podem ser fixas ou calculadas, levando-se em consideração o peso da tireoide e a captação de 131I em 24 horas (142) (B). As doses fixas variam de 10 a 15 mCi e são mais efetivas em bócios menores (143-145) (B). Quando atividades maiores do que 150 µCi de 131I/g de tecido tireoidiano são administradas, o hipotireoidismo ocorre em aproximadamente 95% dos casos (142) (B). Não existem estudos, em crianças, comparando os resultados das duas formas de tratamento. Em adultos, resultados semelhantes têm sido relatados com as duas abordagens (146) (D) (vide item 3).
Recomenda-se que crianças com DG e concentrações séricas de T4 total > 20 ug/dL (260 nmol/L) ou de T4L > 5 ng/dL (60 pmol/L) sejam tratadas com MMI e betabloqueadores até a normalização desses hormônios, antes do tratamento com 131I (26) (D). Nesses casos, o MMI deve ser suspenso entre três e cinco dias antes do 131I, ficando os pacientes em uso de betabloqueadores até que as concentrações de T4 total e/ou livre sejam normalizadas (26) (D). Como as concentrações dos hormônios tireoidianos começam a cair na primeira semana após o 131I, o uso de DAT não seria necessário após essa terapia (26) (D). A literatura refere raros casos de pacientes pediátricos com hipertireoidismo grave que desenvolveram crise tireotóxica depois de suspender o MMI e receber 131I (147) (C).
Não há evidências de que o tratamento do hipertireoidismo com 131I esteja associado com câncer de tireoide ou de outros sítios particularmente quando são utilizadas doses > 160 µCi/g de tecido tireoidiano (148,149) (B,D). No entanto, com base em projeções de risco, considerando-se a exposição à radiação de baixo nível em relação à idade, é teoricamente possível haver um baixo risco de neoplasias malignas em crianças muito jovens tratadas com 131I (150) (B). Desse modo, recomenda-se que a terapia com 131I seja evitada em crianças muito jovens (< 5 anos) (149) (D). O uso do 131I é aceitável, em pacientes entre 5 e 10 anos de idade, se a atividade calculada administrada for menor que 10 mCi e, em crianças maiores de 10 anos de idade, se a atividade for maior que 160 µCi/g de tecido tireoidiano (149) (D).
Foi relatada maior incidência de hipotireoidismo em crianças tratadas com 131I em relação às tratadas com DAT (RR = 6,46, IC 95% = 1,16-35,81). Nenhuma diferença significativa foi observada entre os dois tratamentos em relação à oftalmopatia de Graves (agravamento ou aparecimento) (RR = 1,30, 95% IC = 0,56-3,00) (141) (B).
Recomendação 29
A terapia com 131I deve ser evitada em crianças menores que 5 anos (D). Em crianças maiores com DG, o tratamento com 131I é eficaz e seguro, podendo ser feito com doses fixas ou calculadas (B). Naqueles pacientes com níveis muito elevados dos hormônios da tireoide, deve ser considerado o pré-tratamento com DAT (D).
C. A INDICAÇÃO DE TIREOIDECTOMIA PARA CRIANÇA OU ADOLESCENTE COM DG
A cirurgia é uma opção para tratamento definitivo da DG em crianças ou adolescentes. Atualmente, a indicação da TT é a conduta cirúrgica mais aceita, em função do risco de recidiva da TP (151,152) (D,B). Essa forma de tratamento é segura, quando realizada em mãos experientes, e demanda pouco tempo de hospitalização (65,151-153) (B,D,B,B).
No preparo pré-operatório, o paciente deve estar eutireóideo. A solução de Lugol (5 a 10 gotas, 3 vezes ao dia) pode auxiliar na redução da perda sanguínea durante a cirurgia, mas não é realizada de rotina. Além de bloquear a liberação dos hormônios tireoidianos, é descrito que essa substância reduz a vascularização da glândula, proporcionando um período transoperatório com menores intercorrências. A maior perda sanguínea ocorre nos casos em que a cirurgia parcial é realizada por conta da secção da glândula (65) (B).
Os potenciais problemas como dor e desconforto pós-operatório, tempo de cicatrização, riscos envolvendo o ato anestésico e riscos específicos relacionados ao ato cirúrgico (lesão dos nervos recorrentes e hipoparatireoidismo temporário ou mesmo definitivo) são reduzidos nas mãos de cirurgiões experientes (151) (D). Na eventualidade de remoção acidental da paratireoide, esta, após ser identificada, deve ser transplantada em músculo da região cervical (151-153) (D,B,B).
A reposição hormonal com levotiroxina deve ser iniciada no pós-operatório imediato e a dose deve ser ajustada ao longo dos anos, conforme o crescimento e o desenvolvimento da criança (152) (B).
Recomendação 30
O tratamento cirúrgico por meio da TT proporciona um tratamento definitivo e de baixo risco para o hipertireoidismo, ocasionado pela DG em crianças, adolescentes e adultos jovens (B).
9) COMO TRATAR O HIPERTIREOIDISMO NA GESTANTE?
Os dois principais diagnósticos diferenciais em pacientes gestantes com tireotoxicose são DG e hipertireoidismo gestacional. Em ambas as situações, as manifestações clínicas da doença são semelhantes, entretanto a ausência de história prévia de doença tireoidiana e de sinais clínicos de DG (bócio, oftalmopatia) favorece o diagnóstico de hipertireoidismo gestacional. Nos casos duvidosos, a determinação do TRAb está indicada, uma vez que 95% dos casos de DG apresentam TRAb positivo (10) (B). O hipertireoidismo na gestação pode levar a complicações como doença hipertensiva, aborto espontâneo, parto prematuro, baixo peso fetal, natimortos, crise tireotóxica e insuficiência cardíaca materna (154-156) (C,B,B).
A. COMO DEVE SER TRATADA A GESTANTE COM DG?
Mulheres com o diagnóstico de DG deverão ser aconselhadas a não engravidarem enquanto não atingirem o eutireoidismo, sendo fortemente recomendado o uso de anticoncepcionais (157) (D). Deve ser discutida com as pacientes que planejam a gravidez a possibilidade dos tratamentos definitivos (131I ou cirurgia) ou o uso de DAT. Casos leves, diagnosticados no primeiro trimestre, com ganho adequado de peso e em boas condições obstétricas, podem ser seguidos cuidadosamente sem tratamento. A meta é controlar o hipertireoidismo materno normalizando as concentrações de T4L tão rapidamente quanto possível, sem causar o hipotireoidismo fetal (158) (D).
O tratamento poderá ser realizado com MMI ou PTU. Recomenda-se o tratamento preferencial com PTU no primeiro trimestre da gestação, em face da sua menor passagem pela barreira placentária, bem como em decorrência dos relatos de aplasia cútis, atresia cloacal, fístula traqueoesofágica e anomalias faciais com o uso de MMI (157,159,160) (D,C,D).
A dose inicial das DAT vai depender da gravidade dos sintomas e do grau da hipertiroxinemia. Em geral, doses iniciais variam de 5-15 mg/dia de MMI em dose única e 50-300 mg/dia de PTU divididas em três tomadas. Os níveis séricos de T4L e TSH deverão ser avaliados em duas a quatro semanas após o início do tratamento e repetidos a cada quatro a seis semanas depois de alcançado o eutireoidismo. Neste momento, a dose da DAT deverá ser diminuída progressivamente, podendo até ser suspensa em um terço das pacientes (161) (D). Os ajustes da dose deverão ser efetuados de acordo com as concentrações do T4L, devendo-se utilizar a mínima dose possível, com o objetivo de deixar as concentrações de T4L na faixa específica para o trimestre ou em nível ligeiramente superior. Quando os valores de referência dos hormônios para a gestação não estiverem disponíveis, deverá ser utilizada a faixa de referência para mulheres não grávidas (157) (D). A utilização dos níveis de T3 como referência para o tratamento não é recomendada, pois a normalização das concentrações de T3 maternas poderá resultar em hipotireoidismo fetal (161) (D). As mulheres em uso de MMI, previamente à gestação, deverão ser orientadas para substituir a medicação para PTU até o final do 1º trimestre, quando deverão voltar ao uso de MMI (157,162,163) (D,D,B). Outras indicações para o uso do PTU são gestantes com alergia ao MMI e na crise tireotóxica.
Betabloqueadores são úteis no controle dos sintomas adrenérgicos. Propranolol (20-40 mg, duas a três vezes/dia) ou atenolol (25-50 mg/dia) podem ser utilizados quando necessário. Entretanto, o uso prolongado poderá acarretar diminuição do crescimento uterino, bradicardia fetal e hipoglicemia (164) (B).
A terapia com 131I é contraindicada na gestação, uma vez que o iodo radioativo cruza a barreira placentária e poderá causar bócio, hipotireoidismo e até asfixia fetal (165,166) (D). Na crise tireotóxica, compostos iodados podem ser utilizados por curto período de tempo (menos que duas semanas, 5 a 7 gotas de iodeto de potássio, duas vezes por dia) (vide item 7).
A tireoidectomia total é uma maneira efetiva para controlar o hipertireoidismo, porém, atualmente, é pouco utilizada, sendo indicada apenas para situações especiais como reação adversa importante a ambas as DAT ou pacientes não aderentes ao tratamento (167) (C). Recomenda-se que seja realizada no segundo trimestre da gestação, idealmente antes da 22ª-24ª semanas de gestação. O preparo da gestante com betabloqueadores e iodeto de potássio por curto período (50-100 mg/dia) é recomendado (168) (B). A determinação dos valores de TRAb no momento da cirurgia é adequada para avaliar o potencial risco do hipertireoidismo fetal (9) (B).
Recomendação 31
Mulheres com hipertireoidismo deverão ser orientadas a não engravidarem antes de alcançar o eutireoidismo (D).
Recomendação 32
No primeiro trimestre da gestação, a DAT recomendada para o tratamento de hipertireoidismo é o PTU (C), sendo necessária a substituição do MMI em mulheres que já usavam previamente à gestação (B). Após o primeiro trimestre, o tratamento pode ser feito com MMI (D).
Recomendação 33
Mulheres tratadas com DAT na gestação deverão ser monitoradas com T4L e TSH aproximadamente a cada duas a seis semanas e as concentrações de T4L, mantidas na faixa superior da normalidade ou discretamente acima do nível para a gestante. A utilização dos níveis de T3 como referência para o tratamento não é recomendada, pois a normalização das concentrações de T3 maternas poderá resultar em hipotireoidismo fetal (D).
Recomendação 34
A terapia com 131I é contraindicada na gestação (D).
Recomendação 35
A tireoidectomia na gestação é raramente indicada. Se necessária, o período ideal de sua realização será no segundo trimestre da gestação entre a 22ª e 24ª semana (C).
Recomendação 36
Vigilância fetal com exame ultrassonográfico deverá ser realizada em mulheres com hipertireoidismo descompensado e/ou concentrações elevadas de TRAb (maiores que três vezes o limite superior da normalidade). Nesse monitoramento, deverão ser incluídos a frequência cardíaca fetal, o crescimento fetal, o volume do fluido amniótico e volume do bócio fetal (D).
B. COMO DEVE SER O TRATAMENTO DO HIPERTIREOIDISMO GESTACIONAL (RELACIONADO À GONADOTROFINA CORIÔNICA - HCG)?
No primeiro trimestre, o hipertireoidismo poderá estar relacionado à hCG ou a variantes moleculares desse hormônio. O quadro de hipertireoidismo poderá manifestar-se de modo variável:
Tireotoxicose transitória gestacional: ocorre no primeiro trimestre, entre a 8ª e 14ª semana de gestação, com prevalência de 2,4% das gestações (169) (B). A glândula tireoide não está aumentada e a paciente raramente requer tratamento, pois é de natureza transitória.
Hiperêmese gravídica: representa uma séria complicação, pois está associada à perda de peso e à desidratação grave (170) (B). Hipertireoidismo bioquímico é encontrado na maioria das mulheres. O tratamento é realizado com medidas de suporte para controle dos vômitos, da desidratação e das anormalidades eletrolíticas. O uso de DAT não é indicado (171) (B). Em situações quando o diagnóstico diferencial com a DG é duvidoso, a terapia com DAT poderá ser instituída por curto período de tempo. Caso o hipertireoidismo retorne após a descontinuação da DAT, o diagnóstico mais provável será a DG e poderá requerer continuação da terapia.
Hipertireoidismo gestacional recorrente: casos de hipertireoidismo recorrente na gestação têm sido descritos (172) (B). Um dos casos foi associado a uma mutação no domínio extracelular do gene que expressa o receptor de TSH, tornando-o hipersensível a níveis normais de hCG (173) (B).
Recomendação 37
Nas pacientes diagnosticadas com tireotoxicose transitória gestacional, hiperêmese gravídica ou hipertireoidismo gestacional recorrente, não há indicação para a utilização da DAT (B).
Outras causas de hipertireoidismo poderão ocorrer na gestação, incluindo o AT e o BMNT. Nessas condições, há a presença de bócio uni ou multinodular, respectivamente, e o tratamento com DAT deverá ser realizado, deixando o tratamento definitivo (131I ou cirurgia) para o período pós-parto. Após o parto, a terapia com DAT deverá ser mantida e as mulheres devem ser orientadas sobre o aleitamento materno. As pacientes que descontinuaram a DAT na gestação deverão ser orientadas a buscar atendimento, caso voltem apresentar os sintomas do hipertireoidismo. Nas pacientes que permanecerem assintomáticas, a determinação rotineira de TSH e T4L deverá ser realizada seis semanas após o parto, e o seguimento deve ser programado em intervalos regulares, uma vez que recorrências são comuns (174) (B).
O hipertireoidismo neonatal é raro, com incidência < 1% nas crianças nascidas de mães hipertireóideas. É causado pela transferência pela mãe de anticorpos estimuladores da tireoide (175) (D). Quando a mãe é adequadamente tratada com DAT, o feto se beneficia do tratamento materno e permanece eutireóideo durante a gestação. Entretanto, o efeito protetor é perdido após o parto e o hipertireoidismo clínico poderá se desenvolver, podendo requerer tratamento com DAT. Altos títulos de TRAb identificados no terceiro trimestre da gestação são preditores de hipertireoidismo neonatal (176) (D). Preconiza-se a dosagem de TRAb entre a 26ª e 28ª semana de gestação, incluindo aquelas mulheres com história prévia de DG tratada com 131I ou cirurgia. Naquelas com valores elevados de TRAb, deve ser realizado US fetal para avaliar a presença de bócio ou outro sinal de hipertireoidismo, como retardo de crescimento intrauterino ou insuficiência cardíaca (177,178) (D).
Existem relatos de hipotireoidismo central em filhos de mães com DG, cujo hipertireoidismo não foi controlado na gestação. A explicação para essa ocorrência é a passagem de altas concentrações de T4 maternas para o feto, levando à supressão da hipófise fetal. O diagnóstico é estabelecido após o nascimento, sendo observados valores baixos de T4L e TSH normal-baixo ou inapropriado para os níveis de T4L. A função tireoidiana fetal retornará ao normal após semanas ou meses. Entretanto, é recomendado o tratamento com tiroxina e seguimento em longo prazo (179,180) (B).
O aleitamento é permitido às mulheres em uso de DAT. Entretanto, deverão utilizar a mínima dose possível da droga; recomendam-se, no máximo, 300 mg/dia de PTU ou 20-30 mg/dia de MMI (181) (D). As crianças deverão ser acompanhadas com os testes de função tireoidiana.
Recomendação 38
A determinação do TRAb é recomendada em mulheres com história passada ou presente de DG e deverá ser obtida entre a 20ª-24ª semana de gestação (D).
10) COMO TRATAR O HIPERTIREOIDISMO NO PACIENTE COM OFTALMOPATIA DE GRAVES (OG)?
A OG ocorre em 50% dos pacientes com DG e em 20%-30% dos casos tem expressão clínica importante, requisitando um tratamento mais agressivo e específico (182) (B). As duas características primordiais da OG são atividade e gravidade (183) (B). A OG evolui por meio de uma fase ativa (inflamatória), seguida de estabilização (plateau) e fase final de doença inativa (184) (D). Um método útil de se avaliar o grau de atividade é a utilização do clinical activity score (CAS) (185) (A). O CAS inclui: edema palpebral, eritema palpebral, eritema conjuntival, quemose, edema de carúncula, dor ocular espontânea e dor ocular à movimentação. A OG é considerada ativa quando apresenta, no mínimo, três desses sete itens. Enquanto isso, avaliação de gravidade baseia-se em alterações de tecidos moles, proptose, envolvimento da musculatura extraocular extrínseca e de nervo óptico ou acometimento corneano (183) (B).
O tratamento com DAT não parece exercer nenhum impacto na evolução da doença ocular, contudo, acredita-se em um efeito benéfico indireto por meio de resolução do estado de hipertireoidismo, principalmente se associado a decréscimos nos níveis de TRAb (186) (D). A desvantagem dessa estratégia são as possíveis recidivas do hipertireoidismo (34) (B). Essas podem reativar o processo autoimune e elevar os níveis de TRAb e outros autoanticorpos e, embora a ligação entre a resposta autoimune contra antígenos compartilhados pela tireoide e órbitas não esteja completamente estabelecida, uma reativação e progressão da OG pode ocorrer (182) (B).
Recomendação 39
Os pacientes com hipertireodismo e OG podem ser tratados com DAT. No entanto, essa estratégia apresenta a desvantagem de uma taxa maior de recidivas, que podem impactar negativamente na evolução da OG (B).
Quanto ao uso de 131I para o tratamento do hipertireoidismo, os estudos randomizados existentes são concordantes em mostrar um risco de progressão ou surgimento de OG após o tratamento em 15%-39% dos casos (187,188) (A). A exacerbação é mais observada em indivíduos que possuem diagnóstico de OG antes do tratamento e pode ser prevenida com administração oral de corticosteroides (182,187) (A). O protocolo usual recomenda prednisona (ou esteroide oral equivalente), em dose de 0,5 mg/kg por dois a três meses (186) (D). Contudo, doses menores de 0,2 mg/kg, utilizadas por períodos mais curtos (seis semanas), mostraram semelhante eficácia (189) (B). A profilaxia com prednisona (ou esteroide oral equivalente) é eficaz na prevenção da progressão de OG em pacientes nos quais a OG já existia antes do tratamento com 131I (187) (A).
O surgimento ou a exacerbação da OG após o tratamento com 131I acontece na minoria dos pacientes e alguns fatores de risco já foram identificados: a) início recente do hipertireoidismo (188) (A); b) OG preexistente (especialmente se ativa) (182) (B); c) gravidade do hipertireoidismo (níveis muito elevados de hormônios tireoidianos) (190) (A); d) níveis séricos elevados de TSH (186) (D); e) níveis séricos elevados de TRAb (186) (D); f) tabagismo (188) (A). A administração de 131I em pacientes sem sinais de OG ou com OG minimamente ativa ou inativa na ausência de fatores de risco muito raramente leva à piora das condições oculares (186) (D). Apesar disso, um estudo retrospectivo sugere que OG pós-radioiodo pode ocorrer mesmo em pacientes sem fatores de risco (191) (B). Contudo, acredita-se que mesmo que a administração de 131I possa ser prejudicial em curto prazo, possivelmente possui benefícios a longo prazo (182) (B). O uso do 131I está relacionado a um aumento do TRAb e, embora os níveis de TRAb ajudem a identificar pacientes em uso de DAT que possuam maior risco de desenvolver OG, a relação entre a elevação pós-radioiodo e piora da OG ainda não é clara (187) (A).
Recomendação 40
O tratamento do hipertireoidismo de 131I está associado com piora da OG, especialmente naqueles pacientes com OG prévia (B), e com atividade moderada a grave (A) e na presença de tabagismo (A). Nesses pacientes e naqueles com fatores de risco para desenvolvimento da OG (D) ou risco de progressão da OG prévia (A), pode-se usar corticosteroides (D).
A TT parece não ter efeito significativo no curso da OG. Estudos randomizados e controlados não encontraram diferença significativa entre TT ou TST na evolução da OG (61,183,192) (C,B,B). A TT ou 131I isolados não estão associados à completa ablação do tecido tireoidiano, mesmo que o hipotireoidismo se desenvolva (193) (D). Em estudo randomizado recente, pacientes submetidos à ablação total do tecido tireoidiano para tratamento do hipertireoidismo e concomitante corticoterapia endovenosa apresentaram uma melhor resposta geral à imunossupressão quando com pacientes submetidos a TT, no entanto a diferença observada entre os grupos analisados não foi expressiva (194) (B). Portanto, a utilidade dessa estratégia precisa ser testada em estudos com maior seguimento.
Recomendação 41
O tratamento cirúrgico do hipertireoidismo não parece ter efeito significativo nos pacientes com OG (B).
O tratamento do hipertireoidismo de Graves com OG pode ser selecionado de acordo com grau da OG. Esta pode ser classificada de acordo com sua gravidade e atividade inflamatória em OG leve inativa, OG moderada-grave ativa, OG moderada-grave inativa, OG grave com risco à visão.
OG LEVE INATIVA
Recomendação 42
A escolha terapêutica do hipertireoidismo parece não influenciar nas alterações oculares. Se a opção for 131I, não há indicação de profilaxia com corticosteroide oral, a menos que fatores de risco para progressão estejam presentes (B).
OG MODERADA-GRAVE ATIVA
Recomendação 43
A escolha do tratamento do hipertireoidismo é controversa. O uso isolado de DAT em geral restaura o eutireoidismo e isso favorece a melhora da OG. Contudo, além de não ser adequadamente sustentado por estudos, questiona-se se o risco aumentado de recidiva e a manutenção da atividade da glândula, associados às flutuações nos níveis hormonais, possam exercer efeito deletério na evolução da OG (42,184,187,194,195) (D,D,D,D,B). Com base nesses argumentos, uma segunda linha terapêutica sugere que, nesse tipo de paciente, após estabelecimento do eutireoidismo com DAT, a glândula deve ser ablada (194) (D).
OG MODERADA-GRAVE INATIVA
Recomendação 44
A escolha do tratamento para o hipertireoidismo é menos crítica. Profilaxia com corticosteroide oral pode ser evitada na ausência de fatores de risco (186) (D).
OG GRAVE COM RISCO À VISÃO
Recomendação 45
A maioria dos pacientes nesta categoria possui neuropatia óptica ou acometimento grave da córnea. O hipertireoidismo deve ser tratado com DAT (186) (D). Tratamento com 131I ou cirurgia deve ser adiado até melhora das condições oculares (186) (D).
11) COMO TRATAR A TIREOTOXICOSE INDUZIDA POR DROGAS?
O tratamento da tireotoxicose induzida pelo iodo é complexo, pois a tireoide enriquecida pelo iodo torna inviável o tratamento com 131I por várias semanas e o tratamento com DAT é menos eficaz. O tratamento clínico com DAT deve ser feito por período prolongado, podendo ser necessários seis a nove meses a partir da suspensão do iodo antes da administração do 131I. O perclorato de potássio pode ser associado para liberar o iodo inorgânico e prevenir a captação de iodo pela tireoide (196) (D).
A tireotoxicose induzida por amiodarona (TIA) pode ser classificada em tipo I, quando há síntese e liberação excessiva de hormônio tireoidiano, ou tipo II, que é uma tireoidite destrutiva. Quando possível, a amiodarona deve ser suspensa. No entanto, devido sua meia-vida longa e falta de resposta da TIA tipo I e II com a retirada da amiodarona, o tratamento medicamentoso em geral deve ser instituído. A TIA tipo I deve ser tratada com doses elevadas de DAT, pois o conteúdo aumentado de iodo intratireóideo reduz a eficácia dessas drogas (197) (D). O perclorato de potássio (1 g/dia) pode ser adicionado para bloquear a captação de iodo e reduzir seu conteúdo intraglandular, mas deve ser usado por um período limitado para evitar efeitos nefrotóxicos e em medula óssea (198) (B). A associação de carbonato de lítio (900 a 1.350 mg/dia) por quatro a seis semanas pode ser feita para reduzir a síntese e liberação dos hormônios tireoidianos (199) (B). Na TIA tipo I, a tireotoxicose pode recorrer ou não chegar a remitir, tornando necessário o tratamento definitivo com 131I (se a amiodarona foi retirada) ou cirurgia. Na TIA tipo II, a suspensão da amiodarona algumas vezes é suficiente, sendo o eutireoidismo alcançado dentro de três a cinco meses. O tratamento com glicocorticoides (prednisona 0,5 a 1 mg/kg/dia ou dexametasona 3 a 6 mg/dia por dois ou três meses) acelera a recuperação clínica e bioquímica (200) (D). Nas formas mistas de TIA ou enquanto a diferenciação dos dois tipos permanecerem inconclusiva, o tratamento deve ser feito utilizando uma combinação de DAT e glicocorticoide (197,198,200) (D,B,D). A TT está indicada quando é necessário o controle imediato, em casos de crise tireotóxica, insuficiência cardíaca grave ou arritmias intratáveis.
O tratamento com interferon-alfa (INF-alfa) pode causar tireoidite destrutiva ou induzir DG em 21% e 17% dos pacientes, respectivamente. O tratamento do hipertireoidismo pode ser efetuado sem necessidade de interrupção do INF-alfa. Betabloqueadores podem ser usados na fase tireotóxica da tireoidite destrutiva, enquanto no caso do hipertireoidismo de Graves deve ser instituído o tratamento com DAT (201) (C). Em geral, a função tireoidiana normaliza quando o tratamento com INF-alfa é descontinuado. Pacientes têm risco aumentado de desenvolver disfunção tireoidiana autoimune no futuro.
O tratamento com interleucina-2 (IL-2) pode causar tireotoxicose em 5% dos casos (202) (D). O tratamento da disfunção tireoidiana deve ser feito como descrito anteriormente naqueles pacientes que utilizaram INF-alfa.
Recomendação 46
Na tireotoxicose induzida por drogas secundária a sobrecarga de iodo (TIA tipo I), o tratamento deve ser feito com altas doses de DAT (D). Na TIA tipo II, a cessação da amiodarona pode ser suficiente e glicocorticoides podem ser utilizados (B). Na tireotoxicose por INF-alfa (C) e IL-2 (D), devem ser considerados a suspensão dos medicamentos e o uso de betabloqueadores para alívio dos sintomas.
12) COMO TRATAR A TIREOTOXICOSE ASSOCIADA A TIREOIDITES?
As tireoidites destrutivas caracterizam-se pela inflamação da tireoide e consequente liberação desregulada dos hormônios tireoidianos, secundária à destruição dos folículos tireoidianos e proteólise da tireoglobulina armazenada (203) (D). As tireoidites podem apresentar-se com dor cervical (tireoidite subaguda e aguda) ou de forma "silenciosa" (tireoidite indolor).
As manifestações clínicas da tireotoxicose são, na maioria das vezes, mais leves do que nas outras causas de hipertireoidismo e têm curso autolimitado (com duração de duas a seis semanas) (204) (B). Por essas razões, recomenda-se o tratamento com betabloqueadores somente naqueles pacientes sintomáticos (18) (D). Não é recomendado o uso de tionamidas, uma vez que a causa da tireotoxicose não é decorrente do aumento da produção dos hormônios tireoidianos. O uso de radioiodo também não é indicado, pois a captação é caracteristicamente baixa nas tireoidites (26,203,205) (D). Naqueles raros pacientes em que a tireotoxicose se apresenta com maior gravidade, existem relatos de uso de contrastes iodados com objetivo de controle mais rápido dos níveis de hormônios tireoidianos (206) (C).
Recomendação 47
No tratamento da tireotoxicose associada a tireoidites, recomenda-se o uso somente de betabloqueadores (D). Nos pacientes que apresentarem quadros clínicos mais graves, o uso de contrastes iodados pode ser considerado (C).
13) COMO TRATAR A TIREOTOXICOSE DEVIDO A OUTRAS CAUSAS?
A. COMO AVALIAR E TRATAR A TIREOTOXICOSE DEVIDA A TUMOR PRODUTOR DE TSH?
Tumores produtores de TSH correspondem a menos de 1% de todos os tumores hipofisários e geralmente causam bócio difuso e tireotoxicose clínica (207) (B). Ao contrário da DG, os níveis de TSH são elevados ou inapropriadamente normais para os níveis séricos de hormônios tireoidianos (207) (B). Esses pacientes podem secretar também prolactina em até 25% dos casos, hormônio de crescimento em até 25%, ambos em 1% e gonadotrofinas em 1%. Geralmente, são maiores do que 1 cm de diâmetro, o que os torna diagnosticáveis com ressonância magnética de crânio (208) (D).
O tratamento dos tumores produtores de TSH consiste na sua remoção cirúrgica preferencialmente com o paciente em eutireoidismo após uso de DAT. O uso de octreotide diminui os níveis séricos de TSH em mais de 50% dos pacientes e a maior parte dos pacientes retorna ao eutireoidismo com diminuição do tamanho tumoral em 20% a 50% dos casos (207) (B). Bromocriptina também pode ser usada embora produza resultados menos importantes (208) (D). Pacientes com tumores incompletamente ressecados podem se beneficiar do uso adjuvante de octreotide, assim como nos pacientes sem condições cirúrgicas (207) (B).
É importante diferenciar tumores produtores de TSH da resistência aos hormônios tireoidianos, pois, embora os testes laboratoriais sejam similares, o tratamento dessas duas condições é muito diferente. Pacientes portadores de tumores hipofisários geralmente têm elevação da subunidade alfa do TSH, resposta de TSH ao TRH bloqueada, níveis elevados de globulina transportadora de hormônios sexuais e sinais clínicos evidentes de tireotoxicose com anormalidades anatômicas demonstráveis pela RM de crânio.
Recomendação 48
O diagnóstico de tumor produtor de TSH deve se basear em níveis inapropriadamente elevados de TSH sérico associados a T3 e T4 elevados (B), usualmente com imagem de adenoma hipofisário na RMN (D) e ausência de história familiar ou de testes genéticos compatíveis com resistência a hormônios tireoidianos. Deve ser indicada a cirurgia hipofisária para retirada do tumor. O uso de octreotide pode ser considerado (B).
B. COMO AVALIAR E TRATAR A TIREOTOXICOSE DEVIDA À RESISTÊNCIA AOS HORMÔNIOS TIREOIDIANOS?
Pacientes com síndrome de resistência aos hormônios tireoidianos (SRHT) apresentam elevadas concentrações séricas de T3 e T4 associadas a TSH sérico elevado ou inapropriadamente normal, característico da sensibilidade reduzida do tireotrofo-hipofisário. Refetoff e cols., em 1967, foram os primeiros a descrever a síndrome clínica em dois indivíduos que apresentavam bócio, surdo-mudez e atraso na idade óssea. Os níveis séricos de hormônios tireoidianos eram elevados, contrastando com os sintomas de hipotireoidismo. A administração de tiroxina exógena não produziu o efeito metabólico esperado e também não suprimiu o TSH estimulado pelo TRH (209) (C).
O diagnóstico da SRHT é estabelecido pela presença de níveis séricos elevados de T3 e T4L associados à TSH não suprimido, na ausência de defeito de transporte de hormônio tireoidiano ou de interferência por anticorpos nos ensaios; ausência de supressão do TSH a doses suprafisiológicas de hormônio tireoidiano; presença eventual da síndrome em outros familiares. Conforme descrito anteriormente, o diagnóstico diferencial com tumor hipofisário secretor de TSH pode ser confirmado pela dosagem da subunidade alfa do TSH e/ou pela demonstração das anormalidades genéticas etiopatogênicas da SRHT como mutações do TR beta (210) (C).
Não é necessário tratamento na maioria dos casos em que a resistência ao hormônio tireoidiano parece ser adequadamente compensada pelo aumento endógeno de hormônios tireoidianos. Pacientes com maior resistência em nível hipofisário e sintomas de hipertireoidismo se beneficiam de tratamento sintomático com agente bloqueador beta-adrenérgico (209,211) (C,D). Tratamento com L-T3 pode melhorar os sintomas de hiperatividade e déficit de atenção em crianças (212) (B).
Recomendação 49
Pacientes com síndrome de resistência aos hormônios tireoidianos podem apresentar hipertireoidismo e serem confundidos com portadores de tumores hipofisários secretores de TSH. O diagnóstico diferencial é importante já que esses pacientes geralmente não necessitam de tratamento ou se beneficiam apenas do uso de betabloqueadores e, eventualmente, de L-T3 (C).
C. COMO AVALIAR E TRATAR A TIREOTOXICOSE DEVIDA A STRUMA OVARII?
O struma ovarii representa uma forma rara de teratoma ovariano composto inteira ou predominantemente por tecido tireoidiano e, em geral, é um tumor benigno, embora 5% a 37% dos casos possam ser malignos (213) (C). O tecido tireoidiano ectópico pode conter células cancerígenas e produzir hormônio tireoidiano com consequente quadro de tireotoxicose em 5% a 10% dos pacientes, além de eventualmente se associar a DG concomitante (214, 215) (D,C). O diagnóstico diferencial com outras causas de tireotoxicose é auxiliado pela baixa captação de iodo radioativo e imagem do tumor ovariano (213, 215) (C,D). O tratamento consiste no uso de DAT para atingir o eutireoidismo e ressecção cirúrgica do tumor. O uso pós-cirúrgico de iodo radioativo permite a eliminação de células malignas residuais tanto tireoidianas quanto ovarianas.
Recomendação 50
Nas pacientes com tireotoxicose com baixa captação de iodo e imagem de tumor ovariano deve ser considerado o diagnóstico de struma ovarii. Se confirmado, o tratamento é cirúrgico com remoção do tumor (C).
D. COMO AVALIAR E TRATAR A TIREOTOXICOSE DEVIDA À HIPERSECREÇÃO DE GONADOTROFINAS?
A produção de níveis muito elevados de gonadotrofina coriônica (HCG) pode estimular o receptor do TSH e causar hipertireoidismo em pacientes com coriocarcinomas, gravidez molar (mola hidatiforme) ou câncer de testículo (216-218) (C,C,B). O diagnóstico diferencial com outras causas de tireotoxicose é auxiliado pela baixa captação de 131I pela tireoide, pelos elevados níveis séricos de gonadotrofinas e pela documentação do tumor produtor correspondente. O tratamento nesses casos consiste primariamente na remoção do tumor e no restauro do eutireoidismo com DAT.
Recomendação 51
Pacientes com tireotoxicose com baixa captação de 131I, elevados níveis de gonadotrofina e coriocarcinomas, mola ou tumores de testículo, devem ser tratados com ressecção cirúrgica do tumor após a obtenção do eutireoidismo com DAT (B).
E. COMO AVALIAR E TRATAR A TIREOTOXICOSE FACTÍCIA?
A tireotoxicose factícia é um problema grave em nosso meio, principalmente devido ao uso abusivo de hormônios tireoidianos visando à perda de peso (219) (B). O diagnóstico pode ser difícil nos casos de uso inapropriado, sem recomendação médica, pois o paciente pode omitir tal fato, e também se torna um desafio diagnóstico nos casos de uso acidental pela contaminação de alimentos ou por erro farmacêutico (220) (C). O diagnóstico diferencial se baseia na ausência de bócio, supressão dos níveis de tireoglobulina e baixa captação de 131I. Pacientes que ingerem T3 ou uma combinação de T4 e de T3 apresentam níveis desproporcionalmente elevados de T3. O tratamento consiste na suspensão da administração/tomada dos hormônios tireoidianos e uso de betabloqueadores para controle dos sintomas.
Recomendação 52
O diagnóstico de tireotoxicose factícia deve ser considerado em pacientes com sintomas do excesso de hormônios tireoidianos, sem bócio ou outros dados sugestivos de doença tireoidiana. Níveis indetectáveis de tireoglobulina sérica e baixa captação de 131I confirmam o diagnóstico. O tratamento consiste na suspensão da ingestão inapropriada de hormônios tireoidianos e uso de betabloqueadores para tratamento dos sintomas (B).
F. COMO AVALIAR E TRATAR A TIREOTOXICOSE DEVIDA A METÁSTASES FUNCIONAIS DE CÂNCER DIFERENCIADO DA TIREOIDE?
Foram descritos alguns raros casos de hipertireoidismo secundário a metástases funcionais de tumores foliculares, geralmente lesões muito grandes ou extensas, causando tireorotoxicose (221) (C). Esses pacientes apresentam tumores facilmente identificados e devem ser tratados com ressecção cirúrgica e/ou 131I adicionado a DAT para restauro do eutireoidismo.
Recomendação 53
Pacientes com lesões ou metástases extensas de carcinoma folicular de tireoide podem apresentar hipertireoidismo. O tratamento pode ser cirúrgico ou por meio da administração de 131I (C).
Recebido em 19/Mar/2013
Aceito em 19/Mar/2013
Declaração: os autores declaram não haver conflitos de interesse científico neste estudo.
- 1. Andrade VA, Gross JL, Maia AL. Effect of methimazole pretreatment on serum thyroid hormone levels after radioactive treatment in Graves' hyperthyroidism. J Clin Endocrinol Metab. 1999;84(11):4012-6.
- 2. Boelaert K, Torlinska B, Holder RL, Franklyn JA. Older subjects with hyperthyroidism present with a paucity of symptoms and signs: a large cross-sectional study. J Clin Endocrinol Metab. 2010;95(6):2715-26.
- 3. Nordyke RA, Gilbert FI Jr, Harada AS. Graves' disease. Influence of age on clinical findings. Arch Intern Med. 1988;148(3):626-31.
- 4. Woeber KA. Thyrotoxicosis and the heart. N Engl J Med. 1992;327(2):94-8.
- 5. de los Santos ET, Starich GH, Mazzaferri EL. Sensitivity, specificity, and cost-effectiveness of the sensitive thyrotropin assay in the diagnosis of thyroid disease in ambulatory patients. Arch Intern Med. 1989;149(3):526-32.
- 6. Rajatanavi R, Braverman LE. Euthyroid hyperthyroxinemia. J Endocrinol Invest. 1983;6(6):493-505.
- 7. Rajatanavin R, Liberman C, Lawrence GD, D'Arcangues CM, Young RA, Emerson CH. Euthyroid hyperthyroxinemia and thyroxine-binding prealbumin excess in islet cell carcinoma. J Clin Endocrinol Metab. 1985;61(1):17-21.
- 8. Mariotti S, Martino E, Cupini C, Lari R, Giani C, Baschieri L, et al. Low serum thyroglobulin as a clue to the diagnosis of hyperthyroidism factitia. N Engl J Med. 1982;307(7):410-2.
- 9. Luton D, Le Gac I, Vuillard E, Castanet M, Guibourdenche J, Noel M, et al. Management of Graves' disease during pregnancy: the key role of fetal thyroid gland monitoring. J Clin Endocrinol Metab. 2005;90(11):6093-8.
- 10. Vos XG, Smit N, Endert E, Tijssen JG, Wiersinga WM. Frequency and characteristics of TBII-seronegative patients in a population with untreated Graves' hyperthyroidism: a prospective study. Clin Endocrinol (Oxf). 2008;69(2):311-7.
- 11. Al-Shariff A, Abujbara AA, Chiacchio S, Ajlouni KM, Mariani G. Contribution of radioiodine uptake measurement and thyroid scintigraphy to the differential diagnosis of thyrotoxicosis. Hell J Nucl Med. 2010;13(2):132-7.
- 12. Bogazzi F, Martino E, Dell'Unto E, Brogioni S, Cosci C, Aghini-Lombardi F, et al. Thyroid color flow Doppler sonography and radioiodine uptake in 55 consecutive patients with amiodarone-induced thyrotoxicosis. J Endocrinol Investigation. 2003;26(7):635-40.
- 13. Maia AL, Ward LS, Carvalho GA, Graf H, Maciel RM, Maciel LM, et al. Thyroid nodules and differentiated thyroid cancer: Brazilian consensus. Arq Bras Endocrinol Metab. 2007;51(5):867-93.
- 14. Ota H, Amino N, Morita S, Kobayashi K, Kubota S, Fukata S, et al. Quantitative measurement of thyroid blood flow for differentiation of painless thyroiditis from Graves' disease. Clin Endocrinol (Oxf). 2007;67(1):41-5.
- 15. Bogazzi F, Vitti P. Could improved ultrasound and power Doppler replace thyroidal radioiodine uptake to assess thyroid disease? Nat Clin Pract Endocrinol Metab. 2008;4(2):70-1.
- 16. Bogazzi F, Bartalena L, Brogioni S, Mazzeo S, Vitti P, Burelli A, et al. Color flow Doppler sonography rapidly differentiates type I and type II amiodarone-induced thyrotoxicosis. Thyroid. 1997;7(4):541-5.
- 17. Trzepacz PT, Klein I, Roberts M, Greenhouse J, Levey GS. Graves' disease: an analysis of thyroid hormone levels and hyperthyroid signs and symptoms. Am J Med. 1989;87(5):558-61.
- 18. Geffner DL, Hershman JM. Beta-adrenergic blockade for the treatment of hyperthyroidism. Am J Med. 1992;93(1):61-8.
- 19. McDevitt DG, Nelson JK. Comparative trial of atenolol and propranolol in hyperthyroidism. Br J Clin Pharmacol. 1978;6(3):233-7.
- 20. Duggal J, Singh S, Kuchinic P, Butler P, Arora R. Utility of esmolol in thyroid crisis. Can J Clin Pharmacol. 2006;13(3):292-5.
- 21. Henderson JM, Portmann L, Van Melle G, Haller E, Ghika JA. Propranolol as an adjunct therapy for hyperthyroid tremor. Eur Neurol. 1997;37(3):182-5.
- 22. Milner MR, Gelman KM, Phillips RA, Fuster V, Davies TF, Goldman ME. Double-blind crossover trial of diltiazem versus propranolol in the management of thyrotoxic symptoms. Pharmacotherapy. 1990;10(2):100-6.
- 23. Kelestimur F, Aksu A. The effect of diltiazem on the manifestations of hyperthyroidism and thyroid function tests. Exp Clin Endocrinol Diabetes. 1996;104(1):38-42.
- 24. Cooper DS. Antithyroid drugs. N Engl J Med. 2005;352(9):905-17.
- 25. Russo MW, Galanko JA, Shrestha R, Fried MW, Watkins P. Liver transplantation for acute liver failure from drug induced liver injury in the United States. Liver Transpl. 2004;10(8):1018-23.
- 26. Bahn RS, Burch HB, Cooper DS, Garber JR, Greenlee MC, Klein I, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr Pract. 2011;17(3):456-520.
- 27. Shivakumar SK, Dwarakanath S, Swaroop G, Venkataramana NK. Aplasia cutis congenita of the scalp: therapeutic modalities. Neurol India. 2006;54(3):312-13.
- 28. Reinwein D, Benker G, Lazarus JH, Alexander WD. A prospective randomized trial of antithyroid drug dose in Graves' disease therapy. J Clin Endocrinol Metab. 1993;76(6):1516-21.
- 29. Pearce SH. Spontaneous reporting of adverse reactions to carbimazole and propylthiouracil in the UK. Clin Endocrinol (Oxf). 2004;61(5):589-94.
- 30. Williams KV, Nayak S, Becker D, Reyes J, Burmeister LA. Fifty years of experience with propylthiouracil-associated hepatotoxicity: what have we learned? J Clin Endocrinol Metab. 1997;82(6):1727-33.
- 31. Fibbe WE, Claas FHJ, Van der Star-Dijkstra W, Schaafsma MR, Meyboom RH, Falkenburg JH. Agranulocytosis induced by propylthiouracil: evidence of a drug dependent antibody reacting with granulocytes, monocytes and haematopoietic progenitor cells. Br J Haematol. 1986;64(2):363-73.
- 32. Cooper DS. The side effects of antithyroid drugs. The Endocrinologist. 1999;9:457-67.
- 33. Schleusener H, Schwander J, Fischer C, Holle R, Holl G, Badenhoop K, et al. Prospective multicentre study on the prediction of relapse after antithyroid drug treatment in patients with Graves' disease. Acta Endocrinol. 1989;120(6):689-701.
- 34. Vitti P, Rago T, Chiovato L, Pallini S, Santini F, Fiore E, et al. Clinical features of patients with Graves' disease undergoing remission after antithyroid drug treatment. Thyroid. 1997;7(3):369-75.
- 35. Tamai H, Nakagawa T, Fukino O, Ohsako N, Shinzato R, Suematsu H, et al. Thionamida therapy in Graves' disease: relation of relapse rate to duration of therapy. Ann Intern Med. 1980;92(4):488-90.
- 36. Allannic H, Fauchet R, Orgiazzi J, Madec AM, Genetet B, Lorcy Y, et al. Antithyroid drugs and Graves' disease: a prospective randomized evaluation of the efficacy of treatment duration. J Clin Endocrinol Metab. 1990;70(3):675-9.
- 37. Benker G, Rjenwein D, Kahaly G, Teglu L, Alexander WD, Fassbinder J, et al. Is there a methimazole dose effect on remission rate in Graves' disease? Results from a long-term prospective study. Clin Endocrinol (Oxf). 1998;49(4):451-7.
- 38. Wood LC, Ingbar SH. Hypothyroidism as a late sequela in patient with Graves' disease treated with antithyroid agents. J Clin Invest. 1979;64(5):1429-36.
- 39. Hedley AJ, Young RE, Jones SJ, Alexander WD, Bewsher PD. Antithyroid drugs in the treatment of hyperthyridism of Graves' disease: long-term follow-up of 434 patients. Clin Endocrinol (Oxf). 1989;31(2):209-18.
- 40. Berglund J, Christensen SB, Dymling JF, Hallengren B. The incidence of recurrence and hypothyroidism following treatment with antithyroid drugs, surgery or radioiodine in all patients with thyrotoxicosis in Malmo during the period 1970-1974. J Intern Med. 1991;229(5):435-42.
- 41. Cruz Júnior AF, Takahashi MH, Albino CC. Tratamento clínico com drogas antitireoidianas ou dose terapêutica de Iodo-131 no controle do hipertireoidismo na doença de Graves: avaliação dos custos e benefícios. Arq Bras Endocrinol Metab. 2006;50(6):1096-101.
- 42. Hegedus L. Treatment of Graves' hyperthyroidism: evidence-based and emerging modalities. Endocrinol Metab Clin North Am. 2009;38(2):355-71.
- 43. Ross DS. Radioiodine therapy for hyperthyroidism. N Engl J Med. 2011;364(6):542-50.
- 44. Burch HB, Solomon BL, Cooper DS, Ferguson P, Walpert N, Howard R. The effect of antithyroid drug pretreatment on acute changes in thyroid hormone levels after (131)I ablation for Graves' disease. J Clin Endocrino Metab. 2001;86(7):3016-21.
- 45. Andrade VA, Gross JL, Maia AL. The effect of methimazole pretreatment on the efficacy of radioactive iodine therapy in Graves' hyperthyroidism: one-year follow-up of a prospective, randomized study. J Clin Endocrinol Metab. 2001;86(8):3488-93.
- 46. Santos RB, Romaldini JH, Ward LS. Propylthiouracil reduces the effectiveness of radioiodine treatment in hyperthyroid patients with Graves' disease. Thyroid. 2004;14(7):525-30.
- 47. Imseis RE, Vanmiddlesworth L, Massie JD, Bush AJ, Vanmiddlesworth NR. Pretreatment with propylthiouracil but not methimazole reduces the therapeutic efficacy of iodine-131 in hyperthyroidism. J Clin Endocrinol Metab. 1998;83(2):685-7.
- 48. Bonnema SJ, Bennedbaek FN, Gram J, Veje A, Marving J, Hegedus L. Resumption of methimazole after 131I therapy of hyperthyroid diseases: effect on thyroid function and volume evaluated by a randomized clinical trial. Eur J Endocrinol. 2003;149(6):485-92.
- 49. Abraham P, Acharya S. Current and emerging treatment options for Graves' hyperthyroidism. Ther Clin Risk Manag. 2010;2(6):29-40.
- 50. Jarløv AE, Hegedüs L, Kristensen LO, Nygaard B, Hansen JM. Is calculation of the dose in radioiodine therapy of hyperthyroidism worth while? Clin Endocrinol (Oxf). 1995;43(3):325-9.
- 51. Leslie WD, Ward L, Salamon EA, Ludwig S, Rowe RC, Cowden EA. A randomized comparison of radioiodine doses in Graves' hyperthyroidism. J Clin Endocrino Metab. 2003;88(3):978-83.
- 52. Allahabadia A, Dykin J, Sheppard MC, Gough SC, Franklyn JA. Radioiodine treatment of hyperthyroidism - prognostic factors for outcome. J Clin Endocrinol Metab. 2001;86(8):3611-17.
- 53. van Isselt JW, de Klerk JM, Lips CJ. Radioiodine treatment of hyperthyroidism: fixed or calculated doses; intelligent design or science? Eur J Nucl Med Mol Imag. 2007;34(11):1883-4.
- 54. de Rooij A, Vandenbroucke JP, Smit JW, Stokkel MP, Dekkers OM. Clinical outcomes after estimated versus calculated activity of radioiodine for the treatment of hyperthyroidism: systematic review and meta-analysis. Eur J Endocrinol. 2009;161(5):771-7.
- 55. Boelaert K, Syed AA, Manji N, Sheppard MC, Holder RL, Gough SC, et al. Prediction of cure and risk of hypothyroidism in patients receiving 131I for hyperthyroidism. Clin Endocrinol (Oxf). 2009;70(1):129-38.
- 56. Abraham P, Acharya A. Current and emerging treatment options for Graves' hyperthyroidism. Ther Clin Risk Manag. 2010;6:29-40.
- 57. Flower MA, al-Saadi A, Harmer CL, McCready VR, Ott RJ. Dose-response study on thyrotoxic patients undergoing positron emission tomography and radioiodine therapy. Eur J Nucl Med. 1994;21(6):531-6.
- 58. Cooper DS. Hyperthyroidism. Lancet. 2003;362(9382):459-68.
- 59. Bogazzi F, Giovannetti C, Fessehatsion R, Tanda ML, Campomori A, Compri E, et al. Impact of lithium on efficacy of radioactive iodine therapy for Graves' disease: a cohort study on cure rate, time to cure, and frequency of increased serum thyroxine after antithyroid drug withdrawal. J Clin Endocrinol Metab. 2010;95(1):201-8.
- 60. Metso S, Auvinen A, Huhtala H, Salmi J, Oksala H, Jaatinen P. Increased cancer incidence after radioiodine treatment for hyperthyroidism. Cancer. 2007;109(10):1972-9.
- 61. Verburg FA, Luster M, Lassmann M, Reiners C. (131)I therapy in patients with benign thyroid disease does not conclusively lead to a higher risk of subsequent malignancies. Nuklearmedizin. 2011;50(3):93-9.
- 62. Ceccarelli C, Canale D, Battisti P, Caglieresi C, Moschini C, Fiore E, et al. Testicular function after 131I therapy for hyperthyroidism. Clin Endocrinol. 2006;65(4):446-52.
- 63. Stalberg P, Svensson A, Hessman O, Akerstrom G, Hellman P. Surgical treatment of Graves' disease: evidence-based approach. World J Surg. 2008;32(7):1269-77.
- 64. Yip J, Lang BH, Lo CY. Changing trend in surgical indication and management for Graves' disease. Am J Surg. 2012;203(2):162-7.
- 65. Liu J, Bargren A, Schaefer S, Chen H, Sippel RS. Total thyroidectomy: a safe and effective treatment for Graves' disease. J Surg Res. 2011;168(1):1-4.
- 66. Nayak B, Burman K. Thyrotoxicosis and thyroid storm. Endocr Metab Clin North Am. 2006;35(4):663-86.
- 67. Ansaldo GL, Pretolesi F, Varaldo E, Meola C, Minuto M, Borgonovo G, et al. Doppler evaluation of intrathyroid arterial resistances during preoperative treatment with Lugol's iodide solution in patients with diffuse toxic goiter. J Am Coll Surg. 2000;191(6):607-12.
- 68. Erbil Y, Ozluk Y, Giris M, Salmaslioglu A, Issever H, Barbaros U, et al. Effect of lugol solution on thyroid gland blood flow and microvessel density in the patients with Graves' disease. J Clin Endocrinol Metab. 2007;92(6):2182-9.
- 69. Bellantone R, Lombardi CP, Raffaelli M, Boscherini M, Alesina PF, De Crea C, et al. Is routine supplementation therapy (calcium and vitamin D) useful after total thyroidectomy? Surgery. 2002;132(6):1109-12.
- 70. Portefield JR Jr, Thompson GB, Farley DR, Grant CS, Richards MI. Evidence-based management of toxic multinodular goiter (Plummer' Disease). World J Surg. 2008;32(7):1278-84.
- 71. Winsa B, Rastad J, Akerstrom G, Johansson H, Westermark K, Karlsson FA. Retrospective evaluation of subtotal and total thyroidectomy in Graves' disease with and without endocrine ophthalmopathy. Eur J Endocrinol. 1995;132(4):406-12.
- 72. Miccoli P, Vitti P, Rago T, Iacconi P, Bartalena L, Bogazzi F, et al. Surgical treatment of Graves' disease: subtotal or total thyroidectomy? Surgery. 1996;120(6):1020-4.
- 73. Palit TK, Miller CC, 3rd, Miltenburg DM. The efficacy of thyroidectomy for Graves' disease: a meta-analysis. J Surg Res. 2000;90(2):161-5.
- 74. Sosa JA, Bowman HM, Tielsch JM, Powe NR, Gordon TA, Udelsman R. The importance of surgeon experience for clinical and economic outcomes from thyroidectomy. Ann Surg. 1998;228(3):320-30.
- 75. Stocker DJ, Burch HB. Thyroid cancer yield in patients with Graves' disease. Minerva Endocrinol. 2003;28(3):205-12.
- 76. Kikuchi S, Noguchi S, Yamashita H, Uchino S, Kawamoto H. Prognosis of small thyroid cancer in patients with Graves' disease. Br J Surg. 2006;93(4):434-9.
- 77. Camargo R, Corigliano S, Friguglietti C, Gauna A, Harach R, Munizaga F, et al. Latin American thyroid society. Latin American thyroid society recommendations for the management of thyroid nodules. Arq Bras Endocrinol Metab. 2009;53(9):1167-75.
- 78. Krohn K, Führer D, Bayer Y, Eszlinger M, Brauer V, Neumann S, et al. Molecular pathogenesis of euthyroid and toxic multinodular goiter. Endocr Rev. 2005;26(4):504-24.
- 79. Franklyn JA, Boelaert K. Thyrotoxicosis. Lancet. 2012;379(9821):1155-66.
- 80. Becker DV, Hurley JR. Complications of radioiodine treatment of hyperthyroidism. Semin Nucl Med. 1971;1(4):442-60.
- 81. Koornstra JJ, Kerstens MN, Hoving J, Visscher KJ, Schade JH, Gort HB, et al. Clinical and biochemical changes following 131I therapy for hyperthyroidism in patients not pretreated with antithyroid drugs. Neth J Med. 1999;55(5):215-21.
- 82. Papini E, Guglielmi R, Bianchini A, Creszenci A, Taccogna S, Nardi F, et al. Risk of malignancies in non-palpable thyroid nodules: predictive value of ultrasound and colo-Doppler features. J Clin Endocrinol Metab. 2002;87(5):1941-6.
- 83. Graf H, Pacini F, Pinchera A, Leung A, Vaisman M, Reiners C, et al. Modified-release recombinant human TSH (MRrhTSH) augments the effect of 131I therapy in benign multinodular goiter: results from a multicenter international, randomized, placebo-controlled study. J Clin Endocrinol Metab. 2011;96(5):1368-76.
- 84. Hegedus L, Bonnema SJ, Bennedbaek FN. Management of simple nodular goiter: current status and future perspectives. Endocr Rev. 2003;24(1):102-32.
- 85. Zakavi SR, Mousavi Z, Davachi B. Comparison of four different protocols of I-131 therapy for treating single toxic thyroid nodule. Nucl Med Commun. 2009;30(2):169-75.
- 86. Erickson D, Gharib H, Li H, van Heerden JA. Treatment of patients with toxic multinodular goiter. Thyroid. 1998;8(4):277-82.
- 87. Wahl RA, Rimpl I, Saalabian S, Schabram J. Differentiated operative therapy of thyroid autonomy (Plummer's disease). Exp Clin Endocrinol Diabetes. 1998;106 suppl 4:S78-84.
- 88. Kang AS, Grant CS, Thompson GB, van Heerden JA. Current treatment of nodular goiter with hyperthyroidism (Plummer's Disease): surgery versus radioiodine. Surgery. 2002;132(6):916-23.
- 89. Vidal-Trecan GM, Stahl JE, Eckman MH. Radioiodine or surgery for toxic thyroid adenoma: dissecting an important decision. A cost-effectiveness analysis. Thyroid. 2004;14(11):933-45.
- 90. Vaiman M, Nagibin A, Hagag P, Kessler A, Gavriel H. Hypothyroidism following partial thyroidectomy. Otolaryngol Head Neck Surg. 2008;138(1):98-100.
- 91. Lippi F, Ferrari C, Manetti L, Rago T, Santini F, Monzani F, et al. Treatment of solitary authonomous thyroid nodules by percutaneous ethanol injection: results of an Italian multicenter study. The Multicenter Study Group. J Clin Endocrinol Metab. 1996;81(9):3261-4.
- 92. Braga-Basaria M, Trippia MA, Stolf AR, Mesa C Jr, Graf H. Treatment of autonomous and cystic thyroid nodules with intranodular ethanol injection. Rev Assoc Med Bras. 2002;48(4):335-40.
- 93. Yano Y, Sugino K, Akaishi J, Uruno T, Okuwa K, Shibuya H, et al. Treatment of autonomously functioning thyroid nodules at a single institution: radioiodine therapy, surgery, and ethanol injection therapy. Ann Nucl Med. 2011;25(10):749-54.
- 94. Monzani F, Caraccio N, Goletti O, Lippolis PV, Casolaro A, Del Guerra P, et al. Five-year follow-up of percutaneous ethanol injection for the treatment of hyperfunctioning thyroid nodules: a study of 117 patients. Clin Endocrinol (Oxf). 1997;46(1):9-15.
- 95. Janowitz P, Ackmann S. Long-term results of ultrasound-guided ethanol injections in patients with autonomous thyroid nodules and hyperthyroidism. Med Klin (Munich). 2001;96(8):451-6.
- 96. Valcavi R, Frasoldati A. Ultrasound-guided percutaneous etanol injection therapy in thyroid cystic nodules. Endocr Pract. 2004;10(3):269-75.
- 97. Tarantino L, Francica G, Sordelli I, Sperlongano P, Parmeggiani D, Ripa C, et al. Percutaneous ethanol injection of hyperfunctioning thyroid nodules: long-term follow-up in 125 patients. AJR Am J Roentgenol. 2008;190(3):800-8.
- 98. Dossing H, Bennebaek FN, Karstrup S, Hegedüs L. Benign solitary solid cold thyroid nodules: US-guided interstitial laser photocoagulation-initial experience. Radiology. 2002;225(1):53-7.
- 99. Papini E, Guglielmi R, Bizarri G, Pacella CM. Ultrasound-guided laser termal ablation for treatment of benign thyroid nodules. Endocrine Practice. 2004;10(3):276-83.
- 100. Baek JB, Lee JH, Valcavi R, Pacella CM, Rhim H, Gyu D. Thermal ablation for benign thyroid nodules: radiofrequency and laser. Korean J Radiol. 2011;12(5):525-40.
- 101. Burch HB, Wartofsky L. Life-threatening thyrotoxicosis. Thyroid storm. Endocrinol Metab Clin North Am. 1993;22(2):263-77.
- 102. Akamizu T, Satoh T, Isozaki O, Suzuki A, Wakino S, Iburi T, et al. Diagnostic criteria, clinical features, and incidence of thyroid storm based on nationwide surveys. Thyroid. 2012;22(7):661-79.
- 103. Laurberg P, Vestergaard H, Nielsen S, Christensen SE, Seefeldt T, Helleberg K, et al. Sources of circulating 3,5,3'-triiodothyronine in hyperthyroidism estimated after blocking of type 1 and type 2 iodothyronine deiodinases. J Clin Endocrino Metab. 2007;92(6):2149-56.
- 104. Giles HG, Roberts EA, Orrego H, Sellers EM. Disposition of intravenous propylthiouracil. J Clin Pharmacol. 1981;21(11-12 Pt1):466-71.
- 105. Nabil N, Miner DJ, Amatruda JM. Methimazole: an alternative route of administration. J Clin Endocrino Metab. 1982;54(1):180-1.
- 106. Walter RM Jr, Bartle WR. Rectal administration of propylthiouracil in the treatment of Graves' disease. Am J Med. 1990;88(1):69-70.
- 107. Yeung SC, Go R, Balasubramanyam A. Rectal administration of iodide and propylthiouracil in the treatment of thyroid storm. Thyroid. 1995;5(5):403-5.
- 108. Jongjaroenprasert W, Akarawut W, Chantasart D, Chailurkit L, Rajatanavin R. Rectal administration of propylthiouracil in hyperthyroid patients: comparison of suspension enema and suppository form. Thyroid. 2002;12(7):627-31.
- 109. Hodak SP, Huang C, Clarke D, Burman KD, Jonklaas J, Janicic-Kharic N. Intravenous methimazole in the treatment of refractory hyperthyroidism. Thyroid. 2006;16(7):691-5.
- 110. Baeza A, Aguayo J, Barria M, Pineda G. Rapid preoperative preparation in hyperthyroidism. Clin Endocrinol (Oxf). 1991;35(5):439-45.
- 111. Robuschi G, Manfredi A, Salvi M, Gardini E, Montermini M, d'Amato L, et al. Effect of sodium ipodate and iodide on free T4 and free T3 concentrations in patients with Graves' disease. J Endocrinol Invest. 1986;9(4):287-91.
- 112. Tsatsoulis A, Johnson EO, Kalogera CH, Seferiadis K, Tsolas O. The effect of thyrotoxicosis on adrenocortical reserve. Eur J Endocrinol. 2000;142(3):231-5.
- 113. Solomon BL, Wartofsky L, Burman KD. Adjunctive cholestyramine therapy for thyrotoxicosis. Clin Endocrinol (Oxf). 1993;38(1):39-43.
- 114. Vyas AA, Vyas P, Fillipon NL, Vijayakrishnan R, Trivedi N. Successful treatment of thyroid storm with plasmapheresis in a patient with methimazole-induced agranulocytosis. Endocr Pract. 2010;16(4):673-6.
- 115. Glaser NS, Styne DM. Organization of Pediatric Endocrinologists of Northern California Collaborative Graves' Disease Study Group. Predicting the likelihood of remission in children with Graves' disease: a prospective, multicenter study. Pediatrics. 2008;121:e481-8.
- 116. Dötsch J, Siebler T, Hauffa BP, Doeker B, Andler W, Bettendorf M, et al. Diagnosis and management of juvenile hyperthyroidism in Germany: a retrospective multicenter study. J Pediatr Endocrinol Metab. 2000;13(7):879-85.
- 117. Poyrazoğlu S, Saka N, Bas F, Isguven P, Dogu A, Turan S, et al. Evaluation of diagnosis and treatment results in children with Graves' disease with emphasis on the pubertal status of patients. J Pediatr Endocrinol Metab. 2008;21(8):745-51.
- 118. Kaguelidou F, Alberti C, Castanet M, Guitteny MA, Czernichow P, Leger J. French Childhood Graves' Disease Study Group. Predictors of autoimmune hyperthyroidism relapse in children after discontinuation of antithyroid drug treatment. J Clin Endocrinol Metab. 2008;93(10):3817-26.
- 119. Barrio R, López-Capapé M, Martinez-Badás I, Carrillo A, Moreno JC, Alonso M. Graves' disease in children and adolescents: response to long-term treatment. Acta Paediatr. 2005;94(11):1583-9.
- 120. Abraham P, Avenell A, McGeoch SC, Clark LF, Bevan JS. Antithyroid drug regimen for treating Graves' hyperthyroidism. Cochrane Database Syst Rev. 2010;20:CD003420.
- 121. Léger J, Gelwane G, Kaguelidou F, Benmerad M, Alberti C. Positive impact of long-term antithyroid drug treatment on the outcome of children with Graves' disease: national long-term cohort study. J Clin Endocrinol Metab. 2012;97(1):110-9.
- 122. Perrild H, Grüters-Kieslich A, Feldt-Rasmussen U, Grant D, Martino E, Kayser L, et al. Diagnosis and treatment of thyrotoxicosis in childhood. A European questionnaire study. Eur J Endocrinol. 1994;131(5):467-73.
- 123. Mussa GC, Corrias A, Silvestro L, Battan E, Mostert M, Mussa F, et al. Factors at onset predictive of lasting remission in pediatric patients with Graves' disease followed for at least three years. J Pediatr Endocrinol Metab. 1999;12(4):537-41.
- 124. Slyper AH, Wyatt D, Boudreau C. Effective methimazole dose for childhood Graves' disease and use of free triiodothyronine combined with concurrent thyroid-stimulating hormone level to identify mild hyperthyroidismand delayed pituitary recovery. J Pediatr Endocrinol Metab. 2005;18(6):597-602.
- 125. Cassio A, Corrias A, Gualandi S, Tato' L, Cesaretti G, Volta C, et al. Influence of gender and pubertal stage at diagnosis on growth outcome in childhood thyrotoxicosis: results of a collaborative study. Clin Endocrinol (Oxf). 2006;64(1):53-7.
- 126. Sato H, Harada S, Yokoya S, Tanaka T, Asayama K, Mori M, et al. Treatment for childhood-onset Graves' disease in Japan: results of a nationwide questionnaire survey of pediatric endocrinologists and thyroidologists. Thyroid. 2007;17(1):67-72.
- 127. Smith J, Brown RS. Persistence of thyrotropin (TSH) receptor antibodies in children and adolescents with Graves' disease treated using antithyroid medication. Thyroid. 2007;17(11):1103-7.
- 128. Rivkees SA, Stephenson K, Dinauer C. Adverse events associated with methimazole therapy of graves' disease in children. Int J Pediatr Endocrinol. 2010;2010:176970.
- 129. Lazar L, Kalter-Leibovici O, Pertzelan A, Weintrob N, Josefsberg Z, Phillip M. Thyrotoxicosis in prepubertal children compared with pubertal and postpubertal patients. J Clin Endocrinol Metab. 2000;85(10):3678-82.
- 130. Rivkees SA, Szarfman A. Dissimilar hepatotoxicity profiles of propylthiouracil and methimazole in children. J Clin Endocrinol Metab. 2010;95(7):3260-7.
- 131. Sato H, Hattori M, Fujieda M, Sugihara S, Inomata H, Hoshi M, et al. High prevalence of antineutrophil cytoplasmic antibody positivity in childhood onset Graves' disease treated with propylthiouracil. J Clin Endocrinol Metab. 2000;85(11):4270-3.
- 132. Jafarzadeh A, Poorgholami M, Izadi N, Nemati M, Rezayati M. Immunological and hematological changes in patients with hyperthyroidism or hypothyroidism. Clin Invest Med. 2010;33(5):271-9.
- 133. Sarinnapakorn V, Noppavetchwich P, Sunthorntepwarakul T, Deerochanawong C, Ngongamrut S. Abnormal liver function test in Graves' disease: a prospective study of comparison between the hyperthyroid state and the euthyroid state. J Med Assoc Thai. 2011;94(Suppl 2):S11-6.
- 134. Sandrini R, França SN, Lacerda L, Graf H. Treatment of hyperthyroidism in infancy and adolescence. Arq Bras Endocrinol Metab. 2001;45(1):32-6.
- 135. Hamerschlak N, Maluf E, Biasi Cavalcanti A, Avezum Júnior A, Eluf-Neto J, Passeto Falcão R, et al. Incidence and risk factors for agranulocytosis in Latin American countries--the Latin Study: a multicenter study. Eur J Clin Pharmacol. 2008;64(9):921-9.
- 136. Takata K, Kubota S, Fukata S, Kudo T, Nishihara E, Ito M, et al. Methimazole-induced agranulocytosis in patients with Graves' disease is more frequent with an initial dose of 30 mg daily than with 15 mg daily. Thyroid. 2009;19(6):559-63.
- 137. Salpeter SR, Ormiston TM, Salpeter EE. Cardioselective beta-blockers in patients with reactive airway disease: a meta-analysis. Ann Intern Med. 2002;137(9):715-25.
- 138. Sato H, Minagawa M, Sasaki N, Sugihara S, Kazukawa I, Minamitani K, et al. Comparison of methimazole and propylthiouracil in the management of children and adolescents with Graves' disease: efficacy and adverse reactions during initial treatment and long-term outcome. J Pediatr Endocrinol Metab. 2011;24(5-6):257-63.
- 139. Chen DY, Chen TH. Comparison of efficacy of 131I and antithyroid drugs in the treatment of Graves' disease in children. Chin J Pediatr. 2005;43(7):507-9.
- 140. Hu B, Wei YF, Huang C, Chen LX. The treatment strategy for pediatric Graves' disease and the relevant problems of radioiodine treatment. J Med Forum. 2006;27:67-8.
- 141. Ma C, Kuang A, Xie J, Liu G. Radioiodine treatment for pediatric Graves' disease. Cochrane Database Syst Rev. 2008;16(CD006294).
- 142. Rivkees SA, Cornelius EA. Influence of iodine-131 dose on the outcome of hyperthyroidism in children. Pediatrics. 2003;111(4 Pt1):745-9.
- 143. Zantut-Wittmann DE, Ramos CD, Santos AO, Lima MM, Panzan AD, Facuri FV, et al. High pre-therapy [99mTc]pertechnetate thyroid uptake, thyroid size and thyrostatic drugs: predictive factors of failure in [131I]iodide therapy in Graves' disease. Nucl Med Commun. 2005;26(11):957-63.
- 144. Nebesio TD, Siddiqui AR, Pescovitz OH, Eugster EA. Time course to hypothyroidism after fixed-dose radioablation therapy of Graves' disease in children. J Pediatr. 2002;141(1):99-103.
- 145. Monte O, Calliari LEP, Longui CA. Utilização do 131I no tratamento da doença de Basedow-Graves na infância e adolescência. Arq Bras Endocrinol Metab. 2004;48(1):166-70.
- 146. Kalinyak JE, McDougall IR. How should the dose of iodine-131 be determined in the treatment of Graves' hyperthyroidism? J Clin Endocrinol Metab. 2003;88(3):975-7.
- 147. Kadmon PM, Noto RB, Boney CM, Goodwin G, Gruppuso PA. Thyroid storm in a child following radioactive iodine (RAI) therapy: a consequence of RAI versus withdrawal of antithyroid medication. J Clin Endocrinol Metab. 2001;86(5):1865-7.
- 148. Freitas JE, Swanson DP, Gross MD, Sisson JC. Iodine-131: optimal therapy for hyperthyroidism in children and adolescents? J Nucl Med. 1979;20(8):847-50.
- 149. Rivkees SA, Dinauer C. An optimal treatment for pediatric Graves' disease is radioiodine. J Clin Endocrinol Metab. 2007;92(3):797-800.
- 150. Imaizumi M, Usa T, Tominaga T, Neriishi K, Akahoshi M, Nakashima E, et al. Radiation dose-response relationships for thyroid nodules and autoimmune thyroid diseases in Hiroshima and Nagasaki atomic bomb survivors 55-58 years after radiation exposure. JAMA. 2006;295(9):1011-22.
- 151. Cheetham TD, Hughes IA, Barnes ND, Wraight EP. Treatment of hyperthyroidism in young people. Arch Dis Child. 1998;78(3):207-9.
- 152. Feliciano DV, Lyons JD. Thyroidectomy is optimal treatment for Graves' disease. J Am Coll Surg. 2011;212(4):714-20.
- 153. Sugino K, Ito K, Nagahama M, Kitagawa W, Shibuya H, Ito K. Surgical management of Graves' disease-10-year prospective trial at a single institution. Endocr J. 2008;55(1):161-7.
- 154. Kriplani A, Buckshee K, Bhargava VL, Takkar D, Ammini AC. Maternal and perinatal outcome in thyrotoxicosis complicating pregnancy. Eur J Obstet Gynecol Reprod Biol. 1994;54(3):159-63.
- 155. Davis LE, Lucas MJ, Hankins GD, Roark ML, Cunningham FG. Thyrotoxicosis complicating pregnancy. Am J Obstet Gynecol. 1989;160(1):63-70.
- 156. Millar LK, Wing DA, Leung AS, Koonings PP, Montoro MN, Mestman JH. Low birth weight and preeclampsia in pregnancies complicated by hyperthyroidism. Obstet Gynecol. 1994;84(6):946-9.
- 157. Stagnaro-Green A, Abalovich M, Alexander E, Azizi F, Mestman J, Negro R, et al. Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and Postpartum The American Thyroid Association Taskforce on Thyroid Disease During Pregnancy and Postpartum. Thyroid. 2011;21(10):1081-125.
- 158. Mandel SJ, Cooper DS. The use of antithyroid drugs in pregnancy and lactation. J Clin Endocrinol Metab. 2001;86(6):2354-9.
- 159. Clementi M, Di Gianantonio E, Pelo E, Mammi I, Basile RT, Tenconi R. Methimazole embryopathy: delineation of the phenotype. Am J Med Genet. 1999;83(1):43-6.
- 160. Clementi M, Di Gianantonio E, Cassina M, Leoncini E, Botto LD, Mastroiacovo P. SAFE-Med Study Group Treatment of hyperthyroidism in pregnancy and birth defects. J Clin Endocrinol Metab. 2010;95(11):E337-41.
- 161. Hamburger JI. Diagnosis and management of Graves' disease in pregnancy. Thyroid. 1992;2(3):219-24.
- 162. Bahn RS, Burch HS, Cooper DS, Garber JR, Greenlee CM, Klein IL, et al. The role of propylthiouracil in the management of Graves' disease in adults: report of a meeting jointly sponsored by the American Thyroid Association and the Food and Drug Administration. Thyroid. 2009;19(7):673-4.
- 163. Cooper DS, Rivkees SA. Putting propylthiouracil in perspective. J Clin Endocrinol Metab. 2009;94(6):1881-2.
- 164. Lydakis C, Lip GY, Beevers M, Beevers DG. Atenolol and fetal growth in pregnancies complicated by hypertension. Am J Hypertens. 1999;12(6):541-7.
- 165. Galina MP, Avnet ML, Einhorn A. Iodides during pregnancy. An apparent cause of neonatal death. N Engl J Med. 1962;267:1124-7.
- 166. Stoffer SS, Hamburger JI. Inadvertent 131I therapy for hyperthyroidism in the first trimester of pregnancy. J Nucl Med. 1976;17(2):146-9.
- 167. Bruner JP, Landon MB, Gabbe SG. Diabetes mellitus and Graves' disease in pregnancy complicated by maternal allergies to antithyroid medication. Obstet Gynecol. 1988;72(3 Pt 2):443-5.
- 168. Momotani N, Hisaoka T, Noh J, Ishikawa N, Ito K. Effects of iodine on thyroid status of fetus versus mother in treatment of Graves' disease complicated by pregnancy. J Clin Endocrinol Metab. 1992;75(3):738-44.
- 169. Glinoer D, De Nayer P, Robyn C, Lejeune B, Kinthaert J, Meuris S. Serum levels of intact human chorionic gonadotropin (HCG) and its free alpha and beta subunits, in relation to maternal thyroid stimulation during normal pregnancy. J Endocrinol Invest. 1993;16(11):881-8.
- 170. Bashiri A, Neumann L, Maymon E, Katz M. Hyperemesis gravidarum: epidemiologic features, complications and outcome. Eur J Obstet Gynecol Reprod Biol. 1995;63(2):135-8.
- 171. Bouillon R, Naesens M, Van Assche FA, De Keyser L, De Moor P, Renaer M, et al. Thyroid function in patients with hyperemesis gravidarum. Am J Obstet Gynecol. 1982;143(8):922-6.
- 172. Nader S, Mastrobattista J. Recurrent hyperthyroidism in consecutive pregnancies characterized by hyperemesis. Thyroid. 1996;6(5):465-6.
- 173. Rodien P, Bremont C, Sanson ML, Parma J, Van Sande J, Costagliola S, et al. Familial gestational hyperthyroidism caused by a mutant thyrotropin receptor hypersensitive to human chorionic gonadotropin. N Engl J Med. 1998;339(25):1823-6.
- 174. Abalovich M, Amino N, Barbour LA, Cobin RH, De Groot LJ, Glinoer D, et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2007;92(8):S1-47.
- 175. Momotani N, Ito K. Treatment of pregnant patients with Basedow's disease. Exp Clin Endocrinol. 1991;97(2-3):268-74.
- 176. McKenzie JM, Zakarija M. Fetal and neonatal hyperthyroidism and hypothyroidism due to maternal TSH receptor antibodies. Thyroid. 1992;2(2):155-9.
- 177. Chan GW, Mandel SJ. Therapy insight: management of Graves' disease during pregnancy. Nat Clin Pract Endocrinol Metab. 2007;3(6):470-8.
- 178. Abalovich M, Amino N, Barbour LA, Cobin RH, De Groot LJ, Glinoer D, et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2007;92(8):S1-47.
- 179. Kempers MJ, van Tijn DA, van Trotsenburg AS, de Vijlder JJ, Wiedijk BM, Vulsma T. Central congenital hypothyroidism due to gestational hyperthyroidism: detection where prevention failed. J Clin Endocrinol Metab. 2003;88(12):5851-7.
- 180. Lee YS, Loke KY, Ng SC, Joseph R. Maternal thyrotoxicosis causing central hypothyroidism in infants. J Paediatr Child Health. 2002;38(2):206-8.
- 181. Mestman JH. Hyperthyroidism in pregnancy. Best Pract Res Clin Endocrinol Metab. 2004;18(2):267-88.
- 182. Bartalena L, Marcocci C, Bogazzi F, Manetti L, Tanda ML, Dell'Unto E, et al. Relation between therapy for hyperthyroidism and the course of Graves' ophthalmopathy. N Engl J Med. 1998;338(2):73-8.
- 183. Jarhult J, Rudberg C, Larsson E, Selvander H, Sjovall K, Winsa B, et al. Graves' disease with moderate-severe endocrine ophthalmopathy-long term results of a prospective, randomized study of total or subtotal thyroid resection. Thyroid. 2005;15(10):1157-64.
- 184. Wiersinga WM, Prummel MF. Graves' ophthalmopathy: a rational approach to treatment. Trends Endocrinol Metab. 2002;13(7):280-7.
- 185. Mourits MP, Prummel MF, Wiersinga WM, Koornneef L. Clinical activity score as a guide in the management of patients with Graves' ophthalmopathy. Clin Endocrinol (Oxf). 1997;47(1):9-14.
- 186. Bartalena L, Baldeschi L, Dickinson A, Eckstein A, Kendall-Taylor P, Marcocci C, et al. Consensus statement of the European Group on Graves' orbitopathy (EUGOGO) on management of GO. Eur J Endocrinol. 2008;158(3):273-85.
- 187. Acharya SH, Avenell A, Philip S, Burr J, Bevan JS, Abraham P. Radioiodine therapy (RAI) for Graves' disease (GD) and the effect on ophthalmopathy: a systematic review. Clin Endocrinol (Oxf). 2008;69(6):943-50.
- 188. Traisk F, Tallstedt L, Abraham-Nordling M, Andersson T, Berg G, Calissendorff J, et al. Thyroid-associated ophthalmopathy after treatment for Graves' hyperthyroidism with antithyroid drugs or iodine-131. J Clin Endocrinol Metab. 2009;94(10):3700-7.
- 189. Lai A, Sassi L, Compri E, Marino F, Sivelli P, Piantanida E, et al. Lower dose prednisone prevents radioiodine-associated exacerbation of initially mild or absent graves' orbitopathy: a retrospective cohort study. J Clin Endocrinol Metab. 2010;95(3):1333-7.
- 190. Tallstedt L, Lundell G, Torring O, Wallin G, Ljunggren JG, Blomgren H, et al. Occurrence of ophthalmopathy after treatment for Graves' hyperthyroidism. The Thyroid Study Group. N Engl J Med. 1992;326(26):1733-8.
- 191. Vannucchi G, Campi I, Covelli D, Dazzi D, Curro N, Simonetta S, et al. Graves' orbitopathy activation after radioactive iodine therapy with and without steroid prophylaxis. J Clin Endocrinol Metab. 2009;94(9):3381-6.
- 192. Witte J, Goretzki PE, Dotzenrath C, Simon D, Felis P, Neubauer M, et al. Surgery for Graves' disease: total versus subtotal thyroidectomy-results of a prospective randomized trial. World J Surg. 2000;24(11):1303-11.
- 193. DeGroot LJ. Radioiodine and the immune system. Thyroid. 1997;7(2):259-64.
- 194. Leo M, Marcocci C, Pinchera A, Nardi M, Megna L, Rocchi R, et al. Outcome of Graves' orbitopathy after total thyroid ablation and glucocorticoid treatment: follow-up of a randomized clinical trial. J Clin Endocrinol Metab. 2012;97(1):E44-8.
- 195. Azizi F, Ataie L, Hedayati M, Mehrabi Y, Sheikholeslami F. Effect of long-term continuous methimazole treatment of hyperthyroidism: comparison with radioiodine. Eur J Endocrinol. 2005;152(2):695-701.
- 196. Lawrence JE, Lamm SH, Braverman LE. The use of perchlorate for the prevention of thyrotoxicosis in patients given iodine rich contrast agents. J Endocrinol Invest. 1999;22(5):405-7.
- 197. Bogazzi F, Bartalena L, Gasperi M, Braverman LE, Martino E. The various effects of amiodarone on thyroid function. Thyroid. 2001;11(5)511-9.
- 198. Bartalena L, Brogioni S, Grasso L, Bogazzi F, Burelli A, Martino E. Treatment of amiodarone-induced thyrotoxicosis, a difficult challenge: results of a prospective study. J Clin Endocrinol Metab. 1996;81(8):2930-3.
- 199. Dickstein G, Shechner C, Adawi F, Kaplan J, Baron E, Ish-Shalom S. Lithium treatment in amiodarone-induced thyrotoxicosis. Am J Med. 1997;102(5):454-8.
- 200. Newman CM, Price A, Davies DW, Gray TA, Weetman AP. Amiodarone and the thyroid: a practical guide to the management of thyroid dysfunction induced by amiodarone therapy. Heart. 1998;79(2):121-7.
- 201. Koh LK, Greenspan FS, Yeo PP. Interferon-alfa induced thyroid dysfunction: three clinical presentation and a review of the literature. Thyroid. 1997;7(6):891-6.
- 202. Hamnvik OP, Larsen PR, Marqusee E. Thyroid dysfunction from antineoplastic agents. J Natl Cancer Inst. 2011;103(21):1572-87.
- 203. Pearce EN, Farwell AP, Braverman LE. Thyroiditis. N Engl J Med. 2003;348(26):2646-55.
- 204. Fatourechi V, Aniszewski JP, Fatourechi GZ, Atkinson EJ, Jacobsen SJ. Clinical features and outcome of subacute thyroiditis in an incidence cohort: Olmsted County, Minnesota, study. J Clin Endocrinol Metab. 2003;88(5):2100-5.
- 205. Pearce EN. Diagnosis and management of thyrotoxicosis. BMJ. 2006;332(7554):1369-73.
- 206. Chopra IJ, van Herle AJ, Korenman SG, Viosca S, Younai S. Use of sodium ipodate in management of hyperthyroidism in subacute thyroiditis. J Clin Endocrinol Metab. 1995;80(7):2178-80.
- 207. Socin HV, Chanson P, Delemer B, Tabarin A, Rohmer V, Mockel J, et al. The changing spectrum of TSH-secreting pituitary adenomas: diagnosis and management in 43 patients. Eur J Endocrinol. 2003;148(4):433-42.
- 208. Beck-Peccoz P, Brucker-Davis F, Persani L, Smallridge RC, Weintraub BD. Thyrotropin-secreting pituitary tumors. Endocr Rev. 1996;17(6):610-38.
- 209. Refetoff S, DeWind LT, DeGroot LJ. Familial syndrome combining deaf-mutism, stippled epiphyses, goiter and abnormally high PBI: possible target organ refractoriness to thyroid hormone. J Clin Endocrinol Metab. 1967;27(2):279-94.
- 210. Adams M, Matthews C, Collingwood TN, Tone Y, Beck-Peccoz P, Chatterjee KV. Genetic analysis of 29 kindreds with generalized and pituitary resistance to thyroid hormone. J Clin Invest. 1994;94(2):506-15.
- 211. Beck-Peccoz P, Chatterjee VK. The variable clinical phenotype in thyroid hormone resistance syndrome. Thyroid. 1994;4(1):225-32.
- 212. Weiss RE, Stein MA, Refetoff S. Behavioral effects of liothyronine (L-T3) in children with attention deficit hyperactivity disorder in the presence and absence of resistance to thyroid hormone. Thyroid. 1997;7(3):389-93.
- 213. Zakhem A, Aftimos G, Kreidy R, Salem P. Malignant struma ovarii: report of two cases and selected review of the literature. J Surg Oncol. 1990;43(1):61-5.
- 214. Ross DS. Syndromes of thyrotoxicosis with low radioactive iodine uptake. Endocrinol Metab Clin North Am. 1998;27(1):169-85.
- 215. Kung AW, Ma JT, Wang C, Young RT. Hyperthyroidism during pregnancy due to coexistence of struma ovarii and Graves' disease. Postgrad Med J. 1990;66(772):132-3.
- 216. Soutter WP, Green-Thompson RW. The management of choriocarcinoma causing severe hyperthyroidism. Br J Obstet Gynaecol. 1981;88(9):938-43.
- 217. Rajatanavin R, Chailurkit LO, Srisupandit S, Tungtrakuls S, Bunyaratvej S. Case reports: trophoblastic hyperthyroidism: clinical and biochemical features of five cases. Am J Med. 1988;85(2):237-41.
- 218. Giralt SA, Dexeus F, Amato R, Sella A, Logothetis C. Hyperthyroidism in men with germ cell tumors and high levels of beta-human chorionic gonadotropin. Cancer. 1992;69(5):1286-90.
- 219. Sichieri R, Andrade R, Baima J, Henriques J, Vaisman M. TSH levels associated with slimming pill use in a population-based study of Brazilian women. Arq Bras Endocrinol Metabol. 2007;51(9):1448-51.
- 220. Hedberg CW, Fishbein DB, Janssen RS, Meyers B, McMillen JM, MacDonald KL, et al. An outbreak of thyrotoxicosis caused by the consumption of bovine thyroid gland in ground beef. N Engl J Med. 1987;316(16):993-8.
- 221. Kasagi K, Takeuchi R, Miyamoto S, Misaki T, Inoue D, Shimazu A, et al. Metastatic thyroid cancer presenting as thyrotoxicosis: report of three cases. Clin Endocrinol (Oxf). 1994;40(3):429-34.
Correspondência para:
Datas de Publicação
-
Publicação nesta coleção
10 Maio 2013 -
Data do Fascículo
Abr 2013
Histórico
-
Recebido
19 Mar 2013 -
Aceito
19 Mar 2013