Resumos
Racional - Trabalhos recentes têm enfatizado os benefícios da imunonutrição com ácidos graxos ômega-3 (AGn-3) em diversas situações clínicas. O presente estudo apresenta os resultados da administração parenteral de diferentes emulsões lipídicas em colite aguda experimental e revê a literatura pertinente. Métodos - Setenta e quatro ratos Wistar machos adultos foram randomizados em seis grupos, cinco dos quais submetidos a indução de colite com ácido acético a 10%. Os ratos receberam dieta oral sem gorduras e água em gaiolas metabólicas individuais. Por cateter venoso central, infundiu-se (0,5 mL/hora) solução fisiológica aos grupos-controle CS (sem colite) e CC (com colite), enquanto os outros grupos receberam emulsões lipídicas específicas durante 7 dias. As razões entre n-3/n-6 e as composições lipídicas dos grupos foram: grupo L - 1:7,7 (TCL; n = 12), M - 1:7,0 (TCM/TCL; n = 12), LW-3 - 1:4,5 (TCL + FO; n = 12) e MW-3 - 1:3,0 (TCM/TCL + FO; n = 13). Compararam-se as alterações inflamatórias na cavidade abdominal, celularidade de macrófagos, alterações histológicas e concentrações de leucotrienos (LTB4 e C4), prostaglandina (PGE2) e tromboxane (TXB2) no cólon. Resultados - Somente os ratos que receberam ácidos graxos ômega-3 (LW-3 e MW-3) apresentaram menos alterações inflamatórias que o grupo com colite. A formação de úlceras da mucosa intestinal do grupo MW-3 equiparou-se ao grupo sem colite. Somente os grupos M e MW-3 apresentaram escores de celularidade de macrófagos inferiores ao grupo com colite. Em comparação ao grupo com colite, foram menores as concentrações de LTB4 dos grupos LW-3 e MW-3, de prostaglandina dos grupos M e MW-3 e de tromboxane do grupo MW-3. Não houve diferença quanto às médias de LTC4 entre os grupos. Conclusões - 1) Emulsões lipídicas contendo TCL com baixa razão n-3/n-6 não modifica as manifestações inflamatórias da colite; 2) a associação TCM/TCL e óleo de peixe com alta razão entre n-3/n-6 determina grande impacto benéfico, atenuando as conseqüências morfológicas e inflamatórias e diminuindo as concentrações teciduais de eicosanóides pró-inflamatórios.
Enteropatias inflamatórias; Colite ulcerativa; Lipídios; Ácidos graxos ômega-3; Mediadores da inflamação; Emulsões gordurosas endovenosas; Ratos Wistar
Background - Recent data have given emphasis to the benefits of immunonutrition with omega-3 fatty acids (n-3 FA) in various clinical situations. This work presents the results of parenteral administration of different lipid emulsions in experimental acute colitis and reviews the pertinent literature. Methods - Seventy-four adult male Wistar rats were randomized in six groups that had 10% acetic acid-induced colitis (except CS). During 7 days, control groups CS (without colitis) and CC (with colitis) received physiological solution and the others received specific lipid emulsion by a central venous catheter (0,5 mL/h). The n-3/n-6 FA ratio and lipidic compositions were: group L - 1:7,7 (LCT, n = 12), M - 1:7,0 (MCT and LCT, n = 12), LW-3 - 1:4,5 (LCT plus FO, n = 12) and MW-3 - 1:3,0 (MCT and LCT plus FO, n = 13). Rats were evaluated to assess abdominal and intestinal alterations, macrophage cellularity and colonic concentrations of LTB4, LTC4, PGE2 and TXB2. Results - N-3 FA treated rats (LW-3 and MW-3) presented less inflammatory abdominal alterations than CC rats. Mucosal ulcer formation in MW-3 group was the only comparable to CS group. Only CS, M and MW-3 rats presented smaller cellularity than CC group. Comparing to CC group, there were found smaller averages of LTB4 in CS, LW-3 and MW-3 groups, of PGE2 in CS, M and MW-3 groups, and of TXB2 in CS and MW-3 groups. LTC4 averages were not different. Conclusions - 1) LCT-containing lipid emulsion with low n-3/n-6 ratio do not modify inflammatory colitis derived manifestations; 2) the association of MCT/LCT-containing lipid emulsion with fish oil with high n-3/n-6 ratio impels great beneficial impact, attenuating morphological and inflammatory consequences and decreasing colonic concentrations of proinflammatory mediators.
Inflammatory bowel diseases; Colitis, ulcerative; Lipids; Fatty acids, omega-3; Inflammation mediators; Fat emulsion, intravenous; Rats, Wistar
ARTIGO ORIGINAL / ORIGINAL ARTICLE
IMUNONUTRIÇÃO EM COLITE EXPERIMENTAL: efeitos benéficos dos ácidos graxos ômega-3
Fábio Guilherme CAMPOS, Dan L. WAITZBERG, Angela Flávia LOGULO, Raquel Susana TORRINHAS, William Gemio Jacobsen TEIXEIRA e Angelita HABR-GAMA
RESUMO Racional Trabalhos recentes têm enfatizado os benefícios da imunonutrição com ácidos graxos ômega-3 (AGn-3) em diversas situações clínicas. O presente estudo apresenta os resultados da administração parenteral de diferentes emulsões lipídicas em colite aguda experimental e revê a literatura pertinente. Métodos - Setenta e quatro ratos Wistar machos adultos foram randomizados em seis grupos, cinco dos quais submetidos a indução de colite com ácido acético a 10%. Os ratos receberam dieta oral sem gorduras e água em gaiolas metabólicas individuais. Por cateter venoso central, infundiu-se (0,5 mL/hora) solução fisiológica aos grupos-controle CS (sem colite) e CC (com colite), enquanto os outros grupos receberam emulsões lipídicas específicas durante 7 dias. As razões entre n-3/n-6 e as composições lipídicas dos grupos foram: grupo L - 1:7,7 (TCL; n = 12), M - 1:7,0 (TCM/TCL; n = 12), LW-3 - 1:4,5 (TCL + FO; n = 12) e MW-3 - 1:3,0 (TCM/TCL + FO; n = 13). Compararam-se as alterações inflamatórias na cavidade abdominal, celularidade de macrófagos, alterações histológicas e concentrações de leucotrienos (LTB4 e C4), prostaglandina (PGE2) e tromboxane (TXB2) no cólon. Resultados - Somente os ratos que receberam ácidos graxos ômega-3 (LW-3 e MW-3) apresentaram menos alterações inflamatórias que o grupo com colite. A formação de úlceras da mucosa intestinal do grupo MW-3 equiparou-se ao grupo sem colite. Somente os grupos M e MW-3 apresentaram escores de celularidade de macrófagos inferiores ao grupo com colite. Em comparação ao grupo com colite, foram menores as concentrações de LTB4 dos grupos LW-3 e MW-3, de prostaglandina dos grupos M e MW-3 e de tromboxane do grupo MW-3. Não houve diferença quanto às médias de LTC4 entre os grupos. Conclusões - 1) Emulsões lipídicas contendo TCL com baixa razão n-3/n-6 não modifica as manifestações inflamatórias da colite; 2) a associação TCM/TCL e óleo de peixe com alta razão entre n-3/n-6 determina grande impacto benéfico, atenuando as conseqüências morfológicas e inflamatórias e diminuindo as concentrações teciduais de eicosanóides pró-inflamatórios.
DESCRITORES Enteropatias inflamatórias. Colite ulcerativa. Lipídios. Ácidos graxos ômega-3. Mediadores da inflamação. Emulsões gordurosas endovenosas. Ratos Wistar.
INTRODUÇÃO
As doenças inflamatórias intestinais (DII) são afecções de etiologia ainda não claramente definida e em cuja patogenia estão envolvidos fatores genéticos, ambientais e imunológicos(37, 38).
Drogas antiinflamatórias e imunossupressoras constituem a base do tratamento das DII(16, 45, 46). A terapia nutricional pode ser necessária em diferentes fases evolutivas da doença para recuperar o estado nutricional e/ou controlar doença ativa. Conseqüentemente, uma formulação racional de nutrientes deve incluir aqueles que forneçam calorias e modulem a inflamação, ao mesmo tempo em que despertem pouco estímulo antigênico(5, 6).
A eficácia de emulsões lipídicas (EL) está relacionada à proporção entre ácidos graxos poli-insaturados ômega-3 (AGn3) e ômega-6 (AGn6) e a dimensão da cadeia de triglicérides(8, 9). A competição entre AGn-3 e o ácido araquidônico (AGn-6) na via da 5-lipoxigenase suprime a formação dos mediadores pró-inflamatórios leucotrienos (da série quatro) e tromboxanes (da série dois) e favorece a produção das séries com menor potencial inflamatório (séries cinco e três)(3, 36). Os benefícios potenciais da suplementação com óleo de peixe têm sido reportados em diversos processos inflamatórios e imunológicos(1, 9, 32).
O objetivo deste trabalho foi estudar os efeitos da administração endovenosa de EL enriquecidas com AGn-3 em colite experimental aguda, avaliando-se as alterações histológicas e inflamatórias induzidas por variações na razão n-3/n-6 e na dimensão da cadeia de triglicérides.
MATERIAL E MÉTODOS
Setenta e quatro ratos Wistar, machos, adultos, com peso entre 200 e 220 gramas foram randomizados em seis grupos denominados conforme a solução injetada via retal e a infusão parenteral (Tabela 1). Os animais receberam dieta oral sem gorduras ad libitum e forammantidos em gaiolas metabólicas individuais.
No 1º dia cinco grupos de ratos receberam infusão endoanal de solução de ácido acético a 10% e um grupo sem colite (CS) recebeu solução salina conforme descrito por MacPHERSON e PFEIFER(27). Subseqüentemente, todos os animais receberam solução salina por cateter venoso central por 48 horas. Após este período, os animais controle CS e com colite (CC) receberam infusão endovenosa de solução salina e os grupos teste (L, M, LW-3 e MW-3) receberam emulsões lipídicas a 10%. Os volumes parenterais foram fornecidos por meio de bomba de infusão (0,5 mL por hora) durante 7 dias.
No 10º dia realizou-se laparotomia e as alterações inflamatórias (dilatação e espessamento da parede intestinal, aderências com intestino delgado ou com epíploon e mesenterite), eventualmente presentes, foram anotadas. Em seguida, todo o cólon foi ressecado para realização dos estudos propostos.
Fragmentos retirados de tecido inflamado no cólon esquerdo foram submetidos a análise histológica para verificar a presença de úlceras. A celularidade de macrófagos foi determinada por análise imunohistoquímica com a técnica APAAP(33) (alkaline phosphatase anti-alkaline phosphatase). Esta celularidade foi apresentada em índices calculados de inflamação que variaram de 5 a 10 (Tabela 2).
As concentrações teciduais de de leucotrienos (LTB4 e LTC4), prostaglandinas (PGE2) e tromboxane (TXB2) foram determinadas por radioimunoensaio(35) .
Os resultados foram submetidos a análise estatística apropriada na dependência das característica da variável estudada.
RESULTADOS
Os resultados das diversas variáveis estudadas são apresentados nas Tabelas 3, 4, 5.
Os ratos que receberam suplementação com AGn-3 (LW-3 e MW-3) apresentaram menos alterações inflamatórias na cavidade abdominal (médias de 1,1 e 0,9) que o grupo CC (2,7) (P <0,05). Quanto à preservação da integridade mucosa, a ausência de úlceras em 10 ratos grupo MW-3 foi a única comparável ao grupo controle sem colite (CS 12 ratos) (P >0,05).
Somente os ratos M (7,1) e MW-3 (6,8) tiveram menor celularidade de macrófagos em relação a CC (9,0) (P <0,05).
Em comparação ao grupo CC, encontraram-se médias menores de LTB4 (341,4) nos ratos LW-3 (41,4) e MW-3 (83,9), de PGE2 (7660,0) nos grupos M (2148,6) e MW-3 (2235,8), e de TXB2 (6416,4) no grupo MW-3 (709,4). As médias de LTC4 não diferiram entre os grupos (P >0,05).
DISCUSSÃO
Modelos experimentais de colite têm sido largamente utilizados para estudar a patogênese e tratamento das DII(38). A colite induzida por enema de ácido acético em animais de pequeno porte é método simples, barato e reproduzível(5, 27, 29, 30), apresentando similaridades com DII em humanos quanto a aspectos histológicos e metabólicos relacionados ao ácido araquidônico(26, 40). No presente estudo, os grupos não-tratados (CS e CC) apresentaram diferenças em quase todas as variáveis estudadas, indicando que a inflamação induzida pelo ácido acético foi efetiva aos propósitos deste trabalho.
À laparotomia, observaram-se menos alterações inflamatórias nos grupos do presente estudo que receberam Agn-3 (LW-3 e MW-3), sugerindo que essas emulsões lipídicas (EL) reduzem as conseqüências e a intensidade do processo inflamatório intestinal. INUI et al.(19, 20) também observaram menor espessamento da parede intestinal de ratos com colite experimental tratados por 7 dias com nutrição parenteral associada à EL rica em AGn3.
Da mesma forma, a preservação da estrutura morfológica com o uso de EL com AGn-3 também foi demonstrada em estudos experimentais(20,28, 42) e clínicos(43). Na presente investigação, constatou-se, à avaliação histológica, que os ratos tratados com TCM/TCL + óleo de peixe (MW-3) apresentaram maior proteção contra o desenvolvimento de lesões morfológicas graves, com menor formação de úlceras.
Quanto ao processo inflamatório da mucosa intestinal determinado pelos macrófagos (MØ) intestinais, os índices de inflamação dos grupos M e MW-3 foram os únicos menores que do grupo CC, indicando que as EL com TCM/TCL determinaram processo inflamatório menos intenso, com menor recrutamento de MØ. Dados da literatura indicam que fórmulas ricas em TCL n-6 têm efeitos imunossupressores, determinando inibição das funções de células inflamatórias e imunológicas(7, 9), afetando a síntese de eicosanóides e citocinas e resultando em maior dano tecidual(47). Além disso, a maior proporção de AGn-3 no grupo MW-3 pode modificar a síntese de mediadores da inflamação, estimulando mecanismos de defesa celular e resultando em menos quimiotaxia e aderência celular(8, 13, 31, 32) .
Níveis séricos e teciduais elevados de LT (B4, C4), PG (E2, F2a, F1) e TX (B2) foram encontrados em pacientes com DII e em modelos de colite experimental, onde a concentração desses mediadores pode estar até 50 vezes aumentada em relação à dos controles(22, 23, 41).
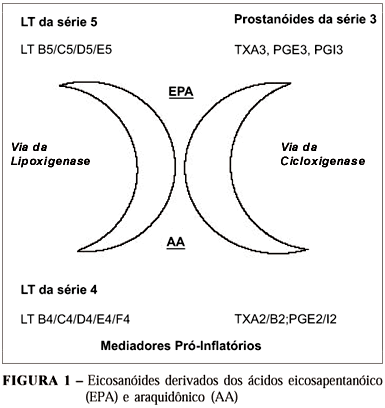
A suplementação com AGn-3 cria uma competição entre o ácido eicosapentaenóico (EPA) e ácido araquidônico (AA) como precursores da síntese de eicosanóides (Figura 1). Esta competição favorece a síntese de PG e LT das séries 3 e 5, respectivamente, em detrimento de PG e TX da série 2 e LT da série 4(39) . Na presente investigação, a provisão de AGn-3 reduziu as concentrações de LTB4 na mucosa, em comparação com os outros grupos, não se encontrando diferença quanto aos valores de LTC4. Redução dos níveis teciduais de LTB4 associada à provisão de AGn-3 foi reportada em pacientes com DII(14, 43) e em animais de laboratório(15, 33) .
Na presente série, somente os grupos M e MW-3 apresentaram baixos níveis de PGE2, em comparação ao grupo CC. A ausência de diferença entre LW-3 e CC provavelmente se deve à presença de TCM nos grupos MW-3 e M e a maior razão n-3/n-6 no grupo MW-3. Observou-se, também, redução na concentração de TXB2 no grupo MW-3, resultado semelhante a observações prévias com provisão enteral(4) ou parenteral(48) de AGn-3.
Nas DII, estudos iniciais sobre a suplementação oral com AGn3 por longos períodos obtiveram resultados contraditórios quanto à efetividade e remissão prolongada(2, 11, 24, 25). Ao mesmo tempo, estudos experimentais relataram melhora do padrão histológico, manutenção da permeabilidade intestinal e redução tecidual de mediadores derivados do ácido araquidônico(15, 28, 33, 42) .
Por outro lado, dados sobre a administração parenteral mostram que esta via determina incorporação mais rápida(14), sugerindo que a infusão endovenosa permita um efeito farmacológico mais imediato que atenda às necessidades metabólicas em diferentes situações clínicas(17, 32, 44). Esta vantagem levanta a possibilidade de se obter modulação mais efetiva com a via parenteral no manuseio da inflamação aguda, mesmo em tratamentos de curta duração.
IKEHATA et al.(18) reportaram aumento da relação LTB5/LTB4 após infusão de 0,6 g de EPA por 2 semanas. GRIMMINGER et al.(14) relataram redução da atividade de colite ulcerativa em mulher de 36 anos após 9 dias de tratamento com EL endovenosa (200-300 mL/dia), contendo 4,2 g EPA e 4,2 g de DHA durante surto agudo. Trabalhos experimentais(19, 20) reportaram ganho de peso, melhora histológica, aumento da relação EPA/AA e supressão da produção de LTB4 em ratos com colite por TNBS tratados com NPT rica em ácido alphalinolênico como fonte de AGn3.
Os efeitos moduladores podem variar na dependência do balanceamento entre as proporções de AG n3/n-6(12, 13, 17). Em pacientes submetidos a grandes operações abdominais e nos internados em terapia intensiva, demonstrou-se que a relação 1:2 entre n-3/n-6 determinou a maior relação LTC5/LTC4(13, 32). Hoje se reconhece que proporções de 1:2 até 1:4 estão associadas a vantagens farmacológicas mais evidentes e menor efeito imunossupressivo(8, 21) .
No presente estudo, a maior proporção entre AG n-3 e n-6 dentre as diferentes EL fornecidas foi a do grupo MW-3 (1: 3,0). Nessas condições, não foi surpresa observar que esses ratos tenham apresentado resultados mais consistentes na modulação da inflamação intestinal aguda neste modelo experimental.
Dessa maneira, este trabalho e a revisão da literatura pertinente sugerem que o manuseio da inflamação intestinal com nutrientes imunomoduladores apresenta perspectivas interessantes e promissoras. Os dados iniciais sugerem que a provisão parenteral de AGn-3 seria indicação melhor nas colites agudas do que o suprimento enteral para impedir a reativação de doença quiescente.
Apesar disso, novos estudos prospectivos, randomizados e controlados são necessários para avaliar outras variáveis como a dimensão da cadeia de triglicérides, a duração do tratamento, diferentes proporções entre AGn-3 e n-6 e a associação com outros nutrientes com propriedades imunomoduladoras.
CONCLUSÕES
Nas condições da presente investigação experimental, pode-se concluir que EL contendo TCL com baixa proporção n-3/n-6 não modifica as manifestações inflamatórias da colite. Por outro lado, EL formada pela associação de TCM/TCL e óleo de peixe com razão n-3/n-6 de 1:3 determina grande impacto benéfico, atenuando as conseqüências morfológicas e inflamatórias e diminuindo as concentrações teciduais de eicosanóides pró-inflamatórios.
AGRADECIMENTOS
Os autores gostariam de registrar seu mais profundo agradecimento à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), pelo auxílio na execução deste trabalho (processo nº 97 / 07971-7) e às pessoas que colaboraram no seu desenvolvimento: aos Médicos-Residentes Caio Plopper e Ricardo Terra; ao acadêmico de Medicina Daniel Andrade, ao Dr Celso Cukier e à Profa. Dra. Magaly Gemio Teixeira.
Campos FG, Waitzberg DL, Logulo AF, Torrinhas RS, Teixeira WGJ, Habr-Gama A. Immunonutrition in experimental colitis: beneficial effects of omega-3 fatty acids. Arq Gastroenterol 2002;39(1):48-54.
ABSTRACT Background Recent data have given emphasis to the benefits of immunonutrition with omega-3 fatty acids (n-3 FA) in various clinical situations. This work presents the results of parenteral administration of different lipid emulsions in experimental acute colitis and reviews the pertinent literature. Methods - Seventy-four adult male Wistar rats were randomized in six groups that had 10% acetic acid-induced colitis (except CS). During 7 days, control groups CS (without colitis) and CC (with colitis) received physiological solution and the others received specific lipid emulsion by a central venous catheter (0,5 mL/h). The n-3/n-6 FA ratio and lipidic compositions were: group L - 1:7,7 (LCT, n = 12), M - 1:7,0 (MCT and LCT, n = 12), LW-3 - 1:4,5 (LCT plus FO, n = 12) and MW-3 - 1:3,0 (MCT and LCT plus FO, n = 13). Rats were evaluated to assess abdominal and intestinal alterations, macrophage cellularity and colonic concentrations of LTB4, LTC4, PGE2 and TXB2. Results - N-3 FA treated rats (LW-3 and MW-3) presented less inflammatory abdominal alterations than CC rats. Mucosal ulcer formation in MW-3 group was the only comparable to CS group. Only CS, M and MW-3 rats presented smaller cellularity than CC group. Comparing to CC group, there were found smaller averages of LTB4 in CS, LW-3 and MW-3 groups, of PGE2 in CS, M and MW-3 groups, and of TXB2 in CS and MW-3 groups. LTC4 averages were not different. Conclusions - 1) LCT-containing lipid emulsion with low n-3/n-6 ratio do not modify inflammatory colitis derived manifestations; 2) the association of MCT/LCT-containing lipid emulsion with fish oil with high n-3/n-6 ratio impels great beneficial impact, attenuating morphological and inflammatory consequences and decreasing colonic concentrations of proinflammatory mediators.
HEADINGS Inflammatory bowel diseases. Colitis, ulcerative. Lipids. Fatty acids, omega-3. Inflammation mediators. Fat emulsion, intravenous. Rats, Wistar.
Recebido em 6/3/2001.
Aprovado em 16/8/2001.
Departamento de Gastroenterologia da Faculdade de Medicina da Universidade de São Paulo - Laboratório de Metabologia e Nutrição em Cirurgia. Disciplina de Coloproctologia da Faculdade de Medicina da Universidade de São Paulo.
Endereço para correspondência: Dr. Fábio Guilherme Campos - Alameda Jau, 1477 apto 111-A - 01420-002 - São Paulo, SP. e-mail: fgmcampos@terra.com.br
- 1. Alexander JW. Immunonutrition: the role of w3 fatty acids. Nutrition 1998;14:627-33.
- 2. Aslan AMD, Triadafilopoulos GMD. Fish oil fatty acid supplementation in active ulcerative colitis: a double-blind, placebo-controlled, crossover study. Am J Gastroenterol 1992;87:432-7.
- 3. Calder PC. Immunomodulatory and the anti-inflamatory effects of n-e polyunsaturated fatty acids. Proc Nutr Soc 1996;55:737-74.
- 4. Campbell JM, Fahey GC, Lichtensteiger CA, Demichele SJ, Garleb KA. An enteral formula containing fish oil, indigestible oligosaccharides, gum arabic and antioxidants affects plasma and colonic phospholipid fatty acid and prostaglandin profiles in pigs. J Nutr 1997;127:137-45.
- 5. Campos FG, Waitzberg DL, Plopper C, Terra RM, Habr-Gama A. Ácidos graxos de cadeia curta e doenças colo-retais. Rev Bras Nutr Clin 1998;13:276-85.
- 6. Carpentier YA, Simoens C, Siderova V, Vanweyenberg V, Eggerickx D, Deckelbaum RJ. Recent developments in lipid emulsions: relevance to intensive care. Nutrition 1997;13 Suppl:73-8.
- 7. Cukier C, Waitzberg DL, Soares SR, Logullo AF, Bacchi CE, Travassos VH, Saldiva PH, Torrinhas RS, Oliveira TS. Effect of glucidic and fat total parenteral nutrition on macrophage phagocytosis in rats. Rev Hosp Clin Fac Med São Paulo 1997;52:239-45.
- 8. Fürst P. New parenteral substrates in clinical nutrition. Part II. New substrates in lipid nutrition. Eur J Clin Nutr 1994;48:681-91.
- 9. Fürst P, Kuhn KS. Fish oil emulsions: what benefits can they bring? Clin Nutr 2000;19:7-14.
- 10. Gelas P, Cotte L, Poitevin-Later F, Pichard C, Leverve X, Barnoud D, Leclercq P, Touraine-Moulin F, Trépo C, Boulétreau P. Effect of parenteral medium- and long- chain triglycerides on lymphocytes subpopulations and functions in patients with acquired immunodeficiency syndrome: a prospective study. JPEN J Parenter Enteral Nutr 1998;22:67-71.
- 11. Greenfield SM, Green AT, Teare JP, Jenkins AP, Punchard NA, Ainley CC, Thompson RP. A randomized controlled study of evening primrose oil and fish oil in ulcerative colitis. Aliment Pharmacol Ther 1993;7:159-66.
- 12. Grimm H, Tibell A, Norrlind B, Blecher C, Wilker S, Schwemmle K. Immunoregulation by parenteral lipids: impact of the n-3 to n-6 fatty acid ratio. JPEN J Parent Enteral Nutr 1994;18:417-42.
- 13. Grimm H, Schott J, Schwemmle K. Development of an immuno-neutral lipid emulsion for optimal postoperative management of intensive care patients. Langenbecks Arch Chir Kongressbd 1998;115:599-604.
- 14. Grimminger F, Führer D, Papavassilis C, Schlotzer E, Mayer K, Heuer K, Kiss L, Walmrath D, Kramer HJ, Seeger W. Influence of intravenous n-3 lipid supplementation on fatty acids profiles and lipid mediator generation in patients with severe ulcerative colitis. Eur J Clin Invest 1993;23:706-15.
- 15. Guarner F, Vilaseca J, Malagelada JR. Dietary manipulation in experimental inflammatory bowel disease. Agents Actions 1992;Spec No:C-104.
- 16. Habr-Gama A. Retocolite ulcerativa. In: Pinotti HW, editor. Tratado de clínica cirúrgica. São Paulo, Atheneu, 1994. p. 1169-84.
- 17. Hayashi N, Tashiro T, Yamamori H, Takagi K, Morishima Y, Otsubo Y, Sugiura T, Furukawa K, Nitta H, Nakajima N, Suzuki N, Ito I. Effect of intravenous w-6 and w-3 fat emulsion on nitrogen retention and protein kinetics in burned rats. Nutrition 1999;15:135-9.
- 18. Ikehata A, Hiwatashi N, Kinouchi Y, Yamazaki H, Kumagai Y, Ito K, Kayaba Y, Toyota T. Effect of intravenously infused eicosapentaenoic acid on the leukotriene generation in patients with active Crohn's disease. Am J Clin Nutr 1992;56:938-42.
- 19. Inui K, Fukuta Y, Ikeda A, Kameda H, Kokuba Y, Sato M. The effect of alpha-linolenic acid-rich emulsion on fatty acid metabolism and leukotriene generation of the colon in a rat model with inflammatory bowel disease. Ann Nutr Metab 1996;40:175-82.
- 20. Inui K, Fukuta Y, Kameda H, Kokuba Y, Sato M. The nutrition effect of a-linolenic acid-rich emulsion with total parenteral nutrition in a rat model with inflammatory bowel disease. Ann Nutr Metab 1996;40:227-33.
- 21. Kinsella JE. Lipids, membrane receptors and enzymes: effects of dietary fatty acids. JPEN J Parent Enteral Nutr 1990;14 Suppl:200.
- 22. Lauritsen K, Laursen LS, Bukhave K, Rask-Madsen J. Effects of sulphasalazine and disodium azodisalicylate on colonic PGE2 concentrations determined by equilibrium in vivo dialysis of faeces in patients with ulcerative colitis and health controls. Gut 1984;25:1271-8.
- 23. Lauritsen K, Laursen LS, Bukhave K, Rask-Madsen J. Effect of topical 5-aminosalicylic acid (5-ASA) and prednisone on prostaglandin (PGE2) and leukotriene (LTB4) levels determined by equilibrium in vivo dialysis of rectum in relapsing ulcerative colitis. Gastroenterology 1986;91:837-44.
- 24. Loeschke K, Ueberschaer B, Pietsch A, Gruber E, Ewe K, Wiebecke B, Heldwein W, Lorenz R. N-3 fatty acids only delay early relapse of ulcerative colitis in remission. Dig Dis Sci 1996;41:2087-94.
- 25. Lorenz-Meyer H, Bauer P, Nicolay C, Schulz B, Purrmann J, Fleig WE, Scheurlen C, Koop I, Pudel V, Carr L. Omega-3 fatty acids and low carbohydrate diet for maintenance of remission in Crohn's disease. A randomized controlled multicenter trial. Scand J Gastroenterol 1996;31:778-85.
- 26. Lowe VC, Noronha-Blob L. The leucocyte recruitment inhibitor, NPC 15669 accelerates healing in acetic acid-induced colitis. Agents Actions 1993;39:80-2.
- 27. MacPherson BR, Pfeiffer CJ. Experimental production of diffuse colitis in rats. Digestion 1978;17:135-50.
- 28. Marotta F, Chui DH, Safran P, Rezakovic I, Zhong GG, Ideo G. Shark fin enriched diet prevents mucosal lipid abnormalities in experimental acute colitis. Digestion 1995;56:46-51.
- 29. Moraes RS. Indução da colite difusa pela instilação de ácido acético via retal: estudo experimental em ratos Sprague-Dawley [dissertação]. Curitiba: Universidade Federal do Paraná; 1987.
- 30. Moraes RS. Aspectos morfológicos da colite induzida pelo ácido acético a 10% e tratada com enemas de ácido 5-amino-2-hidroxibenzóico. Estudo experimental em ratos Sprague-Dawley [tese]. São Paulo: Escola Paulista de Medicina; 1989.
- 31. Morlion BJ, Torwesten E, Lessire A, Peskar BM, Fürst P, Puchstein C. The effect of parenteral fish oil on leukocyte membrane fatty acid composition and leukotriene synthesizing capacity in postoperative trauma. Metabolism 1996;45:1208-13.
- 32. Morlion BJ, Torwesten E, Wrenger K, Puchstein C, Fürst P. What is the optimum w-3 to w-6 fatty acid ratio of parenteral lipid emulsions in postoperative trauma? Clin Nutr 1997;16:49.
- 33. Nieto N, Fernandez MI, Torres MI, Rios A, Suarez MD, Gil A. Dietary monounsaturated n-3 and n-6 long-chain polyunsaturated fatty acids affected cellular antioxidant defense system in rats with experimental ulcerative colitis induced by trinitrobenzene sulfonic acid. Dig Dis Sci 1998;43:2676-87.
- 34. Noronha IL, Niemier Z, Ritz E, Waldherr R. Expression of cytokines and growth factors in renal diseases. Nephrol Dial Transplant 1995;10:775-86.
- 35. Pradelles P, Grassi J, MacLouf J. Enzyme immunoassays of eicosanoids using acetylcholine esterase as label: an alternative to radioimmunoassay. Anal Chem 1985;57:1170-3.
- 36. Roper RL, Phipps RP. Prostaglandin E2 regulation of the immune response. Adv Prostaglandin Thromboxane Leukot Res 1994;22:101-11.
- 37. Rutgeerts P. Medical therapy of inflammatory bowel disease. Digestion 1998;59:453-69.
- 38. Sartor RB. Pathogenesis and immune mechanisms of chronic inflammatory bowel diseases. Am J Gastroenterol 1997;92:5S-11S.
- 39. Schmidt EB, Dyerberg J. Omega-3 fatty acids. Current status in cardiovascular medicine. Drugs 1994;47:405-24.
- 40. Sharon P, Stenson WF. Enhanced synthesis of leukotriene B4 by colonic mucosa in inflammatory bowel disease. Gastroenterology 1984;86:453-60.
- 41. Sharon P, Stenson WF. Metabolism of arachidonic acid in acetic acid colitis in rats: similarity to human inflammatory bowel disease. Gastroenterology 1985;88:55-63.
- 42. Shoda R, Matsueda K, Yamato S, Umeda N. Therapeutic efficacy of N-3 polyunsaturated fatty acid in experimental Crohn's disease. J Gastroenterol 1995;30 Suppl 8:98-101.
- 43. Stenson WF, Cort D, Rodgers J, Burakoff R, DeSchryver-Kecskemeti K, Gramlich TL, Beeken W. Dietary supplementation with fish oil in ulcerative colitis. Ann Intern Med 1992;116:609-14.
- 44. Tashiro T, Yamamori H, Hayashi N, Sugiura T, Takagi K, Furukawa K, Nakajima N, Itoh I, Wakabayashi T, Ohba S, Akahane N. Effects of a newly developed fat emulsion containing eicosapentaenoic acid and docosahexaenoic acid on fatty acid profiles in rats. Nutrition 1998;14:372-5.
- 45. Teixeira MG, Habr-Gama A, Alcântara RSM, Brunetti-Netto C, Pinotti HW. Doença de Crohn: resultado do tratamento clínico em 121 pacientes. Rev Bras Coloproctol 1993;3:94-9.
- 46. Teixeira MG, Habr-Gama A, Takiguti C, Calache JE, Teixeira WG, Pinotti HW. Colonic Crohn's disease: results of treatment. Rev Hosp Clin Fac Med São Paulo 1998;53:61-7.
- 47. Ulrich H, Pastores SM, Katz DP, Kvetan V. Parenteral use of medium-chain triglycerides: a reappraisal. Nutrition 1996;12:231-8.
- 48. Yeh SL, Chang KY, Huamg PC, Chen WJ. Effects of n-3 and n-6 fatty acids on plasma eicosanoids and liver antioxidant enzymes in rats receiving total parenteral nutrition. Nutrition 1997;13:32-6.
Datas de Publicação
-
Publicação nesta coleção
10 Fev 2003 -
Data do Fascículo
Mar 2002
Histórico
-
Aceito
16 Ago 2001 -
Recebido
06 Mar 2001