Resumos
OBJETIVO: Analisar a disfunção hormonal pré-operatória, clínica e/ou laboratorial, das lesões intracranianas não hipofisárias da linha média e região peri-selar. MÉTODO: Foram analisados 44 pacientes com lesões intracranianas não hipofisárias, com exames de imagem (tomografia computadorizada ou ressonância magnética) e dosagens hormonais basais; 16 tinham provas de função hipotálamo-hipofisária (megateste) pré-operatórios. Esses pacientes foram divididos em dois grupos: Grupo I - 34 lesões da linha média: 11 craniofaringiomas, 8 meningiomas, 3 germinomas, 3 tumores do seio esfenoidal, 2 síndromes sela vazia, 2 astrocitomas pilocíticos, 1 aneurisma gigante, 2 mucoceles, 1 divertículo do III ventrículo e 1 cisto da bolsa de Rathke; Grupo II - 10 lesões da região peri-selar: 9 meningiomas e 1 aneurisma gigante. RESULTADOS: No grupo I, 25/34 (73,5%) pacientes apresentavam déficit hormonal laboratorial (14 sem clínica evidente), 18/34 (52,9%) hiperprolactinemia (apenas 5 com galactorréia) e, dos 15 megatestes realizados nesse grupo, 8 (53,3%) mostraram deficiência do hormônio de crescimento (GH); 3 (8,8 %) pacientes apresentaram diabetes insipidus central (DIC) pré-operatório. No grupo II, 6/10 (60%) pacientes apresentavam déficit hormonal laboratorial (5 sem clínica evidente), 1/10 (10%) hiperprolactinemia e 1 deficiência de GH (único megateste feito nesse grupo); nenhum paciente apresentou DIC pré-operatório. CONCLUSÃO: A presença de manifestações clínicas inespecíficas ou pouco valorizadas não indica ausência de disfunção hormonal laboratorial; na presente série, 19/38 (50%) pacientes com alterações laboratoriais, não apresentavam manifestações clínicas. Disfunção hormonal é frequente em lesões não hipofisárias selares e peri-selares, especialmente, aquelas envolvendo a linha média.
tumores intracranianos; lesões selares e periselares; disfunção hormonal
OBJECTIVE: To analyse clinical and/or laboratorial preoperative hormonal dysfunction , of the nonpituitary intracranial lesions from midline and parasellar area. METHOD: Forty-four patients were evaluated with nonpituitary intracranial lesions, who had images studies (computed tomography or magnetic resonance) and preoperative basal hormonal level; 16 had preoperative hypothalamus-hypophysial function tests (megatests). These patients were divided in two groups. Group I - 34 lesions from midline: 11 craniopharyngiomas, 8 meningiomas, 3 germinomas, 3 tumors of sphenoid sinus, 2 empty sella syndrome, 2 pylocitic astrocytomas, 1 giant aneurysm, 2 mucoceles, 1 III ventricle diverticulum and 1 Rathke's cleft cyst; Group II - 10 lesions from parasellar area: 9 meningiomas and 1 giant aneurysm. RESULTS: In group I, 25/34 (73.5%) patients showed laboratorial hormonal deficit (14 without clinical manifestations) 18/34 (52.9%) hyperprolactinemia (5 with galactorreia) and 8 (53.3%) showed growth hormone deficiency in 15 megatests avaliable in this group; 3 (8.8 %) patients presented central diabetes insipidus (CDI). In group II, 6/10 (60%) patients showed laboratorial hormonal deficit (5 without clinical manifestations), 1 (10%) hyperprolactinemia and 1 growth hormone deficiency (single megatest realized in this group); no patient had preoperative CID. CONCLUSIONS: The presence of nonspecific or poorly valorized clinical manifestations, does not indicate absence of hormonal dysfunction; in this present serie, 19/38 (50%) patients with laboratorial abnormalities, didn't show clinical manifestations. Hormonal dysfunction is frequent in sellar and perisellar nonpituitary lesions, specially involving midline.
intracranial tumor; sellar and juxtasellar lesions; hormonal dysfunction
DISFUNÇÃO HORMONAL EM LESÕES NÃO HIPOFISÁRIAS DAS REGIÕES SELAR E PERISELAR
Ana Luíza Vidal Fonseca11Serviço de Neurocirurgia HUCFF, FM, UFRJ; Hospital Universitário Clementino Fraga Filho (HUCFF), Universidade Federal do Rio de Janeiro (UFRJ), Faculdade de Medicina (FM), Rio de Janeiro RJ, Brasil: Serviço de Neurocirurgia HUCFF, FM, UFRJ; 2Residente do Serviço de Neurocirurgia do HUCFF; 3Coordenador Adjunto da Pós-Graduação em Endocrinologia, FM-UFRJ, Chefe de Serviço da Endocrinologia, HUCFF e Pesquisador do CNPq; 4Professora Adjunta da Disciplina de Endocrinologia, FM-UFRJ; 5Professora Titular e Chefe de Departamento de Patologia, FM-UFRJ; 6Chefe Médico do Laboratório de Hormônios, HUCFF. , Antonio A.D. Souto11Serviço de Neurocirurgia HUCFF, FM, UFRJ; Hospital Universitário Clementino Fraga Filho (HUCFF), Universidade Federal do Rio de Janeiro (UFRJ), Faculdade de Medicina (FM), Rio de Janeiro RJ, Brasil: Serviço de Neurocirurgia HUCFF, FM, UFRJ; 2Residente do Serviço de Neurocirurgia do HUCFF; 3Coordenador Adjunto da Pós-Graduação em Endocrinologia, FM-UFRJ, Chefe de Serviço da Endocrinologia, HUCFF e Pesquisador do CNPq; 4Professora Adjunta da Disciplina de Endocrinologia, FM-UFRJ; 5Professora Titular e Chefe de Departamento de Patologia, FM-UFRJ; 6Chefe Médico do Laboratório de Hormônios, HUCFF. ,Flavio Domingues21Serviço de Neurocirurgia HUCFF, FM, UFRJ; Hospital Universitário Clementino Fraga Filho (HUCFF), Universidade Federal do Rio de Janeiro (UFRJ), Faculdade de Medicina (FM), Rio de Janeiro RJ, Brasil: Serviço de Neurocirurgia HUCFF, FM, UFRJ; 2Residente do Serviço de Neurocirurgia do HUCFF; 3Coordenador Adjunto da Pós-Graduação em Endocrinologia, FM-UFRJ, Chefe de Serviço da Endocrinologia, HUCFF e Pesquisador do CNPq; 4Professora Adjunta da Disciplina de Endocrinologia, FM-UFRJ; 5Professora Titular e Chefe de Departamento de Patologia, FM-UFRJ; 6Chefe Médico do Laboratório de Hormônios, HUCFF. ,Mario Vaisman31Serviço de Neurocirurgia HUCFF, FM, UFRJ; Hospital Universitário Clementino Fraga Filho (HUCFF), Universidade Federal do Rio de Janeiro (UFRJ), Faculdade de Medicina (FM), Rio de Janeiro RJ, Brasil: Serviço de Neurocirurgia HUCFF, FM, UFRJ; 2Residente do Serviço de Neurocirurgia do HUCFF; 3Coordenador Adjunto da Pós-Graduação em Endocrinologia, FM-UFRJ, Chefe de Serviço da Endocrinologia, HUCFF e Pesquisador do CNPq; 4Professora Adjunta da Disciplina de Endocrinologia, FM-UFRJ; 5Professora Titular e Chefe de Departamento de Patologia, FM-UFRJ; 6Chefe Médico do Laboratório de Hormônios, HUCFF. , Monica R. Gadelha41Serviço de Neurocirurgia HUCFF, FM, UFRJ; Hospital Universitário Clementino Fraga Filho (HUCFF), Universidade Federal do Rio de Janeiro (UFRJ), Faculdade de Medicina (FM), Rio de Janeiro RJ, Brasil: Serviço de Neurocirurgia HUCFF, FM, UFRJ; 2Residente do Serviço de Neurocirurgia do HUCFF; 3Coordenador Adjunto da Pós-Graduação em Endocrinologia, FM-UFRJ, Chefe de Serviço da Endocrinologia, HUCFF e Pesquisador do CNPq; 4Professora Adjunta da Disciplina de Endocrinologia, FM-UFRJ; 5Professora Titular e Chefe de Departamento de Patologia, FM-UFRJ; 6Chefe Médico do Laboratório de Hormônios, HUCFF. , Leila Chimelli51Serviço de Neurocirurgia HUCFF, FM, UFRJ; Hospital Universitário Clementino Fraga Filho (HUCFF), Universidade Federal do Rio de Janeiro (UFRJ), Faculdade de Medicina (FM), Rio de Janeiro RJ, Brasil: Serviço de Neurocirurgia HUCFF, FM, UFRJ; 2Residente do Serviço de Neurocirurgia do HUCFF; 3Coordenador Adjunto da Pós-Graduação em Endocrinologia, FM-UFRJ, Chefe de Serviço da Endocrinologia, HUCFF e Pesquisador do CNPq; 4Professora Adjunta da Disciplina de Endocrinologia, FM-UFRJ; 5Professora Titular e Chefe de Departamento de Patologia, FM-UFRJ; 6Chefe Médico do Laboratório de Hormônios, HUCFF. , Mario José C.F. Santos61Serviço de Neurocirurgia HUCFF, FM, UFRJ; Hospital Universitário Clementino Fraga Filho (HUCFF), Universidade Federal do Rio de Janeiro (UFRJ), Faculdade de Medicina (FM), Rio de Janeiro RJ, Brasil: Serviço de Neurocirurgia HUCFF, FM, UFRJ; 2Residente do Serviço de Neurocirurgia do HUCFF; 3Coordenador Adjunto da Pós-Graduação em Endocrinologia, FM-UFRJ, Chefe de Serviço da Endocrinologia, HUCFF e Pesquisador do CNPq; 4Professora Adjunta da Disciplina de Endocrinologia, FM-UFRJ; 5Professora Titular e Chefe de Departamento de Patologia, FM-UFRJ; 6Chefe Médico do Laboratório de Hormônios, HUCFF. ,Alice Helena D. Violante41Serviço de Neurocirurgia HUCFF, FM, UFRJ; Hospital Universitário Clementino Fraga Filho (HUCFF), Universidade Federal do Rio de Janeiro (UFRJ), Faculdade de Medicina (FM), Rio de Janeiro RJ, Brasil: Serviço de Neurocirurgia HUCFF, FM, UFRJ; 2Residente do Serviço de Neurocirurgia do HUCFF; 3Coordenador Adjunto da Pós-Graduação em Endocrinologia, FM-UFRJ, Chefe de Serviço da Endocrinologia, HUCFF e Pesquisador do CNPq; 4Professora Adjunta da Disciplina de Endocrinologia, FM-UFRJ; 5Professora Titular e Chefe de Departamento de Patologia, FM-UFRJ; 6Chefe Médico do Laboratório de Hormônios, HUCFF.
RESUMO - Objetivo: Analisar a disfunção hormonal pré-operatória, clínica e/ou laboratorial, das lesões intracranianas não hipofisárias da linha média e região peri-selar. Método: Foram analisados 44 pacientes com lesões intracranianas não hipofisárias, com exames de imagem (tomografia computadorizada ou ressonância magnética) e dosagens hormonais basais; 16 tinham provas de função hipotálamo-hipofisária (megateste) pré-operatórios. Esses pacientes foram divididos em dois grupos: Grupo I - 34 lesões da linha média: 11 craniofaringiomas, 8 meningiomas, 3 germinomas, 3 tumores do seio esfenoidal, 2 síndromes sela vazia, 2 astrocitomas pilocíticos, 1 aneurisma gigante, 2 mucoceles, 1 divertículo do III ventrículo e 1 cisto da bolsa de Rathke; Grupo II 10 lesões da região peri-selar: 9 meningiomas e 1 aneurisma gigante. Resultados: No grupo I, 25/34 (73,5%) pacientes apresentavam déficit hormonal laboratorial (14 sem clínica evidente), 18/34 (52,9%) hiperprolactinemia (apenas 5 com galactorréia) e, dos 15 megatestes realizados nesse grupo, 8 (53,3%) mostraram deficiência do hormônio de crescimento (GH); 3 (8,8 %) pacientes apresentaram diabetes insipidus central (DIC) pré-operatório. No grupo II, 6/10 (60%) pacientes apresentavam déficit hormonal laboratorial (5 sem clínica evidente), 1/10 (10%) hiperprolactinemia e 1 deficiência de GH (único megateste feito nesse grupo); nenhum paciente apresentou DIC pré-operatório. Conclusão: A presença de manifestações clínicas inespecíficas ou pouco valorizadas não indica ausência de disfunção hormonal laboratorial; na presente série, 19/38 (50%) pacientes com alterações laboratoriais, não apresentavam manifestações clínicas. Disfunção hormonal é frequente em lesões não hipofisárias selares e peri-selares, especialmente, aquelas envolvendo a linha média.
PALAVRAS-CHAVE: tumores intracranianos, lesões selares e periselares, disfunção hormonal.
Hormonal dysfunction of nonpituitary lesions from midline and perisellar area
ABSTRACT - Objective: To analyse clinical and/or laboratorial preoperative hormonal dysfunction , of the nonpituitary intracranial lesions from midline and parasellar area. Method: Forty-four patients were evaluated with nonpituitary intracranial lesions, who had images studies (computed tomography or magnetic resonance) and preoperative basal hormonal level; 16 had preoperative hypothalamus-hypophysial function tests (megatests). These patients were divided in two groups. Group I - 34 lesions from midline: 11 craniopharyngiomas, 8 meningiomas, 3 germinomas, 3 tumors of sphenoid sinus, 2 empty sella syndrome, 2 pylocitic astrocytomas, 1 giant aneurysm, 2 mucoceles, 1 III ventricle diverticulum and 1 Rathke's cleft cyst; Group II - 10 lesions from parasellar area: 9 meningiomas and 1 giant aneurysm. Results: In group I, 25/34 (73.5%) patients showed laboratorial hormonal deficit (14 without clinical manifestations) 18/34 (52.9%) hyperprolactinemia (5 with galactorreia) and 8 (53.3%) showed growth hormone deficiency in 15 megatests avaliable in this group; 3 (8.8 %) patients presented central diabetes insipidus (CDI). In group II, 6/10 (60%) patients showed laboratorial hormonal deficit (5 without clinical manifestations), 1 (10%) hyperprolactinemia and 1 growth hormone deficiency (single megatest realized in this group); no patient had preoperative CID. Conclusions: The presence of nonspecific or poorly valorized clinical manifestations, does not indicate absence of hormonal dysfunction; in this present serie, 19/38 (50%) patients with laboratorial abnormalities, didn't show clinical manifestations. Hormonal dysfunction is frequent in sellar and perisellar nonpituitary lesions, specially involving midline.
KEY WORDS: intracranial tumor, sellar and juxtasellar lesions, hormonal dysfunction.
Tem sido demonstrado, em grandes séries cirúrgicas, que as regiões selar e peri-selar podem ser acometidas por diversas lesões neoplásicas e não neoplásicas (congênitas ou do desenvolvimento, infecção, inflamação, cisto, trauma); apenas 9% não têm origem hipofisária1-5. O grau de disfunção endócrina é variável, incluindo hiperprolactinemia, hipopituitarismo (parcial ou total) e/ou diabetes insipidus central. Algumas lesões não apresentam alteração hormonal (laboratorial e clínica)1,5.
Analisamos retrospectivamente as lesões não hipofisárias da região selar e/ou peri-selar, tratadas no Hospital Universitário Clementino Fraga Filho (HUCFF), quanto aos sinais, sintomas, resultados laboratoriais hormonais e de imagem.
MÉTODO
Foram estudados 44 pacientes do HUCFF com lesões intracranianas não hipofisárias, das regiões selar e/ou peri-selar entre 1985 e 2000. Eles foram divididos em dois grupos: grupo I com 34 lesões da linha média e grupo II com 10 lesões da região para-selar. Todos foram submetidos à cirurgia, exceto dois pacientes com síndrome de sela vazia.
Todos tiveram avaliação clínica e dosagens hormonais basais: PRL (prolactina), GH (hormônio do crescimento), LH (hormônio luteinizante), FSH (hormônio folículo-estimulante), TSH (hormônio tireotrófico), cortisol, hormônios tireoidianos, estradiol em mulheres e testosterona em homens. Durante os 15 anos de investigação, os níveis basais de normalidade dos hormônios variaram com os diversos kits de reagentes utilizados e por isso a análise foi qualitativa e não quantitativa.
Dos 44 pacientes, 16 fizeram teste de função integrada hipotálamo-hipofisária (megateste):
a) estímulo de LH e FSH com 100 µg endovenosa de LHRH (hormônio liberador de gonadotropinas), amostras de sangue colhidas 30, 60 e 90 minutos após a injeção (resposta normal se houver, no mínimo, um pico do dobro do basal para o LH aos 30', sendo que a resposta do FSH é mais lenta variando de 50-200% do valor basal);
b) estímulo de TSH e PRL com 200 µg endovenosa de TRH (hormônio liberador de TSH), amostras de sangue colhidas 30, 60 e 90 minutos após a injeção (resposta normal - aumento de 2-3 vezes do valor basal da PRL e pico de TSH precoce, 20-30'após a injeção, seguido de queda gradativa);
c) estímulo do cortisol e GH com hipoglicemia induzida por 0,05 a 0,1 UI/kg de insulina regular endovenosas com amostras de sangue colhidas 30, 60 e 90 minutos após a injeção; o teste é considerado válido se há hipoglicemia clínica ou laboratorial (glicemia £ 40 mg/dl); resposta normal do GH- se atingir pico acima de 5 ng/ml em qualquer amostra; resposta normal do cortisol aumento de 7 µg/dl do valor basal ou > 17 µg/dl em qualquer tempo).
Todos fizeram tomografia computadorizada (TC) pré e pós-operatórias e 11 ressonância magnética (RM).
RESULTADOS
Dos 44 pacientes, 28 (63,6%) pertenciam ao sexo feminino (22 do grupo I e 6 do grupo II) e 16 (36,4%) ao masculino (12 do grupo I e 4 do grupo II). A idade variou entre 6 e 79 anos (média 48); 23 pacientes tinham mais de 45 anos.
Doenças ou condições associadas ocorreram em 29 (65,9%) pacientes: hipertensão arterial (15), acidente vascular encefálico (3), cardiopatia (2), diabetes mellitus (2), etilismo (2), câncer de próstata (2), traumatismo craniencefálico (2), doença de Addison (1), uso de drogas (1), meningite (1), doença vestibular (1), espondiloartrose (1), anemia falciforme (1). Três pacientes tinham 1 ou mais processos expansivos intracranianos associados, incluindo germinoma da pineal (1), neurofibromatose (1), meningiomas múltiplos (1).
Houve 6 óbitos no pós operatório, quatro no grupo I e dois no grupo II. As causas dos óbitos incluíram: cardiopatia (2), lesão vascular (1), complicação anestésica (1), septicemia por infecção pulmonar (1), progressão tumoral (1).
A média de idade foi menor no grupo I que no grupo II (37,4 X 59 anos, respectivamente). Disfunção visual ocorreu em 35 pacientes: 25 no grupo I e 10 no grupo II. Distúrbio hormonal ocorreu em 31 pacientes: 25 do grupo I e 6 do grupo II (Tabela 1).
Grupo I - lesões da linha média
Foi o grupo mais heterogêneo, com 34 lesões: craniofaringiomas (11), meningiomas (8), germinomas (3), tumores do seio esfenoidal (3), síndrome de sela vazia (2), mucocele (2), astrocitoma pilocítico (2), aneurisma gigante (1), divertículo do III ventrículo (1) e cisto da bolsa de Rathke (1).
Vinte e cinco (73,5%) desenvolveram algum tipo de disfunção visual: hemianopsia uni ou bilateral (10), diminuição da acuidade visual uni ou bilateral (7), amaurose unilateral (6) ou bilateral (1) e quadrantanopsia (1).
Outras alterações neurológicas incluíram: distúrbio de um dos nervos oculomotores (5), convulsão (3), sonolência (2), distúrbio de comportamento (1), desorientação (1), síndrome de Foster Kennedy (1), disfonia (1) e anosmia (1).
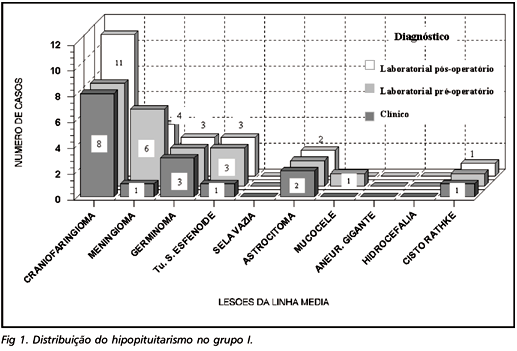
Déficit hormonal ocorreu em 25 (73,5%) pacientes: 25 gonadal, 17 tireóideo e 16 adrenal (Fig 1). Os tumores que causaram disfunção foram craniofaringiomas (8/11), meningiomas (6/8), germinomas (3/3), tumor de seio esfenóide (3/3), astrocitoma (2/2), mucocele (1/2) e cisto de Rathke (1/1). Dos 25 casos de hipopituitarismo, 14 (56%) não apresentavam maior expressão clínica.
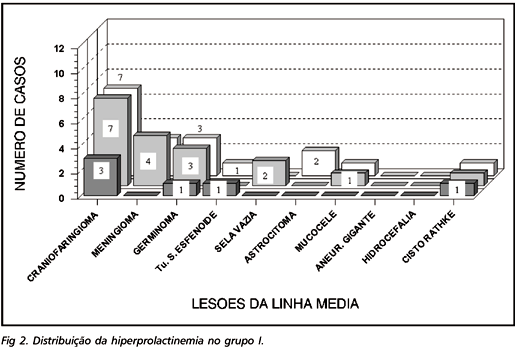
Os níveis de prolactina (PRL) variaram de 3,7 a 194,0 ng/ml. Hiperprolactinemia ocorreu em 18 (52,9%) pacientes (apenas 5 apresentaram galactorréia) (Fig 2). O hormônio do crescimento apresentou resposta diminuída em 8 dos 15 (53,3%) megatestes realizados nesse grupo.
Somente 4 (11,7 %) apresentaram diabetes insipidus central (DIC) pré-operatório; 16/32 (50%) desenvolveram DIC no pós-operatório (transitório em14).
Grupo II - lesões peri-selares
Foi o grupo mais homogêneo, com 10 lesões: 9 meningiomas e 1 aneurisma gigante. Todos desenvolveram disfunção visual: diminuição da acuidade visual uni ou bilateral (6), amaurose unilateral (2) ou bilateral (1), hemianopsia (1). Todos apresentavam alteração de um dos nervos cranianos que passam pelo seio cavernoso (III, IV, VI e as duas primeiras divisões do V); outras alterações neurológicas incluíram: convulsão (1), alteração da marcha (1), distúrbio da memória (1) e diminuição da acuidade auditiva (1).
Déficit hormonal se desenvolveu em 6 (60%) pacientes (6 gonadal, 5 tireóideo e 4 adrenal), sendo que 5 (83,3%) deles sem maior expressão clínica. O único submetido ao megateste apresentou diminuição da resposta do GH.
Nesse grupo, os níveis de PRL variaram de 8,2 a 43,9 ng/ml sendo que hiperprolactinemia leve ocorreu em 4 pacientes (40%). Nenhum desenvolveu DIC pré-operatório.
DISCUSSÃO
A sela turca reúne estruturas anatômicas de origens diversas e restos embriônicos, sequestrados da vizinhança, justificando o amplo espectro de neoplasias (Tabela 2)1-24. Freda, em 1999, publicou uma série de 1120 cirurgias transesfenoidais, sendo que 9% dos pacientes apresentavam lesões não hipofisárias1.
Tanto lesões hipofisárias, como não hipofisárias podem causar disfunção neuroendócrina2,5. De forma geral, essas lesões apresentam quadro clínico variável: 1. distúrbios endócrinos devido a hipersecreção hormonal (tumores hipotalâmicos e hiperprolactinemia da síndrome de secção da haste) ou insuficiência hipofisária secundária a compressão da hipófise, haste e/ou hipotálamo; 2. distúrbios neurológicos e/ou oftalmológicos devido ao efeito de massa ou hemorragia intratumoral; 3. hipertensão intracraniana devido a crescimento tumoral direto e/ou compressão do III ventrículo, resultando em hidrocefalia; 4. assintomáticas (achados de imagem ou autopsia)5,6.
A causa mais comum de hipopituitarismo (2/3) são tumores hipotálamo-hipofisários devido a compressão tumoral e/ou tratamento (cirurgia, quimioterapia e/ou radioterapia)11,16. O hipopituitarismo pode ser parcial ou total dependendo do volume tumoral, da reserva funcional hipofisária e da localização diferente de cada tipo de célula adeno-hipofisária. Nishioka et al e Vance mostraram que o eixo mais acometido é o do GH, seguido por FSH/LH, TSH e ACTH5,18.
Alterações hormonais pré-operatórias se não forem identificadas e corrigidas, podem aumentar a morbidade e mortalidade desses pacientes no per e pós-operatórios. A deficiência do setor cortisol, se não corrigido, resulta em falha de resposta ao estresse cirúrgico e/ou infecção, podendo resultar em hipotensão, choque e óbito. A deficiência do setor tireóideo, resulta em falta de resposta adequada aos medicamentos utilizados no procedimento anestésico e pós-operatório, graças ao hipometabolismo16.
Quando as alterações neurológicas são mais evidentes do que as endócrinas, os pacientes com lesões não hipofisárias, inicialmente, são avaliados por neurocirurgiões. Isso ocorre, especialmente, para massas com epicentro para-selar e lesões vasculares. Disfunções hormonais podem ser discretas ou confundidas com alterações do sistema nervoso ou próprias da idade11,16. No presente estudo, a maioria dos pacientes foi avaliada inicialmente pela neurocirurgia. Dezenove dos 31 pacientes com anormalidades laboratoriais pré-operatórias, não apresentavam expressão evidente de disfunção hormonal ou não foram valorizadas.
É esperado, em crianças pré-púberes, caracteres sexuais não desenvolvidos, ausência de vida sexual ou de ciclo menstrual e, em idosos, disfunção sexual e/ou falha do ciclo menstrual. Essas características podem subvalorizar ou mascarar distúrbios do setor gonadal. Na presente série, 31 pacientes apresentaram disfunção laboratorial do eixo gonadal (25 do grupo I e 6 do grupo II): por deficiência das gonadotrofinas ou por hiperprolactinemia. Em 20 pacientes, a idade e doenças co-existentes, mascararam os sintomas do eixo gonadal.
Meningiomas são tumores mais freqüentes em mulheres pós menopausa, que fisiologicamente apresentam níveis elevados de LH e FSH (insuficiência gonadal primária)1, 5 No grupo II a idade mediana foi alta (59 anos) e 9/10 lesões eram meningiomas. Isso pode ter contribuído para pouco distúrbio hormonal, pois o setor gonadal (o segundo mais afetado) ficou influenciado pelo aumento fisiológico das gonadotrofinas. Além disso, nesse grupo, apenas um paciente fez megateste.
Crianças são mais propensas a apresentarem craniofaringiomas ou germinomas. Portanto, disfunção gonadal é menos evidente clinicamente, exceto se alcançaram a idade puberal e adolescência1,2. Na casuística apresentada, dos 11 craniofaringiomas e 3 germinomas, apenas dois tinham menos de 15 anos (1 em idade puberal e 1 pré-puberal) - o diagnóstico de disfunção gonadal no paciente de 6 anos, só foi feito laboratorialmente. O setor mais comumente afetado (GH), em crianças é a baixa estatura, o que não ocorre com adultos. Nesses últimos, deficiência de GH tem sido ligada a piora da memória, habilidade motora, capacidade de percepção, QI e níveis de ansiedade mais altos. Porém, esses sintomas são também encontrados em lesões expansivas intracranianas. Por causa dos valores normais de GH serem numericamente pequenos (até 5 ng/ml), o déficit de GH só poderá ser valorizado, após teste de estímulo5. Dos 16 megatestes realizados, a resposta estava diminuída em 9 (56,3%).
Alguns sinais e sintomas de hipofunção do eixo tireoidiano (bradipsiquismo, astenia, palidez, ganho de peso) podem ser confundidos com aqueles decorrentes de hipertensão intracraniana, lesão de centros hipotalâmicos (temperatura, saciedade) ou suas conexões com os sistemas reticular e límbico (alterações da vigília e do humor respectivamente)1,5,14. Na casuística aqui apresentada, dos 22 pacientes com disfunção laboratorial do setor tireóideo, apenas 6 tiveram suspeita clínica. Alguns sintomas de hipofunção do eixo adrenal (lipotímia, mal estar, fadiga, anorexia, náuseas, vômitos) também podem ser confundidos com alterações neurológicas secundárias a hipertensão intracraniana1,5,14. A série presente mostrou 20 casos de alteração laboratorial do cortisol e apenas 3 foram suspeitados clinicamente.
Hipopituitarismo não ocorreu em pacientes do grupo I com síndrome de sela vazia, mucocele (2/3), aneurisma gigante e hidrocefalia, apesar de descritos na literatura. O grupo II, mais homogêneo, mostrou que um meningioma e o único aneurisma gigante do grupo não apresentaram hipopituitarismo e 6 meningiomas causaram hipopituitarismo leve (1 ou 2 eixos). Isso pode ser indicativo que lesões de menor densidade, curso mais lento e fora da linha média causariam menor disfunção hormonal. Porém, o número de casos foi pequeno para significância estatística.
Efeito de secção da haste é o termo usado para compressão ou distorção do infundíbulo, haste ou vasos portais por lesões expansivas, infiltrativas ou inflamatórias das regiões selar e peri-selar. Ele prejudica o transporte da dopamina para os lactotrofos normais e resulta em hiperprolactinemia leve a moderada (<200 ng/ml)25-27. Entretanto, Smith e Lawscolocaram em dúvida o efeito de secção da haste e hipotetizaram que o fator mais provável fosse o aumento da pressão intra-selar26. Eles estudaram imagem (RM) de 44 pacientes com massas não secretoras de prolactina e não encontraram correlação entre tamanho tumoral ou desvio da haste com os níveis de prolactina.
A hiperprolactinemia altera a secreção pulsátil das gonadotrofinas, interfere no feedback de esteróides sexuais a nível hipotalâmico e inibe a esteroidogênese gonadal, além de estimular a síntese e secreção de androgênio adrenal28-30. No estudo presente, 21/44 pacientes apresentaram hiperprolactinemia (4 do grupo II), sendo o nível mais elevado 194 ng/ml.
Têm sido descrito, na literatura2,12, casos de microprolactinoma associada a craniofaringioma ou a mucocele, assim como prolactinomas ectópicos (seio cavernoso ou supra-selares) que radiologicamente simulam outros tumores. Sabe-se que microprolactinoma causa hiperprolactinemia menor que 200 ng/ml, nível similar às lesões não hipofisárias. Apesar de raros, esses casos podem mascarar a interpretação laboratorial ou radiológica pré-operatórias.
Na atual casuística não houve massas intracranianas associadas, exceto em um paciente com germinoma duplo (pineal e selar). A título de informação, foi incluído no protocolo inicial (excluído posteriormente), um tumor de seio cavernoso, cuja imagem mimetizou meningioma; o nível de prolactina pré-operatório foi 1555,0 ng/ml e a imunohistoquímica confirmou adenoma secretor de PRL. Durante a coleta de dados, foi tratado, cirurgicamente, um paciente com mucocele cujo nível de PRL pré-operatória era excessivamente alta (540 ng/ml); por sugerir a presença de um microprolactinoma associado (não visualizado na imagem pré-operatória) foi excluído desse estudo.
Tem sido descrito com finalidade de diagnóstico diferencial, que DIC pré-operatória é mais frequente em lesões não hipofisárias da linha média do que hipofisárias (5%)16. Surpreendentemente, DIC pré-operatória ocorreu em apenas 3 dos 34 pacientes do grupo I e, como esperado, em nenhum caso do grupo II.
CONCLUSÃO
Na região selar, 90% das lesões operadas têm origem hipofisária, enquanto na região peri-selar predominam as não hipofisárias. Ambas podem comprometer o eixo hipotálamo-hipofisário. Alterações hormonais pré-operatórias não corrigidas, aumentam a morbidade e mortalidade per e pós-operatórias. No atual estudo, apesar da casuística pequena e heterogênea, a avaliação da função adeno-hipofisária permitiu identificar: 1. disfunção hormonal em pacientes assintomáticosou sintomas não valorizados pelos cirurgiões ou pelo próprio paciente; 2. adenomas hipofisários ectópicos simulando outro tumor, radiologicamente; 3. lesões mistas, como descrito na literatura, na qual um dos componentes seja hipersecretor hormonal (craniofaringioma + prolactinoma; mucocele + prolactinoma; neuroblastoma/adenoma, gangliocito-adenoma) 4. lesões para-selares com disfunção hormonal pré-operatória (reavaliação hormonal e acompanhamento endocrinológico pós-operatórios).
Recebido 5 Março 2001, recebido na forma final 14 Julho 2001. Aceito 24 Julho 2001.
Dra. Ana Luiza Vidal Fonseca - Serviço Neurocirurgia UFRJ - Av. Trompowsky s/n sala 17-E - 21941-590 Rio de Janeiro RJ Brasil.
- 1. Abe T, Ludecke D. Mucocele-like formation leading to neurological symptoms in prolactin-secreting pituitary adenoma under dopamine agonist therapy. Surg Neurol 1999;52:274-279.
- 2. Arafah BM, Prunty D, Ybarra J, Hlavin ML, Selman WR. The dominant role of increased intrasellar pressure in the pathogenesis of hypopituitarism, hyperprolactinemia, and headaches in patients with pituitary adenomas. J Clin Endocrinol Metab 2000;85:1789-1793.
- 3. Ashkan K, Papadopoulos MC, Casey AT, et al. Sellar tuberculoma: report of two cases. Acta Neurochir (Wien) 1997;139:523-525.
- 4. Benvenga S, Campenní A, Ruggeri RM, Trimarchi F. Clinical review 113: Hypopituitarism secondary to head trauma. J Clin Endocrinol Metab 2000;85:1353-1361.
- 5. Cho DY, Wang YC, Ho WL. Primary intrasellar mixed germ-cell tumor with precocious puberty and diabetes insipidus. Childs Nerv Syst 1997;13:42-46.
- 6. Civit T, Pinelli C, Klein M, Auque J, Baylac F, Hepner H. Intrasellar schwannoma. Acta Neurochir (Wien) 1997;139:160-161.
- 7. Cusimano MD, Kovacs K, Bilbao JM, Tucker WS, Singer W. Suprasellar craniopharyngioma associated with hiperprolactinemia, pituitary lactotroph hyperplasia and microprolactinoma. J Neurosurg 1998;69:620-623.
- 8. Donovan JL, Nesbit GM. Distinction of masses involving the sella and suprasellar space: specificity of imaging features. Am J Roentgenol 1996;167:597-603.
- 9. FitzPatrick M, Tartaglino LM, Hollander MD, Zimmerman RA, Flanders AE. Imaging of sellar and parasellar pathology. Radiol Clin N Am 1999;37:101-121.
- 10. Freda PU, Wardlaw SL, Post KD. Unysual cases of sellar/parasellar masses in large transsphenoidal surgical series. J Clin Endocrinol Metab 1996;81:3455-3459.
- 11. Freda PU, Post KD. Advances in pituitary tumor therapy - Differential diagnosis of sellar masses. Endocrinol Metab Clin N Am 1999;28:81-117.
- 12. Glass GE, Peters CJ, Nolte KB. Pituitary hemorrhage as a complication of hantaviral disease AJNR 1995;16:179-180.
- 13. Gottfredsson M, Oury TD, Bernstein C, Carpenter C, Bartlett JA. Lymphoma of the pituitary gland: an unusual presentation of central nervous system lymphoma in AIDS. Am J Med 1996;101:563-564.
- 14. Hampton TA, Scheitauer BW, Rojiani AM, Kovacs K, Horvath E, Vogts P. Salivary gland-like tumors of sellar region. Am J Surg Pathol 1997;21:424-434.
- 15. Khawali C, Silva MRD, Faiçal S. Hypothalamic diabetes insipidus and panhypopituitarism due to langerhans cell histiocytosis in an adult. Endocrinologist 1999;9:61-63.
- 16. Krisht AF, Tindall GT. Pituitary disorders: comprehensive management. Baltimore: Lippincott Williams & Wilkins:1999:99-118.
- 17. Lees PD, Pickard JD. Hyperprolactinemia, intrasellar pituitary tissue pressure, and the pituitary stalk compression syndrome. J Neurosurg 1987;67:192-196.
- 18. Nagatani T, Shibuya M, Suzuki Y, Saito K, Yoshida J. Suprasellar ectopic pituitary adenoma. Acta Neurochir (Wien) 1997;139:94-95.
- 19. Nishioka H, Ito H, Haraoka J, Akada K. Immature teratoma originating from the pituitary gland: case report. Neurosurgery 1999;44:644-648.
- 20. Nomikos P, Buchfelder M, Fahlbusch R. Intra- and suprasellar colloid cysts. Pituitary 1999;2:123-126.
- 21. Osborn AG, Tong KA. Handbook of neuroradiology: brain and skull. 2.Ed. St Louis: Mosby 1996:604-614.
- 22. Petrossians P, Delvenne P, Flandory P, Jopart P, Stevenaert A, Beckers A. An unusual pituitary pathology. J Clin Endocrinol Metab 1998; 83:3454-3548.
- 23. Sahjpaul RL, Lee DH. Infratentorial subdural empyema, pituitary abscess, and septic cavernous sinus thrombophlebitis secondary to paranasal sinusitis: case report. Neurosurgery 1999;44:864-868.
- 24. Sato N, Putman CM, Chaloupka JC, Glenn BJ, Vinuela F, Sze G. Pituitary gland enlargement secondary to dural arteriovenous fistula in the cavernous sinus: appearance at MR imaging. Radiology 1997;203:263-267.
- 25. Scheithauer BW, Parameswaran A, Burdick B. Intrasellar paraganglioma report of a case in a sibship of von hippel-lindau disease. Neurosurgery 1996;38:395-399.
- 26. Smith MV, Laws ER Jr. Magnetic resonance imaging measurements of pituitary stalk compression and deviation in patients with nonprolactin-secreting intrasellar and parasellar tumors: lack of correlation with serum prolactin levels. Neurosurgery 1994;34:834-839.
- 27. Takahata-T, Katayama-Y, Tsubokawa-T, Oshima-H, Yoshino-A Ectopic pituitary adenoma occurring in the interpeduncular cistern: case report. J Neurosurg 1995;83:1092-1094.
- 28. Thodou E, Kontogeorgos G, Scheithauer BW, et al. Intrasellar chordomas mimicking pituitary adenoma. J Neurosurg 2000; 92:976-982.
- 29. Tsetis D, Bhattacharya J, Cavenagh J, Thakkar CH. CT and MRI demonstration of hypothalamic and infundibular relapse in childhood acute lymphoblastic leukaemia. Br J Radiol 1996;69:269-271.
- 30. Vance ML. Hypopituitarism. N Engl J of Med 1994;330:1651-1662.
Datas de Publicação
-
Publicação nesta coleção
28 Nov 2001 -
Data do Fascículo
Dez 2001
Histórico
-
Aceito
24 Jul 2001 -
Revisado
14 Jul 2001 -
Recebido
05 Mar 2001