Resumos
OBJETIVOS: Este modelo experimental foi desenvolvido para analisar os efeitos da restrição nutricional e da hiperoxia, durante 11 dias, sobre o peso e a morfometria pulmonares, em coelhos prematuros. MÉTODOS: Após cesárea, coelhos New Zealand White com idade gestacional de 28 dias foram randomizados nos seguintes grupos: dieta controle e ar ambiente, dieta controle e hiperoxia (> 95% O2), restrição nutricional e ar ambiente e restrição nutricional e hiperoxia (>95% O2). A restrição nutricional foi obtida com uma redução em 30% de todos os nutrientes da dieta controle. As lâminas de pulmão foram coradas com hematoxilina-eosina, resorcina-orceína modificada e picrosírius, sendo posteriormente realizada a análise morfométrica RESULTADOS: Observou-se um menor ganho de peso no grupo restrição nutricional e hiperoxia (p < 0,001) a partir do quarto dia e, no grupo restrição nutricional e ar ambiente (p < 0,001), a partir do sexto dia de vida, em relação aos respectivos grupos controles. A restrição nutricional reduziu o número de alvéolos (p < 0,001) e o depósito de colágeno (p < 0,001). A hiperoxia produziu uma redução do número de alvéolos (p < 0,001) e do depósito de colágeno (p < 0,001), além de maiores intercepto linear médio (p < 0,05) e espessamento de septos inter-alveolares (p < 0,001). A restrição nutricional associada à hiperoxia intensificou a redução do número de alvéolos (p < 0,001) e do depósito de colágeno (p < 0,001). CONCLUSÕES: A restrição nutricional intensificou as alterações morfométricas pulmonares produzidas pela hiperoxia, especialmente em relação à alveolização e depósito de colágeno.
Restrição nutricional; hiperoxia; desenvolvimento pulmonar; coelhos prematuros
OBJECTIVES: To analyze the effects of nutritional restriction and hyperoxia on lung weight and pulmonary morphometry in premature rabbits during the first 11 days of life METHODS: New Zealand White rabbits were delivered by C-section at 28 days' gestational age and randomized into four groups: control diet and room air, control diet and hyperoxia (> 95% O2), nutritional restriction and room air and nutritional restriction and hyperoxia (> 95% O2). Nutritional restriction was achieved by reducing all nutrients by 30% in comparison with the control diet. Lung tissue slides were stained with hematoxylin-eosin, modified resorcin-orcein and picrosirius, before morphometric analysis was performed. RESULTS: From the fourth day onwards, less weight was gained by the nutritional restriction and hyperoxia group (p < 0.001) and from the sixth day on, by the nutritional restriction and room air group (p < 0.001), in comparison with their respective control groups. Nutritional restriction decreased alveoli number (p < 0.001) and collagen deposition (p < 0.001). Hyperoxia was responsible for reductions in number of alveoli (p < 0.001) and collagen deposition (p < 0.001), in addition to higher mean linear intercept values (p < 0.05) and thickening of alveolar septa (p < 0.001). When nutritional restriction was associated with hyperoxia, the reductions in number of alveoli (p < 0.001) and of collagen deposition (p < 0.001) intensified. CONCLUSIONS: Nutritional restriction intensified the changes of pulmonary architecture findings caused by hyperoxia, in particular through alterations to alveolarization and collagen deposition.
Nutritional restriction; hyperoxia; lung development; premature rabbits
ARTIGO ORIGINAL
Respostas pulmonares à restrição nutricional e à hiperoxia em coelhos prematuros
Marta M. G. B. MatalounI; Celso M. RebelloII; Renata S. MascarettiIII; Marisa DohlnikoffIV; Cléa R. LeoneV
IDoutora, Unidade de Pesquisa Experimental - Pediatria Neonatal, Departamento de Pediatria, Faculdade de Medicina, Universidade de São Paulo (FMUSP), São Paulo, SP
IIDoutor, Unidade de Pesquisa Experimental - Pediatria Neonatal, Departamento de Pediatria, FMUSP, São Paulo, SP
IIIDoutora, Unidade de Pesquisa Experimental - Pediatria Neonatal, Departamento de Pediatria, FMUSP, São Paulo, SP
IVDoutora, Departamento de Patologia, FMUSP, São Paulo, SP
VLivre-docente, Professora associada, Pediatria Neonatal, Departamento de Pediatria, FMUSP, São Paulo, SP
Correspondência Correspondência: Marta M. G. B. Mataloun Rua Antônio Júlio dos Santos, 524/33 CEP 05661-020 - São Paulo, SP Tel.: (11) 3742.1042 E-mail: mataloun@uol.com.br
RESUMO
OBJETIVOS: Este modelo experimental foi desenvolvido para analisar os efeitos da restrição nutricional e da hiperoxia, durante 11 dias, sobre o peso e a morfometria pulmonares, em coelhos prematuros.
MÉTODOS: Após cesárea, coelhos New Zealand White com idade gestacional de 28 dias foram randomizados nos seguintes grupos: dieta controle e ar ambiente, dieta controle e hiperoxia (> 95% O2), restrição nutricional e ar ambiente e restrição nutricional e hiperoxia (>95% O2). A restrição nutricional foi obtida com uma redução em 30% de todos os nutrientes da dieta controle. As lâminas de pulmão foram coradas com hematoxilina-eosina, resorcina-orceína modificada e picrosírius, sendo posteriormente realizada a análise morfométrica
RESULTADOS: Observou-se um menor ganho de peso no grupo restrição nutricional e hiperoxia (p < 0,001) a partir do quarto dia e, no grupo restrição nutricional e ar ambiente (p < 0,001), a partir do sexto dia de vida, em relação aos respectivos grupos controles. A restrição nutricional reduziu o número de alvéolos (p < 0,001) e o depósito de colágeno (p < 0,001). A hiperoxia produziu uma redução do número de alvéolos (p < 0,001) e do depósito de colágeno (p < 0,001), além de maiores intercepto linear médio (p < 0,05) e espessamento de septos inter-alveolares (p < 0,001). A restrição nutricional associada à hiperoxia intensificou a redução do número de alvéolos (p < 0,001) e do depósito de colágeno (p < 0,001).
CONCLUSÕES: A restrição nutricional intensificou as alterações morfométricas pulmonares produzidas pela hiperoxia, especialmente em relação à alveolização e depósito de colágeno.
Palavras-chave: Restrição nutricional, hiperoxia, desenvolvimento pulmonar, coelhos prematuros.
Introdução
A displasia broncopulmonar constitui uma das principais causas de morbidade entre os recém-nascidos pré-termo, especialmente os extremos, admitidos nas unidades de terapia intensiva neonatal. Hiperoxia1, ventilação mecânica2,3, infecção perinatal4 e persistência de canal arterial5,6 constituem os principais fatores de risco para o seu desenvolvimento, além da prematuridade2,5,6. Em relação à nutrição, ainda são necessários novos estudos para elucidar a sua importância na fisiopatologia desse distúrbio.
Existem vários modelos experimentais para estudar a lesão pulmonar aguda pela hiperoxia em animais a termo1,7, bem como em prematuros8, em um período anterior ou durante a alveolização. Nestes, as principais características histopatológicas descritas são uma interrupção no desenvolvimento pulmonar e vascular, com redução do número de alvéolos e alterações morfológicas vasculares1,7-9.
No entanto, em relação aos efeitos da restrição nutricional sobre o pulmão, os resultados são contraditórios. Ressalte-se que a maioria desses estudos utilizou animais a termo ou adultos. Alguns estudos observaram, em ratos recém-nascidos a termo, uma redução do crescimento somático, peso e volume pulmonares, número de alvéolos e conteúdo de colágeno10,11, enquanto outros não detectaram qualquer influência da restrição nutricional sobre a arquitetura pulmonar12.
Alguns modelos experimentais utilizaram coelhos recém-nascidos a termo e prematuros para analisar o desenvolvimento pulmonar13-15. No entanto, em relação aos modelos experimentais de restrição nutricional e hiperoxia, poucos foram desenvolvidos em animais prematuros16, nos quais não foram analisados os efeitos sobre a arquitetura pulmonar.
A partir dos dados de literatura existentes, formulou-se a hipótese de que a restrição nutricional e a hiperoxia, isoladas ou associadas, causariam alterações significativas sobre a alveolização, com interrupção da formação alveolar e desorganização das fibras elásticas e de colágeno. Nesse sentido, este estudo foi realizado para avaliar os efeitos da restrição nutricional e da hiperoxia sobre a arquitetura pulmonar, em coelhos prematuros expostos à restrição nutricional e à hiperoxia, durante os primeiros 11 dias de vida.
Material e métodos
O protocolo deste estudo foi aprovado pelo comitê para análise de projetos de pesquisa local.
Preparação dos animais
Coelhas grávidas New Zealand White (Benjamin Fleder®- Moji das Cruzes, SP), com idade gestacional conhecida de 28 dias, foram sedadas com ketamina intramuscular (10 mg/kg) e acepromazina (0,1 mg/kg) e posteriormente submetidas a raquianestesia com solução de marcaína-xilocaína a 2% (1:1, vol:vol - 2 ml). Após a cesárea, os filhotes foram identificados com um número na região dorsal e pesados sobre um colchão térmico e sob calor radiante. Estes foram mantidos com 30% O2 durante os primeiros 30 minutos. As mães foram sacrificadas com pentobarbital endovenoso (5 ml).
Após um período de adaptação inicial, os animais sobreviventes foram randomizados, por sorteio, através de sua numeração seqüencial e de acordo com a exposição ao oxigênio e ao tipo de dieta em: CA, dieta controle, ar (n = 18); CH, dieta controle, hiperoxia (n = 17); RA, restrição nutricional, ar (n = 18); RH, restrição nutricional, hiperoxia (n = 18). Os filhotes foram sacrificados com 11 dias de vida.
Os animais foram colocados em incubadoras (Fanem®, São Paulo, Brasil) para manter uma temperatura de 30-32 ºC. Com o objetivo de prevenir infecções, as incubadoras foram lavadas, utilizando água destilada nos nebulizadores, a dieta foi esterilizada, e a serragem utilizada nas incubadoras foi autoclavada. A partir do terceiro dia de vida, administrou-se penicilina cristalina (20.000 UI/kg) e estreptomicina (20 mg/kg/d) intramuscular para prevenir infecções, as quais foram as principais causas de óbito, em um estudo piloto realizado para determinar a metodologia utilizada. Nesse momento, administrou-se, também, vitamina K (0,002 mg/kg/dia) para prevenir hemorragia pulmonar.
Desenvolveu-se uma fórmula láctea com uma composição semelhante à do leite de coelha17 e similar a estudos anteriores13,15,18. A dieta controle foi composta por uma mistura de: AL110 (Nestlé®), 5 gramas; caseína (Support®), 5 gramas; triglicérides CMAGE (Support®), 15 ml; polivitamínico, 1 gota; água destilada, 100 ml qsp. Essa dieta fornecia 5,3 gramas de proteínas, 16,2 gramas de gordura, 2,8 gramas de dextrino-maltose e 155 kcal por 100 ml. A restrição nutricional foi definida como uma redução de 30% de todos os nutrientes da dieta controle, baseado em modelos experimentais de desnutrição18. A evolução ponderal dos filhotes ocorreu de forma semelhante à descrita na literatura, em modelo experimental que utilizou fórmula13. Todos os animais foram alimentados duas vezes por dia através de uma sonda orogástrica nº 4, adaptada a uma seringa graduada. Os seguintes volumes foram administrados: D0, 50 ml/kg/dia; D1, 100 ml/kg/dia; D2, 150 ml/kg/dia; D3 a D10, 200 ml/kg/dia. O mesmo volume foi oferecido a ambos os grupos, a fim de mantê-los hidratados. As sondas e os animais foram manipulados com luvas de látex para procedimentos.
Os animais foram pesados pela manhã, diariamente, com uma balança analítica de precisão (TR 403, Denver Instrument Company®, EUA) por três vezes; após, realizou-se a média aritmética das medidas, para determinar o peso médio diário.
Exposição à hiperoxia
Administrou-se oxigênio aquecido e umidificado, com nebulizadores neonatais (Intermed®, São Paulo, Brasil), fluxo contínuo de 3 l/min, através de uma câmara de acrílico selada. Este fluxo contínuo prevenia o acúmulo de CO2 e mantinha uma concentração constante de 95% O2. A concentração de oxigênio foi monitorizada, continuamente, através de um oxímetro de ar ambiente (Dixtal®, São Paulo, Brasil).
Histologia
Os animais foram sacrificados com injeção intraperitoneal de pentobarbital sódico (25 mg/kg) e secção de aorta abdominal. A traquéia foi canulada com cânulas de Sylastic de 1 mm de diâmetro. Após, produziu-se um pneumotórax bilateral, através da punção do diafragma, na sua superfície abdominal. Então, conectou-se a cânula a uma coluna de água, e os pulmões foram inflados a uma pressão de 30 cmH2O, sendo que, após, ligou-se a traquéia. Os pulmões foram removidos do tórax e submersos em uma solução de formol tamponado a 10% durante 24 horas. Após esse período, os pulmões foram pesados três vezes, em uma balança analítica de precisão TR 403 (Denver Instrument Company®, EUA), e calculou-se a média aritmética dessas medidas. A seguir, os volumes pulmonares foram medidos através da técnica de deslocamento de água19. As medidas foram realizadas três vezes e, a seguir, suas médias aritméticas foram calculadas. Essas medidas foram repetidas se dois valores diferissem mais que 0,05 ml entre eles. Não se utilizou um fator de correção para valores úmidos e desidratados, porque todos os pulmões foram processados de forma idêntica. Determinou-se a relação peso pulmonar/peso corpóreo no momento do sacrifício (PP/PC), e o volume pulmonar específico foi determinado dividindo-se o volume pulmonar por 100 gramas de peso corpóreo (ml/100 gramas de peso corpóreo)20.
O conteúdo de água pulmonar foi quantificado através da diferença entre os pesos pulmonares, seco e úmido. Utilizou-se o pulmão esquerdo para essa medida, sendo inicialmente realizada a medida do peso úmido e após colocado em uma temperatura de 80º C durante 72 horas21. As medidas foram realizadas em uma balança de precisão (TR403, Denver Instrument Company®, EUA).
Cortes sagitais de tecido com 1 mm de espessura foram removidos da porção distal de lobo superior direito. Os tecidos foram conservados em álcool etílico a 70% até serem embebidos em parafina para realização de cortes seriados de 5 m de espessura. Esses cortes foram corados com hematoxilina-eosina (HE), resorcina-orceína modificada, para fibras elásticas e picrosírius para colágeno.
Análise morfométrica
A análise morfométrica foi realizada pelo mesmo investigador, de maneira cega, usando um microscópio (Nikkon E-600) acoplado a uma grade com 100 pontos e 50 linhas na ocular e um software para análise de imagens (Image-Pro®, Media Cybernetics INC, EUA).
Imagens seriadas de cada lâmina, não sobrepostas, foram fotografadas. Foram traçadas três linhas em níveis distintos, de pleura a pleura. Após, realizou-se a contagem dos interceptos das paredes alveolares. Posteriormente, os interceptos foram somados e divididos por dois para obter o número de alvéolos. O comprimento de cada linha foi medido através do analisador de imagens. O número de alvéolos, por lâmina, foi calculado dividindo-se o número total de alvéolos dividido pela soma do comprimento das três linhas (número de alvéolo por unidade de comprimento - nº alvéolos X 10-3/µm)22.
O intercepto linear médio (ILM) foi calculado em 10 campos por lâmina (100 X)23. O septo alveolar foi medido, em 50 septos alveolares, através do analisador de imagem (400 X)24. A proporção das fibras elásticas e de colágeno no parênquima pulmonar foi determinada como uma relação entre o número de pontos coincidentes com áreas coradas e o número de pontos coincidentes com tecidos não corados, sendo realizados em 20 campos por animal, usando uma grade com 50 linhas e 100 pontos (400 X)25. Os pontos de parênquima foram estimados contando os pontos coincidentes com os pontos da grade como ponto de parênquima, exceto vasos sangüíneos e brônquios > 2 mm de diâmetro.
Análise estatística
A análise de variância para medidas repetidas foi utilizada para comparar as médias de peso diárias de cada grupo durante o período do estudo, sendo que as comparações múltiplas foram realizadas baseadas na estatística de Wald. Calculou-se um tamanho da amostra de 17 animais, com a = 0,05 e poder de teste = 0,80, para observar uma redução de 10% no número de alvéolos, em cada grupo submetido às exposições e nos grupos controle-ar.
Realizou-se a análise de variância one way para comparar peso, volume e conteúdo de água pulmonares, número de alvéolos, espessura de septo alveolar, ILM, proporção de fibras elásticas e de colágeno. Considerou-se um p < 0,05 como significante.
Resultados
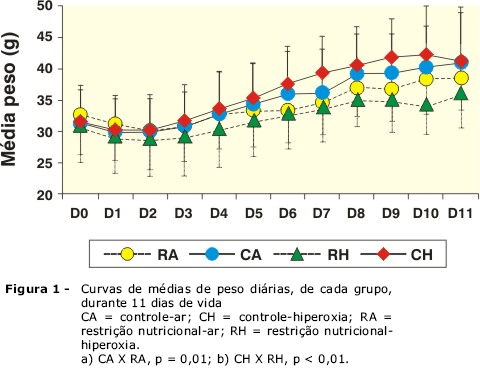
Analisando-se a curva de ganho de peso médio diário, observou-se uma redução inicial do peso e, a partir do terceiro dia de estudo, um ganho de peso em todos os grupos. No entanto, ocorreu um menor ganho de peso nos grupos submetidos a restrição nutricional e hiperoxia em relação aos grupos controle a partir do quarto dia (p < 0,001) até o final do estudo e, a partir do sexto dia, no grupo restrição nutricional e ar ambiente (p = 0,001) (Figura 1).
Efeitos pulmonares
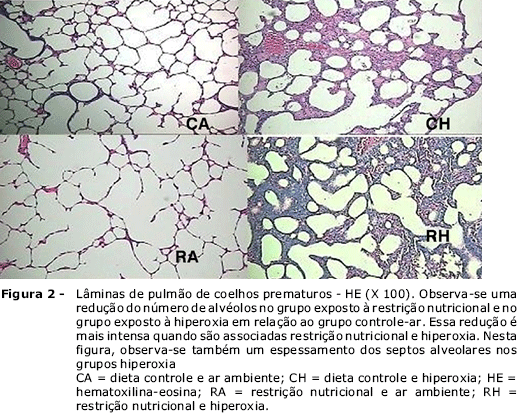
Neste modelo experimental em coelhos prematuros, a restrição nutricional durante 11 dias produziu menores volume e conteúdo de água pulmonares (p < 0,001), redução do número de alvéolos (p < 0,001) e dos depósitos de colágeno (p < 0,001).
A exposição à hiperoxia durante 11 dias também resultou em diminuição do número de alvéolos (p < 0,001) e do depósito de colágeno (p < 0,001), além de maiores espessamento septal (p < 0,05) e ILM (p < 0,01).
No grupo em que a restrição nutricional e a hiperoxia foram associadas, a redução do número de alvéolos (p < 0,001) e do depósito de colágeno (p < 0,001) detectadas foram intensificadas. Neste, foram também detectados maiores pesos pulmonares (p < 0,001).
A descrição desses resultados encontra-se na Tabela 1 e nas Figuras 2 e 3.
Discussão
Este estudo analisou os efeitos da restrição nutricional e da hiperoxia sobre um pulmão imaturo em desenvolvimento. Modelos experimentais anteriores descreveram as repercussões desses fatores, de forma isolada ou associados, em pulmões de animais adultos7 ou recém-nascidos a termo1,10. Apenas alguns demonstraram efeitos da restrição nutricional e hiperoxia sobre pulmão prematuro, principalmente em relação ao crescimento e às respostas antioxidantes, após um período de exposição de 72 horas16. Mesmo assim, esses modelos não analisaram as alterações da arquitetura pulmonar decorrentes.
Este modelo foi escolhido por permitir a análise dos efeitos da restrição nutricional e da hiperoxia, durante 11 dias, em um pulmão imaturo em desenvolvimento. Considerando que a duração da gestação em coelhos dura 31 dias, e a idade gestacional de 28 dias é o limite da viabilidade nesses animais13, pôde-se analisar os efeitos da restrição nutricional e da hiperoxia sobre pulmões na fase sacular, anteriormente à alveolização15.
A dieta utilizada possuía menor conteúdo protéico do que o leite de coelha17. No entanto, a comparação entre os grupos foi possível, uma vez que foi utilizada a mesma fonte nutricional em todos os grupos.
Os resultados deste estudo, em modelo experimental em coelhos prematuros, mostraram que a restrição nutricional durante 11 dias produziu menores volume e conteúdo de água pulmonares, além de redução do número de alvéolos e do depósito de colágeno; a hiperoxia reduziu o número de alvéolos e o depósito de colágeno, concomitantemente ao espessamento do septo interalveolar e aumento do ILM; associadas, a restrição nutricional e a hiperoxia reduziram, de maneira mais intensa, o número de alvéolos e do depósito de colágeno, além de promover um maior peso pulmonar, mesmo quando corrigido para o peso corpóreo.
Neste modelo, não se observou influência da restrição nutricional sobre o peso pulmonar, da mesma forma que em estudo anterior16, porém diferente do esperado. Da mesma forma, esta não foi detectada quando se relacionou peso pulmonar com o peso corpóreo. Uma redução do peso pulmonar proporcional a um menor ganho de peso somático explicaria essa relação inalterada, mesmo sem observar um menor peso pulmonar nesse grupo, em relação aos demais. Outros autores relataram, em ratos recém-nascidos a termo expostos à restrição nutricional, menores pesos pulmonares. No entanto, quando o peso pulmonar foi corrigido em relação ao peso somático, a relação não foi diferente dos animais que receberam dieta controle10. Os diferentes resultados dos diversos estudos poderia ser decorrente da variação da intensidade da restrição nutricional imposta. No último estudo citado, a restrição nutricional não foi mensurada, pois a mesma foi obtida aumentando o número de lactentes sugando na mesma mãe.
Em relação aos efeitos pulmonares da restrição nutricional, observou-se uma redução do número de alvéolos, sem alteração de suas dimensões, da mesma forma que o descrito por modelos anteriores26. Esses dados sugerem que esse efeito da restrição nutricional não esteja relacionado a alterações na septação, mas em outra via envolvida com a alveolização.
Também neste estudo, como descrito por outros, a restrição nutricional causou uma redução dos depósitos de colágeno11,27, provavelmente devido a uma menor disponibilidade dos substratos para sua síntese. Apesar de não se ter detectado redução de fibras elásticas, estas tinham um aspecto grosseiro no grupo exposto à restrição nutricional. Essas alterações também podem ter sido decorrentes de menor disponibilidade de substratos, com interferência na produção da enzima lisil-oxidase, envolvida nas fases iniciais da formação de elastina, alterando seu aspecto21,28,29.
A hiperoxia, isoladamente, não produziu alterações no peso pulmonar. Em relação aos efeitos da hiperoxia sobre o crescimento pulmonar, os resultados da literatura são discordantes. Alguns estudos detectaram maiores pesos pulmonares16. No entanto, outros autores que avaliaram esses efeitos sobre o crescimento pulmonar em animais recém-nascidos a termo descreveram uma redução do peso pulmonar e do conteúdo de DNA pulmonar10. Da mesma forma, neste estudo não se observou um maior conteúdo de água pulmonar nos animais expostos à hiperoxia, conforme descrito por outros14. Provavelmente essas diferenças estejam relacionadas à duração da exposição à hiperoxia e ao grau de imaturidade pulmonar.
A redução do número de alvéolos verificada nos animais expostos à hiperoxia, com concomitante aumento do ILM, sugere uma interferência daquela na alveolização através de um bloqueio na septação, produzindo alvéolos maiores, de forma semelhante a outros modelos experimentais de lesão pulmonar pela hiperoxia1. Esse aumento do ILM pode também refletir o espessamento do septo interalveolar detectado nesse grupo, sugerindo um aumento do processo inflamatório26. Neste, a hiperoxia reduziu também os depósitos de colágeno. No entanto, estudos anteriores em relação aos efeitos da hiperoxia sobre o conteúdo de colágeno pulmonar têm resultados controversos, sendo que alguns detectaram aumento1 desses depósitos e outros, redução20. Essa diversidade pode ser uma decorrência da variação, entre os modelos, da duração da hiperoxia ou até da presença de sensibilidade variável à hiperoxia dentre as espécies animais.
A associação de restrição nutricional à hiperoxia produziu uma redução mais intensa do número de alvéolos e do depósito de colágeno. Estudos anteriores relataram uma diminuição da produção de DNA pelo pulmão, tanto devido à hiperoxia, como devido à restrição nutricional10. Talvez essa interferência no DNA seja um dos mecanismos responsáveis por essas repercussões.
Neste estudo, observou-se um maior peso pulmonar quando foram associadas restrição nutricional e hiperoxia, sem, no entanto, ser acompanhado de aumento do conteúdo de água pulmonar, como seria esperado, se estivesse associado a um processo inflamatório. No entanto, outros estudos16 descreveram uma redução do mesmo durante a exposição a esses fatores, relacionando-o a uma redução do conteúdo de DNA pulmonar.
Os resultados deste estudo descreveram efeitos da restrição nutricional e da hiperoxia sobre a alveolização e os depósitos de colágeno, sendo mais intensos quando tais fatores foram associados.
Esses resultados sugerem que a redução de substratos para a produção de tecidos pode intensificar os efeitos da hiperoxia sobre o pulmão em desenvolvimento, principalmente em relação à alveolização e depósitos de colágeno. As repercussões detectadas sobre os alvéolos e o ILM sugerem que esses fatores possam também interromper a alveolização por vias diferentes, causando um efeito mais intenso.
Os componentes da matriz extracelular, entre eles o colágeno, fatores de crescimento, bem como fatores humorais e, principalmente, a elastina, estão envolvidos com a regulação da alveolização29,30. A deficiência de substratos pode ser responsável por uma menor disponibilidade desses fatores, e portanto, pode estar envolvida nesses efeitos.
Neste estudo, observou-se uma interrupção da alveolização, produzida pela restrição nutricional pós-natal precoce e pela hiperoxia, a qual é uma das principais alterações histopatológicas da "nova" displasia broncopulmonar. Neste sentido, a nutrição neonatal precoce pode ter um papel modulador na lesão pulmonar causada pela hiperoxia.
Artigo submetido em 07.11.05, aceito em 17.02.06.
- 1. Warner BB, Stuart LA, Papes RA, Wispe JR. Functional and pathological effects of prolonged hyperoxia in neonatal mice. Am J Physiol. 1998;275:L110-7.
- 2. Coalson JJ, Winter VT, Siler-Khodr T, Yoder BA. Neonatal chronic lung disease in extremely immature baboons. Am J Respir Crit Care Med. 1999;160:1333-46.
- 3. Mataloun MMGB, Leone CR, Ono NA, Prado PP, Britto MGS, Vaz FAC. Risk factors of bronchopulmonary dysplasia in very low birth weight infants. Pediatr Res. 2005;57:2066A.
- 4. Jobe AH. Antenatal associations with lung maturation and infection. J Perinatol. 2005;25 Suppl 2:S31-5.
- 5. Monte VLF, Silva Fş LVFS, Miyoshi MH, Rozov T. Displasia broncopulmonar. J Pediatr (Rio J). 2005;81:99-110.
- 6. D.Angio CT, Maniscalco WM. Bronchopulmonary dysplasia in preterm infants: pathophysiology and management strategies. Paediatr Drugs. 2004;6:303-30.
- 7. Crapo JD. Morphologic changes in pulmonary oxygen toxicity. Annu Rev Physiol. 1986;48:721-31.
- 8. Tanswell AK, Wong L, Possmayer F, Freeman BA. The preterm rat: a model for studies of acute and chronic neonatal lung disease. Pediatr Res. 1989;25:525-9.
- 9. Lin YJ, Markham NE, Balasubramaniam V, Tang JR, Maxey A, Kinsella JP, et al. Inhaled nitric oxide enhances distal lung growth after exposure to hyperoxia in neonatal rats. Pediatr Res. 2005;58:22-9.
- 10. Frank L, Groseclose E. Oxygen toxicity in newborn rats: the adverse effects of undernutrition. J Appl Physiol. 1982;53:1248-55.
- 11. Das RM. The effects of intermittent starvation on lung development in suckling rats. Am J Pathol. 1984;117:326-32.
- 12. Kalenga M, Tschanz AS, Burri PH. Protein deficiency and the growing rat lung. II. Morphometric analysis and morphology. Pediatr Res. 1995;37:789-95.
- 13. Lorenzo AV. The preterm rabbit: a model for the study of acute and chronic effects of premature birth. Pediatr Res. 1985;19:201-5.
- 14. Johnsson H, Eriksson L, Jonzon A, Laurent TC, Sedin G. Lung hyaluronan and water content in preterm and term rabbit pups exposed to oxygen or air. Pediatr Res. 1998;44:716-22.
- 15. Kovar J, Sly PD, Willet KE. Postnatal alveolar development of the rabbit. J Appl Physiol. 2002;93:629-35.
- 16. Langley SC, Kelly FJ. Effect of food restriction on hyperoxia-induced lung injury in preterm guinea pig. Am J Physiol. 1992;263:L357-62.
- 17. Sogorb F, Damy SB, Rodrigues UP, Chaguri ICAG. Variação na composição do leite de coelha. Mem Inst Butantan. 1991;53:175-80.
- 18. Kerr JS, Riley DJ, Lanza-Jacoby S, Berg RA, Spilker HC, Yu SY, et al. Nutritional emphysema in the rat. Am Rev Respir Dis. 1985;131:644-50.
- 19. Scherle W. A simple method for volumetry of organs in quantitative Stereology. Mikroskopie. 1970;26:57-60.
- 20. Bruce MC, Bruce EN, Janiga K, Chetty A. Hyperoxic exposure of developing rat lung decreases tropoelastin mRNA levels that rebound postexposure. Am J Physiol. 1993;265:L293-300.
- 21. Chen Y, Martinez MA, Frank L. Prenatal dexamethasone administration to premature rats exposed to prolonged hyperoxia: a new rat model of pulmonary fibrosis (bronchopulmonary dysplasia). J Pediatr. 1997;130:409-16.
- 22. Dunnil MS. Quantitative methods in the study of pulmonary pathology. Thorax. 1962;17:320-8.
- 23. Thurlbeck WM. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 1967;95:765-73.
- 24. Stocker JT. Pathologic features of long-standing "healed" bronchopulmonary dysplasia: a study of 28 3- to 40-month-old infants. Hum Pathol. 1986;17:943-61.
- 25. Dolhnikoff M, Mauad T, Ludwig MS. Extracellular matrix and oscillatory mechanics of rat lung parenchyma in bleomycin - induced fibrosis. Am J Respir Crit Care Med. 1999;160:1750-7.
- 26. Massaro D, Teich N, Maxwell S, Massaro GD, Whitney P. Postnatal development of alveoli: regulation and evidence for a critical period in rats. J Clin Invest. 1985;76:1297-305.
- 27. Kalenga M, Eeckout Y. Effects of protein deprivation from the neonatal period on lung collagen and elastin in the rat. Pediatr Res. 1989;26:125-7.
- 28. Tinker D, Rucker RB. Role of selected nutrients in synthesis, accumulation and chemical modification of connective tissue proteins. Physiol Rev. 1985;65:607-57.
- 29. Bourbon J, Boucherat O, Chaileey-Heu B, Delacourt C. Control mechanisms of lung alveolar development and their disorders in bronchopulmonary dysplasia. Pediatr Res. 2005;57:38R-46R.
- 30. Ambalavanan N, Carlo WA. Bronchopulmonary dysplasia: new insights. Clin Perinatol. 2004;31:613-28.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
10 Jul 2006 -
Data do Fascículo
Jun 2006
Histórico
-
Aceito
17 Fev 2006 -
Recebido
07 Nov 2005