Resumos
OBJETIVOS: Apresentar as recomendações baseadas em evidência para uso de antibióticos no tratamento das infecções respiratórias agudas (IRA) mais freqüentes e as informações disponíveis sobre a importância desse tipo de conduta. FONTES DOS DADOS: Bases de dados MEDLINE, LILACS, publicações técnicas de organizações internacionais, diretrizes nacionais e internacionais. Foram utilizados os unitermos acute respiratory infection, otitis, sinusitis, tonsillitis, pneumonia, antibiotic, guidelines, bacterial resistance. Artigos citados pelos artigos incluídos foram analisados quanto à apresentação de informação de interesse. SÍNTESE DOS DADOS: A resistência bacteriana tem crescido, sendo atualmente reconhecida como problema mundial de saúde pública. As IRA são a causa mais freqüente para uso de antibiótico na comunidade; grande parte desses casos, tanto nas vias aéreas superiores (otite, sinusite, faringoamidalite) como nas inferiores (pneumonia), são decorrente de infecção viral. As recomendações para racionalizar o uso de antibióticos nos pacientes com IRA têm como objetivo comum minimizar o uso desnecessário de antibióticos, visto que a "pressão antibiótica" é um dos fatores desencadeantes da resistência bacteriana. CONCLUSÕES: É de grande importância a distinção, entre os pacientes com IRA, daqueles que podem se beneficiar do uso de antibióticos. O uso das recomendações para a prescrição de antibióticos é uma estratégia para minimizar a freqüência de resistência bacteriana.
Antibióticos; resistência bacteriana; otite; sinusite; faringoamidalite; pneumonia
OBJECTIVES: To present evidence-based recommendations for the use of antibiotics for the treatment of the most common acute respiratory infections (ARI) and the available information on the importance of this type of management. SOURCES: MEDLINE and LILACS databases, technical publications by international organizations, national and international directives. The search terms acute respiratory infection, otitis, sinusitis, tonsillitis, pneumonia, antibiotic, guidelines and bacterial resistance were used. Articles cited by the articles selected were analyzed for information of interest. SUMMARY OF THE FINDINGS: Bacterial resistance has grown, to the extent that today it is recognized as a global public health problem. ARI are the most common cause of antibiotic usage within the community; yet a large proportion of these cases, compromising the upper (otitis, sinusitis, tonsillitis) or the lower airways (pneumonia), are the result of viral infections. Recommendations to rationalize the use of antibiotics in patients with ARI have the common objective of minimizing unnecessary antibiotic use, since "antibiotic pressure" is one of the factors triggering bacterial resistance. CONCLUSIONS: It is of great importance to differentiate among ARI patients those who will benefit from the use of antibiotics. The establishment of recommendations for the prescription of antibiotics is one strategy for minimizing the frequency of bacterial resistance.
Antibiotics; bacterial resistance; otitis; sinusitis; tonsilitis; pneumonia
ARTIGO DE REVISÃO
Antibioticoterapia ambulatorial como fator de indução da resistência bacteriana: uma abordagem racional para as infecções de vias aéreas
Cristiana M. Nascimento-Carvalho
Doutora. Professora adjunta, Departamento de Pediatria, Faculdade de Medicina, Universidade Federal da Bahia (UFBA), Salvador, BA
Correspondência Correspondência: Cristiana Nascimento de Carvalho Rua Prof. Aristides Novis, 105/1201B CEP 40210-730 - Salvador, Bahia Tel./Fax: (71) 3235.7869 E-mail: nascimentocarvalho@hotmail.com
RESUMO
OBJETIVOS: Apresentar as recomendações baseadas em evidência para uso de antibióticos no tratamento das infecções respiratórias agudas (IRA) mais freqüentes e as informações disponíveis sobre a importância desse tipo de conduta.
FONTES DOS DADOS: Bases de dados MEDLINE, LILACS, publicações técnicas de organizações internacionais, diretrizes nacionais e internacionais. Foram utilizados os unitermos acute respiratory infection, otitis, sinusitis, tonsillitis, pneumonia, antibiotic, guidelines, bacterial resistance. Artigos citados pelos artigos incluídos foram analisados quanto à apresentação de informação de interesse.
SÍNTESE DOS DADOS: A resistência bacteriana tem crescido, sendo atualmente reconhecida como problema mundial de saúde pública. As IRA são a causa mais freqüente para uso de antibiótico na comunidade; grande parte desses casos, tanto nas vias aéreas superiores (otite, sinusite, faringoamidalite) como nas inferiores (pneumonia), são decorrente de infecção viral. As recomendações para racionalizar o uso de antibióticos nos pacientes com IRA têm como objetivo comum minimizar o uso desnecessário de antibióticos, visto que a "pressão antibiótica" é um dos fatores desencadeantes da resistência bacteriana.
CONCLUSÕES: É de grande importância a distinção, entre os pacientes com IRA, daqueles que podem se beneficiar do uso de antibióticos. O uso das recomendações para a prescrição de antibióticos é uma estratégia para minimizar a freqüência de resistência bacteriana.
Palavras-chave: Antibióticos, resistência bacteriana, otite, sinusite, faringoamidalite, pneumonia.
Introdução
As infecções respiratórias agudas (IRA) são comuns, causam significativa morbidade e contribuem muito para a carga total de doença na comunidade1. Além do importante impacto social, as IRA são causa freqüente de atendimento médico e consumo de antibióticos2. Estima-se que 20-40% dos atendimentos ambulatoriais e 12-35% das admissões hospitalares, em um hospital pediátrico geral, sejam decorrentes de IRA3. Na Finlândia, uma avaliação dos diagnósticos durante 1 semana de atendimento em 30 centros de saúde (população alvo 819.000 pessoas) revelou que de 7.777 consultas 74% foram devidas à infecção respiratória. Ao se considerar apenas as crianças com idade inferior a 5 anos, 84% das infecções eram do aparelho respiratório4. Apesar de a incidência de IRA ser maior nos primeiros 5 anos de vida5, essas infecções foram documentadas como sendo comuns em adolescentes a partir dos 10 anos de idade, cursando com substancial co-morbidade entre as vias aéreas superiores e inferiores6. Em um recente estudo, realizado no Paquistão em crianças com idade entre 2 meses e 5 anos, a incidência estimada de IRA foi de 44%7.
Entre as IRA, destaca-se a pneumonia, a qual resulta em 2 milhões de mortes por ano em crianças em todo o mundo (20% de todas as mortes em crianças)8. Setenta por cento desses óbitos ocorrem na África e Sudeste Asiático, mesma região em que a incidência de pneumonia é 2 a 10 vezes maior (7-40% por ano) do que nos Estados Unidos9. Na América Latina, a evolução da mortalidade por pneumonia variou bastante entre 1990 e 2000: diminuiu na maioria dos países, a exemplo do Chile e do Uruguai, ao mesmo tempo em que aumentou ou permaneceu alta em outros, a exemplo da Bolívia, Peru e Guiana10. Os dados disponíveis apresentam, em países desenvolvidos, incidência anual estimada de pneumonia de 10 a 15 casos/1.000 crianças, variando a incidência anual de hospitalização por pneumonia de 1 a 4/1.00011. Cerca de 95% das crianças com pneumonia recebem antibióticos12.
Entre as IRA, as otites médias agudas (OMA) são a causa mais comum de busca por atendimento médico; nesses casos, os antibióticos são largamente prescritos13. Em um recente estudo realizado em Valência, na Espanha, a incidência de OMA foi de 40.014 episódios/100.000 crianças menores de 5 anos (IC 95% 39.700-40.300), com uso de antibióticos em 94,5%14. Em Israel, a média da duração (dias) de uso de antibióticos em crianças com OMA foi 9,0±5,615. OMA é a infecção para a qual mais comumente se prescreve antibiótico, o que resulta em mais de 20 milhões de prescrições de antibióticos anualmente16.
Nos Estados Unidos, estimou-se que 7,3 milhões de atendimentos médicos ocorreram para pacientes com idade entre 3 e 17 anos, no ano de 2003, em função de dor de garganta, com prescrição para uso de antibióticos em 54% dos atendimentos17. Em um estudo populacional na Suécia, o número anual de episódios de IRA foi de 166 para cada 1.000 habitantes; 18% foram diagnosticados como faringoamidalite (FA) aguda. No total, o número anual de prescrições antibióticas para IRA foi de 78 para cada 1.000 habitantes18.
Embora o envolvimento dos seios da face seja comum em infecções respiratórias virais, a verdadeira incidência de sinusite bacteriana em crianças é desconhecida. Estima-se que cerca de 10% das infecções de vias aéreas superiores compliquem com sinusite aguda bacteriana (SAB)19. Avaliando-se a freqüência de congestão nasal e tosse diurna por período superior a 9 dias em 1.307 crianças com idade entre 1 e 5 anos atendidas em clínicas pediátricas na cidade de Seattle, EUA, foi encontrada uma prevalência pontual de 9,3% (IC 95%: 7,7%-10,9%) para SAB; excluindo-se a concomitância de OMA, 5% das 1.307 crianças receberam antibiótico devido a SAB20. Um estudo multicêntrico finlandês demonstrou que os antibióticos são prescritos 2 a 5 vezes mais freqüentemente do que a verdadeira incidência de SAB21. A SAB tem sido descrita como a quinta causa mais freqüente de prescrição de antibióticos22.
Uso de antibióticos em infecções de vias aéreas
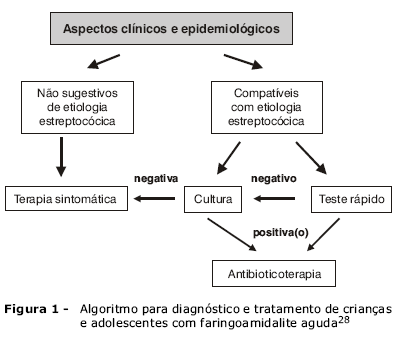
A maioria dos quadros de IRA, tanto nas vias aéreas superiores (OMA, FA, SAB)23 quanto nas inferiores (pneumonia)24, é de etiologia viral. Para as FA de causa bacteriana, o principal agente etiológico é o Streptococcus pyogenes25, pois as FA estreptocócicas podem evoluir com complicações supurativas, como abscesso periamidaliano, ou complicações não supurativas, como febre reumática, as quais podem ser prevenidas com o uso adequado de antibióticos para tratamento do quadro primário (FA estreptocócica)26. As estratégias para diagnóstico e tratamento dos pacientes com FA são destinadas a distinguir as crianças com FA viral, que não se beneficiam do uso de antibióticos, das crianças com FA estreptocócica, para as quais a antibioticoterapia é benéfica27. O Departamento de Infectologia da Sociedade Brasileira de Pediatria (SBP), em consonância com as recomendações da Academia Americana de Pediatria e da Sociedade Norte-Americana de Doenças Infecciosas (AAP, American Academy of Pediatrics/NASID, Infectious Diseases Society of America), desenvolveu um algoritmo para diagnóstico e tratamento desses pacientes (Figura 1)28. A distinção entre a etiologia viral ou bacteriana em crianças com FA é crucial para minimizar o uso de antibióticos27.
Para os pacientes com pneumonia, OMA e SAB, os agentes etiológicos bacterianos mais freqüentes são Streptococcus pneumoniae, Haemophilus influenzae e Moraxella catarrhalis22,29,30. Entre os pacientes com pneumonia, a importância da etiologia bacteriana se deve à letalidade desses agentes31. Uma compilação de estudos realizados em países desenvolvidos para investigar a etiologia da pneumonia em crianças, utilizando métodos específicos e não invasivos, mostrou que, nos pacientes nos quais foi possível determinar a etiologia, essa foi viral em 69% e 48% e bacteriana em 61% e 65% dos indivíduos hospitalizados ou ambulatoriais, respectivamente30. A Organização Mundial da Saúde (OMS) estima que até 1 milhão de crianças menores de 5 anos morrem anualmente de pneumonia, meningite ou sepse pneumocócica, sendo a grande maioria desses óbitos atribuída à pneumonia em países em desenvolvimento32. Apesar da falta de eqüidade nas informações disponíveis sobre a freqüência de agentes etiológicos para crianças com pneumonia nas diversas regiões do mundo, o S. pneumoniae é considerado o patógeno bacteriano mais comum em crianças com idade inferior a 5 anos33.
Para conter a alta mortalidade por pneumonia nos países em desenvolvimento, a OMS tem apresentado um algoritmo (Figura 2) para a condução dos pacientes com IRA. Esse algoritmo é baseado em sinais clínicos de fácil detecção, como taquipnéia e tiragem subcostal34. O mesmo algoritmo também tem sido recomendado pela SBP como estratégia para racionalizar o uso de antibióticos em crianças com IRA35, sendo que existem evidências do substancial impacto do algoritmo na mortalidade por pneumonia36. Por outro lado, o uso do algoritmo (Figura 2) tem resultado em um número considerável de crianças com diagnóstico incorreto de pneumonia (especificidade 49-89%)37-39. Em um estudo caso-controle conduzido no Haiti, a maioria das crianças com pneumonia recorrente diagnosticadas pelo algoritmo da OMS tinham, na verdade, crise aguda de asma40. As crises de broncoespasmo também se apresentam com taquipnéia e, por esse motivo, é possível que o uso do algoritmo da OMS ocasione o uso desnecessário de antibióticos41.
É importante ressaltar que no algoritmo para condução dos pacientes com IRA, o objetivo é distinguir, entre as crianças com queixas respiratórias, as que têm comprometimento das vias aéreas inferiores (VAI), sendo o uso de antibióticos recomendado nas situações em que as VAI estão comprometidas42. De forma distinta do que fora comentado em relação às FA, o algoritmo de conduta para pacientes com pneumonia não visa a distinção entre a etiologia viral e bacteriana. Isso decorre da dificuldade em se estabelecer a etiologia das pneumonias e do fato de que a alta mortalidade por pneumonia ocorre em regiões onde há limitações operacionais em termos de recursos tecnológicos básicos9-10. O padrão ouro para diagnóstico de pneumonia é a detecção de infiltrado pulmonar no estudo radiológico do tórax43. Muitas tentativas têm sido realizadas para distinguir, radiologicamente, entre as crianças com infiltrado pulmonar, as que têm etiologia exclusivamente viral e as que têm etiologia bacteriana, a exemplo do escore para pneumonia bacteriana (BPS, bacterial pneumonia score)44. Esse tipo de tentativa visa aumentar a racionalidade do uso de antibióticos, diminuindo sua utilização desnecessária. No entanto, um estudo finlandês, utilizando métodos específicos e não invasivos para a determinação etiológica da pneumonia em crianças, demonstrou que as infecções bacterianas podem apresentar tanto infiltrado alveolar como infiltrado intersticial45. Um estudo brasileiro mostrou que o padrão radiológico pode ser influenciado pela idade da criança, possivelmente em decorrência de diferenças na resposta inflamatória dos lactentes quando comparados com crianças mais velhas46. Dessa forma, a presença de sinais radiológicos como consolidação, derrame pleural e pneumatocele pode ser vista como tendo associação com etiologia bacteriana, mas a ausência desses sinais não significa que a etiologia não seja bacteriana45.
Entre os pacientes com OMA, a importância da antibioticoterapia decorre das complicações e seqüelas que podem ser estabelecidas quando a etiologia é bacteriana, a exemplo de mastoidite e surdez de condução47. O advento dos antibióticos entre as décadas de 1930 e 1940 levou a um declínio significativo na incidência tanto das complicações quanto das seqüelas48. No entanto, em 1972, Howie & Ploussard49 demonstraram que a resolução espontânea da OMA pode acontecer e está na dependência do agente etiológico: 48% para H. influenzae e 18% para S. pneumoniae. Uma recente meta-análise de 63 estudos demonstrou que os sintomas da OMA melhoram em 24 h sem uso de antibióticos em 61% das crianças (IC 95%: 50-72%), aumentando para 80% em 2 a 3 dias (IC 95%: 69-90%). A freqüência de complicações supurativas quando os antibióticos são usados imediatamente (0,24%) é comparável à freqüência de complicações quando os antibióticos são usados após um período inicial de observação (0,12%)50.
A constatação da crescente freqüência de resistência bacteriana entre os patógenos de OMA51, a compreensão de que essa resistência está fortemente associada ao uso de antimicrobianos52 e a dificuldade de, na prática, se identificar o agente etiológico da OMA (necessidade de timpanocentese e cultura de líquido de ouvido médio) resultaram em repetidas recomendações, cujo objetivo é minimizar o uso de antibióticos em crianças com OMA51,53-55.
As recomendações mais recentes foram publicadas em 2004 e apresentadas pela AAP56 e pela Academia Americana de Medicina de Família (AAFP, American Academy of Family Physicians)57 (Figura 3). É importante ressaltar que essas recomendações enfatizam a necessidade de aumentar a precisão diagnóstica ao se avaliar um paciente com quadro compatível com OMA e sugerem fortemente a opção de tratamento conservador, ou seja, observação sem introdução de antibióticos, com o uso de medicação sintomática nos casos de OMA não complicada. Essas recomendações, de modo inovador, propõem que se repense o uso rotineiro de antibióticos em pacientes com OMA, na expectativa de se prevenir a continuidade do aumento de resistência bacteriana58, sem que se deixe de tratar os casos que de fato se beneficiam do uso de antibióticos.
Entre os pacientes com SAB, a disponibilidade de informação baseada em evidência é menor do que para as situações anteriormente comentadas59. Em 2001, a AAP publicou recomendações para o manejo de pacientes com quadro clínico sugestivo de SAB com base em um consenso entre especialistas, de forma a complementar as questões para as quais as evidências eram insuficientes60 (Figura 4). É importante comentar que as recomendações foram baseadas em cinco ensaios clínicos randomizados, em oito estudos do tipo série de casos e nas opiniões dos especialistas. Conforme essas recomendações, o uso de antibióticos para tratamento de SAB não complicada tem o objetivo de propiciar cura clínica de forma mais rápida. Esse mesmo uso foi enfaticamente recomendado para os pacientes com suspeita ou comprovação de complicação.
Recentes estudos conduzidos em países escandinavos demonstraram que os antibióticos são prescritos 2 a 5 vezes mais do que a verdadeira incidência da SAB (10%)21. Os médicos se sentem pressionados a prescrever antibióticos para SAB tanto em função da expectativa dos pacientes quanto da dificuldade em se precisar o diagnóstico de SAB61. Embora seja difícil precisar o exato momento em que a infecção viral foi sobreposta pela infecção bacteriana, o risco de infecção bacteriana é maior quanto maior a duração dos sintomas62. Por isso, aceita-se que o diagnóstico de SAB não complicada, para a qual o antibiótico é benéfico, se baseie na persistência dos sintomas de infecção de vias aéreas superiores (descarga e/ou congestão nasal, rinorréia posterior, tosse) por 10 dias, ou na piora desses sintomas após 5 a 7 dias. A descarga nasal pode ser clara, mucóide ou purulenta, e a tosse (seca ou úmida) deve estar presente durante o dia, embora freqüentemente piore à noite62 (Figura 4).
Resistência antimicrobiana dos patógenos respiratórios
Recentemente, os resultados de vigilância in vitro de patógenos respiratórios nos Estados Unidos demonstraram que cerca de 45% das cepas de S. pneumoniae eram resistentes à penicilina (16% resistência intermediária e 29% resistência absoluta), sendo que 33% e 43% das cepas foram resistentes aos macrolídeos e à sulfametoxazol-trimetoprim, respectivamente. A resistência a múltiplas drogas foi significativamente mais freqüente entre cepas resistentes do que entre cepas suscetíveis à penicilina63. Entre as cepas de H. influenzae, 28,6% eram produtoras de beta-lactamase, 70,2% foram suscetíveis a amoxicilina, 99,8% à combinação amoxicilina-ácido clavulânico, 82,8% a cefuroxime-axetil, 78,1% a sulfametoxazol-trimetoprim, 23,2% a cefprozil e 5% a cefaclor, azitromicina e claritromicina63. A quase totalidade das cepas de M. catarrhalis foi resistente a amoxicilina, cefaclor, cefprozil e sulfametoxazol-trimetoprim, tendo sido a produção de beta-lactamase o mecanismo de resistência63.
Apesar da resistência antimicrobiana estar crescendo nos últimos anos, há grande disparidade entre os diversos locais em que os estudos foram realizados, tendo sido descritas taxas altas e baixas de resistência à penicilina em regiões geográficas próximas64. Essa é uma situação bastante preocupante, em vista da grande facilidade de transporte nos dias atuais, em que o trânsito de pessoas entre diferentes localidades pode rapidamente contribuir para a disseminação de cepas resistentes65. No Brasil, dados da vigilância nacional registram que, de 1993 para 2004, a freqüência de cepas de S. pneumoniae resistente à penicilina cresceu de 10,2% para 27,9%. As proporções de resistência intermediária e alta resistência foram, em 1993, de 9,1% e 1,1%, passando a 22,0% e 5,9% em 2004, respectivamente66. Em relação ao H. influenzae, de 1.712 cepas invasivas isoladas em 10 estados brasileiros, entre 1996 e 2000, a prevalência de produção de beta-lactamase variou de 6,6% a 57,5%, sendo a prevalência geral 18,4%67.
Entre as cepas de S. pyogenes, não há registro de resistência às penicilinas, mas o mesmo não acontece em relação aos macrolídeo. Um estudo conduzido na Espanha, avaliando bactérias patogênicas para o trato respiratório, mostrou que 33,2% de 3.174 cepas de S. pyogenes apresentaram resistência a eritromicina68. Já na França, a taxa de resistência a eritromicina foi de 22,4% em 322 cepas de S. pyogenes, tendo sido associada, principalmente, a alguns poucos clones emm tipo 2869. Essa resistência tem aumentado significativamente em alguns países europeus a partir dos últimos anos da década de 1990. Entre 1999 e 2002, na Grécia, 24% de 1.577 cepas eram resistentes à eritromicina70.
Evidência do uso de antibiótico como fator associado à resistência antimicrobiana dos patógenos respiratórios
Os patógenos respiratórios aqui comentados integram a flora colonizadora das vias aéreas superiores, estando, assim, freqüentemente expostos ao uso de antibióticos71. Pacientes expostos ao uso prévio de antibiótico têm maior incidência de cepas não suscetíveis do que pacientes que não receberam antibiótico previamente72. Na atualidade, a resistência bacteriana não é apenas um problema em infecções hospitalares, mas também em infecções comunitárias52. A maior parte dos antibióticos consumidos é para tratamento de infecções comunitárias, sendo que a principal pressão seletiva capaz de gerar mudanças na freqüência de resistência é o volume consumido de antibióticos73. A chamada "pressão antibiótica" refere-se à relação crua entre a quantidade de droga utilizada e a seleção de cepas resistentes74. A cada ano, nos Estados Unidos, são preenchidas 160 milhões de prescrições de antibióticos, correspondendo a 22,7 milhões de kg, 50% para uso em humanos e 50% para uso em animais, agricultura e hidrocultura75. Em uma população de 275 milhões, isso equivale, anualmente, a 30 prescrições para cada 100 pessoas e a 4,1 kg de antibióticos para cada 100 pessoas74.
A pressão antibiótica é diferente para cada droga64. Na Espanha, Garcia-Rey et al. demonstraram, em 1.684 cepas de S. pneumoniae isoladas de pacientes com infecção respiratória adquirida na comunidade, que a correlação entre uso de antibiótico e resistência bacteriana foi crescente quando foram analisados separadamente penicilinas, cefalosporinas e macrolídeos76. Três importantes medidas podem ser utilizadas para predizer o nível de resistência bacteriana em uma dada localidade: a proporção de organismos introduzidos de fora, a proporção do que é selecionado espontaneamente ou pela pressão antibiótica e a proporção do que é transmitido de uma pessoa para outra74. Dessa forma, é possível compreender que o uso de antibiótico é extremamente importante no processo de seleção de cepas resistentes e que o uso mais racional e limitado pode conter a progressão nas taxas de resistência.
No entanto, a diminuição da resistência não é tão influenciada pela redução no uso de antibióticos. Na Suécia, entre 1997 e 2003, foi demonstrada a falta de correlação entre a evolução da freqüência de resistência do S. pneumoniae e a redução no uso de antibióticos77. Possivelmente, tal achado possa ser explicado em função dos demais fatores implicados, como introdução e disseminação de cepas resistentes na comunidade. Já nos Estados Unidos, dados da vigilância epidemiológica demonstraram uma queda significativa na freqüência de infecção por S. pneumoniae resistente associada ao uso em larga escala da vacina pneumocócica conjugada heptavalente78. Essas informações nos permitem supor que, a curto prazo, o principal fator de impacto na redução da resistência bacteriana é a diminuição da circulação da bactéria na comunidade. As dificuldades técnicas para se dispor de vacinas para todas as bactérias que causam infecção respiratória comunitária são um forte motivo para a adesão, na prática clínica, às recomendações para o uso racional de antibióticos.
Considerações finais
A resistência bacteriana entre os patógenos respiratórios é mundialmente reconhecida como um problema crescente e de grande relevância. O uso de antibióticos em IRA é um dos fatores que influencia a ocorrência desse fenômeno. Embora a redução no uso de antibiótico não pareça estar associada à redução na resistência bacteriana a curto prazo, entre as medidas de mais fácil execução destaca-se o uso racional de antibióticos, na expectativa de, pelo menos, diminuir o aumento acelerado nas taxas de resistência.
- 1. Leder K, Sinclair MI, Mitakakis TZ, Hellard ME, Forbes A. A community-based study of respiratory episodes in Melbourne, Australia. Aust N Z J Public Health. 2003;27:399-404.
- 2. Shoham Y, Dagan R, Givon-Lavi N, Liss Z, Shagan T, Zamir O, et al. Community-acquired pneumonia in children: quantifying the burden on patients and their families including decrease in quality of life. Pediatrics. 2005;115:1213-9.
- 3. Jain N, Lodha R, Kabra SK. Upper respiratory tract infections. Indian J Pediatr. 2001;68:1135-8.
- 4. Rautakorpi UM, Klaukka T, Honkanen P, Makela M, Nikkarinen T, Palva E, et al. Antibiotic use by indication: a basis for active antibiotic policy in the community. Scand J Infect Dis. 2001;33:920-6.
- 5. Facanha MC, Pinheiro AC. Distribution of acute respiratory diseases in Brazil from 1996 to 2001, Brazil. Rev Saude Publica. 2004;38:346-50.
- 6. Karevold G, Kvestad E, Nafstad P, Kvaerner KJ. Respiratory infections in schoolchildren: co-morbidity and risk factors. Arch Dis Child. 2006;91:391-5.
- 7. Nizami SQ, Bhutta ZA, Hasan R. Incidence of acute respiratory infections in children 2 months to 5 years of age in periurban communities in Karachi, Pakistan. J Pak Med Assoc. 2006;56:163-7.
- 8. Mulholland K. Global burden of acute respiratory infections in children: implications for interventions. Pediatr Pulmonol. 2003;36:469-74.
- 9. Singh V. The burden of pneumonia in children: an Asian perspective. Paediatr Respir Rev. 2005;6:88-93.
- 10. Fuchs SC, Fischer GB, Black RE, Lanata C. The burden of pneumonia in children in Latin America. Paediatr Respir Rev. 2005;6:83-7.
- 11. Farha T, Thomson AN. The burden of pneumonia in children in the developed world. Paediatr Respir Rev. 2005;6:76-82.
- 12. Weigl JA, Bader HM, Everding A, Schmitt HJ. Population-based burden of pneumonia before school entry in Schleswig-Holstein, Germany. Eur J Pediatr. 2003;162:309-16.
- 13. Cripps AW, Otczyk DC, Kyd JM. Bacterial otitis media: a vaccine preventable disease? Vaccine. 2005;23:2304-10.
- 14. Garces-Sanchez M, Diez-Domingo J, Alvarez de Labiada T, Planelles V, Graullera M, Baldo JM, et al. Epidemiology and burden of acute otitis media in Valencia (Spain). An Pediatr (Barc). 2004;60:125-32.
- 15. Greenberg D, Bilenko N, Liss Z, Shagan T, Zamir O, Dagan R. The burden of acute otitis media on the patient and the family. Eur J Pediatr. 2003;162:576-81.
- 16. Bernius M, Perlin D. Pediatric ear, nose, and throat emergencies. Pediatr Clin North Am. 2006;53:195-214.
- 17. Linder JA, Bates DW, Lee GM, Finkelstein JA. Antibiotic treatment of children with sore throat. JAMA. 2005;294:2315-22.
- 18. Engstrom S, Molstad S, Nilsson G, Lindstrom K, Borgquist L. Data from electronic patient records are suitable for surveillance of antibiotic prescriptions for respiratory tract infections in primary health care. Scand J Infect Dis. 2004;36:139-43.
- 19. Wald ER, Guerra N, Byers C. Upper respiratory tract infection in young children: duration of and frequency of complications. Pediatrics. 1991;87:129-33.
- 20. Aitken M, Taylor JA. Prevalence of clinical sinusitis in young children followed up by primary care pediatricians. Arch Pediatr Adolesc Med. 1998;152:244-8.
- 21. Varonen H, Rautakorpi UM, Huikko S, Honkanen PO, Klaukka T, Laippala P, et al. Management of acute maxillary sinusitis in Finnish primary care. Results from the nationwide MIKSTRA study. Scand J Prim Health Care. 2004;22:122-7.
- 22. Bishai WR. Issues in the management of bacterial sinusitis. Otolaryngol Head Neck Surg. 2002;127(6 Suppl):S3-9.
- 23. West JV. Acute upper airway infections. Br Med Bull. 2002;61:215-30.
- 24. Klig JE. Current challenges in lower respiratory infections in children. Curr Opin Pediatr. 2004;16:107-12.
- 25. Gieseker KE, Roe MH, MacKenzie T, Tood JK. Evaluating the American Academy of Pediatrics diagnostic standard for Streptococcus pyogenes pharyngitis: backup culture versus repeat rapid antigen testing. Pediatrics. 2003;111:e666-70.
- 26. Vincet MT, Celestin N, Hussain AN. Pharyngitis. Am Fam Physician. 2004;69:1465-70.
- 27. Gerber MA. Diagnosis and treatment in children. Pediatr Clin North Am. 2005;52:729-47, vi.
- 28. Nascimento-Carvalho CM, Marques HH. The Brazilian Society of Pediatrics, Department of Infectious Diseases guidelines for the management of children and adolescents with acute pharyngitis. J Pediatr (Rio J). 2006;82:79-80.
- 29. Cripps AW, Otczyk DC, Kyd JM. Bacterial otitis media: a vaccine preventable disease? Vaccine. 2005;23:2304-10.
- 30. Nascimento-Carvalho CM. Etiology of childhood community-acquired pneumonia and its implication for vaccination. Braz J Infect Dis. 2001;5:87-97.
- 31. Shann F. Etiology of severe pneumonia in children in developing countries. Pediatr Infect Dis J. 1986;5:247-52.
- 32. World Health Organization. Pneumococcal vaccines. Wkly Epidemiol Record. 2003;14:110-9.
- 33. Burgner D, Richmond P. The burden of pneumonia in children: an Australian perspective. Paediatr Respir Rev. 2005;6:94-100.
- 34. Cashat-Cruz M, Morales-Aguirre JJ, Mendoza-Azpiri M. Respiratory tract infections in children in developing countries. Semin Pediatr Infect Dis. 2005;16:84-92.
- 35. Nascimento-Carvalho CM, Marques HHS. Recomendação da Sociedade Brasileira de Pediatria para antibioticoterapia em crianças e adolescentes com pneumonia comunitária. Rev Panam Salud Publica. 2004;15:380-7.
- 36. Qazi SA, Rehman GN, Khan MA. Standard management of acute respiratory infections in a children's hospital in Pakistan: impact on antibiotic use and case fatality. Bull World Health Organ. 1996;74:501-7.
- 37. Perkins BA, Zucker JR, Otieno J, Jafari HS, Paxton L, Redd SC, et al. Evaluation of an algorithm for integrated management of childhood illness in an area of Kenya with high malaria transmission. Bull World Health Organ. 1997;75(Suppl 1):33-42.
- 38. Simoes EA, Desta T, Tessema T, Gerbresellassie T, Dagnew M, Gove S. Performance of health workers after training in integrated management of childhood illness in an area with seasonal malaria in the Gambia. Bull World Health Organ. 1997;75 Suppl 1:43-53.
- 39. Weber MW, Mulholland EK, Jaffar S, Troedsson H, Gove S, Greenwood BM. Evaluation of an algorithm for the integrated management of childhood illness in an area with seasonal malaria in the Gambia. Bull World Health Organ. 1997;75 Suppl 1:25-32.
- 40. Heffelfinger JD, Davis TE, Gebrian B, Bordeau R, Schwartz B, Dowell SF. Evaluation of children with recurrent pneumonia diagnosed by World Health Organization criteria. Pediatr Infect Dis J. 2002;21:108-12.
- 41. Torzillo PJ. Wheezing and the management algorithms for pneumonia in developing countries. Indian Pediatr. 2001;38:821-6.
- 42. Benguigui Y, Stein F. Integrated management of childhood illness: an emphasis on the management of infectious diseases. Semin Pediatr Infect Dis. 2006;17:80-98.
-
43World Health Organization. Standardization of interpretation of chest radiographs for the diagnosis of pneumonia in children. Geneva: WHO; 2001.
- 44. Moreno L, Krishman JA, Duran P, Ferrero F. Development and validation of a clinical prediction rule to distinguish bacterial from viral pneumonia in children. Pediatr Pulmonol. 2006;41:331-7.
- 45. Korppi M, Kiekara O, Heiskanen-Kosma T, Soimakallio S. Comparison of radiological findings and microbial aetiology of childhood pneumonia. Acta Paediatr. 1993;82:360-3.
- 46. Nascimento-Carvalho CM, Alves NN, Athayde LA, Caldas RM, Barberino MG, Duarte J, et al. Is there any association of a specific chest x-ray pattern and bacteremia in children with pneumonia? J Trop Pediatr. 2002;48:253-4.
- 47. Leskinen K. Complications of acute otitis media in children. Curr Allergy Asthma Rep. 2005;5:308-12.
- 48. Agrawal S, Husein M, MacRae D. Complications of otitis media: an evolving state. J Otolaryngol. 2005;34 Suppl 1:S33-9.
- 49. Howie VM, Ploussard JH. Efficacy of fixed combination antibiotics versus separate components in otitis media. Effectiveness of erythromycin estolate, triple sulfonamide, ampicillin, erythromycin-estolate-triple sulfonamide and placebo in 280 patients with acute otitis media under two and one-half years of age. Clin Pediatr. 1972;11:205-14.
- 50. Rosenfeld RM, Kay D. Natural history of untreated otitis media. Laryngoscope. 2003;113:1645-57.
- 51. Leibovitz E. Acute otitis media in pediatric medicine: current issues in epidemiology, diagnosis, and management. Paediatr Drugs. 2003;5 Suppl 1:1-12.
- 52. Tenover FC, McGowan JE Jr. Reasons for the emergence of antibiotic resistance. Am J Med Sci.1996;311:9-16.
- 53. Hoberman A, Marchant CD, Kaplan SL, Feldman S. Treatment of acute otitis media consensus recommendations. Clin Pediatr (Phila). 2002;41:373-90.
- 54. Dowell SF, Schwartz B, Phillips WR. Appropriate use of antibiotics for URIs in children: Part I. Otitis media and acute sinusitis. The pediatric URI Consensus Team. Am Fam Physician. 1998;58:1113-8, 1123.
- 55. Paradise JL. Treatment guidelines for otitis media: the need for breadth and flexibility. Pediatr Infect Dis J. 1995;14:429-35.
- 56. American Academy of Pediatrics Subcommittee on Management of Acute Otitis Media. Diagnosis and management of acute otitis media. Pediatrics. 2004;113:1451-65.
- 57. American Academy of Family Physicians. Guideline on Diagnosis and Management of Acute Otitis Media. Am Fam Physician. 2004;69:2713-5.
- 58. Pelton SI. Otitis media: re-evaluation of diagnosis and treatment in the era of antimicrobial resistance, pneumococcal conjugate vaccine, and evolving morbidity. Pediatr Clin North Am. 2005;52:711-28.
- 59. Ioannidis JP, Lau J. Technical report: evidence for the diagnosis and treatment of acute uncomplicated sinusitis in children: a systematic overview. Pediatrics. 2001;108:E57.
- 60. American Academy of Pediatrics. Subcommittee on Management of Sinusitis and Committee on Quality Improvement. Pediatrics. 2001;108:798-808.
- 61. Varonen K, Sainio S. Patients' and physicians' view on the management of acute maxillary sinusitis. Scand J Prim Health Care. 2004;22:22-6.
- 62. Poole MD, Jacobs MR, Anon JB, Marchant CD, Hoberman A, Harrison CJ. Antimicrobial guidelines for the treatment of acute bacterial rhinosinusitis in immunocompetent children. Int J Pediatr Otorhinolaryngol. 2002;63:1-12.
- 63. Jacobs MR, Bajaksouzian S, Windau A. Good CE, Lin G, Pankuch GA, et al. Susceptibility of Streptococcus pneumoniae, Haemophilus influenzae, and Moraxella catarrhalis to 17 oral antimicrobial agents based on pharmacodynamic parameters: 1998-2001 US Surveillance Study. Clin Lab Med. 2004;24:503-30.
- 64. Cardozo DM, Nascimento-Carvalho CM, Souza FR, Silva NM. Nasopharyngeal colonization and penicillin resistance among Pneumococcal Strains: a world-wide 2004 update. Braz J Infect Dis (in press).
- 65. Schito GC. Is antimicrobial resistance also subject to globalization? Clin Microbiol Infect. 2002;8 Suppl 3:1-8, 33-5.
- 66. Brandileone MC, Casagrande ST, Guerra ML, Zanella RC, Andrade AL, Di Fabio JL. Increase in numbers of beta-lactam-resistant invasive Streptococcus pneumoniae in Brazil and the impact of conjugate vaccine coverage. J Med Microbiol. 2006;55:567-74.
- 67. Casagrande ST, Landgraf IM, Kobata AMM, Zanella RC, Bonkermann S. Antimicrobial resistance among invasive Haemophilus influenzae strains: results of a Brazilian study carried out from 1996 through 2000. Braz J Med Biol Res. 2002;35:1293-300.
- 68. Perez-Trallero E, Garcia-de-la-Fuente C, Garcia-Rey C, Baquero F, Aguilar L, Dal-Re R, et al. Geographical and ecological analysis of resistance, coresistance, and coupled resistance to antimicrobials in respiratory pathogenic bacteria in Spain. Antimicrob Agents Chemother. 2005;49:1965-72.
- 69. Bingen E, Bidet P, Mihaila-Amrouche L, Doit C, Forcet S, Brahimi N, et al. Emergence of macrolide-resistant Streptococcus pyogenes strains in French children. Antimicrob Agents Chemother. 2004;48:3559-62.
- 70. Grivea IN, Al-Lahham A, Katopodis GD, Syrogiannopoulos GA, Reinert RR. Resistance to erythromycin and telithromycin in Streptococcus pyogenes isolates obtained between 1999 and 2002 from Greek children with tonsillopharyngitis: phenotypic and genotypic analysis. Antimicrob Agents Chemother. 2006;50:256-61.
- 71. Jacobs MR. Streptococcus pneumoniae: epidemiology and patterns of resistance. Am J Med. 2004;117 Suppl 3A:3S-15S.
- 72. Sokol W. Epidemiology of sinusitis in the primary care setting: results from the 1999-2000 respiratory surveillance program. Am J Med. 2001;111 Suppl 9A:19S-24S.
- 73. Austin DJ, Kristinsson KG, Anderson RM. The relationship between the volume of antimicrobial consumption in human communities and the frequency of resistance. Proc Natl Acad Sci. 1999;96:1152-6.
- 74. Wenzel RP, Edmond MB. Managing antibiotic resistance. N Engl J Med. 2000;343:1961-3.
- 75. Levy SB. Antibiotic resistance: an ecological imbalance. In: Antibiotic resistance: origins, evolution, selection and spread. Ciba Foundation Symposium 207. Chichester, England: John Wiley; 1997. p. 1-14.
- 76. Garcia-Rey C, Aguilar L, Baquero F, Casal J, Dal-Re R. Importance of local variations in antibiotic consumption and geographical differences of erythromycin and penicillin resistance in Streptococcus pneumoniae J Clin Microbiol. 2002;40:159-64.
- 77. Hogberg L, Ekdahl K, Sjostrom K, Olsson-Liljequist B, Walder M, Melander E, et al. Penicillin-resistant pneumococci in Sweden 1997-2003: increased multiresistance despite stable prevalence and decreased antibiotic use. Microb Drug Resist. 2006;12:16-22.
- 78. Levine OR, O'Brien KL, Knoll M, Adegbola RA, Black S, Cherian T, et al. Pneumococcal vaccination in developing countries. Lancet. 2006;367:1880-2.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
23 Fev 2007 -
Data do Fascículo
Nov 2006