CARTAS AO EDITOR
Cortisol salivar na avaliação do eixo hipotálamohipofisárioadrenal em crianças saudáveis menores de 3 anos
Prezado Editor,
Na publicação recente de Silva et al.1, um nível médio de cortisol matinal de 558 nmol/L (variação de 77 a 1.620 nmol/L) foi relatado em crianças. Isso é significativamente maior que quaisquer valores de cortisol salivar em crianças publicados anteriormente. Embora Silva et al. não tenham relatado os níveis séricos de cortisol correspondentes, seus dados contradizem a noção de que somente o componente livre do cortisol pode ser transferido à saliva, sendo que em condições basais, o cortisol salivar chega a < 10% do cortisol sérico total. A maioria das instituições relata níveis matinais de cortisol bem menores que, em média, são < 30 nmol/L (Tabela 1).
Os autores afirmam que não foram capazes de localizar, na literatura, níveis de cortisol salivar de referência para crianças. Para informação dos leitores, incluímos uma breve síntese dos estudos pediátricos já publicados sobre cortisol salivar (Tabela 1). Nosso grupo publicou recentemente valores de referência para o cortisol salivar em crianças saudáveis8. Os limites para o cortisol matinal variaram entre 0 e 25 nmol/L8.
Silva et al. utilizaram um radioimunoensaio (RIE) próprio de cortisol empregando anticorpos anticortisol3oxima acoplados à albumina bovina, encontrando uma reação cruzada de 8,5% para a cortisona e de 7,9% para o 11deoxicortisol. Essas reações cruzadas são maiores que nos radioimunoensaios disponíveis no mercado. Por exemplo, as informações do teste de RIE da Orion Diagnostica Spectra demonstram uma reação cruzada de 0,9% para a cortisona e de 0,3% para o 11deoxicortisol. Contudo, a reação cruzada elevada à cortisona e ao 11deoxicortisol não explica porque os resultados de Silva et al. diferem tanto dos dados publicados anteriormente. Isso enfatiza a importância de se estabelecer valores de referência para todos os métodos e em todas as instituições, conforme mencionado no Editorial na mesma edição desta revista9. Entretanto, para não confundir os clínicos, especialmente aqueles que não estão familiarizados com os níveis de cortisol salivar, os autores poderiam ter explicado isso melhor em sua discussão. Será que os autores poderiam comentar sobre o grau de discrepância entre os níveis de cortisol salivar relatados por eles e aqueles publicados anteriormente e resumidos na Tabela 1?
Referências
1. Silva ML, Mallozi MC, Ferrari GF. Salivary cortisol to assess the hypothalamicpituitaryadrenal axis in healthy children under 3 years old. J Pediatr (Rio J). 2007;83:1216.
2. Bettendorf M, Albers N, Bauer J, Heinrich UE, Linderkamp O, MaserGluth C. Longitudinal evaluation of salivary cortisol levels in fullterm and preterm neonates. Horm Res. 1998;50:3038.
3. Calixto C, Martinez FE, Jorge SM, Moreira AC, Martinelli CE. Correlation between plasma and salivary cortisol levels in preterm infants. J Pediatr. 2002;140:1168.
4. Gröschl M, Rauh M, Dörr HG. Circadian rhythm of salivary cortisol, 17alphahydroxyprogesterone, and progesterone in healthy children. Clin Chem. 2003;49:168891.
5. Kiess W, Meidert A, Dressendorfer RA, Schriever K, Kessler U, Konig A, et al. Salivary cortisol levels throughout childhood and adolescence: relation with age, pubertal stage, and weight. Pediatr Res. 1995;37(4 Pt 1):5026.
6. Shimada M, Takahashi K, Ohkawa T, Segawa M, Higurashi M. Determination of salivary cortisol by ELISA and its application to the assessment of the circadian rhythm in children. Horm Res. 1995;44:2137.
7. Tornhage CJ. Reference values for morning salivary cortisol concentrations in healthy schoolaged children. J Pediatr Endocrinol Metab. 2003;15:197204.
8. Maguire AM, Ambler GR, Moore B, Waite K, McLean M, Cowell CT. The clinical utility of alternative, less invasive sampling techniques in the assessment of oral hydrocortisone therapy in children and adolescents with hypopituitarism. Eur J Endocrinol. 2007;156:4716.
9. Kiess W, Pfaeffle R. Steroid analysis in saliva: a noninvasive tool for pediatric research and clinical practice. J Pediatr (Rio J). 2007;83:979.
Ann M. Maguire
Christopher T. Cowell
Institute of Endocrinology and Diabetes, The Children's Hospital at Westmead, Sydney, Australia. Discipline of Paediatrics and Child Health, University of Sydney, Sydney, Australia
Resposta dos autores
Dosagem de cortisol salivar envolve avaliação adrenal, realizada de forma prática e sem estresse, viabilizando sua aplicabilidade na pediatria.
A medida de cortisol na saliva pode ser executada por diferentes métodos, os quais demonstram sensibilidade e especificidade elevadas, exaltando a importância deste exame. No estudo, foi utilizado o método de radioimunoensaio (RIA) sem extração1. Neste, após a centrifugação da saliva, é acrescentado um anticorpo contra o cortisol produzido em coelho contra o conjugado 3oxima, acoplado à albumina bovina, produzido pelo Prof. Dr. José Gilberto Vieira (laboratório Fleury), o qual tem sensibilidade que chega a 5 ng/dL2. A eficácia do método optado no estudo é baseada na existência de coeficiente de variação abaixo de 12 a 15%, com análise em duplicata2.
A consideração da idade na dosagem de cortisol salivar é relevante, uma vez que os estudos colocam a possibilidade de diferenças dos resultados3,4.
O compromisso dos autores em estabelecer valores de referência de cortisol salivar em menores de 3 anos saudáveis teve por base a escassez desses dados na literatura que reunissem um número adequado de amostras em faixa etária restrita e cuidados de técnica de coleta.
Neste contexto, é com grande satisfação que recebemos a carta da Dra. Ann M. Maguire e do Prof. Christopher T. Cowell, The Children"s Hospital at Westmead, Sydney, e da University of Sydney, na Austrália, que coloca alguns aspectos sobre o nosso trabalho publicado "Cortisol salivar na avaliação do eixo hipotálamohipofisárioadrenal em crianças saudáveis menores de 3 anos". Essa manifestação abre a oportunidade de ampliar o assunto, com o acréscimo de esclarecimentos a fim de evitar interpretações inadequadas.
Dentre os estudos citados na Tabela 1 da carta ao editor pela Dra. Maguire e pelo Prof. Cowell, ressaltamos Gröschl et al.5, no qual foram avaliadas 252 crianças saudáveis e eutróficas. Todavia, ao analisar o número amostral referente a cada faixa etária (< 1 mês, n = 13; 1 a 12 meses, n = 17; 1 a 2 anos, n = 10; 2 a 15 anos, n = 212), obtivemos entre os lactentes um poder de teste abaixo de 80%, com erro alfa superior a 0,05. Em outro estudo, de Kiess et al.3, dos 138 pacientes, 10 pertenciam à faixa etária de 0 a 1 ano e 17 de 1 a 4 anos.
Em nosso estudo para variância de 95% e erro 1%, o tamanho amostral foi calculado em 71, número inferior ao utilizado (n = 91).
À lista de estudos envolvendo dosagem de cortisol salivar mencionada pela Dra. Maguire e pelo Prof. Cowell, poderíamos acrescentar estudos sob técnica semelhante ao nosso, como o de Fogaça et al.6, que avaliaram 11 crianças de 4 a 6 meses, e o de Few et al.7, Neste, os autores consideraram 106 crianças de 1 a 12 meses, com coleta nos seguintes períodos: cedo = 9:30 às 12 h e tarde = 14 às 16 h. Esses intervalos estão tão próximos que, por certo, prejudicam a verificação de ritmo circadiano. Outro aspecto importante quanto ao horário é a possibilidade de diferença nas medidas matutinas e vespertinas de cortisol salivar entre os menores de 1 ano e acima de 1 ano3,5. Desta forma, o estudo de Törnhage8, que somente considerou medida matutina, não permite a avaliação dessa diferença relacionada às faixas etárias.
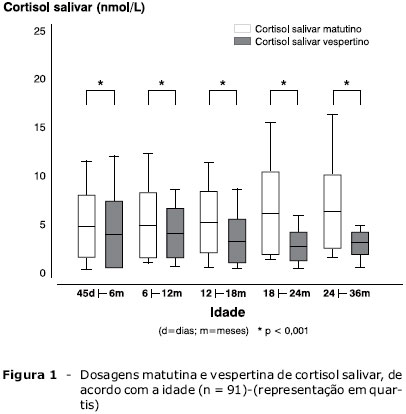
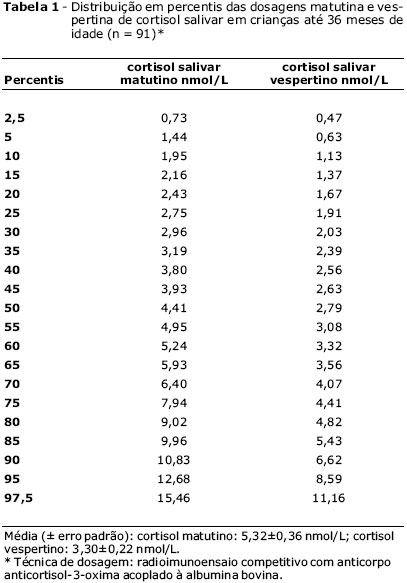
A discrepância entre os valores apresentados em nosso estudo e os citados pela Dra. Maguire e pelo Prof. Cowell foi revista. Os resultados de dosagem foram emitidos pelo laboratório Fleury em ng/dL, e a conversão em nmol/L baseouse na referência do manual de exames da Central de Radioimunoensaio de São Paulo9. Solicitamos esclarecimentos ao laboratório Fleury, que nos informou que o valor de conversão deste manual está errado10. Os cálculos foram refeitos, e os valores médios (±erro padrão) esperados para a dosagem matutina foram de 5,32±0,36 nmol/L, com variação de 0,73 a 15,46 nmol/L (percentis 2,5 a 97,5), e para a vespertina foram de 3,30±0,22 nmol/L, com variação de 0,47 a 11,16 nmol/L (percentis 2,5 a 97,5).
Anexamos uma errata da tabela com os valores do estudo em percentis, assim como das Figuras 1 e 2.
Referências
1. Vieira JGH, Noguti KO, Hidal JT, Russo EMK, Maciel RMB. Ensaio do cortisol na saliva como um método para avaliação da fração livre sérica. Arq Bras Endocrinol Metab. 1984;28:810.
2. Hanrahan K, McCarthy AM, Kleiber C, Lutgendorf S, Tsalikian E. Strategies for salivary cortisol collection and analysis in research with children. Appl Nurs Res. 2006;19:95101.
3. Kiess W, Meidert A, Dressendörfer RA, Schriever K, Kessler U, König A, et al. Salivary cortisol levels throughout childhood and adolescence: relation with age, pubertal stage, and weight. Pediatr Res. 1995;37(4 Pt 1):5026.
4. Törnhage CJ, Alfvén G. Diurnal salivary cortisol concentrations in schoolage children: increased morning cortisol concentration and total cortisol concentration negatively correlated to body mass index in children with recurrent abdominal pain of psychosomatic origin. J Pediatr Endocrinol Metab. 2006;19:84354.
5. Gröschl M, Rauh M, Dorr HG. Circadian rhythm of salivary cortisol, 17 alphahydroxyprogesterone, and progesterone in healthy children. Clin Chem. 2003;49:168891.
6. Fogaça MC, Carvalho WB, Peres CA, Lora MI, Hayashi LF, Verreschi ITN. Cortisol salivar como indicador da função adrenal em lactentes sadios com massagem terapêutica. Sao Paulo Med J. 2005;123:2158.
7. Few JD, Mangat TK, Oppe TE, James VH. Saliva aldosterone concentration in healthy infants. Arch Dis Child. 1986;61:5089.
8. Törnhage CJ. Reference values for morning salivary cortisol concentrations in healthy schoolaged children. J Pediatr Endocrinol Metab. 2002;15:197204.
9. Di Dio R, Barbério JC, Pradal MG, Menezes MA. Procedimentos hormonais: Central de Radioimunoensaio de São Paulo. 3ªed. São Paulo: CPD CRIESP; 1995.
10. Olesen H, Ibsen I, Bruunshuus I, Kenny D, Dybkaer R, FuentesArderiu X, et al. Properties and Units in the Clinical Laboratory Sciences. Part XII. Properties and Units in General Clinical Chemistry. (IUPAC Technical Report). Pure Appl. Chem. 2000;72:747972.
Margarete L. Silva
Mestre, Universidade Estadual Paulista (UNESP), Botucatu, SP, Brasil. Auxiliar de ensino, Disciplina de Pediatria, Faculdade de Medicina do ABC, Santo André, SP, Brasil
Márcia C. Mallozi
Universidade Federal de São Paulo Escola Paulista de Medicina (UNIFESPEPM), São Paulo, SP, Brasil. Auxiliar de ensino, Disciplina de Pediatria, Faculdade de Medicina do ABC, Santo André, SP, Brasil
Giesela F. Ferrari
Doutora. Professora assistente, Disciplina de Pneumologia Pediátrica, Departamento de Pediatria, Faculdade de Medicina de Botucatu, UNESP, Botucatu, SP, Brasil
Datas de Publicação
-
Publicação nesta coleção
27 Ago 2007 -
Data do Fascículo
Ago 2007