Resumos
OBJETIVO: Avaliar a liberação espontânea de ânion superóxido por granulócitos de sangue periférico de pacientes com asma crônica não-controlada antes e após corticoterapia e de indivíduos sadios. MÉTODOS: Foram estudados 32 pacientes entre 6 e 18 anos (média 12,04 anos) e 29 indivíduos sadios como grupo de comparação. Os pacientes foram agrupados de acordo com o volume expiratório forçado no primeiro segundo: grupo I, volume expiratório forçado no primeiro segundo entre 60 e 80%, 19 pacientes; e grupo II, volume expiratório forçado no primeiro segundo = 60%, 13 pacientes. A liberação espontânea de superóxido por granulócitos, medida por espectrofotometria utilizando superóxido dismutase, foi avaliada nos pacientes antes e após o tratamento com prednisona por via oral e beclometasona, budesonida ou fluticasona administradas por via inalatória. Na análise estatística foram utilizados os testes de análise de variância, Tukey e de Wilcoxon. RESULTADOS: Comparando-se a liberação de ânion superóxido por granulócitos dos pacientes asmáticos e indivíduos sadios observamos que a liberação foi maior nos asmáticos não-controlados do grupo II (p < 0,05). Avaliando-se a liberação de superóxido pelas células dos pacientes antes e após a terapia com corticosteroide uma diminuição significativa foi observada apenas no grupo I. CONCLUSÃO: O impacto dos glicocorticoides sobre a modulação da inflamação ocorreu nos indivíduos asmáticos não-controlados com volume expiratório forçado no primeiro segundo entre 60 e 80%. Naqueles com volume expiratório forçado no primeiro segundo = 60 não foi observada essa modulação, havendo necessidade de mais estudos para avaliar o impacto de tal achado nos pacientes asmáticos.
Corticosteroides; radical superóxido; granulócitos; asma; criança; adolescente
OBJECTIVE: To evaluate spontaneous release of superoxide anion by peripheral blood granulocytes of atopic patients with uncontrolled asthma undergoing glucocorticoid therapy and of healthy subjects. METHODS: We studied 32 patients, aged 6 to 18 (mean 12.04), and 29 healthy subjects as a comparative group. Patients were grouped according to the forced expiratory vital capacity in the first second. Group I, forced expiratory vital capacity in the first second of between 60 and 80%, had 19 patients, and group II, forced expiratory vital capacity in the first second = 60%, had 13 patients. Spontaneous superoxide release by granulocytes was measured by a spectrophotometer method based on superoxide dismutase, before and after oral prednisone and beclomethasone, budesonide or fluticasone inhaled therapy. Statistical analyses were performed using ANOVA, Wilcoxon and Tukey tests. RESULTS: Comparing the superoxide anion release by granulocytes of asthmatic patients and healthy subjects, we observed a higher release by cells of the uncontrolled patient group II (p < 0.05). Evaluating the superoxide release by cells of asthmatic patients before and after steroid therapy, a significant decrease was found only in patient group I. CONCLUSION: The impact of corticosteroids on inflammatory modulation occurred in the uncontrolled asthmatics with forced expiratory vital capacity in the first second between 60 and 80%. In those with forced expiratory vital capacity in the first second of = 60%, this finding was not observed. Further studies are necessary to evaluate the effect of this finding on asthmatic patients.
Corticosteroids; superoxide radical; granulocytes; asthma; children; adolescents
ARTIGO ORIGINAL
Avaliação da inflamação com base na liberação de radicais oxidantes por granulócitos na asma crônica não-controlada
Cristina F. SartorelliI; Jussara RehderII; Antonio Condino NetoIII; Maria Marluce S. VilelaIV
IMestre, Pediatria, Curso de Pós-Graduação em Saúde da Criança e do Adolescente, Centro de Investigação em Pediatria (CIPED), Faculdade de Ciências Médicas (FCM), Universidade Estadual de Campinas (UNICAMP), Campinas, SP. Professora assistente, Departamento de Pediatria, Faculdade de Medicina de Jundiaí (FMJ), Jundiaí, SP
IIBióloga, CIPED, FCM, UNICAMP, Campinas, SP
IIIProfessor associado, Departamento de Pediatria, FCM, UNICAMP, Campinas, SP
IVProfessora titular, Departamento de Pediatria, CIPED, FCM, UNICAMP, Campinas, SP
Correspondência Correspondência: Maria Marluce dos Santos Vilela Centro de Investigação em Pediatria, Departamento de Pediatria Faculdade de Ciências Médicas Universidade Estadual de Campinas - Caixa Postal 6111 CEP 13083-887 - Campinas, SP Tel.: (19) 3521.8959 Fax: (19) 3521.8972 Email: marluce@fcm.unicamp.br
RESUMO
OBJETIVO: Avaliar a liberação espontânea de ânion superóxido por granulócitos de sangue periférico de pacientes com asma crônica não-controlada antes e após corticoterapia e de indivíduos sadios.
MÉTODOS: Foram estudados 32 pacientes entre 6 e 18 anos (média 12,04 anos) e 29 indivíduos sadios como grupo de comparação. Os pacientes foram agrupados de acordo com o volume expiratório forçado no primeiro segundo: grupo I, volume expiratório forçado no primeiro segundo entre 60 e 80%, 19 pacientes; e grupo II, volume expiratório forçado no primeiro segundo = 60%, 13 pacientes. A liberação espontânea de superóxido por granulócitos, medida por espectrofotometria utilizando superóxido dismutase, foi avaliada nos pacientes antes e após o tratamento com prednisona por via oral e beclometasona, budesonida ou fluticasona administradas por via inalatória. Na análise estatística foram utilizados os testes de análise de variância, Tukey e de Wilcoxon.
RESULTADOS: Comparando-se a liberação de ânion superóxido por granulócitos dos pacientes asmáticos e indivíduos sadios observamos que a liberação foi maior nos asmáticos não-controlados do grupo II (p < 0,05). Avaliando-se a liberação de superóxido pelas células dos pacientes antes e após a terapia com corticosteroide uma diminuição significativa foi observada apenas no grupo I.
CONCLUSÃO: O impacto dos glicocorticoides sobre a modulação da inflamação ocorreu nos indivíduos asmáticos não-controlados com volume expiratório forçado no primeiro segundo entre 60 e 80%. Naqueles com volume expiratório forçado no primeiro segundo = 60 não foi observada essa modulação, havendo necessidade de mais estudos para avaliar o impacto de tal achado nos pacientes asmáticos.
Palavras-chave: Corticosteroides, radical superóxido, granulócitos, asma, criança, adolescente.
Introdução
A asma é uma doença inflamatória crônica com múltiplos fenótipos. A inflamação das vias aeríferas na asma alérgica é mediada pelas células auxiliares tipo 2 (Th2)efetoras específicas para proteínas inócuas, aeroalérgenos, do ambiente1. No Brasil, a despeito da tendência de redução, a prevalência de sintomas de asma ainda é uma das maiores da América Latina2.
A exposição frequente aos aeroalérgenos mantém as células Th2de memória ativadas e induz à disfunção crônica do sistema imune, resultando em processo inflamatório persistente. A ativação de eosinófilos, basófilos, neutrófilos e monócitos e sua interação com células residentes levam à liberação de mediadores farmacológicos e imunológicos pró-inflamatórios, incluindo espécies reativas de oxigênio3. Desde o nascimento, a ontogenia do sistema NADPH oxidase de leucócitos, síntese de ânion superóxido e atividade microbicida, é semelhante ao indivíduo adulto4. Os radicais oxidantes levam à injúria aguda das células e tecidos através da peroxidação lipídica e da oxidação proteica e da liberação de mediadores endógenos, especialmente os metabólitos do ácido aracdônico, ativam ainda o fator nuclear de transcrição ?B (NF-?B) e a proteína ativadora-1 (AP-1) amplificando a resposta inflamatória5.
Estudos prévios demonstram que eosinófilos6, neutrófilos7 e monócitos8 de sangue periférico, assim como leucócitos de vias aeríferas de pacientes asmáticos liberam grandes quantidades de espécies reativas de oxigênio, principalmente durante os períodos de exacerbação da doença9. Observaram também correlação direta entre produção de ânion superóxido por neutrófilos de sangue periférico e gravidade, progressão e duração da doença7.
Embora a inflamação seja a principal característica fisiopatológica da asma, os métodos convencionais para classificar a doença e avaliar a resposta ao tratamento não incluem uma medida direta da inflamação. No entanto, especialmente na infância, o manejo do paciente asmático fundamentado apenas nos sintomas e na função pulmonar pode ser equivocado, já que a percepção dos sintomas e sua correlação com a função pulmonar são variáveis10,11. Além desses aspectos, é relevante considerar que as alterações na função pulmonar poderão ser permanentes, devido ao remodelamento da mucosa brônquica. Tal teste passa a não ser o adequado para avaliação da resposta terapêutica12. Sob essas circunstâncias, fica clara a necessidade do uso de um marcador de inflamação na avaliação e acompanhamento do paciente asmático.
A natureza invasiva da biópsia pulmonar e do lavado broncoalveolar torna esses métodos inaceitáveis para avaliação da inflamação. Na análise do muco espontâneo ou induzido por solução salina, o número de eosinófilos, níveis de proteína catiônica eosinofílica, leucotrieno E4 e RANTES encontram-se aumentados em pacientes com asma pouco controlada e melhoram após o tratamento13. Embora esse método seja promissor, é de difícil execução. Recentemente, a dosagem de radicais intermediários do oxigênio (ROI)14 e a medida da fração de óxido nítrico no ar exalado (FeNO) estão sendo utilizadas como métodos não-invasivos de avaliação da inflamação de vias aéreas15.
Os objetivos do nosso estudo foram: comparar a liberação de ânion superóxido por granulócitos de sangue periférico de pacientes atópicos com asma não-controlada, classificados de acordo com o grau de obstrução de vias aeríferas determinado pelo volume expiratório forçado no primeiro segundo (VEF1) com a de indivíduos sadios e investigar os efeitos terapêuticos dos glicocorticoides administrados por via oral e via inalatória, sobre a liberação de ânion superóxido desses grupos de pacientes.
Métodos
Indivíduos
Os pacientes foram recrutados no ambulatório de Alergia e Imunologia Pediátricas do Hospital de Clínicas da Universidade Estadual de Campinas (UNICAMP). O estudo iniciou-se em março de 2001 e foi concluído em julho de 2004. Inicialmente, foram selecionados 41 indivíduos atópicos com asma persistente classificada como leve em 18 indivíduos, moderada em 17 e grave em seis indivíduos. Os critérios de inclusão foi apresentar asma não-controlada caracterizada pela presença de sintomas e exacerbações frequentes, VEF1 basal < 80%, limitação na atividade física e necessidade habitual de beta2-agonistas1. Por essa razão, nove indivíduos com asma persistente leve foram excluídos do estudo. A idade dos pacientes variou entre 6 a 18 anos (média ± desvio padrão 12,04±2,47 anos). O diagnóstico de asma foi estabelecido para cada paciente baseado nos sintomas e na reversibilidade da obstrução de vias aéreas1. Atopia foi caracterizada pelo antecedente familiar de rinite, asma ou dermatite atópica, testes cutâneos de leitura imediata positivos para aeroalérgenos domiciliares e níveis elevados de IgE sérica. Para o teste cutâneo, foram utilizados extratos alergênicos (IPI-ASAC do Brasil) para: Dermatophagoides pteronyssinus, Dermatophagoides farinae, Blomia tropicalis, Blatella germânica, Canis familiaris, Felis domesticus, fungos I e II, epitélio de cão, epitélio de gato, histamina e controle negativo. Durante o estudo não houve evidências clínicas de asma desencadeada por processos infecciosos. O VEF1 foi usado para classificar os pacientes em dois grupos: grupo I, composto por 19 pacientes com VEF1 entre 60 e 80% do previsto; e grupo II, composto por 13 pacientes com VEF1 = 60% do previsto. O grupo de comparação foi formado por 29 indivíduos sadios sem história clínica de atopia com idade entre 25 e 40 anos.
O tratamento com corticosteroides sistêmico e tópico inalatório seguiu as recomendações do Global Initiative for Asthma (GINA)1. Todos os pacientes foram submetidos a um curso de prednisona por via oral na dose de 2 mg/kg/dia, com máximo de 60 mg associado ao uso de beta2-agonistas de curta duração, durante 7 dias e, em seguida, mantidos sob corticoterapia por via inalatória. Quando necessário, ao longo do estudo, foram administrados aos pacientes beta2-agonistas de ação curta ou longa. A avaliação por espirometria e liberação de ânion superóxido de granulócitos de sangue periférico dos pacientes foi realizada imediatamente antes e após a corticoterapia oral, e simultaneamente ao corticoide por via inalatória. Dez (52%) pacientes do grupo I foram avaliados após 1 semana de terapia com prednisona e nove (48%) após corticosteroide tópico inalatório por um período médio de 2,4 meses. Nove (70%) pacientes do grupo II foram avaliados após 1 semana de terapia com prednisona e quatro (30%) avaliados após o uso de corticosteroide tópico inalatório por um período médio de 4,7 meses. No grupo I, dose moderada de budesonida foi prescrita para um e alta para três indivíduos; dose alta de propionato de fluticasona para dois e de dipropionato de beclometasona para três indivíduos. No grupo II, dose alta de budesonida foi prescrita para quatro pacientes.
Consentimento informado por escrito foi outorgado pelos pais ou responsáveis pelos pacientes no início do estudo, e o protocolo foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de acordo com a convenção de Helsinki.
Isolamento dos granulócitos
Granulócitos foram isolados de amostras de 10 mL de sangue periférico por centrifugação em Ficoll-Hypaque (Hystopaque®1119)16. As células foram lavadas três vezes com solução salina balanceada de Hanks, e a contagem final de granulócitos foi ajustada para 2x107 células mL-1. A viabilidade celular medida por exclusão pelo Azul de Tripan foi superior a 90%.
Produção de ânion superóxido
A liberação espontânea de superóxido foi avaliada pelo método espectrofotométrico baseado na inibição da redução do citocromo-C pela superóxido-dismutase de acordo com McCord & Fridovich17, previamente modificado18. No dia do experimento, granulócitos foram incubados em solução salina balanceada de Hanks contendo citocromo-C (50 µM), e na metade dos tubos foi acrescentado superóxido-dismutase (60 U/mL). A absorbância ótica (550 nm) do sobrenadante foi medida em 0, 5, 15, 25, 45 e 60 minutos do início do experimento. A quantidade de ânion superóxido foi calculada utilizando-se coeficiente de extinção de 21.100 M-1 cm-1 e expressos em nanomoles (nmol) de superóxido por 106 células.
Análise estatística
A análise de variância para medidas repetidas (ANOVA) foi um teste inicial realizado para avaliar se havia diferenças entre os grupos. O teste de Tukey foi utilizado para comparar a quantidade de superóxido liberada pelas células dos indivíduos sadios com os dois grupos de pacientes, pré e pós tratamento. O teste de Wilcoxon para amostras relacionadas foi usado para a comparação da liberação de ânion superóxido e valores de VEF1 dos pacientes antes e após o tratamento com corticosteroides. Os resultados do estudo cinético de liberação de superóxido foram expressos em média ± desvio padrão. Para as análises, p < 0,05 foi considerado estatisticamente significativo19.
Resultados
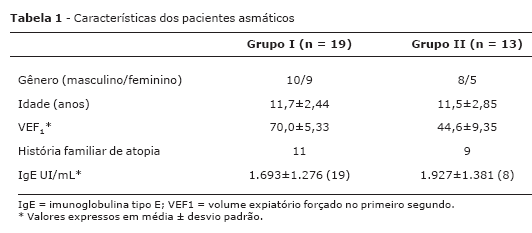
A Tabela 1 mostra as características das crianças e adolescentes asmáticos e grupo de comparação. O grupo controle foi constituído por 29 indivíduos, 17 masculinos e 12 femininos, com média de idade 30,4±2,63 anos.
O VEF1 médio dos pacientes asmáticos antes da corticoterapia foi de 70±5,3% para o grupo I e 44,62±9,4% para o grupo II. As diferenças no VEF1 médio antes e após corticoterapia foram de 14,5% para o grupo I (p = 0,002 teste de Wilcoxon) e 28% para o grupo II (p = 0,011 teste de Wilcoxon) (Figura 1).
O teste cutâneo de leitura imediata com aeroalérgenos foi positivo para antígenos do Dermatophagoides pteronyssinus em todos os pacientes, seguido pelo Dermatophagoides farinae com positividade em 80% em cada um dos grupos e pelo Blomia tropicalis positivo em 8 (42%) pacientes do grupo I e 5 (38%) do grupo II. Blatella germânica, Canis familiaris, Felis domesticus, e fungos I apresentaram positividade de 20% em ambos os grupos.
Aumento da liberação espontânea de superóxido por granulócitos de asmáticos não-controlados do grupo II
A avaliação inicial da liberação espontânea de ânion superóxido por granulócitos dos grupos de asmáticos e controles demonstrou a presença de diferença significativa entre os grupos (p = 0,007, ANOVA). A comparação da liberação de ânion superóxido por células de indivíduos sadios com asmáticos do grupo I e do grupo II separadamente demonstrou que, antes da corticoterapia, asmáticos do grupo II (VEF1 = 60%) liberaram quantidades significantemente maiores de ânion superóxido aos 25, 45 e 60 minutos de incubação (p < 0,05 teste de Tukey) (Figura 2). Após o tratamento com corticosteroides, os valores de ânion superóxido liberados por asmáticos do grupo II e grupo controle foram similares.
Não houve diferença estatística entre a liberação espontânea de ânion superóxido por asmáticos do grupo I (60% < VEF1 < 80%) e indivíduos sadios antes ou após a corticoterapia.
Redução da liberação espontânea de ânion superóxido por granulócitos de asmáticos do grupo I após corticoterapia
A comparação da liberação espontânea de ânion superóxido por granulócitos de asmáticos do grupo I (60% < VEF1 < 80%), antes e após corticoterapia (teste de Wilcoxon para amostras relacionadas), mostrou uma redução significativa aos 15 (p = 0,027), 25 (p = 0,001), 45 (p = 0,001) e 60 (p = 0,001) minutos de incubação (Figura 3). Para os pacientes do grupo II (VEF1 = 60%), após a corticoterapia, houve uma redução não-significativa na liberação de superóxido.
Discussão
O aumento da liberação de ânion superóxido por granulócitos de sangue periférico de asmáticos não-controlados encontrado no presente estudo confirma nossos resultados prévios20. A correlação entre o estado da doença asmática, a produção exagerada de espécies reativas de oxigênio por células inflamatórias e um desequilíbrio entre sistemas oxidante e antioxidante foi relatada por diversos autores6,14. Alterações características da asma, como desnudamento do epitélio, hiper-reatividade brônquica e aumento da secreção de muco podem ser produzidas pela ação das espécies reativas de oxigênio, confirmando sua participação na fisiopatologia da asma5.
Glicocorticoides são os anti-inflamatórios mais potentes para o tratamento da asma crônica. No entanto, o efeito da corticoterapia sobre os marcadores da inflamação de vias aeríferas se mostra variável. Majori et al. demonstraram que monócitos de asmáticos tratados com um curso de corticosteroide por via oral ou inalatória liberaram menos ânion de superóxido do que os pacientes não-tratados. No entanto, naqueles córtico-dependentes não houve essa diferença21. Em estudo envolvendo pacientes com asma de difícil controle, sob tratamento com corticosteroide por via oral, Stirling et al. observaram um subgrupo que mantinha FeNO elevada e evolução clínica desfavorável22. Em pacientes com asma moderada, La Grutta et al. evidenciaram uma correlação entre altos níveis de GM-CSF (granulocyte-macrophage colony-stimulating factor), IL-8, fator nuclear kappa B (KB) e FeNO com maior número de exacerbações e declínio no VEF1, demonstrando a persistência da inflamação apesar do uso de altas doses de corticosteroides23.
Após corticoterapia, embora os pacientes do grupo I (60% < VEF1 < 80%) apresentassem melhora clínica e queda significativa na liberação de anion superóxido, apenas 64% dos indivíduos atingiram valores normais de VEF1. Essa reversibilidade incompleta da obstrução de vias aéreas foi também encontrada por Bisgaard, que analisou o efeito da corticoterapia prolongada por via inalatória sobre a função pulmonar24. Pode-se sugerir como responsáveis por tal resultado a presença de remodelamento de vias aeríferas, onde a ação dos corticosteroides é questionável12 e, ainda, o efeito positivo rápido dos corticosteroides sobre os marcadores inflamatórios e mais tardio sobre a função pulmonar25.
Outro aspecto importante do presente estudo foi a ausência do efeito modulador da corticoterapia sobre a liberação de anion superóxido nos pacientes com maior grau de obstrução de vias aeríferas (VEF1 = 60%). Esse resultado pode refletir a diversidade nos padrões de inflamação de mucosa brônquica, eosinofílico, neutrofílico, misto ou paucigranular, identificados em asmáticos crônicos, os quais influenciam na resposta aos corticosteroides26.
Vários estudos em crianças mostram correlação entre FeNO, inflamação eosinofílica no sangue periférico e muco induzido avaliado por lavado broncoalveolar e por biópsia endobrônquica27,28. Tais resultados estimularam a publicação conjunta pelas American Thoracic Society e European Respiratory Society da padronização da medida de FeNO em crianças, confirmando a necessidade de se avaliar a inflamação29.
Nós confirmamos resultados anteriores21-25,30 de que os glicocorticoides contribuem para a restauração do estado oxidativo normal dos granulócitos de sangue periférico e melhoram a obstrução de vias aéreas em pacientes com VEF1 entre 60 e 80%. Em contraste, granulócitos de asmáticos com VEF1 = 60% não retornam ao seu estado oxidativo normal, embora se estabeleça aumento do VEF1 e melhora dos sintomas. Nossos resultados mostram que há um subgrupo de pacientes com asma crônica não-controlada que pode apresentar melhora dos sintomas e da obstrução brônquica após a terapia com corticosteroides e manter níveis elevados de liberação de anion de superóxido por granulócitos. Nesse subgrupo de pacientes, há manutenção da inflamação e consequentemente necessidade de outras medidas terapêuticas para se alcançar melhor prognóstico. Outros estudos com ampliação do tamanho da amostra e um seguimento clínico mais prolongado dos pacientes com asma persistente não-controlada e VEF1 = 60% são necessários para julgar a implicação definitiva de tais achados na evolução da doença.
Artigo submetido em 06.10.08, aceito em 04.02.09.
Fonte financiadora: Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Como citar este artigo: Sartorelli CF, Rehder J, Condino Neto A, Vilela MM. Assessment of inflammation based on the release of oxygen radicals by granulocytes in chronic uncontrolled asthma. J Pediatr (Rio J). 2009;85(2):143-148.
- 1. Global Initiative for Asthma [site na internet]. Global strategy for asthma management and prevention. Revised 2006. http://www.ginasthma.com/Guidelineitem.asp??l1=2&l2=1&intId=60 Acesso: 29/03/2006.
- 2. Solé D, Melo KC, Camelo-Nunes IC, Freitas LS, Britto M, Rosário NA, et al. Changes in the prevalence of asthma and allergic diseases among Brazilian schoolchildren (13-14 years old): comparison between ISAAC Phases One and Three. J Trop Pediatr. 2007;53:13-21.
- 3. Barnes PJ. Immunology of asthma and chronic obstructive pulmonary disease. Nat Rev Immunol. 2008;8:183-92.
- 4. Speer CP, Ambruso DR, Grimsley J, Johnston RB Jr. Oxidative metabolism in cord blood monocytes and monocyte-derived macrophages. Infect Immun. 1985;50:919-21.
- 5. Sugiura H, Ichinose M. Oxidative and nitrative stress in bronchial asthma. Antioxid Redox Signal. 2008;10:785-97.
- 6. Chanez JP, Dent G, Yukawa T, Barnes PJ, Chung KF. Generation of oxygen free radicals from blood eosinophils from asthma patients after stimulation with PAF or phorbol ester. Eur Resp J. 1990;3:1002-7.
- 7. Kanazawa H, Kurihara N, Hirata K, Takeda T. The role of free radicals in airway obstruction in asthmatic patients. Chest. 1991;100:1319-22.
- 8. Vachier I, Damon M, Le Doucen C, de Paulet AC, Chanez P, Michel FB, et al. Increased oxygen species generation in blood monocytes of asthmatic patients. Am Rev Respir Dis. 1992;146:1161-6.
- 9. Jarjour NN, Busse WW, Calhoun WJ. Enhanced production of oxygen radicals in nocturnal asthma. Am Rev Respir Dis. 1992;146:905-11.
- 10. Yawn BP, Brenneman SK, Allen-Ramey FC, Cabana MD, Markson LE. Assessment of asthma severity and asthma control in children. Pediatrics. 2006;118:322-9.
- 11. Fonseca AC, Fonseca MT, Rodrigues ME, Lasmar LM, Camargos PA. Peak expiratory flow monitoring in asthmatic children. J Pediatr (Rio J). 2006;82:465-9.
- 12. James AL, Wenzel S. Clinical relevance of airway remodelling in airway diseases. Eur Respir J. 2007;30:134-55.
- 13. Romagnoli M, Vachier I, Tarodo de la Fuente P, Meziane H, Chavis C, Bousquet J, et al. Eosinophilic inflammation in sputum of poorly controlled asthmatics. Eur Respir J. 2002;20:1370-7.
- 14. Nadeem A, Raj HG, Chabra SK. Increased oxidative stress in acute exacerbations of asthma. J Asthma. 2005;42:45-50.
- 15. Gogate S, Katial R. Pediatric biomarkers in asthma: exhaled nitric oxide, sputum eosinophils and leukotriene E4. Curr Opin Allergy Clin Immunol. 2008;8:154-7.
- 16. Boyum A. Isolation of mononuclear cells and granulocytes from human blood. Isolation of monuclear cells by one centrifugation, and of granulocytes by combining centrifugation and sedimentation at 1 g. Scand J Clin Lab Invest Suppl. 1968: 97:77-89.
- 17. McCord JM, Fridovich I. Superoxide dismutase. An enzymatic function for erythrocuprein (hemocuprein). J Biol Chem. 1969;244:6044-55.
- 18. Condino-Neto A, Newburger PE. NADPH oxidase activity and cytochrome b558 content of human Epstein-Barr-virus-transformed B lymphocytes correlate with expression of genes encoding components of the oxidase system. Arch Biochem Biophys. 1998;360:158-64.
- 19. Montgomery DC. Design and analysis of experiments. 6th ed. New York, NY: John Wiley & Sons; 2004.
- 20. Marçal LE, Rehder J, Newburger PE, Condino-Neto A. Superoxide release and cellular glutathione peroxidase activity in leukocytes from children with persistent asthma. Braz J Med Biol Res. 2004;37:1607-13.
- 21. Majori M, Vachier I, Godard P, Farce M, Bousquet J, Chanez P. Superoxide anion production by monocytes of corticosteroid-treated asthmatic patients. Eur Resp J. 1998;11:133-8.
- 22. Stirling RG, Kharitonov SA, Campbell D, Robinson DS, Durham SR, Chung KF, et al. Increase in exhaled nitric oxide levels in patients with difficult asthma and correlation with symptoms and disease severity despite treatment with oral and inhaled corticosteroids. Asthma and Allergy Group. Thorax. 1998;53:1030-4.
- 23. La Grutta S, Gagliardo R, Mirabella F, Pajno GB, Bonsignore G, Bousquet J, et al. Clinical and biological heterogeneity in children with moderate asthma. Am J Respir Crit Care Med. 2003;167:1490-5.
- 24. Bisgaard H. Use of inhaled corticosteroids in pediatric asthma. Pediatr Pulmonol Suppl. 1997;15:27-33.
- 25. Kharitonov SA, Barnes PJ. Effects of corticosteroids on noninvasive biomarkers on inflammation in asthma and chronic obstructive pulmonary disease. Proc Am Thorac Soc. 2004;1:191-9.
- 26. Green RH, Brightling CE, Bradding P. The reclassification of asthma based on subphenotypes. Curr Opin Allergy Clin Immunol. 2007;7:43-50.
- 27. Strunk RC, Szefler SJ, Phillips BR, Zeiger RS, Chinchilli VM, Larsen G, et al. Relationship of exhaled nitric oxide to clinical and inflammatory markers of persistent asthma in children. J Allergy Clin Immunol. 2003;112:883-92.
- 28. Pontin J, Blaylock MG, Walsh GM, Turner SW. Sputum eosinophil apoptotic rate is positively correlated to exhaled nitric oxide in children. Pediatr Pulmonol. 2008;43:1130-4.
- 29. Baraldi E, de Jongste JC; European Respiratory Society; American Thoracic Society. Measurement of exhaled nitric oxide in children, 2001. Eur Respir J. 2002;20:223-37.
- 30. Sadowska AM, Klebe B, Germonpré P, De Backer WA. Glucocorticosteroids as antioxidants in treatment of asthma and COPD. New application for and old medication? Steroids. 2007;72:1-6.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
13 Abr 2009 -
Data do Fascículo
Abr 2009
Histórico
-
Aceito
04 Fev 2009 -
Recebido
06 Out 2008