Resumos
OBJETIVO: Avaliar o perfil de sorotipos e a sensibilidade aos antimicrobianos de cepas de pneumococo obtidas de crianças e as implicações na formulação de vacinas pneumocócicas. MÉTODOS: Cepas de pneumococo isoladas no Hospital de Clínicas da Universidade Federal de Uberlândia, Uberlândia (MG), a partir de pacientes com doença invasiva, foram enviadas ao Instituto Adolfo Lutz, São Paulo (SP), para confirmação da identificação, sorotipagem e determinação da sensibilidade aos antimicrobianos. RESULTADOS: De abril de 1999 a dezembro de 2008, foram avaliadas 142 cepas de pneumococo obtidas de crianças de até 5 anos de idade. Setenta e cinco (52,8%) eram de pacientes do sexo masculino, e a idade variou de 1 a 60 meses (média de 19±15,4 meses e mediana de 15 meses). Os diagnósticos clínicos mais comuns foram pneumonia [92 casos (64,8%)] e meningite [33 casos (23,2%)], e as principais fontes de recuperação foram sangue [61 amostras (43%)], líquido pleural [52 (36,6%)] e liquor [28 (19,7%)]. Os sorotipos mais comuns foram o 14, 5, 6B, 1, 6A, 18C, 19A, 3, 9V, 19F, 23F, 9N e 10A. Foram detectadas 14 (9,9%) cepas penicilina-resistentes, restritas aos sorotipos 14, 6B, 19F, 19A e 23F e predominantes no período de 2004 a 2008 (p = 0,000). Foi detectada sensibilidade diminuída ao cotrimoxazol (79,5%), à eritromicina e à clindamicina (11,3% cada) e à ceftriaxona (5,6%). CONCLUSÕES: A resistência à penicilina foi detectada em 9,9% das cepas e predominou no período de 2004 a 2008. Foram identificados 20 diferentes sorotipos de pneumococo, e a cifra de cobertura pela vacina 7-valente atualmente disponível (PN CRM7) é de 71,9%.
Streptococcus pneumoniae; sorotipagem; vacinas pneumocócicas; farmacorresistência bacteriana
OBJECTIVE: To determine the prevalence of serotypes and antimicrobial susceptibility of strains of pneumococcus in children and to evaluate the implications for vaccine formulation. METHODS: Strains of pneumococcus obtained from children admitted with invasive diseases were isolated at Hospital de Clínicas of Universidade Federal de Uberlândia, Uberlândia, Brazil, and sent to Instituto Adolfo Lutz, São Paulo, Brazil, for further identification, serotyping, and determination of antimicrobial susceptibility. RESULTS: From April 1999 to December 2008, 142 strains of pneumococcus, obtained from children under 5 years of age, were analyzed. Seventy-five (52.8%) patients were male, and the age ranged from 1 to 60 months (mean age = 19±15.4 months; median = 15 months). The most common diagnoses were pneumonia [92 cases (64.8%)] and meningitis [33 cases (23.2%)]. The strains were mostly isolated from blood [61 samples (43%)], pleural fluid [52 samples (36.6%)], and cerebrospinal fluid [28 samples (19.7%)]. The most common serotypes were 14, 5, 6B, 1, 6A, 18C, 19A, 3, 9V, 19F, 23F, 9N, and 10A. There were 14 [9.9%] penicillin-resistant strains, which was detected only in the following serotypes: 14, 6B, 19F, 19A, and 23F, being predominant from 2004 to 2008 (p = 0.000). There was reduced susceptibility to co-trimoxazole (79.5%), erythromycin and clindamycin (11.3% each), and ceftriaxone (5.6%). CONCLUSIONS: Penicillin resistance was detected in 9.9% of the strains, being predominant from 2004 to 2008. Twenty different pneumococcal serotypes were identified, and 71.9% of the serotypes were represented in the 7-valent conjugate vaccine (PN CRM7) currently available.
Streptococcus pneumoniae; serotyping; pneumococcal vaccines; drug resistance
ARTIGO ORIGINAL
Prevalência de sorotipos e resistência antimicrobiana de cepas invasivas do pneumococo em crianças: análise de 9 anos
Orlando Cesar ManteseI; Alan de PaulaII; Vivieni Vieira Prado AlmeidaIII; Paula Augusta Dias Fogaça de AguiarIV; Paula Carolina Bejo WolkersV; Jackelline Rodrigues AlvaresV; Samanta Cristine Grassi AlmeidaVI; Maria Luiza Leopoldo Silva GuerraVII; Maria Cristina de Cunto BrandileoneVIII
IDoutor, Pediatria, Universidade Federal de São Paulo (UNIFESP), São Paulo, SP. Professor, Pediatria, Faculdade de Medicina, Universidade Federal de Uberlândia (UFU), Uberlândia, MG
IIMestre, Ciências da Saúde, Pediatra, Faculdade de Medicina, UFU, Uberlândia, MG
IIIFarmacêutica-bioquímica, Laboratório do Hospital de Clínicas de Uberlândia, UFU, Uberlândia, MG, Especialista, Microbiologia Clínica, Universidade de São Paulo (USP), São Paulo, SP
IVMédica patologista clínica, Laboratório do Hospital de Clínicas de Uberlândia, UFU, Uberlândia, MG
VEnfermeira, Pós-Graduanda, Programa de Pós-Graduação em Ciências da Saúde, Faculdade de Medicina, UFU, Uberlândia, MG
VIMestre, Ciências, UNIFESP, São Paulo, SP, Pesquisadora científica, Instituto Adolfo Lutz (IAL), São Paulo, SP
VIISeção de Bacteriologia, IAL, São Paulo, SP
VIIIDoutora, Ciências. Escola Paulista de Medicina (EPM), UNIFESP, São Paulo, SP, Coordenadora, Projeto Sistema Regional de Vacinas (SIREVA), Seção de Bacteriologia, IAL, São Paulo, SP
Correspondência Correspondência: Orlando Cesar Mantese Avenida Pará, 1979 CEP 38405-320 - Uberlândia, MG Tel.: (34) 3232.2736 Fax: (34) 3232.2736 E mail: orlando@ufu.br
RESUMO
OBJETIVO: Avaliar o perfil de sorotipos e a sensibilidade aos antimicrobianos de cepas de pneumococo obtidas de crianças e as implicações na formulação de vacinas pneumocócicas.
MÉTODOS: Cepas de pneumococo isoladas no Hospital de Clínicas da Universidade Federal de Uberlândia, Uberlândia (MG), a partir de pacientes com doença invasiva, foram enviadas ao Instituto Adolfo Lutz, São Paulo (SP), para confirmação da identificação, sorotipagem e determinação da sensibilidade aos antimicrobianos.
RESULTADOS: De abril de 1999 a dezembro de 2008, foram avaliadas 142 cepas de pneumococo obtidas de crianças de até 5 anos de idade. Setenta e cinco (52,8%) eram de pacientes do sexo masculino, e a idade variou de 1 a 60 meses (média de 19±15,4 meses e mediana de 15 meses). Os diagnósticos clínicos mais comuns foram pneumonia [92 casos (64,8%)] e meningite [33 casos (23,2%)], e as principais fontes de recuperação foram sangue [61 amostras (43%)], líquido pleural [52 (36,6%)] e liquor [28 (19,7%)]. Os sorotipos mais comuns foram o 14, 5, 6B, 1, 6A, 18C, 19A, 3, 9V, 19F, 23F, 9N e 10A. Foram detectadas 14 (9,9%) cepas penicilina-resistentes, restritas aos sorotipos 14, 6B, 19F, 19A e 23F e predominantes no período de 2004 a 2008 (p = 0,000). Foi detectada sensibilidade diminuída ao cotrimoxazol (79,5%), à eritromicina e à clindamicina (11,3% cada) e à ceftriaxona (5,6%).
CONCLUSÕES: A resistência à penicilina foi detectada em 9,9% das cepas e predominou no período de 2004 a 2008. Foram identificados 20 diferentes sorotipos de pneumococo, e a cifra de cobertura pela vacina 7-valente atualmente disponível (PN CRM7) é de 71,9%.
Palavras-chave: Streptococcus pneumoniae, sorotipagem, vacinas pneumocócicas, farmacorresistência bacteriana.
Introdução
O Streptococcus pneumoniae é um dos agentes mais frequentes de pneumonia, otite média aguda (OMA), meningite e sinusite em crianças1,2. É responsável por elevadas taxas de morbimortalidade em crianças abaixo de 5 anos e adultos acima de 65 anos, particularmente nos países em desenvolvimento2-4.
A evolução clínica da infecção pneumocócica é influenciada por diversos fatores, entre eles a adequação do tratamento instituído. O tratamento para as infecções pneumocócicas é baseado na antibioticoterapia inicial que em geral é empírica quanto à etiologia e à sensibilidade in vitro aos antimicrobianos. Diante do isolamento da bactéria em cultura e do antibiograma, a antibioticoterapia pode ser, então, devidamente ajustada. A penicilina é a droga de escolha para muitas doenças pneumocócicas1,2; entretanto, com a descrição crescente de cepas resistentes à penicilina, a partir da década de 80, esquemas alternativos têm sido propostos5-7. Frente à resposta adequada ao tratamento com ß lactâmicos (penicilina ou ampicilina) de pacientes com doença pneumocócica invasiva (exceto meningite), mesmo quando causada por cepas com concentração inibitória mínima (CIM) até 2,0 µg/mL, tem sido recomendada uma redefinição das categorias de sensibilidade5.
A prevenção de doença invasiva baseia-se, fundamentalmente, na imunização ativa1-3. De acordo com o antígeno polissacarídico capsular, são descritos até o momento 91 diferentes sorotipos8,9 contidos em 46 sorogrupos de pneumococos10. Uma vacina 7-valente contendo polissacarídeo capsular dos sorotipos 4, 6B, 9V, 14, 18C, 19F e 23F, conjugados a um carreador proteico, foi licenciada nos EUA em 20003,10-12. A imunogenicidade do polissacarídeo é ampliada pela ligação covalente com a molécula proteica, particularmente em crianças abaixo dos 2 anos de idade3,10,11. Além disso, a vacina confere proteção contra a colonização em nasofaringe para os sorotipos nela representados3,10,11.
Com o objetivo de monitorar o padrão de resistência aos antimicrobianos e o perfil de sorotipos de pneumococo na América Latina, foi criado o Projeto Sistema Regional de Vacinas (SIREVA) pela Organização Panamericana de Saúde (OPAS) em 1993, com a participação de seis países (entre eles, o Brasil). A partir de 2004, o programa foi ampliado para abranger outras bactérias (Haemophilus influenzae e Neisseria meningitidis, além do pneumococo) e outros países (número atual de 20), passando a ser designado SIREVA II13-15. Trata-se de um programa de vigilância laboratorial no qual são analisadas (contabilizadas e descritas) características laboratoriais tais como o sorotipo e o padrão de resistência in vitro das cepas das bactérias recuperadas. Desde abril de 1999, Uberlândia (MG) participa da rede nacional do Projeto SIREVA por meio do envio de cepas de pneumococo isoladas no Laboratório de Análises Clínicas do Hospital de Clínicas da Universidade Federal de Uberlândia (HC-UFU), Uberlândia, para o Instituto Adolfo Lutz (IAL), São Paulo (SP).
Como o padrão de resistência aos antibióticos e a prevalência de sorotipos de pneumococo variam em diferentes populações, em diferentes regiões geográficas e, provavelmente, ao longo do tempo, é importante o estabelecimento do perfil dos sorotipos mais prevalentes numa determinada comunidade e o conhecimento das taxas de resistência para fundamentar a escolha da melhor cobertura vacinal e do melhor tratamento empírico inicial.
O objetivo deste trabalho foi documentar o perfil de sorotipos e a sensibilidade aos antimicrobianos das cepas de pneumococo obtidas em espécimes clínicos de crianças de até 5 anos de idade atendidas com doença invasiva no HC-UFU e avaliar as implicações para a formulação das vacinas antipneumocócicas.
Pacientes e métodos
O HC-UFU é um hospital público universitário totalmente conveniado com o Sistema Único de Saúde. Possui capacidade instalada de 510 leitos ativos e, por constituir um centro de referência regional, a maioria dos leitos é ocupada por pacientes que apresentam formas mais graves de doenças.
Este é um estudo de vigilância laboratorial, de série de casos, prospectivo, cujos dados laboratoriais de sorotipagem e sensibilidade in vitro aos antimicrobianos de cepas invasivas de pneumococo foram obtidos de pacientes admitidos no HC-UFU. O caso índice consiste em cepa de pneumococo isolada no Laboratório de Análises Clínicas a partir de espécimes clínicos (sangue, liquor, líquido pleural, líquido peritoneal, secreção de abscesso) de paciente internado. Os espécimes obtidos assepticamente foram devidamente processados e semeados em frascos para hemocultura (amostras de sangue) ou em placas de ágar chocolate e ágar sangue (demais tipos de amostra) o mais rapidamente possível após a coleta e imediatamente à chegada no laboratório. Somente um isolado de pneumococo por paciente por internação foi considerado no estudo. As cepas de pneumococos foram isoladas e identificadas no HC-UFU segundo os métodos internacionalmente descritos e encaminhadas para a Seção de Bacteriologia do IAL para confirmação da espécie, sorotipagem e determinação da sensibilidade in vitro aos antimicrobianos16. As cepas de pneumococo foram liofilizadas em leite desnatado a 20% e devidamente catalogadas.
A sensibilidade antimicrobiana foi avaliada pela técnica de difusão em disco para a oxacilina (1 µg), tetraciclina, ofloxacina, cloranfenicol, eritromicina, sulfametoxazol-trimetoprim (cotrimoxazol), vancomicina e clindamicina em placas de ágar Mueller-Hinton suplementada com sangue de carneiro a 5%, segundo técnica padronizada17,18. Cepas resistentes à oxacilina (halo de inibição ≤ 19 mm) foram submetidas à determinação da CIM para a penicilina pela técnica de microdiluição em caldo e consideradas, de acordo com os critérios do Clinical and Laboratory Standards Institute (CLSI) 200819, sensíveis (S) diante de CIM ≤ 0,06 µg/mL e com resistência (R) diante de CIM ≥ 0,12 µg/mL para cepas oriundas de paciente com meningite; para as cepas obtidas de pacientes sem meningite, os pontos de corte considerados foram S ≤ 2 µg/mL, resistência intermediária (RI) = 4 µg/mL e resistência plena (RP) ≥ 8 µg/mL. Cepas resistentes à oxacilina foram submetidas à determinação da CIM de ceftriaxona e consideradas S com CIM ≤ 0,5 µg/mL, RI com CIM = 1 µg/mL e RP com CIM ≥ 2 µg/mL para cepas provenientes de pacientes com meningite; para as cepas recuperadas de pacientes sem meningite, os valores de corte adotados foram CIM ≤ 1 µg/mL para S, CIM = 2 µg/mL para RI e CIM ≥ 4 µg/mL para RP20. Cepas sensíveis à oxacilina (halo de inibição > 19 mm) foram consideradas sensíveis à penicilina e não submetidas à determinação da CIM, de acordo com a recomendação do CLSI 200721. Os recentes pontos de corte definidos para a penicilina19 e para a ceftriaxona20 foram aplicados nos resultados obtidos ao longo do período de estudo, mantidos em banco de dados.
A sorotipagem foi realizada pela reação de Neufeld-Quellung segundo técnica descrita anteriormente22, utilizando antissoros policlonais8.
Foram obtidos dados de abril de 1999 a dezembro de 2008, e os resultados, submetidos à análise estatística. Para a comparação de proporções dos diagnósticos clínicos e do padrão de sensibilidade antimicrobiana nos diferentes períodos de tempo, foi empregada a prova do qui-quadrado via simulação de Monte Carlo com 10.000 reamostragem. Foram empregados testes de normalidade e homogeneidade das amostras sempre que necessário. O nível para a rejeição da hipótese de nulidade foi fixado em 5% (p < 0,05).
O trabalho obteve aprovação do Comitê de Ética e Pesquisa da UFU.
Resultados
No período de 9 anos e 8 meses, de abril de 1999 a dezembro de 2008, foram encaminhadas 330 amostras para o IAL, das quais 152 foram obtidas de crianças de até 5 anos de idade; destas, 142 foram analisadas após exclusão de 10 cepas inviáveis. Setenta e cinco (52,8%) eram provenientes de pacientes do sexo masculino, e a idade variou de 1 a 60 meses, com média de 19±15,4 meses e mediana de 15 meses. O número de isolamentos por faixa de idade foi de 101 em crianças de até 24 meses e de 41 naquelas de 25 a 60 meses. O número de amostras estudadas, obtidas nos anos de 1999 a 2008, foi de 22, 21, 14, 16, 24, 9, 11, 9, 10 e 6, respectivamente. O diagnóstico clínico foi pneumonia em 92 pacientes (64,8%), meningite em 33 (23,2%), bacteremia sem foco evidente em 12 (8,5%), sepse em três (2,1%), abscesso de partes moles em um (0,7%) e celulite em outro paciente (0,7%). Não houve diferença significante entre as proporções de diagnóstico de meningite e pneumonia ao longo do tempo. As fontes de recuperação foram o sangue em 61 amostras (43%), líquido pleural em 52 (36,6%), liquor em 28 (19,7%) e secreção em uma (0,7%).
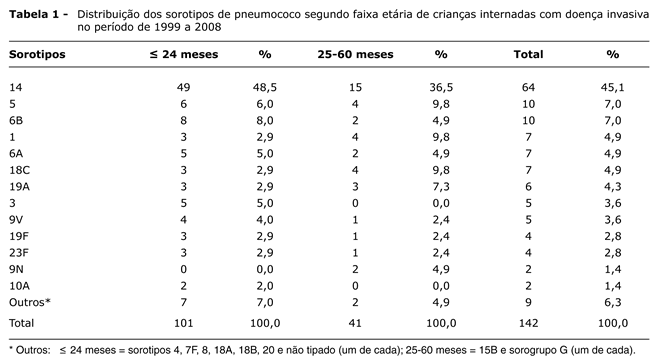
Um total de 20 diferentes sorotipos foi identificado, e os mais comuns estão expostos na Tabela 1 (segundo diferentes faixas de idade), na Tabela 2 (segundo diferentes períodos de tempo do isolamento) e na Tabela 3 (segundo diagnóstico clínico). Não houve predomínio de sorotipo em relação à faixa de idade, ao período de tempo, ou ao diagnóstico clínico quando havia frequência diferente de zero na coluna correspondente.
Foram detectadas 51 (35,9%) cepas oxacilina-resistentes. Segundo os critérios do CLSI 200818, 14 (9,9%) confirmaram a resistência à penicilina (1,4% com RI e 8,5% com RP), que esteve restrita aos sorotipos 14 (10 cepas), 6B, 19F, 19A e 23F (uma cepa cada). Houve um predomínio da resistência em casos de meningite [12 isolados (36,4%)] em relação aos demais diagnósticos [dois isolados (1,8%)] (p = 0,000) e no período de 2004 a 2008 em relação ao de 1999 a 2003 (p = 0,000) (Tabela 4). Foi detectada sensibilidade diminuída ao cotrimoxazol em 113 cepas (79,5%), sendo 7% com RI e 72,5% com RP. A resistência à eritromicina e à clindamicina foi encontrada simultaneamente em 16 cepas (11,3% cada). A resistência à ceftriaxona foi detectada em oito das 14 cepas penicilina-resistentes, conferindo a taxa de 5,6% (8/142), sendo 4,9% com RI e 0,7% com RP. Não foi observada resistência a cloranfenicol, ofloxacina, rifampicina ou vancomicina.
Discussão
Apesar da pequena dimensão da população aqui estudada, é possível reconhecer as semelhanças dos dados obtidos com resultados de levantamentos de âmbito nacional13-15,23 e internacional10,12-15. No aspecto geral, foi confirmado o perfil de sorotipos mais frequentes encontrados em países em desenvolvimento (14, 6A/6B, 5, 1, 19F/19A, 9N/9V e 23F), com destaque para a elevada prevalência dos sorotipos 1 e 5, comumente encontrados na América Latina3,10,11,23.
Em um estudo de meta-análise de aproximadamente 60.000 cepas invasivas de pneumococo obtidas de crianças abaixo de 6 anos nos seis continentes no período de 1980 a 2007, os sorotipos mais comumente isolados em países da América Latina (18.788 cepas avaliadas) foram o 14, 6B, 5, 1, 23F, 6A, 18C, 19F, 19A, 9V, 7F, 3 e 412. A taxa de cobertura da vacina 7-valente para essa população foi calculada em 57,9% (incluindo o sorotipo 6A). O Projeto SIREVA captou de diferentes regiões do Brasil no período de 8 anos (de 2000 a 200513, em 200614 e em 200715) 6.548 cepas invasivas de pneumococo; destas, 5.742 foram sorotipadas, sendo 2.575 oriundas de crianças abaixo de 6 anos de idade. Os sorotipos mais frequentemente encontrados foram o 14, 6B, 18C, 19F, 23F, 1, 6A, 5, 19A, 9V, 3, 7F e 4, conferindo uma cobertura da vacina 7-valente de 72,1% (incluindo o sorotipo 6A). Em outros levantamentos continentais, as taxas de cobertura da vacina 7-valente reportadas para os EUA, o Canadá e a Austrália estão entre 80 e 90%10,11, para a Europa e a África, entre 70 e 75%10,11, e para a Ásia, em 50%10.
A vacina conjugada 7-valente oferece cobertura para antígeno dos sorotipos 4, 6B, 9V, 14, 18C, 19F, 23F, contidos no produto e, provavelmente, também para o sorotipo 6A, por proteção cruzada12. Segundo os dados das Tabelas 1 e 2, a cobertura da vacina na população aqui estudada seria de 71,9% (ao incluir o sorotipo 6A) e não agregaria, entre outros, os sorotipos 1, 3 e 5, comumente isolados; entretanto, estariam cobertos os sorotipos 6B, 14, 19F e 23F, dentre os quais se encontram as cepas resistentes à penicilina (cobertura vacinal de 92,7%). A inclusão dos sorotipos 1, 5 e 7F na vacina 10-valente12 elevaria a cobertura para a população aqui estudada para 84,5% (com o sorotipo 6A), e a inclusão dos sorotipos 1, 5, 3, 7F, 6A e 19A na vacina 13-valente, em fase final de desenvolvimento12, aumentaria a cobertura para 92,2%.
A despeito de representar uma dificuldade técnica, o objetivo consiste na inclusão do maior número possível dos sorotipos mais prevalentes. Os produtos em via de licenciamento são compostos por 10 e 13 diferentes sorotipos12. A imunogenicidade do conjugado depende, entre outros aspectos, da natureza química e antigênica da proteína carreadora3. A vacina 7-valente (Prevenar®, Wyeth Pharmaceuticals, Maidenhead, Reino Unido) contém o oligossacarídeo capsular de sete diferentes sorotipos conjugados individualmente à proteína não tóxica CRM197, produzida por mutante da Corynebacterium diphtheriae3. Licenciada nos EUA em 2000 e atualmente presente em mais de 70 países para emprego em crianças a partir de 2 meses de idade, é indicada para prevenção de doença pneumocócica invasiva (DPI) e OMA12. Apresenta uma eficácia comprovada na prevenção de DPI e OMA causadas por sorotipos representados na vacina de 97,4 e 57%, respectivamente3. A vacina 13-valente, produzida pelo mesmo laboratório farmacêutico, contém a proteína carreadora CRM197 e apresenta imunogenicidade semelhante à 7-valente3.
A vacina 10-valente (GlaxoSmithKline Biologicals, Rixensart, Bélgica) é constituída de três diferentes carreadores: proteína D (que liga individualmente o polissacarídeo capsular dos sorotipos 1, 4, 5, 6B, 7F, 9V, 14 e 23F), o toxoide tetânico (que liga o sorotipo 18C) e o toxoide diftérico (liga o sorotipo 19F)3,12. Devido à inclusão da proteína D, uma proteína de superfície originalmente produzida pelo Haemophilus influenzae não tipável, há expectativa de proteção contra a infecção por esta bactéria3.
Provavelmente pela limitada dimensão da amostra, no levantamento aqui apresentado não houve predomínio significante na frequência dos sorotipos ao longo do tempo quando havia representação diferente de zero em cada um dos períodos (Tabela 2). Entretanto, a variação da frequência em ondas de doença invasiva causada pelo sorotipo 1 já foi observada10, e a tendência de queda ao longo do tempo na frequência dos sorotipos 1 e 5 pode ser reconhecida em nosso meio13-15. Os motivos para tal tendência são desconhecidos, e na população aqui estudada ambos permanecem ainda com importante participação no ranking dos mais comuns.
O mesmo ocorreu com a comparação das proporções segundo a faixa de idade (Tabela 1). A despeito da maior frequência em adultos, nos quais está associado às formas graves de pneumonia3,10,23, o sorotipo 3 é importante causa de doença invasiva em recém-nascidos e lactentes jovens, o que justificaria a sua inclusão em vacina para proteção de crianças abaixo de 2 anos10. No levantamento aqui apresentado, o sorotipo 3 ocupa importante posição entre os mais comuns em crianças de até 2 anos.
Apesar de alguns sorotipos estarem associados a uma doença em particular, não há exclusividade, e diferentes sorotipos podem causar diferentes doenças3 (Tabela 3). Como são variáveis não completamente dependentes, a correlação do perfil de sorotipos com o tipo de doença pode ser influenciada por outros fatores tais como a temporalidade e a idade3. O predomínio do sorotipo 19A (em crianças de até 5 anos) e do 9V (em crianças acima de 5 anos e em adultos) em pneumonia, em relação à meningite, pôde ser detectado em levantamento de âmbito nacional de 1977 a 200023. A despeito da baixa frequência no território nacional4,13-15,23 e em países da América Latina12, ambos os sorotipos estão associados à resistência à penicilina3,10,24, e o sorotipo 19A representa atualmente o principal sorotipo emergente nos EUA após a liberação para uso universal da vacina conjugada heptavalente3,10.
Novos pontos de corte de sensibilidade in vitro para a penicilina têm sido propostos recentemente19 e, ao adotá-los, houve neste estudo uma taxa de resistência de 9,9% (14/142 cepas), sendo 1,4% (duas cepas) de RI e 8,5% (12 cepas) de RP, porcentagem bem inferior às taxas de 15% (em todas as idades) e de 29,6% (em crianças de até 2 anos) encontradas nessa mesma população em 200325, ao ser adotado o critério tradicional21. Aumentos significativos nas taxas de resistência à penicilina de cepas invasivas de pneumococo têm sido descritos no território nacional, passando de 10,2% em 1993 a 27,9% em 200424, de acordo com o critério tradicional21. É possível comparar estes valores com os de um levantamento nacional recentemente publicado15 que emprega os novos critérios de pontos de corte para a penicilina19. Ao analisar 315 cepas invasivas de pneumococo obtidas de crianças de até 5 anos durante o ano de 2007, a taxa de resistência à penicilina, segundo critério atual19 foi de 39,4%, sendo 5,4% de RI e 34% de RP15. Tal diferença pode ser explicada, pelo menos em parte, pelo fato de no levantamento nacional 69,5% das cepas (219/315) terem sido oriundas de pacientes com meningite15, enquanto no presente estudo apenas 23,2% (33/142) tiveram essa origem. É importante salientar que para cepas invasivas obtidas de pacientes com meningite, os pontos de corte para penicilina permaneceram os mesmos (S ≤ 0,06 µg/mL e R ≥ 0,12 µg/mL)19. Portanto, ao adotar os critérios propostos pelo CLSI 200819, o impacto para diminuição nas taxas de resistência à penicilina será tanto menor quanto maior for o número de cepas provenientes de pacientes com meningite na amostra analisada. Este fato pode explicar também, pelo menos em parte, o predomínio de resistência à penicilina em casos de meningite em relação aos de pneumonia no estudo aqui apresentado.
A resistência à penicilina foi restrita aos sorotipos 14, 6B, 19A, 19F e 23F, classicamente associados à resistência às drogas3,10,24. Estes são os denominados sorotipos pediátricos, responsáveis por grande número de episódios de infecção em crianças. Provavelmente, as características intrínsecas de imunogenicidade dependente da idade e a extensa exposição aos antimicrobianos contribuem, respectivamente, para o predomínio entre as crianças mais jovens e o desenvolvimento de resistência à penicilina2,10,24. Neste estudo foi possível confirmar o aumento da proporção de cepas com resistência à penicilina durante o período de 2004 a 2008 (24,4%) em relação ao de 1999 a 2003 (3,1%), conforme exposto na Tabela 4. A tendência para o aumento da resistência à penicilina em nosso meio ao longo do tempo já foi demonstrada em estudo de âmbito nacional24 e está associada à emergência e disseminação de dois clones internacionais denominados Espanha 9V-3 e Tennessee 14-18. Esses clones, que expressam a cápsula do sorotipo 14 e se caracterizam pela resistência às drogas, passaram a predominar na região Sul e Sudeste do país após 1998. Dentre os 14 isolados com resistência à penicilina detectados no presente estudo, 10 (71,4%) são do sorotipo 14 e, portanto, é possível especular que, pelo menos em parte, o aumento da proporção de cepas resistentes decorre da disseminação dos referidos clones nessa comunidade.
O método de triagem para detecção de resistência à penicilina com discos de oxacilina (1 µg) tem sido empregado há décadas e apresenta maior sensibilidade (acima de 99%) do que especificidade (80%)26. Na avaliação aqui apresentada, 72,5% (37 dentre 51) das cepas classificadas como presumivelmente resistentes (pelo disco de oxacilina) eram de fato sensíveis à penicilina (pela determinação da CIM), o que reforça a necessidade de rever a especificidade do método frente à adoção dos novos critérios do CLSI 200819 e a importância da determinação da CIM para a categorização segura da resistência de cepas de pneumococo à penicilina19.
O encontro de oito cepas de pneumococo resistentes à ceftriaxona (seis com RI e duas com RP) confere uma taxa de 5,6% de resistência, inferior, então, às encontradas em estudos de vigilância populacional de âmbito nacional14,15 ao empregar os atuais pontos de corte para ceftriaxona20. Dentre 601 cepas invasivas obtidas de crianças de até 5 anos de idade em 200614 e 200715, foi detectada uma taxa de resistência à ceftriaxona de 20,6% (124/601 cepas), sendo 16% com RI e 4,7% com RP. Da mesma forma que para a penicilina, tal diferença pode ser justificada, pelo menos em parte, pela maior proporção de casos com meningite no levantamento nacional14,15 (69,5 versus 23,2%). Nos EUA, o Active Bacterial Core Surveillance (ABCs) Report detectou, dentre 3.514 cepas invasivas obtidas de pacientes nas diversas faixas de idade durante o ano de 2007, uma taxa de resistência à cefotaxima de 6,9% (RI = 5,5% e RP = 1,4%)4.
Algumas observações podem ser feitas quanto à sensibilidade a outros antimicrobianos. A elevada taxa de resistência encontrada para o cotrimoxazol (79,5%) está de acordo com as relatadas em estudos nacionais de 54,527, 61,213-15, 6524 e 65,7%28 e pode comprometer a indicação deste quimioterápico no tratamento das infecções pneumocócicas. Permanecem relativamente baixas as cifras para a eritromicina (11,3%) e clindamicina (11,3%), comparáveis com as relatadas em outros estudos nacionais: para eritromicina, valores de 3,827, 5,513-15, 5,728 e 6,2%24 e para clindamicina, valores de 2,928 e 3,1%27. O fato de 16 cepas resistentes à eritromicina serem também resistentes à clindamicina sugere a manifestação do fenótipo MLSB, caracterizado pela resistência constitutiva aos macrolídeos, lincosaminas e estreptogramina B29,30. Não houve resistência in vitro ao cloranfenicol, ofloxacina, rifampicina ou vancomicina.
O tratamento inicial para a maioria das infecções pneumocócicas permanece empírico quanto à etiologia e sensibilidade às drogas. Como a escolha do antibiótico é influenciada pela categorização laboratorial (em sensível ou resistente, de acordo com a CIM), a adoção de novos pontos de corte deve aumentar as taxas de cepas relatadas como S e consolidar a importância da manutenção da penicilina no tratamento da doença pneumocócica não meníngea.
Referências
1. American Academy of Pediatrics. Pneumococcal infections. In: Red book: Report of the Committee on Infectious Diseases. Illinois: Elk Grove Village; 2009. p. 524-40.
2. Jackson LA, Neuzil KM. Pneumococcal polysaccharide vaccines. In: Plotkin SA, Orenstein W, Offit P, editors. Vaccines. Philadelphia: WB Saunders; 2008. p. 569-604.
3. Black S, Eskola J, Whitney C, Shinefield H. Pneumococcal conjugate vaccine and pneumococcal common protein vaccines. In: Plotkin SA, Orenstein W, Offit P, editors. Vaccines. Philadelphia: WB Saunders; 2008. p. 531-67.
4. Centers for Disease Control and Prevention. 2008. Active Bacterial Core Surveillance Report, Emerging Infections Program Network, Streptococcus pneumoniae, 2007.
5. Heffelfinger JD, Dowell SF, Jorgensen JH, Klugman KP, Mabry LR, Musher DM, et al. Management of community-acquired pneumonia in the era of pneumococcal resistance: a report from the Drig-Resistant Streptococcus pneumoniae Therapeutic Working Group. Arch Intern Med. 2000;160:1399-408.
6. Kaplan SL. Review of antibiotic resistance, antibiotic treatment and prevention of pneumococcal pneumonia. Pediatr Respir Review. 2004;5 Suppl A:S153-8.
7. Okeke IN, Laxminarayan R, Bhutta ZA, Duse AG, Jenkins P, OBrien TF, et al. Antimicrobial resistance in developing countries. Part I: recent trends and current status. Lancet Infect Dis. 2005;5:481-93.
8. Henrichsen J. The pneumococcal typing system and pneumococcal surveillance. J Infect Dis. 1979;1:S31-7.
9. Park IH, Pritchard DG, Cartee R, Brandão A, Brandileone MC, Nahm MH. Discovery of a new capsular serotype (6C) within serogroup 6 of Streptococcus pneumoniae. J Clin Microbiol. 2007;45:1225-33.
10. Hausdorff WP, Feikin DR, Klugman KP. Epidemiological differences among pneumococcal serotypes. Lancet Infect Dis. 2005;5:83-93.
11. Hausdorff WP, Bryant J, Paradiso PR, Siber GR. Which pneumococcal serogroups cause the most invasive disease: implications for conjugate vaccine formulation and use, part i. Clin Infect Dis. 2000;30:100-21.
12. World Health Organization (WHO). Target Product Profile (TPP) for the Pneumococcal Advanced Marked Commitment. Independent Assessment Committee. Department of International Health. Johns Hopkins Bloomberg School of Public Health. Baltimore, 2008. http://www.vaccineamc.org/updatedec_08.html. Acesso: 23/02/2009.
13. Organización Panamericana de la Salud. Informe Regional de SIREVA II, 2000-2005: datos por país y por grupo de edad sobre las características de los aislamientos de Streptococcus pneumoniae, Haemophilus influenzae y Neisseria meningitidis en procesos invasivos, 2000-2005. (Serie Documentos técnicos. Tecnologias esenciales de salud. THS/EV-2007/002). Washington: OPS; 2007.
14. Organización Panamericana de la Salud. Informe Regional de SIREVA II, 2006: datos por país y por grupo de edad sobre las características de los aislamientos de Streptococcus pneumoniae, Haemophilus influenzae y Neisseria meningitidis en procesos invasivos, 2000-2005. (Serie Documentos técnicos. Tecnologias esenciales de salud. THS/EV-2008/001). Washington: OPS; 2008.
15. Organización Panamericana de la Salud. Informe Regional de SIREVA II, 2007: datos por país y por grupo de edad sobre las características de los aislamientos de Streptococcus pneumoniae, Haemophilus influenzae y Neisseria meningitidis en procesos invasivos, 2000-2005. (Serie Documentos técnicos. Tecnologias esenciales de salud. THS/EV-2008/003). Washington: OPS; 2008.
16. Brandileone MC, Vieira VS, Casagrande ST, Zanella RC, Guerra ML, Bokermann S, et al. Prevalence of serotypes and antimicrobial resistance of streptococcus pneumoniae strains isolated from Brazilian children with invasive infections. Pneumococcal Study Group in Brazil for the SIREVA Project. Regional System for Vaccines in Latin America. Microb Drug Resist. 1997;3:141-6.
17. National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial disk susceptibility tests: approved standard. NCCLS Publication M2-A5. Villanova, PA: National Committee for Clinical Laboratory Standards, 1997.
18. Clinical and Laboratory Standards Institute/NCCLS. Performance Standards for Antimicrobial Susceptibility Testing; Fifteenth Informational Supplement. CLSI/NCCLS document M100-S15. Wayne, PA, USA. Clinical and Laboratory Standards Institute, 2005.
19. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Eighteenth Informational Supplement. CLSI Publication M100-S18, Vol. 28, No. 1. Wayne, PA, USA. Clinical and Laboratory Standards Institute, 2008.
20. National Committee for Clinical Laboratory Standards. Supplemental Tables. Performance Standards for Antimicrobial Susceptibility Testing; Twelfth Informational Supplement. NCCLS Publication M100-S12, Vol. 22, No. 1. M2-A7 and M7-A5.Villanova, PA: National Committee for Clinical Laboratory Standards, 2002.
21. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Sixteenth Informational Supplement. CLSI Publication M100-S17. Wayne, PA, USA. Clinical and Laboratory Standards Institute, 2007.
22. Sørensen UB. Typing of pneumococci by using 12 pooled antisera. J Clin Microbiol. 1993;31:2097-100.
23. Brandileone MC, de Andrade AL, Di Fabio JL, Guerra ML, Austrian R. Appropriateness of a pneumococcal conjugate vaccine in Brazil: potential impact of age and clinical diagnosis, with emphasis on meningitis. J Infect Dis. 2003;187:1206-12.
24. Brandileone MC, Casagrande ST, Guerra ML, Zanella RC, Andrade AL, Di Fabio JL. Increase in numbers of beta-lactam-resistant invasive Streptococcus pneumoniae in Brazil and the impact of conjugate vaccine coverage. J Med Microbiol. 2006;55:567-74.
25. Mantese OC, Paula A, Moraes AB, Moreira TA, Guerra ML, Brandileone MC. Prevalência de sorotipos e resistência antimicrobiana de cepas invasivas do Streptococcus pneumoniae. J Pediatr (Rio J). 2003;79:537-42.
26. Bartlett JG, Breiman RF, Mandell LA, File TM Jr. Community-acquired pneumonia in adults: guidelines for management. The Infectious Diseases Society of America. Clin Infect Dis. 1998;26:811-38.
27. Koeth LM, Felmingham D, Jacobs MR, Rossi F. Antimicrobial resistance of Streptococcus pneumoniae and Haemophilus influenzae in Sao Paulo, Brazil from 1996 to 2000. Int J Antimicrob Agents. 2004;23:356-61.
28. Nascimento-Carvalho CM, Freitas-Souza LS, Moreno-Carvalho OA, Alves NN, Caldas RM, Barberino MG, et al. Cepas invasivas de pneumococo isoladas de crianças e adolescentes em Salvador. J Pediatr (Rio J). 2003;79:209-14.
29. Mandell LA, Bartlett JG, Dowell SF, File TM Jr, Musher DM, Whitney C, et al. Update of practice guidelines for the management of community-acquired pneumonia in immunocompetent adults. Clin Infect Dis. 2003;37:1405-33.
30. Hyde TB, Gay K, Stephens DS, Vugia DJ, Pass M, Johnson S, et al. Macrolide resistance among invasive Streptococcus pneumoniae isolates. JAMA. 2001;286:1857-62.
Artigo submetido em 14.05.09, aceito em 30.09.09
Este trabalho foi realizado na Universidade Federal de Uberlândia (UFU), Uberlândia, MG, e no Instituto Adolfo Lutz (IAL), São Paulo, SP.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Como citar este artigo: Mantese OC, de Paula A, Almeida VV, de Aguiar PA, Wolkers PC, Alvares JR, et al. Prevalence of serotypes and antimicrobial resistance of invasive strains of pneumococcus in children: analysis of 9 years. J Pediatr (Rio J). 2009;85(6):495-502.
- 1. American Academy of Pediatrics. Pneumococcal infections. In: Red book: Report of the Committee on Infectious Diseases. Illinois: Elk Grove Village; 2009. p. 524-40.
- 2. Jackson LA, Neuzil KM. Pneumococcal polysaccharide vaccines. In: Plotkin SA, Orenstein W, Offit P, editors. Vaccines. Philadelphia: WB Saunders; 2008. p. 569-604.
- 3. Black S, Eskola J, Whitney C, Shinefield H. Pneumococcal conjugate vaccine and pneumococcal common protein vaccines. In: Plotkin SA, Orenstein W, Offit P, editors. Vaccines. Philadelphia: WB Saunders; 2008. p. 531-67.
- 4. Centers for Disease Control and Prevention. 2008. Active Bacterial Core Surveillance Report, Emerging Infections Program Network, Streptococcus pneumoniae, 2007.
- 5. Heffelfinger JD, Dowell SF, Jorgensen JH, Klugman KP, Mabry LR, Musher DM, et al. Management of community-acquired pneumonia in the era of pneumococcal resistance: a report from the Drig-Resistant Streptococcus pneumoniae Therapeutic Working Group. Arch Intern Med. 2000;160:1399-408.
- 6. Kaplan SL. Review of antibiotic resistance, antibiotic treatment and prevention of pneumococcal pneumonia. Pediatr Respir Review. 2004;5 Suppl A:S153-8.
- 7. Okeke IN, Laxminarayan R, Bhutta ZA, Duse AG, Jenkins P, OBrien TF, et al. Antimicrobial resistance in developing countries. Part I: recent trends and current status. Lancet Infect Dis. 2005;5:481-93.
- 8. Henrichsen J. The pneumococcal typing system and pneumococcal surveillance. J Infect Dis. 1979;1:S31-7.
- 9. Park IH, Pritchard DG, Cartee R, Brandão A, Brandileone MC, Nahm MH. Discovery of a new capsular serotype (6C) within serogroup 6 of Streptococcus pneumoniae. J Clin Microbiol. 2007;45:1225-33.
- 10. Hausdorff WP, Feikin DR, Klugman KP. Epidemiological differences among pneumococcal serotypes. Lancet Infect Dis. 2005;5:83-93.
- 11. Hausdorff WP, Bryant J, Paradiso PR, Siber GR. Which pneumococcal serogroups cause the most invasive disease: implications for conjugate vaccine formulation and use, part i. Clin Infect Dis. 2000;30:100-21.
-
12World Health Organization (WHO). Target Product Profile (TPP) for the Pneumococcal Advanced Marked Commitment. Independent Assessment Committee. Department of International Health. Johns Hopkins Bloomberg School of Public Health. Baltimore, 2008. http://www.vaccineamc.org/updatedec_08.html. Acesso: 23/02/2009.
-
13Organización Panamericana de la Salud. Informe Regional de SIREVA II, 2000-2005: datos por país y por grupo de edad sobre las características de los aislamientos de Streptococcus pneumoniae, Haemophilus influenzae y Neisseria meningitidis en procesos invasivos, 2000-2005. (Serie Documentos técnicos. Tecnologias esenciales de salud. THS/EV-2007/002). Washington: OPS; 2007.
-
14Organización Panamericana de la Salud. Informe Regional de SIREVA II, 2006: datos por país y por grupo de edad sobre las características de los aislamientos de Streptococcus pneumoniae, Haemophilus influenzae y Neisseria meningitidis en procesos invasivos, 2000-2005. (Serie Documentos técnicos. Tecnologias esenciales de salud. THS/EV-2008/001). Washington: OPS; 2008.
-
15Organización Panamericana de la Salud. Informe Regional de SIREVA II, 2007: datos por país y por grupo de edad sobre las características de los aislamientos de Streptococcus pneumoniae, Haemophilus influenzae y Neisseria meningitidis en procesos invasivos, 2000-2005. (Serie Documentos técnicos. Tecnologias esenciales de salud. THS/EV-2008/003). Washington: OPS; 2008.
- 16. Brandileone MC, Vieira VS, Casagrande ST, Zanella RC, Guerra ML, Bokermann S, et al. Prevalence of serotypes and antimicrobial resistance of streptococcus pneumoniae strains isolated from Brazilian children with invasive infections. Pneumococcal Study Group in Brazil for the SIREVA Project. Regional System for Vaccines in Latin America. Microb Drug Resist. 1997;3:141-6.
-
17National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial disk susceptibility tests: approved standard. NCCLS Publication M2-A5. Villanova, PA: National Committee for Clinical Laboratory Standards, 1997.
-
18Clinical and Laboratory Standards Institute/NCCLS. Performance Standards for Antimicrobial Susceptibility Testing; Fifteenth Informational Supplement. CLSI/NCCLS document M100-S15. Wayne, PA, USA. Clinical and Laboratory Standards Institute, 2005.
-
19Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Eighteenth Informational Supplement. CLSI Publication M100-S18, Vol. 28, No. 1. Wayne, PA, USA. Clinical and Laboratory Standards Institute, 2008.
-
20National Committee for Clinical Laboratory Standards. Supplemental Tables. Performance Standards for Antimicrobial Susceptibility Testing; Twelfth Informational Supplement. NCCLS Publication M100-S12, Vol. 22, No. 1. M2-A7 and M7-A5.Villanova, PA: National Committee for Clinical Laboratory Standards, 2002.
-
21Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Sixteenth Informational Supplement. CLSI Publication M100-S17. Wayne, PA, USA. Clinical and Laboratory Standards Institute, 2007.
- 22. Sřrensen UB. Typing of pneumococci by using 12 pooled antisera. J Clin Microbiol. 1993;31:2097-100.
- 23. Brandileone MC, de Andrade AL, Di Fabio JL, Guerra ML, Austrian R. Appropriateness of a pneumococcal conjugate vaccine in Brazil: potential impact of age and clinical diagnosis, with emphasis on meningitis. J Infect Dis. 2003;187:1206-12.
- 24. Brandileone MC, Casagrande ST, Guerra ML, Zanella RC, Andrade AL, Di Fabio JL. Increase in numbers of beta-lactam-resistant invasive Streptococcus pneumoniae in Brazil and the impact of conjugate vaccine coverage. J Med Microbiol. 2006;55:567-74.
- 25. Mantese OC, Paula A, Moraes AB, Moreira TA, Guerra ML, Brandileone MC. Prevalência de sorotipos e resistência antimicrobiana de cepas invasivas do Streptococcus pneumoniae. J Pediatr (Rio J). 2003;79:537-42.
- 26. Bartlett JG, Breiman RF, Mandell LA, File TM Jr. Community-acquired pneumonia in adults: guidelines for management. The Infectious Diseases Society of America. Clin Infect Dis. 1998;26:811-38.
- 27. Koeth LM, Felmingham D, Jacobs MR, Rossi F. Antimicrobial resistance of Streptococcus pneumoniae and Haemophilus influenzae in Sao Paulo, Brazil from 1996 to 2000. Int J Antimicrob Agents. 2004;23:356-61.
- 28. Nascimento-Carvalho CM, Freitas-Souza LS, Moreno-Carvalho OA, Alves NN, Caldas RM, Barberino MG, et al. Cepas invasivas de pneumococo isoladas de crianças e adolescentes em Salvador. J Pediatr (Rio J). 2003;79:209-14.
- 29. Mandell LA, Bartlett JG, Dowell SF, File TM Jr, Musher DM, Whitney C, et al. Update of practice guidelines for the management of community-acquired pneumonia in immunocompetent adults. Clin Infect Dis. 2003;37:1405-33.
- 30. Hyde TB, Gay K, Stephens DS, Vugia DJ, Pass M, Johnson S, et al. Macrolide resistance among invasive Streptococcus pneumoniae isolates. JAMA. 2001;286:1857-62.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
12 Jan 2010 -
Data do Fascículo
Dez 2009
Histórico
-
Aceito
30 Set 2009 -
Recebido
14 Maio 2009