Resumos
OBJETIVO: Analisar comparativamente a dispersão da onda P (DOP) em pacientes com talassemia beta maior (β-TM) e indivíduos saudáveis (controles) para a detecção precoce do risco de arritmias. MÉTODOS: Oitenta e uma crianças com β-TM, com idades entre 4 e 19 anos, e 74 crianças saudáveis (grupo controle) foram submetidas a exame eletrocardiográfico e ecocardiograma transtorácico de rotina para avaliação cardíaca. A DOP foi calculada como a diferença entre as durações máxima e mínima da onda P. RESULTADOS: Houve uma diferença estatisticamente significativa entre o grupo de estudo e o grupo controle no pico de velocidade do fluxo transmitral no início da diástole (E) e na razão E/fluxo transmitral tardio (A). A duração máxima da onda P e a DOP foram significativamente maiores nos pacientes com β-TM do que nos indivíduos controles. CONCLUSÕES: O aumento da DOP em nossos pacientes com β-TM pode estar relacionado à depressão na condução intra-atrial, devido à dilatação atrial, e ao aumento da atividade simpática. Estes pacientes devem ser acompanhados atentamente devido à possibilidade de ocorrência de arritmias com risco de vida.
Talassemia maior; dispersão da onda P; ferritina; acometimento cardíaco
OBJECTIVE: To comparatively evaluate P-wave dispersion (PWD) in patients with β-thalassemia major (TM) and healthy control subjects for the early prediction of arrhythmia risk. METHODS: Eighty-one children with β-TM, aged 4-19 years, and 74 healthy children (control group) underwent routine electrocardiography and transthoracic echocardiography for cardiac evaluation. PWD was calculated as the difference between the maximum and the minimum P-wave duration. RESULTS: There was a statistically significant difference between study and control groups in peak early (E) mitral inflow velocity and E/late (A) velocity ratio. Maximum P-wave duration and PWD were found to be significantly higher in β-TM patients than in control subjects. CONCLUSIONS: Increased PWD in our β-TM patients might be related to depression of intra-atrial conduction due to atrial dilatation and increased sympathetic activity. These patients should be closely followed up for risk of life-threatening arrhythmias.
Thalassemia major; P-wave dispersion; ferritin; cardiac involvement
ARTIGO ORIGINAL
Marcadores eletrocardiográficos para detecção precoce de doença cardíaca em pacientes com talassemia beta maior
Kemal NisliI;Yavuz TanerI; Oner NaciI;Salcioglu ZaferII;Karakas ZeynepIII;Dindar AygunI;Umrah AydoganI; Rukiye EkerI; Turkan ErtugrulI
IMD, Department of Pediatric Cardiology, Istanbul Medical Faculty, Istanbul University, Istanbul, Turquia
IIMD, Department of Pediatric Hematology, Bakirkoy Education Hospitals, Istanbul, Turquia
IIIMD, Department of Pediatric Hematology, Istanbul Medical Faculty, Istanbul University, Istanbul, Turquia
Correspondência Correspondência: Kemal Nisli Istanbul (Çapa) Tıp Fakültesi Çocuk Kardiyolojisi Bilim Dalı Şehremini/Çapa Istanbul - Turquia Tel: +90 (221) 661.5870 Fax: +90 (212) 414.2196 E-mail: kemalnisli@yahoo.com
RESUMO
OBJETIVO: Analisar comparativamente a dispersão da onda P (DOP) em pacientes com talassemia beta maior (β-TM) e indivíduos saudáveis (controles) para a detecção precoce do risco de arritmias.
MÉTODOS: Oitenta e uma crianças com β-TM, com idades entre 4 e 19 anos, e 74 crianças saudáveis (grupo controle) foram submetidas a exame eletrocardiográfico e ecocardiograma transtorácico de rotina para avaliação cardíaca. A DOP foi calculada como a diferença entre as durações máxima e mínima da onda P.
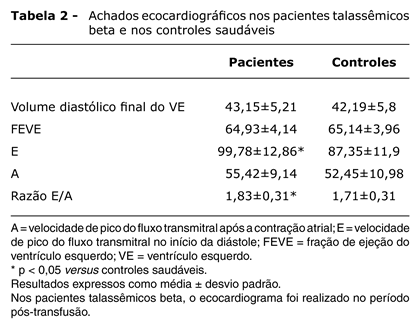
RESULTADOS: Houve uma diferença estatisticamente significativa entre o grupo de estudo e o grupo controle no pico de velocidade do fluxo transmitral no início da diástole (E) e na razão E/fluxo transmitral tardio (A). A duração máxima da onda P e a DOP foram significativamente maiores nos pacientes com β-TM do que nos indivíduos controles.
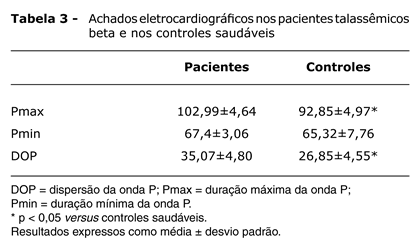
CONCLUSÕES: O aumento da DOP em nossos pacientes com β-TM pode estar relacionado à depressão na condução intra-atrial, devido à dilatação atrial, e ao aumento da atividade simpática. Estes pacientes devem ser acompanhados atentamente devido à possibilidade de ocorrência de arritmias com risco de vida.
Palavras-chave: Talassemia maior, dispersão da onda P, ferritina, acometimento cardíaco.
ABSTRACT
OBJECTIVE: To comparatively evaluate P-wave dispersion (PWD) in patients with β-thalassemia major (TM) and healthy control subjects for the early prediction of arrhythmia risk.
METHODS: Eighty-one children with β-TM, aged 4-19 years, and 74 healthy children (control group) underwent routine electrocardiography and transthoracic echocardiography for cardiac evaluation. PWD was calculated as the difference between the maximum and the minimum P-wave duration.
RESULTS: There was a statistically significant difference between study and control groups in peak early (E) mitral inflow velocity and E/late (A) velocity ratio. Maximum P-wave duration and PWD were found to be significantly higher in β-TM patients than in control subjects.
CONCLUSIONS: Increased PWD in our β-TM patients might be related to depression of intra-atrial conduction due to atrial dilatation and increased sympathetic activity. These patients should be closely followed up for risk of life-threatening arrhythmias.
Keywords: Thalassemia major, P-wave dispersion, ferritin, cardiac involvement.
Introdução
Insuficiência cardíaca e morte súbita, esta provavelmente causada por arritmia, permanecem como as principais causas de mortalidade na talassemia beta maior (β-TM)
1. O prognóstico dessa doença, no entanto, tem sido modificado com a realização de transfusões de sangue regulares e quelação de ferro com deferoxamina
2. A dispersão da onda P (DOP) é um marcador eletrocardiográfico simples que tem sido associado à propagação descontínua e inomogênea dos impulsos sinusais. É definida como a diferença entre as durações máxima e mínima da onda P
3-4. A duração prolongada da onda P e o aumento da DOP têm sido relacionados a um maior risco de fibrilação atrial
4. As miocardiopatias estão associadas a um risco quatro a seis vezes maior de desenvolver fibrilação atrial
5. O presente estudo objetivou analisar comparativamente esses marcadores eletrocardiográficos em pacientes com β-TM e controles saudáveis para a detecção precoce do risco de arritmias.
Métodos
Os participantes foram divididos em dois grupos: Grupo I 81 crianças com β-TM; e grupo II 74 crianças saudáveis (grupo controle) sem doença cardiovascular clinicamente aparente através de exame físico, exame eletrocardiográfico e ecocardiograma. Todos os participantes foram selecionados dentre os indivíduos que compareceram ao serviço de hematologia de dois hospitais locais. Pacientes com diabetes melito, doenças das valvas cardíacas, pré-excitação ventricular e anormalidades na condução atrioventricular foram excluídos do estudo. A avaliação cardíaca foi realizada durante os intervalos entre as transfusões de sangue, em média 5 dias (3-7 dias) após as transfusões. Pacientes e indivíduos controles foram submetidos a ecocardiograma transtorácico de rotina (Vivid 3, General Electric, USA), durante o qual foram realizadas, em modo M, as medidas dos diâmetros diastólico e sistólico finais do ventrículo esquerdo (VE) e da fração de ejeção (FE) do VE de acordo com as recomendações da Sociedade Americana de Ecocardiografia6. Para a avaliação da função diastólica total do VE, foram obtidas curvas espectrais típicas do preenchimento do VE com o uso de Doppler de pulso convencional, posicionando-se o volume de amostra nas pontas dos folhetos da valva mitral. Os picos de velocidade do fluxo transmitral no início da diástole (E) e após a contração atrial (A) foram expressos em cm/s. O tempo de desaceleração do fluxo transmitral E foi medido em milissegundos. Disfunção diastólica geral do VE foi definida como a presença de qualquer anormalidade na valva mitral.
Um eletrocardiograma (ECG) de 12 derivações foi realizado para cada paciente e cada indivíduo controle a uma velocidade de registro de 50 mm/s. No momento do registro eletrocardiográfico, todos os indivíduos apresentavam ritmo sinusal e nenhum deles utilizava agentes antiarrítmicos. A duração da onda P foi medida manualmente por dois dos pesquisadores, que desconheciam o quadro clínico dos participantes. Todas as medidas foram realizadas com o auxílio de compasso de calibre e lentes de aumento para maior precisão. O início da onda P foi definido como a junção entre a linha isoelétrica e o início da deflexão da onda P e o término da onda P como a junção entre o final da deflexão da onda P e a linha isoelétrica. As durações máxima e mínima da onda P foram medidas a partir das 12 derivações do ECG de superfície. Os pacientes com ondas P mensuráveis em nove ou menos derivações foram excluídos do estudo. A DOP foi calculada como a diferença entre a duração máxima da onda P (Pmax) e a duração mínima da onda P (Pmin) (DOP = Pmax - Pmin)7.
A análise estatística foi realizada utilizando-se o teste U de Mann-Whitney e o teste de qui-quadrado sempre que apropriados. O teste de correlação de Pearson foi utilizado para determinar a correlação entre as variáveis eletrocardiográficas e ecocardiográficas. As variáveis numéricas foram expressas como média ± desvio padrão e as variáveis categóricas foram expressas como porcentagem. O nível de significância foi estabelecido em p < 0,05.
Resultados
O grupo de estudo foi composto por 81 pacientes com β-TM (37 meninos e 44 meninas), com idades entre 4 e 19 (10,9±4,1) anos, e o grupo controle foi composto por 74 indivíduos saudáveis (36 meninos e 38 meninas), com idades entre 4 e 20 (10,9±4,1) anos. Os valores do índice de massa corporal (IMC) foram de 17,2±2,4 para o grupo de estudo e 18,8±2,9 para o grupo controle. O nível de ferritina sérica nos pacientes com β-TM variou de 375 a 4.900 (1.865±876) µg/L, indicando que a adesão à terapia de quelação não foi uniforme neste grupo. No momento do estudo, os parâmetros hemodinâmicos de todos os indivíduos encontravam-se normais e nenhum deles apresentou sinais clínicos de doença cardiovascular. Não houve diferença estatisticamente significativa entre o grupo de estudo e o grupo controle com relação a sexo, idade média, frequência cardíaca e pressão arterial sistólica e diastólica (p > 0,05). Entretanto, o IMC foi menor nos pacientes com β-TM do que nos indivíduos controles (Tabela 1). As médias do volume diastólico final e da FE do VE foram, respectivamente, 43,1±5,2 mm e 64,9±4,1% no grupo de estudo e 42,2±5,8 mm e 65,1±3,9% no grupo controle. Houve uma diferença estatisticamente significativa entre o grupo de estudo e o grupo controle nas medidas do pico de velocidade E do fluxo transmitral e na razão E/A (Tabela 2). A duração máxima da onda P e a DOP foram significativamente maiores nos pacientes com β-TM do que nos indivíduos controles. No entanto, não houve diferença estatisticamente significativa entre o grupo de estudo e o grupo controle com relação à duração mínima da onda P (Tabela 3).
Discussão
A TM é uma hemoglobinopatia hereditária que resulta em anemia hemolítica crônica. Insuficiência cardíaca secundária à sobrecarga de ferro no miocárdio é a principal causa de mortalidade nessa doença. Acredita-se que a toxicidade de ferro em sistemas biológicos esteja associada à sua capacidade de catalisar a geração de radicais livres8. A miocardiopatia induzida por ferro é uma miocardiopatia restritiva que se manifesta como uma disfunção sistólica ou diastólica e/ou como arritmias ventriculares secundárias a uma pronunciada deposição de ferro no miocárdio. A terapia de quelação com deferoxamina tem sido associada a uma acentuada diminuição na morbimortalidade em pacientes com TM9. Estudos recentes sugerem que o uso da deferiprona oferece maior proteção cardíaca contra a miocardiopatia induzida por ferro do que a deferoxamina10. Em nosso estudo, todos os pacientes foram submetidos à terapia padrão com deferoxamina (40-50 mg/kg, subcutânea, 5 dias/semana).
Atualmente, há a necessidade de testes confiáveis para a identificação pré-sintomática das miocardiopatias, uma vez que o método de avaliação convencional da função ventricular através de ecocardiograma e técnicas nucleares não tem se mostrado adequado11. A avaliação cardíaca por ressonância magnética (RM) com T2* apresenta uma fraca relação com a função cardíaca até que um nível crítico seja atingido, sendo seguido de uma rápida deterioração, o que explicaria a razão pela qual a identificação da função sistólica anormal é um sinal tardio de toxicidade de ferro. O ferro é eliminado mais lentamente do coração do que do fígado, o que contribui para a alta taxa de mortalidade observada em pacientes com miocardiopatia estabelecida apesar da terapia de quelação intensiva. A técnica T2* nos possibilita identificar precocemente os pacientes que precisam de terapia de quelação intensiva antes do início da disfunção sistólica, o que pode reduzir a mortalidade associada à insuficiência cardíaca manifesta12. A análise por ultrassonografia Doppler revelou, nesses pacientes, uma disfunção precoce do miocárdio provavelmente relacionada, especificamente, a essa sobrecarga inicial de ferro, como sugerido pela correlação com os valores cardíacos obtidos com a técnica T2*13. Em nosso estudo, não foi possível avaliar os pacientes pela técnica de RM cardíaca ou Doppler, tornando-se esta a principal limitação deste estudo.
Sabe-se que a disfunção no preenchimento do VE está associada à miocardiopatia induzida por ferro. Assim, a importância prognóstica de achados diastólicos por ecocardiograma tem sido questionada até mesmo para a TM14. No entanto, a razão E/A, um dos critérios mais amplamente utilizados na miocardiopatia restritiva, encontrou-se significativamente elevada na TM tanto em pacientes saudáveis quanto em pacientes com doença cardíaca evidente, provavelmente refletindo o efeito da sobrecarga de ferro15. Em nosso estudo, a principal diferença entre pacientes com β-TM versus controles foi o padrão de preenchimento diastólico restritivo, mesmo quando estes eram assintomáticos e apresentavam função do VE normal.
Complicações cardíacas da TM foram inicialmente descritas antes da introdução da terapia de quelação. Arritmias atriais foram observadas em metade dos pacientes e taquicardia ventricular repetitiva estava presente em uma minoria16. Contudo, o real valor do monitoramento da função cardíaca para o manejo de longo prazo da TM ainda não está claro, em parte porque a importância prognóstica das anormalidades diastólicas, que surgem no início do processo da doença, também permanece desconhecida14. Além disso, uma vez que a insuficiência cardíaca congestiva tornou-se presente, as anormalidades sistólicas também se tornaram evidentes pelo ecocardiograma. Essas observações levaram os pesquisadores a questionar o valor do monitoramento não-invasivo da função cardíaca no manejo da talassemia17.
A depressão na condução intra-atrial causa um alongamento da onda P18. Além disso, sabe-se que um novo e simples marcador eletrocardiográfico, a DOP, também representa a condução atrial descontínua e inomogênea e possui um valor de predição especialmente de fibrilação atrial paroxística19-21. Em crianças saudáveis, a duração da onda P varia de 50 a 100 ms22. A DOP tem sido estudada em algumas outras condições cardíacas como crescimento atrial, obesidade, hipertensão arterial, defeito no septo atrial, estenose pulmonar e miocardiopatia dilatada23,24. Tükek et al.25 relataram que o aumento da atividade simpática leva a uma significativa elevação da DOP. Portanto, o aumento da DOP observado em nossos pacientes pode estar relacionado em parte a uma elevação da atividade simpática, que, por sua vez, aumenta o risco de arritmias.
Referências
1. Bianco I. Clinical and therapeutic aspects of Mediterranean anaemia. II Progr Med. 1986;42:471-5.
2. Ehlers KH, Giardina PJ, Lesser ML, Engle MA, Hilgartner MW. Prolonged survival in patients with beta-thalassemia major treated with deferoxamine. J Pediatr. 1991;118:540-5.
3. Dilaveris PE, Gialafos EJ, Sideris SK, Theopistou AM, Andrikopoulos GK, Kyriakidis M, et al. Simple electrocardiographic markers for the prediction of paroxysmal idiopathic atrial fibrillation. Am Heart J. 1998;135:733-8.
4. Dilaveris PE, Gialafos EJ, Andrikopoulos GK, Richter DJ, Papanikolaou V, Poralis K, et al. Clinical and electrocardiographic predictors of recurrent atrial fibrillation. Pacing Clin Electrophysiol. 2000;23:352-8.
5. Senen K, Turhan H, Riza Erbay A, Basar N, Saatci Yasar A, Sahin O, et al. P-wave duration and P-wave dispersion in patients with dilated cardiomyopathy. Eur J Heart Fail. 2004;6:567-9.
6. Sahn DJ, DeMaria A, Kisslo J, Weyman A. Recommendations regarding quantitation in M-mode echocardiography: results of a survey of echocardiographic measurements. Circulation 1978;58:1072-83.
7. Gialafos JE, Dilaveris PE, Gialafos EJ. P-wave dispersion: a valuable electrocardiographic marker for the prediction of paroxysmal lone atrial fibrillation. Ann Noninvas Electrocardiol. 1999;4:39-45.
8. Olivieri NF, Nathan DG, MacMillan JH, Wayne AS, Liu PP, McGee A, et al. Survival in medically treated patients with homozygous beta-thalassemia. N Engl J Med 1994;331:574-8.
9. Borgna-Pignatti C, Rugolotto S, De Stefano P, Zhao H, Cappellini MD, Del Vecchio GC, et al. Survival and complications in patients with thalassemia major treated with transfusion and deferoxamine. Haematologica. 2004;89:1187-93.
10. Anderson LJ, Wonke B, Prescott E, Holden S, Walker JM, Pennell DJ. Comparison of effects of oral deferiprone and subcutaneous desferrioxamine on myocardial iron concentrations and ventricular function in beta-thalassaemia. Lancet. 2002;360:516-20.
11. Hoffbrand AV. A sensitive test for early myocardial iron loading. Eur Heart J. 2003;24:26-7.
12. Anderson LJ, Holden S, Davis B, Prescott E, Charrier CC, Bunce NH, et al. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload. Eur Heart J. 2001;22;2171-9.
13. Magri D, Sciomer S, Fedele F, Gualdi G, Casciani E, Pugliese P, et al. Early impairment of myocardial function in young patients with beta-thalassemia major. Eur J Haematol. 2008;80:515-22.
14. Kremastinos DT, Tsiapras DP, Tsetsos GA, Rentoukas EI, Vretou HP, Toutouzas PK. Left ventricular diastolic Doppler characteristics in beta-thalassemia major. Circulation. 1993;88:1127-35.
15. Lubien E, DeMaria A, Krishnaswamy P, Clopton P, Koon J, Kazanegra R, et al. Utility of B-natriuretic peptide in detecting diastolic dysfunction: comparison with Doppler velocity recordings. Circulation. 2002;105:595-601.
16. Cohen AR, Galanello R, Pennell DJ, Cunningham MJ, Vichinsky E. Thalassemia. Hematology Am Soc Hematol Educ Program. 2004:14-34.
17. Borow KM, Propper R, Bierman FZ, Grady S, Inati A. The left ventricular end-systolic pressure-dimension relation in patients with thalassemia major. A new noninvasive method for assessing contractile state. Circulation. 1982;66:980-5.
18. Kawano S, Hiraoka M, Sawanobori T. Electrocardiographic features of P waves from patients with transient atrial fibrillation. Jpn Heart J. 1988;29:57-67.
19. Dilaveris PE, Gialafos JE. P-wave dispersion: a novel predictor of paroxysmal atrial fibrillation. Ann Noninvasive Electrocardiol. 2001;6:159-65.
20. Tanigawa M, Fukutani M, Konoe A, Isomoto S, Kadena M, Hashiba K. Prolonged and fractionated right atrial electrograms during sinus rhythm in patients with paroxysmal atrial fibrillation and sick sinus node syndrome. J Am Coll Cardiol. 1991;17:403-8.
21. Papageorgiou P, Monaham K, Boyle NG, Seifert MJ, Beswick P, Zebede J, et al. Site-dependent intra-atrial conduction delay. Relationship to initiation of atrial fibrillation. Circulation. 1996;94:384-9.
22. Garson A. Electrocardiography. In: Garson A, Bricker JT, Fisher DJ, Neish SR, editors. The Science and Practice of Pediatric Cardiology. 2nd ed. Vol 1. Baltimore: Williams & Wilkins; 1998. p. 735-88.
23. Seyfeli E, Duru M, Kuvandiık G, Kaya H, Yalcin F. Effect of obesity on P-wave dispersion and QT dispersion in women. Int J Obes. 2006;30:957-61.
24. Ho TF, Chia EL, Yip WC, Chan KY. Analysis of P wave and P dispersion in children with secundum atrial septal defect. Ann Noninvasive Electrocardiol 2001;6:305-9.
25. Tükek T, Akkaya V, Demirel S, Sözen AB, Kudat H, Atilgan D, et al. Effect of Valsalva maneuver on surface electrocardiographic P-wave dispersion in paroxysmal atrial fibrillation. Am J Cardiol. 2000;85:896-9, A10.
Artigo submetido em 26.11.09, aceito em 28.12.09.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Como citar este artigo: Nisli K, Yavuz T, Oner N, Salcioglu Z, Karakas Z, Dindar A, et al. Electrocardiographic markers for the early detection of cardiac disease in patients with beta-thalassemia major. J Pediatr (Rio J). 2010;86(2):159-162.
- 1. Bianco I. Clinical and therapeutic aspects of Mediterranean anaemia. II Progr Med. 1986;42:471-5.
- 2. Ehlers KH, Giardina PJ, Lesser ML, Engle MA, Hilgartner MW. Prolonged survival in patients with beta-thalassemia major treated with deferoxamine. J Pediatr. 1991;118:540-5.
- 3. Dilaveris PE, Gialafos EJ, Sideris SK, Theopistou AM, Andrikopoulos GK, Kyriakidis M, et al. Simple electrocardiographic markers for the prediction of paroxysmal idiopathic atrial fibrillation. Am Heart J. 1998;135:733-8.
- 4. Dilaveris PE, Gialafos EJ, Andrikopoulos GK, Richter DJ, Papanikolaou V, Poralis K, et al. Clinical and electrocardiographic predictors of recurrent atrial fibrillation. Pacing Clin Electrophysiol. 2000;23:352-8.
- 5. Senen K, Turhan H, Riza Erbay A, Basar N, Saatci Yasar A, Sahin O, et al. P-wave duration and P-wave dispersion in patients with dilated cardiomyopathy. Eur J Heart Fail. 2004;6:567-9.
- 6. Sahn DJ, DeMaria A, Kisslo J, Weyman A. Recommendations regarding quantitation in M-mode echocardiography: results of a survey of echocardiographic measurements. Circulation 1978;58:1072-83.
- 7. Gialafos JE, Dilaveris PE, Gialafos EJ. P-wave dispersion: a valuable electrocardiographic marker for the prediction of paroxysmal lone atrial fibrillation. Ann Noninvas Electrocardiol. 1999;4:39-45.
- 8. Olivieri NF, Nathan DG, MacMillan JH, Wayne AS, Liu PP, McGee A, et al. Survival in medically treated patients with homozygous beta-thalassemia. N Engl J Med 1994;331:574-8.
- 9. Borgna-Pignatti C, Rugolotto S, De Stefano P, Zhao H, Cappellini MD, Del Vecchio GC, et al. Survival and complications in patients with thalassemia major treated with transfusion and deferoxamine. Haematologica. 2004;89:1187-93.
- 10. Anderson LJ, Wonke B, Prescott E, Holden S, Walker JM, Pennell DJ. Comparison of effects of oral deferiprone and subcutaneous desferrioxamine on myocardial iron concentrations and ventricular function in beta-thalassaemia. Lancet. 2002;360:516-20.
- 11. Hoffbrand AV. A sensitive test for early myocardial iron loading. Eur Heart J. 2003;24:26-7.
- 12. Anderson LJ, Holden S, Davis B, Prescott E, Charrier CC, Bunce NH, et al. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload. Eur Heart J. 2001;22;2171-9.
- 13. Magri D, Sciomer S, Fedele F, Gualdi G, Casciani E, Pugliese P, et al. Early impairment of myocardial function in young patients with beta-thalassemia major. Eur J Haematol. 2008;80:515-22.
- 14. Kremastinos DT, Tsiapras DP, Tsetsos GA, Rentoukas EI, Vretou HP, Toutouzas PK. Left ventricular diastolic Doppler characteristics in beta-thalassemia major. Circulation. 1993;88:1127-35.
- 15. Lubien E, DeMaria A, Krishnaswamy P, Clopton P, Koon J, Kazanegra R, et al. Utility of B-natriuretic peptide in detecting diastolic dysfunction: comparison with Doppler velocity recordings. Circulation. 2002;105:595-601.
- 16. Cohen AR, Galanello R, Pennell DJ, Cunningham MJ, Vichinsky E. Thalassemia. Hematology Am Soc Hematol Educ Program. 2004:14-34.
- 17. Borow KM, Propper R, Bierman FZ, Grady S, Inati A. The left ventricular end-systolic pressure-dimension relation in patients with thalassemia major. A new noninvasive method for assessing contractile state. Circulation. 1982;66:980-5.
- 18. Kawano S, Hiraoka M, Sawanobori T. Electrocardiographic features of P waves from patients with transient atrial fibrillation. Jpn Heart J. 1988;29:57-67.
- 19. Dilaveris PE, Gialafos JE. P-wave dispersion: a novel predictor of paroxysmal atrial fibrillation. Ann Noninvasive Electrocardiol. 2001;6:159-65.
- 20. Tanigawa M, Fukutani M, Konoe A, Isomoto S, Kadena M, Hashiba K. Prolonged and fractionated right atrial electrograms during sinus rhythm in patients with paroxysmal atrial fibrillation and sick sinus node syndrome. J Am Coll Cardiol. 1991;17:403-8.
- 21. Papageorgiou P, Monaham K, Boyle NG, Seifert MJ, Beswick P, Zebede J, et al. Site-dependent intra-atrial conduction delay. Relationship to initiation of atrial fibrillation. Circulation. 1996;94:384-9.
- 22. Garson A. Electrocardiography. In: Garson A, Bricker JT, Fisher DJ, Neish SR, editors. The Science and Practice of Pediatric Cardiology. 2nd ed. Vol 1. Baltimore: Williams & Wilkins; 1998. p. 735-88.
- 24. Ho TF, Chia EL, Yip WC, Chan KY. Analysis of P wave and P dispersion in children with secundum atrial septal defect. Ann Noninvasive Electrocardiol 2001;6:305-9.
- 25. Tükek T, Akkaya V, Demirel S, Sözen AB, Kudat H, Atilgan D, et al. Effect of Valsalva maneuver on surface electrocardiographic P-wave dispersion in paroxysmal atrial fibrillation. Am J Cardiol. 2000;85:896-9, A10.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
30 Abr 2010 -
Data do Fascículo
Abr 2010
Histórico
-
Aceito
28 Dez 2009 -
Recebido
26 Nov 2009