Resumos
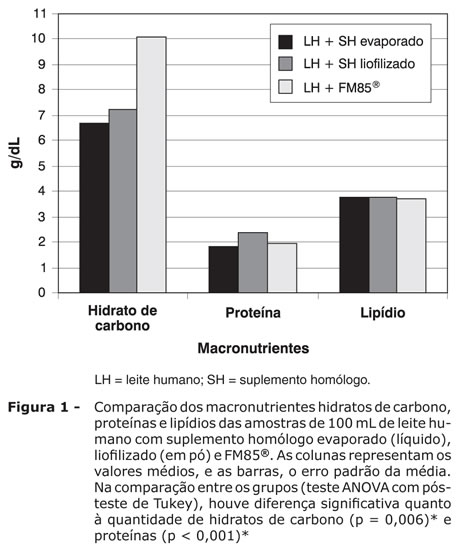
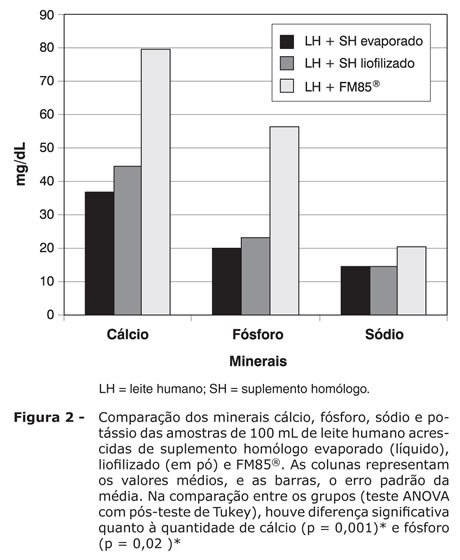
OBJETIVOS: Descrever a metodologia de preparo de dois aditivos, líquido e em pó, derivados do leite humano e comparar a constituição com aditivo comercial FM85®. MÉTODOS: Foram utilizadas 40 amostras de leite humano para o preparo dos suplementos líquido e em pó. Ambos passaram por três fases de preparo: desnate, evaporação e retirada da lactose. Após essas fases, o suplemento líquido está pronto, e o em pó necessita da quarta fase - a liofilização. Em cada amostra dos suplementos líquido e em pó, foram adicionados, respectivamente, 80 mL (grupo I) e 100 mL (grupo II) de pool de leite humano de banco. Para comparação, 20 amostras de 100 mL do pool foram acrescidas de 5 g do suplemento FM85® (Nestlé) (grupo III). Realizaram-se análises de hidratos de carbono, proteína, lipídios, cálcio, fósforo, sódio, osmolalidade e conteúdo calórico, considerando diferença significativa p < 0,05. RESULTADOS: Os grupos I, II e III mostraram, respectivamente, os seguintes resultados: proteínas = 1,81, 2,38 e 1,96 g/dL (p < 0,001); hidratos de carbono = 6,70, 7,25 e 10,06 g/dL (p = 0,006); gordura = 3,75, 3,75 e 3,73 g/dL (p = 0,96); cálcio = 36,92, 44,75 e 79,37 mg/dL (p = 0,001); fósforo = 20,02, 23,28 e 56,30 mg/dL (p = 0,02); sódio = 14,32, 14,40 e 20,33 mEq/L (p = 0,143); osmolalidade = 391,45, 412,47 e 431, 00 mOsmol/kgH2O (p = 0,074); e conteúdo calórico = 67,78, 72,27 e 81,65 kcal (p = 0,001). CONCLUSÃO: Os aditivos estudados diferem significativamente do aditivo comercial FM85® em alguns de seus constituintes, e a sua constituição pode ou não atender às quantidades de nutrientes propostas pelas recomendações mais recentes.
Recém-nascido prematuro; nutrição enteral; leite humano; banco de leite
OBJECTIVES: To describe the methodology for the preparation of two additives derived from human milk, liquid and powdered, and to compare this composition with the commercial additive FM85®. METHODS: For the preparation of the liquid and powdered supplements, 40 samples of human milk were used. Both supplements have been through three preparation phases: skimming, evaporation and lactose removal. After these phases, the liquid supplement is ready, and the powdered requires a fourth phase - lyophilization. To each sample of the liquid and powdered supplements were added, respectively, 80 mL (group I) and 100 mL (group II) of pooled banked human milk. For comparison, 20 samples of 100 mL of the pool were added to 5 g of the FM85® supplement (Nestlé) (group III). Analyses of carbohydrates, protein, lipids, calcium, phosphorus, sodium, osmolality and caloric content were performed, considering a significant difference p < 0.05. RESULTS: Groups I, II, and III showed, respectively, the following results: protein = 1.81, 2.38 and 1.96 g/dL (p < 0.001); carbohydrates = 6.70, 7.25 and 10.06 g/dL (p = 0.006); fat = 3.75, 3.75 and 3.73 g/dL (p = 0.96); calcium = 36.92, 44.75 and 79.37 mg/dL (p = 0.001); phosphorus = 20.02, 23.28 and 56.30 mg/dL (p = 0.02); sodium = 14.32, 14.40 and 20.33 mEq/L (p = 0.143); osmolality = 391.45, 412.47 and 431.00 mOsmol/kgH2O (p = 0.074); and caloric content = 67.78, 72.27 and 81.65 kcal (p = 0.001). CONCLUSION: The studied additives differ significantly from the commercial additive FM85® in some of its components, and its composition may or may not meet the quantity of nutrients suggested by the most recent recommendations.
Premature infant; enteral nutrition; human milk; milk bank
ARTIGO ORIGINAL
Comparação entre suplementos homólogos do leite humano e um suplemento comercial para recém-nascidos de muito baixo peso
Débora M. C. ThomazI; Paula O. SerafimII; Durval B. PalharesIII; Petr MelnikovIV; Luciana VenhofenV; Marcio O. F. VargasVI
IDoutora. Departamento de Pediatria, Universidade Federal de Mato Grosso do Sul (UFMS), Campo Grande, MS
IIMestre. Departamento de Pediatria, UFMS, Campo Grande, MS
IIIDoutor. Professor titular, Departamento de Pediatria, UFMS, Campo Grande, MS
IVDoutor. Departamento de Clínica Cirúrgica, UFMS, Campo Grande, MS
VMestre. Departamento de Fisioterapia, UFMS, Campo Grande, MS
VIQuímico, Departamento de Tecnologia de Alimentos, UFMS, Campo Grande, MS
Correspondência Correspondência: Débora M. C. Thomaz Departamento de Pediatria Universidade Federal de Mato Grosso do Sul (UFMS) Rua São Remo, 893, Jardim Mansur CEP 79051-230 Campo Grande, MS Tel.: (67) 3341.3459, (67) 9604.4844 E-mail: deboramcthomaz@hotmail.com
RESUMO
OBJETIVOS: Descrever a metodologia de preparo de dois aditivos, líquido e em pó, derivados do leite humano e comparar a constituição com aditivo comercial FM85®.
MÉTODOS: Foram utilizadas 40 amostras de leite humano para o preparo dos suplementos líquido e em pó. Ambos passaram por três fases de preparo: desnate, evaporação e retirada da lactose. Após essas fases, o suplemento líquido está pronto, e o em pó necessita da quarta fase a liofilização. Em cada amostra dos suplementos líquido e em pó, foram adicionados, respectivamente, 80 mL (grupo I) e 100 mL (grupo II) de pool de leite humano de banco. Para comparação, 20 amostras de 100 mL do pool foram acrescidas de 5 g do suplemento FM85® (Nestlé) (grupo III). Realizaram-se análises de hidratos de carbono, proteína, lipídios, cálcio, fósforo, sódio, osmolalidade e conteúdo calórico, considerando diferença significativa p < 0,05.
RESULTADOS: Os grupos I, II e III mostraram, respectivamente, os seguintes resultados: proteínas = 1,81, 2,38 e 1,96 g/dL (p < 0,001); hidratos de carbono = 6,70, 7,25 e 10,06 g/dL (p = 0,006); gordura = 3,75, 3,75 e 3,73 g/dL (p = 0,96); cálcio = 36,92, 44,75 e 79,37 mg/dL (p = 0,001); fósforo = 20,02, 23,28 e 56,30 mg/dL (p = 0,02); sódio = 14,32, 14,40 e 20,33 mEq/L (p = 0,143); osmolalidade = 391,45, 412,47 e 431, 00 mOsmol/kgH2O (p = 0,074); e conteúdo calórico = 67,78, 72,27 e 81,65 kcal (p = 0,001).
CONCLUSÃO: Os aditivos estudados diferem significativamente do aditivo comercial FM85® em alguns de seus constituintes, e a sua constituição pode ou não atender às quantidades de nutrientes propostas pelas recomendações mais recentes.
Palavras-chave: Recém-nascido prematuro, nutrição enteral, leite humano, banco de leite
ABSTRACT
OBJECTIVES: To describe the methodology for the preparation of two additives derived from human milk, liquid and powdered, and to compare this composition with the commercial additive FM85®.
METHODS: For the preparation of the liquid and powdered supplements, 40 samples of human milk were used. Both supplements have been through three preparation phases: skimming, evaporation and lactose removal. After these phases, the liquid supplement is ready, and the powdered requires a fourth phase lyophilization. To each sample of the liquid and powdered supplements were added, respectively, 80 mL (group I) and 100 mL (group II) of pooled banked human milk. For comparison, 20 samples of 100 mL of the pool were added to 5 g of the FM85® supplement (Nestlé) (group III). Analyses of carbohydrates, protein, lipids, calcium, phosphorus, sodium, osmolality and caloric content were performed, considering a significant difference p < 0.05.
RESULTS: Groups I, II, and III showed, respectively, the following results: protein = 1.81, 2.38 and 1.96 g/dL (p < 0.001); carbohydrates = 6.70, 7.25 and 10.06 g/dL (p = 0.006); fat = 3.75, 3.75 and 3.73 g/dL (p = 0.96); calcium = 36.92, 44.75 and 79.37 mg/dL (p = 0.001); phosphorus = 20.02, 23.28 and 56.30 mg/dL (p = 0.02); sodium = 14.32, 14.40 and 20.33 mEq/L (p = 0.143); osmolality = 391.45, 412.47 and 431.00 mOsmol/kgH2O (p = 0.074); and caloric content = 67.78, 72.27 and 81.65 kcal (p = 0.001).
CONCLUSION: The studied additives differ significantly from the commercial additive FM85® in some of its components, and its composition may or may not meet the quantity of nutrients suggested by the most recent recommendations.
Keywords: Premature infant, enteral nutrition, human milk, milk bank
Introdução
Os estudos em nutrição vêm contribuindo para a diminuição da morbidade e mortalidade no período neonatal. A introdução de aminoácidos precocemente, o uso de soluções de lipídios adequadas, o conceito de nutrição enteral mínima e a adequação de micronutrientes (vitaminas, oligoelementos e minerais) têm melhorado a sobrevida, em especial, de recém-nascidos pré-termo de muito baixo peso (RNMBP), contribuindo para diminuir a permanência hospitalar, além de evitar as doenças crônicas não transmissíveis em longo prazo1,2.
Há concordância na utilização do leite humano como fonte de nutrientes para RNMBP, devido ao conteúdo energético proteico, enzimático, fatores de crescimento e, principalmente, em decorrência dos fatores imunológicos provenientes dessa fonte3,4. Entretanto, algumas semanas pós-parto, os teores de nutrientes diminuem, e a oferta não supre as exigências nutricionais, principalmente quanto à quantidade de proteína, cálcio e fósforo5. O acréscimo de fortificantes ao leite humano proveniente da própria mãe ou de banco de leite se faz necessário6-8. Considerando que a qualidade da proteína do leite humano é considerada a ideal para os recém-nascidos, o uso de aditivos cuja proteína seja de origem homóloga parece ser o mais adequado9.
Os aditivos dessa origem atualmente existentes no mercado Prolacta +4, +6, +8, +10® e NeoPro® Prolacta Bioscience®10 têm alto custo, o que limita sua utilização em unidades de terapia intensiva neonatal de hospitais públicos.
Estudos demonstram que a modificação do leite humano por evaporação pode ser uma maneira de concentrarmos nutrientes e oferecermos teores nutricionais adequados para RNMBP11-13. A análise destes nos orientou para a metodologia proposta neste estudo: modificação do leite humano de banco de leite por extração de gordura, lactose e liofilização, com o objetivo de utilizá-lo como aditivo do leite humano de banco de leite que ofereça nutrientes de origem homóloga e na quantidade recomendada para proporcionar crescimento e desenvolvimento adequado em curto e longo prazo.
Métodos
Foram utilizados para o preparo dos aditivos líquido e em pó e para a reconstituição dos aditivos propostos e aditivo comercial, leite humano de banco com período de lactação de 2 meses a 1 ano advindos de doadoras do banco de leite humano do hospital universitário da Universidade Federal de Mato Grosso do Sul (UFMS), que autorizou a utilização do leite doado, após o parecer favorável do Comitê de Ética da direção clínica do hospital e desta universidade e Consentimento Livre e Informado.
Foram utilizadas 40 amostras de 200 mL para o preparo do leite humano modificado, realizado em três etapas: retirada da gordura, evaporação para concentração dos nutrientes e retirada da lactose e liofilização.
A gordura de cada amostra foi retirada utilizando desnatadeira de baixo porte, modelo 18 GR da marca Casa das Desnatadeiras®, que por força centrífuga separa a gordura do restante; este processo, porém, retém no rotor cerca de 120 mL da amostra do leite. Apos a retirada da gordura, amostras de 80 mL foram submetidas ao evaporador rotativo Marconi MA 120®, reduzindo o volume para 20 mL com concentração dos nutrientes. Esse concentrado foi acondicionado em tubos cônicos a 20 ºC negativos por 24 horas. Após, as amostras foram centrifugadas a 4.000 rpm por 20 minutos a 4 ºC em centrífuga refrigerada modelo Sigma 3K30®, formando o precipitado de lactose nas amostras, que foram então aquecidas em banho-maria a 37 ºC para a retirada do sobrenadante, desprezando o precipitado e dando origem ao aditivo na forma líquida, técnica de retirada da lactose já proposta em estudo desenvolvido por Santos12.
Esse mesmo processo é repetido para formação do aditivo em pó, porém o volume de cada amostra a ser evaporado é de 70 mL. O conteúdo, após evaporação e retirada da lactose, foi congelado a 20 ºC negativos e liofilizado em equipamento marca Edwards®, dando origem ao aditivo na forma em pó.
O aditivo na forma líquida de cada amostra foi adicionado a pool de leite humano, obtendo o volume de 100 mL (grupo I evaporado). O aditivo da forma em pó de cada amostra foi adicionado a 100 mL do mesmo pool de leite humano (grupo II liofilizado), sendo então pasteurizados, condição necessária para utilização na alimentação de recém-nascidos pré-termo.
Para comparação com o aditivo comercial, foram utilizadas 20 amostras do mesmo pool de leite utilizado nos grupos I e II, aditivado com FM85® (Nestlé) na proporção de 5 g% (grupo III).
Todas as amostras, após reconstituição, passaram pela avaliação do banco de leite quanto aos aspectos dilucionais, estabilização e foram submetidas a pasteurização e análise microbiológica; somente após serem aprovadas por essa avaliação, foram realizadas as análises quantitativas de: hidratos de carbono (técnica de formação de glicídios redutores); proteína (quantificação de nitrogênio proteico pelo método de microKjedahl); cálcio (método de cinzas utilizando colorimetria com ácido cloranílico; fósforo (fotocolorimetria); sódio (fotometria de chama); osmolalidade (osmometria de congelamento); gordura (método de Gerber); e conteúdo calórico (fórmula de Atwater); técnicas descritas e recomendadas pelo Instituto Adolfo Lutz14.
A comparação entre as variáveis mensuradas foi feita utilizando o teste ANOVA com pós-teste de Tukey com determinação da média e erro padrão da média, considerando diferença significativa p < 0,05. Foi utilizado Microsoft Excel 2003 para o planilhamento dos dados e o Sigma Start na versão 2.015.
Resultados
Os resultados dos teores nutricionais do leite humano acrescido de suplemento líquido (evaporado), em pó (liofilizado) e FM85® foram, respectivamente: proteína = 1,81±0,01, 2,38±0,03 e 1,96±0,01 g/dL (p < 0,001); hidrato de carbono = 6,70±0,20, 7,25±0,25 e 10,06±0,05g/dL (p = 0,006); lipídios = 3,75±0,16, 3,75±0,16 e 3,73±0,07 g/dL (p = 0,96) (Figura 1); cálcio = 36,92±1,09, 44,75±1,21 e 79,37±0,34 mg/dL (p = 0,001); fósforo = 20,02±0,95, 23,28±0,95 e 56,30±0,18 mg/dL (p = 0,02); sódio = 14,32±0,69, 14,4±0,061 e 20,33±0,033 mEq/L (p = 0,143) (Figura 2); osmolalidade = 391,45±7,22, 412,00±5,99 e 431,00±0,50 mOsmol/kgH2O (p = 0,074) (Figura 3); e conteúdo calórico = 67,78±2,01, 72,27±2,56 e 81,65±0,87 (p = 0,001) (Figura 4).
Discussão
A adequação da quantidade de nutrientes oferecidos pelo leite humano de banco e da própria mãe é necessária para proporcionar a quantidade de nutrientes suficientes para o crescimento e desenvolvimento adequados, e para tal devemos utilizar aditivos5,8,16,17.
No Brasil, o aditivo comercial comumente utilizado é o FM85®, que acrescenta ao leite humano de banco de leite proteína, carboidrato, vitaminas, minerais e oligoelementos, justificando a sua escolha para comparação com os aditivos propostos neste estudo.
O número das amostras em cada grupo foi baseado em estudo prévio, que levou em consideração a pequena variação de nutrientes do leite maduro em diferentes mães doadoras12. O volume de pool de leite humano utilizado para adição do suplemento na forma líquida e em pó 80 e 100 mL, respectivamente, em cada amostra foi calculado por análises prévias com o objetivo de atingir o menor volume de leite humano modificado, para servir como aditivo capaz de, ao ser adicionado a 100 mL de leite humano de banco de leite, oferecer nutrientes em quantidade, qualidade e custo aceitáveis.
O aditivo na forma líquida é adicionado a um menor volume de pool de leite quando comparado ao aditivo na forma em pó. A reconstituição do aditivo em pó em 100 mL de leite humano de banco de leite propicia um volume de diluição maior com níveis nutricionais e bioativos mais elevados que o aditivo na forma líquida11. Entretanto, a técnica de liofilização requer maior investimento, aquisição pelo banco de leite de um evaporador, centrífuga refrigerada e liofilizador, enquanto o aditivo na forma líquida, por depender somente dos dois primeiros equipamentos, é considerado de baixo custo e de fácil operacionalização. O custo único e inicial para equipar o banco de leite e produzir os suplementos líquido e em pó é de aproximadamente R$ 25.000,00 e R$ 52.000,00, respectivamente. Considerando que o custo da caixa do aditivo comercial com 70 flaconetes é de R$ 90,98 no empenho número 801-790 da UFMS e que um flaconete aditiva 20 mL de leite humano, o custo para alimentar uma criança de 1.000 g, com volume diário de 150 mL/kg por 30 dias, será de R$ 682,35. Para alimentar 10 crianças por dia com este volume durante 1 ano, haverá o gasto de R$ 81.840,00. Sendo assim, uma unidade de terapia neonatal que atende 10 crianças por mês, utilizando o volume proposto, terá gasto em 1 ano três vezes o valor do custo inicial do aditivo líquido e uma vez e meia o do aditivo em pó.
As amostras do aditivo em pó produziram em média 5,4 g de pó, e esta quantidade foi utilizada para suplementar 100 mL de leite humano de banco.
A evaporação e liofilização concentram os nutrientes, sendo necessário controlar teores de lactose e gordura, evitando alterações gastrointestinais nos RNMBP12. Justificando a necessidade de retirada da lactose e gordura.
O fornecimento de lactose deve estar em torno de 3 a 12 g para cada 100 kcal e não ultrapassar 8 g/100 mL17. Os grupos I, II e III ofereceram respectivamente 9,88 g/100 kcal, 10,03 g/100 kcal e 12,3 g/100 kcal de hidratos de carbono.
Quanto à quantidade de calorias, o grupo I oferece 101,7 a 135,6 kcal/kg/dia; o grupo II, 108,4 a 144,5 kcal/kg/dia; e o grupo III, 122,4 a 163,3 kcal/kg/dia, se forem utilizados volumes de 150 a 200 mL/kg/dia. Apesar de os grupos I e II oferecerem índices calóricos inferiores aos oferecidos pelo grupo III, há a oferta de valores calóricos de acordo com as recomendações nutricionais para RNMBP18.
O teor de gordura ofertado pelas amostras dos grupos I e II foi de aproximadamente 5,53 g/100 kcal e o do grupo III foi de 5,16 g/100 kcal. O total de lipídios recomendado é baseado no conteúdo de leite humano e pode variar de 3,8 a 11 g/kg/dia, sendo que a proximidade do valor máximo em uma dieta poderá ocasionar esteatorreia. Se utilizarmos um volume de dieta que varia de 150 a 200 mL/kg/dia, estaremos ofertando uma quantidade aproximada de 5,6 g/kg/dia a 11,3 g/kg/dia18.
A oferta de aminoácidos em quantidade adequada, mesmo com baixa ingestão calórica, permite a não utilização da proteína endógena, aumentando a síntese proteica e diminuindo a diferença entre proteólise e síntese proteica. São necessários 3,8 a 4,0 g/kg/dia para atingir valores intrauterinos de agregação18. Dieta com suplemento na forma líquida irá fornecer 2,7 g/100 kcal (grupo I); com suplemento em pó, fornece 3,4 g/100 kcal; e com suplemento comercial, 2,4 g/100 kcal. Todas fornecem quantidade dentro da referência para nutrição de RNMBP e recém-nascido de extremo baixo peso (RNEBP)18-20. A oferta de 160 mL/kg/dia de leite humano aditivado com suplemento homólogo em pó (grupo II) irá fornecer ao RNMBP 3,8 g/kg/dia de proteína homóloga, atendendo às necessidades nutricionais dessa população com menor risco à saúde em longo prazo2,3.
O sódio é necessário para manter a tonicidade extracelular, influenciando no balanço hídrico adequado, pré-requisito para o crescimento e desenvolvimento21. Considerando que a oferta de 160 mL/kg/dia das dietas (grupo I e II) oferecerá aproximadamente 2,4 mEq/kg/dia e que a necessidade de sódio de RNMBP segundo os comitês de nutrição é de 4 a 5 mEq/kg/dia, há necessidade de controle bioquímico desse mineral para recém-nascidos com idade gestacional menor que 32 semanas3,16.
A quantidade de cálcio nos grupos I e II está abaixo das recomendações nutricionais3,16,18. Há exigência da oferta extra de aproximadamente 75 mg de cálcio e 35 mg de fósforo para cada 100 mL de leite, que poderá ser manipulado sob a forma de glicerofosfato de cálcio e cálcio quelado a glicina e adicionado aos aditivos propostos, para que, ao ofertarmos 150 mL/kg/dia dessas dietas suplementadas, ofereçam aproximadamente 180 mg/kg/dia de cálcio e 87 mg/kg/dia de fósforo, valores que atingem as recomendações nutricionais dessa faixa etária (70 a 140 mg/kg/dia de cálcio e 50 a 90 mg/kg/dia de fósforo)16; e que, quando oferecido volume igual a 200 mL/kg/dia, alcancem as recomendações propostas pela Academia Americana de Pediatria, que são de 200 a 250 mg/kg/dia de cálcio e 110 a 125 mg/kg/dia de fósforo3. O acréscimo desses minerais não mostrou aumento significativo na osmolalidade do suplemento quando comparada à osmolalidade inicial da fórmula e ainda mostrou-se inferior ao pool de leite humano acrescido de FM85®.
A osmolalidade dos aditivos dos grupos I, II e III encontra-se em níveis toleráveis22. Dietas hipertônicas estão relacionadas a enterocolite necrotizante aguda23. Porém, a facilidade da absorção dos nutrientes provenientes do leite humano, associada à existência de imunoglobulinas, fatores de crescimento epidérmico e enzimas que hidrolisam fatores de ativação plaquetária, indica que a osmolalidade do leite humano com os aditivos I e II proporciona menor risco ao recém-nascido, além de ofertar proteína de origem homóloga23.
As modificações do leite humano de banco de leite propostas neste estudo e suas reconstituições proporcionaram um alimento com quantidades de macronutrientes semelhante ao oferecido pelo leite humano da própria mãe do recém-nascido prematuro nas primeiras semanas de lactação. Considerando que a evaporação não destrói por completo fatores imunológicos e sendo a liofilização um método de conservação de nutrientes, há provável preservação das funções enzimáticas e imunológicas na produção dos aditivos dos grupos I e II11,24, o que os torna melhor em qualidade do que o aditivo comercial.
A aquisição de evaporador, centrífuga refrigerada e liofilizador pelos bancos de leite é o investimento inicial e único para equipar e desenvolver a metodologia proposta. Sendo assim, em bancos de leite equipados, que contam com um número elevado de doadoras, em países em desenvolvimento, considerando o alto custo dos aditivos industrializados, os aditivos propostos nas formas líquida e em pó parecem ser bem indicados como aditivos do leite humano de banco de leite ou da própria mãe para nutrir RNMBP, por oferecerem quantidades significantes de proteína de origem homóloga e permitirem o alcance das recomendações nutricionais de macronutrientes eleitas pelos comitês internacionais de nutrição, autorizando a utilização desses aditivos de forma rotineira nos serviços de neonatologia, considerando os acréscimos de cálcio e fósforo na quantidade proposta neste estudo.
Os suplementos homólogos propostos neste estudo poderão ser melhorados quanto ao seu conteúdo energético de maneira controlada, com a escolha de leite humano de banco com maior conteúdo energético e proteico para ser acrescido de suplemento homólogo em líquido ou em pó, ou acrescentando, de maneira controlada, 1 g, por exemplo, de gordura extraída do próprio leite humano no processo de desnate. Haverá, assim, acréscimo de calorias e de ácidos graxos poliinsaturados, que proporcionará um melhor crescimento e desenvolvimento em longo prazo25. Outra maneira seria aumentar o conteúdo calórico acrescentando polímeros de glicose ao suplemento homólogo, sem grande interferência na osmolalidade e com boa absorção22.
Em estudo clínico sobre o crescimento de RNMBP alimentados com as diferentes dietas propostas, ainda não submetido a publicação, observou-se que há benefícios para o crescimento do perímetro cefálico nos grupos alimentados com leite humano acrescido de leite humano modificado. Esse dado provavelmente indica que a melhor qualidade dos aminoácidos ofertados pelo suplemento homólogo, com suprimento maior de determinados em detrimentos de outros, poderia implicar no melhor crescimento cerebral26.
Estudos longitudinais em diferentes centros de atendimento a recém-nascidos pré-termo, que avaliem o crescimento, tolerabilidade gastrintestinal e desenvolvimento em longo prazo de recém-nascidos alimentados com leite humano de banco adicionado de suplemento homólogo, devem ser realizados para comprovar os benefícios dessas dietas.
Agradecimentos
Agradecemos a colaboração de Elisabete Kamiya pela assistência junto ao banco de leite, e de Ana Maria Miguel Figueiredo e Baltazar Nunes pela análise da osmolalidade.
Artigo submetido em 06.08.11, aceito em 16.11.11.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Como citar este artigo: Thomaz DM, Serafim PO, Palhares DB, Melnikov P, Venhofen L, Vargas MO. Comparison between homologous human milk supplements and a commercial supplement for very low birth weight infants. J Pediatr (Rio J). 2012;88(2):119-24.
- 1. Camelo JS Jr, Martinez FE. Dilemas nutricionais no pré-termo e repercussões na infância, adolescência e vida adulta. J Pediatr (Rio J). 2005;81:S33-42.
- 2. Lucas A. Role of nutritional programming in determining adult morbidity. Arch Dis Child. 1994;71:288-90.
- 3. American Academy of Pediatrics Committee on Nutrition: nutritional needs of low birth weight infants. Pediatrics. 1985;75:976-86.
- 4. Schanler RJ. Suitability of human miIk for the low-birth weight infant. Clin Perinatol. 1995;22:207-22.
- 5. Atkinson SA, Bryan MH, Anderson GH. Human miIk feeding in premature infant: protein, fat, and carbohydrate balances in the first two weeks of life. J Pediatr. 1981;99:617-24.
- 6. Rigo J, Senterre J. Nutritional needs of premature infants: current issues. J Pediatr. 2006;149:S80-8.
- 7. Schanler RJ. Evaluation of the evidence to support current recommendations to meet the needs of premature infant: the role of human milk. Am J CIin Nutr. 2007;85:625S-628S.
- 8. Kuschel CA, Harding JE. Multicomponent fortified human milk for promoting growth preterm infants. Cochrane Database Syst Rev. 2004;(1):CD000343.
- 9. dos Santos SC, de Figueiredo CM, de Andrade SM, Palhares DB. Plasma amino acids in preterm infants fed different human milk diets from a human milk bank. E Spen Eur E J Clin Nutr Metab. 2007;2:51-6.
- 10. Waber B, Begany M. Uso de fórmulas para o recém-nascido pré-termo hospitalizado. In: Pereira GR, Leone CR, Alves Filho N, Trindade Filho O, editores. Nutrição do recém-nascido pré-termo. Rio de Janeiro: Medbook; 2008. p. 45-60.
- 11. Braga LP, Palhares DB. Effect of evaporation and pasteurization in the biochemical and immunological composition of human milk. J Pediatr (Rio J). 2007;83:59-63.
- 12. Santos MM. Preparo de um concentrado de leite humano especial para recém-nascido pré-termo [dissertação]. Ribeirão Preto: Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo; 1994.
- 13. Boehm G, Melichar V, Müller DM, Mikova M, Senger H, Beyreiss K. The application of redissolved human milk lyophilisate for nutrition of very low birth weight infants. Acta Paediatr Hung. 1987;28:267-72.
- 14. Instituto Adolfo Lutz. Normas analíticas do Instituto Adolfo Lutz: métodos químicos e físicos para análise de alimentos. 4Ş ed. Brasília: Ministério da Saúde; 2005.
- 15. Shotts S. Statistics for health professionals. Philadelphia: W. B. Saunders Company; 1990.
- 16. Nutrition and feeding of preterm infants. Committee on Nutrition of the Preterm Infant, European Society of Paediatric Gastroenterology and Nutrition. Acta Paediatr Scand Suppl. 1987;336:1-14.
- 17. Heiman H, Schanler RJ. Enteral nutrition for premature infants: the role of human milk. Semin Fetal Neonatal Med. 2007;12:26-34.
- 18. Edmond K, Bahl R. Optimal feeding of very low-birth-weight: technical review. Geneva: World Health Organization; 2006.
- 19. Polberger SK, Axelsson IA, Räihä NC. Growth of very low birth weight infants on varying amounts of human milk protein. Pediatr Res. 1989;25:414-9.
- 20. Denne SC. Regulation of proteolysis and optimal protein accretion in extremely premature newborns. Am J Clin Nutr. 2007;85:621S-624S.
- 21. Al-Dahhan J, Jannoun L, Haycock GB. Effect of salt supplementation of newborn premature infants on neurodevelopmental outcome at 10-13 years of age. Arch Dis Child Fetal Neonatal Ed. 2002;86:F120-3.
- 22. De Curtis M, Candusso M, Pieltain C, Rigo J. Effect of fortification on the osmolality of human milk. Arch Dis Child Fetal Neonatal Ed. 1999;81:F141-3.
- 23. Lucas A, Cole TJ. Breast milk and neonatal necrotising enterocolits. Lancet. 1990;336:1519-23.
- 24. Liebhaber M, Lewiston NJ, Asquith MT, Olds-Arroyo L, Sunshine P. Alterations of lymphocytes and of antibody content of human milk after processing. J Pediatr. 1977;91:897-900.
- 25. Tinoco SM, Sichieri R, Setta CL, Moura AS, Carmo MG. n-3 polyunsaturated fatty acids in milk is associate to weight gain and growth in premature infants. Lipids Health Dis. 2009;8:23.
- 26. Wharton BA, Morley R, Isaacs EB, Cole TJ, Lucas A. Low plasma taurine and later neurodevelopment. Arch Dis Child Fetal Neonatal Ed. 2004;89:F497-8.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
28 Jun 2012 -
Data do Fascículo
Abr 2012
Histórico
-
Recebido
06 Ago 2011 -
Aceito
16 Nov 2011