Resumos
OBJETIVOS: Avaliar a associação entre o polimorfismo genético do fator de necrose tumoral alfa (TNF-α) e o desenvolvimento de sepse e choque séptico em pacientes pediátricos tailandeses e investigar o impacto clínico de polimorfismos do TNF-α nessa população. MÉTODOS: Para a realização deste estudo de associação genética, foram analisados prospectivamente pacientes pediátricos (idade < 18 anos) com sepse clínica/choque séptico. Todos os dados foram coletados por especialistas em terapia intensiva pediátrica e as análises genéticas foram realizadas em um laboratório central. Um polimorfismo de nucleotídeo único [single nucleotide polymorphism (SNP)], localizado na região promotora 5' na posição -308, foi genotipado e os resultados foram associados a fenótipos clínicos. RESULTADOS: Foram investigados 167 indivíduos tailandeses, dos quais 66 eram pacientes pediátricos com sepse/choque séptico e 101 eram controles saudáveis. Curiosamente, não foi possível identificar associação entre sepse e o polimorfismo -308 (G→A), um dos principais SNPs anteriormente associado à sepse em várias populações caucasianas, visto que não houve diferença de frequência entre casos e controles. CONCLUSÕES: Neste estudo, o principal polimorfismo do TNF-α -308 não esteve associado à sepse clínica/choque séptico na população tailandesa. Essa informação é importante para futuras análises que busquem identificar a função do TNF-α como risco genético para o desenvolvimento de imunopatologia subjacente a várias doenças no continente asiático.
Sepse; fator de necrose tumoral alfa; polimorfismo; nucleotídeo único; unidades de terapia intensiva pediátrica
OBJECTIVES: To evaluate the association between the genetic polymorphism of the tumor necrosis factor-alpha (TNF-α) gene and the development of sepsis and septic shock in Thai pediatric patients and to investigate the clinical impacts of TNF-α polymorphisms in this population. METHODS: To perform this genetic association study, a prospective analysis of pediatric patients (age < 18 years) with clinical sepsis/septic shock was conducted. All clinical data were collected by pediatric intensive care experts, and genetic analyses were performed at a central laboratory. A single nucleotide polymorphism (SNP) located in the 5'-promoter region at position -308 was genotyped and the results were associated with clinical phenotypes. RESULTS: A total of 167 Thai individuals were investigated, 66 of which were pediatric patients with sepsis/septic shock and 101 were healthy controls. Interestingly, we could not identify an association between sepsis and -308 (G→A) polymorphism, which have previously been demonstrated to be a major SNP associated with sepsis in several Caucasian populations, since there was no frequency difference between cases and controls. CONCLUSIONS: In this report, the major TNF-α polymorphism (-308) was not associated with clinical sepsis/septic shock in Thais. This information will be important for future analyses to identify the role of TNF-α as a genetic risk for the development of immunopathology underlying several diseases in Asia.
Sepsis; tumor necrosis factor-alpha; polymorphism; single nucleotide; pediatric intensive care units
ARTIGO ORIGINAL
Estudo de associação genética entre fator de necrose tumoral alfa e sepse e choque séptico em pacientes pediátricos tailandeses
Suwannee PhumeethamI; Nunthawut Chat-uthaiII; Manutham ManavathongchaiIII; Vip ViprakasitIV
IMD. Division of Pediatric Pulmonology. Faculty of Medicine Siriraj Hospital, Mahidol University, Bangkok, Tailândia.
IIBSc. Department of Immunology, MSc. Program, Faculty of Medicine Siriraj Hospital, Mahidol University, Bangkok, Tailândia.
IIIMD. Department of Pediatrics, Bangkok Metropolitan Administration Medical College, Vajira Hospital, Bangkok, Tailândia.
IVMD. Phil. Division of Hematology/Oncology, Department of Pediatrics, Faculty of Medicine Siriraj Hospital, Mahidol University, Bangkok, Tailândia.
Correspondência Correspondência: Vip Viprakasit Mahidol University 2 Prannok Road, Bangkoknoi 10700 - Bangkok - Tailândia Tel.: +66 (2) 4122113 E-mail: vip.vip@mahidol.ac.th
RESUMO
OBJETIVOS: Avaliar a associação entre o polimorfismo genético do fator de necrose tumoral alfa (TNF-α) e o desenvolvimento de sepse e choque séptico em pacientes pediátricos tailandeses e investigar o impacto clínico de polimorfismos do TNF-α nessa população.
MÉTODOS: Para a realização deste estudo de associação genética, foram analisados prospectivamente pacientes pediátricos (idade < 18 anos) com sepse clínica/choque séptico. Todos os dados foram coletados por especialistas em terapia intensiva pediátrica e as análises genéticas foram realizadas em um laboratório central. Um polimorfismo de nucleotídeo único [single nucleotide polymorphism (SNP)], localizado na região promotora 5' na posição -308, foi genotipado e os resultados foram associados a fenótipos clínicos.
RESULTADOS: Foram investigados 167 indivíduos tailandeses, dos quais 66 eram pacientes pediátricos com sepse/choque séptico e 101 eram controles saudáveis. Curiosamente, não foi possível identificar associação entre sepse e o polimorfismo -308 (G→A), um dos principais SNPs anteriormente associado à sepse em várias populações caucasianas, visto que não houve diferença de frequência entre casos e controles.
CONCLUSÕES: Neste estudo, o principal polimorfismo do TNF-α -308 não esteve associado à sepse clínica/choque séptico na população tailandesa. Essa informação é importante para futuras análises que busquem identificar a função do TNF-α como risco genético para o desenvolvimento de imunopatologia subjacente a várias doenças no continente asiático.
Palavras-chave: Sepse, fator de necrose tumoral alfa, polimorfismo, nucleotídeo único, unidades de terapia intensiva pediátrica.
Introdução
Apesar de um melhor entendimento a respeito da fisiopatologia da sepse uma síndrome caracterizada por respostas inflamatórias sistêmicas e pró-coagulantes [síndrome da resposta inflamatória sistêmica (SRIS)] do hospedeiro a patógenos , e também dos avanços no monitoramento nas unidades de terapia intensiva e nos tratamentos de suporte (incluindo suporte respiratório, uso de antibióticos e outras medidas farmacológicas), a mortalidade relacionada à sepse clínica/choque séptico permanece elevada. Atualmente, uma resposta intensa do hospedeiro que acarreta uma disfunção orgânica e que leva à sepse e ao choque séptico graves está se tornando uma causa importante de óbito em unidades de cuidado intensivo1,2. Respostas imunológicas não controladas a um determinado patógeno por parte de diferentes indivíduos têm papel fundamental no desenvolvimento de sepse clínica/choque séptico3. A influência da genética sobre a mortalidade associada a certas doenças infecciosas vem sendo analisada há muito tempo, desde a década de 19804. Sørensen et al. relataram que a morte dos pais biológicos em decorrência de infecções aumentou o risco de que seus filhos venham a óbito pelo mesmo motivo, o que não ocorreu no caso de pais adotivos4. Nos últimos 10 anos, após a finalização do projeto genoma humano, vários estudos, principalmente em populações caucasianas, demonstraram que existe uma variação genética significativa em diversas doenças humanas comuns5. Muitos estudos sobre o tema indicam uma forte influência genética na susceptibilidade a sepse/choque séptico e podem ser utilizados para predizer a evolução clínica6. Além disso, descobriu-se que várias infecções são afetadas pela variação genética, incluindo malária7, tuberculose, hanseníase, e infecções por helicobacter pylori, HIV e hepatite B, entre outras8.
A principal patogênese da sepse é uma resposta sistêmica aguda que produz excesso de citocinas pró-inflamatórias sem que haja uma produção adequada de mediadores anti-inflamatórios para contrabalançar a produção dessas citocinas1,9. O fator de necrose tumoral alfa (TNF-α), uma das mais importantes citocinas pró-inflamatórias, tem papel essencial na patogênese dessa resposta inflamatória aguda (reação de fase aguda) e está envolvido na inflamação sistêmica10. O gene do TNF-α está localizado no cromossomo 6p21.3, tem comprimento de aproximadamente 3 kb e contém quatro éxons que produzem proteína transmembrana tipo II com 212 aminoácidos e disposta em homotrímeros estáveis11. Além disso, o TNF-α tem várias funções na imunopatologia humana, desde produzir inflamação, proliferação e diferenciação celular, tumorigênese, replicação viral até induzir a morte celular por apoptose. Em modelos clínicos de sepse, a administração do TNF-α causa hipotensão, ativação da cascata de coagulação e disfunção orgânica, confirmando a sua função de mediador na fase aguda12. No nível in vivo, observou-se um aumento nos níveis de TNF-α após desafio com endotoxinas em voluntários saudáveis13 e também em pacientes com choque séptico devido tanto a bacteremia gram-postiva quanto a bacteremia gram-negativa14,15. A esse respeito, não surpreende que os estudos de associação genética do gene TNF-α em pacientes com sepse/choque séptico foram um dos primeiros estudos de associação genética a serem realizados em humanos, considerando o fato de que entender tal risco genético pode proporcionar um melhor entendimento e um aprimoramento no manejo de condições letais como a sepse16. Por meio dessas análises, principalmente em populações caucasianas, foi possível identificar o principal polimorfismo genético presente nas regiões reguladoras do gene que codifica o TNF-α: -308 (G→A). Essa transição de guanina para adenina localizada no par de bases -308 do local de início da transição foi observada em vários estudos in vitro, demonstrando que essa alteração polimórfica está associada a um aumento na secreção de TNF-α por macrófagos após estímulo com lipopolissacarídeo e que esse aumento potencial pode conferir uma resposta semelhante, levando à sepse clínica in vivo17. Entretanto, existem dados conflitantes até mesmo em populações de mesma etnia, visto que nem sempre foi possível reproduzir uma correlação positiva entre o polimorfismo -308 e sepse clínica/choque séptico em outros estudos18. Todavia, considerando ser amplamente aceito o fato de que o polimorfismo genético varia entre grupos étnicos, quaisquer estudos comparativos devem ser realizados dentro do mesmo fundo genético19. Contudo, continua sendo importante rever todos os principais polimorfismos relatados em qualquer população, a fim de demonstrar se é possível utilizar esses marcadores genéticos como um risco genético universal para uma determinada condição clínica. Nesse sentido, realizamos o primeiro estudo prospectivo em uma população do sudeste asiático a avaliar se existe uma associação entre o polimorfismo -308A do TNF e o desenvolvimento de sepse e choque séptico em pacientes pediátricos tailandeses.
Métodos
Pacientes e controles
Foi realizado um estudo prospectivo em indivíduos elegíveis incluindo todos os pacientes com sepse ou choque séptico de origem tailandesa internados na unidade de terapia intensiva pediátrica (UTIP) no Siriraj Hospital e no Vajira Hospital de novembro de 2007 a abril de 2009. O grupo de pacientes com sepse foi definido de acordo com os critérios da Conferência Internacional de Consenso sobre Sepse Pediátrica20; (1) evidência de SRIS manifestada por pelo menos dois dos quatro critérios seguintes: temperatura central > 38,5 °C ou < 36 °C, taquicardia [frequência cardíaca > dois desvios padrão (DPs) acima do normal para a idade] ou bradicardia em crianças < 1 ano (frequência cardíaca < percentil 10 para a idade), taquipneia (frequência respiratória > dois DPs acima do normal para a idade) ou necessidade de ventilação mecânica, contagem de leucócitos elevada ou baixa para a idade ou > 10% de neutrófilos imaturos; (2) infecção suspeita ou comprovada. O grupo de pacientes com choque séptico devia atender aos seguintes critérios: (1) evidência de sepse; (2) disfunção cardiovascular definida por hipotensão [pressão arterial (PA) < percentil 5 para a idade ou PA sistólica < dois DPs abaixo do normal para a idade], ou necessidade de droga vasoativa para manter a PA em níveis normais, ou perfusão orgânica inadequada manifestada por pelo menos uma das seguintes síndromes: acidose metabólica não explicada (déficit de base > 5,0 mEq/L), aumento de lactato arterial > duas vezes o limite superior da normalidade, oligúria (débito urinário < 0,5 mL/kg/h), tempo de enchimento capilar > 5 s, diferença entre a temperatura central e periférica > 3 °C. Os critérios de exclusão foram os seguintes: (1) imunodeficiência primária; (2) infecção por HIV; (3) administração inadequada de antibióticos nos 7 dias anteriores ao diagnóstico de sepse ou choque séptico, conforme determinado pelos pesquisadores. O grupo controle consistiu em 101 estudantes de medicina tailandeses saudáveis e sem parentesco entre si. Dados clínicos e demográficos incluindo doenças subjacentes, fonte da infecção, patógenos responsáveis, avaliação da gravidade clínica por meio do escore Acute Physiology and Chronic Health Evaluation (APACHE)21, e desfecho do tratamento (sobrevivência ou óbito) foram coletados e avaliados diretamente por dois especialistas em UTIP (S.P. e M.M.). Este estudo foi aprovado pelos comitês de ética do Siriraj Hospital e do Vajira Hospital, Bangkok, Tailândia. Foi obtido consentimento informado dos casos e controles e/ou de seus pais ou responsáveis.
Genotipagem do TNF -308
O DNA genômico foi extraído de amostras de 5 mL de sangue coletado com anticoagulante EDTA utilizando o método fenol-clorofórmio. A genotipagem dos polimorfismos dos genes TNF-α -308 foi realizada pelo método reação em cadeia da polimerase com polimorfismo de comprimento de fragmentos de restrição. O promotor do gene TNF-α foi amplificado utilizando um protocolo modificado descrito anteriormente22: primer direto do TNF-α (5'- AGG CAA TAG GTT TTG AGG GCC AT - 3') e primer inverso do TNF-α (5'- ACA AGC ATC AAG GAT ACC CCT - 3'). O volume da mistura de PCR foi de 25 μL, contendo 0,5 mmol/L de cada primer, solução tampão de PCR 1 X, 1,5 mmol/L de MgCl2, 0,2 mmol/L de cada base nitrogenada, 1,25 U de Taq DNA polimerase, 50 ng de DNA, e água estéril. A PCR foi realizada em um mini termociclador MJ (Bio-Rad®, USA) de acordo com a seguinte sequência: 95 °C por 5 min, seguido por 31 ciclos que consistiam em 95 °C por 30 s, 54,3 °C por 35 s, e 72 °C por 1 min, com uma extensão final a 72 °C por 15 min. O tamanho do produto de PCR amplificado foi de 139 bp; posteriormente, ele foi digerido durante a noite com NcoI (sítio de reconhecimento: 5'-CCATGG-3') a 37 °C para detectar a transição de G para A na região promotora -308. Os fragmentos de PCR digeridos foram analisados por eletroforese em gel de agarose a 3%, visualizados por coloração com brometo de etídio e documentados no Gel Doc System (DNR Imaging System®, Israel). A transição de G→A gera uma nova região digerida, resultando em dois fragmentos digeridos de 119 e 20 bp, enquanto o tipo selvagem (G) permanece inalterado.
Análise estatística
Os dados descritivos foram expressos como frequência (%) ou como média ± desvio padrão. Foi utilizado o teste t de Student bicaudal (two-tailed) para a comparação das variáveis contínuas com distribuição normal e o teste de Mann-Whitney U para variáveis contínuas sem distribuição normal. Os estudos de associação entre diferentes grupos foram analisados com o teste qui-quadrado. Foi considerado estatisticamente significativo um valor p inferior a 0,05.
Resultados
Foram recrutados 66 pacientes tailandeses que preenchiam todos os critérios para sepse/choque séptico mencionados anteriormente, dos quais 43 apresentavam sepse e 23 apresentavam choque séptico. As características demográficas dos pacientes com sepse e choque séptico encontram-se resumidas na Tabela 1. Os valores do escore APACHE foram calculados com base nas condições subjacentes e na gravidade dos pacientes selecionados. No total, a taxa de mortalidade na UTIP, que foi de 19,7%, está de acordo com o risco predito de óbito com base no escore APACHE. Apenas duas características clínicas basais apresentaram diferenças significativas entre sobreviventes e não sobreviventes (óbitos): idade no diagnóstico (31,2 versus 75,2 meses, respectivamente) e escore APACHE (9,0 versus 15,1, respectivamente), como demonstrado na Tabela 1.
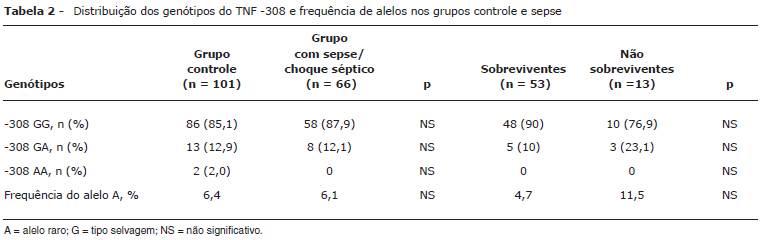
Conseguimos desenvolver com sucesso uma análise simples do genótipo para fazer a distinção entre G e o alelo A (AA) do polimorfismo TNF-α -308. O ensaio baseado em PCR foi confirmado pela sequenciação genômica direta da região promotora do TNF (dados não apresentados). Todos os casos e controles recrutados foram investigados para detectar a presença desse importante polimorfismo de nucleotídeo único. A distribuição dos genótipos G e A (alelo raro) apresentou distribuição normal, com base no desequilíbrio de Hardy Weinberg, em todas as populações (controles saudáveis e pacientes com sepse/choque séptico), como demonstrado na Tabela 2. Não houve diferença na frequência de AA entre os diferentes grupos, e nenhum paciente do grupo com sepse apresentou homozigosidade de AA. Em uma análise do subgrupo de pacientes com choque séptico, 13 dos 23 indivíduos incluídos no grupo sobreviveram. Novamente, não houve diferença estatística na distribuição dos alelos G e A entre os pacientes que sobreviveram e os que faleceram (dados não apresentados).
Discussão
Este estudo investiga, pela primeira vez no Sudeste Asiático, a associação entre o alelo TNF2 (que abrange uma transição G-308A no promotor do gene TNF-α) e a susceptibilidade à sepse ou ao choque séptico, além da mortalidade relacionada a esses eventos em nossas unidades de terapia intensiva. Cada vez mais se tem evidenciado a variação genética da população humana, e vários polimorfismos genéticos têm sido associados à predisposição e ao desenvolvimento de sepse ou choque séptico e a um pior desfecho23,24. Por exemplo, Nadel et al.25 demonstraram, na população britânica, uma maior frequência do alelo TNF-α -308A em crianças que faleceram em decorrência da doença meningocócica em comparação com as que sobreviveram. Em um estudo realizado por Mira et al.23 na França, foi novamente relatado que a frequência do alelo TNF-α -308A era mais elevada em pacientes adultos com choque séptico se comparados a controles franceses saudáveis. Além disso, entre os pacientes franceses com choque séptico, a frequência do AA também era significativamente mais elevada naqueles que faleceram. Embora haja evidências que aparentemente corroboram esse conceito, vários outros estudos não conseguiram reproduzir tal associação. Em um estudo realizado por Stuber et al.26, não foi observada diferença entre controles saudáveis e adultos internados na unidade de terapia intensiva (UTI) cirúrgica em decorrência de sepse pós-operatória grave ou entre sobreviventes e não sobreviventes (óbitos) no subgrupo de pacientes com sepse grave. O ponto forte desse estudo é que os casos e os controles foram bem pareados quanto à gravidade da doença e eram etnicamente homogêneos. Todos os casos e controles eram caucasianos (alemães) e originários da mesma região geográfica. Além disso, não foi observado aumento no risco de choque séptico ou mortalidade em pacientes pós-operatórios portadores do alelo TNF-α -308A em uma população chinesa adulta de Taiwan, de acordo com o relato de Tang et al.27. Entretanto, no grupo de pacientes com choque séptico, os portadores do alelo TNF-α -308A apresentaram maior taxa de mortalidade do que os pacientes que não eram portadores desse alelo.
No presente artigo, nosso estudo demonstra que não foi encontrada diferença na frequência do alelo TNF2 entre o grupo controle e o grupo dos pacientes com sepse/choque séptico, e que não foi observada associação entre aumento na mortalidade e o alelo TNF2. Além disso, em uma análise do subgrupo de pacientes com choque séptico, não houve diferença na frequência do alelo TNF2 entre os sobreviventes e os não sobreviventes. Em nosso estudo, todos os pacientes e controles saudáveis pertenciam à etnia tailandesa e viviam principalmente em Bangkok e arredores, o que tornou a população do nosso estudo aparentemente homogênea e talvez tenha reduzido o efeito confundidor da miscigenação e da migração populacionais que pode ser evidenciado em outros estudos. Devem ser consideradas várias explicações para os achados negativos deste estudo. Primeiramente, muitas variações genéticas diferentes podem desempenhar funções no desenvolvimento da sepse ou do choque séptico, sendo que algumas delas podem atuar em cis ou em trans no TNF e em outro sistema (ou caminho) para levar ao desenvolvimento da sepse. A magnitude desses possíveis fatores de predisposição ainda não identificados pode ir além do risco genético atribuído ao alelo -308A. Esses outros riscos genéticos podem não ser semelhantes entre diferentes populações e podem afetar significativamente qualquer estudo de associação genética. Em segundo lugar, embora algumas evidências sugiram que o alelo TNF-α -308A tem efeito sobre a produção do TNF-α17,28, outros estudos apresentaram resultados contrários29,30. É possível que o alelo TNF-α -308A, por si só, não tenha influência direta na produção de TNF-α, mas simplesmente atue como um marcador genético vinculado a outro(s) elemento(s) regulador(es) localizado(s) no cromossomo 6 ou a clusters de HLA que podem afetar diretamente a produção de TNF. Essa associação marcador-vínculo pode estar presente em uma etnia devido ao efeito fundador, mas não necessariamente pode ser reproduzida em outras etnias que têm um cromossomo ancestral diferente e que evoluíram por meio da deriva genética e do efeito gargalo. Por fim, a fisiopatologia da sepse ou do choque séptico é um processo complexo e multifatorial; um grande número de fatores afetam essa condição, além do polimorfismo genético, incluindo a virulência dos organismos etiológicos, o intervalo de tempo entre o aparecimento da doença e o início do tratamento, ou o monitoramento e manejo adequados da doença ou de enfermidades subjacentes. Os fatores ambientais presentes na Tailândia, incluindo o tipo e a fonte de patógenos em nosso país (que está localizado nos trópicos), e um manejo clínico apropriado antes do desenvolvimento da sepse e de doenças subjacentes, podem ser diferentes dos observados em outras regiões. Esses fatores certamente confundem a associação genética, se esta existir, quando se tenta comparar e reproduzir os achados de uma população em outra.
Além disso, o estudo também apresenta algumas limitações. A primeira é o fato de que não foi possível obter os níveis de TNF-α neste estudo devido a dificuldades técnicas; portanto, não pudemos demonstrar uma correlação entre diferentes genótipos -308 e a produção de TNF, como demonstrado anteriormente17. A segunda é a população relativamente pequena de pacientes, em especial no grupo com choque séptico, o que pode ter afetado o poder da nossa análise. Por fim, pudemos comparar apenas os casos de sepse e os controles saudáveis; porém, o ideal seria comparar indivíduos que foram expostos ao mesmo tipo e intensidade de patógenos infecciosos mas não desenvolveram sepse clínica/choque séptico. Entretanto, esse tipo de controles parece difícil de ser identificado, o que pode prejudicar a viabilidade do estudo.
Em resumo, este estudo não conseguiu demonstrar uma associação entre o polimorfismo TNF-α -308 e o risco e a gravidade de sepse e choque séptico na população tailandesa. Futuramente, devem ser realizados estudos incluindo uma população maior, com mais polimorfismos ou haplótipos do TNF-α.
Agradecimentos
Gostaríamos de agradecer ao corpo médico e aos enfermeiros das UTIPs do Siriraj Hospital e do Vajira Hospital pela assistência a todos os pacientes incluídos no estudo. Este trabalho foi financiado por uma bolsa de estudos e pesquisa concedida a S.P. pela Faculty of Medicine Siriraj Hospital. M.M. recebe uma bolsa de estudos da Bangkok Metropolitan Administration Medical College. N.C. teve sua dissertação financiada pelo Departamento de Imunologia, Siriraj Hospital. V.V. também recebe bolsa de estudos da National Research University, Tailândia, por meio da Mahidol University.
Artigo submetido em 10.04.12, aceito em 24.05.12.
Apoio financeiro: este trabalho foi financiado por uma bolsa de estudos e pesquisa concedida a Suwannee Phumeetham pela Faculty of Medicine Siriraj Hospital. Nunthawut Chat-uthai teve sua dissertação financiada pelo Departamento de Imunologia, Siriraj Hospital. Manutham Manavathongchai recebe uma bolsa de estudos do Bangkok Metropolitan Administration Medical College. Vip Viprakasit também recebe uma bolsa de estudos da National Research University, Tailândia, através da Mahidol University.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Como citar este artigo: Phumeetham S, Chat-uthai N, Manavathongchai M, Viprakasit V. Genetic association study of tumor necrosis factor-alpha with sepsis and septic shock in Thai pediatric patients. J Pediatr (Rio J). 2012;88(5):417-22.
- 1. Parrillo JE, Parker MM, Natanson C, Suffredini AF, Danner RL, Cunnion RE, et al. Septic shock in humans. Advances in the understanding of pathogenesis, cardiovascular dysfunction, and therapy. Ann Intern Med. 1990;113:227-42.
- 2. Friedman G, Silva E, Vincent JL. Has the mortality of septic shock changed with time. Crit Care Med. 1998;26:2078-86.
- 3. Bone RC, Grodzin CJ, Balk RA. Sepsis: a new hypothesis for pathogenesis of the disease process. Chest. 1997;112:235-43.
- 4. Sřrensen TI, Nielsen GG, Andersen PK, Teasdale TW. Genetic and environmental influences on premature death in adult adoptees. N Engl J Med. 1988;318(12):727-32.
- 5. Bayley JP, Ottenhoff TH, Verweij CL. Is there a future for TNF promoter polymorphisms? Genes Immun. 2004;5:315-29.
- 6. Holmes CL, Russell JA, Walley KR. Genetic polymorphisms in sepsis and septic shock: role in prognosis and potential for therapy. Chest. 2003;124:1103-15.
- 7. Burt RA. Genetics of host response to malaria. Int J Parasitol. 1999;29:973-9.
- 8. Kwiatkowski D. Science, medicine, and the future: susceptibility to infection. BMJ. 2000;321:1061-5.
- 9. Walley KR, Lukacs NW, Standiford TJ, Strieter RM, Kunkel SL. Balance of inflammatory cytokines related to severity and mortality of murine sepsis. Infect Immun. 1996;64:4733-8.
- 10. Beutler B, Grau GE. Tumor necrosis factor in the pathogenesis of infectious diseases. Crit Care Med. 1993;21:S423-35.
- 11. Nedwin GE, Naylor SL, Sakaguchi AY, Smith D, Jarrett-Nedwin J, Pennica D, et al. Human lymphotoxin and tumor necrosis factor genes: structure, homology and chromosomal localization. Nucleic Acids Res. 1985;13:6361-73.
- 12. Wheeler AP, Bernard GR. Treating patients with severe sepsis. N Engl J Med. 1999;340:207-14.
- 13. Michie HR, Manogue KR, Spriggs DR, Revhaug A, O'Dwyer S, Dinarello CA, et al. Detection of circulating tumor necrosis factor after endotoxin administration. N Engl J Med. 1988;318:1481-6.
- 14. Girardin E, Grau GE, Dayer JM, Roux-Lombard P, Lambert PH. Tumor necrosis factor and interleukin-1 in the serum of children with severe infectious purpura. N Engl J Med. 1988;319:397-400.
- 15. Calandra T, Baumgartner JD, Grau GE, Wu MM, Lambert PH, Schellekens J, et al. Prognostic values of tumor necrosis factor/cachectin, interleukin-1, interferon-alpha, and interferon-gamma in the serum of patients with septic shock. Swiss-Dutch J5 Immunoglobulin Study Group. J Infect Dis. 1990;161:982-7.
- 16. Imahara SD, O'Keefe GE. Genetic determinants of the inflammatory response. Curr Opin Crit Care. 2004;10:318-24.
- 17. Louis E, Franchimont D, Piron A, Gevaert Y, Schaaf-Lafontaine N, Roland S, et al. Tumour necrosis factor (TNF) gene polymorphism influences TNF-alpha production in lipopolysaccharide (LPS)-stimulated whole blood cell culture in healthy humans. Clin Exp Immunol. 1998;113:401-6.
- 18. Brinkman BM, Zuijdeest D, Kaijzel EL, Breedveld FC, Verweij CL. Relevance of the tumor necrosis factor alpha (TNF alpha) -308 promoter polymorphism in TNF alpha gene regulation. J Inflamm. 1995-1996;46:32-41.
- 19. Lazarus R, Vercelli D, Palmer LJ, Klimecki WJ, Silverman EK, Richter B, et al. Single nucleotide polymorphisms in innate immunity genes: abundant variation and potential role in complex human disease. Immunol Rev. 2002;190:9-25.
- 20. Goldstein B, Giroir B, Randolph A; International Consensus Conference on Pediatric Sepsis. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med. 2005;6:2-8.
- 21. Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med. 1985;13:818-29.
- 22. Wilson AG, di Giovine FS, Blakemore AI, Duff GW. Single base polymorphism in the human tumour necrosis factor alpha (TNF alpha) gene detectable by NcoI restriction of PCR product. Hum Mol Genet. 1992;1:353.
- 23. Mira JP, Cariou A, Grall F, Delclaux C, Losser MR, Heshmati F, et al. Association of TNF2, a TNF-alpha promoter polymorphism, with septic shock susceptibility and mortality: a multicenter study. JAMA. 1999;282:561-8.
- 24. Stüber F, Petersen M, Bokelmann F, Schade U. A genomic polymorphism within the tumor necrosis factor locus influences plasma tumor necrosis factor-alpha concentrations and outcome of patients with severe sepsis. Crit Care Med. 1996;24:381-4.
- 25. Nadel S, Newport MJ, Booy R, Levin M. Variation in the tumor necrosis factor-alpha gene promoter region may be associated with death from meningococcal disease. J Infect Dis. 1996;174:878-80.
- 26. Stuber F, Udalova IA, Book M, Drutskaya LN, Kuprash DV, Turetskaya RL, et al. -308 tumor necrosis factor (TNF) polymorphism is not associated with survival in severe sepsis and is unrelated to lipopolysaccharide inducibility of the human TNF promoter. J Inflamm. 1995-1996;46:42-50.
- 27. Tang GJ, Huang SL, Yien HW, Chen WS, Chi CW, Wu CW, et al. Tumor necrosis factor gene polymorphism and septic shock in surgical infection. Crit Care Med. 2000;28:2733-6.
- 28. Wilson AG, Symons JA, McDowell TL, McDevitt HO, Duff GW. Effects of a polymorphism in the human tumor necrosis factor alpha promoter on transcriptional activation. Proc Natl Acad Sci U S A. 1997;94:3195-9.
- 29. Huizinga TW, Westendorp RG, Bollen EL, Keijsers V, Brinkman BM, Langermans JA, et al. TNF-alpha promoter polymorphisms, production and susceptibility to multiple sclerosis in different groups of patients. J Neuroimmunol. 1997;72:149-53.
- 30. Mycko M, Kowalski W, Kwinkowski M, Buenafe AC, Szymanska B, Tronczynska E, et al. Multiple sclerosis: the frequency of allelic forms of tumor necrosis factor and lymphotoxin-alpha. J Neuroimmunol. 1998;84:198-206.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
08 Nov 2012 -
Data do Fascículo
Out 2012
Histórico
-
Recebido
10 Abr 2012 -
Aceito
24 Maio 2012