Resumos
OBJETIVO: Descrever a variabilidade genotípica do rotavírus grupo A (RVA) encontrado em pacientes pediátricos imunocompetentes e imunocomprometidos tratados no Hospital de Clínicas/Universidade Federal do Paraná (HC/UFPR), Curitiba, Paraná. MÉTODOS: Foi realizado um estudo transversal com 1.140 amostras de fezes coletadas, de abril de 2001 a dezembro de 2008, em pacientes ambulatoriais e pacientes hospitalizados com gastroenterite aguda encaminhados ao hospital. As técnicas usadas foram o método da aglutinação do látex e imunoensaio enzimático para diagnóstico de RVA. Foi realizada transcrição reversa, seguida por PCR multiplex semi-nested e sequência de nucleotídeos para caracterização do genótipo. Foram relatados dados de combinações de genótipos, clínicos, epidemiológicos, laboratoriais e sobre a presença de infecções hospitalares. RESULTADOS: Foi analisado um total de 80 amostras de fezes positivas para rotavírus. As associações mais frequentes entre os genótipos G e P foram: G4 P[8] (38,9%), G1 P[8] (30,5%), G9 P[8] (13,9%), G2 P[4] (6.9 %) e G3 P[8] 1,4%). O genótipo prevalente foi G2 P[4] depois da implementação da vacina nos anos de 2006 e 2008. Verificou-se que um total de 62,5% das crianças com idade abaixo de 12 meses estavam infectadas. Destas, 55,6% tinham grave desidratação, e 26,7% precisaram de cuidados intensivos. Encontrou-se uma frequência de 12,5% de infecções hospitalares. Não se observou correlação entre o genótipo e a gravidade da infecção nos pacientes estudados. CONCLUSÃO: As infecções por RVA podem associar-se a manifestações clínicas graves e é crucial a vigilância da variabilidade genotípica desse vírus para monitorizar a emergência de novas cepas e o impacto da imunização nesses pacientes.
Gastroenterite; Genótipos; Infecções pediátricas; Rotavírus
OBJECTIVE: To describe the genotypic variability of group A rotavirus (RVA) found in immunosuppressed and non-immunosuppressed pediatric patients treated at the Hospital de Clínicas da Universidade Federal do Paraná (HC-UFPR), Curitiba, Paraná. METHODS: A cross-sectional study was conducted with 1,140 stool samples collected from April, 2001 to December, 2008 in outpatients and hospitalized patients with acute gastroenteritis referred to the hospital. RVA diagnosis was performed through the latex agglutination method and enzyme immunoassay. Reverse transcription followed by multiplex hemi-nested polymerase chain reaction (PCR) and nucleotide sequencing were used for genotype characterization. Genotype combinations, clinical data, epidemiological data, laboratory data, and presence of hospital-acquired infections were reported. RESULTS: A total of 80 rotavirus-positive stool samples were analyzed. The most frequent associations between genotypes G and P were: G4 P[8] (38.9%), G1 P[8] (30.5%), G9 P[8] (13.9%), G2 P[4] (6.9%), and G3 P[8] (1.4%). G2 P[4] was the most prevalent genotype after the vaccine implementation in the years 2006 and 2008. A total of 62.5% of children aged less than 12 months were found to be infected. Of these, 55.6% had severe dehydration and 26.7% needed intensive care. A frequency of 12.5% of nosocomial infections was found. No correlation was observed between genotype and severity of infection in the study patients. CONCLUSION: RVA infections can be associated with severe clinical manifestations, and the surveillance of genotypic variability of this virus is crucial to monitor the emergence of new strains and the impact of the immunization in these patients.
Gastroenteritis; Genotypes; Pediatric infections; Rotavirus
ARTIGO ORIGINAL
Caracterização molecular dos genótipos do rotavírus em pacientes pediátricos imunossuprimidos e não imunossuprimidos
Luciane A. PereiraI; Carla E. O. FerreiraI; Giovana D. TurchettoII; Meri B. NogueiraII; Luine R. VidalII; Cristina R. CruzIII; Maria C. DeburIV; Sergio M. De AlmeidaV; Sonia M. RaboniVI;* * Autor para correspondência. E-mail: sraboni@ufpr.br (S.M. Raboni).
IBióloga, Laboratório de Virologia, Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil
IIBioquímica, Laboratório de Virologia, UFPR, Curitiba, PR, Brasil
IIIProfessora, Departamento de Pediatria, UFPR, Curitiba, PR, Brasil
IVBioquímica, Laboratório de Saúde Pública do Estado, Secretaria Estadual de Saúde do Paraná, Curitiba, PR, Brasil
VMédico, Laboratório de Virologia, UFPR, Curitiba, PR, Brasil
VIProfessora-associada, Laboratório de Virologia e Departamento de Doenças Infecciosas, UFPR, Curitiba, PR, Brasil
RESUMO
OBJETIVO: Descrever a variabilidade genotípica do rotavírus grupo A (RVA) encontrado em pacientes pediátricos imunocompetentes e imunocomprometidos tratados no Hospital de Clínicas/Universidade Federal do Paraná (HC/UFPR), Curitiba, Paraná.
MÉTODOS: Foi realizado um estudo transversal com 1.140 amostras de fezes coletadas, de abril de 2001 a dezembro de 2008, em pacientes ambulatoriais e pacientes hospitalizados com gastroenterite aguda encaminhados ao hospital. As técnicas usadas foram o método da aglutinação do látex e imunoensaio enzimático para diagnóstico de RVA. Foi realizada transcrição reversa, seguida por PCR multiplex semi-nested e sequência de nucleotídeos para caracterização do genótipo. Foram relatados dados de combinações de genótipos, clínicos, epidemiológicos, laboratoriais e sobre a presença de infecções hospitalares.
RESULTADOS: Foi analisado um total de 80 amostras de fezes positivas para rotavírus. As associações mais frequentes entre os genótipos G e P foram: G4 P[8] (38,9%), G1 P[8] (30,5%), G9 P[8] (13,9%), G2 P[4] (6.9 %) e G3 P[8] 1,4%). O genótipo prevalente foi G2 P[4] depois da implementação da vacina nos anos de 2006 e 2008. Verificou-se que um total de 62,5% das crianças com idade abaixo de 12 meses estavam infectadas. Destas, 55,6% tinham grave desidratação, e 26,7% precisaram de cuidados intensivos. Encontrou-se uma frequência de 12,5% de infecções hospitalares. Não se observou correlação entre o genótipo e a gravidade da infecção nos pacientes estudados.
CONCLUSÃO: As infecções por RVA podem associar-se a manifestações clínicas graves e é crucial a vigilância da variabilidade genotípica desse vírus para monitorizar a emergência de novas cepas e o impacto da imunização nesses pacientes.
Palavras-chave: Gastroenterite; Genótipos; Infecções pediátricas; Rotavírus
Introdução
Os rotavírus do grupo A (RVA) são os principais agentes etiológicos da diarreia aguda aquosa em crianças com menos de cinco anos em todo o mundo. Em uma escala global, são responsáveis por aproximadamente 611.000 óbitos por ano em um nível mundial, principalmente em países com baixa renda.1
As infecções por RVA continuam a ser causa importante de hospitalização pediátrica, particularmente nos países em desenvolvimento, onde fatores demográficos e socioeconômicos se associam ao aumento das taxas de mortalidade. A vacinação tem impacto significativo na frequência da doença; todavia, as infecções graves persistem e é preciso considerar a possível emergência de novos genótipos. A diversidade das cepas do rotavírus salienta a necessidade de vigilância intensiva das mesmas e, assim, é crítica a implementação de vigilância laboratorial para prevenir surtos.2
Os rotavírus são classificados em sete grupos principais (A-G), porém, a maioria das infecções se associa ao rotavírus A, apesar de terem sido encontrados os grupos B e C em doença humana. Foram descritos genótipos distintos do RVA (antígeno dos capsídeos externos G e P), sendo G1P[8], G2P[4], G3P[8], G4P[8] e G9P[8] os mais comumente identificados no Brasil e no mundo.3
Vários artigos têm demonstrado a importância desse patógeno como responsável pela hospitalização de crianças com gastroenterite aguda (GEA). No Brasil, achados epidemiológicos sugerem taxas de detecção variando de 12% a 42%.4 O Hospital de Clínicas/Universidade Federal do Paraná (HC-UFPR) é um centro terciário que recebe pacientes encaminhados de toda a Curitiba e da região metropolitana. Análises da causa de todos os casos de gastroenterite internados no HC-UFPR têm mostrado que o RVA é o patógeno mais frequentemente encontrado (20%) na população estudada.5
Em 2006, foram disponibilizadas duas vacinas contra o rotavírus: uma monovalente (Rotarix®, GlaxoSmithKline Biologicals Inc.) e uma pentavalente (RV5; Rota Teq®, Merck & Co., Inc.). Ambas são recomendadas pela OMS e têm sido usadas em diferentes países, que vêm apresentando uma redução significativa da hospitalização e mortalidade devido à gastroenterite pelo rotavírus.6,7
O Brasil foi um dos primeiros países a introduzir a vacinação universal contra o RVA com o Rotarix® (GlaxoSmithKline Biologicals, Inc.), que tem sido distribuído gratuitamente por meio do sistema de saúde público desde março de 2006. A cobertura da vacina, em todo o país, em 2006 e 2007, foi de 60% e 75%, respectivamente.8 No entanto, as regiões Sul e Sudeste tiveram a mais alta cobertura da vacina, e foi possível observar a maior taxa de redução das hospitalizações de crianças por idade.9
Uma análise prévia, realizada em 2009 neste hospital para avaliar o impacto da vacinação contra o RVA, mostrou uma redução de 54,2% e 39,4% das consultas médicas para crianças com menos de 12 meses de idade e entre 12-60 meses, respectivamente. Além disso, houve uma redução de 43,9% e 33,3% para o número de hospitalizações por gastroenterite em crianças abaixo de 12 meses e com 12-60 meses, respectivamente, considerando a cobertura em torno de 80% no período mencionado (dados não publicados). A vigilância epidemiológica da doença diarreica por RVA foi estabelecida no país com a finalidade de monitorizar a diversidade genotípica do RVA circulante, bem como a elevação de cepas de RVA emergentes e re-emergentes.10
Vários estudos envolvendo a variabilidade genética do RVA foram publicados no país, embora a maioria dessas análises tenha sido realizada nas regiões Central e Sudeste, sendo escassas as informações sobre outras regiões. Este estudo tem por objetivo descrever a variabilidade genotípica do RVA durante um período de oito anos, avaliar as características clínicas e epidemiológicas dos pacientes infectados e o impacto do programa de imunização sobre a diversificação genética viral.
Métodos
Amostras e desenho do estudo
Este é um estudo transversal que envolveu o exame de 1.140 amostras de fezes de pacientes ambulatoriais e internados com gastroenterite aguda, sendo encaminhados ao HC/UFPR. Os pacientes foram internados em enfermarias pediátricas ou na unidade de Transplante de Células-Tronco Hematopoiéticas (TCTH). As amostras de fezes foram coletadas de abril de 2001 a dezembro de 2008, enviadas ao Laboratório de Virologia para detecção do RVA e posteriores estudos de genotipagem. Os prontuários dos pacientes infectados foram analisados e dados clínicos foram coletados usando fichas específicas.
Este estudo foi aprovado pela Comissão de Ética de Pesquisa em Seres Humanos do HC/HFPR sob o registro número 4441.023/2002-04.
Critérios para a classificação da gravidade da desidratação
A desidratação foi classificada como leve, moderada ou grave e avaliada em uma escala de desidratação clínica para crianças, como previamente relatado.11
Detecção do antígeno viral
As amostras fecais foram inicialmente testadas para a detecção do antígeno do rotavírus do grupo A por testes de triagem - LA (Kit Virotect Rota - Omega Diagnostics ou Kit Rotascreen-Microgen Bioproducts) e IEE (Kit EIARA-Biomanguinhos ou Rotascreen II - Microgen Bioproducts), de acordo com as instruções do fabricante. Foi analisado o desempenho desses dois métodos e de seus resultados comparativos previamente publicados.12 As amostras positivas foram sequencialmente analisadas por métodos moleculares.
Extração do RNA genômico viral e RT-PCR multiplex semi-nested
O RNA genômico foi extraído usando-se alíquotas de 200 µL de suspensão fecal (10% peso/vol) e filtro de sílica, de acordo com o processo previamente descrito.13 O RNA obtido foi analisado por RT-PCR multiplex semi-nested para definir o genótipo viral através dos métodos previamente relatados.13 Resumidamente, o RNA foi reversamente transcrito e amplificado pelo uso de primers específicos, correspondendo a uma sequência de nucleotídeos conservada de genes VP4 e VP7, fragmentos de 876pb e , respectivamente.13 O fragmento amplificado foi usado como matriz para uma segunda PCR, usando um esquema de tipagem combinado de pool de primers para identificar PV7: pool A (G1, G2, G3, G4 e G5), pool B (G8, G9 e G10) e pool C (G6 e G11); e VP4: pool A [P4], [P6], [P8] e [P9] e genótipos pNCDV [P1]. Os resultados obtidos foram confirmados com primers individuais para o genótipo identificado.
Sequenciamento, montagem e comparação da sequência de nucleotídeos
As amostras que eram positivas na primeira etapa da PCR e que não poderiam ser genotipadas por PCR multiplex nested foram analisadas por sequenciamento de nucleotídeos. Os produtos da PCR foram purificados com a aplicação do Invisorb® Spin PCRapid kit (Invitek Inc., EUA), depois que ambas as fitas do DNA fossem diretamente sequenciadas como descrito no manual do kit Thermo Sequenase (USB Inc., Ohio, EUA). O método BigDyer® Terminator foi usado em ABI 3100 (Applied Biosystems Inc., EUA). Foram usados primers específicos da primeira e da segunda PCR para detectar o RVA.
Foi usado o BioEdit Sequence Alignment Editor para montar os fragmentos na sequência mais provável.14 Um conjunto da sequência de segmentos de VP4 e VP7 foi recuperado do Genbank,15 compreendendo genótipos representativos do RVA. As diferenças dos nucleotídeos foram quantificadas com o uso do software MegaAlignTM (DNASTAR®, Inc., EUA).
Toda a análise molecular e reações de sequenciamento foram realizadas no laboratório de virologia do HC/UFPR.
Análises estatísticas
Foi realizada análise estatística utilizando-se o teste do Qui-quadrado ou o teste exato de Fisher, o que fosse mais apropriado. Os testes foram realizados com o GraphPad Prism versão 5.0 para Windows (GraphPad Software, San Diego, Califórnia, EUA). Foram usados somente testes bicaudais. Um valor p < 0,05 foi considerado estatisticamente significativo.
Resultados
Durante o período de estudo, 179 (179/1.140 - 15,7%) amostras foram positivas para o RVA, 80 (80/179 - 44,7%) das quais tiveram material suficiente para maior análise e foram selecionadas para que fosse realizada a RT-PCR multiplex semi-nested para determinação de genótipos e sequência de nucleotídeos, se necessário. Destas, 72 amostras (72/80 - 90%) eram RT-PCR positivas para RVA, das quais 78% (56/72) eram de pacientes hospitalizados.
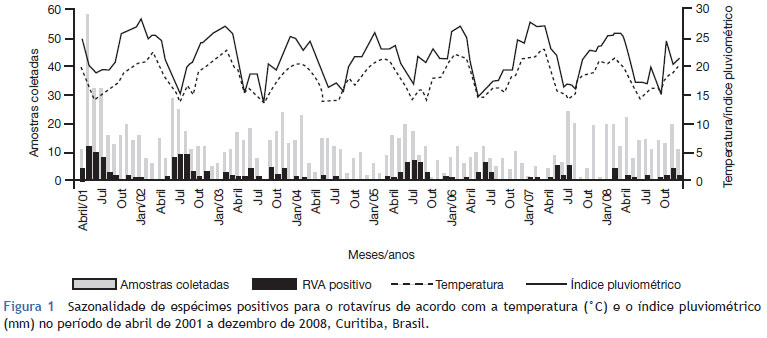
A figura 1 mostra a distribuição do RVA durante o estudo de oito anos e sua relação com a temperatura média mensal (ºC) e a quantidade de precipitação (mm).
Associações G e P
Foram genotipadas 66 (66/72 - 91,6%) amostras. Os genótipos encontrados nas amostras foram G4 P [8] (28/72 - 38,9%), G1 P [8] (22/72 - 30,5%), G9 P [8] (10/72 - 13,9%), G2 P [4] (5/72 - 6,9%) e uma G3 p [8] (01/72 - 1,4%). Não puderam ser sequenciadas seis amostras, provavelmente porque os primers usados não correspondiam ao genótipo investigado e também aquelas amostras apresentavam banda fraca no gel de agarose, diminuindo a qualidade das reações de sequenciamento realizadas. Foram detectadas diferenças na distribuição dos genótipos G e P em anos distintos, refletindo a mudança anual de epidemiologia do rotavírus humano, com uma alternância entre os genótipos a cada um ou dois anos (fig. 2). Não foram detectadas infecções mistas por RVA. Depois da implementação do programa de vacinação, foram encontrados somente os genótipos G2 P [4] e GNT P [8].
Dados demográficos e clínicos
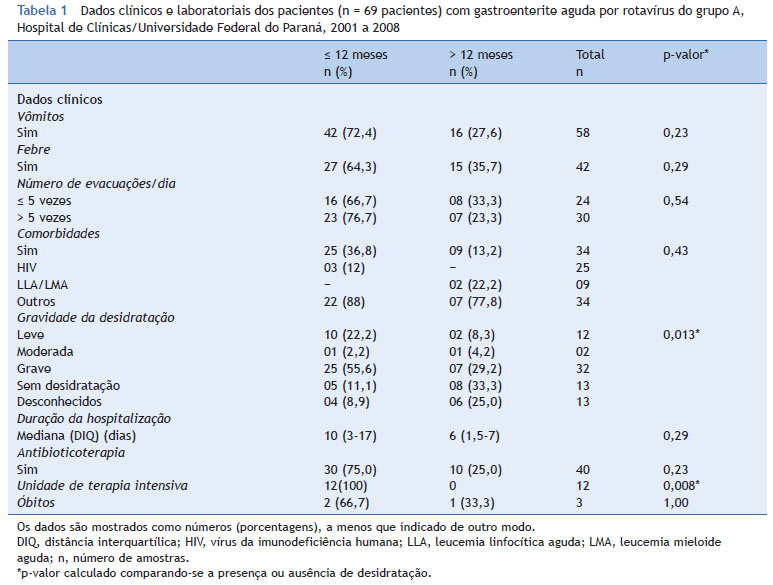
Foi analisado um total de 69 (69/80 - 86,2%) prontuários, 65% dos pacientes eram masculinos e 35%, femininos. A mediana da idade dos pacientes foi de nove meses (DIQ de seis a 16,5 meses), e a maioria dos casos ocorreu em pacientes com idade < 12 meses. Apesar da grande frequência de pacientes com doenças subjacentes, foi internado um total de 51% (37/72) dos pacientes primariamente pela gravidade da diarreia. Com referência ao estado de vacinação dos pacientes internados depois de 2006, somente dois deles relataram imunização prévia contra RVA - um recebeu o esquema completo e o outro somente a primeira dose, sendo ambos não imunossuprimidos.
Para a análise dos dados clínicos e laboratoriais, os pacientes foram divididos em dois grupos, de acordo com a idade: crianças < 12 meses (65%, 45/69) e crianças > 12 meses (35%, 24/69). A comparação quanto à enfermaria clínica mostrou maior frequência de pacientes < 12 meses na unidade de terapia intensiva (UTI) (p = 0,008). No total, 78% das crianças apresentaram desidratação, 78,3% das quais tinham 12 meses ou menos (p = 0,01) (tabela 1). Três (3,7%) crianças evoluíram para óbito, um deles relacionado com gastroenterite. Não foram observadas diferenças estatisticamente significativas na comparação entre o genótipo e a presença de desidratação (p = 0,86).
Group A rotavirus e infecções hospitalares
Foram consideradas infecções hospitalares aquelas que ocorreram 72 horas depois da internação. Do total de 72 pacientes RVA-positivos, 9 (12,5%) crianças tiveram diarreia depois desse período. Delas, quatro foram internadas na emergência pediátrica e cinco em serviços de doenças infecciosas pediátricas. A mediana do tempo de hospitalização foi de sete dias (DIQ de quatro a 12,5 dias) (tabela 2).
Discussão
A introdução da vacina contra o RVA no calendário nacional de imunizações contribuiu para uma redução significativa da frequência dessa infecção na população pediátrica. No entanto, esse patógeno ainda pode ser associado à doença grave e é crucial a vigilância de sua variabilidade genotípica para monitorizar a emergência da circulação de novas cepas nos seres humanos.
A variação dos genótipos G e P observada em diferentes anos destaca os mecanismos usados pelo RVA para escapar à pressão da seleção imune e para manter o patógeno na natureza. A análise de combinações dos tipos de genótipos G e P mostrou que o G1 P [8] foi predominante em 2001 e 2003, semelhantemente aos achados prévios.13 O genótipo G3 P [8] foi identificado somente em uma amostra em 2003. Com referência ao G 4 P [8], sua ocorrência foi detectada em 2001 como o segundo genótipo mais frequente, prevalecendo em 2002, semelhantemente ao que foi relatado no Paraguai.16 O genótipo G9 P [8] foi identificado neste estudo nos anos 2002, 2004 e 2005. De acordo com alguns trabalhos,17 essa espécie agora está circulando mais amplamente. O G2 P [4] reemergiu desde 2006 e tem se tornado predominante nas amostras analisadas neste estudo, bem como em outras partes do Brasil e em outros países.18 No ano de 2007, nenhum RVA foi detectado nas amostras estudadas; entretanto, alguns trabalhos no Brasil mostraram a continuidade da detecção do genótipo G2 P[4] até 2008.19
Esses resultados demonstram a capacidade da variação genética do RVA e destacam a necessidade da constante vigilância dos genótipos circulantes.20 Depois da introdução da vacinação universal no Brasil, foi observada a emergência dos genótipos G2 P[4] e G9 P [8].O impacto dessas infecções precisa ser monitorizado a fim de se avaliar a eficácia das vacinas atualmente disponíveis. Foi relatada a predominância do genótipo G2 (4) em outros países que usam a vacina Rotarix® . Todavia, ainda não se sabe se isso se deve à pressão seletiva ou à mudança da epidemiologia.21 No entanto, pôde ser observado um aumento da frequência do genótipo G2 P[4] em períodos anteriores à implementação da vacina e também em países sem imunização contra o RVA18,22 e, provavelmente, sua circulação se associou à re-remergência natural desse genótipo.3,23
Semelhantemente aos achados prévios, observou-se, neste estudo, uma significativa diminuição da frequência das infecções por RVA na população pediátrica desde a implementação da imunização, e os casos positivos observados referem-se a pacientes com imunização incompleta ou a pacientes imunossuprimidos que podem não desenvolver uma resposta imune completa. Depois de 2006, não foi detectada nenhuma amostra positiva de RVA em pacientes ambulatoriais.
As infecções por RVA são mais comuns no inverno em regiões temperadas e durante o ano todo nas regiões tropicais.24 No presente estudo, foi observado um aumento dos casos positivos em determinados anos, particularmente durante os meses mais frios, em concordância com outros achados.13 No entanto, verificou-se que a frequência da doença variou durante o ano todo, sugerindo que outros fatores, que não o tempo, influenciam na sazonalidade deste patógeno.25 Além disso, em 2008, foi possível observar que a atividade do RVA se propagou durante todo o ano, tendo um pico na primavera, e perdurou por quase cinco meses, em comparação com o período pré-imunização. Provavelmente, há uma população menos suscetível e, consequentemente, o vírus leva mais tempo para se propagar.23
As infecções por RVA foram predominantes em crianças com 0 a 12 meses, de acordo com trabalhos prévios,26 e as manifestações clínicas variaram de intensidade de acordo com a idade e a imunidade do hospedeiro. Relata-se que o quadro clínico clássico das infecções por RVA é com um início abrupto de vômitos, febre e depois diarreia, levando à desidratação.25,27 Vale a pena observar que sete dos 12 pacientes afetados pela infecção por RVA que precisaram de hospitalização foram admitidos na UTI com desidratação grave, não tinham nenhuma doença subjacente e tinham menos de seis meses de idade.
Verificou-se que 47,2% das crianças hospitalizadas tinham desidratação moderada ou grave, o que corrobora a gravidade dessa infecção. No entanto, não se encontrou associação entre a gravidade da doença e o genótipo, demonstrando que outros fatores, principalmente as condições clínicas prévias, podem associar-se à gravidade e intensidade das infecções causadas pelo RVA.28
Ainda vale mencionar a importância do RVA associado a infecções hospitalares/entre crianças. Vários fatores, como idade, estado imune, doença subjacente, intervenções diagnósticas e terapêuticas, estação do ano e duração da hospitalização podem influenciar na aquisição dessas infecções. Além da morbidade, essas infecções causam um grande impacto econômico nos países desenvolvidos e em desenvolvimento.29 A incidência das infecções hospitalares, neste estudo, foi de 12,5%; outros trabalhos encontraram taxas que variam de 8% a 33%.30 Todos os pacientes tinham doenças subjacentes sérias, e essa infecção pode ter contribuído para o aumento da gravidade. Os genótipos encontrados nesses pacientes refletiram o mesmo genótipo circulando na comunidade, o que destaca a importância de medidas para controle das infecções hospitalares para prevenir a propagação do patógeno nesse ambiente.31
Estudos epidemiológicos demonstraram clara correlação entre o período de circulação do RVA e o aumento de internações pediátricas. Embora não exista terapia antiviral específica para o RVA, a identificação de pacientes infectados é importante para prevenir a transmissão hospitalar, compreender o impacto clínico dessas infecções, orientar as medidas terapêuticas para impedir o uso inadequado de antibióticos e indicar a necessidade de imunização específica.
Concluindo, este estudo demonstrou a variabilidade genética do RVA durante um período extensivo de monitorização, a gravidade dessas infecções em pacientes pediátricos e enfatizou a importância da contínua vigilância laboratorial para detectar a emergência de novos genótipos e determinar se é consequência do programa global de imunização e avaliar seu impacto sobre a saúde pediátrica.
Financiamento
Fundação Araucária/Estado do Paraná, Brasil.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Referências
1. Parashar UD, Gibson CJ, Bresee JS, Glass RI. Rotavirus and severe childhood diarrhea. Emerg Infect Dis. 2006;12:304-6.
2. Ramani S, Iturriza-Gomara M, Jana AK, Kuruvilla KA, Gray JJ, Brown DW, et al. Whole genome characterization of reassortant G10P[11] strain (N155) from a neonate with symptomatic rotavirus infection: identification of genes of human and animal rotavirus origin. J Clin Virol. 2009;45:237-44.
3. Carvalho-Costa FA, Volotão E de M, de Assis RM, Fialho AM, de Andrade J da S, Rocha LN, et al. Laboratory-based rotavirus surveillance during the introduction of a vaccination program, Brazil, 2005-2009. Pediatr Infect Dis J. 2011;30:S35-41.
4. Linhares AC. Rotavirus infection in Brazil: epidemiology and challenges for its control. Cad Saude Publica. 2000;16:629-46.
5. Raboni SM, Nogueira MB, Hakim VM, Torrecilha VT, Lerner H, Tsuchiya LR. Comparison of latex agglutination with enzyme immunoassay for detection of rotavirus in fecal specimens. Am J Clin Pathol. 2002;117:392-4.
6. Lopman BA, Payne DC, Tate JE, Patel MM, Cortese MM, Parashar UD. Post-licensure experience with rotavirus vaccination in high and middle income countries; 2006 to 2011. Curr Opin Virol. 2012;2:434-42.
7. Soares-Weiser K, Maclehose H, Bergman H, Ben-Aharon I, Nagpal S, Goldberg E, et al. Vaccines for preventing rotavirus diarrhoea: vaccines in use. Cochrane Database Syst Rev. 2012;2: CD008521.
8. Brasil. Ministério da Saúde. Saúde Brasil 2008: 20 anos do Sistema Único de Saúde (SUS) no Brasil. Brasília: Ministério da Saúde; 2009. 416p.
9. Lanzieri TM, Costa I, Shafi FA, Cunha MH, Ortega-Barria E, Linhares AC, et al. Trends in hospitalizations from all-cause gastroenteritis in children younger than 5 years of age in Brazil before and after human rotavirus vaccine introduction, 1998-2007. Pediatr Infect Dis J. 2010;29:673-5.
10. Santos N, Hoshino Y. Global distribution of rotavirus serotypes/genotypes and its implication for the development and implementation of an effective rotavirus vaccine. Rev Med Virol. 2005;15:29-56.
11. Gorelick MH, Shaw KN, Murphy KO. Validity and reliability of clinical signs in the diagnosis of dehydration in children. Pediatrics. 1997;99:E6.
12. Pereira LA, Raboni SM, Nogueira MB, Vidal LR, Almeida SM, Debur MC, et al. Rotavirus infection in a tertiary hospital: laboratory diagnosis and impact of immunization on pediatric hospitalization. Braz J Infect Dis. 2011;15:215-9.
13. Santos JS, Alfieri AF, Leite JP, Skraba I, Alfieri AA. Molecular epidemiology of the human group A rotavirus in the Paraná State, Brazil. Braz Arch Biol Technol. 2008;51:287-94.
14. Hall TA. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucl Acids Symp Ser. 1999;41:95-8.
15. National Center for Biotechnology Information [Internet]. Bethesda (MD): U.S. National Library of Medicine [acessado em 27 Nov 2011]. GenBank. Disponível em: http://www.ncbi.nlm.nih.gov/
16. Coluchi N, Munford V, Manzur J, Vazquez C, Escobar M, Weber E, et al. Detection, subgroup specificity, and genotype diversity of rotavirus strains in children with acute diarrhea in Paraguay. J Clin Microbiol. 2002;40:1709-14.
17. Carmona RC, Timenetsky M do C, Morillo SG, Richtzenhain LJ. Human rotavirus serotype G9, São Paulo, Brazil, 1996-2003. Emerg Infect Dis. 2006;12:963-8.
18. Ferrera A, Quan D, Espinoza F. Increased prevalence of genotype G2P(4) among children with rotavirus-associated gastroenteritis in Honduras. 17th European Congress of Clinical Microbiology and Infectious Diseases ICC; 2007 Mar 31-Apr 04; Munich. Hoboken (NJ): Wiley-Blackwell; 2007.
19. Cilli A, Luchs A, Morillo SG, Costa FF, Carmona R de C, Timenetsky M do C. Characterization of rotavirus and norovirus strains: a 6-year study (2004-2009). J Pediatr (Rio J). 2011;87:445-9.
20. Carvalho-Costa FA, Assis RM, Fialho AM, Bóia MN, Alves DP, Martins CM, et al. Detection and molecular characterization of group A rotavirus from hospitalized children in Rio de Janeiro, Brazil, 2004. Mem Inst Oswaldo Cruz. 2006;101:291-4.
21. Kirkwood CD, Boniface K, Barnes GL, Bishop RF. Distribution of rotavirus genotypes after introduction of rotavirus vaccines, Rotarix® and RotaTeq®, into the National Immunization Program of Australia. Pediatr Infect Dis J. 2011;30:S48-53.
22. Patel MM, de Oliveira LH, Bispo AM, Gentsch J, Parashar UD. Rotavirus P[4]G2 in a vaccinated population, Brazil. Emerg Infect Dis. 2008;14:863-5.
23. Sáfadi MA, Berezin EN, Munford V, Almeida FJ, de Moraes JC, Pinheiro CF, et al. Hospital-based surveillance to evaluate the impact of rotavirus vaccination in São Paulo, Brazil. Pediatr Infect Dis J. 2010;29:1019-22.
24. Kane EM, Turcios RM, Arvay ML, Garcia S, Bresee JS, Glass RI. The epidemiology of rotavirus diarrhea in Latin America. Anticipating rotavirus vaccines. Rev Panam Salud Publica. 2004;16:371-7.
25. Nunes AA, de Mello LM, Parrode RN, Bittar JP, Domingues AL. Prevalence of rotavirus in acute diarrhea and its association with clinical signs and symptoms. J Trop Pediatr. 2010;56:
212-3.
26. Andreasi MS, Batista SM, Tozetti IA, Ozaki CO, Nogueira MM, Fiaccadori FS, et al. Rotavirus A among hospitalized infants, up to three years of age, with acute gastroenteritis in Campo Grande, State of Mato Grosso do Sul. Rev Soc Bras Med Trop. 2007;40:411-4.
27. Silva ML, Souza JR, Melo MM. Rotavirus prevalence in infants and children in the public healthcare system of the state of Pernambuco. Rev Soc Bras Med Trop. 2010;43:548-51.
28. Aupiais C, de Rougemont A, Menager C, Vallet C, Brasme JF, Kaplon J, et al. Severity of acute gastroenteritis in infants infected by G1 or G9 rotaviruses. J Clin Virol. 2009;46:
282-5.
29. Harrington M, Butler K, Cafferkey M. Rotavirus infection in hospitalised children: incidence and impact on healthcare resources. Ir J Med Sci. 2003;172:33-6.
30. Gianino P, Mastretta E, Longo P, Laccisaglia A, Sartore M, Russo R, et al. Incidence of nosocomial rotavirus infections, symptomatic and asymptomatic, in breast-fed and non-breast-fed infants. J Hosp Infect. 2002;50:13-7.
31. Gleizes O, Desselberger U, Tatochenko V, Rodrigo C, Salman N, Mezner Z, et al. Nosocomial rotavirus infection in European countries: a review of the epidemiology, severity and economic burden of hospital-acquired rotavirus disease. Pediatr Infect Dis J. 2006;25:S12-21
Recebido em 18 de abril de 2012; aceito em 21 de novembro de 2012
- 1. Parashar UD, Gibson CJ, Bresee JS, Glass RI. Rotavirus and severe childhood diarrhea. Emerg Infect Dis. 2006;12:304-6.
- 2. Ramani S, Iturriza-Gomara M, Jana AK, Kuruvilla KA, Gray JJ, Brown DW, et al. Whole genome characterization of reassortant G10P[11] strain (N155) from a neonate with symptomatic rotavirus infection: identification of genes of human and animal rotavirus origin. J Clin Virol. 2009;45:237-44.
- 3. Carvalho-Costa FA, Volotão E de M, de Assis RM, Fialho AM, de Andrade J da S, Rocha LN, et al. Laboratory-based rotavirus surveillance during the introduction of a vaccination program, Brazil, 2005-2009. Pediatr Infect Dis J. 2011;30:S35-41.
- 4. Linhares AC. Rotavirus infection in Brazil: epidemiology and challenges for its control. Cad Saude Publica. 2000;16:629-46.
- 5. Raboni SM, Nogueira MB, Hakim VM, Torrecilha VT, Lerner H, Tsuchiya LR. Comparison of latex agglutination with enzyme immunoassay for detection of rotavirus in fecal specimens. Am J Clin Pathol. 2002;117:392-4.
- 6. Lopman BA, Payne DC, Tate JE, Patel MM, Cortese MM, Parashar UD. Post-licensure experience with rotavirus vaccination in high and middle income countries; 2006 to 2011. Curr Opin Virol. 2012;2:434-42.
- 7. Soares-Weiser K, Maclehose H, Bergman H, Ben-Aharon I, Nagpal S, Goldberg E, et al. Vaccines for preventing rotavirus diarrhoea: vaccines in use. Cochrane Database Syst Rev. 2012;2: CD008521.
- 8. Brasil. Ministério da Saúde. Saúde Brasil 2008: 20 anos do Sistema Único de Saúde (SUS) no Brasil. Brasília: Ministério da Saúde; 2009. 416p.
- 9. Lanzieri TM, Costa I, Shafi FA, Cunha MH, Ortega-Barria E, Linhares AC, et al. Trends in hospitalizations from all-cause gastroenteritis in children younger than 5 years of age in Brazil before and after human rotavirus vaccine introduction, 1998-2007. Pediatr Infect Dis J. 2010;29:673-5.
- 10. Santos N, Hoshino Y. Global distribution of rotavirus serotypes/genotypes and its implication for the development and implementation of an effective rotavirus vaccine. Rev Med Virol. 2005;15:29-56.
- 11. Gorelick MH, Shaw KN, Murphy KO. Validity and reliability of clinical signs in the diagnosis of dehydration in children. Pediatrics. 1997;99:E6.
- 12. Pereira LA, Raboni SM, Nogueira MB, Vidal LR, Almeida SM, Debur MC, et al. Rotavirus infection in a tertiary hospital: laboratory diagnosis and impact of immunization on pediatric hospitalization. Braz J Infect Dis. 2011;15:215-9.
- 13. Santos JS, Alfieri AF, Leite JP, Skraba I, Alfieri AA. Molecular epidemiology of the human group A rotavirus in the Paraná State, Brazil. Braz Arch Biol Technol. 2008;51:287-94.
- 14. Hall TA. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucl Acids Symp Ser. 1999;41:95-8.
-
15National Center for Biotechnology Information [Internet]. Bethesda (MD): U.S. National Library of Medicine [acessado em 27 Nov 2011]. GenBank. Disponível em: http://www.ncbi.nlm.nih.gov/
» link - 16. Coluchi N, Munford V, Manzur J, Vazquez C, Escobar M, Weber E, et al. Detection, subgroup specificity, and genotype diversity of rotavirus strains in children with acute diarrhea in Paraguay. J Clin Microbiol. 2002;40:1709-14.
- 17. Carmona RC, Timenetsky M do C, Morillo SG, Richtzenhain LJ. Human rotavirus serotype G9, São Paulo, Brazil, 1996-2003. Emerg Infect Dis. 2006;12:963-8.
- 18. Ferrera A, Quan D, Espinoza F. Increased prevalence of genotype G2P(4) among children with rotavirus-associated gastroenteritis in Honduras. 17th European Congress of Clinical Microbiology and Infectious Diseases ICC; 2007 Mar 31-Apr 04; Munich. Hoboken (NJ): Wiley-Blackwell; 2007.
- 19. Cilli A, Luchs A, Morillo SG, Costa FF, Carmona R de C, Timenetsky M do C. Characterization of rotavirus and norovirus strains: a 6-year study (2004-2009). J Pediatr (Rio J). 2011;87:445-9.
- 20. Carvalho-Costa FA, Assis RM, Fialho AM, Bóia MN, Alves DP, Martins CM, et al. Detection and molecular characterization of group A rotavirus from hospitalized children in Rio de Janeiro, Brazil, 2004. Mem Inst Oswaldo Cruz. 2006;101:291-4.
- 22. Patel MM, de Oliveira LH, Bispo AM, Gentsch J, Parashar UD. Rotavirus P[4]G2 in a vaccinated population, Brazil. Emerg Infect Dis. 2008;14:863-5.
- 23. Sáfadi MA, Berezin EN, Munford V, Almeida FJ, de Moraes JC, Pinheiro CF, et al. Hospital-based surveillance to evaluate the impact of rotavirus vaccination in São Paulo, Brazil. Pediatr Infect Dis J. 2010;29:1019-22.
- 24. Kane EM, Turcios RM, Arvay ML, Garcia S, Bresee JS, Glass RI. The epidemiology of rotavirus diarrhea in Latin America. Anticipating rotavirus vaccines. Rev Panam Salud Publica. 2004;16:371-7.
- 26. Andreasi MS, Batista SM, Tozetti IA, Ozaki CO, Nogueira MM, Fiaccadori FS, et al. Rotavirus A among hospitalized infants, up to three years of age, with acute gastroenteritis in Campo Grande, State of Mato Grosso do Sul. Rev Soc Bras Med Trop. 2007;40:411-4.
- 27. Silva ML, Souza JR, Melo MM. Rotavirus prevalence in infants and children in the public healthcare system of the state of Pernambuco. Rev Soc Bras Med Trop. 2010;43:548-51.
- 29. Harrington M, Butler K, Cafferkey M. Rotavirus infection in hospitalised children: incidence and impact on healthcare resources. Ir J Med Sci. 2003;172:33-6.
- 30. Gianino P, Mastretta E, Longo P, Laccisaglia A, Sartore M, Russo R, et al. Incidence of nosocomial rotavirus infections, symptomatic and asymptomatic, in breast-fed and non-breast-fed infants. J Hosp Infect. 2002;50:13-7.
- 31. Gleizes O, Desselberger U, Tatochenko V, Rodrigo C, Salman N, Mezner Z, et al. Nosocomial rotavirus infection in European countries: a review of the epidemiology, severity and economic burden of hospital-acquired rotavirus disease. Pediatr Infect Dis J. 2006;25:S12-21
Datas de Publicação
-
Publicação nesta coleção
03 Jul 2013 -
Data do Fascículo
Jun 2013
Histórico
-
Recebido
18 Abr 2012 -
Aceito
21 Nov 2012