Resúmenes
Agalychnis spurrelli Boulenger, 1913 es el nombre válido más reciente para una especie hylida de rana Phyllomedusina que habita los bosques tropicales de tierras bajas y premontanos del Pacífico, desde el sur de Costa Rica hasta el centro-occidente de Ecuador. Presento datos que apoyan la ubicación de Agalychnis litodryas Duellman & Trueb, 1967 como un sinónimo junior de A. spurrelli. Agalychnis spurrelli es una rana medianamente grande con extensas membranas interdigitales que se distingue de otras especies del género Agalychnis por tener los flancos y extremidades uniformemente amarillo, anaranjado, rosado pálido o morado pálido, sin barras oscuras. Su dorso es verde, comúnmente con verrugas pustulares bordeadas de negro.
Anura; Agalychnis spurrelli; identificación, ecología; estado de conservación; Ecuador
Agalychnis spurrelli Boulenger, 1913 is the earliest available name for a hylid species of Phyllomedusin frogs that inhabit the lowland and pre-montane tropical forests on the Pacific coast, from southern Costa Rica to central-western Ecuador. I present data that support the placement of Agalychnis litodryas Duellman & Trueb, 1967 as a junior synonym of A. spurrelli. Agalychnis spurrelli is a medium-large sized frog with extensive interdigital membrane that is distinguished from other species of the genus Agalychnis by having the flanks and limbs uniformly yellow, orange, pale rose or pale purple, without dark stripes. The dorsum is green, usually with black-bordered pustular white warts.
Anura; Agalychnis spurrelli; identification; ecology; conservation status; Ecuador
Agalychnis spurrelli Boulenger (Anura, Hylidae): variación, distribución y sinonimia
H. Mauricio Ortega-AndradeI, II
IMuseo Ecuatoriano de Ciencias Naturales, Sección Vertebrados, División de Herpetología, Rumipamba 341 y Av. De los Shyris, Quito
IIFundación EcoCiencia, Francisco Salazar E14-34 y Coruña, Quito, Ecuador. Autor para correspondencia: biomauro_rtg@yahoo.com
RESUMEN
Agalychnis spurrelli Boulenger, 1913 es el nombre válido más reciente para una especie hylida de rana Phyllomedusina que habita los bosques tropicales de tierras bajas y premontanos del Pacífico, desde el sur de Costa Rica hasta el centro-occidente de Ecuador. Presento datos que apoyan la ubicación de Agalychnis litodryas Duellman & Trueb, 1967 como un sinónimo junior de A. spurrelli. Agalychnis spurrelli es una rana medianamente grande con extensas membranas interdigitales que se distingue de otras especies del género Agalychnis por tener los flancos y extremidades uniformemente amarillo, anaranjado, rosado pálido o morado pálido, sin barras oscuras. Su dorso es verde, comúnmente con verrugas pustulares bordeadas de negro.
Palabras-clave: Anura, Agalychnis spurrelli, identificación, ecología, estado de conservación, Ecuador.
ABSTRACT
Agalychnis spurrelli Boulenger, 1913 is the earliest available name for a hylid species of Phyllomedusin frogs that inhabit the lowland and pre-montane tropical forests on the Pacific coast, from southern Costa Rica to central-western Ecuador. I present data that support the placement of Agalychnis litodryas Duellman & Trueb, 1967 as a junior synonym of A. spurrelli. Agalychnis spurrelli is a medium-large sized frog with extensive interdigital membrane that is distinguished from other species of the genus Agalychnis by having the flanks and limbs uniformly yellow, orange, pale rose or pale purple, without dark stripes. The dorsum is green, usually with black-bordered pustular white warts.
Keywords: Anura, Agalychnis spurrelli, identification, ecology, conservation status, Ecuador.
INTRODUCCIÓN
El género Agalychnis Cope, 1864 incluye especies de tamaño mediano a grande distribuidas en el Neotrópico desde el sureste de México a través de Centroamérica y la vertiente del Pacífico de Colombia hasta los bosques tropicales del noroccidente de Ecuador (Frost et al. 2006). Se caracterizan por presentar la pupila vertical, el iris rojo o rojo oscuro (excepto A. annae que lo tiene amarillo), el dorso verde, los flancos coloreados y con barras contrastantes en algunas especies, el vientre blanco, amarillo o anaranjado y membranas extensas entre los dedos de las manos y pies (Faivovich et al. 2005). Está compuesto por las especies Agalychnis annae Duellman, 1963; A. callidryas Cope, 1862; A. litodryas Duellman & Trueb, 1967; A. moreletii Duméril, 1853; A. saltator Taylor, 1955 y A. spurrelli Boulenger, 1913 (Faivovich et al., 2005; Frost et al., 2006). En 1967 se describió Phyllomedusa (= Agalychnis) litodryas en base a un espécimen macho (KU 96149) proveniente de la localidad de Río Mono, Provincia de Darién, en el Chocó de Panamá (Duellman & Trueb 1967). La especie fue posteriormente reportada para cinco localidades en el noroccidente de Ecuador (Duellman 2001a, Coloma et al. 2006). Agalychnis litodryas fue descrita como una especie sin pigmentos brillantes en los flancos, manos, pies y superficies anteriores y posteriores de los brazos y piernas, además de presentar el dorso verde uniforme sin verrugas bordeadas de negro excepto en un espécimen de la Estación Biológica Río Palenque, Ecuador (Duellman & Trueb 1967, Duellman 2001a, 2001b).
Duellman (2001a:124,130) menciona que A. litodryas es muy similar a A. spurrelli en sus formas estructurales, considerándolas filogenéticamente como especies hermanas de acuerdo al análisis de su morfología y sitios de ovoposición, pero diferenciándose esta última por presentar los flancos, manos, pies, barbilla y piernas amarillo brillantes, verrugas blancas bordeadas de negro en el dorso, un hocico ligeramente más alto y con menor proyección hacia adelante y un mayor número de tubérculos supernumerarios (Duellman 2001a). Adicionalmente, Duellman (2001b:842) provee datos morfométricos de especímenes provenientes de Ecuador de Agalychnis spurrelli donde menciona que esta especie puede carecer de las verrugas blancas bordeadas de negro en el dorso. Revisiones de individuos colectados en Pedro Vicente Maldonado (Ecuador) y fotografías en vivo de ese material revelan que los especímenes reportados como A. spurrelli (Duellman 2001b:842) presentaban sus flancos rosado pálido y verrugas bordeadas de negro en el dorso.
Nuevo material obtenido durante las dos últimas décadas, proveniente de series de especímenes colectados en el occidente de Colombia y Ecuador, además de la revisión de la descripción de los holotipos y sus fotografías proveen material base para proponer que Agalychnis litodryas Duellman y Trueb es un sinónimo junior de Agalychnis spurrelli Boulenger.
MATERIALES Y MÉTODOS
Se revisaron 176 especímenes (Apéndice 1Apéndice 1) asignados a los géneros Agalychnis y Cruziohyla provenientes del occidente de Ecuador y Colombia depositados en el Museo Ecuatoriano de Ciencias Naturales, Quito (DHMECN); Museo de Zoología de la Pontificia Universidad Católica del Ecuador, Quito (QCAZ); Fundación Herpetológica Gustavo Orcés, Quito (FHGO) e Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, Bogotá (ICN). Además se examinaron fotografías de alta definición del holotipo de A. litodryas depositado en el Museum of Natural History of the University of Kansas, Lawrence (KU). Las grabaciones de los cantos fueron realizadas mediante el uso de una grabadora Sony microcassette-corder M-670V y el análisis de sonogramas fue realizado con el programa Adobe Audition®, estudiando los parámetros bioacústicos sugeridos por Angulo (2006). Las observaciones en el laboratorio fueron realizadas con un estereoscopio y las medidas de los especímenes estudiados fueron tomadas con un calibrador de escala graduada metálica a 0.05 mm de precisión. La combinación de caracteres en la diagnosis, proporciones morfométricas y los términos siguen lo referido por Duellman (1974) y Duellman & Trueb (1967), mientras que la terminología de membranas sigue la propuesta por Savage & Heyer (1967) modificado por Myers & Duellman (1982). El sexo fue determinado directamente por examen de gónadas y por la presencia de callos nupciales en los pulgares de los machos adultos. Las siguientes medidas fueron tomadas al menos tres veces cada una (abreviaturas siguen estándares derivados del inglés): longitud rostro-cloaca (SVL), ancho de la cabeza (HW); largo de la cabeza (HL); distancia ojo-narina (EN); diámetro del ojo (ED); distancia inter-orbital (IOD); diámetro horizontal del tímpano (TD); longitud de la tibia (TL) y longitud del pie (FL). Se sigue la clasificación propuesta por Cerón et al. (1999) para las formaciones vegetales de Ecuador. Las coordenadas geográficas y la elevación de las localidades de colección fueron obtenidas de los registros de museos, notas de campo del autor y revisadas en base al mapa digital de la República del Ecuador (IGM 2008) y al mapa digital de Colombia (IIRBAVH 2007). Se usa los criterios sugeridos por la UICN (2001) para evaluar el estado de conservación de Agalychnis spurrelli.
RESULTADOS
Agalychnis spurrelli Boulenger
Agalychnis spurrelli, Boulenger, 1913:1024. Holotipo: B.M.N.H. 1947.2.24.24 y 25 (dos sintipos) de Peña Lisa, Condoto, Provincia de Chocó, Colombia.
Phyllomedusa spurrelli, Funkhouser, 1957, Occasional Papers of the Natural History Museum of Stanford University, 5:39.
Phyllomedusa litodryas Duellman & Trueb, 1967:125. Holotipo: KU 96149, 1 km oeste-suroeste de la unión del Río Mono y el Río Tuira, Provincia de Darién, Panamá, 130 m, nuevo sinónimo.
Agalychnis litodryas, Duellman, 1968, Univ. Kansas Publ. Mus. Nat. Hist., 18:4.
Diagnosis
Agalychnis spurrelli es una especie de tamaño mediano a grande, con extensas membranas entre sus dedos. Se diferencia de las otras especies de Agalychnis por presentar los flancos y extremidades de color amarillo, anaranjado, rosado pálido o morado pálido, carente de barras oscuras contrastantes y presentando comúnmente verrugas pustulares bordeadas de negro en el dorso. (Fig. 1).
Descripción
Especie mediana a grande con los siguientes caracteres: (1) rostro acuminado o sub-acuminado en vista dorsal, proyectado en perfil; (2) glándulas parotoideas indistintas; (3) piel del dorso ligeramente rugosa o lisa, granular hacia la región escapular, superficies ventrales de extremidades, zonas gular y torácica lisas, región abdominal y superficie ventral de la cloaca aeroladas; (4) Dedo manual I más corto que el II; (5) Dedo pedial I más corto que el II; (6) discos grandes, todos mayores al tímpano; (7) antebrazo más robusto que el brazo; (8) pliegue dérmico pequeño en el talón; (9) apertura cloacal dirigida postero-ventralmente entre los muslos; (10) coloración en vida de las superficies dorsales del cuerpo y extremidades verde claro a oscuro, con o sin la presencia de verrugas pustulares blancas bordeadas de negro; (11) superficies ocultas de los flancos pigmentadas desde anaranjado brillante, amarillo, rosado pálido hasta morado pálido; (12) superficies anteriores y posteriores de las extremidades coloreadas igual que los flancos; (13) gula y pecho blancos, vientre blanco; (14) pliegues dérmicos en los antebrazos, tarsos y labio inferior blancos; (15) iris rojo carmesí oscuro con delgadas reticulaciones negras, pupila vertical; (16) membrana nictitante con reticulaciones doradas; (17) SVL en machos 47.0-75.6 mm (x = 65.90 ± 6.3 mm, n = 30) y en hembras 62.0-92.8 mm (x = 76.4 ± 9.8 mm, n = 22).
Adultos moderadamente grandes; longitud rostro-cloaca desde 47.0 hasta 75.6 mm (x = 64.0 mm, n = 30) en machos; desde 62.0 hasta 92.8 mm (x = 77.9 mm, n = 20) en hembras; cabeza más ancha que el cuerpo; anchura cefálica entre 28.8 y 38.3 por ciento (x = 31.5, n = 39) de la longitud rostro-cloaca. Rostro alargado, acuminado o sub-acuminado en vista dorsal, proyectado de manera inclinada desde las narinas hacia el extremo del rostro en vista de perfil. Narinas protuberantes, sobresalidas lateralmente a un tercio de la distancia ente el extremo del rostro y el ojo. El canto rostral es redondo y conspicuo; región loreal cóncava; labios delgados y moderadamente acampanados. Ojos grandes, protuberantes, sobresalientes del rostro, dirigidos antero-lateralmente, entre 16.1 y 38.1 por ciento (x = 25.3, n = 39) de la longitud cefálica; pupila elíptica vertical. Un delgado pliegue dérmico se extiende desde la parte posterior de la órbita ocular, cubre el borde superior y posterior del tímpano, se dirige hacia el ángulo posterior de la mandíbula y termina en la inserción posterior del brazo. Tímpano conspicuo, postero-ventral en relación al ojo, anillo visible y grueso en su parte ventral, diámetro del tímpano entre 42.9 y 83.3 por ciento (x = 58.7, n = 39) del diámetro del ojo, separado del ojo por una distancia menor a un tercio del diámetro del tímpano.
El brazo es delgado, antebrazo robusto; pliegue ulnar delgado, se extiende desde el codo a través del borde externo del antebrazo y borde externo del cuarto dedo, hasta el disco. Discos grandes, todos de mayor diámetro en relación al tímpano. Tubérculo distal subarticular del dedo V grande y redondo, tubérculos subarticulares en los otros dedos son cónicos de tamaño medianos a pequeños. El prepóllex es alargado, aplanado y ventralmente elíptico; las excrecencias nupciales son oscuras, grandes, córneas, y no espinosas, pueden llegar hasta el tubérculo tenar, desde la base del Dedo II cubriendo toda la región dorsal del prepóllex. Todos los dedos presentan membranas en alrededor de dos tercios cubiertos por éstas, fórmula de las membranas entre los dedos I 2-2 II 1-2 III 1-2½ IV; dedo I<II<III<IV, discos anchos, elípticos redondeados; flecos laterales extensos; tubérculos supernumerarios inconspicuos, tubérculo palmar ausente, tubérculo tenar agrandado, elíptico. Extremidades posteriores delgadas; longitud de la tibia entre 35.6 y 66.0 por ciento ( = 51.5, n = 39) de la longitud rostro-cloaca. Pliegues dérmicos suaves a través de la superficies internas y externas de la tibia; pequeño pliegue dérmico atraviesa postero-ventralmente todo el talón; pliegue tarsal fuerte, se extiende a través de toda la longitud del tarso. Tubérculos tarsales ausentes; tubérculo metatarsal interno conspicuo, largo y elíptico; tubérculo metatarsal externo pequeño, visible, redondeado. Dedos moderadamente alargados y delgados, totalmente cubiertos por membranas; fórmula de las membranas entre los dedos I(2)1-2(1½)II1-2III1-2IV2-1V; discos grandes y redondeados; todos los tubérculos subarticulares son grandes y redondeados; tubérculos supernumerarios plantares inconspicuos, escasos, pequeños (KU 96149, ICN 28017, DHMECN 2682-2687, QCAZ 3755-3758, 3845, 4391-4394, 5545, 7222, 23367, 26072, 27284-27286) o conspicuos, numerosos y agrandados (QCAZ 1529, DHMECN 2681, ICN 10828-10829, 13238-13240, 28015-28016, 52031-52034) localizados comúnmente próximos a los dedos III-V (Fig. 3).
= 51.5, n = 39) de la longitud rostro-cloaca. Pliegues dérmicos suaves a través de la superficies internas y externas de la tibia; pequeño pliegue dérmico atraviesa postero-ventralmente todo el talón; pliegue tarsal fuerte, se extiende a través de toda la longitud del tarso. Tubérculos tarsales ausentes; tubérculo metatarsal interno conspicuo, largo y elíptico; tubérculo metatarsal externo pequeño, visible, redondeado. Dedos moderadamente alargados y delgados, totalmente cubiertos por membranas; fórmula de las membranas entre los dedos I(2)1-2(1½)II1-2III1-2IV2-1V; discos grandes y redondeados; todos los tubérculos subarticulares son grandes y redondeados; tubérculos supernumerarios plantares inconspicuos, escasos, pequeños (KU 96149, ICN 28017, DHMECN 2682-2687, QCAZ 3755-3758, 3845, 4391-4394, 5545, 7222, 23367, 26072, 27284-27286) o conspicuos, numerosos y agrandados (QCAZ 1529, DHMECN 2681, ICN 10828-10829, 13238-13240, 28015-28016, 52031-52034) localizados comúnmente próximos a los dedos III-V (Fig. 3).
Abertura de la cloaca transversal, dirigida ventralmente hacia abajo entre las piernas; infundíbulo cloacal largo; superficie dorsal de la abertura cloacal cubierta por tubérculos irregulares cónicos, superficie ventral con tubérculos granulares que forman una fila distintiva en el borde postero-ventral de las piernas. Piel del dorso y superficies dorsales de las extremidades rugosas; garganta, pecho, y superficies ventrales de las extremidades lisa, excepto en las piernas; vientre y superficies ventrales de las piernas moderadamente granular. Lengua ligeramente más larga que ancha, formando un ángulo hacia el extremo anterior; libre en un tercio anterior de su extensión, adherida posteriormente. Coanas ovoides; procesos dentígeros del prevomer transversos y cortos, localizados en los márgenes anteriores de las coanas; ocho a diez dientes presentes en cada proceso. Saco vocal simple, medio, subgular y poco visible.
Color en vivo (Fig. 1)
Los adultos presentan tonos verdes en el dorso, comúnmente con verrugas blancas bordeadas de negro y los flancos anaranjados, amarillos, rosado pálido o morado pálido. Las superficies dorsales de la cabeza, cuerpo, extremidades, los dedos IV y V de la mano y los dedos IV y V del pie presentan tonalidades desde verde claro a oscuro. Los bordes externos del tarso y talón presentan un pliegue fuerte de color blanco amarillento. Un pliegue blanco amarillento se extiende a través del borde externo del antebrazo y del dedo cuarto manual. Los flancos, membranas, dedos II y III manuales, dedos I, II y III del pie, superficies anteriores y posteriores de las piernas, superficies internas del tarso, brazo y antebrazo, presentan coloraciones desde rosado pálido hasta morado pálido. Superficies del vientre, pecho, garganta, labio inferior e inserciones de los brazos y piernas, generalmente blanco o crema. El iris es rojo oscuro con finas reticulaciones negras; membrana nictitante reticulada de dorado. Las excrecencias nupciales son café oscuro o gris oscuro. Los adultos pueden presentar un gradiente cromático desde verde claro a verde oscuro. La coloración general del dorso en juveniles metamórficos (< 34.5 mm SVL, n = 244) se presenta desde verde pálido, café oscuro o rojizo, normalmente con manchas crema bordeadas de café rojizo. Las membranas, los dedos II y III manuales, los dedos I-III pediales, superficies anteriores y posteriores de las piernas, superficies internas del tarso brazo y antebrazo presentan un color anaranjado intenso. Superficies de los flancos, vientre, pecho, gula, labio inferior e inserciones de los brazos y piernas generalmente son blancas. El iris es rojizo claro, pupila redonda (Fig. 2A). Los huevos presentan una yema verde-crema y están cubiertos por una masa gelatinosa verdosa transparente (Fig. 2B)
Color en preservado
Las superficies dorsales del cuerpo, la cabeza, extremidades, dedos IV y V de la mano y los dedos IV y V del pie presentan una coloración desde verde azulado hasta verde pálido u oscuro; las verrugas son blancas bordeadas de negro. Los bordes externos del tarso, talón, antebrazo y dedo manual V son blancos. Los flancos, membranas, los dedos II y III manuales, los dedos pediales I, II y III, superficies anteriores y posteriores de las piernas, superficies internas del tarso brazo y antebrazo son crema a morado grisáceo. Superficies ventrales de la garganta, pecho, vientre y extremidades blanco pálido.
Variaciones
Agalychnis spurrelli es una especie moderadamente grande; las hembras adultas tienen una longitud rostro-cloaca mayor a los machos (t = 5.51, p < 0.01, gl = 31). Se reportan las siguientes proporciones (promedios ± desviación estándar) y medidas morfométricas (Fig. 4): HW/HL: 0.90 ± 0.10; HW/SVL: 0.32 ± 0.02; HL/SVL: 0.35 ± 0.04; EN/HL: 0.31 ± 0.04; ED/HL: 0.28 ± 0.05; IOD/ED: 1.18 ± 0.22; EN/ED: 1.15 ± 0.19; EN/IOD: 0.99 ± 0.16; TL/SVL: 0.52 ± 0.05; FL/SVL: 0.42 ± 0.06. Duellman (2001a) refiere a las poblaciones de Costa Rica como especímenes de menor tamaño, respecto a los obtenidos en Panamá. La hembra más grande fue registrada en Peña Lisa, Chocó, Colombia (SVL = 92.8 mm), mientras que el macho más grande fue registrado en Tacarcuna, Darièn, Panamá (SVL = 75.6 mm) (Duellman 2001b). Existen diferencias significativas entre las medias de longitud rostro-cloaca (Kruskal-Wallis, H = 12.03, p < 0.05, gl = 4) evaluadas para cinco poblaciones con especímenes adultos del noroccidente de Ecuador, siendo los especímenes de Estero Aguacate (DHMECN 2682-2684, 2686, 2687) los que presentaron valores promedio inferiores respecto a las otras poblaciones en Ecuador (Tabla 1). Los especímenes de Colombia presentaron promedios de SVL mayores a los ecuatorianos, con tamaños semejantes a los panameños. La coloración de los flancos, patas, pies y muslos es una característica variable en la especie, tanto en juveniles como en adultos, donde el 80% de los individuos revisados (n = 39) presentaron entre una y once verrugas blancas bordeadas de negro distribuidas en el dorso. De 39 especímenes adultos de A. spurrelli provenientes de Ecuador, ocho (20%) presentaron el dorso verde uniforme sin verrugas (DHMECN 2683, QCAZ 3758, 4391, 15476, 15478, 15501, 21075, 26072). El espécimen QCAZ 27286 presentó once verrugas bordeadas de negro distribuidas en su dorso; los restantes treinta especímenes presentaron los siguientes porcentajes de verrugas en el dorso: una verruga, 27%; dos y tres verrugas, 40%; cuatro o cinco verrugas, 20%; seis verrugas, 10%, y nueve verrugas 3%. Todos ellos presentaron coloraciones desde rosado pálido hasta morado pálido en los flancos, manos y pies. Los especímenes colombianos (ICN 28017, 28015, 52034, 52033, 28016, 5203, 10829, 52032, 13238, 10828, 13239, 13240) presentaron también verrugas en su dorso. Al igual que la coloración, la disposición y el número de tubérculos supernumerarios plantares también son caracteres variables en la especie a nivel interpoblacional, en cuyo caso su facilidad de observación puede verse afectada por el proceso de fijación y preservación de los especímenes en las colecciones (Fig. 5)
Vocalización
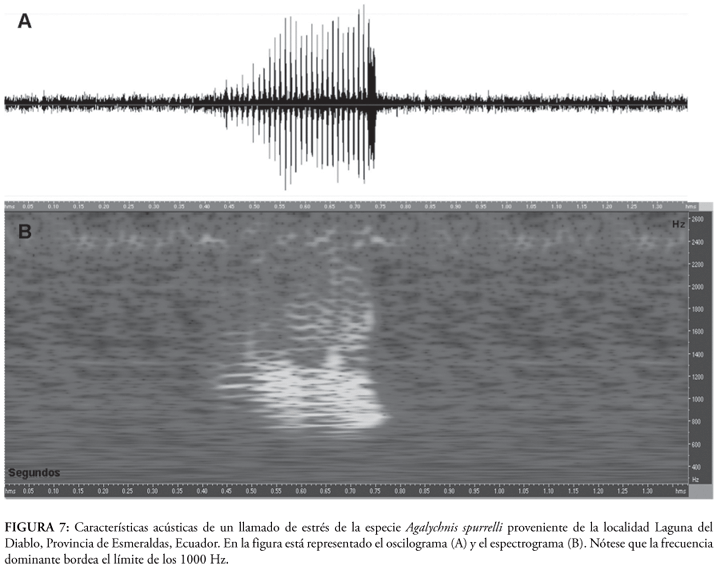
La vocalización de Agalychnis spurrelli consiste de un simple y débil "groan" repetido en intervalos desde 4 segundos hasta varios minutos. Análisis de cuatro vocalizaciones de un mismo individuo (no colectado) de la localidad de Laguna del Diablo, provincia de Esmeraldas, Ecuador muestran que la duración de la nota va desde 156 hasta 215 (x = 187) milisegundos; la nota tiene entre 9 y 16 (x = 12.8) pulsos por llamada y se registra una proporción de cinco llamadas por minuto. La frecuencia dominante tiene un promedio de 893.25 ± 73 Hz (818-990 Hz, Fig. 6). La vocalización de estrés consiste en una nota con 24 pulsos, con una duración de 0.248 milisegundos y una frecuencia dominante alrededor de 990 Hz (Fig. 7). Duellman (2001a) cita que la frecuencia dominante está entre 435 a 700 Hz, la duración del canto entre 340 y 400 milisegundos, mientras que cada nota consiste de 19 a 24 pulsos.
Historia Natural
Agalychnis spurrelli habita altitudes inferiores a los 885 m, en los bosques húmedos tropicales de tierras bajas, desde el sur de Costa Rica hasta el noroccidente de Ecuador. Es una especie de reproducción explosiva inmediata a periodos de lluvias (Savage 2002); agrupaciones de esta especie son comúnmente encontradas en pequeños humedales naturales o artificiales y riachuelos poco torrentosos rodeados por vegetación arbórea, asociada a los estratos altos del bosque de donde desciende para reproducirse; es posible encontrarlos en bosques primarios, secundarios y áreas alteradas con árboles remanentes asociados a cuerpos de agua (Gray 1997, Duellman 2001a). Durante 12 meses entre los años 2006 y 2007 se monitoreó esta especie en la Laguna del Diablo, Provincia de Esmeraldas, Ecuador (Apéndice IApéndice 1), observando incrementos de su densidad relativa durante los períodos de lluvias, época de reproducción y durante el nacimiento de individuos, procesos que ocurren a inicios del mes de febrero (Ortega-Andrade et al. En prep.). Se registró una baja tasa de recaptura durante todo el período de muestreo, la misma que permitió proyectar tamaños poblacionales que podrían superar más de 2000 individuos adultos para un área de muestreo con aproximadamente 2400 m2. Esta información poblacional es acorde a lo reportado por Scott & Starrett (1974), aunque con un menor número de individuos proyectados en Ecuador, quienes reportan altas concentraciones de individuos que pudieran alcanzar más de 13.000 ranas en una pequeña posa en Rincón de Osa, Costa Rica. Machos vocalizando fueron encontrados perchando en ramas de árboles y arbustos sobre los 2 metros del suelo en Laguna del Diablo, zona de Cabo San Francisco-Punta Galeras la noche del 24 de marzo de 2004. Los especímenes DHMECN 2686, 2688, 2719 son juveniles metamórficos capturados sobre hojas de heliconia a 1.5 metros del suelo al borde de la Laguna del Diablo, entre el 24 y 30 de marzo de 2004; otros dos especímenes juveniles (QCAZ 14930, 14929) fueron capturados la noche del 6 de junio de 1999. Una hembra grávida (DHMECN 2685, LRC 80.8 mm), capturada la noche del 29 de abril de 2004, contenía 245 huevos maduros en su oviducto. En la época menos lluviosa (junio-diciembre) no se registraron adultos vocalizando alrededor de la laguna, aunque dos renacuajos metamórficos fueron observados en septiembre y octubre de 2004. La noche del 14 de Junio de 2001 se contaron 52 adultos de Agalychnis spurrelli, en un pequeño humedal rodeado de un pastizal a 3 km NO de Durango, Provincia Esmeraldas, Ecuador (I. Tapia, notas de campo). En el tracto digestivo de dos machos adultos (DHMECN 2683, 2686) se encontraron un Orthoptera, cuatro Formicoidea y dos Araneae. En la Laguna del Diablo, al menos nueve especies se alimentan de Agalychnis spurrelli (Tabla 2), siendo la serpiente Leptodeira septentrionalis su principal depredador, especialmente de juveniles (Fig. 8). El espécimen KU 96149 fue encontrado en una poza donde también se reportaron adultos reproductores de Agalychnis callidryas y adultos de Phyllomedusa venusta (Duellman & Trueb 1967). Agalychnis spurrelli (QCAZ 29852, 29789) y Cruziohyla calcarifer (QCAZ 30209, 30198, 30210, 29790) fueron encontrados en simpatría las noches del 16 y 17 de septiembre de 2004 en Durango, Ecuador. En los bosques tropicales de tierras bajas de la zona del Cabo San Francisco-Punta Galeras, se encontraron en simpatría los siguientes hílidos: Hypsiboas pellucens, H. rosenbergi, Scinax quinquefasciatus, S. sugillatus, Smilisca phaeota, Trachycephalus jordani y T. venulosa.
Distribución
Agalychnis spurrelli habita altitudes inferiores a los 885 m en los bosques húmedos tropicales de tierras bajas desde el sur de Costa Rica hasta el noroccidente de Ecuador (Frost 2007, Figura 8, Apéndice IApéndice 1). La revisión de nuevo material colectado extiende su distribución hacia la costa del Pacífico de Ecuador, en las provincias de Esmeraldas y Manabí. Se adicionan nueve localidades para los Bosques Semi-Deciduos de Tierras Bajas de la Costa (2 loc.), Bosques Siempre Verdes de Tierras Bajas de la Costa (4), Bosques Siempre Verdes Montanos Bajos de la Cordillera de la Costa (1), Bosques Siempre Verdes Piemontanos de la Cordillera de la Costa (1), Bosques Siempre Verdes Piemontanos de la Costa (1) de las provincias de Esmeraldas, norte de Manabí y Pichincha. El área de ocupación de Agalychnis spurrelli en Ecuador es de un polígono de aproximadamente 19,600 km2, mientras que su rango de distribución en América se extiende aproximadamente 1900 km lineales desde el suroccidente de Costa Rica hasta el Centro occidente de Ecuador (Fig. 9).
DISCUSIÓN
El holotipo de Agalychnis litodryas Duellman & Trueb es un macho (SVL = 70.2 mm) que presentó una coloración carente de pigmentos en flancos, piernas, pies, manos y barbilla, además de la ausencia de verrugas blancas bordeadas de negro en el dorso, citándose a éstas como las características más notables de la especie. Posteriormente, Duellman (2001b) menciona que A. litodryas presenta el dorso verde uniforme en vida, excepto por un individuo que mostró un pequeño punto bordeado de negro en la región escapular izquierda. Los especímenes vivos de A. spurrelli provenientes de Ecuador se ajustan al patrón de coloración descrito para el holotipo de A. litodryas, con la diferencias que alrededor del 80% de los individuos estudiados presentaron verrugas blancas sobre el dorso, demostrando que la presencia de éstas evidentemente es un carácter variable dentro de la especie. Es en estas poblaciones donde existe un cambio ontogénico en el patrón de coloración de los flancos y extremidades, pues los juveniles son crema y/o anaranjados en sus etapas tempranas de desarrollo, característica coincidente con las poblaciones centroamericanas (Gray 1997, Fig. 2). Se han observado variaciones morfológicas y de coloración en poblaciones de Agalychnis spurrelli a través de su rango de distribución (Duellman 2001a, b, Savage 2002, Tabla 1). De hecho, la presencia inconspicua de los tubérculos supernumerarios de la patas, otro caracter tomado en consideración para la descripción de A. litodryas (Duellman & Trueb 1967), es variable dentro de las poblaciones ecuatorianas y colombianas, pudiendo ser un efecto de preservación (Fig. 3). En Centroamérica, la localidad tipo de A. litodryas se encuentra apenas a 50 km vía aérea de otra población con el patrón de coloración amarillo de la extremidades reportado para A. spurrelli (Duellman 2001b). Poblaciones con la coloración descrita para A. litodryas se reportan para Panamá y Ecuador, mientras que la coloración amarilla descrita para A. spurrelli ha sido encontrada en todo su rango de distribución, con variabilidad en color y tamaños (Duellman 2001b, Savage 2002). Las observaciones de su historia natural demuestran que es un reproductor explosivo después de fuertes lluvias, con masas de huevos colocadas en hojas suspendidas sobre cuerpos de agua poco torrentosos, lagunas o charcas temporales (Savage 2002). Las relaciones tróficas de sus depredadores son similares a las realizadas en otras especies de Agalychnis de Centro América y Colombia (Gray 1997, Warkentin 2000, 2005). La ausencia de algún caracter morfológico (Tabla 1) o etológico en la reproducción a través de las poblaciones estudiadas es indicativo de que Agalychnis spurrelli y Agalychnis litodryas son conespecíficas, siendo este último un sinónimo junior.
Medidas de conservación de Agalychnis spurrelli en Ecuador
La región Chocó-Darién es considerada una de las 25 Ecoregiones terrestres prioritarias para la conservación de la diversidad biológica, caracterizada por ser uno de los biomas con mayor grado de endemismo del planeta (Conservation Internacional, 2007). En los bosques tropicales de la provincia de Esmeraldas se encuentran los límites suroccidentales de la formación biogeográfica del Chocó, que se extiende desde el sur de Panamá hasta el noroccidente de Ecuador, abarcando toda la cuenca del Pacífico colombiano. Los hábitats en Ecuador donde Agalychnis spurrelli se desarrolla son parches de remanentes boscosos, muchos de ellos rodeados de áreas de cultivo, pastizales y asentamientos humanos. Durante varios siglos de actividades antrópicas de extracción madereray cultivos expansivos, los bosques ecuatorianos han sufrido una dramática reducción de la vegetación natural convirtiendo los bosques tropicales de occidente en pequeños remanentes aislados (Dodson & Gentry 1991, Sierra 1996). Dodson & Gentry (1991), aseveran que en la región costera (0 a 1000 m) los Bosques Semidesiduos Piemontanos y de Tierras Bajas, los Bosques Húmedos Piemontanos y los Bosques Secos son formaciones con un gran riesgo de extinción.
En el presente trabajo, se amplía el área general de ocurrencia de Agalychnis spurrelli (= A. litodryas por Coloma et al. 2006) de 1851 km2 a 19.550 km2, reportando su presencia en al menos 22 localidades provenientes de cuatro provincias del noroccidente de Ecuador. De acuerdo con el Sistema Nacional de Áreas Protegidas de Ecuador (SNAP), dos poblaciones de Agalychnis spurrelli ocurren en las cercanías de la Reserva Ecológica Cayapas-Mataje y Reserva Mache-Chindul. A pesar de ser parte del SNAP, las dos reservas donde se encontraría esta especie son sujeto de extracción selectiva de madera, apertura de cobertura vegetal para fincas y una presión constante de la expansión agrícola, además de incluir asentamientos humanos. Otras reservas privadas en la provincia de Esmeraldas son parte de áreas protegidas bajo el control de organizaciones no gubernamentales ambientalistas; éstas incluyen a la Estación Biológica Bilsa de la Fundación Jatun Sacha con alrededor de 3,000 ha en la Cordillera Mache-Chindul; el Bosque Protector Monte Saíno a cargo de la Fundación EcoCiencia con 106 ha, en la zona del Cabo San Francisco en Muisne (Larrea & Fabara 2005); y la Reserva Biológica Canandé de la Fundación Jocotoco con alrededor de 1,000 ha (Yánez-Muñoz et al. 2005). Las otras localidades donde esta especie ocurre se encuentran fuera del SNAP, en áreas bajo una fuerte degradación ambiental y pérdida de hábitats, donde la remoción de la cobertura vegetal es constante y las zonas con remanentes forestales se restringen mayormente a cuencas de ríos, quebradas y áreas de amortiguamiento de las Reservas Ecológicas Mache-Chindul, Cotacachi-Cayapas y Cayapas-Mataje.
Esta especie puede presentar localmente elevados tamaños poblacionales, inclusive en zonas con gradientes de alteración (Duellman 2001b, Ortega et al. en prep.). Al parecer, la dificultad de su observación en estudios herpetológicos dentro de su rango de observación es un efecto de muestreo, el cual desestima la existencia de poblaciones aún desconocidas en el noroccidente de Ecuador y la vertiente soroccidental del Pacífico de Colombia. Bajo estos argumentos, en la especie Agalychnis spurrelli se propone la categoría de Casi Amenazada (NT) a nivel nacional bajo los criterios propuestos por la UICN (2001, 2003).
AGRADECIMIENTOS
A Mario Yánez-Muñoz, Marco Altamirano B. (DHMECN), Luis A. Coloma (QCAZ), John D. Lynch (ICN) y Jorge Valencia (FHGO), quienes apoyaron este estudio y me permitieron revisar las colecciones a su cargo. También recibí el invaluable apoyo de Martín Bustamante e Ítalo Tapia (QCAZ) y John J. Mueses-Cisneros (ICN). John D. Lynch y William E. Duellman proveyeron invaluable información, fotografías y comentarios respecto a los especímenes depositados en el ICN y KU, respectivamente. Néstor Acosta-Buenaño, Silvia Aldaz, Julieta Bermingham, David C. Cannatella, Edwin Carrillo, Luis A. Coloma, Ximena Cordovez, Gloria Correa, Rafael O.de Sá, Marcelo Díaz, William E. Duellman, Cristina Erazo, Julian Faivovich, Catherine A. Graham, Paul Hamilton, Stephan Lotters, Andrés Merino-Viteri, Keneth Miyata, Manuel Morales, Pablo Picerno, Alexandra Quiguango-Ubillús, Paola Ramón, Santiago R. Ron, Ricardo Schmalbach, John E. Simmons, Elicio Tapia, Ítalo Tapia, Queti Tapia, Andrés Vallejo, Alex Widmer, Mario Yánez-Muñoz y Vlastimil Zak colectaron especímenes utilizados en este estudio. Julieta Bermingham, Paul Hamilton y Tobias Eisenberg facilitaron información, fotografías y coordenadas geográficas de las localidades de avistamiento de la especie en la Estación Biológica Bilsa, en Chindul (Ecuador) y en Costa Rica. Mario Larrea (EcoCiencia) y Carlos Aulestia (Fundación Jatun Sacha), brindaron facilidades para realizar el trabajo de campo de HMOA en la Reserva Monte Saíno y en la Estación Biológica Bilsa, respectivamente. Karen Warkentin e Iván Gómez-Mestre del Departamento de Biología de la Universidad de Boston facilitaron importante información sobre la ecología de Agalychnis. Verónica Armas realizó los dibujos a escala presentados en este manuscrito. Durante el trabajo de campo recibí el apoyo de: Antonio Ortiz y familia, Cecilia Tobar, Mónica Arellano, M. Fernanda Armas, Raúl Cabrera y Fabricio Narváez. A Mauricio Herrera, Santiago Villamarín y Vladimir Carvajal por su ayuda en la identificación taxonómica de los invertebrados catalogados como depredadores, y a Luis Carrasco por facilitar información sobre observaciones de la especie en la Estación Biológica Bilsa. A Diego F. Cisneros-Heredia e Iván Gómez-Mestre por sus valiosos comentarios y sugerencias respecto al manuscrito borrador. Un especial agradecimiento a Luis A. Coloma y a un revisor anónimo quienes aportaron invaluablemente en la revisión íntegra y sugerencias sobre el manuscrito final. El trabajo de campo de HMOA en la zona de San Francisco-Punta Galeras fue apoyado mediante dos becas del Programa de Investigación para la Conservación (PBCI) dirigido por EcoCiencia, Conservación Internacional y la Embajada Real de los Países Bajos. El permiso de investigación (Nº 002) en la provincia de Esmeraldas fue acreditado por el Ministerio del Ambiente de Ecuador.
REFERENCIAS
ANGULO, A. 2006. Fundamentos de bioacústica y aspectos prácticos de grabaciones y análisis de cantos. In: Angulo, A.; Rueda-Almondacid, J.V.; Rodríguez-Mahecha J.V. & Marca, E. La (Eds.), Técnicas de inventario y monitoreo para los anfibios de la Región Tropical Andina. Conservación Internacional, Serie Manuales de Campo, Bogotá, Colombia, p. 93-134.
CERÓN, C.P.W.; VALENCIA, R. & SIERRA, R. 1999. Las Formaciones Naturales de la costa del Ecuador. In: Sierra, R. (Ed.), Propuesta preliminar de un Sistema de Clasificación de Vegetación para el Ecuador Continental. Quito, Ecuador, p. 55-73.
COLOMA, L.; RON, S.; JUNGFER, K.; CISNEROS-HEREDIA, D.; ALMANDÁRIZ, A.; SOLÍS, F.; IBÁÑEZ, R.; JARAMILLO, C. & FUENMAYOR, Q. 2006. Agalychnis litodryas. Electronic database accessible at: <http://www.globalamphibians.org/>. Access in: 08/Feb./2007.
CONSERVATION INTERNATIONAL. 2007. Biodiversity hotspots: Tumbes-Chocó-Magdalena. Electronic database accessible at: <http://www.biodiversityhotspots.org/xp/Hotspots/tumbes_choco/>. Access in: 20/Mar./2007.
DODSON, C.H. & GENTRY, A.H. 1991. Biological extinction in western Ecuador. Annals of the Missouri Botanical Garden, 78(2):273-295.
DUELLMAN, W.E. 1974. Taxonomic notes on Phyllomedusa (Anura: Hylidae) from the upper Amazon Basin. Herpetologica, 30:105-112.
DUELLMAN, W.E. 2001a. The Hylid frogs of Middle America. Society for the Study of Amphibians and Reptiles. Ithaca, New York, USA, p. 658.
DUELLMAN, W.E. 2001b. The Hylid frogs of Middle America. Society for the Study of Amphibians and Reptiles. Ithaca, New York, USA, p. 659-1129.
DUELLMAN, W.E. & Trueb, L. 1967. Two new species of tree frogs (genus Phyllomedusa) from Panama. Copeia, 1967(1):125-131.
FAIVOVICH, J.; HADDAD, C.; GARCIA, P.; FOSTER, D.; CAMPBELL, J.A. & WHEELER, W.C. 2005. Sistematic Review of the frog family Hylidae, with special reference to hylinae: Phylogenetic analysis and taxonomic revision. Bulletin of the American Museum of Natural History, 294:240. Frost, D. 2007. Amphibian Species of the World 5.0, an Online Reference. Electronic database accessible at: <http://research.amnh.org/herpetology/>. Access in: 10/Aug./2007.
FROST, D., GRANT, T.; FAIVOVICH, J.; BAIN, R.; HAAS, A.; HADDAD, C.; DE SÁ, R.; CHANNING, A.; WILKINSON, M.; DONNELLAN, S.; RAXWORTHY, C.; CAMPBELL, J.A.; BLOTTO, B.; MOLER, P.; DREWES, R.C.; NUSSBAUM, R.; LYNCH, J.D.; GREEN, D.M. & WHEELER, W.C. 2006. The amphibian tree of life. Bulletin of the American Museum of Natural History, 297:370.
GRAY, A.R. 1997. Observations on the biology of Agalychnis spurrelli from the Caribbean lowlands of Costa Rica. Journal of the International Herpetological Society, 22:61-70.
IGM. 2008. Mapa físico del Ecuador 1:1'000.000. Electronic database accessible at: <http://www.igm.gov.ec/cms/ index.php?option=com_content&task=view&id=85&Itemid=89>. Access in: 27/Feb./2008.
IIRBAVH. 2007. Laboratorio de Biogeografìa y Análisis Espacial. Electronic database accessible at: <http://www.humboldt.org.co/ humboldt/mostrarpagina.php?codpage=7000>. Access in: 16/Nov./2007.
LARREA, M. & FABARA, J. 2005. Inventario de especies promisorias en Monte Saíno y Tagual. In: Vásquez, M., Freile, J. & Suárez, L. (Eds.), Biodiversidad en el suroccidente de la provincia de Esmeraldas: un reporte de las evaluaciones ecológicas y socioeconómicas rápidas. EcoCiencia y MAE, Quito, Ecuador, p. 189-203.
MYERS, C. & DUELLMAN, W.E. 1982. A new species of Hyla from Cerro Colorado, and other tree frog records and geographical notes from western Panamá. American Museum Novitates, 2752:1-32.
SAVAGE, J.M. & HEYER, R. 1967. Variation and distribution in the tree-frog genus Phyllomedusa in Costa Rica, Central America. Beitrage zur Neotropischen Fauna, 2:111-131.
SAVAGE, J. 2002. The Amphibians and Reptiles of Costa Rica: A Herpetofauna between two Continents, between two Seas. The University of Chicago Press, Chicago, USA. 954p.
SCOTT, N. & STARRETT, A. 1974. An unusual breeding aggregation of frogs, with notes on the ecology of Agalychnis spurrelli (Anura:Hylidae). Bulletin of South California Academy of Science, 76(2):86-94.
SIERRA, R. 1996. La deforestación del noroccidente del Ecuador, 1983-1993. Quito, Ecuador. UICN. 2001. Categorías y criterios de la Lista Roja de la UICN. Version 3.1. Electronic database accessible at: <http://www.iucn.org.> Access in: 25/Oct./2006.
UICN. 2003. Directrices para emplear los criterios de la Lista Roja de la UICN a nivel regional: Versión 3.0. Comisión de Supervivencia de Especies de la UICN. UICN, Gland, Suiza y Cambridge. Reino Unido. Warkentin, K.M. 2000. Wasp predation and wasp-induced hatching of red-eyed treefrog eggs. Animal Behaviour, 60:503-510.
WARKENTIN, K.M. 2005. How do embryos assess risk? Vibrational cues in predator-induced hatching of red-eyed treefrogs. Animal Behaviour, 70:59-71.
YÁNEZ-MUÑOZ, M.; MEZA-RAMOS, P. & REYES, M. 2005. Caracterización y composición de la herpetofauna en la Reserva Biológica Canandé. Provincia de Esmeraldas, Ecuador. In: SEB (Ed.), Resúmenes XXIX Jornadas Ecuatorianas de Biología. Sociedad Ecuatoriana de Biología. CEPIRCI. Universidad Laica "Eloy Alfaro" de Manabí. Facultad de Ciencias del Mar. Manabí, Ecuador, p. 104.
Recebido em: 05.07.2007
Aceito em: 28.03.2008
Impresso em: 30.06.2008
Material Examinado
Agalychnis spurrelli. COLOMBIA: Departamento de Antioquia: Dabeiba, Río Amparradó, 07°0321"N 76°2615"W, 805 m, ICN 10828, 10829; Departamento de Chocó: Límite con Risalda, 15-15.6 km carretera Sta. Cecilia - Quilodó, 05°2448"N 76°1507"W, 28015-28017; Quibdó, Tutunendó, 05°4448"N 76°3207"W, ICN 52031-52034; Departamento de Valle del Cauca: Campamento Chancos, 460 m, 03°5747"N 76°4407"W, ICN 13240; Vda. Campo Alegre, Campamento Río Bravo, 940 m, 03°5747"N 76°3807"W, ICN 13238, 13239. COSTA RICA: Provincia de Limón: Guayacán de Siquirres, 83°3230"N 10°0210"W, espécimen fotografiado. ECUADOR: Provincia Esmeraldas: 3 km W de Durango, 00°5338"N 78°4936"W, 158 m, QCAZ 5535, 5536, 5545, 5548, 15457-15501, 15545-15547, 15570, 20004, 21075, 21134, 21136, 23367, 24162, 27284-27286, 29268, 30262, 31275; 3.9 km W de Durango, 00°5350"N 78°4954"W, 215 m, QCAZ 6267-6271; 5 km W de Durango, 00°5410"N 78°5025"W, 200 m, QCAZ 13217, 22992, 14929, 14930; 7 km W de Durango, 00°5506"N 78°5133"W, 100 m, QCAZ 23609, 30216; Alto Tambo, 00°5512"N 78°3340"W, 700 m, QCAZ 17075-17079, 17122; Durango, 00°5300"N 78°4800"W, 158 m, QCAZ 4314, 4391-4394, 7339, 22991, 29110, 29193-29196, 29775, 29776, 29789, 29831-29840, 29852, 30327, 30526, 30532-30535; Estación Biológica Bilsa, 00°2035"N 79°4310"W, 550 m, DHMECN 3792; Estero Aguacate, 00°3913"N 80°0302"W, 30 m, FHGO 3560; Laguna del Diablo, 00°3910"N 80°0320"W, 53 m, DHMECN 2682-2687; Oeste de Durango, 00°5258"N 78°4902"W, 158 m, QCAZ 7192, 7222, 7226-7230, 7254-7257; Río Canandé, 00°1428"N 79°0844"W, 600 m, DHMECN 2681; San Lorenzo, 00°1732"N 78°5001"W, 30 m, QCAZ 27701; Viche, 00°3943"N 79°3218"W, 30 m, FHGO 1190; Provincia Los Ríos: Centro Científico Río Palenque, 00°3400"S 79°2000"W, 220 m, KU 146255-146260, MCZ 95412; Provincia Manabí: Estero Ancho, 00°0659"S 79°5957"W, 329 m, QCAZ 26072; 1 km N de Chindul, 50 m, 00°1354"N 79°5240"W, registro fotográfico; Provincia de Pichincha: km E de Maldonado, 00°0517.5"N 79°0232"W, 600 m, KU 217505, 217506, 217509, 217510, QCAZ 3755-3758; 9 km W. vía San Miguel de los Bancos-Puerto Quito, 00°0426" N 78°5730"W, 800 m, QCAZ 3845; Hacienda Cerro Chico, 45 km N en la vía Quevedo-Santo Domingo de Los Colorados, 00°3906"S 79°2632"W, 200 m, MCZ 94901; Pedro Vicente Maldonado, 00°0518"N 79°0303"W, 600 m, KU 217507, 217508; Pedro Vicente Maldonado, Hacienda Shangrilla, 00°0518"N 79°0303"W, 600 m, FHGO 3612; Puerto Quito, 00°0732"N 79°1509"W, 200 m, QCAZ 15291. PANAMÁ: Provincia Darién: Río Tuira y Río Mono, 130 m, KU 96149.
Cruziohyla calcarifer. COLOMBIA: Departamento de Valle del Cauca: Campamento Chancos, 460 m, 03°5747"N 76°4407"W, ICN 38913. ECUADOR: Provincia Esmeraldas: Durango, 00°5300"N 78°4800"W, 215 m, QCAZ 2979, 30198, 30209-30210.
- ANGULO, A. 2006. Fundamentos de bioacústica y aspectos prácticos de grabaciones y análisis de cantos. In: Angulo, A.; Rueda-Almondacid, J.V.; Rodríguez-Mahecha J.V. & Marca, E. La (Eds.), Técnicas de inventario y monitoreo para los anfibios de la Región Tropical Andina. Conservación Internacional, Serie Manuales de Campo, Bogotá, Colombia, p. 93-134.
- CERÓN, C.P.W.; VALENCIA, R. & SIERRA, R. 1999. Las Formaciones Naturales de la costa del Ecuador. In: Sierra, R. (Ed.), Propuesta preliminar de un Sistema de Clasificación de Vegetación para el Ecuador Continental. Quito, Ecuador, p. 55-73.
- COLOMA, L.; RON, S.; JUNGFER, K.; CISNEROS-HEREDIA, D.; ALMANDÁRIZ, A.; SOLÍS, F.; IBÁÑEZ, R.; JARAMILLO, C. & FUENMAYOR, Q. 2006. Agalychnis litodryas. Electronic database accessible at: <http://www.globalamphibians.org/>. Access in: 08/Feb./2007.
- CONSERVATION INTERNATIONAL. 2007. Biodiversity hotspots: Tumbes-Chocó-Magdalena. Electronic database accessible at: <http://www.biodiversityhotspots.org/xp/Hotspots/tumbes_choco/>. Access in: 20/Mar./2007.
- DODSON, C.H. & GENTRY, A.H. 1991. Biological extinction in western Ecuador. Annals of the Missouri Botanical Garden, 78(2):273-295.
- DUELLMAN, W.E. 1974. Taxonomic notes on Phyllomedusa (Anura: Hylidae) from the upper Amazon Basin. Herpetologica, 30:105-112.
- DUELLMAN, W.E. 2001a. The Hylid frogs of Middle America. Society for the Study of Amphibians and Reptiles. Ithaca, New York, USA, p. 658.
- DUELLMAN, W.E. 2001b. The Hylid frogs of Middle America. Society for the Study of Amphibians and Reptiles. Ithaca, New York, USA, p. 659-1129.
- DUELLMAN, W.E. & Trueb, L. 1967. Two new species of tree frogs (genus Phyllomedusa) from Panama. Copeia, 1967(1):125-131.
- FAIVOVICH, J.; HADDAD, C.; GARCIA, P.; FOSTER, D.; CAMPBELL, J.A. & WHEELER, W.C. 2005. Sistematic Review of the frog family Hylidae, with special reference to hylinae: Phylogenetic analysis and taxonomic revision. Bulletin of the American Museum of Natural History, 294:240.
- Frost, D. 2007. Amphibian Species of the World 5.0, an Online Reference. Electronic database accessible at: <http://research.amnh.org/herpetology/>. Access in: 10/Aug./2007.
- FROST, D., GRANT, T.; FAIVOVICH, J.; BAIN, R.; HAAS, A.; HADDAD, C.; DE SÁ, R.; CHANNING, A.; WILKINSON, M.; DONNELLAN, S.; RAXWORTHY, C.; CAMPBELL, J.A.; BLOTTO, B.; MOLER, P.; DREWES, R.C.; NUSSBAUM, R.; LYNCH, J.D.; GREEN, D.M. & WHEELER, W.C. 2006. The amphibian tree of life. Bulletin of the American Museum of Natural History, 297:370.
- GRAY, A.R. 1997. Observations on the biology of Agalychnis spurrelli from the Caribbean lowlands of Costa Rica. Journal of the International Herpetological Society, 22:61-70.
- IIRBAVH. 2007. Laboratorio de Biogeografìa y Análisis Espacial. Electronic database accessible at: <http://www.humboldt.org.co/ humboldt/mostrarpagina.php?codpage=7000>. Access in: 16/Nov./2007.
- LARREA, M. & FABARA, J. 2005. Inventario de especies promisorias en Monte Saíno y Tagual. In: Vásquez, M., Freile, J. & Suárez, L. (Eds.), Biodiversidad en el suroccidente de la provincia de Esmeraldas: un reporte de las evaluaciones ecológicas y socioeconómicas rápidas. EcoCiencia y MAE, Quito, Ecuador, p. 189-203.
- MYERS, C. & DUELLMAN, W.E. 1982. A new species of Hyla from Cerro Colorado, and other tree frog records and geographical notes from western Panamá. American Museum Novitates, 2752:1-32.
- SAVAGE, J.M. & HEYER, R. 1967. Variation and distribution in the tree-frog genus Phyllomedusa in Costa Rica, Central America. Beitrage zur Neotropischen Fauna, 2:111-131.
- SAVAGE, J. 2002. The Amphibians and Reptiles of Costa Rica: A Herpetofauna between two Continents, between two Seas. The University of Chicago Press, Chicago, USA. 954p.
- SCOTT, N. & STARRETT, A. 1974. An unusual breeding aggregation of frogs, with notes on the ecology of Agalychnis spurrelli (Anura:Hylidae). Bulletin of South California Academy of Science, 76(2):86-94.
- SIERRA, R. 1996. La deforestación del noroccidente del Ecuador, 1983-1993. Quito, Ecuador.
- UICN. 2001. Categorías y criterios de la Lista Roja de la UICN. Version 3.1. Electronic database accessible at: <http://www.iucn.org> Access in: 25/Oct./2006.
- UICN. 2003. Directrices para emplear los criterios de la Lista Roja de la UICN a nivel regional: Versión 3.0. Comisión de Supervivencia de Especies de la UICN. UICN, Gland, Suiza y Cambridge. Reino Unido.
- Warkentin, K.M. 2000. Wasp predation and wasp-induced hatching of red-eyed treefrog eggs. Animal Behaviour, 60:503-510.
- WARKENTIN, K.M. 2005. How do embryos assess risk? Vibrational cues in predator-induced hatching of red-eyed treefrogs. Animal Behaviour, 70:59-71.
- YÁNEZ-MUÑOZ, M.; MEZA-RAMOS, P. & REYES, M. 2005. Caracterización y composición de la herpetofauna en la Reserva Biológica Canandé. Provincia de Esmeraldas, Ecuador. In: SEB (Ed.), Resúmenes XXIX Jornadas Ecuatorianas de Biología. Sociedad Ecuatoriana de Biología. CEPIRCI. Universidad Laica "Eloy Alfaro" de Manabí. Facultad de Ciencias del Mar. Manabí, Ecuador, p. 104.
Apéndice 1
Fechas de Publicación
-
Publicación en esta colección
02 Jul 2008 -
Fecha del número
2008
Histórico
-
Recibido
05 Jul 2007 -
Acepto
28 Mar 2008