Resumos
Cefalópodes coleóides (lulas, sépias e polvos) produzem espermatóforos muito complexos que são transferidos à fêmea durante a cópula por meio do hectocótilo, um apêndice modificado nos machos. Durante a transferência à fêmea, ocorre a chamada "reação espermatofórica", complexo processo de evaginação do aparato ejaculatório do espermatóforo, que conduz à exteriorização da massa espermática e corpo cimentante. A presente revisão sintetiza o conhecimento acerca da morfologia e funcionamento desta estrutura exclusiva dos coleóides, identificando lacunas e definindo estratégias que possibilitem avanços na área. Poucos trabalhos abordam com detalhes a morfologia e anatomia funcional dos espermatóforos dos cefalópodes, grande parte do conhecimento acerca da estrutura do espermatóforo tendo sido gerada por trabalhos clássicos do século XIX e início do século XX. Investigações acerca do funcionamento dos espermatóforos são consideravelmente mais raras, estando o conhecimento básico sobre a reação espermatofórica restrito a apenas 19 espécies de coleóides. A revisão da literatura especializada permite sugerir que existem dois tipos básicos de fixação de espermatóforos em Decapodiformes (lulas e sepióides): fixação superficial e implante profundo (ou intra-dérmico). Na fixação superficial, comum em diversas espécies (e.g., Loliginidae, Sepiidae, Ommastrephidae), a base dos espermatângios é aderida ao tecido-alvo aparentemente por meio do corpo cimentante, a partir de substâncias adesivas e, em alguns casos, estruturas de fixação. No implante profundo, comum em alguns grupos de lulas oceânicas e de águas profundas (e.g., Architeuthidae, Cranchiidae, Octopoteuthidae, Sepiolidae), os espermatóforos implantam-se inteiramente no corpo da fêmea, de forma autônoma. Permanece desconhecido o mecanismo responsável pelo implante profundo. Em Octopodiformes (polvos), o espermatóforo é inserido no gonoduto feminino, alcançando a glândula oviducal, onde estão localizadas as espermatecas, ou a cavidade do ovário. Como o funcionamento extracorpóreo dos espermatóforos depende exclusivamente da intrincada estrutura e organização de seus componentes (e.g., membranas e túnicas), somente investigações detalhadas dessas estruturas proverão as bases para a compreensão do funcionamento e da exata função do complexo espermatóforo dos coleóides. Recomenda-se o desenvolvimento de um protocolo simples e eficiente para coloração e preparação total de espermatóforos, de forma que seja possível expandir as descrições morfológicas do espermatóforo em estudos taxonômicos e anatômicos, permitindo, portanto, ampliação do conhecimento acerca desta enigmática estrutura.
Cephalopoda; Coleoidea; Espermatóforo; Reação Espermatofórica; Morfologia Funcional
Coleoid cephalopods (squids, cuttlefishes, and octopods) produce elaborate spermatophores, which are transferred to the female during mating with the aid of a modified appendage called hectocotylus. During transfer, the spermatophores undergo the so-called spermatophoric reaction, i.e., a complex process of evagination of the ejaculatory apparatus that, ultimately, leads to the extrusion of the cement body and sperm mass. The present review summarizes the bulk of our knowledge on the morphology and functioning of this exclusive coleoid character, identifying gaps and defining strategies to stimulate advancements in this area. Few detailed morphological studies regarding this structure have yet been conducted, and much of the knowledge on the coleoid spermatophore was generated by classical studies of the 19th and early 20th centuries. Furthermore, investigations on the functioning of this structure are even rarer, the basic knowledge of the spermatophoric reaction being restricted to 19 species. There seems to be a consensus in the literature that two types of attachment of spermatophores occur in decapodiforms (i.e., squids and sepioids): superficial attachment, and deep (or intradermal) implantation. In superficial attachment, the base of the spermatangia ends up attached on the surface of the female's body, by means of the adhesive contents and, in some cases, attachment structures of the cement body; this type is found in several groups of decapodiforms (e.g., Loliginidae, Ommastrephidae, Sepiidae). In deep implantation, the spermatangia penetrate autonomously the integument, embedding themselves completely into the female tissue; this strategy is common to some oceanic and deep-sea species (e.g., Architeuthidae, Cranchiidae, Octopoteuthidae, Sepiolidae). The mechanism responsible for deep implantation remains unknown. In octopodiforms (octopods), the spermatophore is inserted inside the lumen of the female gonoduct, reaching the oviducal gland, where the spermathecae are located, or the ovarian cavity. Since the extracorporeal functioning of coleoid spermatophores must rely entirely on the intricate structure and organization of the tunics, membranes, and other structures composing the spermatophore, only detailed investigations of these components would provide the basis for comprehending its mechanics. This paper recommends the development of a specific, efficient protocol for whole-mount staining and permanent preparation of coleoid spermatophores, in order to enable expansion of spermatophore morphological descriptions in taxonomic and anatomical studies, and therefore enhance the knowledge of this unique, still enigmatic structure.
Cephalopoda; Coleoidea; Spermatophore; Spermatophoric Reaction; Functional Morphology
O enigma da "reação espermatofórica": breve síntese do conhecimento sobre a estrutura e o funcionamento dos espermatóforos dos cefalópodes (Mollusca: Cephalopoda)
José Eduardo Amoroso Rodriguez Marian
Laboratório de Malacologia, Departamento de Zoologia, Instituto de Biociências da Universidade de São Paulo. Rua do Matão, Travessa 14, nº 101, CEP 05508-090, São Paulo, SP, Brasil. E-mail: jeduardo_marian@yahoo.com.br
RESUMO
Cefalópodes coleóides (lulas, sépias e polvos) produzem espermatóforos muito complexos que são transferidos à fêmea durante a cópula por meio do hectocótilo, um apêndice modificado nos machos. Durante a transferência à fêmea, ocorre a chamada "reação espermatofórica", complexo processo de evaginação do aparato ejaculatório do espermatóforo, que conduz à exteriorização da massa espermática e corpo cimentante. A presente revisão sintetiza o conhecimento acerca da morfologia e funcionamento desta estrutura exclusiva dos coleóides, identificando lacunas e definindo estratégias que possibilitem avanços na área. Poucos trabalhos abordam com detalhes a morfologia e anatomia funcional dos espermatóforos dos cefalópodes, grande parte do conhecimento acerca da estrutura do espermatóforo tendo sido gerada por trabalhos clássicos do século XIX e início do século XX. Investigações acerca do funcionamento dos espermatóforos são consideravelmente mais raras, estando o conhecimento básico sobre a reação espermatofórica restrito a apenas 19 espécies de coleóides. A revisão da literatura especializada permite sugerir que existem dois tipos básicos de fixação de espermatóforos em Decapodiformes (lulas e sepióides): fixação superficial e implante profundo (ou intra-dérmico). Na fixação superficial, comum em diversas espécies (e.g., Loliginidae, Sepiidae, Ommastrephidae), a base dos espermatângios é aderida ao tecido-alvo aparentemente por meio do corpo cimentante, a partir de substâncias adesivas e, em alguns casos, estruturas de fixação. No implante profundo, comum em alguns grupos de lulas oceânicas e de águas profundas (e.g., Architeuthidae, Cranchiidae, Octopoteuthidae, Sepiolidae), os espermatóforos implantam-se inteiramente no corpo da fêmea, de forma autônoma. Permanece desconhecido o mecanismo responsável pelo implante profundo. Em Octopodiformes (polvos), o espermatóforo é inserido no gonoduto feminino, alcançando a glândula oviducal, onde estão localizadas as espermatecas, ou a cavidade do ovário. Como o funcionamento extracorpóreo dos espermatóforos depende exclusivamente da intrincada estrutura e organização de seus componentes (e.g., membranas e túnicas), somente investigações detalhadas dessas estruturas proverão as bases para a compreensão do funcionamento e da exata função do complexo espermatóforo dos coleóides. Recomenda-se o desenvolvimento de um protocolo simples e eficiente para coloração e preparação total de espermatóforos, de forma que seja possível expandir as descrições morfológicas do espermatóforo em estudos taxonômicos e anatômicos, permitindo, portanto, ampliação do conhecimento acerca desta enigmática estrutura.
Palavras-Chave: Cephalopoda; Coleoidea; Espermatóforo; Reação Espermatofórica; Morfologia Funcional.
ABSTRACT
Coleoid cephalopods (squids, cuttlefishes, and octopods) produce elaborate spermatophores, which are transferred to the female during mating with the aid of a modified appendage called hectocotylus. During transfer, the spermatophores undergo the so-called spermatophoric reaction, i.e., a complex process of evagination of the ejaculatory apparatus that, ultimately, leads to the extrusion of the cement body and sperm mass. The present review summarizes the bulk of our knowledge on the morphology and functioning of this exclusive coleoid character, identifying gaps and defining strategies to stimulate advancements in this area. Few detailed morphological studies regarding this structure have yet been conducted, and much of the knowledge on the coleoid spermatophore was generated by classical studies of the 19th and early 20th centuries. Furthermore, investigations on the functioning of this structure are even rarer, the basic knowledge of the spermatophoric reaction being restricted to 19 species. There seems to be a consensus in the literature that two types of attachment of spermatophores occur in decapodiforms (i.e., squids and sepioids): superficial attachment, and deep (or intradermal) implantation. In superficial attachment, the base of the spermatangia ends up attached on the surface of the female's body, by means of the adhesive contents and, in some cases, attachment structures of the cement body; this type is found in several groups of decapodiforms (e.g., Loliginidae, Ommastrephidae, Sepiidae). In deep implantation, the spermatangia penetrate autonomously the integument, embedding themselves completely into the female tissue; this strategy is common to some oceanic and deep-sea species (e.g., Architeuthidae, Cranchiidae, Octopoteuthidae, Sepiolidae). The mechanism responsible for deep implantation remains unknown. In octopodiforms (octopods), the spermatophore is inserted inside the lumen of the female gonoduct, reaching the oviducal gland, where the spermathecae are located, or the ovarian cavity. Since the extracorporeal functioning of coleoid spermatophores must rely entirely on the intricate structure and organization of the tunics, membranes, and other structures composing the spermatophore, only detailed investigations of these components would provide the basis for comprehending its mechanics. This paper recommends the development of a specific, efficient protocol for whole-mount staining and permanent preparation of coleoid spermatophores, in order to enable expansion of spermatophore morphological descriptions in taxonomic and anatomical studies, and therefore enhance the knowledge of this unique, still enigmatic structure.
Key-Words: Cephalopoda; Coleoidea; Spermatophore; Spermatophoric Reaction; Functional Morphology.
INTRODUÇÃO
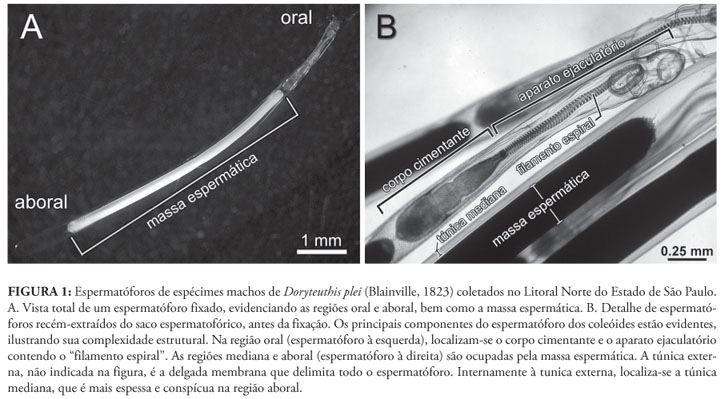
Os moluscos da classe Cephalopoda apresentam comportamento sexual complexo, incluindo corte, comunicação por estímulos visuais e transferência de espermatóforos através de apêndices modificados nos machos (Hanlon & Messenger, 1996). Os cefalópodes viventes estão reunidos nas subclasses Nautiloidea (náutilos) e Coleoidea (lulas, sépias e polvos) (Young et al., 2008). Os espermatóforos dos náutilos são compostos por uma longa massa espermática (15-35 cm de comprimento), muito enovelada e inclusa em uma cápsula ovóide, sendo transferidos à fêmea pelo espádice, órgão derivado da hipertrofia de quatro tentáculos circum-orais (Haven, 1977; Arnold, 1984; Mann, 1984). Os espermatóforos dos coleóides (Fig. 1), por sua vez, estão entre as estruturas reprodutivas mais complexas do Reino Animal (Mann, 1984). Durante a cópula, são transferidos à fêmea por meio de um apêndice modificado nos machos, denominado hectocótilo (e.g., Nesis, 1987). Durante a transferência à fêmea, esses espermatóforos sofrem, de forma autônoma, drásticas modificações na chamada "reação espermatofórica", complexo processo de evaginação que, basicamente, conduz à exteriorização da massa espermática (Mann, 1984).
Em tratados gerais de zoologia (e.g., Ruppert et al., 2005; Brusca & Brusca, 2007) e até mesmo em alguns compêndios específicos sobre a reprodução de Cephalopoda (e.g., Mangold, 1987), o fenômeno da reação espermatofórica, quando abordado, é tratado de maneira excessivamente superficial. Em geral, há apenas menção ao fato de que, durante transferência à fêmea, ocorre eversão do "aparato ejaculatório" e conseqüente exteriorização da "massa espermática" do espermatóforo, sem haver mais detalhes acerca deste processo. Há poucas exceções em que o tema é abordado com maior minúcia (e.g., Arnold, 1984; Mangold, 1989), mas ainda sem detalhes importantes para a compreensão deste fenômeno. A obra de Mann (1984) reúne a única revisão abrangente acerca dos espermatóforos dos cefalópodes, apesar de enfocar principalmente na série de estudos realizados por Thaddeus Mann e colaboradores sobre a fisiologia e bioquímica do espermatóforo do polvo-gigante-do-Pacífico, Enteroctopus dofleini1 1 Uma lista contendo o autor e ano da descrição original de cada espécie citada no presente artigo encontra-se no Apêndice 1. .
Drew (1919a), em sua monografia acerca da estrutura, funcionamento e formação dos espermatóforos da lula Doryteuthis pealeii, faz menção à noção equivocada de muitos zoólogos de sua época, que atribuíam ao filamento espiral estrutura helicoidal da região oral do espermatóforo (Fig. 1) a função de uma "mola", com a qual a massa espermática seria impulsionada durante a "explosão" dos espermatóforos. Não seria surpreendente encontrar atualmente a mesma noção entre zoólogos e malacólogos, em virtu-de da ausência de informações acerca deste fenômeno em livros gerais de Zoologia e Malacologia. A título de exemplo, quando comparada ao tratamento de outras estruturas complexas e importantes para a compreensão da biologia de determinado animal, como o espermatóforo de escorpiões ou o nematocisto de cnidários (e.g., Ruppert et al., 2005; Brusca & Brusca, 2007), a abordagem do espermatóforo dos cefalópodes e da reação espermatofórica em livros e compêndios é notadamente incipiente. O fato do conhecimento sobre o tema ser pouco disseminado entre zoólogos pode estar relacionado à relativa carência de estudos na área, como exposto adiante, e por ainda não compreendermos por completo a exata função do espermatóforo dos cefalópodes.
Neste contexto, a presente revisão tem por objetivo sintetizar o conhecimento acerca da estrutura e funcionamento do espermatóforo dos coleóides, visando 1) a acessibilidade dessas informações a zoólogos e biólogos marinhos, 2) a identificação de lacunas no conhecimento deste tema e 3) a definição de estratégias que possibilitem avanços na área. Em face da complexidade estrutural e funcional desses espermatóforos, como exposto a seguir, a ampliação do conhecimento deste tema contribuirá diretamente para estudos de anatomia comparada, biologia reprodutiva e seleção sexual.
Breve histórico
O primeiro registro do espermatóforo dos coleóides e do fenômeno da reação espermatofórica foi realizado pelo naturalista holandês Jan Swammerdam (1637-1680) e publicado na obra póstuma Biblia Naturae (Swammerdam, 1738). Com base nos espermatóforos de uma espécie de Sepia, Swammerdam, com os limitados recursos de microscopia de luz de sua época, não só reconheceu e ilustrou as principais regiões dos espermatóforos da sépia, como também observou que os mesmos sofriam drásticas modificações morfológicas autônomas, quando retirados do sistema reprodutor masculino e deixados por algum tempo em água do mar.
Poucos trabalhos abordam com detalhes a morfologia e anatomia funcional dos espermatóforos dos cefalópodes. Apesar das descrições taxonômicas atuais incluírem a morfologia do espermatóforo (vide recomendações de Roper & Voss, 1983), em geral a descrição morfológica e respectivas ilustrações do espermatóforo são demasiadamente simples, feitas com base na limitada ampliação de um estereomicroscópio. Poucos estudos detalhados foram efetuados, grande parte do conhecimento acerca da estrutura do espermatóforo tendo sido gerada por trabalhos clássicos do século XIX e início do século XX (e.g., Milne-Edwards, 1842; Racovitza, 1894b; Marchand, 1913; Drew, 1919a; Blancquaert, 1925; Weill, 1927). Recentemente, descrições mais detalhadas foram feitas apenas por Austin et al. (1964), os quais empregaram cortes seriados e coloração histológica ao estudo dos espermatóforos de Doryteuthis pealeii, e por Takahama et al. (1991), que incluíram a microscopia eletrônica de varredura para investigar o espermatóforo de Todarodes pacificus. Embora sem o mesmo nível de detalhamento, Hess (1987) apresentou uma descrição comparativa dos espermatóforos de diversas espécies de lulas, compondo, dessa forma, o estudo mais abrangente acerca dos espermatóforos dos teutóides.
Investigações acerca do funcionamento dos espermatóforos dos coleóides são consideravelmente mais raras, estando o conhecimento básico sobre a reação espermatofórica restrito a apenas 12 espécies de Decapodiformes (i.e., lulas e sepióides): Doryteuthis pealeii (Drew, 1919a; Austin et al., 1964), D. opalescens (Fields, 1965), Loligo vulgaris (Milne-Edwards, 1842; Marchand, 1913), Illex coindetii (Marchand, 1913), Octopoteuthis sicula (Hoving et al., 2008a), Onykia ingens (Hoving & Laptikhovsky, 2007), Rossia macrosoma (Racovitza, 1894b; Marchand, 1913), R. moelleri (Hoving et al., 2009), Sepia officinalis (Milne-Edwards, 1842; Marchand, 1913), Sepiola atlantica (Weill, 1927), S. rondeleti (Marchand, 1913), Todarodes pacificus (Takahama et al., 1991), e sete espécies de Octopodiformes (i.e., polvos): Callistoctopus macropus (Marchand, 1913), Eledone cirrhosa (Fort, 1937), E. moschata (Milne-Edwards, 1842; Marchand, 1913; Fort, 1941; Orelli, 1962), Enteroctopus dofleini (Mann et al., 1966, 1970; Hanson et al., 1973), Macrotritopus defilippi (Marchand, 1913), Octopus tehuelchus (Pujals, 1978) e O. vulgaris (Drew, 1919b). Descrições detalhadas da reação espermatofórica, indicando o papel dos componentes do espermatóforo no funcionamento do processo, são escassas (e.g., Racovitza, 1894b; Drew, 1919a; Weill, 1927).
Plano básico do espermatóforo dos coleóides
Para entender o funcionamento da reação espermatofórica, é necessário primeiramente compreender a complexa morfologia do espermatóforo, o qual é composto pelas seguintes estruturas (Figs. 1, 2A): (1) massa espermática na região aboral; (2) corpo cimentante, conectado à massa espermática por um cilindro conectivo; (3) três membranas (interna, mediana e externa) envolvendo um filamento espiralado (ou "filamento espiral"); (4) três túnicas (interna, mediana e externa), que recobrem todas ou parte das estruturas enumeradas de 1 a 3, mais os espaços preenchidos por líquidos; e (5) extremidade oral fechada pelo capuz e respectivo filamento do capuz, sendo ambas as estruturas continuidade da túnica externa. Ao conjunto formado pelo filamento espiral, pelas três membranas que o envolvem e pela túnica interna é dado o nome de "aparato ejaculatório" (Drew, 1919a; Fig. 1). Esse padrão estrutural é compartilhado pela maioria dos coleóides, havendo somente variações menores dentro desse plano básico (e.g., Mann, 1984; Hess, 1987). Exceção a esse complexo padrão é encontrada apenas nos polvos da subordem Cirrata, cujo espermatóforo consiste simplesmente de uma cápsula com opérculos nas extremidades, não apresentando aparato ejaculatório (Villanueva, 1992).
A morfologia e o funcionamento do espermatóforo são apresentados a seguir com maior detalhamento para Decapodiformes, com descrições baseadas principalmente nos trabalhos de Drew (1919a) e Austin et al. (1964). Para uma melhor compreensão e acompanhamento das fases dessa "reação" é apresentado um esquema didático (Fig. 2), baseado principal-mente no estudo de Drew (1919a) sobre o espermatóforo da lula D. pealeii. Na versão online do artigo, há também uma animação feita com base nesse modelo (ver Material Suplementar). Na seqüência dessas descrições, são apresentados os mecanismos de armazenamento de espermatozóides em Decapodiformes, bem como o fenômeno de implante intradérmico de espermatóforos observado em algumas espécies do grupo. Finalmente, o conhecimento sobre o tema é sumarizado para Octopodiformes.
Os espermatóforos de Decapodiformes
a. Estrutura do espermatóforo (Fig. 2A)
O espermatóforo extraído de espécimes vivos é túrgido e elástico (Drew, 1919a; Takahama, et al. 1991). Isso se deve à túnica externa (Fig. 2A), que é resistente e elástica, apesar de apresentar espessura relativamente fina. Internamente à túnica externa, localiza-se a túnica mediana (Fig. 2A), de espessura maior na região aboral, reduzindo-se de forma gradual em direção à região oral após o corpo cimentante. Entre as túnicas mediana e interna há um espaço evidente em praticamente toda a extensão do espermatóforo e preenchido por líquido (no esquema didático da Fig. 2, este espaço corresponde à área em branco no interior do espermatóforo).
Na região aboral do corpo cimentante inicia-se a túnica interna2 2 Drew (1919a) acreditava que a túnica interna estendia-se em direção aboral, recobrindo também a massa espermática; essa informação foi omitida do esquema didático (Fig. 2) objetivando maior clareza. e a membrana externa (Fig. 2A), a qual recobre este corpo. A membrana externa é forte-mente unida à túnica interna, sendo por vezes difícil distinguí-las. Próximo às suas extremidades, a túnica interna e a membrana externa terminam formando um espessamento (Fig. 2A). Ambas, membrana e túnica formam, estruturalmente, um tubo aberto e com borda espessada na extremidade oral, porém de base fechada, pois esta envolve e se une à extremidade aboral do corpo cimentante.
A membrana mediana, situada entre as membranas interna e externa (Fig. 2A), forma um tubo que se estende desde a base da metade oral do corpo cimentante, até a extremidade oral do espermatóforo. Estruturalmente, a membrana mediana forma um tubo aberto na extremidade aboral situada ao redor do corpo cimentante e fechada na extremidade oposta onde se funde ao capuz (Fig. 2A). A membrana interna (Fig. 2A) acompanha a membrana mediana ao longo de sua extensão. O filamento espiral (Fig. 2A) é fortemente unido à esta membrana, estendendo-se desde a extremidade oral do corpo cimentante até aproximadamente a extremidade oral do espermatóforo. Tendo em mente esse plano estrutural básico, torna-se mais simples a compreensão da reação espermatofórica, descrita a seguir.
b. Funcionamento do espermatóforo (Figs. 2B-G)
A reação espermatofórica tem início com uma tração sobre o filamento do capuz, a qual se trans-mite para o capuz, rompendo-o na região de inserção do filamento (Fig. 2B). Com o rompimento do capuz, o aparato ejaculatório abre-se para o exterior, iniciando-se o processo de evaginação (Fig. 2C). Este acontece, a princípio, devido a uma pressão inicial, pré-ruptura, pelo fato do espermatóforo intacto ser altamente túrgido. Concomitantemente, a túnica mediana torna-se gradualmente entumescida pela entrada de água no espermatóforo por absorção (Fig. 2C). O entumescimento da túnica mediana, associado à resistência natural à distensão da túnica externa, gerariam a pressão necessária para provocar a expulsão da massa espermática e do corpo cimentante (Drew, 1919a). A propriedade "absortiva" da membrana mediana é aparentemente resultado de sua hipertonia em relação à água do mar, o que geraria um gradiente osmótico no momento em que o espermatóforo é extraído do gonoduto e exposto à água do mar durante a cópula (nos polvos essa função é desempenhada pelo fluido ou plasma espermatofórico; Mann et al., 1970).
O processo de evaginação continua e, no momento em que a extremidade oral do corpo cimentante projeta-se para o meio externo (Fig. 2D), o filamento espiral e a membrana interna se destacam do mesmo e a reação sofre um breve retardo, quando então a massa espermática é forçada contra a região aboral do corpo cimentante. Nesta fase, e após concluído o processo de evaginação da túnica interna e membrana externa, o tubo por elas formado recobre a massa espermática, a qual, a partir da constante pressão interna, continua a ser impelida para o interior desse tubo (Fig. 2D). O contato íntimo entre entre a extremidade aboral da membrana mediana com a região mediana do corpo cimentante cria uma área de resistência que aparentemente retarda ao máximo o destacamento entre ambas estruturas. Esse fator permite que haja tempo para que toda a massa de espermatozóides seja impelida para dentro do envoltório formado pela túnica interna e a membrana externa.
No momento em que a membrana mediana se destaca do corpo cimentante, este último se rompe (Fig. 2E) e a massa espermática, envolta pela tubo constituído pela túnica interna e membrana externa, é lançada por completo para fora do espermatóforo (Fig. 2F). O conjunto recém-expelido, denominado de "reserva espermática" (Drew, 1919a, Takahama et al., 1991) ou "espermatângio" (Fort, 1937; Nesis et al., 1998), tem a base aboral maior e revestida externamente pelo conteúdo adesivo do corpo cimentante, e uma extremidade livre e aberta, por onde os espermatozóides são continuamente liberados (Fig. 2G). Em algumas espécies, entretanto, não há liberação de espermatozóides após a reação, tendo sido postulado que nesses casos deve haver um mecanismo prevenindo a liberação e promovendo armazenamento de esperma no espermatângio (O'Dor, 1983).
A duração da reação espermatofórica é variável entre as espécies de cefalópodes, ocorrendo em média em 10 segundos em D. pealeii (Drew, 1919a; Austin et al., 1964), e em uma a duas horas em Enteroctopus dofleini, o polvo-gigante-do-Pacífico, cujo espermatóforo pode atingir 1 metro de comprimento (Mann et al., 1966, 1970). O gatilho exato para iniciar a reação é tema controverso; alguns autores propuseram que a tração sobre o filamento do capuz, a qual se transmite para o capuz, rompendo-o na região de inserção do filamento, é necessária para iniciar o processo (e.g., Drew, 1919a). Entretanto, foi sugerido que, em algumas espécies, o contato com a água do mar é suficiente para iniciar a reação (e.g., Takahama et al., 1991).
c. Sítios de deposição de espermatóforos e armazenamento de espermatozóides
O sítio de deposição de espermatóforos e aquele de armazenamento de espermatozóides variam muito dentre os Decapodiformes. Em Sepiida, o macho transfere espermatóforos ao receptáculo seminal localizado na membrana peribucal da fêmea (Hanlon et al., 1999). Em alguns Sepiolida, os espermatóforos são depositados em uma bolsa copulatória, localizada na cavidade palial (Hoving et al., 2008b). Em algumas espécies de Myopsida (Loliginidae), o mesmo indivíduo apresenta dois sítios de deposição, um sendo a região do receptáculo seminal, localizado na membrana peribucal, e o outro sendo dentro da cavidade do manto, próximo à base das brânquias e à abertura genital. A opção por um desses sítios pode depender da maturação sexual da fêmea (i.e., se está ou não em fase de postura de ovos), do tamanho do macho e das interações intraespecíficas à época do acasalamento (Hanlon & Messenger, 1996). Em Oegopsida, dependendo da espécie, os espermatóforos podem ser transferidos para a membrana peribucal (próximo a receptáculos seminais, quando presentes), para a cavidade do manto na região da abertura genital, ou ainda para bolsas especializadas localizadas na região "nucal" (Nesis, 1995).
Receptáculos seminais sensu stricto são estruturas especializadas no armazenamento de espermatozóides, embora estes termos sejam utilizados de forma mais abrangente na literatura, incluindo por vezes os receptáculos de espermatóforos. No caso de lulas e sépias, o receptáculo seminal s. str. trata-se de uma invaginação da membrana peribucal, ventral à boca, circundada por musculatura circular e secretora de uma substância que mantém os espermatozóides em estado inativo (Drew, 1911; Oordt, 1938). A ausência de mobilidade observada nos espermatozóides armazenados está aparentemente associada ao pH relativamente ácido dessa secreção (Oordt, 1938). O receptáculo armazena espermatozóides até o momento da postura dos ovos (Lum-Kong, 1992), mas são desconhecidos os mecanismos de atração destes para o interior do receptáculo seminal, uma vez que os espermatóforos são depositados fora deste órgão.
d. O fenômeno de implante intra-dérmico de espermatóforos
Recentemente, diversos estudos foram efetuados sobre o fenômeno de "implante intradérmico" ou "implante profundo", comum a algumas espécies de lulas oceânicas e de águas profundas (e.g., Norman & Lu, 1997; Nesis et al., 1998; Jackson & Jackson, 2004; Hoving & Laptikhovsky, 2007; Hoving et al., 2008a; Hoving et al., 2009). Diferentemente do que ocorre com outras lulas e sepióides, como Loliginidae (e.g., Drew, 1919a), Ommastrephidae (e.g., Durward et al., 1980), Sepiidae (e.g., Hanlon et al., 1999), nos quais a base do espermatângio fixa-se ao corpo da fêmea por meio do corpo cimentante (e.g., Drew, 1919a), no implante profundo o espermatângio penetra inteiramente no tegumento da fêmea.
Em Galiteuthis glacialis (Cranchiidae), os alongados espermatângios são implantados na superfície interna e dorsal do manto das fêmeas, próximo à abertura dos ovidutos (Nesis et al., 1998). Em Onykia ingens (Onychoteuthidae), são enovelados e encontrados em diversas regiões do corpo, como na superfície externa do manto ou dentro da cavidade palial da fêmea (Jackson & Jackson, 2004). Em Octopoteuthis sicula (Octopoteuthidae; Hoving et al., 2008a) e Rossia moelleri (Sepiolidae; Hoving et al., 2009), os implantes são bulbosos e localizados na superfície da cabeça, braços e manto. Em Taningia danae (Octopoteuthidae; Hoving et al., 2010) e algumas espécies de Onychoteuthidae (Bolstad, 2008), os espermatângios são implantados nos sulcos de incisões (entalhes) localizadas na superfície do manto. Na lula-gigante Architeuthis (Architeuthidae), distribuem-se na superfície do manto, cabeça, funil e na base dos braços ventrais (e.g., Norman & Lu, 1997; Hoving et al., 2004; Guerra et al., 2004; Martins & Perez, 2010), em geral apresentando um arranjo em ziguezague. Embora a maioria dos implantes seja superficial, sendo possível identificá-los como saliências na superfície do corpo, na lula-gigante os espermatângios podem, em alguns casos, penetrar profundamente o tecido-alvo (Hoving et al., 2004; Martins & Perez, 2010).
Os espermatóforos de Octopodiformes
Em geral, a estrutura e o funcionamento dos espermatóforos dos polvos da subordem Incirrata (Ordem Octopoda) são similares aos dos Decapodiformes (e.g., Mann, 1984), entretanto o modo de transferência e deposição dos espermatângios é bastante característico. Em Octopodidae, durante a cópula, o macho insere o hectocótilo na cavidade do manto da fêmea, alcançando a abertura do oviduto (Racovitza, 1894a; Mann et al., 1970; Wells & Wells, 1972; Wodinsky, 2008). Em seguida, o espermatóforo é depositado pelo órgão terminal ("pênis") na base do "sulco espermatofórico", um canal delimitado por uma prega lateral do hectocótilo (Wodinsky, 2008). O espermatóforo é então impulsionado para a região distal do braço hectocotlizado a partir de peristaltismo (Wells & Wells, 1972; Wodinsky, 2008). O que ocorre exatamente a partir desse estágio é ainda enigmático, mas acredita-se que os espermatóforos sejam inseridos no oviduto (Racovitza, 1894a; Mann et al., 1970; Wells & Wells, 1972), onde sofrem a reação espermatofórica (Racovitza, 1894a; Mann, 1984), formando o espermatângio ou "bexiga espermatofórica" (Mann et al., 1970) no lúmen da glândula oviducal (Racovitza, 1894a; Mann et al., 1970; Froesch & Marthy, 1975). Nos polvos das subfamílias Octopodinae e Bathypolipodinae, há um par de espermatecas localizadas internamente às glândulas oviducais (e.g., Froesch & Marthy, 1975; O'Dor & Macalaster, 1983). Com o eventual rompimento da bexiga espermatofórica (Racovitza, 1894a; Mann et al., 1970), ocorre liberação de espermatozóides, que são de alguma forma captados para dentro dessas espermatecas, onde podem ser armazenados por muitos meses, até a maturação sexual da fêmea (Froesch & Marthy, 1975).
No caso dos polvos da subfamília Eledoninae, o processo é aparentemente o mesmo, porém os espermatângios alcançam o celoma genital (Fort, 1937; Orelli, 1962; Mangold-Wirz, 1963; Perez et al., 1990). Fort (1937) sugeriu que, em Eledone cirrhosa, o espermatângio deva percorrer o gonoduto feminino e alcançar o ovário a partir de contrações peristálticas do oviduto: espinhos que ornamentam o espermatângio (presentes em E. cirrhosa) preveniriam que o mesmo fosse expelido pelas contrações do oviduto. Os polvos da subfamília Eledoninae não possuem espermatecas nas glândulas oviducais, mas uma descoberta realizada por pesquisadores brasileiros revelou que os espermatozóides podem ser armazenados no filamento apical dos ovócitos até a fêmea atingir a maturação sexual (Perez et al., 1990).
Nos polvos epipelágicos da superfamília Argonautoidea (e.g., Argonauta, Tremoctopus, Ocythöe), os machos são anões e aparentemente produzem um único espermatóforo (Vérany & Vogt, 1852). O elaborado hectocótilo permanece protegido em uma bolsa até o momento da cópula, quando é evertido e sofre autotomia. O hectocótilo inteiro, contendo o espermatóforo, fica retido na cavidade palial ou no sistema reprodutor da fêmea (e.g., Vérany & Vogt, 1852; Müller, 1853; Naef, 1921-23). Devido ao sítio de deposição, à morfologia característica e à complexidade estrutural, o hectocótilo de espécies de Argonautoidea foi a princípio confundido com vermes parasitas, descritos sob o gênero Hectocotylus (daí o nome da estrutura), e até mesmo com o organismo completo dos machos de Argonauta e Tremoctopus (Mann, 1984 apresenta uma excelente revisão acerca desse tópico). Em suma, apesar do excelente tratado de Naef (1921-23) abordar o tema com detalhes, a biologia reprodutiva das espécies de Argonautoidea permanece pouco conhecida.
Como é de se esperar, o conhecimento da biologia reprodutiva de Octopodiformes de águas profundas é consideravelmente mais escasso. O espermatóforo dos polvos da subordem Cirrata consiste simplesmente da massa espermática contida em uma cápsula delimitada por opérculos em ambas as extremidades (Villanueva, 1992). Pouco se sabe, entretanto, sobre seu funcionamento, apenas que são armazenados na glândula oviducal da fêmea (Aldred et al., 1983), de modo similar a outros octópodes. No caso da lula-vampiro, Vampyroteuthis infernalis (ordem Vampyromorpha), apesar dos espermatóforos serem conhecidos (Hess, 1987), seu funcionamento e modo de transferência são enigmáticos. Curiosamente, as espermatecas localizam-se próximo aos olhos das fêmeas (Pickford, 1949).
Principais lacunas no conhecimento sobre a "reação espermatofórica"
Diversas questões relacionadas ao complexo processo de evaginação do espermatóforo e de fixação do espermatângio permanecem não resolvidas. Por exemplo, nos loliginídeos, o conteúdo adesivo e aparentemente alcalino do corpo cimentante é considerado responsável pela fixação da base dos espermatângios no corpo da fêmea (Drew, 1919a; Austin et al., 1964). Entretanto, considerando que os espermatângios são depositados externamente, tanto na membrana peribucal como na cavidade do manto próximos à abertura genital, ambas as áreas desprotegidas e expostas à considerável turbulência3 3 Cefalópodes coleóides são nadadores muito ativos, que continuamente bombeiam água para dentro e para fora da cavidade palial a partir de contrações do manto. Essa condição é aqui considerada como causadora de "turbulência" nas superfícies externas do corpo, incluindo as da cavidade do manto. , é no mínimo intrigante o fato dos espermatângios fixarem-se na fêmea instantaneamente somente a partir de substâncias adesivas. Em lulas da família Ommastrephidae (subordem Oegopsida), além da ação de substâncias adesivas, acredita-se que a extremidade em forma de seta do corpo cimentante tenha papel importante na fixação do espermatângio (e.g., Takahama et al., 1991).
Diversos componentes do espermatóforo dos coleóides têm função enigmática. O intrincado filamento espiral, por exemplo, foi proposto por Drew (1919a), com base em Doryteuthis pealeii, como sendo uma estrutura capaz de evitar o colapso do aparato ejaculatório durante o processo de evaginação. Investigando a mesma espécie, Austin et al. (1964) encontraram numerosos corpúsculos microscópicos de forma estelar ("stellate particles") embebidos na matriz do filamento espiral. Austin et al. (1964) sugeriram que essas estruturas contribuiriam à função proposta por Drew (1919a) por proverem resistência ao filamento espiral. Esses corpúsculos haviam sido descobertos muito tempo antes por Duvernoy (1853) em Sepiola rondeleti, sua presença tendo sido confirmada posteriormente em outros Decapodiformes (Marchand, 1913; Blancquaert, 1923 e 1925; Weill, 1927; Badenhorst, 1974; Takahama et al., 1991; Hoving et al., 2009), porém pouco se sabe sobre sua exata função. Weill (1927) supôs, com base em Sepiola atlantica, que os corpúsculos estariam envolvidos de alguma forma no processo de fixação dos espermatângios na fêmea. Takahama et al. (1991) sugeriram que os mesmos poderiam auxiliar na formação do contato entre o espermatóforo e o corpo da fêmea em Todarodes pacificus.
A extraordinária complexidade estrutural e funcional observada nos espermatóforos das lulas (e.g., Marchand, 1913; Drew, 1919a; Hess, 1987) contrasta com a aparente simples função do todo o processo de evaginação, i.e., exteriorização e fixação superficial da massa espermática por meio de substâncias adesivas. Drew (1919b), em reconhecimento desse quadro intrigante, constatou: "[...] it is very difficult to arrive at the reasons for the formation of such complicated structures as these spermatophores to perform functions where simpler arrangements would seem do as well".
Com relação ao fenômeno de implante profundo observado em cefalópodes oceânicos e de águas profundas, apesar dos grandes avanços proporcionados por estudos recentes (e.g., Norman & Lu, 1997; Nesis et al., 1998; Jackson & Jackson, 2004; Hoving & Laptikhovsky, 2007; Hoving et al., 2008a; Hoving et al., 2009), importantes questões permanecem não resolvidas. Algumas hipóteses foram propostas para explicar o mecanismo responsável por esse fenômeno, mas até o momento nenhuma ganhou ampla aceitação. Alguns autores são favoráveis à hipótese de que o longo órgão terminal ("pênis") de algumas espécies serviria para implantar hidraulicamente os espermatóforos no corpo da fêmea (e.g., Murata et al., 1982; Norman & Lu, 1997; Jackson & O'Shea, 2003; Jackson & Jackson, 2004). Em geral, nas espécies em que o "pênis" é relativamente longo, ultrapassando a margem anterior do manto (Nesis, 1995), o hectocótilo está ausente. Esse fato levou diversos autores a supor que o órgão responsável pela transferência de espermatóforos, nesses casos, seria o "pênis" (e.g., Nesis, 1995). A recente descoberta da capacidade de intumescência e aumento do "pênis" em Onykia ingens (Onychoteuthidae; Arkhipkin & Laptikhovsky, 2010) de fato reforça a hipótese de que este órgão deva ter importante papel durante a transferência de espermatóforos nos casos em que o hectocótilo está ausente.
Outras hipóteses envolvem a ação de ganchos ou ventosas dos braços e/ou tentáculos, bem como das mandíbulas (bicos), com os quais o macho faria incisões no corpo da fêmea para inserir os espermatóforos (e.g., Murata et al., 1982; Nesis, 1995; Nesis et al., 1998). Acredita-se que esses entalhes sirvam para facilitar o implante dos espermatângios, embora esteja claro que não são pré-requisitos para o implante profundo (Hoving et al., 2010).
Uma hipótese recorrente na literatura envolve a ação de supostas enzimas histolíticas presentes nas túnicas ou no corpo cimentante do espermatóforo (e.g., McSweeny, 1978; Nesis et al., 1998; Hoving et al., 2009), que seriam responsáveis pela dissolução do tecido-alvo, embora até o momento não haja registro de tais substâncias nas estruturas componentes desses espermatóforos. O fato é que, recentemente, confirmou-se que o implante profundo é um processo autônomo, ou seja, o espermatóforo é capaz de implantar-se no corpo da fêmea sem a ação de agentes externos (Hoving & Laptikhovsky, 2007; Hoving et al., 2009). Além disso, confirmou-se, em uma espécie que apresenta implante profundo (Rossia moelleri), que a força produzida pela aceleração e massa do espermatóforo em evaginação não é suficiente para perfurar mecanicamente o tecido da fêmea (Hoving et al., 2009). O implante profundo dos espermatângios seria, portanto, um processo muito diferente daquele observado nos nematocistos dos cnidários, nos quais a perfuração da parede do corpo das presas é aparentemente garantida pelo estreito diâmetro e extraordinária aceleração atingida pelo túbulo interno, que é evaginado durante a "explosão" do nematocisto (e.g., Özbek et al., 2009). Dessa forma, a hipótese mais aceita atualmente para explicar o fenômeno de implante profundo é a que envolve a ação de supostas enzimas histolíticas liberadas pelo corpo cimentante (Hoving et al., 2009), embora o mecanismo exato permaneça enigmático.
A recente descoberta do potencial de perfuração dos espermatóforos de Loliginidae em condições artificiais (Marian, 2011), somada à similaridade estrutural do espermatóforo das lulas (e.g., Hess, 1987), sugere que exista um mecanismo comum de perfuração, intrínseco ao espermatóforo dos Decapodiformes, embora, por razões desconhecidas, o mesmo nem sempre resulte em implante profundo em condições naturais. Claramente, faz-se necessária maior experimentação in vitro da reação espermatofórica, de diferentes espécies, para responder essas questões.
Perspectivas
Com base no exposto, pode-se afirmar que, após mais de 250 anos de seu primeiro registro (Swammerdam, 1738) e a despeito de obras clássicas e monografias publicadas sobre o tema, o conhecimento acerca da morfologia funcional dos espermatóforos dos coleóides permanece deficiente. A ausência de um robusto arcabouço de dados morfológicos dificulta, inclusive, o entendimento da reação espermatofórica e a criação de hipóteses para tentar explicar processos difíceis de serem observados in vivo ou in vitro. Como o funcionamento extracorpóreo dos espermatóforos é autônomo e depende exclusivamente da intrincada estrutura e organização de seus componentes (membranas, túnicas etc.), somente investigações detalhadas dessas estruturas proverão as bases para entender o funcionamento e a exata função do complexo espermatóforo dos coleóides.
Considera-se imprescindível a busca por uma metodologia simples e eficiente para processamento dos espermatóforos, os quais são, em geral, de difícil preparação para microscopia (e.g., Hess, 1987), provavelmente devido à estrutura da túnica externa, que atua como uma membrana semi-permeável durante a reação espermatofórica (Mann, 1984). O emprego de protocolos padronizados de preparação de espécimes é rotineiro em estudos taxonômicos de outros grupos zoológicos, sendo em muitos casos imprescindível para análise morfológica (e.g., Dingerkus & Uhler, 1977). Como já exposto, a utilização de espermatóforos em descrições taxonômicas de cefalópodes é ainda muito restrita. Com a elaboração de um protocolo simples de preparação total de espermatóforos (i.e., amostras inteiras montadas e coradas em lâminas), outros pesquisadores (e.g., sistematas) poderiam usufruir mais facilmente das informações morfológicas disponíveis na complexa estrutura dos espermatóforos dos coleóides. Em contrapartida, o produto gerado por esses estudos (i.e., lâminas depositadas em museus científicos), bem como a própria informação resultante da investigação (i.e., descrições morfológicas), estariam amplamente disponíveis para estudos de morfologia funcional e evolução dos espermatóforos.
Finalmente, com relação ao estudo da reação espermatofórica, ressalta-se a importância da experimentação in vitro dos espermatóforos, devendo-se ampliar a análise para outras espécies de coleóides. A recente descoberta de espermatóforos funcionais em espécimes que haviam sido congelados após a coleta (Hoving & Laptikhovsky, 2007; Hoving et al., 2009) permite afirmar que as perspectivas na área são excelentes, pois torna-se factível a expansão das investigações in vitro para espécies oceânicas e de águas profundas.
AGRADECIMENTOS
A presente revisão é parte da Tese de Doutorado do autor pelo Programa de Pós-Graduação em Zoologia do Departamento de Zoologia do IBUSP, financiada com Bolsa e Reserva Técnica da FAPESP (04/13212-7) e auxílios da CAPES PROAP-2006, Pró-Reitoria de Pós-Graduação da USP, American Malacological Society e Houston Conchology Society. O projeto de Doutorado contou com apoio de infra-estrutura das seguintes instituições: Centro de Biologia Marinha da USP, Laboratório de Biologia Celular do IBUSP, Laboratório de Parasitologia e Laboratório de Biologia Celular do Instituto Butantan. Uma versão preliminar do texto foi lida e minuciosamente comentada pelo orientador do autor, Prof. Dr. Osmar Domaneschi (in memoriam), a quem este trabalho é dedicado. Finalmente, dois revisores anônimos contribuíram com valiosas sugestões ao manuscrito.
Recebido em: 18.01.2011
Aceito em: 09.06.2011
Impresso em: 30.06.2011
Lista dos gêneros e espécies citados no presente artigo.
MATERIAL SUPLEMENTAR
o vídeo citado na página 210, pode ser acessado no seguinte endereço: www.scielo.br/scielo.php?script=sci_issuetoc&pid=0031-104920110013&lng=en&nrm=iso
- ALDRED, R.G.; Nixon, M. & Young, J.Z. 1983. Cirrothauma murrayi Chun, a finned octopod. Philosophical Transactions of the Royal Society of London B, 301:1-54.
- ARKHIPKIN, A.I. & Laptikhovsky, V.V. 2010. Observation of penis elongation in Onykia ingens: implications for spermatophore transfer in deep-water squid. Journal of Molluscan Studies, 76(3):299-300.
- ARNOLD, J.M. 1984. Cephalopods. In: Wilbur, K.M. (Ed.), The Mollusca. Academic Press, San Diego, v. 3, p. 419-454.
- AUSTIN, C.R.; Lutwak-Mann, C. & Mann, T. 1964. Spermatophores and spermatozoa of the squid Loligo pealii. Proceedings of the Royal Society of London B, 161:143-152.
- BADENHORST, J.H. 1974. The morphology and histology of the male genital system of the squid Loligo reynaudii (d'Orbigny). Annale Universiteit van Stellenbesch, 49:1-36.
- BLANCQUAERT, T. 1923. Une sécrétion cristalliforme dans la glande à spermatophores des Céphalopodes. Comptes rendus de la Société de Biologie, 89:440-443.
- BLANCQUAERT, T. 1925. L'origine et la formation des spermatophores chez les céphalopodes décapodes. Cellule, 36:315-356.
- BOLSTAD, K.S. 2008. Systematics of the Onychoteuthidae Gray, 1847 (Cephalopoda: Oegopsida). (Ph.D. Dissertation). Auckland University of Technology, Auckland.
- BRUSCA, R.C. & Brusca, G.J. 2007. Invertebrados. 2Ş ed. Guanabara Koogan, Rio de Janeiro, 968p.
- DINGERKUS, G. & Uhler, L.D. 1977. Enzyme clearing of alcian blue stained whole small vertebrates for demonstration of cartilage. Stain Technology, 52(4):229-232.
- DREW, G.A. 1911. Sexual activities of the squid, Loligo pealii. I. Copulation, egg-laying and fertilization. Journal of Morphology, 22:327-359.
- DREW, G.A. 1919a. Sexual activities of the squid, Loligo pealii. II. The spermatophore; its structure, ejaculation and formation. Journal of Morphology, 32:379-435.
- DREW, G.A. 1919b. The structure and ejaculation of the spermatophores of Octopus americana. Papers from the Department of Marine Biology of the Carnegie Institution of Washington, 13:35-47.
- DURWARD, R.D.; Vessey, E.; O'Dor, R.K. & Amaratunga, T. 1980. Reproduction in the squid, Illex illecebrosus: first observations in captivity and implications for the life cycle. ICNAF Selected Papers, 6:7-13.
- DUVERNOY, G.L. 1853. Fragments sur les organes de génération de divers animaux. Quatrième fragment. Des spermaphores dans la Sépiole de Rondelet et dans le Calmar subulé, et des organes qui les produisent dans ces deux espèces et dans plusieurs autres Céphalopodes; de leur composition par ces organes, et de leur décomposition dans l'eau et dans les organes sexuels des femelles. Mémoires de l'Académie des Sciences de l'Institute de France, 23:215-281.
- FIELDS, W.G. 1965. The structure, development, food relations, reproduction, and life history of the squid Loligo opalescens Berry. Fish Bulletin, 131:1-108.
- FORT, G. 1937. Le spermatophore des céphalopodes. Étude du spermatophore d'Eledone cirrhosa (Lamarck, 1799). Bulletin Biologique de la France et de la Belgique, 71:357-373.
- FORT, G. 1941. Le spermatophore des céphalopodes. Étude du spermatophore d'Eledone moschata (Lamarck, 1799). Bulletin Biologique de la France et de la Belgique, 75:249-256.
- FROESCH, D. & Marthy H.J. 1975. The structure and function of the oviductal gland in octopods (Cephalopoda). Proceedings of the Royal Society of London B, 188:95-101.
- GUERRA, A.; Gonzalez, A.F.; Dawe, E.G. & Rocha, F. 2004. Records of giant squid in the north-eastern Atlantic, and two records of male Architeuthis sp. off the Iberian Peninsula. Journal of the Marine Biological Association of the United Kingdom, 84:427-431.
- HANLON, R.T. & Messenger, J.B. 1996. Cephalopod Behaviour. Cambridge University Press, Cambridge, 232p.
- HANLON, R.T.; Ament, S.A. & Gabr, H. 1999. Behavioral aspects of sperm competition in cuttlefish, Sepia officinalis (Sepioidea: Cephalopoda). Marine Biology, 134:719-728.
- HANSON, D.; Mann, T. & Martin, A.W. 1973. Mechanism of the spermatophoric reaction in the giant octopus of the North Pacific, Octopus dofleini martini. The Journal of Experimental Biology, 58:711-723.
- HAVEN, N. 1977. Cephalopoda: Nautiloidea. In: Giese, A.C. & Pearse, J.S. (Eds.), Reproduction of Marine Invertebrates. Academic Press, New York, v. 4, p. 227-241.
- HESS, S.C. 1987. Comparative morphology, variability, and systematic applications of cephalopod spermatophores (Teuthoidea and Vampyromorpha). (Ph.D. Dissertation). University of Miami, Coral Gables, FL.
- HOVING, H.J.T. & Laptikhovsky, V. 2007. Getting under the skin: autonomous implantation of squid spermatophores. Biological Bulletin, 212:177-179.
- HOVING, H.J.T.; Laptikhovsky, V.; Piatkowski, U. & Önsoy, B. 2008b. Reproduction in Heteroteuthis dispar (Rüppell, 1844) (Mollusca: Cephalopoda): a sepiolid reproductive adaptation to an oceanic lifestyle. Marine Biology, 154:219-230.
- HOVING, H.J.T.; Lipinski, M.R. & Videler, J.J. 2008a. Reproductive system and the spermatophoric reaction of the mesopelagic squid Octopoteuthis sicula (Rüppell, 1844) (Cephalopoda: Octopoteuthidae) from southern African waters. African Journal of Marine Science, 30:603-612.
- HOVING, H.J.T.; Lipinski, M.R.; Videler, J.J. & Bolstad, K.S. 2010. Sperm storage and mating in the deep-sea squid Taningia danae Joubin, 1931 (Oegopsida: Octopoteuthidae). Marine Biology, 157:393-400.
- HOVING, H.J.T.; Nauwelaerts, S.; Van Genne, B.; Stamhuis, E.J. & Zumholz, K. 2009. Spermatophore implantation in Rossia moelleri Steenstrup, 1856 (Sepiolidae; Cephalopoda). Journal of Experimental Marine Biology and Ecology, 372:75-81.
- HOVING, H.J.T.; Roeleveld, M.A.C.; Lipinski, M.R. & Melo, Y. 2004. Reproductive system of the giant squid Architeuthis in South African waters. Journal of Zoology, 264:153-169.
- JACKSON, G.D. & Jackson, C.H. 2004. Mating and spermatophore placement in the onychoteuthid squid Moroteuthis ingens. Journal of the Marine Biological Association of the United Kingdom, 84:783-784.
- JACKSON, G.D. & O'Shea, S. 2003. Unique hooks in the male scaled squid Lepidoteuthis grimaldi. Journal of the Marine Biological Association of the United Kingdom, 83:1099-1100.
- LUM-KONG, A. 1992. A histological study of the accessory reproductive organs of female Loligo forbesi (Cephalopoda: Loliginidae). Journal of Zoology, 226:469-490.
- MANGOLD, K. 1987. Reproduction. In: Boyle, P.R. (Ed.), Cephalopod life cycles. Academic Press, London, v. 2, p. 157-200.
- MANGOLD, K. 1989. Organes génitaux. In: Grassé, P. (Ed.), Traité de Zoologie. Anatomie, Systématique, Biologie. Masson, Paris, t. 5, f. 4, p. 459-492.
- MANGOLD-WURZ, K. 1963. Biologie des céphalopodes benthiques et nectoniques de la Mer Catalane. Vie et Milieu (Supplement), 13:1-285.
- MANN, T. 1984. Spermatophores. Development, structure, biochemical attributes and role in transfer of spermatozoa. Zoophysiology. Springer-Verlag, Berlin, v. 15, 217p.
- MANN, T.; Martin, A.W. & Thiersch, J.B. 1966. Spermatophores and spermatophoric reaction in the giant octopus of the North Pacific, Octopus dofleini martini. Nature, 211:1279-1282.
- MANN, T.; Martin, A.W. & Thiersch, J.B. 1970. Male reproductive tract, spermatophores and spermatophoric reaction in the giant octopus of the North Pacific, Octopus dofleini martini. Proceedings of the Royal Society B, 175:31-61.
- MARCHAND, W. 1913. Studien über Cephalopoden II. Über die Spermatophoren. Zoologica, Stuttgart, 26:171-200.
- MARIAN, J.E.A.R. 2011. Perforating potential of loliginid spermatophores. Journal of Molluscan Studies, 77:98-100.
- MARTINS, R.S. & Perez, J.A.A. 2010. A new record of giant squid Architeuthis sp. (Cephalopoda: Oegopsida) in Brazilian waters. Zoologia, 26(4):613-623.
- MCSWEENY, E.S. 1978. Systematics and morphology of the Antarctic cranchiid squid Galiteuthis glacialis (Chun). Antarctic Research Series, 27:1-39.
- MILNE-EDWARDS, M. 1842. Observations sur la structure et les fonctions de quelques zoophytes, mollusques et crustacées des côtes de la France. IV. Sur les spermatophores des céphalopodes. Annales des Sciences Naturelles, 18:331-347.
- MÜLLER, H. 1853. Ueber das Männchen von Argonauta argo und die Hectocotylen. Zeitschirift für Wissenschaftliche Zoologie, 4:1-35.
- MURATA, M.; Ishii, M. & Osako, M. 1982. Some Information on copulation of the oceanic squid Onychoteuthis borealijaponica Okada. Bulletin of the Japanese Society of Scientific Fisheries, 48:351-354.
- NAEF, A. (1921-23). Die Cephalopoden (Systematik). Fauna e Flora del Golfo di Napoli, 35:1-863.
- NESIS, K.N. 1987. Cephalopods of the World. THF Publications, Neptune City, 351p.
- NESIS, K.N. 1995. Mating, spawning, and death in oceanic cephalopods: a review. Ruthenica, 6:23-64.
- NESIS, K.N.; Nigmatullin, Ch.M. & Nikitina, I.V. 1998. Spent females of deepwater squid Galiteuthis glacialis under the ice at the surface of the Weddell Sea (Antarctic). Journal of Zoology, 244:185-200.
- NORMAN, M.D. & Lu, C.C. 1997. Sex in giant squid. Nature, 389:683-684.
- O'DOR, R.K. & Macalaster, E.G. 1983. Bathypolypus articus. In: Boyle, P.R. (Ed.), Cephalopod Life Cycles. Academic Press, London, v. 1, p. 401-410.
- O'DOR, R.K. 1983. Illex illecebrosus. In: Boyle, P.R. (Ed.), Cephalopod Life Cycles. Academic Press, London, v. 1, p. 175-199.
- OORDT, G.J. 1938. The spermatheca of Loligo vulgaris. I. Structure of the spermatheca and function of its unicellular glands. Quarterly Journal of Microscopical Science, 80:593-599.
- ORELLI, M. von. 1962. Die Übertragung der Spermatophore von Octopus vulgaris und Eledone (Cephalopoda). Revue suisse de Zoologie, 69:193-202.
- ÖZBEK, S.; Balasubramanian, P.G. & Holstein, T.W. 2009. Cnidocyst structure and the biomechanics of discharge. Toxicon, 54:1038-1045.
- PEREZ, J.A.A.; Haimovici, M. & Cousin, J.C.B. 1990. Sperm storage mechanisms and fertilization in females of two South American eledonids (Cephalopoda: Octopoda). Malacologia, 32:147-154.
- PICKFORD, G.E. 1949. Vampyroteuthis infernalis Chun an archaic dibranchiate cephalopod. II. External anatomy. Dana-Report, 32:1-132.
- PUJALS, M.A. 1978. Microanatomía del espermatóforo de Octopus tehuelchus d'Orbigny (Mollusca: Cephalopoda). Neotropica, 24:51-55.
- RACOVITZA, E.G. 1894a. Notes de biologie. I. Accouplement et fécondation chez l'Octopus vulgaris Lam. Archives de Zoologie Expérimentale et Générale, 2:23-49.
- RACOVITZA, E.G. 1894b. Notes de biologie. III. Moeurs et reproduction de la Rossia macrosoma (D. Ch.). Archives de Zoologie Expérimentale et Générale, 2:491-539.
- ROPER, C.F. & Voss G.L. 1983. Guidelines for taxonomic descriptions of cephalopod species. Memoirs of the National Museum of Victoria, 44:49-63.
- RUPPERT, E.E.; Fox, R.S. & Barnes, R.D. 2005. Zoologia dos Invertebrados: uma abordagem funcional-evolutiva. 7Ş ed., Roca, São Paulo, 1145p.
- SWAMMERDAM J. 1738. Biblia Naturae, Tomus II. Isaak Severinus, Boudewyn Vander & Pieter Vander, Leiden. (Descrição do espermatóforo, em latim, nas págs. 896 e 897; ilustrações na prancha LII, Figs. VI e VII).
- TAKAHAMA, H.; Kinoshita, T.; Sato, M. & Sasaki, F. 1991. Fine structure of the spermatophores and their ejaculated forms, sperm reservoirs, of the japanese common squid, Todarodes pacificus. Journal of Morphology, 207:241-251.
- VÉRANY, J.B. & Vogt, C. 1852. Mémoire sur les hectocotyles et les males de quelques céphalopodes. Annales des Sciences Naturelles, 3 Série Zoologie, 17:147-188.
- VILLANUEVA, R. 1992. Continuous spawning in the cirrate octopods Opisthoteuthis agassizi and O. vossi: features of sexual maturation defining a reproductive strategy in cephalopods. Marine Biology, 114:265-275.
- WEILL, R. 1927. Recherches sur la structure, la valeur systématique et le fonctionnement du spermatophore de Sepiola atlantica d'Orb. Bulletin Biologique de la France et de la Belgique, 61:59-92.
- WELLS, M.J. & Wells, J. 1972. Sexual displays and mating of Octopus vulgaris Cuvier and O. cyanea Gray and attempts to alter performance by manipulating the glandular condition of the animals. Animal Behaviour, 20:293-308.
- WODINSKY, J. 2008. Reversal and transfer of spermatophores by Octopus vulgaris and O. hummelincki. Marine Biology, 155:91-103.
- YOUNG, R.E.; Vecchione, M. & Mangold, K.M. 2008. Cephalopoda Cuvier 1797. Version 21 April 2008. Available at: <http://tolweb.org/Cephalopoda/19386/2008.04.21 in The Tree of Life Web Project, http://tolweb.org>
APÊNDICE 1
Architeuthis Steenstrup, 1857
Argonauta Linnaeus, 1758
Callistoctopus macropus (Risso, 1826)
Doryteuthis opalescens (Berry, 1911)
Doryteuthis pealeii (Lesueur, 1821)
Doryteuthis plei (Blainville, 1823)
Eledone cirrhosa (Lamarck, 1798)
Eledone moschata (Lamarck, 1798)
Enteroctopus dofleini (Wülker, 1910)
Galiteuthis glacialis (Chun, 1906)
Illex coindetii (Vérany, 1839)
Loligo vulgaris Lamarck, 1798
Macrotritopus defilippi (Vérany, 1851)
Octopoteuthis sicula Rüppel, 1844
Octopus vulgaris Cuvier, 1797
Ocythöe Rafinesque, 1814
Onykia ingens (Smith, 1881)
Rossia macrosoma (delle Chiaje, 1830)
Rossia moelleri Steenstrup, 1856
Sepia Linnaeus, 1758
Sepia officinalis Linnaeus, 1758
Sepiola atlantica d'Orbigny, 1839
Sepiola rondeleti Leach, 1817
Taningia danae Joubin, 1931
Todarodes pacificus (Steenstrup, 1880)
Tremoctopus delle Chiaje, 1830
Vampyroteuthis infernalis Chun, 1903
Datas de Publicação
-
Publicação nesta coleção
02 Ago 2011 -
Data do Fascículo
2011
Histórico
-
Recebido
18 Jan 2011 -
Aceito
09 Jun 2011