Resumos
Amostragens de morcegos na região neotropical geralmente, contêm poucas espécies insetívoras. Apesar da elevada riqueza de morcegos insetívoros, o uso de rede de neblina resulta em baixa captura dessa guilda. As mais comumente amostradas no sudeste do Brasil são Molossus molossus, Molossus rufus e Myotis nigricans, mesmo representados por reduzido número de capturas são capturados próximos aos seus refúgios. Apesar de ser conhecida a preferência de espécies de morcegos insetívoros por ambientes ripários, poucos estudos têm explorado esses ambientes. O objetivo deste trabalho é analisar a riqueza de morcegos insetívoros em 31 lagoas no Estado do Rio de Janeiro usando redes de neblina. Em 1.995 horas de esforço de coleta, foram obtidas 2.159 capturas de 26 espécies exclusivamente ou parcialmente insetívoras. Oito espécies foram capturadas somente sobre as lagoas. A espécie mais frequente foi Myotis nigricans. Foi observado que as lagoas margeadas de florestas se mostraram ricas. A riqueza de espécies de morcegos nas lagoas não se diferenciou pela presença ou não de vegetação aquática e entre as lagoas salobras e doces. A amostragem em lagoas de tamanho médio ou grande e próximas a áreas residenciais podem ser as mais produtivas para a captura de espécies insetívoras. Três espécies amostradas são raramente citadas em inventários faunísticos: Macrophyllum macrophyllum, Lophostoma brasiliensis e Thyroptera tricolor. A realização de coletas com redes de neblina abertas sobre águas calmas foi mais representativa de morcegos insetívoros e pode resultar em uma melhor amostragem da assembleia de morcegos.
Ambiente ripário; Amostragem; Assembleia; Riqueza
Bat samplings in Neotropical region usually contain few insectivorous species. Despite the high richness of insectivorous bats, the use of mist nets results in low efficiency of this guild. The most commonly sampled in southeastern Brazil are Molossus molossus, Molossus rufus and Myotis nigricans but even represented by small number of captures and in general netted in proximity of its roosts. Although being known the preference of species of insectivorous bats by riparian habitats, few studies have explored until now the water. The aim of this study is to analyze the richness of insectivorous bats over 31 ponds in the State of Rio de Janeiro using mist nets. After 1,995 hours of sampling effort, we obtained 2,159 captures of 26 strictly and partially insectivorous species. Eight species were captured only over the ponds. The most frequent species was Myotis nigricans. Ponds with forested margins showed higher richness. Species richness in the ponds did not differ by presence or absence of aquatic vegetation and brackish ponds among that without communication with the sea. The sampling in ponds of medium size or large and close to residential areas maybe the most productive for the capture of insectivorous. Three sampled species are rarely cited in faunal inventories: Macrophyllum macrophyllum, Lophostoma brasiliensis and Thyroptera tricolor. Samplings with mist nets opened over calm waters were more representative of the insectivorous guild and result in a better sampling of the assembly of bats.
Riparian habitats; Sampling; Assembly; Richness
Riqueza de morcegos insetívoros em lagoas no Estado do Rio de Janeiro, Brasil
Luciana de Moraes CostaI,II; Júlia Lins LuzI; Carlos Eduardo Lustosa EsbérardI
ILaboratório de Diversidade de Morcegos, Instituto de Biologia, Universidade Federal Rural do Rio de Janeiro. Antiga estrada Rio-São Paulo, km 47, Caixa Postal 74.507, CEP 23890-000, Seropédica, Rio de Janeiro, RJ, Brasil
IIPrograma de Pós-Graduação em Ecologia e Evolução, Departamento de Ecologia, Instituto de Biologia, Universidade do Estado do Rio de Janeiro. Rio de Janeiro, RJ, Brasil. E-mail: lucianamcosta@yahoo.com.br
RESUMO
Amostragens de morcegos na região neotropical geralmente, contêm poucas espécies insetívoras. Apesar da elevada riqueza de morcegos insetívoros, o uso de rede de neblina resulta em baixa captura dessa guilda. As mais comumente amostradas no sudeste do Brasil são Molossus molossus, Molossus rufus e Myotis nigricans, mesmo representados por reduzido número de capturas são capturados próximos aos seus refúgios. Apesar de ser conhecida a preferência de espécies de morcegos insetívoros por ambientes ripários, poucos estudos têm explorado esses ambientes. O objetivo deste trabalho é analisar a riqueza de morcegos insetívoros em 31 lagoas no Estado do Rio de Janeiro usando redes de neblina. Em 1.995 horas de esforço de coleta, foram obtidas 2.159 capturas de 26 espécies exclusivamente ou parcialmente insetívoras. Oito espécies foram capturadas somente sobre as lagoas. A espécie mais frequente foi Myotis nigricans. Foi observado que as lagoas margeadas de florestas se mostraram ricas. A riqueza de espécies de morcegos nas lagoas não se diferenciou pela presença ou não de vegetação aquática e entre as lagoas salobras e doces. A amostragem em lagoas de tamanho médio ou grande e próximas a áreas residenciais podem ser as mais produtivas para a captura de espécies insetívoras. Três espécies amostradas são raramente citadas em inventários faunísticos: Macrophyllum macrophyllum, Lophostoma brasiliensis e Thyroptera tricolor. A realização de coletas com redes de neblina abertas sobre águas calmas foi mais representativa de morcegos insetívoros e pode resultar em uma melhor amostragem da assembleia de morcegos.
Palavras-Chave: Ambiente ripário; Amostragem; Assembleia; Riqueza.
ABSTRACT
Bat samplings in Neotropical region usually contain few insectivorous species. Despite the high richness of insectivorous bats, the use of mist nets results in low efficiency of this guild. The most commonly sampled in southeastern Brazil are Molossus molossus, Molossus rufus and Myotis nigricans but even represented by small number of captures and in general netted in proximity of its roosts. Although being known the preference of species of insectivorous bats by riparian habitats, few studies have explored until now the water. The aim of this study is to analyze the richness of insectivorous bats over 31 ponds in the State of Rio de Janeiro using mist nets. After 1,995 hours of sampling effort, we obtained 2,159 captures of 26 strictly and partially insectivorous species. Eight species were captured only over the ponds. The most frequent species was Myotis nigricans. Ponds with forested margins showed higher richness. Species richness in the ponds did not differ by presence or absence of aquatic vegetation and brackish ponds among that without communication with the sea. The sampling in ponds of medium size or large and close to residential areas maybe the most productive for the capture of insectivorous. Three sampled species are rarely cited in faunal inventories: Macrophyllum macrophyllum, Lophostoma brasiliensis and Thyroptera tricolor. Samplings with mist nets opened over calm waters were more representative of the insectivorous guild and result in a better sampling of the assembly of bats.
Key-Words: Riparian habitats; Sampling; Assembly; Richness.
INTRODUÇÃO
O Estado do Rio de Janeiro possui pelo menos 77 espécies de morcegos, das quais 51 apresentam hábito exclusivamente ou parcialmente insetívoro (Peracchi & Nogueira, 2010). Apesar dessa variedade, as espécies insetívoras são, geralmente, pouco capturadas e raramente incluídas em inventários de quirópteros (Voss & Emmons, 1996; Simmons & Voss, 1998; Esbérard, 2004; Esbérard & Bergallo, 2005a). As espécies insetívoras mais comumente amostradas em inventários no sudeste do Brasil, são Molossus molossus (Pallas, 1766), Molossus rufus E. Geoffroy, 1805 e Myotis nigricans (Schinz, 1821) (Esbérard, 2004). Mesmo essas espécies, quando presentes, estão geralmente representadas por reduzido número de indivíduos (Peracchi & Albuquerque, 1971, 1986, 1993; Reis & Muller, 1995; Reis et al., 1996; Baptista & Mello, 2001; Bernard et al., 2001; Dias et al., 2002; Esbérard, 2003; Esbérard et al., 2006; Dias & Peracchi, 2008). No entanto, um elevado número de exemplares pode ser facilmente observado ou detectado pelos seus sons em vários ambientes (Almeida et al., 2007).
Morcegos insetívoros podem evitar as redes de neblina armadas em trilhas durante seu deslocamento natural devido ao sistema de ecolocalização apurado, detectando as redes de neblina mais facilmente (Simmons & Voss, 1998) ou por voarem acima da posição das redes quando essas são armadas junto ao solo (Findley, 1993). No entanto, algumas pequenas coleções de água podem concentrar elevado número de morcegos sobrevoando o local para ingerir água e presas (Tuttle, 1976; Chung-Maccoubrey, 1995; Adams & Simmons, 2002). A realização de coletas com redes de neblina sobre essas coleções de água pode resultar em elevada eficiência de captura de morcegos insetívoros (Tuttle, 1976; Esbérard, 2003), superior à observada em redes armadas em trilhas ao nível do solo (Esbérard, 2003; Lourenço et al., 2010).
A ideia de que as assembleias neotropicais são dominadas por uma espécie de hábito frugívoro tem prevalecido desde a aplicação das redes de neblina no estudo de morcegos. Contudo, alguns estudos realizados a partir da década de 1970 em regiões temperadas têm demonstrado que a eficiência de captura de morcegos insetívoros é maior quando são utilizadas redes de neblina sobre a água (Tuttle, 1976; Kunz & Kurta, 1990) e que os morcegos insetívoros podem exceder em número de indivíduos os frugívoros em algumas localidades (Esbérard, 2003; Lourenço et al., 2010).
Muitas espécies de morcegos insetívoros forrageiam preferencialmente junto a margens de rios ou sobre lagoas, especialmente porque esses ambientes apresentam elevada densidade de insetos e também por serem pouco complexos, sem obstáculos, minimizando os possíveis ecos e facilitando a detecção de presas através da ecolocalização (Fenton & Bell, 1979; Fenton et al., 1983; Frenckell & Barclay, 1987). Algumas características desses habitats, como por exemplo, o barulho da água em movimento de rios mais turbulentos ou encachoeirados pode interferir na capacidade de algumas espécies em detectar as presas (Frenckell & Barclay, 1987). Dessa forma, a presença de algumas espécies de morcegos pode estar associada a corpos de águas mais calmos (Fenton et al., 1983; Frenckell & Barclay, 1987; Grindal et al., 1999; Lourenço et al., 2010), pois esses ambientes facilitariam a obtenção de recursos, já que apresentam estrutura mais homogênea e simplificada.
Apesar de ser conhecida a preferência de várias espécies de morcegos insetívoros por lagoas, poucos estudos têm explorado esses ambientes. No Brasil, poucos trabalhos optaram pelo uso de redes de neblina armadas sobre coleções de águas calmas. O objetivo deste trabalho foi analisar a riqueza de morcegos insetívoros em 31 lagoas no Estado do Rio de Janeiro procurando responder as seguintes questões: (i) Maior riqueza de espécies insetívoras é observada nas maiores lagoas? (ii) Lagoas margeadas de florestas podem apresentar maior riqueza de insetívoros? (iii) Aspectos como presença de vegetação aquática, salinidade da água e tipo de ambiente podem explicar as diferenças observadas entre as lagoas? (iv) Lagoas menores são usadas por menores morcegos?
MATERIAL E MÉTODOS
Como parte de um inventário de longa duração no Estado do Rio de Janeiro, foram realizadas, entre os anos de 1989 e 2008, amostragens em 20 localidades (Fig. 1) com a presença de corpos d'água, totalizando 31 lagoas artificiais ou naturais. O estudo incluiu lagos artificiais para exposição de aves, criação de peixes ornamentais e comerciais, represamentos artificiais para captações de água, piscinas naturais e lagoas naturais, que, neste trabalho, serão doravante genericamente denominadas de lagoas.
Cada lagoa foi classificada quanto à área alagada em pequenas (até 100 m2), médias (de 101 até 500 m2), grandes (de 501 a 1.000 m2) ou muito grandes (maiores que 1.000 m2). A área foi estimada medindo-se o maior comprimento e multiplicando pela maior largura, independente da forma apresentada.
As lagoas foram classificadas quanto a existência de floresta nas margens (até 20 m do espelho d'água) como ausente ou presente considerando o número de margens (de 0 a 4), ausência ou presença de vegetação aquática (macrófitas) e salinidade da água (salobra ou doce). O ambiente em que cada lagoa se encontrava foi definido como Unidade de Conservação Ambiental (quando estava inserido em uma Unidade de Conservação sem a presença de construções humanas próximas), como rural (presença de gado e pasto) e como urbano (presença de construções humanas) (Tabela 1).
Os morcegos foram capturados com redes de neblina armadas sobre espelho d'água até onde a profundidade permitiu o acesso dos pesquisadores para a remoção dos morcegos e não necessariamente por toda a extensão da lagoa. As redes permaneceram abertas do pôr-do-sol até o amanhecer para incrementar a captura de espécies raras (Esbérard & Bergallo, 2005b), exceto quando as condições climáticas não permitiram. As redes foram vistoriadas continuamente ou a intervalos de 15 a 20 minutos, como recomendado por Kunz & Kurta (1990). As coletas foram realizadas a intervalos variáveis, geralmente maiores que um ciclo lunar, para evitar o efeito do aprendizado da posição das redes pelos morcegos (Esbérard, 2006). As coletas foram agendadas independentemente da fase do ciclo lunar, não sendo dada preferência às noites de lua nova (Esbérard, 2007).
A cada noite, de uma a dez redes de neblina foram armadas na margem e sobre o espelho d'água. O esforço de coleta variou em cada lagoa. Nas lagoas pequenas houve de uma a três noites de coleta, até quatro noites em lagoas médias, até nove noites em lagoas grandes e nas lagoas muito grandes até 13 noites de coleta. Cinco lagoas, duas médias e três muito grandes, foram amostradas por longo prazo (15 a 29 noites) por apresentarem elevada densidade de morcegos insetívoros. Essas lagoas foram comparadas quanto a riqueza estimada usando a rarefação com 1.000 aleatorizações, considerando-se 50 capturas, usando o programa Past versão 2.00 (Hammer et al., 2001).
Os animais capturados após o ano de 1997 foram marcados através do uso de coleiras plásticas providas de cilindros coloridos (Esbérard & Daemon, 1999). Furos no dactilopatágio ("punch-marking") (Bonaccorso & Smythe, 1972), foram usados antes de 1997 e para as espécies com peso menor ou igual a cinco gramas. Os animais capturados foram soltos no mesmo local, exceto por alguns exemplares, que foram tombados como material testemunho na coleção de referência do Laboratório de Diversidade de Morcegos, depositada no Instituto de Biologia, Universidade Federal Rural do Rio de Janeiro. Os morcegos foram identificados no campo (Vizotto & Taddei, 1973; Gregorin & Taddei, 2002; Rocha, 2008). Parte do material testemunho foi encaminhada para especialistas quando a identificação não foi possível em campo ou laboratório.
Foram consideradas como espécies insetívoras todas as espécies das famílias Emballonuridae, Vespertilionidae, Thyropteridae e Molossidae (Kalko et al., 1996). A espécie Noctilio leporinus (Linnaeus, 1758) da família Noctilionidae também foi incluída como insetívora por possuir hábito alimentar piscívoro e insetívoro (Willig, 1985; Nowak, 1991; Brooke, 1994, 1997; Zórtea & Aguiar, 2001). Também foram incluídas como insetívoras as espécies da subfamília Phyllostominae (Gardner, 1977; Kalko et al., 1996). As maiores espécies dessa subfamília podem apresentar hábito alimentar tanto carnívoro como insetívoro e algumas espécies tendem a onivoria (McNab, 2003), mas empregam estratégia de catador ("gleaner"), capturando grandes insetos pousados principalmente no substrato ou sobre a vegetação (Kalko et al., 1996).
Para cada localidade onde estão as lagoas, foi calculada a riqueza total de espécies de morcegos (riqueza nas redes armadas na lagoa e em outros sítios amostrados da mesma localidade) e o total de espécies insetívoras capturadas apenas nas redes armadas sobre o espelho d'água.
Foram testadas possíveis relações entre a área de cada lagoa, presença de floresta, o número de espécies insetívoras capturadas e o peso médio de todas as espécies insetívoras capturadas em cada lagoa. Para isso calculou-se a regressão linear (Zar, 1999).
As espécies capturadas foram classificadas de acordo com o peso corporal em classes de cinco gramas, visto que a menor espécie capturada (Thyroptera tricolor Spix, 1823) apresenta peso médio pouco inferior a cinco gramas, para analisar se o peso médio das espécies capturadas em cada lagoa varia com tamanho da área alagada. A diferença entre o tipo de ambiente (rural, urbano e Unidade de Conservação Ambiental) foi analisada.
O teste de Kruskal-Wallis foi usado para testar possíveis diferenças no número de espécies de morcegos insetívoros entre as lagoas que possuiam vegetação aquática ou não e entre as lagoas com água doce ou salobra, utilizando o programa Systat 11.0.
RESULTADOS
Neste trabalho, o esforço de coleta correspondeu a um total de 1.995 horas em 198 noites de coleta, com a utilização de 9.122 metros de redes e 22.805 m2. Sobre as lagoas foi obtido um total de 2.159 capturas de 26 espécies insetívoras de morcegos. Dentre essas espécies, uma pertence à família Emballonuridae, uma à Noctilionidae, sete à Phyllostomidae, uma à Thyropteridae, nove à Vespertilionidae e sete à Molossidae. Oito espécies foram capturadas somente em redes armadas sobre as lagoas: Micronycteris minuta (Gervais, 1856), Macrophyllum macrophyllum (Schinz, 1821), Lophostoma brasiliensis (Peters, 1866), Lasiurus cinereus (Beauvois, 1796), Eumops auripendulus (Schaw, 1800), Nyctinomops laticaudatus (E. Geoffroy, 1805), Nyctinomops macrotis (Gray, 1840) e Tadarida brasiliensis (I. Geoffroy, 1824) (Tabela 2).
A espécie que ocorreu em mais lagoas foi M. nigricans em 71% das lagoas, seguida por Myotis riparius Handley, 1960, presente em 58% das lagoas e M. molossus presente em 45% das lagoas amostradas. Seis espécies foram coletadas apenas em uma lagoa: M. minuta, Phyllostomus discolor Wagner, 1843, M. macrophyllum, L. brasiliensis, T. tricolor e T. brasiliensis (Tabela 3).
A riqueza variou de uma a 14 espécies de morcegos insetívoros por lagoa (média de 4,55 ± 3,18 espécies). As cinco lagoas com esforço elevado de amostragem apresentaram, com exceção de uma localidade, a riqueza total antes da 13ª noite de coleta. A rarefação nestes locais demonstrou que todas apresentam riqueza similar se consideradas as primeiras 50 capturas (de 5,10 ± 1,07 a 6,45 ± 0,87 espécies).
Seis localidades apresentaram riqueza muito elevada de morcegos insetívoros em relação às demais estudadas: Parque da Gávea com 14 espécies (45% da riqueza local), Ilha da Marambaia com 13 espécies (36%), Ilha da Gipóia (33%), Reserva Ecológica Rio das Pedras (30%), Parque Nacional da Tijuca (20%) e Reserva dos Trapicheiros (36%), com nove espécies (Tabela 4).
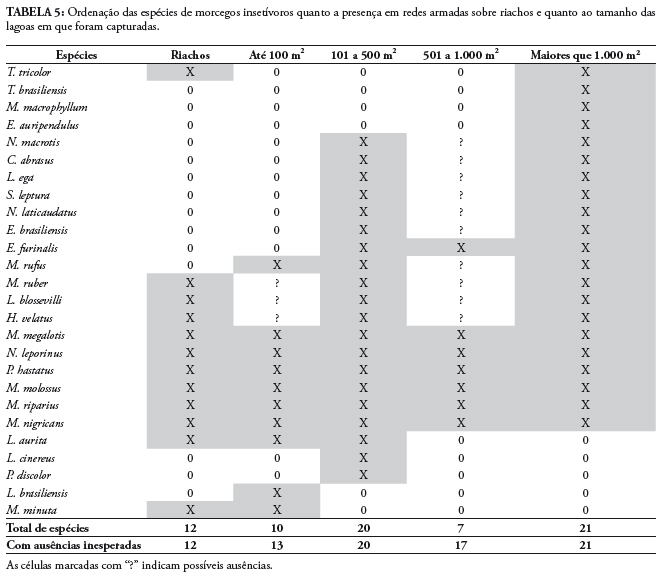
A riqueza de espécies insetívoras pode ser ordenada quanto ao tamanho das lagoas, sendo as maiores riquezas encontradas em lagoas com tamanho maiores que 1.000 m2 e lagoas de tamanho médio (de 101 até 500 m2), que apresentaram respectivamente 21 e 20 espécies de morcegos insetívoros. Seis espécies ocorreram em riachos e em todas as classes de tamanho das lagoas, enquanto 14 espécies ocorreram em lagoas, mas não foram capturadas em riachos (Tabela 5). Considerando as ausências inesperadas (aquelas presentes em tamanhos maiores e menores e ausentes em classes intermediárias) obtém-se de 13 a 21 espécies para os quatro tamanhos de lagoa, com 13 espécies encontradas nas pequenas lagoas até 21 espécies nas maiores lagoas (Tabela 5). A variação da riqueza de espécies insetívoras em relação ao tamanho da área alagada não foi significativa (r = 0,036, F = 0,034, p = 0,855, N = 30) (Fig. 2A).
As lagoas totalmente desprovidas de florestas próximas apresentaram de uma a sete espécies, e as lagoas próximas a florestas (com uma a até quatro das margens com floresta) apresentaram de uma a 12 espécies. Essa diferença foi positivamente e marginalmente significativa (r = 0,33, F = 3,64, p = 0,06, N = 31) (Fig. 2B), sugerindo que quanto mais inserida na floresta, maior a riqueza.
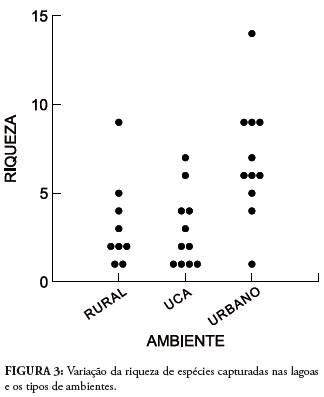
A riqueza variou com o tipo de ambiente, sendo observadas diferenças entre o ambiente rural e urbano (U = 0,616, p = 0,055), e entre Unidade de Conservação e urbano (U = 0,636, p = 0,017) (Fig. 3). No ambiente urbano (11 lagoas), a riqueza variou de uma a 14 espécies, com média de 6,91 ± 3,36 espécies, enquanto no ambiente rural (nove lagoas), a riqueza variou de uma a nove espécies, com média de 3,22 ± 2,54 espécies e nas Unidades de Conservação Ambiental (11 lagoas), a riqueza variou de uma a sete espécies, com média de 2,91 ± 2,12 espécies.
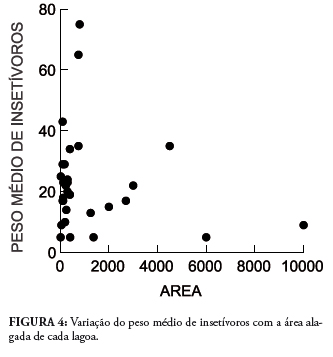
O peso médio das espécies capturadas em cada lagoa não variou com o tamanho da área alagada (r = 0,032, F = 0,93, p = 0,34, N = 31) (Fig. 4). Em termos de tamanho corpóreo, 61,50% das espécies possuía massa inferior a 15 gramas, sendo consideradas de pequeno porte. Já os maiores indivíduos foram de espécies que estão concentradas nas famílias Molossidae, Noctilionidae e Phyllostomidae (Fig. 5).
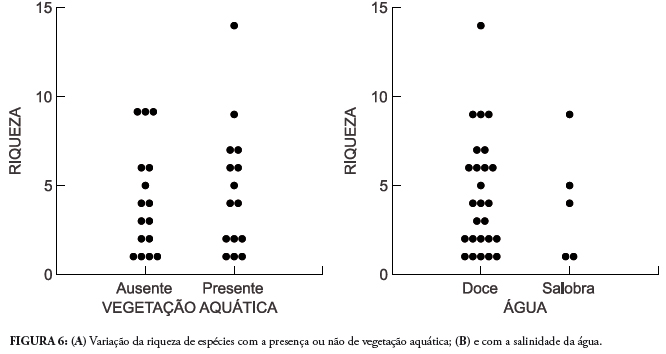
A riqueza de espécies não mostrou relação com a presença ou ausência de vegetação aquática (U = 110,00, p = 0,689, df = 1) (Fig. 6A) nem com a salinidade da água (U = 72,50, p = 0,684, df = 1) (Fig. 6B).
DISCUSSÃO
Os dados do presente estudo indicaram que as espécies insetívoras corresponderam de 6 a 47% da riqueza total de morcegos de cada local. Mostra-se elevada a riqueza de morcegos insetívoros que utilizam as lagoas para forrageio e ingestão de água, já tendo sido confirmadas 26 espécies (50,98%) das 51 que apresentam hábito exclusivamente ou parcialmente insetívoro (Peracchi & Nogueira, 2010). O número total de espécies insetívoras capturadas é muito mais elevado que o descrito frequentemente nas listagens de morcegos realizadas no Brasil. Isso se deve à restrição das coletas com redes de neblinas armadas unicamente em trilhas e bordas de florestas pelos demais autores, o que resulta em uma baixa representatividade das espécies insetívoras, sendo equivalente a menos de 5% do total da riqueza e menos de 1% do total das capturas (Lourenço et al., 2010). As três espécies de morcegos insetívoros mais frequentemente amostrados em inventários no sudeste e sul do Brasil, M. molossus, M. rufus e M. nigricans (Reis & Muller, 1995; Reis et al., 1996; Peracchi & Albuquerque, 1971, 1986, 1993; Baptista & Mello, 2001; Bernard et al., 2001; Dias et al., 2002; Esbérard, 2003), foram as espécies encontradas em mais de 75% das lagoas amostradas, confirmando que as espécies de insetívoros mais frequentes (e muito abundantes) podem ser capturadas, mesmo que pouco frequentemente em redes armadas em trilhas e bordas de florestas. Em 1.995 horas de esforço de coleta, foram obtidas 2.159 capturas de morcegos insetívoros, o que corresponde a 1,08 capturas a cada hora de coleta, valor superior ao observado em vários inventários realizados em áreas florestadas da Mata Atlântica (Esbérard, 2003; Dias & Peracchi, 2008).
Oito espécies de morcegos insetívoros capturadas em lagoas não foram observadas em outros sítios amostrados. Demonstra-se, assim, que é de grande importância o uso de redes de neblina armadas sobre a água e que este método pode apresentar resultados muito diferentes tanto em termos de riqueza de espécies da assembleia quanto em relação a abundância destas espécies (Lourenço et al., 2010).
Não foi comprovada uma relação positiva entre a área de cada lagoa e a riqueza de espécies insetívoras, mas as maiores riquezas de espécies (e a riqueza esperada pelas ausências) foram observadas em lagoas grandes e médias. Isso pode indicar que as lagoas maiores permitem que os morcegos manobrem mais facilmente durante o forrageio e, por isso, maior número de espécies as frequentam (Adams & Simmons, 2002). A elevada riqueza em lagoas de tamanho médio pode indicar que essas são usadas tanto por espécies que preferem lagoas menores quanto por espécies que usam lagoas maiores.
É senso comum que os morcegos insetívoros podem ser mais frequentes em ambientes ripários (Fenton & Bell, 1979; Fenton et al., 1983; Frenckell & Barclay, 1987; Barclay & Brigham, 1994; Grindal et al., 1999; Krusic et al., 1996), que consiste na interface entre florestas e lagoas. Neste trabalho foi observado que as lagoas margeadas de florestas se mostraram ricas em espécies insetívoras.
As lagoas menores e inteiramente inseridas na floresta apresentaram um elevado número de morcegos da família Vespertilionidae, que é representada pelas menores espécies. O ambiente extremamente complexo do sub-bosque pode limitar o tamanho das espécies, que possuem sistema de ecolocalização muito eficiente (Kalko et al., 1996) e espaços reduzidos podem limitar a capacidade de manobra de várias espécies, favorecendo as menores espécies. Mas neste trabalho não foram encontradas diferenças no tamanho médio das espécies com a área de cada lagoa.
Lagoas com vegetação aquática são mais produtivas em termos de concentração de matéria orgânica e podem sustentar maior diversidade de insetos, invertebrados aquáticos e peixes (Esteves et al., 2008) e, consequentemente, deveriam ser mais atrativas aos morcegos. Contudo, a riqueza de espécies de morcegos nas lagoas não se diferenciou pela presença ou não de vegetação aquática. Também não foram observadas diferenças entre as lagoas salobras e doces. Este resultado é inesperado, mas pode demonstrar que mais importante para a manutenção das espécies insetívoras é o tipo de possível presa encontrada nestes ambientes, supondo-se que os morcegos não ingerem espontaneamente água salgada ou salobra. Torna-se necessário a coleta concomitante de insetos e a estimativa de abundância desses em lagoas para permitir maiores considerações sobre os resultados observados com morcegos.
A riqueza em ambientes urbanos foi maior que a observada em ambientes rurais e Unidades de Conservação Ambiental. Maior número de espécies poderia ser esperado em ambientes bem conservados, como as Unidades de Conservação, mas além da disponibilidade de presas e de água, morcegos precisam de abrigos e, geralmente forrageiam na proximidade destes. Numerosas espécies de morcegos insetívoros das famílias Vespertilionidae e Molossidae utilizam residências e outras construções como refúgio no Brasil (Bredt et al., 1996; Esbérard et al., 1999), e a proximidade de refúgios pode ser relevante para a riqueza observada. Assim o ambiente urbanizado pode resultar em maior taxa de captura para espécies insetívoras, principalmente das espécies de Vespertilionidae e Molossidae.
A amostragem em lagoas de tamanho médio ou grande e próximas a áreas residenciais podem ser as mais produtivas para a captura de espécies insetívoras. Neste estudo três espécies amostradas são raramente citadas em inventários faunísticos: M. macrophyllum, que corresponde ao segundo registro dessa espécie no Estado do Rio de Janeiro, tendo o primeiro ocorrido há mais de 40 anos (Peracchi & Albuquerque, 1971, 1986); L. brasiliensis, que se trata do primeiro registro para esta unidade geopolítica (Mangolin et al., 2007) e uma extensão na distribuição geográfica em cerca de 500 km e T. tricolor, cujo registro anterior no Estado data de mais de 100 anos (Vieira, 1942, 1955; Esbérard et al., 2007).
Apesar do elevado esforço amostral, três espécies que devem usar uma ou mais das lagoas analisadas não foram amostradas: Furipterus horrens Cuvier, 1828, capturado no interior das ruínas do presídio Lazaredo, ao lado da foz do riacho amostrada na Praia Preta, Ilha Grande (Esbérard et al., 2006); Natalus stramineus Gray, 1838, capturado no interior de refúgio localizado no porão de residência abandonada ao lado de lagoa estacional, localizada em Miracema, noroeste do Estado do Rio de Janeiro, que não foi inserida nesta amostragem por estar, na época de coleta, temporariamente seca (Esbérard et al., 2010); Myotis albescens (E. Geoffroy, 1806), capturado em uma trilha no Parque da Gávea na Cidade do Rio de Janeiro, às margens de um riacho que deságua em uma lagoa artificial de tamanho médio.
Este trabalho demonstra a necessidade de um maior esforço amostral em lagoas de forma a obter uma maior riqueza de espécies de morcegos insetívoros, que não são comumente capturadas em redes de neblina. Além de obter maior riqueza de espécies, maior representatividade da guilda de insetívoros e maior abundância das espécies insetívoras, a realização de coletas sobre águas calmas pode resultar em uma melhor amostragem da assembleia de morcegos.
AGRADECIMENTOS
Financiamento da Fundação de Amparo a Pesquisa do Estado do Rio de Janeiro (FAPERJ - Processo E-26/170.449/07), Conselho Nacional de Desenvolvimento Científico (CNPq - Processo 301061/2007-6), Fundo de Conservação Ambiental/SMAC (Process 14/001.917/97), Instituto Biomas, SOS Mata Atlântica e Conservation International através do Projeto "Critical Ecosystem Partnership Fund" (CEPF - Aliança para Conservação da Mata Atlântica), e Laboratório de Ecologia de Vertebrados da Universidade Federal do Rio de Janeiro através do projeto "Rede Rio de Biodiversidade". Todos os procedimentos de coleta foram autorizados previamente pelo Instituto Brasileiro de Meio Ambiente (IBAMA), pelos proprietários das áreas ou da administração das Unidades de Conservação; as coletas foram realizadas sob licença de coleta permanente número 10351-1 (SISBIO) e pelo Instituto Brasileiro de Meio Ambiente (Processos 1755/89-SUPES/RJ/IBAMA e 4156/95-46 AC-SUPES/DF/IBAMA). H.G. Bergallo, A. Pires, D. Dias, H.R. Silva e A. Freitas que compuseram a banca de avaliação do mestrado de L.M. Costa. J.C. Almeida, L. Cristina, M.C. Enrici, A.F.P.D. Fernandes, D.S. França, L.A.C. Gomes, T. Jordão-Nogueira, E.C. Lourenço e A.G. Motta auxiliaram no trabalho em campo. D. Dias e A.L. Peracchi auxiliaram na identificação do material testemunho dos morcegos.
Recebido em: 25.04.2011
Aceito em: 11.01.2012
Impresso em: 30.03.2012
- Adams, R.A. & Simmons, J.A. 2002. Directionality of drinking passes by bats at water holes: is there cooperation? Acta Chiropterologica, 4:195-199.
- Almeida, H.; Ditchifield, A. & Tokumaru, R.S. 2007. Atividade de morcegos e preferência por habitats na zona urbana da Grande Vitória, ES, Brasil. Revista Brasileira de Zoociências, 9(2):13-18.
- Baptista, M. & Mello, M.A.R. 2001. Preliminary inventory of the bat species of the Poço das Antas Reserve, RJ. Chiroptera Neotropical, 7(1-2):133-135.
- Barclay, R.M.R. & Brigham, R.E. 1994. Constraints on optimal foraging: a field test of prey discrimination by echolocating insectivorous bats. Animal Behavior, 48:1013-1021.
- Bernard, E.; Albernaz, A.L.K.M. & Manusson, W.E. 2001. Bat species composition in three localities in the Amazon Basin. Studies on Neotropical Fauna and Environment, 36(3):177-184.
- Bonaccorso, F.J. & Smythe, N. 1972. Punch-Marking bats: An Alternative to Banding. Journal of Mammalogy, 53(3):389-390.
- Bredt, A.; Araújo, F.A.A.; Caetano-Júnior, J.; Rodrigues, M.G.R.; Yoshizawa, M.; Silva, M.M.S.; Harmani, N.M.S.; Massunaga, P.N.T.; Bürer, S.P.; Porto, V.A.R. & Uieda, W. 1996. Morcegos em áreas urbanas e rurais: manual de manejo e controle. Fundação Nacional de Saúde, Brasília.
- Brooke, A.P. 1994. Diet of fishing bat, Noctilio leporinus (Chiroptera: Noctilionidae). Journal of Mammalogy, 75(1):212-218.
- Brooke, A.P. 1997. Social organization and foraging behavior of the fishing bat, Noctilio leporinus (Chiroptera: Noctilionidae). Ethology, 103:421-436.
- Chung-Maccoubrey, A. 1995. Bat species composition and roost use in Pinyon-Juniper Woodlands of New Mexico. In: Barclay, M.R. & Brigham, M. Bats and forests symposium. Ministry of Forests Research Program, British Columbia, p. 118-123.
- Dias, D. & Peracchi, A.L. 2008. Quirópteros da Reserva Biológica do Tinguá, estado do Rio de Janeiro, sudeste do Brasil (Mammalia: Chiroptera). Revista Brasileira de Zoologia, 25(2):333-369.
- Dias, D.; Silva, S.S.P. & Peracchi, A.L. 2002. Quirópteros do Parque Estadual da Pedra Branca, Rio de Janeiro, RJ (Mammalia: Chiroptera). Revista Brasileira de Zoologia, 19(2):113-140.
- Esbérard, C.E.L. 2003. Diversidade de morcegos em uma área de Mata Atlântica regenerada no sudeste do Brasil (Mammalia: Chiroptera). Revista Brasileira de Zoociências, 5(2):189-204.
- Esbérard, C.E.L. 2004. Morcegos no Estado do Rio de Janeiro. (Tese de Doutorado), Universidade do Estado do Rio de Janeiro, Rio de Janeiro.
- Esbérard, C.E.L. 2006. Efeito da coleta de morcegos por noites seguidas no mesmo local. Revista Brasileira Zoologia, 23(4):1093-1096.
- Esbérard, C.E.L. 2007. Influência do ciclo lunar na captura de morcegos Phyllostomidae. Iheringia, Série Zoologia, 97(1):81-85.
- Esbérard, C.E.L. & Bergallo, H.G. 2005a. Research on bats in the state of Rio de Janeiro, Southeastern Brazil. Mastozoologia Neotropical, 12(2):237-243.
- Esbérard, C.E.L. & Bergallo, H.G. 2005b. Coletar morcegos por seis ou doze horas a cada noite? Revista Brasileira de Zoologia, 22(4):1095-1098.
- Esbérard, C.E.L. & Daemon, C. 1999. Novo método para marcação de morcegos. Chiroptera Neotropical, 5(1-2):116-117.
- Esbérard, C.E.L.; Baptista, M.; Costa, L.M.; Luz, J.L. & Lourenço, E.C. 2010. Morcegos de Paraíso do Tobias, Miracema, Rio de Janeiro. Biota Neotropica, 10(4):1-7.
- Esbérard, C.E.L.; Chagas, A.S. & Luz, E.M. 1999. Uso de residências por morcegos no Estado do Rio de Janeiro (Mammalia: Chiroptera). Revista Brasileira de Medicina Veterinária, 21(1):17-20.
- Esbérard, C.E.L.; Jordão-Nogueira, T.; Luz, J.L.; Melo, G.G.S.; Mangolin, R.; Jucá, N.; Raíces, D.S.L.; Enrici, M.C. & Bergallo, H.G. 2006. Morcegos da Ilha Grande, Angra dos Reis, RJ, Sudeste do Brasil. Revista Brasileira de Zoociências, 8(2):151-157.
- Esbérard, C.E.L.; Soares-Santos, B. & Fariah, D. 2007. New Thyroptera tricolor Spix records in the Atlantic Forest, Brazil (Chiroptera, Thyropteridae). Revista Brasileira de Biologia, 67(2):379-380.
- Esteves, F.A.; Caliman, A.; Santangelo, J.M.; Guariento, R.D.; Farjalla, V.F. & Bozelli, R.L. 2008. Neotropical coastal lagoons: an appraisal of their biodiversity, functioning, threats and conservation management. Revista Brasileira de Biologia, 68(4):967-981.
- Fenton, M. & Bell, G. 1979. Echolocation and feeding behaviour in four species of Myotis (Chiroptera). Canadian Journal of Zoology, 57:1271-1277.
- Fenton, M.B.; Merriam, H.G. & Holroyd, G.L. 1983. Bats of Kootenay, Glacier, and Mount Revelstroke National Parks in Canada: identification by echolocation calls, distribution, and biology. Canadian Journal of Zoology, 61:2503-2508.
- Findley, J.S. 1993. Bats: a community perspective. Cambridge University Press. (Cambridge Studies in Ecology)
- Frenckell, B.V. & Barclay, R.M.R. 1987. Bat activity over calm and turbulent water. Canadian Journal of Zoology, 65:219-222.
- Gardner, A.L. 1977. Feeding habits. In: Baher, R.J.; Carter, D.C. & Jones, J.K. Biology of bats of the New World family Phyllostomidae. Part III. Special Publications Museum Texas Tech University, 13:293-350.
- Gregorin, R. & Taddei, V.A. 2002. Chave artificial para identificação de Molossídeos brasileiros (Mammalia, Chiroptera). Mastozoologia Neotropical, 9(1):13-32.
- Grindal, S.D.; Morissette, J.L. & Brigham, R.M. 1999. Concentration of bat activity in riparian habitats over an elevational gradient. Canadian Journal of Zoology, 77:972-977.
- Hammer, O.; Harper, D.A.T. & Rian, P.D. 2001. Past: Palaeonthological statistics software package for education and data analysis. Version 2.00. Disponível em: http://palaeo-electronica.org/2001_1/past/issue1_01.htm Acesso em: 19/08/2011.
- Kalko, E.K.V.; Handley, C.O. & Handley, D. 1996. Organization, diversity and long-term dynamics of a neotropical bat community. In: Cody, M.L. & Smallwood, J.A. Long-term studies of vertebrate communities. Academic Press, New York. p. 503-553.
- Krusic, R.A.; Yamasaki, M.; Neefus, C.D. & Pekins, P.J. 1996. Bat habitat use in White Mountain National Forest. Journal of Wildlife Management, 60:625-631.
- Kunz, T.H. & Kurta, A. 1990. Capture methods and holding devices. In: Kunz, T.H. Ecological and behavior methods for the study of bats. Washington, Smithsonian Institution Press. p. 1-29.
- Lourenço, E.C.; Costa, L.M.; Silva, R.M. & Esbérard, C.E.L. 2010. Bat diversity of Ilha da Marambaia, southern Rio de Janeiro State, Brazil (Chiroptera, Mammalia). Revista Brasileira de Biologia, 70(3):511-519.
- Mangolin, R.; Motta, A.G.; Esbérard, C.E.L. & Bergallo, H.G. 2007. Novos registros de Lophostoma brasiliensis Peters para o sudeste do Brasil (Mammalia, Chiroptera, Phyllostomidae). Revista Brasileira de Zoociências, 9:225-228.
- McNab, B.K. 2003. Standart energetics of phyllostomid bats: the inadequacies of phylogenetic-contrast analyses. Comparative Biochemistry and Physiology Part A, 135:357-368.
- Nowak, R.M. 1991. Walker's Mammals of the World. The John Hopkins University, Baltimore.
- Peracchi, A.L. & Albuquerque, S.T. 1971. Lista provisória dos Chiropteros dos Estados do Rio de Janeiro e Guanabara (Chiroptera; Mammalia). Revista Brasileira de Biologia, 31:405-413.
- Peracchi, A.L. & Albuquerque, S.T. 1986. Quirópteros do Estado do Rio de Janeiro, Brasil (Mammalia, Chiroptera). Publicações Avulsas, Museu Nacional, 66:63-69.
- Peracchi, A.L. & Albuquerque, S.T. 1993. Quirópteros do Município de Linhares, Estado do Espirito Santo, Brasil (Mammalia: Chiroptera). Revista Brasileira de Biologia, 53(4):575-581.
- Peracchi, A.L. & Nogueira, M.R. 2010. Lista anotada dos morcegos do Estado do Rio de Janeiro, sudeste do Brasil. Chiroptera Neotropical, 16(1):508-519.
- Reis, N.R. & Muller, M.F. 1995. Bat diversity of forests and open areas in a subtropical region of south Brazil. Ecologia Austral, 5:31-36.
- Reis, N.R.; Peracchi, A.L.; Muller, M.F.; Bastos, E.A. & Soares, E.S. 1996. Quirópteros do Parque Estadual do Morro do Diabo, São Paulo, Brasil (Mammalia: Chiroptera). Revista Brasileira de Biologia, 56(1):87-92.
- Rocha, R.M.M. 2008. Revisão taxonômica das espécies de Myotis Kaup, 1829 (Chiroptera, Vespertilionidae) do Brasil: uma abordagem morfológica e morfométrica. (Tese de Doutorado). Universidade Federal do Rio de Janeiro, Rio de Janeiro.
- Simmons, N.B. & Voss, R.S. 1998. The mammals of Paracou, French Guiana: a Neotropical lowland rainforest fauna, Part 1. Bats. Bulletin of the American Museum of Natural History, 237:1-219.
- Tuttle, M.D. 1976. Collecting techniques. In: Baker, R.J.; Jones, J.K. & Carter, D.C. Biology of bats of the new world family Phyllostomidae. Part 1. Special Publications Museum Texas Tech University, 10:71-88.
- Vieira, C.O.C. 1942. Ensaio monográfico sobre os quirópteros do Brasil. Arquivos de Zoologia do Estado de São Paulo, 3(8):219-471.
- Vieira, C.O.C. 1955. Lista remissiva dos mamíferos do Brasil. Arquivos de Zoologia do Estado de São Paulo, 8(11):341-474.
- Vizotto, L.D. & Taddei, V.A. 1973. Chave para determinação de quirópteros brasileiros. Boletim de Ciências, 1:1-72.
- Voss, R.S. & Emmons, L.H. 1996. Mammalian diversity in neotropical lowland rainforests: a preliminary assessment. Bulletin of the American Museum of Natural History, 230:1-115.
- Willig, M.R. 1985. Reproductive patterns of bats from caatingas and cerrado biomes in northeast Brazil. Journal of Mammalogy, 66:668-681.
- Zar, J.H. 1999. Bioestatistical analysis. Prentice Hall, New Jersey.
- Zórtea, M. & Aguiar, L. 2001. Foraging behavior of the fishing bat Noctilio leporinus (Noctilionidae). Chiroptera Neotropical, 7(1-2):140-142.
Datas de Publicação
-
Publicação nesta coleção
27 Mar 2012 -
Data do Fascículo
2012
Histórico
-
Recebido
25 Abr 2001 -
Aceito
11 Jan 2012