Resúmenes
Las ranas ecuatorianas del género Hyloscirtus incluyen 16 especies descritas, de las cuales 11 pertenecen al grupo H. larinopygion. Su distribución se limita a los flancos de la Cordillera de los Andes, tanto al oriente como al occidente. Una evaluación de la herpetofauna en el sector meridional de la Cordillera del Cóndor (bosques montanos sobre mesetas de arenisca) en la provincia de Zamora Chinchipe, Ecuador, condujo al descubrimiento de una especie nueva del grupo que describimos aquí como Hyloscirtus condor sp. nov.; se analizan los renacuajos, las llamadas de anuncio y se estima las relaciones filogenéticas de la especie nueva y de las especies relacionadas en base a nuevas secuencias de los genes mitocondriales 12S, tRNA Val y 16S, con un total de hasta 2508 bp. Los resultados muestran que el grupo H. larinopygion está conformado por dos clados, uno distribuido en los Andes norte y centro de Ecuador y el otro al sur. La nueva especie pertenece al clado sur y es hermana de H. tapichalaca y de una especie aparentemente no descrita de la Provincia Morona Santiago. La especie nueva difiere de sus congéneres por su patrón de coloración dorsal, que consiste de puntos amarillo obscuro en un fondo canela. Es la especie más grande del grupo H. larinopygion y comparte con H. tapichalaca la presencia de una espina prepólica grande y curvada y brazos hipertrofiados. La especie nueva habita un área remota y bien conservada de la Cordillera del Cóndor. El descubrimiento de ésta y otras especies nuevas del mismo lugar denota la importancia biológica del área y motivan al desarrollo de planes de conservación.
Especie nueva; Hylidae; Hyloscirtus condor; Ecuador; Filogenia; Información ecológica
Ecuadorian frogs of genus Hyloscirtus comprises 16 described species, of which eleven belong to the H. larinopygion group. They are restricted to the flanks of the Andes, both east and west. An assessment of the herpetofauna in the southern part of Cordillera del Condor (montane forests on sandstone plateaus) province of Zamora Chinchipe, Ecuador, led to the discovery of a new species for the group, which we describe herein as Hyloscirtus condor sp. nov. We herein analyze the tadpoles and advertisement calls, as well as estimate the phylogenetic relationships of the new and related species, based on new sequences of mitochondrial genes 12S, tRNA Val y 16S, until a total of 2508 bp. The results show that the group H. larinopygion comprises two clades: one occurring in the northern and central Andes, and the second in the south. The new species belongs to the southern clade, is sister to H. tapichalaca, and a seemingly undescribed species from Provincia Morona Santiago. The new species differs from all its congeners in color pattern, which consists of dark yellow dots on a tan background. It is the largest species of the H. larinopygion group and shares with H. tapichalaca the presence of a large prepollical curved spine and hypertrophied forearms. The new species inhabits a remote and well-preserved area of Cordillera del Condor. The discovery of new species and others at the site denotes the biological importance of this area and encourages the development of conservation plans.
New species; Hylidae; Hyloscirtus condor; Ecuador; Phylogenia; Ecological information
IInstituto de Ciencias Biológicas, Escuela Politécnica Nacional, Casilla 17-01-2759, Telefax: 2236690. Quito, Ecuador. E-mail: ana.almendariz@epn.edu.ec
IIInstituto de Ciencias Biológicas, Escuela Politécnica Nacional, Casilla 17-01-2759, Telefax: 2236690. Quito, Ecuador
IIIMuseo de Zoología, Escuela de Biología, Pontificia Universidad Católica del Ecuador, Av. 12 de Octubre y Roca, Aptdo. 17-01-2184, Quito, Ecuador
ABSTRACT
Ecuadorian frogs of genus Hyloscirtus comprises 16 described species, of which eleven belong to the H. larinopygion group. They are restricted to the flanks of the Andes, both east and west. An assessment of the herpetofauna in the southern part of Cordillera del Condor (montane forests on sandstone plateaus) province of Zamora Chinchipe, Ecuador, led to the discovery of a new species for the group, which we describe herein as Hyloscirtus condor sp. nov. We herein analyze the tadpoles and advertisement calls, as well as estimate the phylogenetic relationships of the new and related species, based on new sequences of mitochondrial genes 12S, tRNAValy 16S, until a total of 2508 bp. The results show that the group H. larinopygion comprises two clades: one occurring in the northern and central Andes, and the second in the south. The new species belongs to the southern clade, is sister to H. tapichalaca, and a seemingly undescribed species from Provincia Morona Santiago. The new species differs from all its congeners in color pattern, which consists of dark yellow dots on a tan background. It is the largest species of the H. larinopygion group and shares with H. tapichalaca the presence of a large prepollical curved spine and hypertrophied forearms. The new species inhabits a remote and well-preserved area of Cordillera del Condor. The discovery of new species and others at the site denotes the biological importance of this area and encourages the development of conservation plans.
Key-words: New species; Hylidae; Hyloscirtus condor; Ecuador; Phylogenia; Ecological information.
RESUMEN
Las ranas ecuatorianas del género Hyloscirtus incluyen 16 especies descritas, de las cuales 11 pertenecen al grupo H. larinopygion. Su distribución se limita a los flancos de la Cordillera de los Andes, tanto al oriente como al occidente. Una evaluación de la herpetofauna en el sector meridional de la Cordillera del Cóndor (bosques montanos sobre mesetas de arenisca) en la provincia de Zamora Chinchipe, Ecuador, condujo al descubrimiento de una especie nueva del grupo que describimos aquí como Hyloscirtus condor sp. nov.; se analizan los renacuajos, las llamadas de anuncio y se estima las relaciones filogenéticas de la especie nueva y de las especies relacionadas en base a nuevas secuencias de los genes mitocondriales 12S, tRNAValy 16S, con un total de hasta 2508 bp. Los resultados muestran que el grupo H. larinopygion está conformado por dos clados, uno distribuido en los Andes norte y centro de Ecuador y el otro al sur. La nueva especie pertenece al clado sur y es hermana de H. tapichalaca y de una especie aparentemente no descrita de la Provincia Morona Santiago. La especie nueva difiere de sus congéneres por su patrón de coloración dorsal, que consiste de puntos amarillo obscuro en un fondo canela. Es la especie más grande del grupo H. larinopygion y comparte con H. tapichalaca la presencia de una espina prepólica grande y curvada y brazos hipertrofiados. La especie nueva habita un área remota y bien conservada de la Cordillera del Cóndor. El descubrimiento de ésta y otras especies nuevas del mismo lugar denota la importancia biológica del área y motivan al desarrollo de planes de conservación.
Palabras-clave: Especie nueva; Hylidae; Hyloscirtus condor; Ecuador; Filogenia; Información ecológica.
INTRODUCCIÓN
Hasta el momento se han descrito 7125 especies de anfibios, de las cuales 6285 son anuros (ranas y sapos); en este grupo, las ranas arborícolas conforman la familia Hylidae, la cual es la más diversa con 928 especies y 49 géneros (AmphibiaWeb, 2013). Los Hylidae son de amplia distribución, exceptuando Africa Central y Meridional, pero altamente diversos en las regiones tropicales del nuevo mundo (Duellman, 2001). Los hylidos son de hábitos nocturnos y arborícolas, con adaptaciones para movilizarse entre las ramas, como son las terminaciones digitales expandidas (Duellman & Trueb, 1994), la presencia de un elemento intercalar cartilaginoso entre las falanges penúltima y última y también por la forma de garra que tiene el extremo distal de la última falange (Cannatella et al., 2012). Comprende 4 subfamilias, de las cuales Hylinae es la más diversa en géneros y especies (Wiens et al., 2005).
Faivovich et al. (2005) presentan una revisión completa sobre la sistemática de la familia Hylidae, junto con un análisis filogenético basado en 276 terminales que incluyó muestras representativas de 40 géneros de las cuatro subfamilias de Hylidae y de 39 grupos de especies del género Hyla. Entre sus resultados también mencionan la división de los Hylinae en cuatro clados, incluyendo en el primero a: el género Aplastodiscus, las ranas gladiadoras (antes Hyla), un clado de los tepuies guayanenses y a las Hyla de los Andes que se reproducen en arroyos o quebradas. En los resultados finales presentan una nueva taxonomía, en la que los Hylinae se hallan divididos en cuatro tribus y se revalidan algunos géneros, entre ellos Hyloscirtus para incluir a las especies de los grupos de H. armatus, H. bogotensis e H. larinopygion. La nomenclatura propuesta por Faivovich et al. (2005) fue adoptada por Wiens et al. (2006); posteriormente Wiens et al. (2010) encontraron fuerte soporte para apoyar la monofilia de Hyloscirtus, Coloma et al. (2012) comprobaron la monofilia del grupo Hyloscirtus larinopygion.
Las ranas del género Hyloscirtus se reproducen en las márgenes de cuerpos de agua de corriente rápida y sus renacuajos son suctoreos; se caracterizan por 56 transformaciones en las proteínas nucleares y mitocondriales y en los genes ribosomales; una particular sinapomorfía morfológica muy notable es la presencia de rebordes cutáneos amplios en los dedos manuales y pediales (Faivovich et al., 2005).
Hyloscirtus está conformado por 32 especies, distribuidas desde Costa Rica hasta la región andina de Venezuela, Colombia, Ecuador, Perú y Bolivia (AmphibiaWeb, 2013).
Ron et al. (2013), registran para el Ecuador un total de 16 especies de Hyloscirtus, de las cuales once pertenecen al grupo H. larinopygion incluyendo dos especies descritas por Coloma et al. (2012), a las que denominaron: H. criptico e H. princecharlesi. En la misma publicación también se reporta para Ecuador a H. tigrinus.
Según la caracterización fenotípica que hacen Duellman & Hillis (1990) para el grupo larinopygion, estas ranas se caracterizan por un tamaño considerable, manos y patas con discos terminales grandes y membrana reducida. El cráneo está bien osificado, particularmente el esfenoetmoide y presenta pequeñas fontanelas frontoparietales; el hueso cruadradoyugal está presente; los odontóforos vomerinos son alargados, transversales y en posición posterior a las coanas, las cuales son abultadas en la parte media; el tubérculo prepólico está apoyado en una espina (prepólex) ancha, elíptica y osificada; los renacuajos son grandes y con colas musculosas; la boca de la larva se halla en posición ventral, con una o dos hileras completas de papilas marginales y con ocho a diez hileras inferiores de dentículos.
Coloma et al. (2012) revisaron la sistemática de las ranas del grupo Hyloscirtus larinopygion y presentaron un nuevo árbol filogenético basado en el ADN mitocondrial (secuencias parciales de genes 12S rRNA, tRNA valina, y 16S rRNA; ~2.3 kb) de once especies de este grupo. La filogenia confirma la estrecha relación de los miembros del grupo H. larinopygion con miembros andinos del grupo H. armatus. Además muestran que Hyloscirtus tapichalaca diverge basalmente de las especies restantes del grupo H. larinopygion. Entre ellas hay dos clados, en el "A" se ubican H. ptychodactylus, H. princecharlesi, H. tigrinus, H. psarolaimus, H. criptico, H. pacha e H. staufferorum; en el clado "B" están H. larinopygion, H. pantostictus e H. lindae. La monofilia del grupo H. larinopygion y la ubicación de H. tapichalaca tuvieron un soporte moderado en la filogenia de Máxima Parsimonia y un bajo soporte en las filogenias Bayesiana y de Máxima Verosimilitud.
Los hábitos seclutorios de las ranas Hyloscirtus y su confinamiento a sitios poco explorados han contribuido al escaso conocimiento de este grupo. En el mes de agosto de 2012, la Universidad Estatal Amazónica y la Fundación Naturaleza y Cultura Internacional realizaron una Evaluación Ecológica Rápida (Sayre et al., 2002), de vertebrados, insectos y plantas, en la Reserva Biológica Cerro Plateado, extremo meridional de la Cordillera del Cóndor. Luego de una larga jornada, con tres campamentos de avanzada, se coronó la cumbre del Cerro Plateado, a una altura de 2950 msnm. En esta expedición se realizaron varios descubrimientos importantes de la anfibio fauna, siendo uno de ellos una especie bastante conspicua de rana del género Hyloscirtus que se describe en el presente artículo y que constituye la 12ª especie ecuatoriana de este género dentro del grupo H. larinopygion. Se describen las larvas en el estadío 25 (Gosner, 1960), se analizan las vocalizaciones de los machos y se presentan algunas anotaciones sobre el hábitat y comportamiento.
MATERIALES Y MÉTODOS
Los especímenes adultos y larvas fueron colectados en el flanco occidental de Cerro Plateado, Cordillera del Cóndor, en puntos localizados en y entre los campamentos de avanzada 1 y 2 (04°35'40.9"S, 78°51'15"O, 1620 msnm y 04°36'15.9"S, 78°49'16.4"O, 2317 msnm), en el mes de agosto de 2012. Los puntos de muestreo pertenecen al Cantón Nangaritza, Parroquia Nuevo Paraíso, Provincia Zamora Chinchipe, Ecuador. Los datos de latitud y longitud se basaron en el datum WGS 84, y fueron registrados con el Garmin eTrex Summit® HC. Los especímenes adultos fueron fijados en formalina al 10% y preservados en etanol de 70%, mientras que las larvas se mantuvieron en formalina al 10% desde el momento de su colección; para la preservación de los especímenes seguimos los protocolos de Chen & Combs (1999) y Simmons (2002). Todos los especímenes se hallan depositados en el Museo de Historia Natural Gustavo Orcés de la Escuela Politécnica Nacional (MEPN).
Los especímenes de la especie nueva fueron comparados con descripciones publicadas de especies del grupo Hyloscirtus larinopygion. Las medidas del material de estudio (holotipo, paratopotipos y paratipos) fueron tomadas con un calibrador digital Buffalo Tools (precisión de ± 0.01 mm), según las recomendaciones de Duellman (2001) y las descritas por Duellman & Hillis (1990) para el grupo H. larinopygion. Las medidas se abrevian como se indica a continuación: LRC (longitud rostro-cloaca), LTI (longitud de la tibia), LPI (longitud del pie), LCA (longitud de la cabeza), ACA (ancho de la cabeza), DEN (distancia entre aberturas nasales), DIO (distancia interorbital), DON (distancia ojo-abertura nasal), DOJ (diámetro del ojo), DTI (diámetro del tímpano). Para la numeración de los dedos (I-IV) y el cálculo de la fórmula de las membranas se usa la metodología de Savage & Heyer (1967) y Myers & Duellman (1982).
La madurez sexual de los machos se determinó por la presencia de hendiduras vocales, sacos vocales extendidos, revisión de gónadas y/o la presencia de espina prepólica. La descripción de la coloración en vivo se basó en Smithe (1975).
La terminología usada para la descripción de las larvas sigue las recomendaciones de Altig (1970), Lips & Savage (1996) y McDiarmid & Altig (1999). Para la descripción se seleccionó un renacuajo en estadio 25, con piezas bucales completas. Las dimensiones del cuerpo y cola fueron tomadas usando un micrómetro acoplado a un estéreo microscopio Olympus SZ2-ILST. Las principales medidas se abrevian a continuación: LT (longitud total), LCU (longitud del cuerpo), ANC (ancho del cuerpo, tomado a nivel del espiráculo), ALC (alto del cuerpo), LC (longitud de la cola), LES (longitud del espiráculo), AEC (ancho del espiráculo), LTC (longitud del tubo cloacal), ATC (ancho del tubo cloacal), ANMC (ancho de la musculatura de la cola), ALMC (altura de la musculatura de la cola), DONF (distancia del ojo al orificio nasal), DEN (distancia entre aberturas nasales), DO (diámetro del ojo), DIO (distancia interorbital), ADO (ancho del disco oral), FDL (formula de los dientes labiales).
Se registró 12 vocalizaciones del espécimen MEPN 14754, con una grabadora digital Zoom H4n y un micrófono unidireccional Sennheiser K6-C. Adicional a esta información se tomó datos sobre la temperatura ambiente con un termómetro Springfield; analizamos la estructura de la vocalización con el software de Adobe Audition 3.0 (Adobe Systems Incroporated, San José, CA) en una frecuencia de 44.1 KHz y 16 "bits" de resolución (Almendáriz & Batallas, 2012); las vocalizaciones fueron diagramadas con el software de Raven 1.4 (Cornell Lab. of Ornithology, Ithaca, NY). Se cuantificó las siguientes variables: (1) frecuencia dominante (frecuencia de máxima energía, determinada con el cálculo de Fourier), (2) frecuencia fundamental (frecuencia más baja o estructural de un espectro), (3) número de armónicas (número de frecuencias armónicas presentes en los cantos), (4) tasa del canto (repetición de los cantos en el lapso de un minuto), (5) número de notas (número de unidades acústicas de un determinado patrón de amplitud reconocido en las llamadas), (6) duración de los cantos (tiempo desde el inicio hasta el final de una llamada, medido con el analizador de forma de onda), (7) duración de las notas, y (8) intervalos entre cantos (tiempo transcurrido entre canto y canto) (Cocroft & Ryan, 1995 y Almendáriz & Batallas, 2012).
Las fotografías del holotipo y larvas preservados fueron tomadas en un estéreo microscopio Olympus SZ61, con el acople de una cámara digital Lumenera Infinity 1-2c. Las imágenes de Rayos X se tomaron en un equipo Thermo Kevex, Model PXS5-925EA-LV, con un ajuste de: voltaje máximo: 80 Kv, potencia máxima: 8 Watts y corriente máxima de: 0.18 mA. Para visualizar características osteológicas, particularmente de las cinturas escapular y pélvica, se procedió a limpiar el esqueleto del paratipo MEPN 14761 en un dermestario.
Extracción, amplificación y secuenciación de ADN
El ADN total fue extraído de tejido de hígado preservado en etanol al 95% con el protocolo de guanidina tiocianato. Aplicamos la reacción en cadena de la polimerasa (PCR) para amplificar, en cuatro fragmentos sobrelapados, los genes mitocondriales 12S rRNA, tRNAVal y 16S rRNA. Los cebadores utilizados fueron los mismos listados en Coloma et al. (2012). La amplificación se llevó a cabo con protocolos estándar. Los productos de PCR fueron secuenciados por el Grupo de Secuenciación Macrogen (Macrogen Inc., Seúl, Corea).
Análisis filogenético
Estimamos las relaciones filogenéticas de la especie nueva y de especies relacionadas, en base a nuevas secuencias de los genes mitocondriales 12S, tRNAVal y 16S con un total de hasta 2508 bp. Para ampliar el muestreo de especies también incluimos datos del GenBank. Las muestras, incluyendo sus números de acceso al GenBank están listadas en la Tabla 1. Como grupo externo incluimos muestras de Pseudacris nigrita, Itapotihyla langsdorfii y varias especies de Hypsiboas (Tabla 1). La alineación preliminar de las secuencias se hizo con el software MAFFT 6.814b con el algoritmo L-INS-i (Katoh et al., 2002). Regiones de alineación ambigua en la matriz fueron corregidas manualmente en Mesquite 2.72 (Maddison & Maddison, 2009). Los árboles filogenéticos fueron obtenidos usando inferencia Bayesiana. Debido a que los loci analizados pueden evolucionar bajo procesos distintos, es improbable que todos se ajusten a un solo modelo evolutivo. Por lo tanto, dividimos la matriz de datos para analizar cada partición bajo modelos separados. El mejor modelo para cada partición fue seleccionado con JModelTest versión 2.1.1 (Darriba et al., 2012; Guindon & Gascuel, 2003) usando el Criterio de Información de Akaike como medida de optimalidad. La matriz se partió en dos: 12S + tRNAVal y 16S. Con fines comparativos, también hicimos un análisis con una sola estrategia de particion. Se escogió entre las dos estrategias estimando sus factores Bayes con un umbral de diferencia de 10 o más, como evidencia a favor del esquema con más particiones (Brandley et al., 2005).
Cada búsqueda Bayesiana consistió de dos corridas paralelas de la cadena Markov de Monte Carlo con combinación Metrópolis por 2 × 106 generaciones. Cada corrida tuvo cuatro cadenas con una temperatura de 0.1. La convergencia en una distribución estacionaria fue determinada examinando los valores del Tamaño Efectivo de Muestra con el programa Tracer versión 1.5 (Rambaut & Drummond, 2007). Asumimos que valores mayores a 100 eran indicativos de convergencia. Se descartó el 10% de las generaciones muestreadas como burn-in y las restantes fueron usadas para estimar el árbol Bayesiano, probabilidades posteriores de los nodos y los parámetros del modelo. La búsqueda Bayesiana se hizo en el programa MrBayes 3.2.1 (Ronquist et al., 2012).
RESULTADOS
Relaciones filogenéticas
El modelo de evolución seleccionado bajo el criterio de información de Akaike fue GTR + I + G para ambas particiones. Los factores Bayes favorecieron el esquema de partición de la matriz en dos partes (valores > 30). Las topologías de ambos árboles de consenso (dos particiones y una partición) fueron idénticas para el grupo interno. A continuación solo discutiremos los resultados del análisis de dos particiones.
El árbol de consenso (Fig. 2) tiene un alto soporte (PP > 0.95) en la mayoría de nodos. El grupo H. larinopygion tiene un alto soporte (probabilidad posterior = 0.99) y es hermano de un clado formado por el resto de especies de Hyloscirtus. Entre estas últimas, recuperamos una relación cercana entre H. simmonsi y H. alytolylax y además la existencia de más de una especie entre las muestras reportadas como "H. phyllognathus".
En el grupo interno, dos clados divergen basalmente. El primero está conformado por especies que habitan en las estribaciones sur orientales del Ecuador y el segundo por especies de las estribaciones orientales y occidentales del centro y norte de los Andes de ecuatorianos. Los clados son alopátricos excepto por una zona de simpatría en los alrededores de Plan de Milagro (Provincia de Morona Santiago).
La muestra de "Hyloscirtus lindae" KU 202728 (colectada a 21.6 km OSO Plan de Milagro) no se agrupó con otros individuos de H. lindae (e.g., QCAZ 45463) sino con H. tapichalaca. Estas tres muestras forman el clado hermano de la población de Hyloscirtus de la Cordillera del Cóndor. Las distancias genéticas no corregidas (gen 12S) entre los Hyloscirtus de la Cordillera del Cóndor y sus muestras más cercanas (H. tapichalaca e "H. lindae") tienen un rango de 0.034 a 0.036. Estas distancias son mayores que las registradas entre pares de especies hermanas como H. pacha e H. staufferorum (0.014-0.018), H. princecharlesi e H. ptychodactylus (0.004-0.020) e incluso entre especies no hermanas como H. criptico e H. psarolaimus (0.022-0.026). La alta divergencia genética encontrada en los Hyloscirtus de la Cordillera del Cóndor asociados a su morfología particular nos conducen a reconocerla como una especie nueva.
Sistemática
Hyloscirtus condor sp. nov.
(Fig. 1)
Holotipo
Un macho adulto (MEPN 14758) colectado por Jorge Brito, en una quebrada adyacente al campamento de avanzada Nº 2 y que corresponde a la formación vegetal Bosque siempreverde montano sobre mesetas de arenisca de la Cordillera del Cóndor (Ministerio del Ambiente, 2012), Cantón Nangaritza, Parroquia Nuevo Paraíso, Reserva Biológica Cerro Plateado, Zamora Chinchipe, Ecuador, 04°36'15.9"S, 78°49'16.4"O, 2317 m, 21 de agosto de 2012.
Paratopotipos (7)
Seis machos adultos (MEPN 14754, 14755, 14756, 14757, 14759 y 14760), colectados por Jorge Brito el 21 de agosto de 2012 y un macho adulto (MEPN 14761) colectado por Jonas Nilson el 22 de agosto del 2012, en la localidad típica.
Paratipos (3)
Un macho joven (MEPN 14753), colectado por Vladimir Carvajal el 21 de agosto de 2012, en una quebrada a 800 m de distancia de la localidad típica (04°36'13.8"S, 78°49'42.0"O, 2078 m). Lote de renacuajos (MEPN 14762) colectados por Jorge Brito en el punto indicado anteriormente, el 23 de agosto de 2012. Lote de renacuajos (MEPN 14752) colectados por Ana Almendáriz y Jorge Brito el 18 de agosto de 2012 en la quebrada junto al Campamento de avanzada Nº 1 y que corresponde a la unidad de vegetación denominada Bosque siempre verde montano bajo sobre mesetas de arenisca de las cordilleras del Cóndor-Kutukú (Ministerio del Ambiente, 2012), en el sector bajo de Cerro Plateado (04°35'40.9"S, 78°51'15"O, 1620 m).
Diagnóstico
Una especie del grupo Hyloscirtus larinopygion como lo define Duellman & Hillis, 1990; Faivovich et al., 2005 y lo ratifica Wiens et al. 2005, con medidas que varían de 64.88 a 73.82 mm LRC en machos adultos y de 47.94 mm en macho joven (Tabla 2), presenta las siguientes características que le hacen única entre sus congéneres: (1) ausencia de bandas diagonales en los flancos; (2) en vida, dorso café canela con puntos amarillo oscuro (amarillo trogón), a nivel de las extremidades anteriores esta combinación de colores se vuelve más tenue y el color café cambia a gris-oliva; (3) color ventral gris claro; (4) iris dorado con finas reticulaciones; (5) pupila horizontal negra; (6) anillo timpánico no distinguible; (7) notable pliegue supratímpánico; (8) 3/4 dientes vomerinos; (9) brazos hipertrofiados; (10) dedos de la mano y pie con rebordes cutáneos; (11) espina prepólica curvada y puntiaguda; (12) tubérculos palmares redondeados; (13) tubérculos subarticulares redondeados; (14) tubérculo metatarsal interno pequeño y ovalado; (15) fino pliegue metatarsal; (16) tubérculo tarsal ausente; (17) en preservante el cuerpo es gris oscuro con puntos crema y el vientre oliva.
Comparaciones
En Hyloscitus condor el patrón de coloración dorsal es singular y le diferencia de las especies restantes del grupo H. larinopygion. Según las fotografías de la figura 1 de Coloma et al. (2012) y Ron et al., (2013), las únicas especies con manchas redondeadas en el dorso son H. pantostictus e H. princecharlesi. En H. pantostictus las manchas son de tamaño mediano, color rojo-coral, esparcidas en todo el dorso. En H. princecharlesi son mucho más grandes y de color rojo geranio. En la especie nueva las manchas son pequeñas, de color amarillo-trogón y se distribuyen en todo el cuerpo. En tamaño, H. condor (LRC promedio = 70.33 mm) supera el rango de todas las especies del grupo H. larinopygion, siendo el más cercano en machos de H. ptychodactylus (LRC promedio = 65.9 mm, Duellman & Hillis, 1990), una especie del occidente de los Andes. El hocico de H. condor es truncado en vistas lateral y dorsal, al igual que en H. tapichalaca (Kizirian et al., 2003), H. criptico (Coloma et al., 2012), H. larinopygion (Duellman, 1973) e H. pricecharlesi (Coloma et al., 2012). La especie nueva (Fig. 1) está cercanamente relacionada con H. tapichalaca; las dos especies comparten la presencia de una espina prepólica, siendo un poco más curva y puntiaguda en H. condor (Fig. 3A). Ambas especies también comparten la ausencia de homoesternón (Fig. 3B) y la presencia de un tubérculo pequeño y cónico en el talón, el mismo que es menos notorio que en H. psarolaimus, H. pacha (Duellman & Hillis, 1990), H. stauferorum (Duellman & Coloma, 1993) e H. tigrinus (Coloma et al., 2012). Hyloscirtus condor difiere de H. tapichalaca (Kizirian et al., 2003) por su coloración dorsal, café canela con puntos amarillo trogón (dorso gris oliva con flancos café grisáceos, discos digitales, rodillas y margen exterior del antebrazo blanco en H. tapichalaca, Kizirian et al., 2003), en el número de dientes vomerinos: 5/5 en H. tapichalaca (Kizirian et al., 2003) y 3/4 en H. condor; además, las diapófisis sacras son dilatadas (planas y triangulares) en H. condor (Fig. 3C) y cilíndricas en H. tapichalaca (Kizirian et al., 2003). En Hyloscirtus condor los discos terminales no son coloreados, se presentan amarillos en H. pantostictus (Duellman & Hillis, 1990 y Duellman & Berger, 1982), anaranjados en H. lindae (Duellman & Altig, 1978) y blancos en H. tapichalaca (Kizirian et al., 2003).
Descripción del holotipo
Macho adulto (71.4 mm LRC); la cabeza es más ancha que larga (largo de la cabeza equivale al 92.75% del ancho de la cabeza), más ancha a la altura de la mandíbula (25,09 mm), lo que representa el 29,5% del LRC; textura de la superficie dorsal de la cabeza rugosa, tornándose algo tuberculada sobre los párpados; ancho el párpado 98% de la distancia interorbital; espacio no deprimido entre las aberturas nasales; hocico truncado en vistas dorsal y lateral; las aberturas nasales ovaladas, en dirección lateral y ligeramente levantadas; canto rostral corto ligeramente cóncavo; ojo grande, 33.65% del largo de la cabeza, su diámetro es 1.92 veces tan largo como su distancia desde la abertura nasal; labios ligeramente abultados; no se distingue el anillo timpánico; pliegue supratimpánico notable y continúa oblicuamente hasta la región escapular, alargado formando una arruga tuberculada hasta la inserción del brazo, orientado oblicuamente en aproximadamente 30º al plano horizontal.
El cuerpo de apariencia mediana-grande, robusto, extremidades gruesas, particularmente los antebrazos. La piel del cuerpo es finamente aerolada, asentuándose hacia los flancos, no hay indicios de glándulas en la región inguinal; ventralmente la piel es finamente aerolada y hacia la garganta es más tenue. Ligera membrana axilar. Pliegue supracloacal transversal y largo; abertura cloacal dirigida postero-ventralmente, en el nivel medio de las extremidades posteriores.
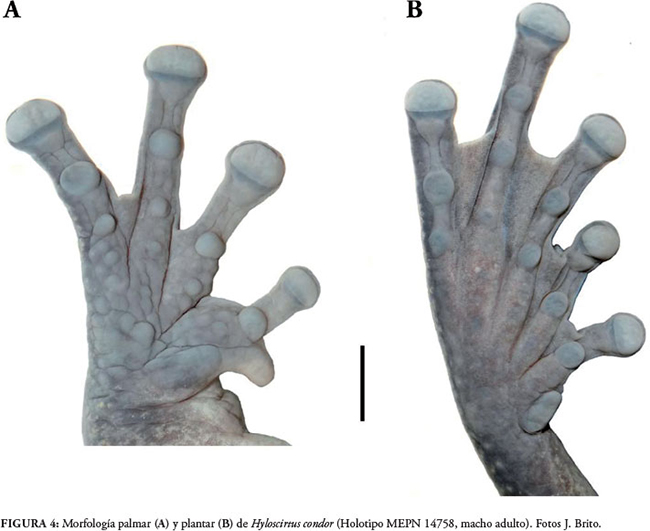
Dedos largos y anchos con rebordes cutáneos laterales en los dedos II y III; discos redondeados que superan levemente el ancho de los dedos. Longitudes relativas de los dedos: III > IV > II > I; fórmula de la membrana para los dedos manuales: I 2-2 II 2½-3 III 3-2½ IV; superficie palmar (Fig. 4A) con surcos profundos, tubérculos subarticulares grandes, prominentes y redondeados, siendo más grandes los de los dedos III y IV; tubérculos supernumerarios pequeños y redondeados; tubérculo tenar plano, grande y de forma elíptica; tubérculo palmar asimétrico al parecer compuesto de tres tubérculos pequeños, de textura tuberculada; antebrazo sin ornamentación; espina prepólica, curvada y puntiaguda.
Miembros posteriores robustos y largos, longitud de la tibia 37.50, que representa el 52.4% de LRC; está presente el pliegue tarsal interno y cubre el tarso longitudinalmente; dedos pediales largos y con discos menos anchos que los de las manos; longitudes relativas de los dedos: IV > III > V > II > I; fórmula de la membrana para los dedos pediales: I 2+-2+ II 1--2- III 2-3½ IV 2--2 V; tubérculos subarticulares redondeados o ligeramente ovalados, siendo más grande el del dedo V; están ausentes los tubérculos supernumerarios pediales; largo del pie 44,6% de LRC; tubérculo metatarsal interno grande, alargado y en la parte proximal redondeado (Fig. 4B); ausente el tubérculo metatarsal externo.
Coanas pequeñas y ovaladas, notablemente separadas una de otra y casi verticales al piso de la boca; los procesos dentigeros del vómer se hallan en posición transversal y los dientes vomerinos alcanzan un número de 3/4; lengua amplia cordiforme y parcialmente adherida al piso de la boca; hendiduras vocales pareadas, alargadas, pequeñas, ubicadas en posición lateral en la base de la boca hacia el ángulo de la mandíbula; saco vocal único, pequeño, en posición media y subgular, externamente forma un pliegue dérmico transversal.
Color en vida
El Holotipo con un dorso café canela con puntos amarillo oscuro (amarillo trogón), extendiéndose hacia los flancos y extremidades; a nivel de las extremidades anteriores la coloración se vuelve más tenue y el color café cambia a gris-oliva; el color ventral es gris claro y el iris dorado con finas reticulaciones café-ferroso (Fig. 1). El macho joven presenta una coloración dorsal café-leonado (Fig. 5A), el mismo que toma tintes amarillo-ocre en la parte anterior de la cabeza. Se presentan manchas negras dispersas en el dorso y sobre las extremidades posteriores forman bandas transversales poco conspicuas; hacia los flancos y parte interna de los muslos hay manchas salmón-amarillento, rebordes cutáneos crema, el vientre es gris claro (Fig. 5B) y en la región gular se notan unas manchas difusas. El iris es amarillento y la pupila horizontal y negra.
Color en preservante
Dorsalmente, el cuerpo, flancos y extremidades de color gris oscuro neutro ampliamente cubiertos por puntos pequeños blanquecinos (Fig. 6A); vientre e interior de las extremidades de color gris mediano neutro; región gular y a la altura del esternón color gris perla (Fig. 6B).
Dimensiones del holotipo (mm): LRC 71.46; LTI 37.50; LPI 31.98; LCA 23.27; ACA 25.05; DEN 5.87; DIO 7.83; DON 5.14; DOJ 7.68, DTI 4.10. Tabla 2.
Descripción de los renacuajos
Las larvas de Hyloscirtus condor son de ambientes lóticos y de tipo suctorial; para el análisis se utilizó dos lotes: MEPN 14752 con seis individuos y MEPN 14756 con tres. De este material se obtuvo muestras de los estadíos 22 a 41 (Gosner, 1960). Para la descripción se seleccionó un renacuajo en estadío 25 (Gosner, 1960) del lote MEPN 14752. Sin embargo, la totalidad de renacuajos (n = 9), en diferentes estadios (21-41) fueron usados para definir la variabilidad en dimensiones, como se observa en la Tabla 3.
A continuación se detallan las medidas: Longitud total 78.6 mm, longitud del cuerpo 29.9 mm, 38% de la longitud total; ancho del cuerpo 16.5 mm, altura del cuerpo 14.7 mm. Visto desde arriba el hocico es redondeado. Ojos dorsales 3.6 mm hasta la fosa nasal. Longitud de la cola 51.2 mm (65% del largo total), ancho de la musculatura de la cola 6.8 mm, alto de la musculatura de la cola 9.8 mm. Las aletas dorsal y ventral comienzan en la base de la cola. El espiráculo sinistral se encuentra en la parte media del cuerpo, la parte anterior se halla adherida al cuerpo, longitud del tubo 2.86, ancho transversal del tubo1.83; abertura espiracular dirigida posterodorsalmente. Tubo cloacal libre, abierto y con dirección ventroposterior; longitud del tubo 4.40 y 3.18 de ancho transversal. El disco oral (Fig. 7A) tiene dirección anteroventral. Disco oral, 7.7 mm (49.6% del ancho del cuerpo). El labio anterior y posterior presenta dos filas completas de papilas marginales irregulares. La fórmula de dientes labiales es 9 (9)/13 (1), (Grupo A, según Sánchez, 2010). A-1 completa, A-9 con un espacio en la mitad de la fila, P-1 con un espacio pequeño en el centro, P-2-P-13 de diferente longitud. En vida, la coloración dorsal gris- verdoso uniforme, vientre negruzco; aletas superior e inferior y musculatura gris transparente con manchas oscuras. En preservante, el dorso es gris oscuro, más claro en la parte anterior de la cabeza, con las estructuras de la boca visibles desde arriba; abdomen gris blanquecino, más oscuro en la parte media. Musculatura de la cola crema oscuro, con una delgada línea negra que va desde la base de la cola hasta la parte media; aleta superior gris transparente con abundantes manchas oscuras, aleta inferior con escasas manchas. (Fig. 7B).
Variación: La variación de caracteres numérico-morfológicos basados en los estadíos 22-41 se muestran en la Tabla 3, nueve renacuajos entre las etapas 22-41 exhiben notable variación, en la longitud total desde 51.93 hasta 93,15; en la longitud corporal de 17.19 a 31.61, en la longitud de la cola desde 35.17 hasta 62.17 y en el número de hileras de dientes, de 7 (7)/10 (1) en el estadío 24 a 5 (5)/9 (1) en el estadío 41.
Comparaciones: Siendo Hyloscirtus tapichalaca la especie más cercana a H. condor, no se pueden hacer las comparaciones respectivas entre los renacuajos de estas dos especies pues no se dispone del material de H. tapichalaca. Sin embargo, por pertenecer al grupo larinopygion, realizamos las comparaciones con la información disponible.
Coloma et al. (2012) describieron los renacuajos de seis especies de Hyloscirtus (H. larinopygion, H. lindae, H. pantostictus, H. princecharlesi, H. psarolaimus y H. tigrinus). Al comparar este material con los renacuajos de Hyloscirtus condor en estadío 25 (Gosner, 1960) se observa que éstos son notablemente más grandes que aquellos descritos por Coloma et al. (2012), en H. condor la longitud total de la larva es de 78.60 y supera el rango de 42.0-48.5 presente en H. psarolaimus e H. pantostictus, respectivamente. Caso similar se presenta en las otras medidas que son usuales para las larvas; con relación a la fórmula de dientes labiales, un número mayor se presenta en H. condor 9(9)/13(1) y la única especie que se acerca a la fórmula es H. psarolaimus con 7(6-7)/9(1). La situación es parecida con los datos de las larvas en estadío 36 (Gosner, 1960), en H. condor el largo total alcanza 94.25 y el rango entre H. lindae e H. pincecharlesi está entre 65.5 y 89, respectivamente; la fórmula de dientes labiales que más se acerca a H. condor (9(9)/13(1)) es la de H. princecharlesi con 8(8)/10. Únicamente, la larva de H. tigrinus en estadío 34 (98.5) supera el largo total de H. condor pero, es notablemente menor su fórmula de dientes labiales (5(3-5/7(1)).
Historia Natural y Distribución
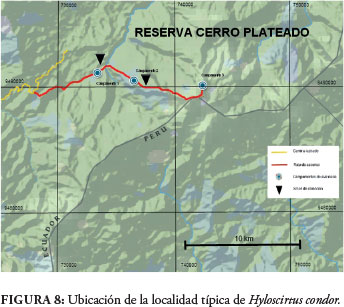
Se conoce únicamente del flanco occidental de Cerro Plateado, Cantón Nangaritza, Parroquia Nuevo Paraíso, Provincia Zamora Chinchipe (Fig. 8); sin embargo, A. Almendáriz ha escuchado el canto de la especie en otras localidades de la Cordillera del Cóndor, particularmente en el sector del Refugio de Vida Silvestre El Zarza.
Los paratipos MEPN 14761 (macho adulto) y MEPN 14753 (macho joven) y los paratopotipos MEPN 14754 y 14755 (machos adultos) de Hyloscirtus condor fueron encontrados en vegetación ribereña de quebradas, en los sistemas boscosos de tepui (dominancia de suros, ciclantáceas y clusias), en alturas de 30 a 80 cm, la colecta se realizó entre las 20:30 y 20:50 h. El holotipo MEPN 14758 (macho adulto) y cuatro paratopotipos MEPN 14756, 14757, 14759 y 14760 (machos adultos) se capturaron a las 22:15 h, cuando estaban sumergidos parcialmente en las pozas que se forman a un lado de la corriente lótica de las quebradas, su pasividad facilitó la colecta.
Los renacuajos del lote: MEPN 14752 se colectaron en pozas de un riachuelo de aguas negras (producidas por ácidos tánicos, cuando la materia vegetal cae en el agua, Roldán, 1992), mientras que el lote: MEPN 14762, se colectó en el único riachuelo de aguas blancas, adyacente al campamento de avanzada Nº 2. Estas quebradas no superan los 3 m de ancho, y la profundidad oscila entre 10 y 60 cm; las larvas siempre fueron avistadas en el fondo del sustrato en medio de rocas y hojarasca.
Etimología
El epíteto específico es usado como sustantivo en aposición y hace referencia al sector del que provienen las colecciones, esto es, la Cordillera del Cóndor. Con esta nueva asignación, a una de las especies nuevas encontradas, queremos resaltar la importancia biológica que tiene esta cadena montañosa.
Comportamiento
Los machos de Hyloscirtus condor al ser manipulados presentaron un comportamiento antidepredatorio inusual, puesto que muerden y usan con fuerza la espina prepólica en señal de defensa para tratar de liberarse, al punto de romper los guantes de látex e incluso ocasionar rasguños leves en las manos del colector. Sin embargo, los ejemplares objeto del presente artículo, no mostraron cicatrices que indiquen confrontaciones previas.
Vocalizaciones
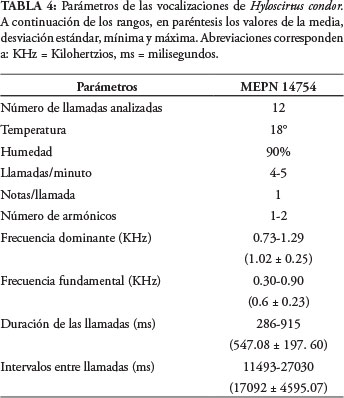
Las grabaciones de las vocalizaciones de Hyloscirtus condor (MEPN 14754) se realizaron el 19 de julio de 2012, a una temperatura ambiental de 18°C y 90% de humedad. La especie nueva presenta llamadas de frecuencia modulada con una sola nota pulsada y conformadas por uno o dos armónicos. La frecuencia dominante tiene un promedio de 1.02 ± 0.25 KHz y la frecuencia fundamental un promedio de 0.6 ± 0.23 KHz. Las llamadas presentan un promedio de duración de 547.08 ± 197. 60 ms, con intervalos promedio de 17092 ± 4595.07 ms, emitiendo de cuatro a cinco llamadas por minuto (Tabla 4).
Esta especie presenta tres tipos de llamadas, las cuales son claramente diferenciables tanto en sus variables temporales como en sus variables espectrales. El primer tipo de llamada es un silbido agudo con una frecuencia dominante que va de 1.20-1.29 KHz, presenta dos armónicos y una duración que varía de 626-698 ms (Fig. 9A). El segundo tipo de llamada es un silbido más grave en relación al primero, tiene una frecuencia dominante de 0,73-0.77 KHz, presenta un solo armónico y una duración de 286-366 ms (Fig. 9B). El tercer tipo de llamada es poco común ya que, en el análisis realizado solo se presentó una vez y es un sonido diferente a los dos anteriores tiene una frecuencia dominante de 1.07 KHz, presenta un armónico poco definido y una duración de 915 ms (Fig. 9C). Es necesario profundizar en el análisis de este tipo de variaciones con un mayor número de llamadas para establecer las diferencias intraespecíficas de las vocalizaciones de esta especie.
Comparaciones: Duellman et al. (1997) describen el canto de Hyloscirtus armatus, como una llamada de una sola nota, de tonalidades altas, compuesta de tres armónicos y con una duración entre 160-240 ms. Coloma et al. (2012) se refieren a las vocalizaciones de siete especies de Hyloscirtus, de las cuales cuatro presentan llamadas de una sola nota y sin pulsos: H. criptico, H. staufferorum, H. tapichalaca e H. pacha; las vocalizaciones de estas especies no sobrepasan los 210 ms de duración con intervalos cortos, mientras que en H. condor se presentan llamadas de mayor duración (promedio = 547 ms). En cuanto a los intervalos entre llamadas, los de mayor duración son los de H. condor (promedio = 17 sec) superando a los de H. pacha, el cual llega hasta 2.4 sec. En cuanto a la frecuencia dominante, los valores de H. condor (1.02 KHz) son menores a los que presentan las especies indicadas (0.79-1.60 KHz); los valores de la frecuencia fundamental de H. criptico, H. stauferorum, H. pacha son iguales a los de la frecuencia dominante; en cambio, en H. tapichalaca es menor a la frecuencia dominante (1.46 KHz). Comparativamente, H. condor coincide en mantener un valor bajo de frecuencia fundamental (0.6 KHz).
Del análisis realizado, H. condor presenta variables temporales de mayor duración y variables espectrales de menor valor.
DISCUSIÓN
Sistemática
Nuestra filogenia es consistente con estudios previos (e.g., Coloma et al., 2012; Faivovich et al., 2005; Pyron & Wiens, 2011; Wiens et al., 2010) al encontrar un alto soporte para los tres grupos de especies que conforman Hyloscirtus: grupo H. bogotensis, grupo H. armatus y grupo H. larinopygion. Sin embargo, nuestra filogenia difiere en las relaciones entre los tres clados puesto que no recuperamos al grupo H. armatus como clado hermano del grupo H. larinopygion. La única excepción es la filogenia de máxima verosimilitud de Coloma et al. (2012) que también recupera a los grupos H. armatus y H. bogotensis como clados hermanos (aunque con bajo soporte, al igual que en nuestro árbol). Una relación cercana entre los grupos H. armatus y H. larinopygion es sugerida por la presencia de brazos hipertrofiados en el grupo H. armatus (Faivovich et al., 2005), en H. tapichalaca e H. condor.
Hay tres especies en las que nuestra filogenia sugiere la existencia de diversidad críptica o especímenes mal identificados. Las distancias genéticas que se discuten en esta sección son no corregidas p para el gen 12S. En H. phyllognathus, tres individuos de Ecuador (QCAZ) están separados del espécimen KU 212119 de Perú, Tarapoto, por distancias genéticas de 0.081 a 0.084. Las distancias genéticas que separan especies hermanas son típicamente < 0.05 por lo que se presume que la población de Perú pertenezca a una especie diferente. Hyloscirtus armatus es parafilético con respecto a H. charazani (Fig. 2) ya que la muestra de Buenos Aires, Cusco, Perú, es más cercana a H. charazani que a la muestra de H. armatus de Caballero, Santa Cruz, Bolivia. La distancia entre las dos muestras de H. armatus es 0.035 y entre H. armatus (Perú) y H. charazani es 0.025. La existencia de diversidad críptica en H. armatus fue propuesta por Duellman et al. (1997). Se requiere una revisión del grupo para determinar el estatus taxonómico de las poblaciones de H. armatus y H. charazani que se muestran en la filogenia.
Dentro del grupo H. larinopygion encontramos polifilia entre las poblaciones de H. lindae (Fig. 2). La distancia genética entre la población de Morona Santiago y las de los Andes centrales de Ecuador (e.g., QCAZ 45346) tiene un rango de 0.085 a 0.094. Las altas distancias y la polifilia demuestran la existencia de más de una especie dentro de H. lindae. Debido a que las muestras de los Andes centrales, usadas para la filogenia, provienen de la localidad tipo se asume que representan a H. lindae sensu stricto; la población de Morona Santiago pertenecería a H. tapichalaca o a una especie no descrita. Las distancias genéticas entre H. tapichalaca y el espécimen de Morona Santiago son de 0.028 y 0.035, lo cual sugiere que se trata de una especie nueva.
La polifilia en H. lindae explicaría la incongruencia en la posición de H. lindae entre la filogenia de Coloma et al. (2012) y las filogenias de Duellman & Hillis (1990), Wiens et al. (2010) y Pyron & Wiens (2011). Antes del trabajo de Coloma et al. (2012) los análisis filogenéticos que incluyeron a H. lindae se basaron en material genético de la provincia de Morona Santiago. La filogenia de Coloma et al. (2012) fue la primera en incluir muestras de H. lindae sensu stricto. La parafilia de H. lindae no fue detectada en el trabajo de Coloma por la exclusión de la secuencia del GenBank del espécimen KU 202728. Una vez que se toma en cuenta que las poblaciones de Morona Santiago no forman parte de H. lindae, las topologías para el grupo de especies H. larinopygion consideradas en las cuatro publicaciones indicadas y en el presente trabajo son completamente congruentes.
Las vocalizaciones de Hyloscritus condor son marcadamente diferentes a las analizadas por Coloma et al. (2012) para siete especies del grupo H. larinopygion y los valores de las frecuencias dominante y fundamental son significativamente menores.
Hyloscritus condor es una especie bastante conspicua, constituye la especie de mayor tamaño que se conoce del género y se presume que las hembras deben ser más grandes que los machos.
El análisis de la morfología de las larvas ha sido respaldado por muchos autores para determinar las interelaciones en los hilidos asociados con el género Hyloscirtus (Duellman et al., 1997; Duellman, 2001; Faivovich et al., 2005; Duellman, 1972; Duellman & Hillis, 1990; Mijares-Urrutia, 1992, 1998; Faivovich et al., 2005; Lötters et al., 2005). La estructura del disco oral es una de las características más sobresalientes y dentro de ésta la fórmula de las hileras de dientes constituye uno de los rasgos que usualmente conducen a determinar la especificidad de una especie (Altig & McDiarmid, 1999). Los renacuajos de Hyloscirtus (Hylidae: Cophomantini) exhiben una amplio rango de variación de la fórmula de las hileras de dientes (Ruiz-Carranza & Lynch, 1982; La Marca, 1985; Duellman & Hillis, 1990; Cadle & Altig, 1991; Mijares-Urrutia, 1992, 1998; Ardila-Robayo et al., 1993; Duellman & Coloma, 1993; Lötters et al., 2005).
Sánchez (2010), analizó la formula dentaria para los renacuajos de Hyloscirtus y determinó la presencia de dos grupos: (A) incluye especies que presentan una fórmula que varía entre: 5(5)/6(1) y 17(17)/19(1), con especies de Colombia, Ecuador, Perú y Bolivia. Incluye en el grupo B principalmente a las especies del grupo bogotensis, con renacuajos cuya fórmula se halla entre 2(2)/4(1) y 5(1-5)/6(1). Según esta clasificación, Hyloscirtus condor se ubicaría en el grupo A, pues la fórmula de dientes labiales es 9 (9)/13 (1).
AGRADECIMIENTOS
Ana Almendáriz y Jorge Brito agradecen al Rector de la Universidad Estatal Amazónica (UEA), a David Neil Director de Investigaciones de la UEA y a la Fundación Naturaleza y Cultura Internacional por la invitación a que investigadores de la EPN participen en la expedición a Cerro Plateado (Cordillera del Cóndor), a Vladimir Carvajal por las fotografías del material preservado y elaboración del mapa, a la Escuela de Biología de la Pontificia Universidad Católica por facilitar el uso del equipo de Rayos X y a dos revisores anónimos por sus acertados comentarios. Santiago R. Ron agradece a la Secretaría Nacional de Educación Superior, Ciencia, Tecnología e Innovación por el financiamiento para el trabajo de laboratorio en el marco del proyecto PIC08-0000470. Las colecciones se hicieron amparadas por el permiso Nº 011-IC-FAU/FLO-DPZCH-MA.
Aceito em: 25/09/2013
Publicado em: 31/03/2014
- ALMENDÁRIZ, A. & BATALLAS, D. 2012. Nuevos datos sobre la distribución, historia natural y el canto de Centrolene condor Cisneros-Heredia y Morales-Mite 2008 (Amphibia: Anura: Centrolenidae). Revista Politécnica, 30:42-53.
- ALTIG, R. 1970. A key to the tadpoles of the Continental United States and Canada. Herpetologica, 26:180-207.
- ALTIG, R. & MCDIARMID, R.W. 1999. Body Plan: development and morphology. In: McDiarmid, R.W. & Altig, R. (Eds.). Tadpoles: the biology of anuran larvae. Chicago, The University of Chicago Press. p. 295 - 335.
- AMPHIBIAWEB: INFORMATION ON AMPHIBIAN BIOLOGY AND CONSERVATION. [WEB APPLICATION]. 2013. Berkeley, California: AmphibiaWeb. http://amphibiaweb.org (Consulta: Abril 15, 2013).
- ARDILA-ROBAYO, M.C.; RUIZ-CARRANZA, P.M. & ROA-TRUJILLO, S.H. 1993. Una nueva especie de Hyla del grupo larinopygion (Amphibia: Anura: Hylidae) del sur de la Cordillera Central de Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 18(71):559-566.
- BRANDLEY, M.C.; SCHMITZ, A. & REEDER, T.W. 2005. Partitioned Bayesian analyses, partition choice, and the phylogenetic relationships of scincid lizards. Systematic Biology, 54:373-390.
- CADLE, J.E. & ALTIG, R. 1991. Two lotic tadpoles from the Andes of Southern Peru: Hyla armata and Bufo veraguensis, with notes on the call of Hyla armata (Amphibia: Anura: Hylidae and Bufonidae). Studies on Neotropical Fauna and Environment, 26(1):45-53.
- CANNATELLA, D.; FORD, L. & BOCKSTANZ, L. 2012. Neobatrachia: "higher" frogs. [en línea]. University of Arizona. <http://phylogeny.arizona.edu/tree/eukaryotes/animals/chordata/salientia/neobatrachia.html> [Consulta: 10 Nov. 2012].
- CHEN, M.H. & COMBS, C.A. 1999. An alternative anesthesia for amphibians: ventral application of benzocaine. Herpetological Review, 30:34.
- COLOMA, L.A.; CARVAJAL-ENDARA, S.; DUEÑAS, J.F.; PAREDES-RECALDE, A.; MORALES-MITE, M.; ALMEIDA-REINOSO, D.; TAPIA, E.E.; HUTTER, C.R.; TORAL, E. & GUAYASAMIN, J.M. 2012. Molecular Phylogenetics of stream treefrogs of the Hyloscirtus larinopygion group (Anura: Hylidae), and description of two new species from Ecuador. Zootaxa, 3364:1-78.
- COCROFT, R.B. & RYAN, M.J. 1995. Patterns of advertisement call evolution in toads and chorus frogs. Animal Behaviour, 49:283-303.
- DARRIBA, D.; TABOADA, G.L.; DOALLO, R. & POSADA, D. 2012. jModelTest 2: more models, new heuristics and parallel computing. Nature Methods, 9:772.
- DARST, C.R. & CANNATELLA, D.C. 2004. Novel relationships among hyloid frogs inferred from 12S and 16S mitochondrial DNA sequences. Molecular Phylogenetics and Evolution, 31(2):462-475.
- DUELLMAN, W.E. 1972. A review of the neotropical frogs of the Hyla bogotensis group. Occasional Papers of the Museum of Natural History, University of Kansas, (11):1-31.
- DUELLMAN, W.E. 1973. Descriptions of New Hylid frogs from Colombia and Ecuador. Herpetologica, 29:219-227.
- DUELLMAN, W.E. 2001. The Hylid Frogs of Middle America. Ithaca, Society for the Study of Amphibians and Reptiles. 2 v.
- DUELLMAN, W.E. & BERGER, T.J. 1982. A new species of Andean treefrog (Hylidae). Herpetologica, 38:456-460.
- DUELLMAN, W.E. & COLOMA, L.A. 1993. Hyla staufferorum, a new species of treefrog in the Hyla larinopygion group from the cloud forests of Ecuador. Occasional Papers of the Museum of Natural History, The University of Kansas, (161):1-11.
- DUELLMAN, W.E. & HILLIS, D.M. 1990. Systematics of frogs of the Hyla larinopygion group. Occasional Papers of the Museum of Natural History, The University of Kansas, (134):1-23.
- DUELLMAN, W.E. & TRUEB, L. 1994. Biology of Amphibians. Baltimore,The John Hopkins University Press.
- DUELLMAN, W.E.; DE LA RIVA, I. & WILD, E.R. 1997. Frogs of the Hyla armata and Hyla pulchella groups in the Andes of South America, with definitions and analyses of phylogenetic relationships of Andean groups of Hyla. Scientific Papers of the Natural History Museum, The University of Kansas, (3):1-41.
- FAIVOVICH, J.; GARCIA, P.C.; ANANIAS, F.; LANARI, L.; BASSO, N.G. & WHEELER, W.C. 2004. A molecular perspective on the phylogeny of the Hyla pulchella species group (Anura, Hylidae). Molecular Phylogenetics and Evolution, 32:938-950.
- FAIVOVICH, J.; HADDAD, C.F.B.; GARCIA, P.C.A.; FROST, D.R. & CAMPBELL, J.A. 2005. Systematic review of the frog family Hylidae, with special reference to Hylinae: phylogenetic analysis and taxonomic revision. Bulletin of the American Museum of Natural History, 294:1-240.
- GOSNER, K.L. 1960. A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica, 16:183-190.
- GUINDON, S. & GASCUEL, O. 2003. A simple, fast and accurate method to estimate large phylogenies by maximum-likelihood. Systematic Biology, 52:696-704.
- KATOH, K.; MISAWA, K.; KUMA, K. & MIYATA, T. 2002. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucleic Acids Research, 30:3059-3066.
- KIZIRIAN, D.; COLOMA, L.A. & PAREDES-RECALDE, A. 2003. A new treefrog (Hylidae: Hyla) from southern Ecuador and a description of its antipredator behavior. Herpetologica, 59:339-349.
- LA MARCA, E. 1985. Systematic and ecological observations on the neotropical frogs Hyla jahni and Hyla platydactyla. Journal of Herpetology, 19:227 - 237.
- LIPS, K.R. & SAVAGE, J.M. 1996. Key to de Known Tadpoles (Amphibia: Anura) of Costa Rica. Neotropical Fauna & Environment, 31(1):17-26.
- LÖTTERS, S.; REICHLE, S.; FAIVOVICH, J. & BAIN, R.H. 2005. The stream-dwelling tadpole of Hyloscirtus charazani (Anura: Hylidae) from Andean Bolivia. Studies on Neotropical Fauna and Environment, 40:181-185.
- MADDISON, W.P. & MADDISON, D.R. 2009. Mesquite: a modular system for evolutionary analysis. Version 2.72. http://mesquiteproject.org
- MCDIARMID, R. & ALTIG, R. 1999. Tadpoles: the biology of anuran larvae. Chicago, The University of Chicago Press. 444 p.
- MIJARES-URRUTIA, A. 1992. El renacuajo de Hyla lascinia, con aportes al conocimiento de los renacuajos de Hyla jahni e Hyla platydactyla (Hylidae) de los Andes Venezolanos. Alytes, 10:91-98.
- MIJARES-URRUTIA, A. 1998. Los renacuajos de los anuros (Amphibia) altoandinos de Venezuela: morfología externa y claves. Revista de Biología Tropical, 46:119-143.
- MINISTERIO DEL AMBIENTE DEL ECUADOR. 2012. Sistema de clasificación de los ecosistemas del Ecuador continental. Quito, Subsecretaría de Patrimonio Natural.
- MYERS, C.W. & DUELLMAN, W.E. 1982. A new species of Hyla from Cerro Colorado, and other tree frog records and geographical notes from western Panama. American Museum Novitates, (2752):1-32.
- PYRON, A. & WIENS, J.J. 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution, 61:543-583.
- RAMBAUT, A. & DRUMMOND, A.J. 2007. Tracer v1.4. Available from http://beast.bio.ed.ac.uk/Tracer University of Edinburgh.
- ROLDÁN, G. 1992. Fundamentos de limnología neotropical. Ed. Universidad de Antioquia. 529 p.
- RON, S.R.; GUAYASAMIN, J.M. & YÁNEZ-MUÑOZ, M.H. 2013. AmphibiaWebEcuador. Version 2013.0. Museo de Zoología, Pontificia Universidad Católica del Ecuador. Disponível em: http://zoologia.puce.edu.ec/Vertebrados/anfibios/AnfibiosEcuador Acceso: 27 de Marzo, 2013.
- RONQUIST, F.; TESLENKO, M.; VAN DER MARK, P.; AYRES, D.L.; DARLING, A.; HÖHNA, S.; LARGET, B.; LIU, L.; SUCHARD, M.A. & HUELSENBECK, J.P. 2012. MrBayes 3.2: efficient bayesian phylogentic inference and model choice across a large model space. Systematic Biology, 61(3):539-542.
- RUIZ-CARRANZA, P.M. & LYNCH, J.D. 1982. Dos nuevas especies de Hyla (Amphibia: Anura) de Colombia, con aportes al conocimiento de Hyla bogotensis. Caldasia, 13:647-671.
- SÁNCHEZ, D.A. 2010. Larval development and synapomorphies for species groups of Hyloscirtus. Copeia, 2010:351-363.
- SAVAGE, J.M. & HEYER, W.R. 1967. Variation and distribution of the tree-frog genus Phyllomedusa in Costa Rica, Central America. Beitrage zur Neotropischen Fauna, 5:111 - 131.
- SAYRE, R.; ROCA, E.; SEDAGHATKISH, G.; YOUNG, B.; KEEL, S.; ROCA, R. & SHEPPARD, S. 2002. Un Enfoque en la Naturaleza. Evaluaciones Ecológicas Rápidas. Arlington, The Nature Conservancy. 195p.
- SIMMONS, J.E. 2002. Herpetological collecting and collection management. Herpetological Circular, 31:1-153.
- SMITHE, F. 1975. Naturalist's Color Guide. New York. The American Museum of Natural History.
- WIENS, J.J.; FETZNER, J.W.; PARKINSON, C.L. & REEDER, T.W. 2005. Hylid frog phylogeny and sampling strategies for speciose clades. Systematic Biology, 54:719-748.
- WIENS, J.J.; GRAHAM, C.H.; MOEN, D.S.; SMITH, S.A. & REEDER, T.W. 2006. Evolutionary and ecological causes of the latitudinal diversity gradient in hylid frogs: treefrog trees unearth the roots of high tropical diversity. American Naturalist 168:579-596.
- WIENS, J.J.; KUCZYNSKI, C.A.; HUA, X. & MOEN, D.S. 2010. An expanded phylogeny of treefrogs (Hylidae) based on nuclear and mitochondrial sequence data. Molecular Phylogenetics and Evolution, 55:871-882.
Una especie nueva de rana arbórea del género Hyloscirtus (Amphibia: Anura: Hylidae) de la Cordillera del Cóndor
Fechas de Publicación
-
Publicación en esta colección
07 Abr 2014 -
Fecha del número
2014
Histórico
-
Acepto
31 Mar 2014 -
Recibido
25 Set 2013