Resumos
JUSTIFICATIVA E OBJETIVOS: Trata-se de um estudo experimental que investigou in vitro e in vivo o bloqueio neuromuscular produzido pelo rocurônio e atracúrio em ratos tratados com carbamazepina e determinou as concentrações de citocromo P450 e b5 redutase em microssomos hepáticos. MÉTODO: Ratos foram tratados por sete dias com carbamazepina (CBZ) - 40 mg.kg-1 pelo método de gavagem e sacrificados no oitavo dia sob anestesia com uretana. As preparações in vitro e in vivo foram montadas de acordo com as técnicas de Bulbring e de Leeuwin e Wolters, respectivamente. As concentrações e doses utilizadas dos bloqueadores nas preparações in vitro e in vivo foram, respectivamente, 20 µg.mL-1 e 0,5 mg.kg-1 para atracúrio (ATC); 4 µg.mL-1 e 0,6 mg.kg-1 para rocurônio (ROC). Cada protocolo teve um n = 5 e as respostas foram observadas por 60 minutos. Os efeitos do ATC e ROC foram avaliados nas preparações de ratos tratados (Cbz t) e comparados com os observados nas de ratos não-tratados (CBZst). As concentrações de citocromo P450 e b5 redutase foram determinadas em microssomos isolados de fígados de ratos tratados (CBZt) e comparadas com as obtidas em ratos não tratados (CBZst). RESULTADOS: A carbamazepina não alterou a amplitude das respostas musculares; in vitro e in vivo, não houve diferença entre o bloqueio neuromuscular produzido pelo atracúrio nas preparações CBZt versus CBZst; o bloqueio neuromuscular produzido pelo rocurônio nas preparações CBZt foi potencializado in vitro. A carbamazepina não alterou as concentrações de citocromo P450 e b5. CONCLUSÕES: O tratamento por sete dias com carbamazepina não influenciou no bloqueio produzido pelo atracúrio, e alterou in vitro os efeitos do rocurônio. O tempo de tratamento não foi suficiente para causar indução enzimática e diminuir a sensibilidade ao rocurônio.
ANIMAIS: ratos; ANTICONVULSIVANTE: carbamazepina; BLOQUEADORES NEUROMUSCULARES, adespolarizante
JUSTIFICATIVA Y OBJETIVOS: Se trata de un estudio experimental que investigó in vitro e in vivo el bloqueo neuromuscular producido por el rocuronio y atracurio en ratones tratados con carbamazepina y determinó las concentraciones de citocromo P450 y b5 reductasis en microsomas hepáticos. MÉTODO: Ratones fueron tratados por siete días con carbamazepina (CBZ) - 40 mg.kg-1 a través de una sonda y sacrificados al octavo día bajo anestesia con uretana. Las preparaciones in vitro e in vivo fueron montadas de acuerdo con las técnicas de Bulbring y de Leeuwin y Wolters, respectivamente. Las concentraciones y dosis utilizadas de los bloqueadores en las preparaciones in vitro e in vivo fueron, respectivamente, 20 µg.mL-1 y 0,5 mg.kg-1 para atracurio (ATC); 4 µg.mL-1 y 0,6 mg.kg-1 para rocuronio (ROC). Cada protocolo tuvo un n = 5 y las respuestas fueron observadas por 60 minutos. Los efectos del ATC y ROC fueron evaluados en las preparaciones de ratones tratados (Cbz t) y comparados a los observados en los de ratones no tratados (CBZst). Las concentraciones de citocromo P450 y b5 reductasis fueron determinadas en microsomas aislados de hígados de ratones tratados (CBZt) y comparadas con las obtenidas en ratones no tratados (CBZst) RESULTADOS: La carbamazepina no alteró la amplitud de las respuestas musculares; in vitro y in vivo, no hubo diferencia entre el bloqueo neuromuscular producido por el atracurio en las preparaciones CBZt versus CBZst; el bloqueo neuromuscular producido por el Rocuronio en las preparaciones CBZt fue potenciado in vitro. La carbamazepina no alteró las concentraciones de citocromo P450 y b5. CONCLUSIONES: El tratamiento por siete días con carbamazepina, no influenció en el bloqueo producido por el atracurio, y alteró in vitro los efectos del rocuronio. El tiempo de tratamiento no fue suficiente para causar la inducción enzimática y disminuir la sensibilidad al rocuronio.
BACKGROUND AND OBJECTIVES: This experimental study investigated the in vitro and in vivo neuromuscular blockade of rocuronium and atracurium in rats treated with carbamazepine and determined the concentration of cytochrome P450 and b5 reductase in hepatic microsomes. METHODS: Rats were treated with carbamazepine (CBZ) - 40 mg.kg-1 by gavage and sacrificed on the eighth day under anesthesia with urethane. In vitro and in vivo preparations followed the techniques of Bulbring and Leeuwin and Wolters, respectively. Concentrations and doses of the neuromuscular blockers used in in vitro and in vivo preparations were, respectively, 20 µg.mL-1 and 0.5 mg.kg-1 for atracurium (ATC); and 4 µg.kg-1 and 0.6 mg.kg-1 for rocuronium (ROC). Each protocol had an n = 5 and the response was observed for 60 minutes. The effects of ATC and ROC were evaluated in the preparations of rats treated with carbamazepine (CBZt) and compared to those of non-treated rats (CBZst). The concentration of cytochrome P450 and b5 reductase were determined in hepatic chromosomes of rats treated with carbamazepine (CBZt) and non-treated rats (CBZst). RESULTS: Carbamazepine did not change the amplitude of neuromuscular response; differences in the neuromuscular blockade produced by atracurium in CBZ1 preparations were not observed, in vitro or in vivo, when compared with CBZst; the neuromuscular blockade produced by rocuronium in CBZt preparations was potentiated in vitro. Carbamazepine did not change the concentrations of cytochrome P450 and b5. CONCLUSIONS: Seven-day treatment with carbamazepine did not change the neuromuscular blockade produce by atracurium, but altered the in vitro effects of rocuronium. The duration of the treatment was not enough to cause enzymatic induction and decrease the sensitivity to rocuronium.
ANIMALS, rats; ANTICONVULSANTS, carbamazepine; NEUROMUSCULAR BLOCKERS, non-depolarizing; NEUROMUSCULAR BLOCKERS, non-depolarizing
ARTIGO CIENTÍFICO
Efeitos neuromusculares in vitro e in vivo do atracúrio e do rocurônio em ratos submetidos a tratamento de sete dias com carbamazepina* * Recebido do Departamento de Farmacologia da Faculdade de Ciências Médicas da Unicamp (FCM-UNICAMP), Campinas, SP
Efectos neuromusculares in vitro e in vivo del atracurio y del rocuronio en ratones sometidos a tratamiento de siete días con carbamazepina
Caroline Coutinho de BarcelosI; Angélica de Fátima de Assunção Braga, TSAII; Franklin Sarmento da Silva BragaIII; Gloria Braga Potério, TSAII; Samanta Cristina Antoniassi FernandesI; Yoko Oshima FrancoIV; Léa Rodrigues SimioniV
IMestra em Farmacologia pelo Curso de Pós-Graduação do Departamento de Farmacologia da FCM-UNICAMP
IIProfessora-Associada do Departamento de Anestesiologia da FCM-UNICAMP
IIIProfessor-Doutor do Departamento de Anestesiologia da FCM-UNICAMP
IVPesquisadora Colaboradora Voluntária do Departamento de Farmacologia da FCM-UNICAMP
VProfessora-Associada do Departamento de Farmacologia da FCM-UNICAMP
Endereço para correspondência Endereço para correspondência Dra. Angélica de Fátima de Assunção Braga Rua Luciano Venere Decourt, 245 Cidade Universitária 13084-040 Campinas, SP E-mail: franklinbraga@terra.com.br
RESUMO
JUSTIFICATIVA E OBJETIVOS: Trata-se de um estudo experimental que investigou in vitro e in vivo o bloqueio neuromuscular produzido pelo rocurônio e atracúrio em ratos tratados com carbamazepina e determinou as concentrações de citocromo P450 e b5 redutase em microssomos hepáticos.
MÉTODO: Ratos foram tratados por sete dias com carbamazepina (CBZ) 40 mg.kg-1 pelo método de gavagem e sacrificados no oitavo dia sob anestesia com uretana. As preparações in vitro e in vivo foram montadas de acordo com as técnicas de Bulbring e de Leeuwin e Wolters, respectivamente. As concentrações e doses utilizadas dos bloqueadores nas preparações in vitro e in vivo foram, respectivamente, 20 µg.mL-1 e 0,5 mg.kg-1 para atracúrio (ATC); 4 µg.mL-1 e 0,6 mg.kg-1 para rocurônio (ROC). Cada protocolo teve um n = 5 e as respostas foram observadas por 60 minutos. Os efeitos do ATC e ROC foram avaliados nas preparações de ratos tratados (Cbzt) e comparados com os observados nas de ratos não-tratados (CBZst). As concentrações de citocromo P450 e b5 redutase foram determinadas em microssomos isolados de fígados de ratos tratados (CBZt) e comparadas com as obtidas em ratos não tratados (CBZst).
RESULTADOS: A carbamazepina não alterou a amplitude das respostas musculares; in vitro e in vivo, não houve diferença entre o bloqueio neuromuscular produzido pelo atracúrio nas preparações CBZt versus CBZst; o bloqueio neuromuscular produzido pelo rocurônio nas preparações CBZt foi potencializado in vitro. A carbamazepina não alterou as concentrações de citocromo P450 e b5.
CONCLUSÕES: O tratamento por sete dias com carbamazepina não influenciou no bloqueio produzido pelo atracúrio, e alterou in vitro os efeitos do rocurônio. O tempo de tratamento não foi suficiente para causar indução enzimática e diminuir a sensibilidade ao rocurônio.
Unitermos: ANIMAIS: ratos; ANTICONVULSIVANTE: carbamazepina; BLOQUEADORES NEUROMUSCULARES, adespolarizante: atracúrio, rocurônio.
RESUMEN
JUSTIFICATIVA Y OBJETIVOS: Se trata de un estudio experimental que investigó in vitro e in vivo el bloqueo neuromuscular producido por el rocuronio y atracurio en ratones tratados con carbamazepina y determinó las concentraciones de citocromo P450 y b5 reductasis en microsomas hepáticos.
MÉTODO: Ratones fueron tratados por siete días con carbamazepina (CBZ) 40 mg.kg-1 a través de una sonda y sacrificados al octavo día bajo anestesia con uretana. Las preparaciones in vitro e in vivo fueron montadas de acuerdo con las técnicas de Bulbring y de Leeuwin y Wolters, respectivamente. Las concentraciones y dosis utilizadas de los bloqueadores en las preparaciones in vitro e in vivo fueron, respectivamente, 20 µg.mL-1 y 0,5 mg.kg-1 para atracurio (ATC); 4 µg.mL-1 y 0,6 mg.kg-1 para rocuronio (ROC). Cada protocolo tuvo un n = 5 y las respuestas fueron observadas por 60 minutos. Los efectos del ATC y ROC fueron evaluados en las preparaciones de ratones tratados (Cbzt) y comparados a los observados en los de ratones no tratados (CBZst). Las concentraciones de citocromo P450 y b5 reductasis fueron determinadas en microsomas aislados de hígados de ratones tratados (CBZt) y comparadas con las obtenidas en ratones no tratados (CBZst)
RESULTADOS: La carbamazepina no alteró la amplitud de las respuestas musculares; in vitro y in vivo, no hubo diferencia entre el bloqueo neuromuscular producido por el atracurio en las preparaciones CBZt versus CBZst; el bloqueo neuromuscular producido por el Rocuronio en las preparaciones CBZt fue potenciado in vitro. La carbamazepina no alteró las concentraciones de citocromo P450 y b5.
CONCLUSIONES: El tratamiento por siete días con carbamazepina, no influenció en el bloqueo producido por el atracurio, y alteró in vitro los efectos del rocuronio. El tiempo de tratamiento no fue suficiente para causar la inducción enzimática y disminuir la sensibilidad al rocuronio.
INTRODUÇÃO
Muitos são os fármacos utilizados nos períodos pré ou perioperatório que podem interferir na transmissão neuromuscular ou nas características farmacocinéticas e farmacodinâmicas dos bloqueadores neuromusculares, dificultando ou potencializando o efeito dos mesmos. Entre os fármacos que podem alterar os efeitos dos bloqueadores neuromusculares encontram-se os anestésicos locais, agentes anestésicos voláteis, antibióticos aminoglicosídeos, anticonvulsivantes, antidisrítmicos, magnésio, lítio, bloqueadores de canais de cálcio e outras 1-7.
Os anticonvulsivantes são muito utilizados no tratamento de epilepsia, transtorno bipolar e várias formas de neuropatias. Dentre os mais indicados estão a fenitoína, a vigabatrina, a carbamazepina, o valproato, o fenobarbital e a lamotrigina 8-12. O bloqueio de canais de sódio voltagem-dependentes é o mecanismo primário de ação desses agentes. Há redução da excitabilidade elétrica das membranas celulares, necessária para a geração de um potencial de ação 10. Além disso, por inibirem a GABA transaminase, potencializam a inibição sináptica mediada pelo GABA 8-10. Alguns desses fármacos parecem atuar por meio de um terceiro mecanismo, que consiste em inibição dos canais de cálcio do tipo L e em outros subtipos de canais de cálcio voltagem-dependentes 8,10.
A carbamazepina, derivada dos agentes antidepressivos tricíclicos e eficaz no tratamento de crises parciais complexas é também utilizada no tratamento de vários tipos de dor neuropática, incluindo a de origem diabética 11-12. Atualmente é um dos agentes antiepiléticos mais utilizados, sendo algumas vezes útil no tratamento da doença maníaco-depressiva 8.
Embora inúmeros estudos tenham sido realizados para investigar os efeitos dos anticonvulsivantes nas respostas musculares e sua interação com bloqueadores neuromusculares, os resultados ainda são conflitantes. Alguns estudos mostraram que os anticonvulsivantes modificam as respostas aos bloqueadores neuromusculares, potencializando, diminuindo ou mesmo não alterando os seus efeitos 13-19. Portanto, o estudo dessas interações pode ser interessante na prática anestésica ou em pacientes críticos. O estudo realizado em ratos tratados (CBZt) ou não (CBZst) com carbamazepina, por um período de sete dias, teve por objetivo avaliar in vitro e in vivo o efeito da carbamazepina na transmissão neuromuscular e a sua influência no bloqueio neuromuscular produzido pelo atracúrio e pelo rocurônio, bem como as concentrações de citocromo P450 e b5 redutase em microssomos hepáticos.
MÉTODO
Trata-se de estudo experimental in vitro e in vivo e os procedimentos usados estão de acordo com os princípios éticos na experimentação animal adotado pelo Colégio Brasileiro de Experimentação Animal (COBEA) e foram aprovados pela Comissão de Ética em Experimentação Animal do Instituto de Biologia da Universidade Estadual de Campinas. Foram utilizados ratos machos de linhagem Wistar, com peso entre 180 e 250 g, fornecidos pelo Biotério Central da Unicamp, Campinas (SP). Os animais foram tratados por sete dias com carbamazepina (40 mg.kg-1) pelo método da gavagem, mantidos em gaiolas, em temperatura e iluminação controlada (12 horas claro e 12 horas escuro) e receberam água e ração ad libitum.
Estudo das respostas musculares
Para o estudo in vitro, utilizou-se a preparação nervo frênico-hemidiafragma de rato (NFD). Os animais (n = 5), sob anestesia com uretana (1,2 mg.kg-1, via intraperitonial), foram sacrificados no oitavo dia após tratamento com carbamazepina e a preparação foi montada de acordo com a técnica descrita por Bulbring 21. Os hemidiafragmas com os nervos frênicos correspondentes foram retirados e fixados em cuba, contendo 40 mL de solução nutritiva de Tyrode com a seguinte composição mM: NaCl 137; KCl 2,7; CaCl2 1,8; NaHCO3 11,9; MgCl2 0,25; NaH2PO4 0,3 e glicose 11. A preparação foi aerada constantemente com carbogênio (95% O2 + 5% CO2) e mantida a 37°C. O nervo foi colocado sobre eletrodos de platina ligados a um estimulador Grass S48. O diafragma foi mantido por sua porção tendinosa sob tensão constante (5 g) por meio de um fio ligado a um transdutor isométrico Load Cell BG50 GMS, e submetido à estimulação indireta de 0,1 Hz de freqüência e duração de 0,2 mseg e as respostas musculares foram registradas em fisiógrafo Gould RS 3400.
Para o estudo in vivo, a preparação foi montada segundo técnica proposta por Leeuwin e Wolters 22. Os ratos foram anestesiados com uretana (1,2 mg.kg-1), submetidos a traqueostomia e mantidos em ventilação mecânica com respirador Hugo Basile (mod. 7025), regulado para manter volume corrente de 1,2 mL.kg-1 de peso corporal e freqüência respiratória de 70 movimentos/min. Após a dissecção e secção do tendão do músculo tibial anterior e do nervo isquiático foi realizada a trepanação da tíbia para a fixação do membro a uma base de cortiça. O tendão do músculo tibial anterior foi conectado a um transdutor isométrico (BG 50g) e este ao fisiógrafo (Gould RS 4300). O coto distal do nervo isquiático foi estimulado (estimulador Grass S48) por meio de eletrodos nele fixados, utilizando-se estímulos supramaximais de 0,2 ms de duração e freqüência de 0,5 Hz. Após o registro da resposta-controle e a verificação do perfeito estado da preparação, atracúrio e rocurônio foram injetadas na veia peniana.
No estudo in vitro, as concentrações empregadas de atracúrio e rocurônio foram de 20 µg.mL-1 e 4 µg.mL-1, respectivamente; em in vivo foram utilizadas doses de 0,5 mg.kg-1 e 0,6 mg.kg-1, respectivamente. As concentrações utilizadas foram escolhidas com base no grau de bloqueio produzido pelas drogas, após a realização de curva dose-resposta (não mostrado). As respostas musculares à estimulação indireta foram registradas antes e a cada 15 minutos, durante 60 minutos após a administração da droga estudada.
Nas preparações in vitro e in vivo foram avaliadas: 1) amplitude das respostas musculares em preparação de ratos tratados com a carbamazepina; 2) o efeito do atracúrio e do rocurônio nas respostas musculares em preparações de ratos tratados (CBZt) ou não (CBZst) com carbamazepina.
Estudo das concentrações de citocromo P450 e b5 redutase
Para a determinação das concentrações de citocromo P450 e b5 redutase nos microssomos hepáticos, foram utilizados fígados retirados dos ratos CBZt (G2), empregados para o estudo das respostas musculares in vitro e in vivo. Constituiu-se um grupo-controle G1 (CBZst, n = 5) que recebeu apenas solução fisiológica durante sete dias. Foi executado o seguinte procedimento: exposição do fígado após incisão ventral; com auxílio de um cateter, foram injetados 50 mL de solução fisiológica sem heparina no ventrículo cardíaco, até o fígado obter uma coloração esbranquiçada, quando foi retirado e congelado em nitrogênio líquido. Foram isolados microssomos hepáticos a partir de fígados individuais. Os tecidos foram homogeneizados a mão com tampão fosfato de potássio que foi centrifugado a 10.000 ´ g por 20 minutos (Centrífuga Beckman Avanti J-20 XPI). O sobrenadante foi coletado e ultracentrifugado a 100.000 ´ g por 1 hora. Os microssomos foram armazenados em freezer a -80°C para posterior dosagem de proteínas totais, em que foi utilizado o método colorimétrico de Bradford (1976) tendo o BSA como padrão. As concentrações específicas de citocromo P450 e b5 foram determinadas, utilizando-se a concentração de b5 com NADH (1 mM) como redutor e a concentração de P450 com DTN (2mM) como redutor e CO (monóxido de carbono) como ligante. Para análise, utilizou-se um espectrofotômetro de placas (Biotek Powerwave 2). As concentrações dos citocromos foram calculadas segundo a fórmula de Lambert-Beer (A/C.L.e), e relacionadas com a concentração de proteínas totais da amostra de microssomos. Em que:
A = delta absorbância;
e = absorbância específica: P450 = 91/mM cm e b5 = 112/mM cm;
L = pista óptica da cubeta, cm;
C = concentração de proteínas microssomais (mg proteína.mL-1).
Os resultados foram expressos em média e desvios-padrão. A amplitude das respostas musculares foi comparada antes e 60 minutos após a administração dos fármacos. As concentrações de P450 e b5 redutase obtidas em fígados de ratos previamente tratados com carbamazepina (CBZt) foram comparadas com as do grupo-controle (solução fisiológica, CBZst). Utilizou-se o teste t de Student, assumindo-se o nível de significância de 5% (a = 5%). O poder do teste foi calculado e obteve-se b > 20% (poder > 80%).
RESULTADOS
Das respostas musculares
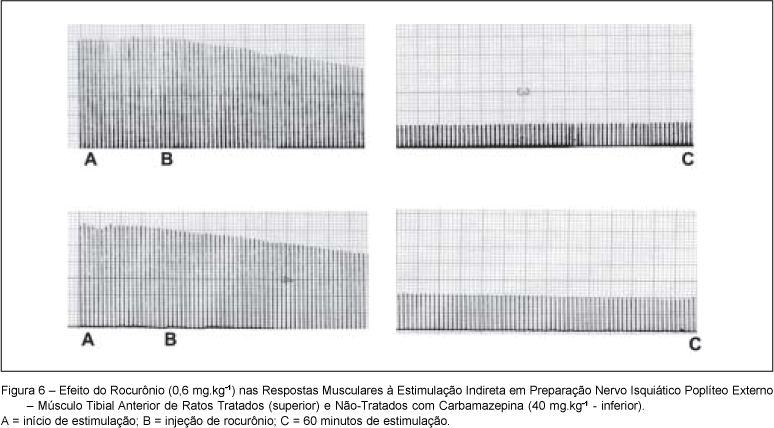
Nas preparações in vitro (nervo frênico diafragma de rato) e in vivo (nervo isquiático poplíteo externo músculo tibial anterior) de ratos expostos a carbamazepina (40 mg.kg-1), não houve alterações significativas na amplitude das respostas musculares à estimulação indireta (Figuras 1 e 2).
In vitro, o bloqueio neuromuscular produzido pelo atracúrio nas preparações de ratos tratados (CBZt) foi 70,0 ± 8,16%, sem diferença significativa em relação ao obtido (74,7 ± 5,05%) nas preparações de ratos não-tratados (CBZst) (Figura 3).
Em relação ao rocurônio, nos ratos CBZt o bloqueio neuromuscular foi de 85,3 ± 17,52% versus 59,7 ± 20,1% nos CBZst, com diferença estatisticamente significativa (p = 0,0003) (Figura 4).
Nos experimentos in vivo, o bloqueio neuromuscular produzido pelo atracúrio, em ratos CBZt foi 56,87 ± 9,73%, sem diferença significativa em relação ao obtido (56,5 ± 12,0%) em ratos CBZst (Figura 5).
Nos ratos CBZt, o bloqueio neuromuscular produzido pelo rocurônio foi de 78,9 ± 18,39%, sem diferença significativa em relação aos ratos CBZst (65,8 ± 6,92%) (Figura 6).
Das concentrações de citocromo P450 e b5 redutase
As concentrações de citocromos P450 e b5 redutase em microssomos hepáticos nos dois grupos (CBZst e CBZt) foram: CBZst (0,43 e 0,45 nmol/mg proteína, respectivamente); CBZt (0,39 e 0,37 nmol.mg-1 proteína, respectivamente), sem diferença significativa (Figura 7).
DISCUSSÃO
Há evidências de que as propriedades farmacocinéticas e farmacodinâmicas dos bloqueadores neuromusculares podem ser modificadas por fatores como idade, estado ácido-básico, temperatura, certas patologias (queimaduras, doenças do neurônio motor superior e inferior) e fármacos 1,6,7. Entre os fármacos utilizados nos períodos pré ou perioperatório, alguns podem atuar de forma isolada ou não na transmissão neuromuscular, assim como são capazes de potencializar ou atenuar o efeito dos bloqueadores neuromusculares.
As mudanças nas respostas desses fármacos podem ser decorrentes de alterações na sua distribuição, metabolismo e eliminação, assim como no nível de junção neuromuscular proximal ao sistema nervoso central ou na membrana muscular. Na junção neuromuscular, a interação pode dever-se à ação no terminal nervoso, na fenda sináptica ou na membrana pós-sináptica, com conseqüente alteração no potencial de ação do nervo, na síntese, liberação ou hidrólise enzimática da acetilcolina, no efluxo de cálcio, ou mesmo por alteração no número e na sensibilidade dos receptores nicotínicos, além de poder causar bloqueio não-competitivo de canais iônicos. Esses fatores influenciam na farmacologia dos bloqueadores neuromusculares, aumentando ou diminuindo e prolongando ou encurtando o bloqueio neuromuscular 6,15,20, 23-26.
Entre esses fármacos, os anticonvulsivantes, muito utilizados no tratamento da epilepsia, transtorno bipolar, neuralgia trigeminal e neuropatia diabética 8-12, podem por si só agir na junção neuromuscular, alterar ou mesmo não interferir nas propriedades farmacodinâmicas e farmacocinéticas dos bloqueadores neuromusculares 13-19,25-34. Do ponto de vista farmacológico e clínico, a carbamazepina assemelha-se à fenitoína, porém com menos efeitos indesejáveis e, embora eficaz e útil no tratamento de crises parciais complexas, é também empregada no tratamento de vários tipos de dor neuropática. Entre os efeitos adversos é freqüente a fraqueza muscular, que pode resultar da diminuição espontânea ou evocada na liberação quantal de acetilcolina 9,32. Além disso, esses fármacos também atuam na membrana do terminal nervoso, de modo similar ao curare 35. É um potente indutor de enzimas microssomais hepáticas; por conseguinte, ocorrem muitas interações medicamentosas por acelerar o metabolismo de muitos fármacos, tais como anticoncepcionais orais, corticosteróides, fenitoína, varfarina e bloqueadores neuromusculares, sobretudo os aminoesteróides 6,9,19,24-25. Embora a inibição dos canais de cálcio e dos receptores de glutamato esteja envolvida na ação de muitas drogas anticonvulsivantes, o principal mecanismo de ação da carbamazepina parece dever-se ao comprometimento da excitabilidade das membranas por meio de uma ação inibitória dos canais de sódio voltagem-dependentes que transportam a corrente para o interior da célula, necessária para a geração de um potencial de ação 9,36.
O atracúrio, bloqueador neuromuscular não-despolarizante do grupo benzilisoquinoleínico, consiste em uma mistura racêmica de dez estereoisômeros. Apresenta metabolização plasmática, que inclui hidrólise por esterases inespecíficas e uma autodegradação denominada eliminação de Hofmann, pH e temperatura-dependentes, o que constituiu grande avanço pelo fato de sua degradação não ser afetada por disfunções orgânicas. O rocurônio é um bloqueador neuromuscular não-despolarizante, aminoesteróide e, ao contrário do observado para o atracúrio, seu término de ação depende principalmente dos processos de distribuição, captação hepática seguido de eliminação inalterado que é predominantemente biliar 37.
Estudos anteriores 38-39, utilizando preparações nervo-músculo in vitro, modelos animais in vivo e ensaios clínicos em humanos, mostraram que o bloqueio neuromuscular produzido por diferentes bloqueadores neuromusculares, como a d-tubocurarina, o vecurônio e o rocurônio, é potencializado pela administração aguda de vários fármacos anticonvulsivantes. A potencialização do bloqueio neuromuscular preexistente, ocasionada pela administração aguda do anticonvulsivante, pode ser atribuída ao fato de esses fármacos competirem com os bloqueadores neuromusculares, deslocando-os dos sítios de ligação nas proteínas plasmáticas com conseqüente aumento da fração livre ativa 39. Outros mecanismos foram descritos na tentativa de esclarecer essa potencialização, tendo sido observado que algumas drogas antiepilépticas exercem efeitos bloqueadores pré e pós-juncional, estabilizadores de membrana neuronal, alterando o fluxo transmembrana de íons sódio, potássio e cálcio, além de reduzir a síntese e a liberação de acetilcolina 7,39,40. Entretanto, estudos prévios têm demonstrado que à exceção do atracúrio e do mivacúrio, a potência e a duração de ação da maioria dos bloqueadores neuromusculares são reduzidas em pacientes em uso crônico de anticonvulsivantes, como a carbamazepina e a fenitoína 15,25-27,29,41.
Nesse estudo, nos dois tipos de experimentos, observou-se que a carbamazepina na concentração empregada não alterou de forma significativa a amplitude das respostas musculares, resultados contrários aos da literatura que mostraram efeitos depressores diretos da carbamazepina na junção neuromuscular 33. Alderdice e Trommer 33 estudaram os efeitos de diferentes anticonvulsivantes na junção neuromuscular de sapo e observaram que, ao contrário do fenobarbital, a carbamazepina ocasionou diminuição na liberação do neurotransmissor com conseqüente diminuição na amplitude do potencial de placa terminal.
Os efeitos do atracúrio tanto em preparação in vivo como in vitro não foram influenciados pela carbamazepina. A influência de anticonvulsivantes no bloqueio neuromuscular produzido pelo atracúrio é ainda controversa. Alguns autores observaram que pacientes tratados cronicamente com fenitoína e carbamazepina não apresentaram resistência ao atracúrio 17,25,42, resultados contrários ao relatado por Tempelhoff e col. 16, que descreveram menor duração de ação do atracúrio em pacientes epilépticos em uso de fenitoína e/ou carbamazepina. Os diferentes resultados observados podem ser atribuídos às metodologias empregadas e aos variados tempos de exposição às drogas anticonvulsivantes 16,17,25,42.
Nesse estudo, o período de sete dias não foi suficiente para produzir indução enzimática, mas, de acordo com estudos anteriores, a explicação para o atracúrio não ter seus efeitos alterados por anticonvulsivantes não está relacionada com a alteração no metabolismo hepático, uma vez que sua metabolização é órgão-independente 17,25,43.
Em relação aos resultados obtidos com o rocurônio in vitro, ao contrário dos experimentos in vivo, observou-se maior grau de bloqueio neuromuscular nas preparações de ratos tratados com carbamazepina em comparação com o obtido nos não-tratados, comportamento similar ao relatado na exposição aguda aos anticonvulsivantes 39-40. Esses resultados diferentes dos da literatura podem ser explicados pelo fato de sete dias não terem sido suficientes para causar alterações na junção neuromuscular, assim como indução enzimática, capazes de ocasionar menor grau e menor duração de bloqueio neuromuscular produzido pelos bloqueadores neuromusculares, sobretudo os aminoesteróides.
Há evidências de que pacientes cronicamente tratados com anticonvulsivantes, apresentam menos sensibilidade aos bloqueadores neuromusculares aminoesteróides. Essa sensibilidade diminuída aos bloqueadores neuromusculares não está claramente estabelecida. A etiologia dessa interação parece ser multifatorial e alguns possíveis mecanismos podem estar envolvidos: indução enzimática com aumento do metabolismo hepático e clearance, aumentada inativação e eliminação dessas drogas; aumento na concentração de a1-glicoproteina ácida, resultando em maior ligação protéica, menor fração livre de drogas catiônicas e alteração na distribuição; menor sensibilidade do receptor à acetilcolina; proliferação de receptores na membrana muscular 6,13,17,19,25,32,34,41,44-50.
A tentativa de correlacionar resultados obtidos in vitro com a clínica é tarefa difícil; por isso, os ensaios in vivo foram realizados, pois são mais apropriados ao estudo farmacológico de drogas, em que pesem as diferenças entre ensaios experimentais e clínicos.
Os resultados permitem concluir que o tempo de exposição à carbamazepina foi insuficiente para causar indução enzimática e/ou alterações que dificultassem os efeitos dos bloqueadores neuromusculares. Pode-se inferir, portanto, que tenha ocorrido uma interação aguda sinérgica entre a carbamazepina e o rocurônio, o que justifica o maior grau de bloqueio neuromuscular e a importância de se monitorar a transmissão neuromuscular quando do uso concomitante de bloqueadores neuromusculares e carbamazepina.
Apresentado em 26 de fevereiro de 2007
Aceito para publicação em 5 de dezembro de 2007
- 01. Martins RS, Martins ALC Bloqueadores Neuromusculares, em: Manica J Anestesiologia: Princípios e Técnicas. Porto Alegre, Artes Médicas, 1997;308-331.
- 02. Miranda FG, Marín JS, Aränó JA Neurofisiologia de la Union Neuromuscular, em: Gómez JAA, Miranda FG, Bozzo RB Relajantes Musculares em Anestesia y Terapia Intensiva. Madrid, Aran, 2000;61-70.
- 03. Cardoso LSM, Martins CR, Tardelli MA Efeitos da lidocaína por via venosa sobre a farmacodinâmica do rocurônio. Rev Bras Anestesiol, 2005;55:371-380.
- 04. Loyola YCS, Braga AFA, Potério GMB et al. Influência da lidocaína no bloqueio neuromuscular produzido pelo rocurônio. Estudo em preparação nervo frênico diafragma de rato. Rev Bras Anestesiol, 2006;56:147-156.
- 05. Sousa SRS, Braga AFA, Potério GMB et al. Influência da nifedipina no bloqueio neuromuscular produzido pelo atracúrio e pelo cisatracúrio. Estudo em preparações nervo frênicodiafragma de rato. Rev Bras Anestesiol, 2006;56:157-167.
- 06. Haywood PT, Divekar N, Karalliedde LD Concurrent medication and the neuromuscular junction. Eur J Anaesthesiol, 1999;16:77-91.
- 07. Spacek A, Kress HG Drug interactions with muscle relaxants. Acta Anaesthesiol Scand, 1998;42(Suppl 112):236-238.
- 08. Mei PA, Montenegro MA, Guerreiro MM et al. Pharmacovigilance in epileptic patients using antiepileptic drugs. Arq Neuropsiquiatr, 2006;64:198-201.
- 09. Rang HP, Dale MM, Ritter JM et al. Fármacos Antiepilépticos, em: Rang HP, Dale MM, Ritter JM et al. Farmacologia. 5Ş Ed. Rio de Janeiro, Churchill Livingstone Elsevier, 2003;627-639.
- 10. Perucca E An introduction to antiepileptic drugs. Epilepsia, 2005;46:31-37.
- 11. Beydoun S, Alarcón F, Mangat S et al. Long-term safety and tolerability of carbamazepine in painful diabetic neuropathy. Acta Neurol Scand, 2007;115:284-288.
- 12. Eisenberg E, River Y, Shifrin A et al. Antiepileptic drugs in the treatment of neuropathic pain. Drugs, 2007;67:1265-1289.
- 13. Alloul K, Whalley DG, Shutway F et al. Pharmacokinetic origin of carbamazepine-induced resistance to vecuronium neuromuscular blockade in anesthetized patients. Anesthesiology, 1996;84:330-339.
- 14. Nguyen A, Ramzan I In vitro response of neuromuscular blockers after chronic carbamazepine treatment in rats. Pharmazie, 2000;55:957.
- 15. Richard A, Girard F, Girard DC et al. Cisatracurium-induced neuromuscular blockade is affected by chronic phenytoin or carbamazepine treatment in neurosurgical patients. Anesth Analg, 2005;100:538-544.
- 16. Tempelhoff R, Modica PA, Jellish WS et al. Resistance to atracurium-induced neuromuscular blockade in patients with intractable seizure disorders treated with anticonvulsants. Anesth Analg, 1990;71:665-669.
- 17. Spacek A, Neiger FX, Spiss CK et al. Atracurium-induced neuromuscular block is not affected by chronic anticonvulsant therapy with carbamazepine. Acta Anaesthesiol Scand, 1997;41: 1308-1311.
- 18. Spacek A, Nickl S, Neiger FX et al. Augmentation of the rocuronium-induced neuromuscular block by the acutely administered phenytoin. Anesthesiology, 1999;90:1551-1555.
- 19. Spacek A, Neiger FX, Krenn CG et al. Rocuronium-induced neuromuscular block is affected by chronic carbamazepine therapy. Anesthesiology, 1999;90:109-112.
- 20. Kim JU, Lee YK, Lee YM et al. The effect of phenytoin on rocuronium-induced neuromuscular block in the rat phrenic nerve-hemidiaphragm preparation. J Neurosurg Anesthesiol, 2005; 17:149-152.
- 21. Bulbring E Observation on the isolated phyrenic nerve-diaphragm preparation of the rat. Br J Pharmacol, 1946;1:38-61.
- 22. Leeuwin RS, Wolters ECMJ Effects of corticosteroids on the sciatic nerve-tibialis anterior muscle of rats treated with hemicholinium-3. Neurology, 1977;27:171-177.
- 23. Ostergaard D, Engbaek J, Viby-Mogensen J Adverse reactions and interactions of the neuromuscular blocking drugs. Med Toxicol Adverse Drug Exp, 1989;4:351-368.
- 24. Anderson GD A mechanistic approach to antiepileptic drug interactions. Ann Pharmacother, 1998;32:554-563.
- 25. Ornstein E, Matteo RS, Schwartz AE et al. The effect of phenytoin on the magnitude and duration of neuromuscular block following atracurium or vecuronium. Anesthesiology, 1987;67: 191-196.
- 26. Ornstein E, Matteo RS, Weinstein JA et al. Accelerated recovery from doxacurium-induced neuromuscular blockade in patients receiving chronic anticonvulsant therapy. J Clin Anesth, 1991;3:108-111.
- 27. Whalley DG, Ebrahim Z Influence of carbamazepine on the dose-response relationship of vecuronium. Br J Anaesth, 1994; 72:125-126.
- 28. Norman J Resistance to vecuronium. Anaesthesia, 1993;48: 1068-1069.
- 29. Roth S, Ebrahim ZY Resistance to pancuronium in patients receiving carbamazepine. Anesthesiology, 1987;66:691-693.
- 30. Jellish WS, Modica PA, Tempelhoff R Accelerated recovery from pipecuronium in patients treated with chronic anticonvulsant therapy. J Clin Anesth, 1993;5:105-108.
- 31. Jellish WS, Thalji Z, Brundidge PK et al. Recovery from mivacurium-induced neuromuscular blockade is not affected by anticonvulsant therapy. J Neurosurg Anesthesiol, 1996;8:4-8.
- 32. Brodie MJ, Dichter MA Antiepileptic drugs. N Engl J Med, 1996;334:168-175.
- 33. Alderdice MT, Trommer BA Differential effects of the anticonvulsants phenobarbital, ethosuximide and carbamazepine on neuromuscular transmission. J Pharmacol Exp Ther, 1980;215: 92-96.
- 34. Platt PR, Thackray NM Phenytoin-induced resistance to vecuronium. Anaesth Intensive Care, 1993;21:185-191.
- 35. Hartman GS, Fiamengo SA, Riker WF Jr. Succinylcholine: mechanism of fasciculations and their prevention by d-tubocurarine or diphenylhydantoin. Anesthesiology, 1986;65:405-413.
- 36. Kohling R Voltage-gated sodium channels in epilepsy. Epilepsia, 2002;43:1278-1295.
- 37. Stoelting RK, Hillier SC Neuromuscular blocking drugs, em: Stoelting RK, Hillier SC Pharmacology & Physiology in Anesthetic Practice. Philadelphia, Lippincott Williams & Wilkins, 2006; 208-250.
- 38. Norris FH Jr, Colella J, Mcfarlin D Effect of diphenylhydantoin on neuromuscular synapse. Neurology, 1964;14:869-876.
- 39. Gray HS, Slater RM, Pollard BJ The effect of acutely administered phenytoin on vecuronium-induced neuromuscular blockade. Anaesthesia, 1989;44:379-381.
- 40. Nguyen A, Ramzan I Acute in vitro neuromuscular effects of carbamazepine and carbamazepine-10,11-epoxide. Anesth Analg, 1997;84:886-890.
- 41. Soriano SG, Sullivan LJ, Venkatakrishnan K et al. Pharmacokinetics and pharmacodynamics of vecuronium in children receiving phenytoin or carbamazepine for chronic anticonvulsant therapy. Br J Anaesth, 2001;86:223-229.
- 42. Ebrahim ZY, Bulkey R, Roth S Carbamazepine therapy and neuromuscular blockade with atracurium or vecuronium. Anesth Analg, 1988;67:S55.
- 43. Fisher DM, Canfell PC, Fahey MR et al. Elimination of atracurium in humans: contribution of Hofmann elimination and ester hydrolysis versus organ-based elimination. Anesthesiology, 1986;65:6-12.
- 44. Loan PB, Connolly FM, Mirakhur RK et al. Neuromuscular effects of rocuronium in patients receiving beta-adrenoreceptor blocking, calcium entry blocking and anticonvulsant drugs. Br J Anaesth, 1997;78:90-91.
- 45. Kim CS, Arnold FJ, Itani MS et al. Decreased sensitivity to metocurine during long-term phenytoin therapy may be attributable to protein binding and acetylcholine receptor changes. Anesthesiology, 1992;77:500-506.
- 46. Kremer JM, Wilting J, Janssen LH Drug binding to human alpha-1-acid glycoprotein in health and disease. Pharmacol Ver, 1988;40:1-47.
- 47. Martyn JA, Abernethy DR, Greenblatt DJ Plasma protein binding of drugs after severe burn injury. Clin Pharmacol Ther, 1984;35:535-539.
- 48. Wood M Plasma binding and limitation of drug access to site of action. Anesthesiology, 1991;75:721-723.
- 49. Hans P, Brichant JF, Pieron F et al. Elevated plasma alpha1-acid glycoprotein levels: lack of connection to resistance to vecuronium blockade induced by anticonvulsant therapy. J Neurosurg Anesthesiol, 1997;9:3-7.
- 50. Pirttiaho HI, Sotaniemi EA, Pelkonen RO et al. Hepatic blood flow and drug metabolism in patients on enzyme-inducing anticonvulsants. Eur J Clin Pharmacol, 1982;22:441-445.
Datas de Publicação
-
Publicação nesta coleção
11 Mar 2008 -
Data do Fascículo
Abr 2008
Histórico
-
Aceito
05 Dez 2007 -
Recebido
26 Fev 2007