Resumos
JUSTIFICATIVA E OBJETIVOS: Com o avanço da tecnologia cirúrgica e anestésica, expandem-se as indicações de intervenção, assim como, em muitos casos, a necessidade de transfusão de hemoderivados. Com grande valor científico, o tema a ser exposto é alvo de infindáveis discussões que fornecem diferentes diretrizes nos diversos aspectos clínicos e laboratoriais. O objetivo dessa revisão é determinar os sinais clínicos, laboratoriais e de monitoração que devem guiar o início da hemotransfusão, evitando-se qualquer risco e o uso desnecessário de recursos, além da demora no início da terapia, determinando hipóxia tecidual e suas consequências. CONTEÚDO: Foram utilizados artigos científicos de ensaios clínicos e revisões sobre vários assuntos abordados no presente conteúdo. Estes foram divididos em orientações segundo aspectos clínicos e laboratoriais. Após a aplicação da estratégia de busca acima relatada, foram identificados 2.608 artigos científicos do gênero, porém somente 17 referências originais foram selecionadas pelos critérios de inclusão. CONCLUSÕES: A literatura é incerta sobre os critérios clínicos que devem guiar o ponto ideal de início da terapia transfusional, de maneira a se otimizar as relações risco/custo/benefício. Estudos revelam que não existe diferença significativa da oferta de oxigênio (O2) quando se comparam níveis de hemoglobina (Hb) entre 6 e 10 g.dL-1, principalmente pela redução da viscosidade sanguínea, facilitando o fluxo vascular aos tecidos. Existe, no entanto, uma tendência de se recomendar o gatilho da transfusão (GT) sempre que ela atinja valores tão baixos quanto 6-7 g.dL-1. Essa mesma tendência indica que hemácias nunca devem ser administradas com Hb em níveis maiores do que 10 g.dL-1, exceto em situações especiais.
complicações, anemia; hipóxia celular; sangue, transfusão
JUSTIFICATIVA Y OBJETIVOS: Con el avance de la tecnología quirúrgica y anestésica se han extendido las indicaciones de intervención y en muchos casos, la necesidad de transfusión de hemoderivados. Con un gran valor científico, el tema que se expone es objeto de infinitas discusiones que acaban suministrando diferentes directrices en los diversos aspectos clínicos y laboratoriales. El objetivo de esta revisión, es determinar los signos clínicos, laboratoriales y de monitorización que deben guiar el inicio de la hemotransfusión, evitando el riesgo y el uso innecesario de recursos y la demora en el inicio de la terapia, determinando la hipoxia tisular y sus consecuencias. CONTENIDO: Se usaron artículos científicos de ensayos clínicos y revisiones sobre varios asuntos abordados en el texto que se presentará a continuación, dividido en orientaciones según los aspectos clínicos y laboratoriales. Después de la aplicación de la estrategia de búsqueda anteriormente relatada, se identificaron 2.608 artículos científicos del género, pero solamente 17 referencias originales se seleccionaron por los criterios de inclusión. CONCLUSIONES: La literatura no es muy exacta sobre los criterios clínicos que deben guiar el punto ideal de inicio de la terapia transfusional, optimizando las relaciones riesgo/ y coste/beneficio. Los estudios arrojan que no hay diferencia significativa de la oferta de oxígeno (O2) cuando se compara con los niveles de hemoglobina (Hb) entre 6 y 10 g.dL-1, principalmente por la reducción de la viscosidad sanguínea, facilitando el flujo vascular a los tejidos. Existe, sin embargo, una tendencia de recomendar el gatillo de la transfusión (GT) siempre que esa tendencia alcance valores tan bajos como 6 a 7 g.dL-1, y los hematíes nunca deben ser administradas con Hb en niveles mayores que 10 g.dL-1, con excepción de las situaciones especiales.
complicaciones, anemia; hipoxia celular; sangre, transfusión
BACKGROUND AND OBJECTIVES: With the surgical and anesthetic technology advance the indications for intervention are expanding, as well as the need for blood transfusions. Because of its great scientific value, the content to be exposed is subject for endless discussions that provide different guidelines in various clinical and laboratory aspects. The objective of this review is to determine the clinical, laboratorial, and monitoring signs that should guide blood transfusion initiation, avoiding any risk and unnecessary use of resources, as well as the delay on starting therapy, determining tissue hypoxia and its corollaries. CONTENT: Scientific articles of clinical trials and reviews were used to range various subjects approached in the present content. These subjects were divided according to clinical and laboratorial aspects. Once the described search finished, 2,608 papers were identified, but only 17 original references were selected by inclusion criteria. CONCLUSIONS: Literature is unclear about clinical criteria on the ideal moment to begin the transfusion therapy in order to optimize the relations risk/ and cost/benefit. Studies show that there is no significant difference of oxygen supply (O2) in a comparison of hemoglobin (Hb) levels between 6 and 10 g.dL-1, mainly by reduced blood viscosity, facilitating the vascular flow to tissues. However, there is a tendency to recommend the transfusion trigger (TT) when it reaches low values as 6-7 g.dL-1. This same tendency indicates that red blood cells should never be administered with Hb levels > 10 g.dL-1, except in special situations.
anemia; bloodtransfusion; cell hypoxia
ARTIGOS DE REVISÃO
Transfusão consciente de hemoderivados. Revisão sistemática dos fatores indicativos do gatilho para a infusão dos componentes sanguíneos
Ricardo Bittencourt, TEAI; José Costa, TSAI; José Eduardo de Oliveira Lobo, TSAIII; Fábio Costa Aguiar, TEAIV
IAnestesiologista, Maternidade Carmela Dutra, Santa Catarina
IIResponsável, CET, Clínica de Anestesiologia do Hospital Naval Marcílio Dias
IIICorresponsável, CET, Clínica de Anestesiologia do Hospital Naval Marcílio Dias
IVResponsável, Serviço de Dor, Hospital Naval Marcílio Dias
Correspondência para Correspondência para: Dr. Ricardo Bittencourt Maternidade Carmela Dutra Centro Cirúrgico, Serviço de Anestesiologia Rua Irmã Benwarda, 208, 2º Andar Centro 88015270 - Florianópolis, SC, Brasil E-mail: ricardob22@hotmail.com
RESUMO
JUSTIFICATIVA E OBJETIVOS: Com o avanço da tecnologia cirúrgica e anestésica, expandem-se as indicações de intervenção, assim como, em muitos casos, a necessidade de transfusão de hemoderivados. Com grande valor científico, o tema a ser exposto é alvo de infindáveis discussões que fornecem diferentes diretrizes nos diversos aspectos clínicos e laboratoriais. O objetivo dessa revisão é determinar os sinais clínicos, laboratoriais e de monitoração que devem guiar o início da hemotransfusão, evitando-se qualquer risco e o uso desnecessário de recursos, além da demora no início da terapia, determinando hipóxia tecidual e suas consequências.
CONTEÚDO: Foram utilizados artigos científicos de ensaios clínicos e revisões sobre vários assuntos abordados no presente conteúdo. Estes foram divididos em orientações segundo aspectos clínicos e laboratoriais. Após a aplicação da estratégia de busca acima relatada, foram identificados 2.608 artigos científicos do gênero, porém somente 17 referências originais foram selecionadas pelos critérios de inclusão.
CONCLUSÕES: A literatura é incerta sobre os critérios clínicos que devem guiar o ponto ideal de início da terapia transfusional, de maneira a se otimizar as relações risco/custo/benefício. Estudos revelam que não existe diferença significativa da oferta de oxigênio (O2) quando se comparam níveis de hemoglobina (Hb) entre 6 e 10 g.dL-1, principalmente pela redução da viscosidade sanguínea, facilitando o fluxo vascular aos tecidos. Existe, no entanto, uma tendência de se recomendar o gatilho da transfusão (GT) sempre que ela atinja valores tão baixos quanto 6-7 g.dL-1. Essa mesma tendência indica que hemácias nunca devem ser administradas com Hb em níveis maiores do que 10 g.dL-1, exceto em situações especiais.
Unitermos: complicações, anemia; hipóxia celular; sangue, transfusão.
INTRODUÇÃO
Com o avanço das tecnologias cirúrgica e anestésica expandem-se as indicações de intervenção e, em muitos casos, a necessidade de transfusão de hemoderivados. Com grande valor científico, o tema fornece diferentes diretrizes nos aspectos clínicos e laboratoriais.
O principal objetivo da terapia transfusional perioperatória é reduzir a morbimortalidade associada à oferta inadequada de O2 tecidual durante o procedimento1. O melhor entendimento do transporte de O2, da fisiopatologia da anemia e do mecanismo da coagulação possibilita a reavaliação da real necessidade da transfusão nos dias de hoje2. Torna-se, portanto, imprescindível o conhecimento das indicações, contraindicações e complicações da infusão de hemoderivados para que a decisão seja acurada e fomente relações custo/benefício e risco/benefício vantajosas. Estas relações se aplicam respectivamente à instituição e ao binômio equipe-médica/paciente, uma vez que a utilização de sangue e seus derivados são medidas salvadoras em casos bem indicados, mas envolvem complexa logística administrativa e possibilidade de risco à saude do paciente3.
A hipótese desta pesquisa é de que, atualmente, mesmo em grandes centros, existe uma antecipação na decisão de se hemotransfundir. O objetivo é determinar os sinais clínicos, laboratoriais e de monitoração que deverão guiar o início da hemotransfusão, evitando-se o risco e o desperdício de recursos, além da demora no início da terapia que pode levar à hipóxia tecidual e suas consequências4.
MÉTODO
Revisão sistemática de artigos científicos originais, incluindo ensaios clínicos e revisões, sobre vários assuntos abordados no texto a ser apresentado, foram divididas em orientações segundo aspectos clínicos e laboratoriais. A estratégia de busca usada teve foco na base de dados Medline (1970-2009). As referências dos artigos originais selecionados que se enquadraram nos critérios de inclusão também foram analisadas com o objetivo de encontrar artigos que não foram identificados pela estratégia inicial de busca.
As variáveis primárias adotadas nesta revisão foram: gatilho de transfusão (GT), anemia, transfusão sanguínea e de hemoderivados, hemodiluição, reposição sanguínea, lactato, piruvato e metabolismo anaeróbico.
RESULTADOS
Após a aplicação da estratégia de busca acima relatada foram identificados 2.608 artigos científicos do gênero, porém somente 17 referências originais foram selecionadas pelos critérios de inclusão.
Inaba5, em artigo sobre o GT intraoperatório, conclui que a demanda mínima para se manter adequado aporte de O2 é de 12 mL.kg-1.min-1, e faz menção à resolução dos Estados Unidos da América (EUA), de 1988, onde se determina o gatilho transfusional operatório e hemoglobina de 7 g.dL-1, exceto para pacientes cardiopatas.
Von Bormann e col.6 determinaram que em condições de normovolemia, pacientes suportam hematócritos tão baixos quanto 20% em virtude da menor viscosidade e consequente maior velocidade sanguínea. Relatam ainda que pacientes, como testemunhas de Jeová, que se recusaram a receber transfusões sanguíneas em cirurgias cardíacas exibiram hematócritos de até 11% durante a circulação extracorpórea (CEC). Seus resultados de morbimortalidade foram similares aos de pacientes que decidiram receber hemocomponentes com o intuito de elevar a oferta de O2. Os autores concluíram também que hemoglobina (Hb) > 9 g.dL-1 não necessariamente incrementa a oferta de O2 aos tecidos. Outra publicação sugere que não há evidências de que a anemia leve prejudique a cicatrização ou aumente o sangramento e o tempo de hospitalização7.
Weil e col.8, em artigo sobre estudos clínicos do lactato e do piruvato como indicadores de gravidade do déficit circulatório agudo, demonstraram que o lactato é o indicador laboratorial que guarda a correlação mais estreita com o desequilíbrio entre a oferta e consumo de O2, sendo lactato > 2 mmol.L-1 referência indicativa deste quadro para os pacientes cirúrgicos. Atesta-se um aumento da mortalidade de 10% para 90% quando valores de lactato passam de 2,1 para 8 mmol.L-1.
A relação do piruvato com o débito acumulado de O2 não foi estatisticamente significativa em nenhuma parcial estudada (p > 0,10). Como resultado final, o lactato falhou ao predizer a mortalidade em apenas 11% dos casos, comparada com a falha do piruvato (21%) e suas variáveis como excesso de lactato (14%) e relação lactato/piruvato (23%).
Smith e col.9 analisaram o base excess como prognóstico para pacientes internados para terapia intensiva, correlacionando valores < -4 com valores de lactato > 1,5 mmol.L-1.
Em um estudo de Mekontso-Dessap e col.10, eles experimentaram as variáveis O2 e CO2 em pacientes monitorados com cateter de artéria pulmonar (CAP). Avaliaram que dentre todos os parâmetros possíveis, a relação entre a diferença venoarterial de CO2 e conteúdo arteriovenoso de O2 (ΔPCO2/C(a-v)O2) é a que melhor se correlaciona com o metabolismo anaeróbio, e o valor a partir de 1,4 apresentou sensibilidade de 79% e especificidade de 84% com valor preditivo positivo de 86% e negativo de 80% para hiperlactatemia (lactato > 2 mmol.L-1). A necessidade tecidual de O2 (VO2) foi menor no grupo "lactato+" comparado ao grupo "lactato-" (109 ± 41 vs 127 ± 32; p < 0,01), não havendo diferença significativa com relação aos outros parâmetros coletados pelo CAP, como saturação venosa de oxigênio (SvO2), oferta tecidual de oxigênio (DO2), C(a-v)O2 ou taxa de extração de oxigênio (O2ER). A ΔPCO2 foi maior no grupo "lactato+" em relação ao grupo "lactato-" (3,8 ± 2,0 vs 6,1 ± 2,7; p < 0,001). Similarmente, a ΔPCO2/C(a-v)O2 foi maior no grupo "lactato+" comparado ao grupo "lactato-" (2,0 ± 0,9 vs 1,1 ± 0,6; p < 0,0001).
A Tabela I apresenta as variáveis, relacionando os intervalos de confiança:
Hébert e col.11, comparando tranfusão liberal (Hb < 10 g.dL-1) com transfusão restritiva (Hb < 7 g.dL-1) em pacientes críticos, concluíram que o gatilho "10-30" proposto anteriormente foi ineficiente e acarreta uso abusivo de 54% de hemoderivados com gastos anuais milionários nos EUA, o que aumenta os riscos inerentes à terapia transfusional. Nesse estudo foi auferida maior mortalidade após 30 dias em pacientes críticos no grupo de transfusão liberal (18,7% vs 23,3%; p = 0,11) com mortalidade durante hospitalização também maior (22,2% vs 28,1%; p = 0,05).
Vincent e col.3, em estudo observacional prospectivo sobre transfusão em pacientes críticos, observaram relação direta entre o número de unidades de hemácias transfundidas e as taxas de mortalidade, relacionadas principalmente com a imunossupressão inerentes à hemotransfusão.
DISCUSSÃO
A fisiopatologia que responde pelo choque circulatório decorrente da hemorragia/anemia é uma crítica redução no transporte de nutrientes vitais e para os requisitos metabólicos de órgãos e tecidos. Quando existe irregularidade da circulação, secundária à redução do volume sanguíneo (VS), a oferta de O2 fica escassa determinando extensa disfunção celular e injúria isquêmica. Em condições normais, a DO2 (montante de O2 carreado aos tecidos por minuto) permanece aproximadamente entre 950 a 1.150 mL.min-1, e é representada pelo produto do débito cardíaco (DC) com o conteúdo arterial de oxigênio (CaO2) multiplicados por 10 [DC x CaO2 x 10]. A VO2- consumo de O2 pelo organismo em um minuto -, por sua vez, gira em torno de 200 a 250 mL.min-1, e é calculada pelo produto do DC pela diferença arteriovenosa de O2 (C(a-v)O2) [DC x C(a-v)O2]. Em condições de repouso, portanto, o consumo de O2 representa somente aproximadamente 25% da oferta12.
Em estágios iniciais de déficit, o principal mecanismo para compensar a queda da oferta é o aumento da fração de extração de O2 pelos tecidos, que normalmente se situa entre 22% a 30%. Como a musculatura cardíaca apresenta alto metabolismo, normalmente a taxa de extração é superior a 70%, não se beneficiando, com isso, do aumento da taxa de extração na vigência do déficit de O2. Em coronárias normais, essa situação é compensada pela vasodilatação com aumento do fluxo sanguíneo (FS) para o miocárdio, porém, em coronariopatas, essa capacidade de dilatação é reduzida, explicando-se o deslocamento do gatilho da transfusão para valores de Hb = 10 g.dL-1.
Em teoria, quando a DO2 é reduzida a 8 mL.kg-1.min-1, a VO2 também se reduz. Essa redução durante o choque está intimamente relacionada ao aparecimento da acidose láctica e, consequentemente, afeta a sobrevida. Como a oportunidade de mensuração dos requisitos metabólicos geralmente é de difícil aferição durante cirurgias e em condições hemodinâmicas precárias, existem métodos práticos indiretos de se determinar a oferta e consumo de O2. Durante o metabolismo anaeróbico, a oxidação aeróbica do acido tricarboxílico é bloqueada, e a oxidação da nicotinamida-adenina dinucleotídeo (NADH2) em NAD é controlada pela falta de O2 que, na presença de desidrogenase láctica, pende a reação a favor do acúmulo de lactato, elemento de estreita relação com a gravidade do choque8. Reduções no CaO2 pela perda sanguínea necessitam do aumento compensatório de uma das variáveis da fórmula de DO2 para o adequado fornecimento. Esse aumento compensatório é resultante da elevação do DC através da redução da resistência vascular periférica devido à menor viscosidade sanguínea.
A análise dos artigos selecionados conclui que o GT é essencialmente pessoal, variando de acordo com as características de cada individuo como idade, estado físico, a presença ou não de comorbidades cardiovasculares, pneumopatias, nefropatias e dos sinais clínicos pré, peri e pós-operatórios13, em composição com indicativos laboratoriais avaliados de forma pertinente7-9,10,14.
A transfusão de hemoderivados deve ser criteriosa e sem demora. Contudo, uma vez indicada, o transfusionista a deve realizá-la de acordo com conhecimentos de fisiologias básicas, como a do choque, da geração de energia por mecanismo anaeróbio, e interpretar de forma concisa as variáveis hemodinâmicas e de oxigenação tecidual, bem como a análise precisa do gases arteriais e venosos3,8-10,14,15.
O conhecimento das alterações decorrentes da estocagem de sangue é fundamental. Essas alterações incluem: trombocitopenia, redução dos fatores de coagulação V e VIII, acidose metabólica por aumento do ácido láctico e diminuição do bicarbonato, hiperpotassemia, hemólise e diminuição dos níveis de ATP e 2,3 DPG, com resultante alteração da curva de dissociação e aumento da afinidade da hemoglobina pelo O2, o que dificulta a sua liberação para os tecidos. Os glóbulos transfundidos sintetizam 2,3 DPG, normalizando a liberação aos tecidos aproximadamente após 12 a 36 horas, evidenciando que a infusão de hemácias estocadas não aumenta de imediato a oferta de O2 aos tecidos2,3,15.
A avaliação deve começar no pré-operatório com uma revisão minuciosa do prontuário, acompanhada de detalhada anamnese à procura de patologias como as cardiovasculares, nefropatias e coagulopatias, além do uso regular de medicações, vitaminas ou ervas que possam afetar a coagulação, o que, em última instância, deverá influenciar no GT. Deve-se também questionar sobre exposição prévia a drogas como aprotinina ou protamina, em função de potenciais reações alérgicas. O complemento a essa estratégia é a adoção de exames laboratoriais, dosagem de Hb, hematócrito e perfil de coagulação, que é sugerido pela literatura por predizer a necessidade de suporte hematológico2,13.
Quando existem problemas de coagulação relacionados à interferência dos fatores II, VII, IX e X, como no caso do uso de warfarina2,13, as medicações a serem oferecidas incluem antifibrinolíticos, acido épsilon-amino-capróico, ácido tranexâmico e vitamina K.
As medidas de prevenção para a transfusão alogênica incluem a coleta antecipada de sangue 21, 14 e 7 dias antes da cirurgia. A estimulação farmacológica da eritropoiese com eritropoetina na dose de 600 UI.kg-1 deve ocorrer neste mesmo intervalo de coleta, incluindo ainda o dia da cirurgia2,4,13, da anestesia hipotensiva e da hemodiluição normovolêmica aguda, quando se é esperada uma perda sanguínea superior a 20% da volemia2,16.
Os mecanismos compensatórios deste método incluem aumento do DC, alterações das características reológicas do sangue e desvio da curva de saturação da hemoglobina para a direita, com maior extração de O2 pelos tecidos. A recuperação intraoperatória de sangue é outra estratégia válida como prevenção da transfusão alogênica. Tal técnica é indicada: 1) para perdas sanguíneas estimadas em mais de 20% do VS; 2) procedimentos cirúrgicos que necessitem de transfusão em mais de 10% dos pacientes; 3) cirurgias com média de transfusão acima de uma unidade; e 4) pacientes que não podem ou se recusam a ter transfusões alogênicas. As contraindicações são geralmente por contaminação do sangue recuperado. Existem trabalhos na literatura demonstrando maior incidência de metástase após recuperação intraoperatória de sangue em cirurgias oncológicas devido a não remoção de células tumorais por este método2,13.
As recomendações para manejo intraoperatório incluem a visualização direta e abordagem com a equipe cirúrgica da monitoração da perda sanguínea microvascular excessiva; monitoração da perfusão e oxigenação inadequadas de órgãos vitais por sinais convencionais como frequência cardíaca (FC), pressão arterial (PA), débito urinário, SpO2 e a variação de pressão arterial sistólica (PAS), que afere a diferença entre as PAS na fase inspiratória e na expiratória da ventilação mecânica. Variações acima de 10 mm Hg são sugestivas de hipovolemia. Monitorações especiais incluem a ecocardiografia, mensuração de pH de mucosa gástrica, saturação venosa mista e análise de gases sanguíneos, apesar de limitadas.
Somados a esses parâmetros, deve-se manter as indicações de transfusões guiadas por valores laboratoriais, como dosagem seriada de Hb, geralmente indicada com níveis de 6 g.dL-1, especialmente se a anemia é aguda. Níveis de Hb maiores que 10 g.dL-1 geralmente são suficientes e a transfusão usualmente não é recomendada, uma vez que a concentração de O2 pode permanecer constante entre 10 e 15 g.dL-1 7. As indicações para os valores intermediários são determinadas por evidências de isquemia potencial ou real, magnitude de sangramento e fatores de risco para complicações de perfusão e oxigenação inadequadas, incluindo baixa reserva cardiopulmonar e alta VO22,13.
O manejo da coagulopatia intraoperatória inclui visualização do campo cirúrgico, aspiração de sangue, perdas por drenos, gazes e compressas. Deve-se também cogitar o teste laboratorial do perfil de coagulação, apoiado pela literatura.
A transfusão de plaquetas é considerada sempre após sua dosagem sanguínea, e os testes funcionais aplicados quando existe a suspeita de disfunção, como no uso de antiagregantes. A infusão de plaquetas raramente é indicada para níveis sanguíneos acima de 100x103.mm-3 e geralmente indicada para níveis inferioraes a 50x103.mm-3. A decisão de transfundir entre esses valores deve se basear na possibilidade de disfunção e a realização de cirurgias em locais confinados como olho e cérebro. A transfusão profilática por trombocitopenia secundária à destruição plaquetária é ineficaz e contraindicada2, 13.
O plasma fresco congelado (PFC) pode ser considerado após testes de coagulação (TAP, INR e PTT), mas nunca infundido caso esses sejam normais. As indicações durante cirurgia são restritas a: 1) tratamento do sangramento microvascular excessivo na evidência de TAP maior do que 1,5 vezes o normal de referência, INR maior do que 2 e PTT 2 vezes maior do que a referência; 2) correção de sangramento microvascular secundário à deficiência dos fatores de coagulação em pacientes transfundidos mais de uma vez com VS (70 mL.kg-1), considerando que testes de coagulação não seriam obtidos de imediato; 3) reversão urgente de warfarina, com dose entre 5 e 8 mL.kg-1; 4) correção de fator de coagulação desconhecido ou quando o concentrado específico não está disponível; e 5) resistência à heparina (deficiência de antitrombina III) em pacientes necessitando de heparina. O PFC nunca é indicado com intuito osmótico ou de reposição volêmica. Geralmente a dose de 15 a 20 mL.kg-1 é necessária para atingir de 20% a 30% dos fatores, o suficiente para normalizar os testes de coagulação2,13,17. A utilização do PFC para tratamento de coagulopatia diluicional durante a transfusão maciça na ausência de sangramento microvascular difuso não encontra respaldo na literatura, podendo até não ser necessária a reposição de 15 a 20 concentrados de hemácias.
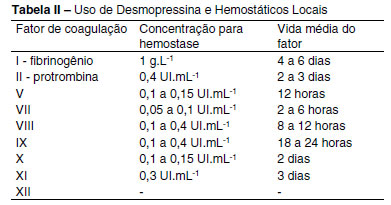
Raramente está indicada transfusão de crioprecipitado se a dosagem de fibrinogênio é superior a 150 mg.dL-1, sendo recomendada para: 1) valores entre 80 e 100 mg% na presença de sangramento microvascular evidente; 2) sangramento microvascular em pacientes transfundidos com grandes volumes, quando a dosagem de fibrinogênio não pode ser auferida prontamente; e 3) pacientes com deficiência congênita de fibrinogênio13. O uso de desmopressina e hemostáticos locais está indicado13 (Tabela II).
Um método prático e indireto de avaliação do déficit de oxigenação tecidual extremamente útil para guiar a terapia transfusional é a mensuração do lactato sanguíneo. O lactato é o produto final da glicólise anaeróbia e é, normalmente, produzido numa taxa de 1 mmol.kg-1.h-1, tendo como fonte única o piruvato. Essa reação assim se dá:
Glicose + 2 ATP + H2PO4 => 2 Lactato + 2 ADP + 2H2O
O lactato gerado pode ser utilizado como substrato primário para oxidação (fonte de energia), podendo-se concluir que o metabolismo anaeróbico é a principal fonte de lactato sérico.
Embora o lactato seja um excelente substrato para análise de anaerobiose, esse parâmetro deve ser analisado com cuidado, observando-se que outras condições também podem elevá-lo sem, porém, significar privação de O2, como na presença de sepse, infusão de adrenalina, deficiência de tiamina, alcalose respiratória ou metabólica, disfunção hepática e intoxicação por nitroprussiato14. Embora essas condições possam confundir a interpretação, deve-se ter em mente que na hiperlactatemia em vigência de boa perfusão tecidual, o mecanismo de tampão é capaz de compensar a queda do pH, não o sendo possível durante a hipoperfusão9.
Mesmo que o lactato seja um substrato do piruvato, somada a outras derivadas do lactato como excesso de lactato e a relação L/P, eles não possuem significância estatística para estabelecer relação com a mortalidade.
Outro parâmetro que se relaciona com a lactatemia é o Base Exess (BE). Segundo Smith e col.9, existe relação entre o excesso de base e a lactatemia pela hipóxia tecidual e disóxia, sendo um parâmetro razoável para o início de reposição volêmica/transfusão caso outros indicadores também apontem para esse tipo de déficit. Devemos guiar a gravidade do excesso de base de acordo com a classificação a seguir: leve (-3 a -5), moderado (-6 a -14) e severo (> -15).
Em condições de hipóxia tecidual, a produção total de CO2 é maior do que o consumo de O2. Isso acontece porque a produção de CO2 em condições de anaerobiose ocorre principalmente pelo tamponamento do excesso de prótons, gerado pela hidrólise de ATP do bicarbonato.
CONCLUSÃO
Inexistem critérios clínicos bem definidos para indicar o momento ideal para início da terapia transfusional. Valores arbitrários são inadequados para definir quando a hemoterapia é indicada. Cada paciente deve ser avaliado individualmente traçando-se estratégias para prevenção do sangramento até a reposição dos componentes. A terapia não deve ser indicada com valores de hemoglobina acima de 10 mg.dL-1, salvo situações especiais em que não há diferença significativa na oferta de O2 quando se comparam níveis de Hb entre 10 e 15 g.dL-1. A associação de indicativos clínicos e laboratoriais de disóxia tecidual parece ser uma boa estratégia para avaliação da necessidade de hemoterapia, sendo geralmente correlacionada a níveis de Hb de 6 mg.dL-1. Para valores intermediários, a avaliação individual de cada paciente é o caminho mais prudente.
AGRADECIMENTOS
Agradecimento especial ao Dr. Mário José da Conceição, por sua gentil colaboração, com pacientes revisões, construtivas críticas e, mais do que úteis, brilhantes opiniões.
Submetido em 1 de abril de 2011.
Aprovado para publicação em 3 de agosto 2011.
Recebido do Hospital Naval Marcílio Dias, Brasil.
- 1. Choy YC, Lim WL Ng SH - Audit of Perioperative Blood Transfusion. Med J Malaysia, 2007;62:299-302.
- 2. Silva ED, Novo RB - Uso crítico de sangue e seus derivados. Atual Anestesiol SAESP, 1997;3:88-107.
- 3. Vincent JL, Baron JF, Reinhart K et al. - Anemia and blood transfusion in critically III patients. JAMA, 2002;288:1499-1507.
- 4. Stulberg BN, Zadzilka JD - Blood management issues. Using blood management strategies. J Arthroplast, 2007;22(Suppl4):95-98.
- 5. Inaba S - Allogenic blood transfusion for surgery. Nihon Geka Gakkai Zasshi, 2005;106(1):13-17.
- 6. Von Bormann B, Aulich S - Critical hematocrit from the viewpoint of the clinician. Beitrage zur Infusionstherapie. 1992;30:216-223 [discussion 247-64]
- 7. Stoelting RK, Miller RD - Bases de anestesia. 4a edição. Editora Roca, 2004.
- 8. Weil MH, Afifi AA - Experimental and clinical studies on lactate and pyruvate as indicators of the severity of acute circulatory failure (Shock). Circulation (American Heart Association), 1970;41:989-1001.
- 9. Smith I, Kumar P, Molloy S - Base excess and lactate as prognostic indicators for patients admitted to intensive care. Intensive Care Med, 2001;27:74-83
- 10. Mekontso-Dessap A, Castelain V, Anguel N et al. - Combination of venoarterial PCO2 difference with arteriovenous O2 content difference to detect anaerobic metabolism in patients. Intensive Care Med, 2002;28:272-277.
- 11. Hébert PC, Wells G, Blajchman MA et al.; Transfusion Requirements in Critical Investigators For the Canadian Critical Care Trials Group - A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. New Eng J Med, 1999;340(6):409-417.
- 12. Felippe HS, Sannuti Pais RG, Cassano AC, Cozza D, Vargas RAA - Monitorização com cateter de Swan-Ganz: aspectos clínicos. Arq Bras Med Naval, 1999;60(01):45-67.
- 13. American Society of Anesthesiologists Task Force on Blood Component Therapy - Practice guideline for blood component therapy. Anesthesiology, 1996;84:732-747
- 14. Knobel E, Akamine N, Junior CJF, Silva E - Terapia intensiva - Hemodinâmica. Rio de Janeiro: Editora Atheneu, 2003.
- 15. Barash PG, Cullen BF, Stoelting RK - Clinical anesthesia. 5Ş edição. Lippincott Williams & Wilkins, 2006.
- 16. Weiskopf RB - Efficacy of acute normovolemic hemodilution assessed as a function of fraction of blood volume lost. Anesthesiology, 2001;94:439-446.
-
17Diretoria Colegiada da Agência nacional de Vigilância Sanitária - Diretrizes para o uso de plasma fresco congelado - PFC de plasma vírus inativo. Resolução-RDC Nº 10, de 23 de Janeiro de 2004 - DOU de 20/02/2004.
Correspondência para:
Datas de Publicação
-
Publicação nesta coleção
05 Jun 2012 -
Data do Fascículo
Jun 2012
Histórico
-
Recebido
01 Abr 2011 -
Aceito
03 Ago 2011