Resúmenes
Justificación y objetivos:
investigar los efectos de la dexmedetomidina sobre la insuficiencia renal isquémica en ratones.
Métodos:
en el presente estudio, 26 ratones machos adultos, albinos Wistar, con un peso de 230-300 g fueron divididos aleatoriamente en 4 grupos: seudooperado (n = 5), isquemia-reperfusión (grupo IR, n = 7), IR/tratamiento de reperfusión con dexmedetomidina (grupo Dex-R, n = 7) e IR/tratamiento preisquemia con dexmedetomidina (grupo Dex-I, n = 7). En el primer grupo, se realizó una seudooperación y no se aplicaron pinzamientos renales. En el grupo IR, la isquemia renal fue inducida por oclusión de las arterias y venas renales bilaterales durante 60 min seguida por reperfusión durante 24 h. En los grupos Dex-R y Dex-I, se llevó a cabo el mismo procedimiento quirúrgico destinado al grupo IR, y la dexmedetomidina (100 µg /kg intraperitoneal) fue administrada 5 min después de la reperfusión y antes de la isquemia. Al final de la reperfusión, fueron recogidas muestras de sangre, los ratones fueron sacrificados y el riñón izquierdo procesado para histología.
Resultados:
los niveles de nitrógeno ureico en la sangre (BUN) de los grupos Dex-R y Dex-I eran significativamente más bajos que los del grupo IR (p = 0,015; p = 0,043), aunque el flujo urinario era significativamente mayor en el grupo Dex-R (p = 0,003). La puntuación histopatológica renal del grupo IR fue significativamente mayor que la de los otros grupos. No hubo diferencia significativa entre los grupos Dex-R y Dex-I.
Conclusiones:
los resultados demostraron que la administración de dexmedetomidina redujo histomorfológicamente la lesión de IR renal. La administración de dexmedetomidina durante el período de reperfusión fue considerada más eficaz debido al aumento de producción de orina y a la disminución de los niveles de nitrógeno ureico en la sangre.
Renal; Isquemia-reperfusión; Dexmedetomidina; Insuficiencia renal aguda
Background and objectives:
We investigated the effect of dexmedetomidine on ischemic renal failure in rats.
Methods:
In the present study, 26 male adult Wistar albino rats weighting 230-300 g were randomly separated into four groups: sham-operated (n = 5), ischemia reperfusion (IR) (IR group, n = 7), IR/reperfusion treatment with dexmedetomidine (Dex. R group, n = 7) and IR/pre-ischemic treatment with dexmedetomidine (Dex. I group, n = 7). In the first group, sham operation was achieved and renal clamps were not applied. For the IR group, renal ischemia was induced by occlusion of the bilateral renal arteries and veins for 60 min followed by reperfusion for 24 h. For the Dex. R and Dex. I groups, the same surgical procedure as in the IR group was performed, and dexmedetomidine (100 mcg/kg intraperitoneal) was administrated at the 5th min after reperfusion and before ischemia. At the end of reperfusion, blood samples were drawn, the rats were sacrificed, and the left kidney was processed for histopathology.
Results:
The blood urea nitrogen (BUN) levels in groups Dex. R and Dex. I were significantly lower than in the IR group (p = 0.015, p = 0.043), although urine flow was significantly higher in group Dex. R (p = 0.003). The renal histopathological score in the IR group was significantly higher than in the other groups. There was no significant difference between the Dex. R and Dex. I groups.
Conclusions:
The results were shown that administration of dexmedetomidine reduced the renal IR injury histomorphologically. Administration of dexmedetomidine in the reperfusion period was considered as more effective due to increase in urinary output and decrease in BUN levels.
Kidney; Ischemia/reperfusion; Dexmedetomidine; Acute renal failure
Justificativa e objetivos:
Investigar os efeitos de dexmedetomidina sobre a insuficiência renal isquêmica em ratos.
Métodos:
No presente estudo, 26 ratos machos adultos, albinos Wistar, com peso 230-300 g, foram randomicamente divididos em quatro grupos: pseudo-operado (n = 5), isquemia-reperfusão (grupo IR, n = 7), IR/tratamento de reperfusão com dexmedetomidina (grupo Dex-R, n = 7) e IR/tratamento pré-isquemia com dexmedetomidina (grupo Dex-I, n = 7). No primeiro grupo, uma pseudo-operação foi feita e clampeamentos renais não foram aplicados. No grupo IR, isquemia renal foi induzida por oclusão das artérias e veias renais bilaterais durante 60minutos seguida por reperfusão durante 24horas. Nos grupos Dex-R e Dex-I, o mesmo procedimento cirúrgico destinado ao grupo IR foi feito e dexmedetomidina (100mcg/kg intraperitoneal) foi administrada cinco minutos após a reperfusão e antes da isquemia. No fim da reperfusão, amostras de sangue foram coletadas, os ratos foram sacrificados e os rins esquerdos processado para histologia.
Resultados:
Os níveis de nitrogênio ureico no sangue (BUN) dos grupos Dex-R e Dex-I estavam significativamente mais baixos do que os do grupo IR (p = 0,015, p = 0,043), embora o fluxo urinário tenha sido significativamente maior no grupo Dex-R (p = 0,003). O escore histopatológico renal do grupo IR foi significativamente maior do que os dos outros grupos. Não houve diferença significativa entre os grupos Dex-R e Dex-I.
Conclusões:
Os resultados demonstraram que a administração de dexmedetomidina reduziu histomorfologicamente a lesão de IR renal. A administração de dexmedetomidina durante o período de reperfusão foi considerada como mais eficaz por causa do aumento do débito urinário e da diminuição dos níveis de BUN.
Renal; Isquemia/reperfusão; Dexmedetomidina; Insuficiência renal aguda
Introducción
La insuficiencia renal aguda es una respuesta isquémica aguda de los riñones que ocurre debido a la hipoperfusión secundaria a la hipotensión, hipovolemia y deshidratación, e isquemia-reperfusión (IR), con altas tasas de morbimortalidad en la práctica clínica11. Thadhani R, Pascual M, Bonventre JV. Acute renal failure. N Engl J Med. 1996;334:1448-60. , 22. Brezis M, Rosen S, Silva P, et al. Renal ischemia: a new perspective. Kidney Int. 1984;26:375-83. and 33. Caron A, Desrosiers RR, Béliveau R. Kidney ischemia reperfusion regulates expression and distribution of tubulin subunits, beta-actin and rho GTPases in proximal tubules. Arch Biochem Biophys. 2004;431:31-46. .
El aumento de la permeabilidad microvascular, edema intersticial, alteración vasorreguladora, infiltración de células inflamatorias, disfunción de las células del parénquima y necrosis tubular aguda, fueron mostrados en estudios histopatológicos relacionados con la lesión de IR renal44. Granger DN, Korthuis RJ. Physiologic mechanisms of postischemic tissue injury. Annu Rev Physiol. 1995;57:311-32. , 55. Brezis M, Rosen S. Hypoxia of the renal medulla-its implications for disease. N Engl J Med. 1995;332:647-55. and 66. Chiao H, Kohda Y, McLeroy P, et al. Alpha-melanocytestimulating hormone protects against renal injury after ischemia in mice and rats. J Clin Invest. 1997;99:1165-72. . Esas alteraciones se exacerbaron 24 h después de la reperfusión y se correlacionaron con niveles elevados de nitrógeno ureico en sangre (BUN) y creatinina sérica (Cr), y son usadas como un indicador de la función renal en entornos clínicos77. Williams P, Lopez H, Britt D, et al. Characterization of renal ischemia-reperfusion injury in rats. J Pharmacol Toxicol Methods. 1997;37:1-7. and 88. Billings FT, Chen SW, Kim M, et al. Alpha-2 adrenergic agonists protect against radiocontrast-induced nephropathy in mice. Am J Physiol Renal Physiol. 2008;295:741-8. .
La dexmedetomidina es un dextroestereoisómero activo de la medetomidina y agonista selectivo de los adrenorreceptores-a2 99. Wikberg JE, Uhlén S, Chhajlani V. Medetomidine stereoisomers delineate two closely related subtypes of idazoxan (imidazoline) I-receptors in the guinea pig. Eur J Pharmacol. 1991;193:335-400. . La dexmedetomidina reduce los niveles plasmáticos de catecolaminas1010. Scheinin M, Kallio A, Koulu M, et al. Sedative and cardiovascular effects of medetomidine, a novel seletive alpha2-adrenoceptor agonist, in healthy volunteers. Br J Clin Pharmacol. 1987;24:443-51. and 1111. Kallio A, Scheinin M, Koulu M, et al. Effects of deksmedetomidine, a seletive alpha 2-adrenoceptor agonist, on hemodynamic control mechanisms. Clin Pharmacol Ther. 1989;46:33-42. , proporciona estabilidad hemodinámica durante la cirugía1212. Aho M, Scheinin M, Lehtinen AM, et al. Intramusculary administered deksmedetomidine attenuates hemodynamic and stress hormone responses to gynecologic laparoscopy. Anesth Analg. 1992;75:932-9. and 1313. Talke P, Chen R, Thomas B, et al. The hemodynamic and adrenergic effects of perioperative deksmedetomidine infusion after vascular surgery. Anesth Analg. 2000;90:834-9. y aumenta la tasa de flujo de la orina1414. Jalonen J, Hynynen M, Kuitunen A, et al. Deksmedetomidine as an anesthetic adjunct in coronary artery bypass grafting. Anesthesiology. 1997;86:331-45. . Villela et al.1515. Villela NR, do Nascimento Júnior P, de Carvalho LR, et al. Effects of dexmedetomidine on renal system and on vasopressin plasma levels. Experimental study in dogs. Rev Bras Anestesiol. 2005;55:429-40. y Frumento et al.1616. Frumento RJ, Logginidou HG, Wahlander S, et al. Deksmedetomidine infusion is associated with enhanced renal function after thoracic surgery. J Clin Anesth. 2006;18:422-6. relataron que la dexmedetomidina causó diuresis acuosa al reducir la secreción de vasopresina y mejoró significativamente la función renal en el postoperatorio en sus estudios clínicos y experimentales. Kocoglu et al.1717. Kocoglu H, Ozturk H, Ozturk H, et al. Effect of deksmedetomidine on ischemia-reperfusion injury in rat kidney a histopathologic study. Renal Failure. 2009;31:70-4. evaluaron los efectos de la dexmedetomidina en la lesión de IR renal, descubriendo que los valores histológicos mejoraron después de 45 min de reperfusión después de 1 h de isquemia renal completa.
El objetivo de este estudio fue evaluar los efectos histopatológicos y bioquímicos de la dexmedetomidina administrada en 2 momentos diferentes (antes de la isquemia y al inicio de la reperfusión), sobre la lesión de IR renal en la vigésima cuarta hora de reperfusión.
Material y métodos
Veintiséis ratones adultos, albinos de la raza Wistar, con un peso de 230-300 g fueron utilizados en este estudio. Los animales fueron alojados en un ambiente con luz controlada por ciclos de 12 h (luz/oscuridad) y con acceso a comida y agua. Los protocolos experimentales y métodos de cuidados de los animales en el estudio fueron aprobados por el Comité de Investigación en animales de experimentación de nuestra institución.
Los ratones fueron divididos en 4 grupos: grupo seudooperado (n = 5), grupo no-tratado IR (grupo IR, n = ), tratamiento de reperfusión con dexmedetomidina (100 µg/kg, 5 min posreperfusión, vía intraperitoneal [IP]) (grupo Dex-R, n = 7), y tratamiento preisquémico con dexmedetomidina (100 µg/kg, 5 min antes de la isquemia, IP) (grupo Dex-I, n = 7). Los ratones fueron anestesiados por vía IP con ketamina (50 mg/kg) y clorhidrato de xilacina (10 mg/kg), y los pedículos renales bilaterales fueron expuestos poslaparotomía. Después de la anestesia, los ratones fueron calentados con una lámpara de calentamiento para mantener la temperatura corporal y rectal a 37 °C. Una solución salina isotónica equivalente al 25% del peso del ratón fue administrada por vía IP antes del cierre del abdomen. Para la lesión de IR inducida, los pedículos renales bilaterales fueron ocluidos por hemostasia con pinzamiento durante 60 min. Al final del período de isquemia, las pinzas fueron retiradas para la reperfusión de sangre. En el grupo seudooperado, los pedículos renales bilaterales fueron expuestos sin ninguna intervención poslaparotomía. Los animales expuestos a 60 min de isquemia fueron alojados en jaulas metabólicas 24 horas después de la reperfusión. Muestras de orina se recogieron en 24 h. Al inicio del estudio, una muestra de 1 mL de sangre se recogió de la vena lateral de la cola para medir los parámetros basales de la función renal antes de la incisión abdominal.
Al final de la reperfusión, los animales fueron anestesiados, se recogieron muestras de sangre de la aurícula derecha para medir los parámetros de la función renal y los riñones izquierdos fueron resecados. Los riñones se metieron en formol al 10% y se zambulleron en cera de parafina, cortados en láminas de 4-5 µm y teñidas con hematoxilina y eosina para el estudio histológico, usando un microscopio de luz.
Las alteraciones histopatológicas fueron analizadas para la infiltración de células mononucleares, extravasación de eritrocitos, dilatación capilar, morfología del corpúsculo renal, vacuolización de túbulos proximales, apoptosis, pérdida del borde en cepillo de las células del túbulo proximal, dilatación tubular y formación de cilindros. La lesión tubulointersticial se clasificó como a continuación exponemos: 0 = ninguna, 1 = 0-10%, 2 = 11-25%, 3 = 26-45%, 4 = 46-75% y 5 = 76-100%1818. Feng L, Xiong Y, Cheng F, et al. Effect of ligustrazine on ischemia-reperfusion injury in murine kidney. Transplant Proc. 2004;36:1949-51. . La puntuación de los datos histológicos fue realizada por un investigador que no conocía la designación de los grupos.
Los niveles de BUN y Cr sérica fueron medidos. También la excreción fraccionada de sodio (FENa) y el aclaramiento de Cr (CCr) fueron calculados a partir de la siguiente fórmula: FENa = UNaV/(PNa × CCr) × 100 (UNaV: sodio urinario, PNa: sodio plasmático)1919. Fujii T, Takaoka M, Muraoka T, et al. Preventive effect of lcarnosine on ischemia/reperfusion-induced acute renal failure in rats. Eur J Pharmacol. 2003;474:261-7. ; = (Cr urinaria × volumen de orina)/(Cr plasmática × tiempo)2020. Hull ME. A new doctor for a men diabetes and hypertension;. In: Scott MG, Gronowski AM, Eby CS, editors. Tietz's applied laboratory medicine. 2nd ed. Hoboken: John Wiley & Sons Inc; 2007. p. 65-74. .
Para el análisis estadístico se usó el SPSS 15.0 (Statistical Package for the Social Sciences, versión 15, Chicago, IL, EE. UU.). Todos los datos fueron expresados como media ± desviación estándar (media ± DE). El análisis univariado fue realizado con el test U de Mann-Whitney para comparar 2 grupos independientes. El nivel de significación estadística aceptado fue p < 0,05.
Resultados
Un total de 26 ratones fueron incluidos en el estudio. Un ratón del grupo IR murió durante el período de isquemia y fue excluido del estudio; por tanto, 25 ratones completaron el estudio. Las puntuaciones histopatológicas de los ratones en todos los grupos aparecen en la tabla 1.
Las puntuaciones histomorfológicas de las lesiones del grupo seudooperado fueron de modo significativo estadísticamente más bajas que las de los grupos IR, Dex-I y Dex-R (respectivamente, p = 0,003; p = 0,002; p = 0,002). Las puntuaciones fueron significativamente más altas en el grupo IR que en los grupos Dex-I y Dex-R (respectivamente, p = 0,018; p =0,026). La diferencia entre las puntuaciones del grupo Dex-R y del Dex-I no fue estadísticamente significativa (p = 0,59).
Infiltración de células mononucleares
Las puntuaciones histomorfológicos de las lesiones del grupo seudooperado (control) fueron significativamente inferiores a las de los grupos IR, Dex-I y Dex-R (respectivamente, p = 0,01; p = 0,029; p = 0,03). Las diferencias entre las puntuaciones de los grupos IR, Dex-I y Dex-R no fueron estadísticamente significativas (respectivamente, p = 0,08; p = 0,29). La diferencia entre las puntuaciones de los grupos Dex-R y Dex-I no fue estadísticamente significativa (p = 0,59).
Extravasación de eritrocitos
Las puntuaciones histomorfológicas de las lesiones del grupo seudooperado (control) fueron significativamente más bajas que las de las grupos IR, Dex-I y Dex-R (respectivamente, p = 0,004; p = 0,002; p = 0,002). Las puntuaciones del grupo IR fueron significativamente más altas que las del grupo Dex-R (p = 0,03), pero no hubo diferencia estadísticamente significativa entre las puntuaciones de los grupos IR y Dex-I (p = 0,29).
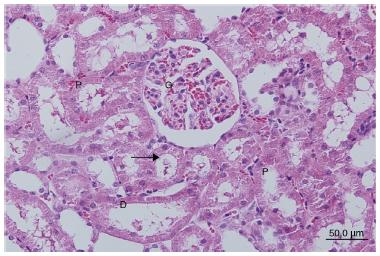
El grupo seudooperado tuvo características morfológicas normales. No se observó ninguna infiltración celular ni pérdida del borde en cepillo de las células del túbulo proximal (fig. 1).
Cortes del grupo seudooperado. D: túbulo distal; G: glomérulo; P: túbulo proximal.; (→) borde en cepillo de célula tubular.
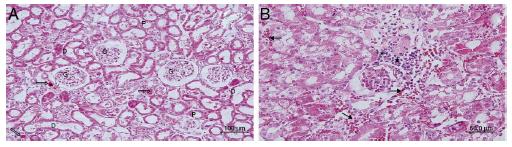
En el grupo IR, se observó infiltración de células mononucleares en el área peritubular, especialmente en el área cortical, pérdida del borde en cepillo de las células del túbulo proximal, atrofia tubular, dilatación tubular y vacuolización. En algunos túbulos, fue observada la deposición de material proteico, con una formación de cilindros y detritos celulares en la luz de los túbulos. En algunas áreas de la corteza, destacaba vasodilatación y extravasación de eritrocitos (fig. 2A-C).
(A) Cortes del grupo isquemia-reperfusión. D: túbulo distal; G: glomérulo; P: túbulo proximal; (→) acumulación de material proteico en los túbulos; (*): células epiteliales del túbulo proximal vertidas a la luz. (B) Cortes del grupo isquemia-reperfusión. D: túbulo distal; P: túbulo proximal; (→) infiltración de células mononucleares; (*): células epiteliales del túbulo proximal vertidas a la luz. (C) Cortes del grupo isquemia-reperfusión. (→) extravasación de eritrocitos; (*): túbulos y acumulación de material proteico en los túbulos.
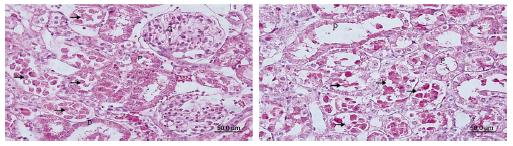
La atrofia tubular, dilatación tubular y vacuolización, deposición de material proteico en los túbulos y pérdida de fragmentos y bordes en cepillo de las células del lumen del túbulo fueron más observadas en el grupo IR que en el grupo Dex-R (Figs. 3A y 3B).
(A-B) Cortes del grupo de tratamiento de reperfusión con dexmedetomidina. D: túbulo distal; G: glomérulo; P: túbulo proximal; (→) la apariencia de que la acumulación de material proteico en los túbulos se redujo en comparación con los otros grupos.
Reducciones de la infiltración de células mononucleares en la región cortical, especialmente en el área peritubular, y de la degeneración de células tubulares y extravasación de eritrocitos fueron observadas en el grupo Dex-I comparado con el grupo IR (Figs. 4A y 4B).
(A-B) Cortes del grupo de tratamiento preisquemia con dexmedetomidina. D: túbulo distal; G: glomérulo; P: túbulo proximal; (→) células epiteliales del túbulo proximal vertidas a la luz.
En la comparación histomorfológica de los grupos Dex-R y Dex-I, la pérdida del borde en cepillo de las células del túbulo proximal, atrofia tubular, dilatación tubular, vacuolización, deposición de material proteico en algunos túbulos, formación de cilindros y detritos celulares en la luz de los túbulos, fue mayor en el grupo Dex-I que en el grupo Dex-R. En el análisis estadístico de la puntuación semicuantitativa de la microscopia de luz de esos 2 grupos, fueron determinadas diferencias estadísticamente significativas en las puntuaciones de extravasación de eritrocitos, túbulo proximal e infiltración de células mononucleares.
Parámetros bioquímicos
En el grupo IR, el volumen de orina y CCr resultaron significativamente menores (respectivamente, p = 0,006; p = 0,025) y los niveles de BUN, Cr y FENa significativamente mayores que en el grupo seudooperado (respectivamente, p = 0,006; p = 0,006; p = 0,025).
El volumen de orina fue significativamente mayor en el grupo Dex-R que en los grupos IR y Dex-I (respectivamente, p = 0,003; p = 0,030) y el valor del BUN fue significativamente menor en los grupos Dex-R y Dex-I que en el grupo IR (respectivamente, p = 0,015; p = 0,043). Los datos bioquímicos de los grupos aparecen en la tabla 2.
Discusión
En este estudio experimental, usamos un modelo de IR renal en ratón durante 60 min para crear una lesión renal con riesgo de muerte, que fue inducida por pinzamiento de las estructuras vasculares renales bilaterales. La lesión renal fue analizada de acuerdo con las alteraciones histomorfológicas y con la función renal en la vigésima cuarta hora de reperfusión. En el presente estudio, en comparación con el grupo seudooperado para los signos de esa deficiencia en la función renal, el grupo IR tuvo una disminución significativa del volumen de orina y CCr y un aumento significativo de los niveles de FENa, BUN y Cr.
Además, la presencia de la lesión tubular renal fue apoyada por el aumento significativo de las puntuaciones de las lesiones histopatológicas en comparación con el grupo seudooperado. Esos hallazgos histológicos y bioquímicos, de acuerdo con estudios anteriores, evidenciaron que la lesión de IR causó una disfunción tanto glomerular como tubular en el riñón1717. Kocoglu H, Ozturk H, Ozturk H, et al. Effect of deksmedetomidine on ischemia-reperfusion injury in rat kidney a histopathologic study. Renal Failure. 2009;31:70-4. , 1919. Fujii T, Takaoka M, Muraoka T, et al. Preventive effect of lcarnosine on ischemia/reperfusion-induced acute renal failure in rats. Eur J Pharmacol. 2003;474:261-7. and 2121. Hussein Ael-A, Shokeir AA, Sarhan ME, et al. Effects of combined erythropoietin and epidermal growth factor on renal ischaemia/reperfusion injury: a randomized experimental controlled study. BJU Int. 2011;107:323-8. .
En estudios anteriores, en los cuales se crearon modelos de lesión de IR renal, se aplicaron diferentes duraciones de isquemia y reperfusión77. Williams P, Lopez H, Britt D, et al. Characterization of renal ischemia-reperfusion injury in rats. J Pharmacol Toxicol Methods. 1997;37:1-7. , 1717. Kocoglu H, Ozturk H, Ozturk H, et al. Effect of deksmedetomidine on ischemia-reperfusion injury in rat kidney a histopathologic study. Renal Failure. 2009;31:70-4. , 1919. Fujii T, Takaoka M, Muraoka T, et al. Preventive effect of lcarnosine on ischemia/reperfusion-induced acute renal failure in rats. Eur J Pharmacol. 2003;474:261-7. , 2020. Hull ME. A new doctor for a men diabetes and hypertension;. In: Scott MG, Gronowski AM, Eby CS, editors. Tietz's applied laboratory medicine. 2nd ed. Hoboken: John Wiley & Sons Inc; 2007. p. 65-74. and 2222. Gu J, Sun P, Zhao H, et al. Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice. Crit Care. 2011;15:153. . Williams et al.77. Williams P, Lopez H, Britt D, et al. Characterization of renal ischemia-reperfusion injury in rats. J Pharmacol Toxicol Methods. 1997;37:1-7. crearon isquemia durante 45 min con pinzamiento de arterias y venas renales bilaterales e investigaron los efectos de la lesión de IR sobre los niveles de BUN y Cr e histología renal en la reperfusión durante 0; 0,5; 1; 2; 4; 6; 9 y 24 h y después de una semana. Esos investigadores relataron que la lesión renal más rápida empezó en la cuarta hora después de la isquemia de 45 min, alcanzando el pico en la vigésima cuarta hora. Igualmente, Yamamoto et al.2323. Yamamoto K, Wilson DR, Baumal R. Outer medullary circulatory defect in ischemic acute renal failure. Am J Pathol. 1984;116:253-61. y Arendshorst et al.2424. Arendshorst WJ, Finn WF, Gottschalk CW. Pathogenesis of acute renal failure following temporary renal ischemia in the rat. Circ Res. 1975;37:558-68. relataron que la necrosis tubular aguda y el defecto de perfusión medular fueron más evidentes después de 22-48 h de reperfusión.
Gu et al.2222. Gu J, Sun P, Zhao H, et al. Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice. Crit Care. 2011;15:153. crearon una lesión renal moderada con pinzamiento de los pedículos renales bilaterales durante 25 min. Para originar una lesión renal con riesgo de muerte en ratones, ellos hicieron el pinzamiento del pedículo renal derecho durante 40 min y extrajeron el riñón izquierdo. Esos investigadores relataron que el promedio de los niveles plasmáticos de Cr y de urea aumentó más de 7 veces en la vigésima cuarta hora de reperfusión después de la isquemia durante 40 min. Kocoglu et al.1717. Kocoglu H, Ozturk H, Ozturk H, et al. Effect of deksmedetomidine on ischemia-reperfusion injury in rat kidney a histopathologic study. Renal Failure. 2009;31:70-4. documentaron datos histológicos de la lesión de reperfusión durante 45 min después de la isquemia de 60 min en el riñón izquierdo de ratones sometidos a nefrectomía del riñón derecho. En nuestro estudio, se creó un modelo de isquemia de 60 min mediante pinzamiento de los pedículos renales bilaterales, y los efectos de la IR y tratamientos con dexmedetomidina fueron estudiados 24 h después de la reperfusión. La insuficiencia renal aguda asociada con la isquemia es un síndrome complejo que involucra vasoconstricción renal, lesión tubular, necrosis de las células tubulares, insuficiencia de filtración glomerular y lesión glomerular2525. Bird JE, Milhoan K, Wilson CB, et al. Ischemic acute renal failure and antioxidant therapy in the rat: the relation between glomerular and tubular dysfunction. J Clin Invest. 1988;81:1630-8. and 2626. Weinberg JM. The cell biology of ischemic renal injury. Kidney Int. 1991;39:476-500. . Los medicamentos que pueden ser eficaces para combatir los varios factores que contribuyen para ese daño se han venido usando en la profilaxis y en el tratamiento. La activación simpática debida a la liberación presináptica de noradrenalina y el aumento de los niveles de noradrenalina en la circulación inducidos por el estrés en el riñón, y por ende, la reducción del flujo sanguíneo renal y de la filtración glomerular, fue sugerida como uno de los posibles mecanismos de la insuficiencia renal aguda producida por la lesión de IR.
La dexmedetomidina es un agonista selectivo potente de los adrenorreceptores-a2. Existen informes de que la dexmedetomidina posee una eficacia protectora real para la isquemia focal en conejos, y la isquemia cardíaca, lesión por reperfusión e isquemia del prosencéfalo incompleta en ratones2727. Hoffman WE, Kochs E, Werner C, et al. Deksmedetomidine improves neurologic outcome from incomplete ischemia in the rat. Reversal by the alpha 2-adrenergic antagonist atipamezole. Anesthesiology. 1991;75:328-32. , 2828. Maier CM, Sun GH, Kunis DM, et al. Neuroprotection by the N- methyl- d- aspartate receptor antagonist CGP 40116: In vivo and in vitro studies. J Neurochem. 1995;65:652-9. and 2929. Koçŏglu H, Karaaslan K, Gonca E, et al. Preconditioning effects of dexmedetomidine on myocardial ischemia/reperfusion injury in rats. Curr Ther Res. 2008;69:150-8. . El mecanismo preciso del efecto protector de los agonistas a2-adrenérgicos en el cerebro no está claro. Se cree que la neurotransmisión catecolaminérgica tal vez esté relacionada con ese efecto. La dexmedetomidina reduce la secreción excesiva de noradrenalina debido a la isquemia debido a la activación presináptica de los adrenorreceptores-a2. Eso evita el metabolismo excesivo de noradrenalina que provoca la formación de radicales libres. Se sugiere que la protección contra la lesión cerebral suministrada por la producción de H2O2 disminuye en la reperfusión debido a la prevención de la desaminación oxidativa de catecolaminas3030. Simonson SG, Zhang J, Canada Jr AT, et al. Hydrogen peroxide production by monoamine oxidase during ischemia-reperfusion in the rat brain. J Cereb Blood Flow Metab. 1993;13:125-34. and 3131. Suzuki T, Akaike N, Ueno K, et al. MAO inhibitors, clorgyline and lazabemide, prevent hydroxyl radical generation caused by brain ischemiarreperfusion in mice. Pharmacology. 1995;50:357-62. . Además de eso, se considera que la dexmedetomidina genera la reducción de la muerte celular por necrosis al reducir el tono simpático, como también la inhibición del flujo de iones mediado por el receptor N-metil-D-aspartato3232. Engelhard K, Werner C, Eberspächer E, et al. The effect of the alpha 2-agonist deksmedetomidine and the N-methyl- d- aspartate antagonist S(+)-ketamine on the expression of apoptosis regulating proteins after incomplete cerebral ischemia and reperfusion in rats. Anesth Analg. 2003;96:524-31. . Además de esos posibles mecanismos, Engelhard et al.3232. Engelhard K, Werner C, Eberspächer E, et al. The effect of the alpha 2-agonist deksmedetomidine and the N-methyl- d- aspartate antagonist S(+)-ketamine on the expression of apoptosis regulating proteins after incomplete cerebral ischemia and reperfusion in rats. Anesth Analg. 2003;96:524-31. relataron que la dexmedetomidina aumentó la concentración de proteínas antiapoptóticas. En otro estudio, Wijeysundera et al.3333. Wijeysundera DN, Naik JS, Beattie WS. Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications: a meta-analysis. Am J Med. 2003;114:742-52. sugirieron que los agonistas a2-adrenérgicos redujeron la mortalidad y el infarto de miocardio en la cirugía vascular. En estudios anteriores, el efecto antiisquémico de la dexmedetomidina quedó demostrado con la administración de altas dosis (100 µg/kg); por tanto, en nuestro estudio, usamos la dexmedetomidina en dosis de 100 µg/kg para la lesión de IR renal1717. Kocoglu H, Ozturk H, Ozturk H, et al. Effect of deksmedetomidine on ischemia-reperfusion injury in rat kidney a histopathologic study. Renal Failure. 2009;31:70-4. , 2727. Hoffman WE, Kochs E, Werner C, et al. Deksmedetomidine improves neurologic outcome from incomplete ischemia in the rat. Reversal by the alpha 2-adrenergic antagonist atipamezole. Anesthesiology. 1991;75:328-32. and 3434. Hoffman WE, Baughman VL, Albrecht RF. Interaction of catecholamines and nitrous oxide ventilation during incomplete brain ischemia in rats. Anesth Analg. 1993;77: 908-12..
Kocoglu et al.1717. Kocoglu H, Ozturk H, Ozturk H, et al. Effect of deksmedetomidine on ischemia-reperfusion injury in rat kidney a histopathologic study. Renal Failure. 2009;31:70-4. relataron que una dosis de 100 µg/kg de dexmedetomidina IP administrada al inicio de la reperfusión previene la lesión causada por 60 min de isquemia seguida de reperfusión durante 45 min, lo que causó la insuficiencia renal aguda, presentando glomérulos normales y un ligero edema de las células tubulares. En nuestro estudio, diferente del de Kocoglu et al.1717. Kocoglu H, Ozturk H, Ozturk H, et al. Effect of deksmedetomidine on ischemia-reperfusion injury in rat kidney a histopathologic study. Renal Failure. 2009;31:70-4. , la dexmedetomidina fue usada en 2 momentos diferentes: al inicio de la reperfusión y antes de la isquemia. Además de eso, evaluamos si el efecto renoprotector continuó hasta la vigésima cuarta hora, cuando la lesión de IR alcanzó el pico, con examen histopatológico y test de función renal. Nuestro estudio mostró que la infiltración de células mononucleares, pérdida del borde en cepillo de las células del túbulo proximal, atrofia tubular, dilatación tubular, vacuolización, proteínas y acumulación de detritos celulares en algunos túbulos y extravasación de eritrocitos fueron observados en el grupo IR. También mostramos que las alteraciones del túbulo proximal, que fueron observadas en el grupo IR, disminuyeron significativamente en ambos grupos tratados con dexmedetomidina y que las alteraciones de la extravasación de eritrocitos disminuyeron significativamente en el grupo que recibió dexmedetomidina en el período de reperfusión. Esos hallazgos histológicos evidenciaron que la dexmedetomidina presentó un efecto renoprotector parcial en ambos grupos en la vigésima cuarta hora de reperfusión.
Gu et al.2222. Gu J, Sun P, Zhao H, et al. Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice. Crit Care. 2011;15:153. calcularon los efectos de la dexmedetomidina tanto en cultivos de células humanas in vitro como de ratones in vivo. Los estudios in vitro demostraron que la dexmedetomidina suministró protección a la estructura tubular y previno la muerte celular con la activación de la vía Akt y la debilitación de la vía HMGB1/TLR4 mediada por el receptor a2-adrenérgico. Los estudios in vivo con ratones demostraron que la administración de dexmedetomidina en una dosis de 25 µg/kg IP antes de la isquemia causó una reducción significativa de los niveles de urea y el aumento de Cr en la vigésima cuarta hora, debido al efecto isquémico producido por el pinzamiento de los pedículos renales bilaterales durante 25 min. Los investigadores también relataron una reducción de las puntuaciones de las lesiones histológicas de un 53% y un 38%, con la administración de la dexmedetomidina pre y posisquemia, respectivamente. En ese mismo estudio, los autores informaron que el deterioro de la función renal producida por la isquemia durante 40 min, que fue más grave (7 veces en la vigésima cuarta hora después de la lesión de IR), disminuyó significativamente con el tratamiento tanto pre como posisquemia, y ese fue un efecto dependiente de los receptores a2-adrenérgicos. En nuestro estudio, similar a los resultados de Gu et al.2222. Gu J, Sun P, Zhao H, et al. Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice. Crit Care. 2011;15:153. , descubrimos que la histología y función renal (solamente para los niveles de BUN), mejoraron significativamente con el uso de dexmedetomidina pre y posisquemia para lesiones de IR más graves. Además, Curtis et al.3535. Curtis FG, Vianna PT, Viero RM, et al. Dexmedetomidine and S(+)-ketamine in ischemia and reperfusion injury in the rat kidney. Acta Cir Bras. 2011;26:202-6. calcularon los efectos de la dexmedetomidina sobre las alteraciones histológicas renales y los niveles de Cr después de la lesión de IR en ratones anestesiados con ketamina. Esos investigadores, a diferencia de nosotros, administraron una dosis de agonista de los adrenorreceptores-a2 de 1 µg/kg por vía intravenosa durante 10 min y continuaron con una dosis de 1 µg/kg/h. En ese estudio, el tiempo de isquemia fue de 45 min, y la nefrectomía y extracción de las muestras de sangre fueron realizadas 48 h después de la reperfusión.
Tanto nuestro estudio como el de Gu et al.2222. Gu J, Sun P, Zhao H, et al. Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice. Crit Care. 2011;15:153. demostraron que la dexmedetomidina protegió parcialmente los riñones contra la lesión de IR en la fase tardía de la reperfusión.
En un estudio experimental, Villela et al.1515. Villela NR, do Nascimento Júnior P, de Carvalho LR, et al. Effects of dexmedetomidine on renal system and on vasopressin plasma levels. Experimental study in dogs. Rev Bras Anestesiol. 2005;55:429-40. relataron que la administración de una baja dosis de dexmedetomidina (bolo de 1-2 µg/kg seguido de 1-2 µg/kg, en infusión intravenosa de 1 h), en perros bajo anestesia causó diuresis de agua libre con disminución de la osmolaridad urinaria y niveles plasmáticos de vasopresina. Frumento et al.1616. Frumento RJ, Logginidou HG, Wahlander S, et al. Deksmedetomidine infusion is associated with enhanced renal function after thoracic surgery. J Clin Anesth. 2006;18:422-6. informaron una mejoría postoperatoria de la función renal con infusión de dexmedetomidina en pacientes sin enfermedad renal sometidos a cirugía torácica con el uso de indicadores de filtración glomerular envolviendo el flujo de orina, Cr sérica y alteraciones fraccionarias del nivel de Cr sérica. En ese estudio, la disminución de los niveles séricos de Cr alcanzó el pico en la primera semana postoperatoria. La disminución de los niveles de Cr identificada en el período sin administración del fármaco se aceptó como una prueba de su efecto benéfico en la filtración glomerular. De acuerdo con Frumento et al.1616. Frumento RJ, Logginidou HG, Wahlander S, et al. Deksmedetomidine infusion is associated with enhanced renal function after thoracic surgery. J Clin Anesth. 2006;18:422-6. , la mejoría de la función renal estaba relacionada con la vasoconstricción renal disminuida por la dexmedetomidina. En nuestro estudio, a diferencia de esos investigadores, descubrimos una recuperación limitada de los parámetros bioquímicos renales en la lesión de IR. En este estudio, en ambos grupos que recibieron dexmedetomidina, los valores de BUN fueron determinados como significativamente más bajos que los del grupo IR. Además de eso, la administración de dexmedetomidina al quinto minuto de reperfusión aumentó la producción de orina de modo significativo. Sin embargo esa mejoría determinada en la diuresis y en los niveles de BUN no pudo ser observada en los niveles sanguíneos de Cr y CCr, que son pruebas renales más específicas. Los resultados de nuestro estudio sugieren que se obtuvo una protección histomorfológica y funcional parcial con la dexmedetomidina en la lesión de IR renal.
En el presente estudio, la ketamina-xilacina (KX) fue usada como el régimen anestésico apropiado para los estudios de IR. Debido a su compatibilidad con otros medicamentos y al amplio intervalo de confianza, la ketamina es uno de los agentes anestésicos más usados en estudios experimentales. En la literatura médica, estudios anteriores presentaron resultados contradictorios sobre el efecto de la ketamina en la lesión de IR renal3535. Curtis FG, Vianna PT, Viero RM, et al. Dexmedetomidine and S(+)-ketamine in ischemia and reperfusion injury in the rat kidney. Acta Cir Bras. 2011;26:202-6. , 3636. Yuzer H, Yuzbasioglu MF, Ciralik H, et al. Effects of intravenous anesthetics on renal ischemia/reperfusion injury. Renal Failure. 2009;31:290-6. , 3737. Rusafa Neto E, Vianna PT, Viero RM, et al. Influence of S(+)-ketamine analgesia in renal intraoperative ischemia. Histological study in rats. Acta Cir Bras. 2006;21:242-6. and 3838. Lee HT, Ota-Setlik A, Fu Y, et al. Differential protective effects of volatile anesthetics against renal ischemia-reperfusion injury in vivo. Anesthesiology. 2004;101:1313-24.. Esos estudios que compararon diferentes anestésicos no poseían un verdadero grupo control. Igualmente, una limitación de nuestro estudio es la falta de un verdadero grupo control (placebo), porque todos los animales recibieron KX como régimen anestésico, de acuerdo con el Comité de Ética de nuestra institución. Por tanto, no se pudo determinar la extensión de la protección inducida por la anestesia con KX y compararla con un grupo "placebo". Para estandarizar el efecto del régimen anestésico en nuestro estudio, todos los grupos recibieron anestesia con KX. Además, nuestro estudio tuvo un grupo seudooperado y un grupo control (IR); cuando calculamos los resultados de esos grupos, en los que no fue usado ningún material activo además de la anestesia con KX, la lesión de IR renal no fue observada en el grupo seudooperado, pero sí en el grupo control. Por la tanto, estamos convencidos de que los resultados obtenidos eran independientes del efecto de la anestesia con KX.
Como conclusión, podemos decir que el uso de la dexmedetomidina tanto antes de la isquemia como después de la reperfusión redujo, histomorfológicamente, los efectos de la lesión de IR renal en la vigésima cuarta hora. Aunque no se haya determinado una diferencia histomorfológica significativa entre los 2 métodos, la administración de la dexmedetomidina en el período de reperfusión fue considerada más eficaz debido a la disminución de los niveles de BUN y al aumento de la producción de orina.
References
-
1Thadhani R, Pascual M, Bonventre JV. Acute renal failure. N Engl J Med. 1996;334:1448-60.
-
2Brezis M, Rosen S, Silva P, et al. Renal ischemia: a new perspective. Kidney Int. 1984;26:375-83.
-
3Caron A, Desrosiers RR, Béliveau R. Kidney ischemia reperfusion regulates expression and distribution of tubulin subunits, beta-actin and rho GTPases in proximal tubules. Arch Biochem Biophys. 2004;431:31-46.
-
4Granger DN, Korthuis RJ. Physiologic mechanisms of postischemic tissue injury. Annu Rev Physiol. 1995;57:311-32.
-
5Brezis M, Rosen S. Hypoxia of the renal medulla-its implications for disease. N Engl J Med. 1995;332:647-55.
-
6Chiao H, Kohda Y, McLeroy P, et al. Alpha-melanocytestimulating hormone protects against renal injury after ischemia in mice and rats. J Clin Invest. 1997;99:1165-72.
-
7Williams P, Lopez H, Britt D, et al. Characterization of renal ischemia-reperfusion injury in rats. J Pharmacol Toxicol Methods. 1997;37:1-7.
-
8Billings FT, Chen SW, Kim M, et al. Alpha-2 adrenergic agonists protect against radiocontrast-induced nephropathy in mice. Am J Physiol Renal Physiol. 2008;295:741-8.
-
9Wikberg JE, Uhlén S, Chhajlani V. Medetomidine stereoisomers delineate two closely related subtypes of idazoxan (imidazoline) I-receptors in the guinea pig. Eur J Pharmacol. 1991;193:335-400.
-
10Scheinin M, Kallio A, Koulu M, et al. Sedative and cardiovascular effects of medetomidine, a novel seletive alpha2-adrenoceptor agonist, in healthy volunteers. Br J Clin Pharmacol. 1987;24:443-51.
-
11Kallio A, Scheinin M, Koulu M, et al. Effects of deksmedetomidine, a seletive alpha 2-adrenoceptor agonist, on hemodynamic control mechanisms. Clin Pharmacol Ther. 1989;46:33-42.
-
12Aho M, Scheinin M, Lehtinen AM, et al. Intramusculary administered deksmedetomidine attenuates hemodynamic and stress hormone responses to gynecologic laparoscopy. Anesth Analg. 1992;75:932-9.
-
13Talke P, Chen R, Thomas B, et al. The hemodynamic and adrenergic effects of perioperative deksmedetomidine infusion after vascular surgery. Anesth Analg. 2000;90:834-9.
-
14Jalonen J, Hynynen M, Kuitunen A, et al. Deksmedetomidine as an anesthetic adjunct in coronary artery bypass grafting. Anesthesiology. 1997;86:331-45.
-
15Villela NR, do Nascimento Júnior P, de Carvalho LR, et al. Effects of dexmedetomidine on renal system and on vasopressin plasma levels. Experimental study in dogs. Rev Bras Anestesiol. 2005;55:429-40.
-
16Frumento RJ, Logginidou HG, Wahlander S, et al. Deksmedetomidine infusion is associated with enhanced renal function after thoracic surgery. J Clin Anesth. 2006;18:422-6.
-
17Kocoglu H, Ozturk H, Ozturk H, et al. Effect of deksmedetomidine on ischemia-reperfusion injury in rat kidney a histopathologic study. Renal Failure. 2009;31:70-4.
-
18Feng L, Xiong Y, Cheng F, et al. Effect of ligustrazine on ischemia-reperfusion injury in murine kidney. Transplant Proc. 2004;36:1949-51.
-
19Fujii T, Takaoka M, Muraoka T, et al. Preventive effect of lcarnosine on ischemia/reperfusion-induced acute renal failure in rats. Eur J Pharmacol. 2003;474:261-7.
-
20Hull ME. A new doctor for a men diabetes and hypertension;. In: Scott MG, Gronowski AM, Eby CS, editors. Tietz's applied laboratory medicine. 2nd ed. Hoboken: John Wiley & Sons Inc; 2007. p. 65-74.
-
21Hussein Ael-A, Shokeir AA, Sarhan ME, et al. Effects of combined erythropoietin and epidermal growth factor on renal ischaemia/reperfusion injury: a randomized experimental controlled study. BJU Int. 2011;107:323-8.
-
22Gu J, Sun P, Zhao H, et al. Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice. Crit Care. 2011;15:153.
-
23Yamamoto K, Wilson DR, Baumal R. Outer medullary circulatory defect in ischemic acute renal failure. Am J Pathol. 1984;116:253-61.
-
24Arendshorst WJ, Finn WF, Gottschalk CW. Pathogenesis of acute renal failure following temporary renal ischemia in the rat. Circ Res. 1975;37:558-68.
-
25Bird JE, Milhoan K, Wilson CB, et al. Ischemic acute renal failure and antioxidant therapy in the rat: the relation between glomerular and tubular dysfunction. J Clin Invest. 1988;81:1630-8.
-
26Weinberg JM. The cell biology of ischemic renal injury. Kidney Int. 1991;39:476-500.
-
27Hoffman WE, Kochs E, Werner C, et al. Deksmedetomidine improves neurologic outcome from incomplete ischemia in the rat. Reversal by the alpha 2-adrenergic antagonist atipamezole. Anesthesiology. 1991;75:328-32.
-
28Maier CM, Sun GH, Kunis DM, et al. Neuroprotection by the N- methyl- d- aspartate receptor antagonist CGP 40116: In vivo and in vitro studies. J Neurochem. 1995;65:652-9.
-
29Koçŏglu H, Karaaslan K, Gonca E, et al. Preconditioning effects of dexmedetomidine on myocardial ischemia/reperfusion injury in rats. Curr Ther Res. 2008;69:150-8.
-
30Simonson SG, Zhang J, Canada Jr AT, et al. Hydrogen peroxide production by monoamine oxidase during ischemia-reperfusion in the rat brain. J Cereb Blood Flow Metab. 1993;13:125-34.
-
31Suzuki T, Akaike N, Ueno K, et al. MAO inhibitors, clorgyline and lazabemide, prevent hydroxyl radical generation caused by brain ischemiarreperfusion in mice. Pharmacology. 1995;50:357-62.
-
32Engelhard K, Werner C, Eberspächer E, et al. The effect of the alpha 2-agonist deksmedetomidine and the N-methyl- d- aspartate antagonist S(+)-ketamine on the expression of apoptosis regulating proteins after incomplete cerebral ischemia and reperfusion in rats. Anesth Analg. 2003;96:524-31.
-
33Wijeysundera DN, Naik JS, Beattie WS. Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications: a meta-analysis. Am J Med. 2003;114:742-52.
-
34Hoffman WE, Baughman VL, Albrecht RF. Interaction of catecholamines and nitrous oxide ventilation during incomplete brain ischemia in rats. Anesth Analg. 1993;77: 908-12.
-
35Curtis FG, Vianna PT, Viero RM, et al. Dexmedetomidine and S(+)-ketamine in ischemia and reperfusion injury in the rat kidney. Acta Cir Bras. 2011;26:202-6.
-
36Yuzer H, Yuzbasioglu MF, Ciralik H, et al. Effects of intravenous anesthetics on renal ischemia/reperfusion injury. Renal Failure. 2009;31:290-6.
-
37Rusafa Neto E, Vianna PT, Viero RM, et al. Influence of S(+)-ketamine analgesia in renal intraoperative ischemia. Histological study in rats. Acta Cir Bras. 2006;21:242-6.
-
38Lee HT, Ota-Setlik A, Fu Y, et al. Differential protective effects of volatile anesthetics against renal ischemia-reperfusion injury in vivo. Anesthesiology. 2004;101:1313-24.
Fechas de Publicación
-
Publicación en esta colección
May-Jun 2014
Histórico
-
Recibido
10 Ene 2013 -
Acepto
10 Jun 2013