Resumos
A rejeição do transplante de córnea é um processo imunológico celular de ataque a córnea transplantada que pode resultar em sua descompensação. É a causa mais comum de falência de transplantes. Os fatores de risco mais comuns para rejeição são a vascularização corneana, falência prévia por rejeição, sinéquias anteriores, botão doador grande ou descentrado, inflamação intra-ocular e cirurgias no segmento anterior. O quadro clínico é caracterizado por hiperemia, dor ocular, edema corneano e inflamação na câmara anterior. As rejeições podem ser classificadas em epitelial, subepitelial, estromal, endotelial, mista e em retransplantes. A prevenção de rejeições pode ser realizada através de técnica cirúrgica meticulosa, utilização de transplantes lamelares, histocompatibilidade receptor-doador e estratégias farmacológicas. Os corticosteróides são a terapia de escolha para o tratamento da rejeição de transplante de córnea e podem ser utilizados em diversas vias e dosagens. Os autores propõem protocolo de tratamento para rejeições.
Transplante de córnea; Rejeição de enxerto; Rejeição de enxerto; Rejeição de enxerto; Esteróides; Revisão
Corneal transplant rejection is an immunological cellular process that attacks the donor cornea and may cause its failure. It is the most common cause of corneal transplant failure.The most common factors for rejection are corneal neovascularization, previous graft failure, anterior synechiae, large or descentered graft, intraocular inflammation and previous anterior segment surgeries. It commonly presents with hyperemia, ocular pain, corneal edema, and anterior chamber inflammation. Corneal graft rejection can be classified as epithelial rejection, subepithelial rejection, stromal rejection, endothelial rejection, combined stromal and endothelial rejection, and rejection in a repeat graft. Prevention of immune-mediated graft rejection can be achieved through meticulous surgical technique, lamellar surgery, enhanced compatibility between donor tissue and receptor cornea, and pharmacologic strategies. Corticosteroids are still the gold standard therapy in corneal rejection management and can be used in many different dosages and routes of administrations. The authors propose a protocol for the treatment of corneal allograft rejection.
Corneal transplantation; Graft rejection; Graft rejection; Graft rejection; Steroids; Review
ARTIGO DE REVISÃO
Rejeição de transplante de córnea
Corneal Transplant Rejection
Dácio Carvalho CostaI; Newton Kara-JoséII
IPós-graduando da Faculdade de Ciências Médicas da Universidade Estadual de Campinas - UNICAMP - Campinas (SP), Brasil
IILivre-docente, professor titular de oftalmologia da Faculdade de Ciências Médicas da Universidade Estadual de Campinas - UNICAMP - Campinas (SP), Brasil
Endereço para correspondência Endereço para correspondência: Dácio Carvalho Costa Departamento de Oftalmologia e Otorrinolaringologia Faculdade de Ciências Médicas da Universidade Estadual de Campinas - FCM - UNICAMP Caixa Postal 6111 CEP 13083-970 - Campinas - SP - Brasil Tel/Fax: (19) 3521-7110 E-mail: daciocosta@hotmail.com
RESUMO
A rejeição do transplante de córnea é um processo imunológico celular de ataque a córnea transplantada que pode resultar em sua descompensação. É a causa mais comum de falência de transplantes. Os fatores de risco mais comuns para rejeição são a vascularização corneana, falência prévia por rejeição, sinéquias anteriores, botão doador grande ou descentrado, inflamação intra-ocular e cirurgias no segmento anterior. O quadro clínico é caracterizado por hiperemia, dor ocular, edema corneano e inflamação na câmara anterior. As rejeições podem ser classificadas em epitelial, subepitelial, estromal, endotelial, mista e em retransplantes. A prevenção de rejeições pode ser realizada através de técnica cirúrgica meticulosa, utilização de transplantes lamelares, histocompatibilidade receptor-doador e estratégias farmacológicas. Os corticosteróides são a terapia de escolha para o tratamento da rejeição de transplante de córnea e podem ser utilizados em diversas vias e dosagens. Os autores propõem protocolo de tratamento para rejeições.
Descritores: Transplante de córnea/efeitos adversos; Rejeição de enxerto/imunologia; Rejeição de enxerto/classificação; Rejeição de enxerto/terapia; Esteróides/uso terapêutico; Revisão
ABSTRACT
Corneal transplant rejection is an immunological cellular process that attacks the donor cornea and may cause its failure. It is the most common cause of corneal transplant failure.The most common factors for rejection are corneal neovascularization, previous graft failure, anterior synechiae, large or descentered graft, intraocular inflammation and previous anterior segment surgeries. It commonly presents with hyperemia, ocular pain, corneal edema, and anterior chamber inflammation. Corneal graft rejection can be classified as epithelial rejection, subepithelial rejection, stromal rejection, endothelial rejection, combined stromal and endothelial rejection, and rejection in a repeat graft. Prevention of immune-mediated graft rejection can be achieved through meticulous surgical technique, lamellar surgery, enhanced compatibility between donor tissue and receptor cornea, and pharmacologic strategies. Corticosteroids are still the gold standard therapy in corneal rejection management and can be used in many different dosages and routes of administrations. The authors propose a protocol for the treatment of corneal allograft rejection.
Keywords: Corneal transplantation/adverse effects; Graft rejection/immunology; Graft rejection/classification; Graft rejection/therapy; Steroids/therapeutic use; Review
INTRODUÇÃO
A rejeição do transplante de córnea é um processo imunológico de reação celular e humoral, uma córnea enxertada que pode resultar na descompensação da mesma (1). Ocorre no período pós-operatório, tendo sido relatados episódios de 14 dias a 30 anos, e é a principal causa de falência das ceratoplastias (2).
A sobrevida dos transplantes de córnea a longo prazo é semelhante à de outros órgãos (3). Na maior coorte acompanhada, na Austrália, a taxa de sobrevida do transplante foi de 74% em cinco anos (4) e cerca de 60% em 10 anos (5). A rejeição endotelial foi a maior causa de falência dos transplantes. Nos Estados Unidos da América, coorte de transplantados acompanhada durante 10 anos mostrou taxa de rejeição de 21% (6). No Brasil, a proporção de pacientes que apresentam rejeição de transplante de córnea, com acompanhamento médio de um ano, oscila entre 13,6% e 29,2% em diversos centros transplantadores (7-11).
A incidência de rejeição varia com a indicação do transplante e com a presença de fatores de risco pré-operatórios. Khodadoust encontrou incidência de rejeição de 3,5%; 13,3%; 28%; e 65% respectivamente em leitos receptores avasculares, levemente vascularizados, moderadamente e muito vascularizados (2). No Brasil, Thomaz et al. apontaram que a incidência de rejeição varia de acordo com a indicação do transplante, de 16% no ceratocone a 45% em retransplantes por rejeição (8).
Entre 24-50% dos enxertos que sofrem episódio agudo de rejeição apresentam falência apesar do tratamento (12-14). Essa variação pode ser explicada por diversos fatores, entre eles, o intervalo entre o início da rejeição e o tratamento, a gravidade, o tipo da rejeição e o esquema terapêutico utilizado (15-16).
Imunologia da rejeição de transplantes de córnea
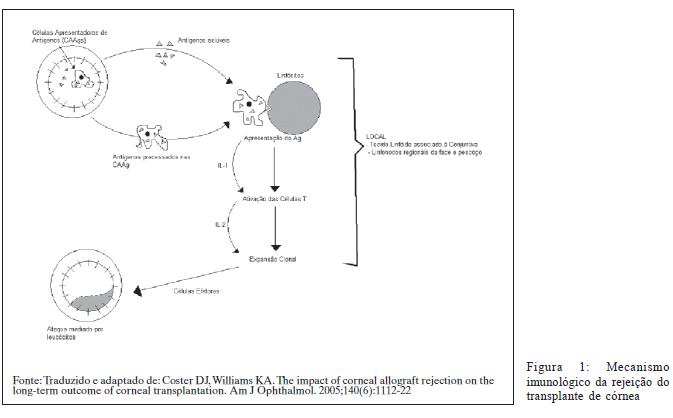
A principal razão para os bons resultados do transplante de córnea é o privilégio imunológico da córnea. Este privilégio deve-se a desvio imunológico que ocorre no segmento anterior do olho, conhecido pela sigla ACAID (Anterior Chamber Associated Immune Deviation). Os fatores que contribuem para a formação do ACAID estão listados no quadro 1.
Os mecanismos que contribuem para o ACAID perdem sua eficiência durante o processo inflamatório, presente ou passado. A inflamação aumenta o número de células de Langerhans (células acessórias) e a expressão de antígenos de histocompatibilidade maior (MHC - Major Histocompatibility Complex) classes I e II. Além disso, diminui a competência microvascular pela quebra da barreira hematoaquosa. Isto aumenta citocinas pró-inflamatórias oculares como o fator de crescimento endotelial vascular (VEGF - Vascular Endothelial Growth Factor), levando a neovascularização corneana.
Com a perda do privilégio imunológico sobrevém a rejeição, cujo mecanismo pode ser didaticamente dividido em três estágios (Figura 1)(17):
1) O antígeno doador é liberado, reconhecido e transportado até os linfonodos (braço aferente);
2) Os aloantígenos são processados para a geração da resposta celular imune (estágio central);
3) O enxerto doador é atacado através de reações celulares e humorais (braço eferente).
Braço aferente da rejeição
O reconhecimento de antígenos heterólogos pelo sistema imune é o principal componente do braço aferente da rejeição. As células de Langerhans, elemento chave nesse processo, processam e apresentam os antígenos ao sistema imunológico além de estimularem os linfócitos B e T. Localizam-se normalmente na periferia da córnea, porém estímulos inflamatórios levam à migração centrípeta com facilitação da rejeição.
Estágio central da rejeição
O reconhecimento dos antígenos como heterólogos ativa os linfócitos T imaturos, que proliferam e sofrem expansão clonal. Esta expansão é promovida sob a influência da interleucina 2 (IL-2). As drogas bloqueadoras de calcineurina como a ciclosporina (CsA) e o tacrolimus (FK 506) atuam ao inibir a expansão clonal dos linfócitos T. Ambas se mostraram ineficazes em prolongar a sobrevida de transplantes quando administradas topicamente, isto é indicativo de que a expansão clonal ocorra fora da córnea (5).
Braço eferente da rejeição
A resposta eferente da rejeição do transplante de córnea é mediada por células, sem participação de anticorpos. A principal célula a comandar a destruição do transplante é o linfócito T CD4+ que recruta as demais células efetoras: macrófagos, leucócitos polimorfonucleares e linfócitos NK (Natural Killer). Estas células liberam citocinas, como o fator de necrose tumoral á, que destroem células doadoras. O endotélio, com capacidade limitada de replicação torna-se responsável pela falência do enxerto doador.
Fatores de risco para rejeição de transplantes de córnea
O mais importante fator de risco para rejeição é a vascularização da córnea receptora. A vascularização de dois ou mais quadrantes eleva de maneira significativa a incidência de rejeição e falência do enxerto (18). Estes fatores foram analisados por diversos grupos e os principais estão relacionados no quadro 2 (19-23).
O conhecimento dos fatores de risco para rejeição é fundamental para a tomada de decisões clínicas.A indicação de imunossupressão sistêmica ou tópica, retransplantes e mesmo contra-indicação de transplantes são, em sua maioria, baseadas no conhecimento dos fatores de risco pré-operatórios.
Quadro clínico da rejeição de transplantes de córnea
O reconhecimento precoce dos sinais e sintomas de rejeição é o primeiro passo para a reversão do quadro. Hill et al. observaram que o tratamento em até oito dias dos sintomas de rejeição, leva a maiores taxas de sucesso no tratamento dos episódios agudos de rejeição (16).
O edema de córnea, focal ou difuso, associado à turvação e células no humor aquoso, sem história prévia de uveíte é altamente sugestivo de rejeição (24). Os principais sinais e sintomas de rejeição estão descritos no quadro 3.
O epitélio, estroma e endotélio corneanos podem sofrer rejeição de forma isolada ou associada, o que embasa a seguinte classificação (1,25):
Rejeição epitelial;
Rejeição subepitelial;
Rejeição estromal;
Rejeição endotelial;
Rejeição mista (estromal e endotelial);
Rejeição em retransplantes.
O quadro 4 mostra os principais achados que diferenciam os diferentes tipos de rejeição.
A rejeição em retransplantes, não classificada em bases anatômicas, possui características particulares que a distingue dos demais tipos: pode ocorrer dentro das duas primeiras semanas, já que o receptor está previamente sensibilizado; há maior chance de falência mesmo com tratamento adequado; pode haver envolvimento da margem receptora; ausência de linha de Khodadoust mesmo com grande reação de câmara anterior e seu tratamento exige que a corticoterapia seja mantida por tempo prolongado.
Várias entidades clínicas podem gerar confusão diagnóstica com a rejeição de transplante de córnea. O quadro 5 mostra os principais diagnósticos diferenciais da rejeição do transplante de córnea com seus respectivos achados.
Prevenção
A prevenção da rejeição de transplante de córnea deve ser buscada nos períodos pré-operatório, intra-operatório e pós-operatório. Na fase pré-operatória almeja-se a diminuição da diferença antigênica entre doador e receptor, além da diminuição da carga antigênica transportada ao receptor durante a cirurgia. Na fase intra-operatória, a prevenção se dá com técnica cirúrgica meticulosa e boa centralização do enxerto. Por fim, no pós-operatório, a prevenção é alcançada pelo controle da resposta imune do receptor.
O resultado do transplante de córnea é diretamente dependente do acompanhamento amiúde dos pacientes. A utilização adequada de corticóides e outros imunossupressores, a remoção adequada de suturas, a acessibilidade do paciente ao médico e ao centro transplantador são fatores fundamentais para o sucesso do transplante.
Diminuição da carga antigênica
Diversas estratégias são utilizadas na tentativa de diminuir a carga antigênica do enxerto doador e obter diminuição das rejeições:
1) Trepanação central - As células de Langerhans, células dendríticas apresentadoras de antígenos, localizam-se na periferia da córnea. A descentração na trepanação tanto do tecido doador quanto do leito receptor facilita a apresentação de antígenos ao sistema imune do receptor, o que aumenta a chance de rejeição;
2) Remoção do epitélio - O epitélio corneano é a camada com maior expressão de antígenos de histocompatibilidade (26). O desbridamento do epitélio diminuiria o aporte antigênico ao receptor. Porém, há questionamentos quanto a esse procedimento, pois, apesar dessas evidências, não foi demonstrada a diminuição das rejeições com esta técnica (27). Além disso, há aumento do risco de outras complicações como defeito epitelial persistente e infecções;
3) Transplantes lamelares - A substituição isolada da lamela corneana doente permite que a quantidade de antígenos seja diminuída substancialmente. Essas novas técnicas são promissoras, porém ainda não há estudos a longo prazo quanto à incidência de rejeição;
4) Exposição à luz ultravioleta - Em alguns estudos, a irradiação com luz ultravioleta diminuiu a incidência de rejeições, mas o mecanismo é incerto: tanto a diminuição de células de Langerhans no enxerto doador como a diminuição da ativação de células T podem ser responsabilizados (28-30);
5) Meio de preservação - A exposição prolongada do tecido doador ao meio de conservação pode diminuir a incidência de rejeições pela inativação das células de Langerhans (31).
Outros métodos para a diminuição da carga antigênica estão sendo pesquisados, porém com pouca aplicabilidade clínica no momento. A injeção subconjuntival de lipossomos de clodromato mostrou alteração da hipersensibilidade tardia com depleção de macrófagos (32). A terapia gênica ex-vivo da córnea doadora no meio de conservação se mostrou capaz de bloquear parcialmente o braço aferente da rejeição, porém não prolongou a sobrevida de enxertos doadores em ratos (33).
Diminuição das diferenças antigênicas entre receptor e doador
Habitualmente é exigido para transplantes de órgãos, compatibilidade do sistema ABO e HLA (Human Leukocyte Antigen). Para o transplante de córnea, no entanto, a legislação brasileira não estabelece a obrigatoriedade de testes de histocompatibilidade.
A necessidade destes testes tem gerado polêmica desde que grupo de pesquisa norte-americano, The Collaborative CornealTransplantation Studies (CCTS), publicou seus resultados em 1992 (21). Os resultados do CCTS mostraram: 1) A compatibilidade HLA A, B e DR não alterou a sobrevida do transplante nem aumentou a incidência de rejeições; 2) A incompatibilidade destes loci não aumentou a falência de córneas doadoras; 3) A compatibilidade no sistema ABO diminuiu, ao longo de 3 anos, a falência por rejeição de 30% para 16%.
Estudos bem controlados, no entanto, vem apontando para a direção oposta: a presença de loci incompatíveis aumenta a freqüência de rejeição. (34) Sanfilippo et al. apontaram diminuição da incidência de rejeição com transplantes histocompatíveis, de 49% para 21% em paciente com alto risco para rejeição (35).
Os custos para o sistema público de saúde com a realização de testes de histocompatibilidade para receptores e doadores são altos e a organização da fila de espera tornar-se-ia complexa. Além disso, os transplantes a quente, com mais fatores de risco para rejeição e maior benefício potencial com a histocompatibilidade, não têm tempo hábil para a realização deste tipo de testes.
Controle da resposta imune do receptor
O controle da resposta imune do receptor no período pós-operatório é, atualmente, a melhor estratégia para a prevenção da rejeição de transplante de córnea. Esse controle pode ser conseguido através da diminuição da vascularização corneana e da terapia imunossupressora.
A vascularização corneana facilita o transporte celular nos braços aferente e eferente do processo de rejeição. Diversos tratamentos podem suprimir ou diminuir a vascularização: cauterização, aplicação de laser de argônio, irradiação, corticóides, transplante de células tronco e mais recentemente o uso de antiangiogênicos, como o bevacizumab (36). O bevacizumab desponta como uma terapia promissora na redução de neovasos de córnea em estágios iniciais, porém não parece ter efeito em neovasos antigos.
A terapia imunossupressora nos casos de transplantes de córnea é conseguida classicamente com corticóides tópicos e sistêmicos, azatioprina oral, CsA tópica e sistêmica. Outras drogas, ainda em estágios experimentais, são FK-506, rapamicina e 15-deoxipergualina. Anticorpos monoclonais também estão sendo pesquisados para prevenção e tratamento de rejeições de transplantes em geral e poderão ser também utilizados em oftalmologia, entre eles: anti-CD154, Anti-T, anti- fator de crescimento endotelial vascular.
O uso de corticosteróides tópicos por vezes é utilizado em baixas doses por tempo prolongado para tentar diminuir a incidência de rejeições. Entretanto, não há diferenças clínicas significativas quanto à incidência de rejeição, entre a corticoterapia pós-operatória por tempo curto ou prolongado (37), além disso,a corticoterapia prolongada pode levar a efeitos colaterais, particularmente glaucoma e catarata.
A CsA é um agente imunossupressor que interfere no braço aferente da rejeição. Atua na célula T, ao inibir a apresentação do antígeno, além de reduzir a produção de interleucina-2. Tem ganhado preferência para imunossupressão em transplantes de alto risco, apesar de seus efeitos colaterais. Deterioração da função renal, hipertensão, hiperplasia gengival, aumento da sudorese, lombalgia, náuseas, candidíase oral, câimbras e parestesias são efeitos colaterais comuns ao uso de CsA sistêmica. A dose ideal para inibição de rejeições de transplante de córnea é 200µg/Kg, e para minimizar efeitos colaterais sistêmicos almeja-se manter a ciclosporinemia entre 130 - 170µg/mL.
Tratamento da rejeição dos transplantes de córnea
Os corticóides são,ainda, a terapia de escolha para o tratamento da rejeição do transplante de córnea. As possíveis vias de administração dos corticóides no tratamento das rejeições de transplante de córnea são: tópica, subconjuntival, oral e intravenosa.
Os corticosteróides tópicos são utilizados para tratar todos os episódios de rejeição de transplante de córnea. Em questionário aplicado aos membros da sociedade de córnea (The Cornea Society), 60% dos entrevistados utilizam apenas a via tópica (38). As vantagens desta via incluem: menor incidência de efeitos colaterais, facilidade de uso e taxa de sucesso de 50 a 90%. As desvantagens da via tópica incluem aderência reduzida, indução de catarata, hipertensão intra-ocular.
O acetato de prednisolona 1% tópico é o corticóide de eleição no tratamento da rejeição (38-39). O regime mais empregado é a aplicação em intervalos de 1 hora nos primeiros dias após o diagnóstico,seguido por regressão lenta. Nos pacientes com rejeição grave, reação inflamatória intensa, acometimento do eixo visual e alto risco de recorrência de rejeição, outras vias podem ser utilizadas, como a subconjuntival e a intravenosa em forma de pulso (39-40).
Nos anos noventa, Hill et al. iniciaram o uso de corticóides intravenosos para o tratamento da rejeição de transplante de córnea (15-16). Os autores mostraram sucesso com o uso intravenoso de metilprednisolona de 92,3% e 63,6% respectivamente quando aplicado até oito dias do início dos sintomas e após esse período (16). O assunto ainda é controverso, principalmente por questões de segurança (41-43).
Hudde et al. não mostraram diferença entre o uso ou não de corticóide intravenoso no tratamento da rejeição do transplante de córnea. Os autores atribuíram a igualdade à internação de todos os pacientes do estudo para aplicação meticulosa da corticoterapia tópica (42). Diferentemente, Costa et al., no Brasil, encontraram superioridade com o uso de metilprednisolona intravenosa com 61,2% de sucesso, enquanto com tratamento tópico apenas 28,57% (44).
O corticóide oral é utilizado isoladamente ou em associação com pulso intravenoso de metilprednisolona. A droga mais comum é a prednisona, em dose de 60-80mg pelos primeiros dias, com regressão gradual à medida que o transplante comece a recuperar a transparência.
Os corticosteróides subconjuntivais podem ser utilizados em casos de rejeições graves, difusas, recorrentes ou de difícil controle. As drogas mais comumente utilizadas nesta são a dexametasona e a betametasona (45-46). O quadro 6 apresenta protocolo para a utilização das diversas vias de corticosteróides no tratamento da rejeição do transplante de córnea.
Alguns imunossupressores também têm papel no tratamento e prevenção das rejeições de transplantes de córnea. A CsA, utilizada pelas vias tópica e subconjuntival, é a droga mais utilizada neste grupo (47-49). Ela é um agente imunossupressor que atua na célula T, inibindo a apresentação do antígeno, além de reduzir a produção de interleucina-2. A dose tópica recomendada é 2% ou 1%, 5 vezes ao dia, no pré e pós-operatório dos pacientes com alto risco para rejeição. A ciclosporinemia é desprezível com o uso tópico, porém a monitorização da função renal e hepática deve ser realizada. A 0,5%, a CsA foi efetiva na prevenção de rejeição em córneas pouco vascularizadas (50).
O uso sistêmico de CsA é comum na prevenção da rejeição de órgãos sólidos, mas não mostra bons resultados na córnea. Inoue et al. após acompanharem 26 pacientes que utilizaram CsA sistêmica por 6 meses não encontraram diferença entre a incidência de rejeição com o uso da droga (51).
CONCLUSÃO
Apesar da otimização dos regimes terapêuticos para o tratamento da rejeição de transplantes de córnea, a prevenção deve ser o objetivo. Seleção adequada do paciente, técnica cirúrgica apurada, fácil acesso ao médico e ao centro transplantador, discussão aberta com o paciente sobre os fatores de risco são essenciais tanto para a prevenção como para o tratamento das rejeições.
O entendimento dos aspectos imunológicos básicos da rejeição, do quadro clínico e da classificação da rejeição dos transplantes de córnea ajuda o oftalmologista a selecionar o esquema terapêutico adequado para cada paciente bem como indicar imunossupressão. A corticoterapia se mantém como tratamento de escolha em todos os tipos de rejeição de transplante de córnea, embora a terapêutica da rejeição de transplantes esteja em constate atualização.
- 1. Panda A, Vanathi M, Kumar A, Dash Y, Priya S. Corneal graft rejection. Surv Ophthalmol. 2007;52(4):375-96.
- 2. Khodadoust A. The allograft rejection: the leading cause of late graft failure of clinical cornea grafts. In: Porter R, Knight J, editors. Corneal graft failure. Amsterdam: Elsevier; 1973. p. 151-64.
- 3. Williams KA, Esterman AJ, Bartlett C, Holland H, Hornsby NB, Coster DJ. How effective is penetrating corneal transplantation? Factors influencing long-term outcome in multivariate analysis. Transplantation. 2006;81(6):896-901.
- 4. Williams KA, Muehlberg SM, Lewis RF, Coster DJ. Long-term outcome in corneal allotransplantation. The Australian Corneal Graft Registry. Transplant Proc. 1997;29(1-2):983.
- 5. Coster DJ, Williams KA. The impact of corneal allograft rejection on the long-term outcome of corneal transplantation. Am J Ophthalmol. 2005;140(6):1112-22.
- 6. Ing JJ, Ing HH, Nelson LR, Hodge DO, Bourne WM. Ten-year postoperative results of penetrating keratoplasty. Ophthalmology. 1998;105(10):1855-65.
- 7. Chalita MRC, Diazgranados EBM, Sato EH, Branco BC, Freitas D. Rejeição corneana pós transplante de córnea: análise de dados do Banco de Olhos do Hospital São Paulo - Escola Paulista de Medicina. Arq Bras Oftalmol. 2000;63(1):55-8.
- 8. Thomaz A, Ando E, Akaishi L, Barros AC. Rejeiçäo em transplante de córnea. Rev Bras Oftalmol. 1990;49(6):15-20.
- 9. Molina LA, Soares I, Pimenta MA, Bastos MM, Pereira MLM, Favaron Filho M, et al. Transplante de córnea e complicaçöes. Rev Bras Oftalmol. 1998;57(9):671-5.
- 10. Urbano AP, Akaishi PMS, Sarmento S, Urbano AP, Costa VP, Arieta CL. Evolução das ceratoplastias penetrantes realizadas por residentes. Rev Bras Oftalmol. 2001;60(10):741-8.
- 11. Endriss D, Cunha F, Ribeiro MP, Toscano J. Ceratoplastias penetrantes realizadas na Fundação Altino Ventura: revisão dos resultados e complicações. Arq Bras Oftalmol. 2003;66(3):273-7.
- 12. Naacke HG, Borderie VM, Bourcier T, Touzeau O, Moldovan M, Laroche L. Outcome of Corneal transplantation rejection. Cornea. 2001;20(4):350-3.
- 13. Alldredge OC, Krachmer JH. Clinical types of corneal transplant rejection. Their manifestations, frequency, preoperative correlates, and treatment. Arch Ophthalmol. 1981;99(4):599-604.
- 14. Gibbs D, Batchelor J, Werb A, Schlesinger W, Casey TA. The influence of tissue-type compatibility on the fate of full-thickness corneal grafts. Trans Ophthalmol Soc UK. 1974;94:101-26.
- 15. Hill JC,IveyA. Corticosteroids in corneal graft rejection: double versus single pulse therapy. Cornea. 1994;13(5):383-8.
- 16. Hill JC, Maske R, Watson P. Corticosteroids in corneal graft rejection. Oral versus single pulse therapy. Ophthalmology. 1991;98(3):329-33.
- 17. Pleyer U, Dannowski H, Volk HD, Ritter T. Corneal allograft rejection: current understanding. I. Immunobiology and basic mechanisms. Ophthalmologica. 2001;215(4):254-62.
- 18. Maguire MG, Stark WJ, Gottsch JD, Stulting RD, Sugar A, Fink NE, et al. Risk factors for corneal graft failure and rejection in the collaborative corneal transplantation studies. Collaborative Corneal Transplantation Studies Research Group. Ophthalmology. 1994;101(9):1536-47.
- 19. Boisjoly HM, Tourigny R, Bazin R, Laughrea PA, Dubé I, Chamberland G, et al. Risk factors of corneal graft failure. Ophthalmology. 1993;100(11):1728-35.
- 20. Yamagami S, Suzuki Y, Tsuru T. Risk factors for graft failure in penetrating keratoplasty. Acta Ophthalmol Scand. 1996;74(6):584-8.
- 21. The collaborative corneal transplantation studies (CCTS). Effectiveness of histocompatibility matching in high-risk corneal transplantation. The Collaborative Corneal Transplantation Studies Research Group. Arch Ophthalmol. 1992;110(10):1392-403.
- 22. Sit M, Weisbrod DJ, Naor J, Slomovic AR. Corneal graft outcome study. Cornea. 2001;20(2):129-33.
- 23. Völker-Dieben HJ, D'Amaro J, Kok-van Alphen CC. Hierarchy of prognostic factors for corneal allograft survival. Aust N Z J Ophthalmol. 1987;15(1):11-8.
- 24. ThamVM,Abbott RL.Corneal graft rejection: recent updates. Int Ophthalmol Clin. 2002;42(1):105-13.
- 25. Luca S, Cvintal T. Rejeição no transplante - Formas clínicas e fatores agravantes. In: Cvintal T, editor. Complicações do transplante de córnea. São Paulo: Santos; 2004. p. 223-39.
- 26. Treseler PA, Foulks GN, Sanfilippo F. The relative immunogenicity of corneal epithelium, stroma, and endothelium. The role of major histocompatibility complex antigens. Transplantation. 1986;41(2):229-34.
- 27. Stulting RD, Waring GO 3rd, Bridges WZ, Cavanagh HD. Effect of donor epithelium on corneal transplant survival. Ophthalmology. 1988;95(6):803-12.
- 28. Ray-Keil L, Chandler JW. Reduction in the incidence of rejection of heterotopic murine corneal transplants by pretreatment with ultraviolet radiation. Transplantation. 1986;42(4):403-6.
- 29. He YG, Niederkorn JY. Depletion of donor-derived Langerhans cells promotes corneal allograft survival. Cornea. 1996;15(1):82-9.
- 30. Niederkorn JY, Callanan D, Ross JR. Prevention of the induction of allospecific cytotoxic T lymphocyte and delayed-type hypersensitivity responses by ultraviolet irradiation of corneal allografts. Transplantation. 1990;50(2):281-6.
- 31. Pels E, van der Gaag R. HLA-A,B,C, and HLA-DR antigens and dendritic cells in fresh and organ culture preserved corneas. Cornea. 1984-1985;3(4):231-9.
- 32. Slegers TP, van der Gaag R, van Rooijen N, van Rij G, Streilein JW. Effect of local macrophage depletion on cellular immunity and tolerance evoked by corneal allografts. Curr Eye Res. 2003;26(2):73-9.
- 33. Jessup CF, Brereton HM, Sykes PJ, Thiel MA, Coster DJ, Williams KA. Local gene transfer to modulate rat corneal allograft rejection. Invest Ophthalmol Vis Sci. 2005;46(5):1675-81.
- 34. Bartels MC, Doxiadis II, Colen TP, Beekhuis WH. Long-term outcome in high-risk corneal transplantation and the influence of HLA-A and HLA-B matching. Cornea. 2003;22(6):552-6.
- 35. Sanfilippo F, MacQueen JM, Vaughn WK, Foulks GN. Reduced graft rejection with good HLA-A and B matching in high-risk corneal transplantation. N Engl J Med. 1986;315(1):29-35.
- 36. Bahar I, Kaiserman I, McAllum P, Rootman D, Slomovic A. Subconjunctival bevacizumab injection for corneal neovascularization. Cornea. 2008;27(2):142-7.
- 37. Cursiefen C, Wenkel H, Martus P, Langenbucher A, Nguyen NX, Seitz B, et al. Impact of short-term versus long-term topical steroids on corneal neovascularization after non-high-risk keratoplasty. Graefes Arch Clin Exp Ophthalmol. 2001;239(7):514-21.
- 38. Randleman JB, Stulting RD. Prevention and treatment of corneal graft rejection: current practice patterns (2004). Cornea. 2006;25(3):286-90.
- 39. Koay PY, Lee WH, Figueiredo FC. Opinions on risk factors and management of corneal graft rejection in the United kingdom. Cornea. 2005;24(3):292-6.
- 40. Rinne JR, Stulting RD. Current practices in the prevention and treatment of corneal graft rejection. Cornea. 1992;11(4):326-8.
- 41. Thiel MA, Ross CA, Coster DJ. Corneal allograft rejection: has the time come for intravenous pulsed methylprednisolone? A debate. Clin Experiment Ophthalmol. 2000;28(6):398-404.42.
- 42. Hudde T, Minassian DC, Larkin DF. Randomised controlled trial of corticosteroid regimens in endothelial corneal allograft rejection. Br J Ophthalmol. 1999;83(12):1348-52.
- 43. Teichmann KD. Randomised controlled trial of corticosteroid regimens in endothelial corneal allograft rejection. Br J Ophthalmol. 2000;84(9):1083.
- 44. Costa DC, Castro RS, Camargo MS, Kara-Jose N. Rejeição de transplantes de córnea: tratamento topico vs. pulsoterapia - resultados de 10 anos. Arq Bras Oftalmol. 2008;71(1):57-61.
- 45. Moro F, Cvintal T. Tratamento padrão da rejeição. In: Cvintal T, editor. Complicações do transplante de córnea. São Paulo: Santos; 2004. p. 241-5.
- 46. Kunimoto DY, Kanitkar KD, Makar MS. The Wills eye manual: office and emergency room diagnosis and treatment of eye disease 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2004.
- 47. Young AL, Rao SK, Cheng LL, Wong AK, Leung AT, Lam DS. Combined intravenous pulse methylprednisolone and oral cyclosporine A in the treatment of corneal graft rejection: 5-year experience. Eye. 2002;16(3):304-8.
- 48. Inoue K, Amano S, Kimura C, Sato T, Fujita N, Kagaya F, et al. Long-term effects of topical cyclosporine A treatment after penetrating keratoplasty. Jpn J Ophthalmol. 2000;44(3):302-5.
- 49. Lam DS, Wong AK, Tham CC, Leung AT. The use of combined intravenous pulse methylprednisolone and oral cyclosporin A in the treatment of corneal graft rejection: a preliminary study. Eye. 1998;12 ( Pt 4):615-8.
- 50. Zhao JC, Jin XY. Local therapy of corneal allograft rejection with cyclosporine. Am J Ophthalmol. 1995;119(2):189-94.
- 51. Inoue K, Kimura C, Amano S, Sato T, Fujita N, Kagaya F, et al. Long-term outcome of systemic cyclosporine treatment following penetrating keratoplasty. Jpn J Ophthalmol. 2001;45(4):378-82.
Datas de Publicação
-
Publicação nesta coleção
24 Nov 2008 -
Data do Fascículo
Out 2008